Атрофический гастрит что это такое
Атрофический гастрит что это такое
Хронический атрофический гастрит (K29.4)
Версия: Справочник заболеваний MedElement
Общая информация
Краткое описание
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
13-15 октября, Алматы, «Атакент»
600 брендов, более 150 компаний-участников из 20 стран.
Новинки рынка стоматологии. Цены от производителей
Классификация
I. По локализации:
— антральный гастрит;
— гастрит (преимущественно или только) тела желудка;
— мультифокальный гастрит.
II. По морфологии.
Для морфологической оценки хронического гастрита российские авторы (Аруин Л.И., Капуллер Л.Л., Исаков В.А., 1998) предлагают использовать визуально-аналоговую шкалу. При ХПГ данная шкала позволяет оценить степень выраженности воспаления с помощью полуколичественных критериев.
Визуальная аналоговая шкала морфологической оценки хронического гастрита
| Признак | Норма | Слабая | Умеренная | Выраженная |
| Обсеменение H.pylori | ||||
| Инфильтрация нейтрофилами | ||||
| Хроническое воспаление | ||||
| Атрофия привратника | ||||
| Атрофия тела желудка | ||||
| Кишечная метаплазия |
Примечание к таблице. В данной таблице отмечается наличие морфологических признаков согласно прилагаемому ниже изображению.
Хроническое воспаление, вызванное Н. pylori: в настоящее время считается, что при исследовании (объектив Х40) СОЖ содержит в норме не более 2-5 лимфоцитов, плазматических клеток и макрофагов в поле зрения или 2-3 мононуклеара в одном валике. Наличие 1-2 плазмоцитов в поле зрения уже свидетельствует о хроническом воспалении.
Не требуют полуколичественной оценки, но указываются следующие признаки: потеря муцина, наличие лимфатических узелков, фовеолярная гиперплазия, пилорическая метаплазия, панкреатическая метаплазия, гиперплазия эндокринных клеток.
В зависимости от степени распространенности дистрофически измененных клеток среди «нормальных» клеток поверхностного эпителия в поле зрения, а также от глубины проникновения воспалительной инфильтрации в толщину слизистой оболочки, среди поверхностных гастритов выделяют:
— слабо выраженный (первая стадия воспалительной активности);
— умеренно выраженный (вторая стадия воспалительной активности);
— сильно выраженный (третья стадия воспалительной активности).
В классификации ХАГ по выраженности атрофии и ее виду выделены три категории изменений слизистой оболочки желудка (СОЖ).
3. Атрофия желудочных желез. Подразделяется на два главных типа:
3.1 Метапластический тип атрофии характеризуется утратой желудочных желез, свойственных данному отделу, с замещением их кишечными, а применительно к слизистой оболочке тела желудка – пилорическими железами.
3.2 Неметапластический тип атрофии: в слизистой оболочке сохраняются железы, характерные для соответствующего отдела желудка, но наблюдается уменьшение объема железистой ткани. Железы становятся редкими и неглубокими. Наблюдается фиброз и фибромускулярная пролиферация собственной пластинки слизистой оболочки.
В данной классификации сохранена полуколичественная оценка степени тяжести атрофии: слабая, умеренная и тяжелая.
При практическом использовании эта классификация показала очень высокий уровень согласованности в интерпретации гистологической картины (до 78%) между разными морфологами. По критериям данной классификации большинство патологоанатомов одинаково оценивали состояние СОЖ.
При слабой неметапластической атрофии в антральном отделе уменьшается количество и глубина пилорических желез, разделенных фиброзным матриксом, а при тяжелой – пилорические железы практически полностью замещены соединительной тканью.
Умеренная неметапластическая атрофия слизистой оболочки тела желудка сопровождается уменьшением количества главных желез, отмечается углубление желудочных ямок и разрастание соединительной ткани в собственной пластинке слизистой оболочки.
При тяжелой неметапластической атрофии слизистой оболочки тела желудка главные железы полностью отсутствуют.
При тяжелой метапластической атрофии в антральном отделе пилорические железы, а в слизистой оболочке тела желудка – главные железы полностью замещены железами кишечного типа.
Раздельная оценка атрофических изменений в антральном и фундальном отделах желудка имеет высокую клиническую значимость, однако затрудняет интегративное восприятие общего состояния СОЖ. Помимо этого, в категорию неопределенных атрофий попадает большое количество случаев с продолжающейся воспалительной реакцией, а также изолированная атрофия СОЖ без воспаления встречается очень редко.
IV. По степени и стадии хронического гастрита (ХГ).
А
Н
Т
Р
У
М
Хронический атрофический гастрит
МКБ-10
Общие сведения
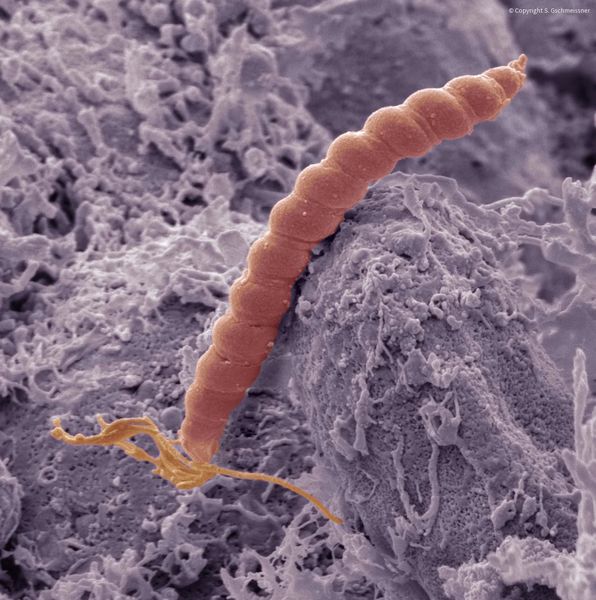
Хронический атрофический гастрит – диагноз морфологический, для верификации которого обязательны результаты ЭГДС. Клинические проявления данной патологии не всегда соответствуют выявляемым при проведении биопсии изменениям. Хронический атрофический гастрит может развиться как на поздних стадиях хеликобактерного гастрита (из-за длительной персистенции инфекции происходит постепенная гибель значительного количества желудочных желез), так и в результате аутоиммунных нарушений в организме (антитела к эпителиальным клеткам желудка вызывают их гибель, постепенно развивается ахлоргидрия).
H.pylori выявляется более чем у 80% населения России, при этом хроническое воспаление слизистой желудка обнаруживается примерно у 50%. Аутоиммунный гастрит у женщин диагностируется в три раза чаще, чем у мужчин, однако является достаточно редким заболеванием. Исследования в области гастроэнтерологии подтверждают, что заболеваемость хроническим гастритом повышается на 1,5% ежегодно.
Причины
Наиболее значимыми причинами хронического атрофического гастрита являются инфекция H.pylori и аутоиммунные процессы. Атрофия эпителия желудка развивается на поздних стадиях хронического хеликобактер-ассоциированного гастрита. Бактерии сначала колонизируют слизистую антрального отдела, вызывая хронический воспалительный ответ. По мере прогрессирования инфекции процесс распространяется сначала на тело желудка, а затем и на остальные его отделы, инициируя пангастрит. На этой стадии уже четко визуализируются атрофические изменения слизистой, формируется хронический атрофический гастрит. Обычно на данном этапе хеликобактерии перестают выявляться, так как желудочные железы атрофируются, происходит замена желудочного эпителия на кишечный, к которому H.pylori не имеет тропности.
При аутоиммунном гастрите поражение основных желез желудка наблюдается в начале заболевания. Диффузная атрофия эпителия желудка очень быстро прогрессирует, что связано с выработкой аутоантител к микросомальным антигенам париетальных клеток, гастринсвязывающим белкам, внутреннему фактору. Антитела принимают непосредственное участие в деструкции эпителиальных клеток желудка.
Причина образования аутоантител на сегодняшний день не определена, но гастроэнтерологи не исключают наследственной предрасположенности к хроническому атрофическому гастриту. Известно, что для запуска аутоиммунного процесса в эпителии желудка титр антител должен достичь некой критической цифры, индивидуальной для каждого человека. Повлиять на скорость этого процесса могут различные эндогенные и экзогенные провоцирующие факторы:
Симптомы
Для хронического атрофического гастрита характерны как местные, так и общие проявления. Некоторые симптомы зависят от этиологии заболевания (HP-ассоциированный или аутоиммунный тип) и локализации воспалительного процесса.
При бактериальном генезе хронического атрофического гастрита с локализацией в антральном отделе пациенты предъявляют жалобы на тяжесть в желудке во время или сразу после еды. Если хронический гастрит длительно протекал как гиперацидный, больного могут беспокоить диспепсические нарушения: диарея или запоры, повышенный метеоризм, урчание в животе.
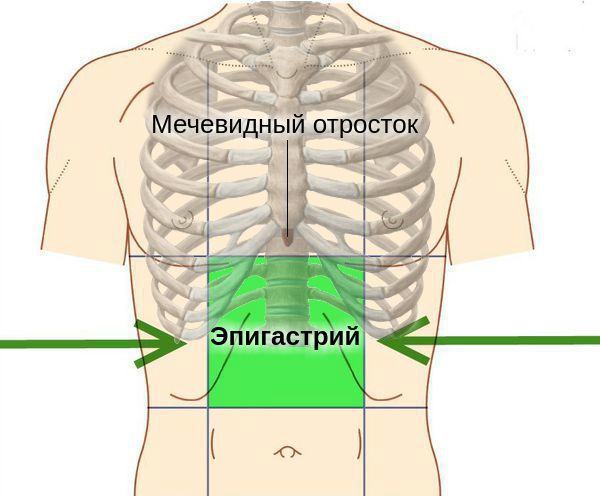
Аутоиммунный гастрит характеризуется тетрадой признаков: аутоиммунный процесс, наличие в крови антител к обкладочным клеткам желудка, В12-фолиеводефицитная анемия, ахлоргидрия. При любом виде хронического атрофического гастрита беспокоят боли в эпигастрии во время или после еды, тошнота, неприятный запах и привкус во рту, отрыжка и срыгивания, жжение в подложечной области или изжога.
Общие проявления выражаются слабостью, раздражительностью, склонностью к артериальной гипотонии, колющими болями в сердце. Для хронического атрофического гастрита характерен демпинг-синдром: после еды возникает резкая слабость, бледность кожи, потливость, сонливость, икота, неустойчивый стул.
Осложнения
При аутоиммунном гастрите антитела поражают не только клетки желудка, но и внутренний фактор Касла, участвующий в метаболизме витамина В12. В результате этого развивается пернициозная анемия, проявляющаяся жжением в языке, симметричными парестезиями в руках и ногах, утомляемостью, сонливостью, депрессией. Помимо В12-дефицитной анемии, хронический аутоиммунный гастрит может осложняться язвенной болезнью желудка и ДПК, ахлоргидрией, раком желудка.
Диагностика
При подозрении на хронический гастрит пациент в обязательном порядке нуждается в консультации гастроэнтеролога и врача-эндоскописта. На первичном приеме назначается ряд анализов и исследований. После получения результатов проводится повторная консультация, на которой обычно и выставляется диагноз хронического атрофического гастрита.
Лечение хронического атрофического гастрита
Перед началом лечения рекомендуется отказаться от вредных привычек (курения, приема алкоголя). Диета не является основным методом терапии хронического атрофического гастрита. Медикаментозное лечение планируется в зависимости от этиологии заболевания (хеликобактерный или аутоиммунный гастрит).
При хроническом атрофическом гастрите, сопровождающемся тяжелыми аутоиммунными нарушениями, показано назначение коротких курсов глюкокортикоидных гормонов в невысоких дозах. После стабилизации процесса и регресса клинических проявлений лечение прекращается. Если секреторная функция желудка не восстановилась, назначают натуральный желудочный сок, прокинетики, ферменты поджелудочной железы. Проводится коррекция В12-дефицитной анемии.
Лечение хеликобактер-ассоциированного хронического атрофического гастрита стандартное: ингибиторы протонной помпы в сочетании с антибактериальными препаратами (кларитромицин, амоксициллин, фуразолидон, метронидазол, тетрациклин), препаратами висмута. Использование препаратов висмута вместо ИПП показано пациентам с пониженной секреторной функцией желудка.
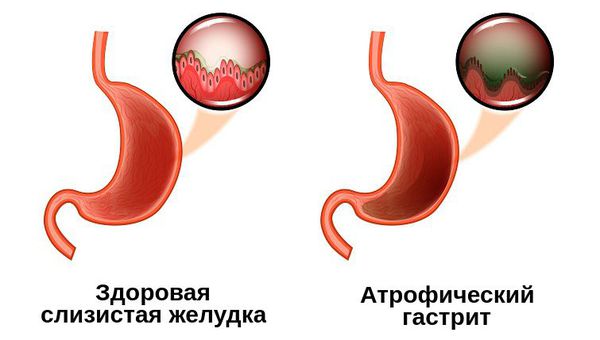
Атрофический гастрит
Атрофический гастрит – это хронический гастрит типа А, при котором уменьшается количество желудочных желез, снижается кислотообразующая функция. Считается предраковым состоянием. Проявляется тяжестью и тупыми болями в желудке, тошнотой, изжогой, диспепсическими явлениями, анемией. Наиболее значимыми методами диагностики являются: гастроскопия с забором и гистологией биоптатов, различные исследования для определения наличия хеликобактерной инфекции. Менее информативны гастрография, УЗИ органов брюшной полости. Так как 90% атрофий желудка связаны с воздействием хеликобактерий, специфическое лечение включает в себя эрадикацию инфекции. Назначается заместительная и симптоматическая терапия, санаторное лечение и физиотерапия.
МКБ-10
Общие сведения
Атрофический гастрит – хроническое прогрессирующее воспаление слизистой желудка, в результате которого полностью утрачиваются обкладочные железы желудка, происходит постепенная атрофия с последующей метаплазией участков слизистой. Основным признаком, который указывает на высокую вероятность рака, является не вид перестройки клеток, а площадь процесса – при распространенности метаплазии на 20% площади слизистой желудка и более вероятность развития рака практически 100%.
По наблюдениям специалистов в сфере практической гастроэнтерологии, хронический атрофический гастрит в 13% случаев заканчивается развитием онкологической патологии. По сравнению с неатрофическим процессом вероятность такого осложнения при атрофическом гастрите в пять раз выше. Основной задачей гастроэнтерологов сегодня является разработка новых, простых и неинвазивных методов достоверной диагностики атрофии, а также ранней диагностики рака желудка. Замечено, что своевременная диагностика и полная эрадикация инфекционного процесса уже через пять лет приводят к восстановлению слизистой желудка и значительному уменьшению площади метаплазии.
Причины
Основными причинами развития атрофического гастрита являются длительно текущая хеликобактерная инфекция и аутоиммунный процесс, при котором собственные антитела повреждают G-клетки желудка (они являются основной составляющей обкладочных желез). Атрофии железистого эпителия могут способствовать различные сопутствующие заболевания и состояния: бесконтрольный прием медикаментов, алкоголизм, стрессы и выраженное физическое переутомление, различные профессиональные вредности, наследственные особенности работы ЖКТ, тяжелые фоновые заболевания.
Патогенез
H.pylori вызывает хроническое повреждение клеток, ослабляя местные защитные свойства слизистой желудка, что в результате позволяет токсинам и свободным радикалам беспрепятственно проникать в ткани и повреждать ядра клеток. В финале этого процесса клетки приобретают свойства нескольких типов тканей – так называемые гибридные клетки, которые имеют свойства предраковых. Данный процесс называется кишечной метаплазией. Вначале эти участки слизистой приобретают вид тонкокишечного эпителия, затем толстокишечного. Чем дальше зашел процесс метаплазии, тем больше вероятность развития аденокарциномы желудка. На сегодняшний день хеликобактерная инфекция включена в список биологических канцерогенов, ведь без надлежащего лечения она рано или поздно приводит к раку желудка.
Механизм развития аутоиммунного процесса несколько иной. При этом в организме из-за нарушения иммунитета начинают образовываться антитела, которые распознают собственные ткани желудка как чужеродные. Чаще всего антитела вырабатываются к G-клеткам и фактору Касла, который отвечает за всасывание витамина В12. Из-за этого постепенно снижается кислотность желудка, клетки перестраиваются и начинают производить слизь вместо соляной кислоты. В желудке перестают всасываться железо и витамины, развивается тяжелая пернициозная анемия. Если же аутоиммунному гастриту сопутствует хеликобактерная инфекция, предраковое состояние разовьется гораздо быстрее.
Симптомы атрофического гастрита
Патология развивается медленно, поражение при этом начинается со дна желудка, переходя на его тело, а затем и на остальную слизистую. В начале заболевания особой симптоматики может и не быть, что затрудняет диагностику и мешает раннему началу лечения. После развития полной клинической картины у пациента могут выявляться несколько симптомокомплексов.
Анемический синдром развивается из-за нарушения всасывания железа и витаминов (особенно В12, фолиевой кислоты) в полости желудка. Проявляется он выраженной слабостью, утомляемостью, сонливостью, постоянной усталостью (порой даже нарушается обычная деятельность пациента). Кожные покровы и слизистые бледнеют. Пациент отмечает постоянные боли в языке, жжение, слизистая языка становится лаковой. Также больной предъявляет жалобы на нарушения чувствительности в конечностях, обычно симметричные. Характерны сухие волосы и ломкие ногти, беспокоит одышка при незначительных нагрузках, колющие боли в сердце.
Диспепсический синдром проявляется выраженной тяжестью в эпигастрии, реже тупыми ноющими болями в верхней половине живота. Боли связаны с растяжением стенок желудка пищевыми массами из-за нарушений пищеварения. Также пациента беспокоят изжога (забрасывание кислого содержимого в пищевод), срыгивание (забрасывание пищи из желудка в ротовую полость), отрыжка (непроизвольный выход воздуха из желудка). Сопровождаются эти симптомы тошнотой, иногда рвотой, после которой боль в эпигастрии уменьшается. В рвотных массах – большое количество съеденной пищи, слизь, желчь. Аппетит значительно снижен.
Нарушения пищеварения распространяются на другие отделы ЖКТ – появляется дискомфорт в животе, стул становится неустойчивым – запоры сменяются поносами. По утрам во рту неприятный привкус, беспокоит постоянный запах изо рта. Язык обложен сероватым налетом, на нем видны отпечатки зубов. Нарушенное пищеварение и снижение аппетита могут приводить к потере веса, а при отсутствии лечения – к выраженной алиментарной дистрофии. Развивается полигиповитаминоз, который приводит к значительному снижению иммунитета, присоединению различных инфекций.
Диагностика
Сегодня все больше внимания уделяется ранней неинвазивной диагностике атрофического гастрита. Для этого врачами-гастроэнтерологами разработана специальная панель диагностики. При проведении обычной гастроскопии выявить очаги дисплазии эпителия, а тем более определить их площадь не представляется возможным. Из-за этого зачастую возникают ошибки, связанные как с гипердиагностикой, так и гиподиагностикой: площадь гиперплазии может быть оценена неправильно, а воспалительные изменения могут быть приняты за метаплазию эпителия. Для того, чтобы правильно оценить площадь измененного эпителия, взять биопсию из всех измененных участков, во время гастроскопии производится окрашивание слизистой (чаще всего метиленовым синим) – краситель хорошо воспринимается участками с кишечной метаплазией.
Специальная гематологическая панель Biohit позволяет быстро и эффективно определить степень метаплазии эпителия, атрофии слизистой и обкладочных желез, избежать ошибок диагностики. В этой панели исследуется уровень сывороточного пепсиногена, определяется соотношение пепсиногена 1 к пепсиногену 2, гистамина 17. Снижение этих показателей говорит о выраженной атрофии клеток железистого эпителия, а низкий уровень гастрина 17 говорит о гибели G-клеток желез желудка.
В то же время, повышение уровня гастрина 17 и пепсиногена 1 часто ассоциируется с хеликобактерной инфекцией. Значительное повышение уровня гастрина 17 чаще всего связано с аутоиммунным гастритом, при котором наблюдается ахлоргидрия или гипохлоргидрия, сохранена функция антрального отдела желудка. Если же в антральном отделе также имеются очаги атрофии (мультифокальная атрофия), то уровни всех этих показателей будут низкими. Данная панель имеет не менее 80% достоверности, используется на начальных этапах обследования и позволяет определиться с типом гастрита, его локализацией и причиной, выявить предраковое состояние и определить правильную тактику лечения.
В сравнении с гематологической панелью и эндоскопическим исследованием с забором биопсии, остальные методы диагностики атрофического гастрита менее информативны. Так, при гастрографии отмечается сглаженность складок слизистой и замедление перистальтики желудка, размеры его уменьшены. Такая же картина обнаруживается при проведении УЗИ желудка. Внутрижелудочная рН-метрия обнаруживает снижение кислотности желудочного сока. Для уточнения диагноза желательно проводить суточное измерение кислотности.
При подозрении на малигнизацию необходимо провести МСКТ органов брюшной полости для исключения опухолевого процесса. Также обязательно проводятся все необходимые исследования для выявления инфицированности H.pylori: ПЦР-диагностику хеликобактер, дыхательный тест, выявление в крови антител к хеликобактер.
Лечение атрофического гастрита
Основной задачей гастроэнтеролога является предупреждение дальнейшей кишечной метаплазии, раковой трансформации. При своевременном начале лечения атрофического гастрита уже через пять лет наступает значительное улучшение состояния эпителия. Обязательно назначается лечебная диета, которая на начальном этапе включает в себя химически, термически и механически щадящую пищу.
После нормализации состояния допускается употребление химически активных продуктов: разведенных соков (лимонный, капустный, клюквенный). Свежие фрукты из диеты исключаются, можно есть только бананы. К пище предъявляются особые требования – она должна быть теплой (нельзя принимать холодные и горячие продукты), приемы пищи должны быть частыми и дробными. Необходимо исключить спиртные напитки и курение.
При обнаружении хеликобактерной инфекции обязательным условием выздоровления является эрадикация инфекционного агента. Современные протоколы лечения предусматривают назначение двух- или трехкомпонентной схемы, включающей антихеликобактерные антибиотики, ингибиторы протонной помпы, препараты висмута. Только полное излечение от хеликобактерий может привести к восстановлению слизистой и снижению риска малигнизации.
Глюкокортикоидные гормоны при атрофическом гастрите назначаются только при развитии В12-фолиеводефицитной анемии. Также назначается симптоматическое лечение: заместительная терапия натуральным желудочным соком, ферментами, недостающими витаминами, препаратами железа. Для стимуляции секреции соляной кислоты необходимо пить минеральные воды с высоким содержанием солей, отвары трав (подорожник, полынь, фенхель), кислые соки, растворы лимонной и янтарной кислот.
Используются гастропротекторы (мизопростол, карбеноксолон), стимуляторы регенерации (облепиховое масло), обволакивающие средства на основе алюминия и висмута, препараты для улучшения перистальтики. Активно применяется физиотерапия: электрофорез с лекарственными препаратами, электро- и магнитотерапия, тепловые процедуры на область эпигастрия. Санаторно-курортное лечение вне периода обострения включает терапию минеральными водами на бальнеологических курортах.
Что надо знать об атрофическом гастрите?
Атрофический гастрит или более правильное медицинское название атрофия слизистой оболочки желудка – это необратимый процесс, при котором происходит гибель клеток слизистой желудка, вырабатывающих желудочных сок и соляную кислоту. К атрофии, также относится постепенное замещение клеток желудка соединительной тканью и клетками, сходными по строению с клетками слизистой оболочки кишечника.
Атрофия слизистой оболочки желудка – это опасное для здоровья состояние, так как с течением времени и, особенно, при наличии дополнительных факторов риска, она может привести к развитию рака желудка.
Причины атрофического гастрита

Хронический гастрит – это распространенное заболевание (выявляется до 30% населения в различных популяциях), имеющее хроническое и рецидивирующее течение, проявляющееся воспалением слизистой оболочки желудка и подтвержденное морфологическим исследованием.
Причинами развития хронического гастрита являются:
То есть, в большинстве случаев атрофия слизистой желудка является результатом наиболее часто встречающегося (80%) хронического гастрита, вызванного хеликобактерной инфекцией, или аутоиммунного гастрита, который встречается в 1-2% случаев. В данной статье подробно рассмотрена атрофия, связанная с этими двумя причинами.
Что происходит с клетками слизистой оболочки при атрофии?
Атрофия слизистой оболочки желудка затрагивает верхний слой и собственную пластинку желудка и является почти необратимым процессом, который можно замедлить, если устранить причины воспаления.
Слизистая желудка находится под действием агрессивной среды, поэтому ее клетки полностью обновляются каждые три дня. Воспалительный процесс, развивающийся вследствие влияния внешних факторов, например, бактериальная инфекция или внутренних причин, например, реакция иммунной системы, нарушает процесс обновления (регенерации) клеток слизистой желудка, в том числе и клеток желез желудка, вырабатывающих желудочный сок. В результате клетки желез желудка погибают и замещаются клетками соединительной ткани, а также клетками по строению схожими с клетками кишечника.
Этот процесс можно диагностировать с помощью гистологического исследования образцов слизистой желудка. Если выявлено только уменьшение количества клеток желудочных желез, то говорят только об атрофии слизистой оболочки желудка. Если же в исследуемом образце будут обнаружены клетки кишечника, то устанавливается диагноз атрофия с кишечной метаплазией. Метаплазия – это появление клеток, нетипичных для данного органа.
Как правильно диагностировать атрофию слизистой желудка?

Диагноз устанавливается врачом-морфологом после проведения гистологического исследования. На основании данного исследования подбирается лечение и определяется периодичность обследований для своевременного выявления онкологического процесса.
Также для оценки выраженности атрофии используется определение активности секреторной функции желудка по лабораторному анализу крови – Гастропанель (ссылка).
Диагностику хеликобактерной инфекции проводят с помощью исследования биоптатов и 13 С-уреазного дыхательного теста.
При аутоиммунном гастрите проводятся лабораторная диагностика анализа крови на определение антител к клеткам желудка и к внутреннему фактору Кастла.
Атрофический гастрит, связанный с хеликобактерной инфекцией
После инфицирования бактерией Helicobacter Pylory, в слизистой желудка развивается воспаление и хронический неатрофический гастрит. Железы желудка в начале заболевания вырабатывают достаточное количество желудочного сока. При отсутствии лечения, воспаление становится более активным и распространяется на все отделы желудка, приводя к атрофии слизистой) и частичному замещению клеток желудка кишечными клетками (кишечная метаплазия).
Симптомы

Лечение
Эрадикация (уничтожение) Helicobacter Pylory является первым этапом лечения при данном варианте атрофического гастрита.
Аутоиммунный атрофический гастрит
При данном типе хронического гастрита клетки желудка повреждаются антителами, которые вырабатывает собственная иммунная система. При этом развивается хроническое воспаление, приводящее к атрофии желез желудка и снижению выработки соляной кислоты и внутреннего фактора Кастла, обеспечивающего усвоение витамина B12. Значительное снижение выработки внутреннего фактора Кастла может вызывать анемию В12-дефицитную анемию (пернициозную анемию) – заболевание, для которого характерно нарушение кроветворения.
Симптомы
Симптомы аутоиммунного атрофического гастрита схожи с симптомами, атрофии, вызванной хеликобактерной инфекцией.
Дополнительно развивается анемия, часто аутоиммунному гастриту могут сопутствовать другие аутоиммунные заболевания.
Лечение
Специфического лечения при аутоиммунном гастрите нет, лечение кортикостероидами используется только в исключительных случаях.
Питание при атрофии слизистой
Специфической диеты при атрофическом гастрите не существует, питание должно быть регулярным, сбалансированным с учетом индивидуальной переносимости. Также рекомендуется сократить в рационе питания: грубую клетчатку, рафинированные сахара, избыток соли, насыщенные жиры, алкоголь, а также консерванты и стабилизаторы.
Прогноз и факторы риска при атрофическом гастрите
В зависимости от уменьшения количества желез в слизистой оболочке желудка выделяют три степени атрофии:
Наибольший риск рака желудка имеют пациенты с тяжелой атрофией, кишечной метаплазией, а в особенности с наличием дисплазии.
Дополнительными факторами риска рака желудка являются:
При наличии атрофии наиболее актуальным является профилактика рака желудка, для чего профессор Мехтиев, главный врач центра Эксперт рекомендует регулярное наблюдение у гастроэнтеролога, который следит за симптомами и определяет периодичность выполнения ФГДС (гастроскопии) с расширенной гистологией и Гастропанели.
Получить консультацию гастроэнтеролога, специализирующегося на ведении пациентов с атрофическим гастритом, можно в Гастроэнтерологическом центре Эксперт. ФГДС (гастроскопия) в ГЦ Эксперт выполняется опытными специалистами с помощью видеоэндоскопической системы, оснащенной технологией виртуальной хромоэндоскопии i-Scan, что повышает точность забора образцов слизистой для гистологического исследования.
Что такое атрофический гастрит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Жуковой Милады Александровны, гастроэнтеролога со стажем в 27 лет.
Определение болезни. Причины заболевания
Атрофический гастрит — это наиболее коварный тип хронического гастрита, при котором изменяются париетальные клетки желудка, из-за чего слизистая оболочка становится тоньше, а железы желудка, вырабатывающие соляную кислоту, атрофируются. Это закономерно приводит к недостаточной выработке соляной кислоты и нарушению переваривания пищи.
Краткое содержание статьи — в видео:
Так как желудок является начальным звеном пищеварительной системы, нарушение его функции неизбежно влияет на состояние других органов: недостаточно переработанная в механическом и химическом отношении пища нарушает работу тонкого и толстого кишечника, а также поджелудочной железы.
Атрофический гастрит возникает и прогрессирует по разнообразным причинам, связанным с воздействием на слизистую оболочку желудка. Принято разделять их на две группы — экзогенные (внешние) и эндогенные (внутренние).
Существенными причинами появления заболевания также являются возрастные изменения: у людей до 30 лет атрофические процессы встречаются в 5 % случаев, до 50 лет — в 30 % случаев, после 50 лет — в 50-70 % случаев. Возможна и генетически обусловленная перестройка слизистой желудка по типу гипо- и атрофии.
Симптомы атрофического гастрита
Клиническая картина хронического гастрита связана с местными и общими расстройствами. Часто болезнь может протекать бессимптомно, особенно у людей после 50 лет. Симптомы, как правило, связаны с недостаточной работой желудка и зависят от степени поражения определённого звена пищеварения.
Основными функциями желудка являются:
При значительном снижении синтеза и отсутствии соляной кислоты возникают следующие местные проявления :
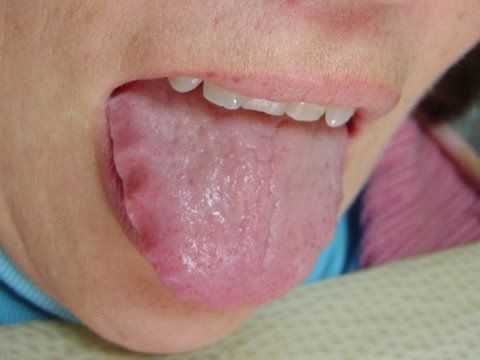
У людей с атрофическим гастритом отмечается «лакированный» язык, при обострениях язык увеличивается (видны отпечатки зубов), он обложен густым белым налётом. При пальпации (прощупывании) области желудка болезненность обычно отсутствует, но иногда возникает слабо выраженная разлитая болезненность в эпигастральной области.
У людей с аутоиммунным гастритом выявляются антитела к париетальным клеткам, сопутствует анемия, вызванная дефицитом витамина B12, и значительное снижение секреции соляной кислоты.
Симптомы общих расстройств:
Клинические симптомы гастрита нельзя сопоставить с гистологическими изменениями. Атрофический гастрит развивается медленно, поражение при этом начинается со дна желудка, переходя на его тело, а затем и на остальную слизистую. Считается, что на первых этапах умеренно выраженного атрофического гастрита клиника малосимптомная, стёртая и не имеет специфических проявлений. Но на дальнейших стадиях появляются симптомы, связанные с моторной и секреторной недостаточность желудка.
Патогенез атрофического гастрита
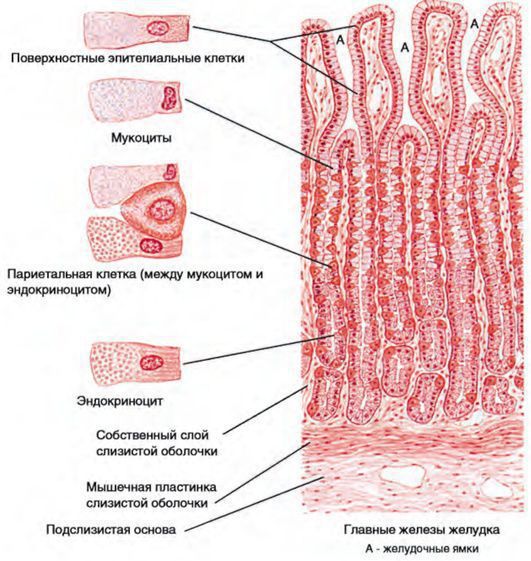
Эпителий слизистой оболочки желудка двухслойный:
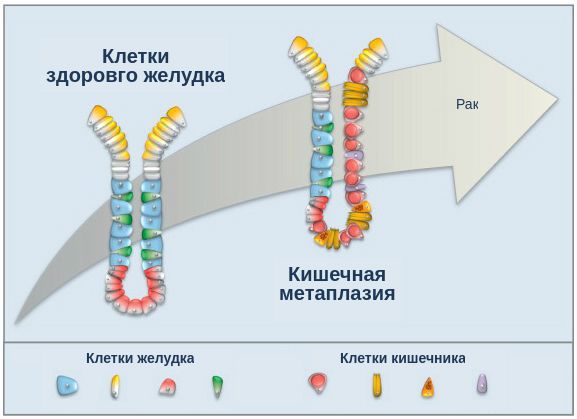
При гастрите оба слоя эпителия желудка вовлечены в патологический процесс. Заселение слизистой H. pylori вызывает хроническое повреждение клеток, ослабляет защитные свойства слизистой желудка, что ведёт к повреждению клеточных ядер свободными радикалами и токсинами. При этом изменяется клеточная структура, нарушается специализация клеток, появляются «гибридные» клетки, которые имеют свойства предраковых. Данный процесс называется кишечной метаплазией. В связи с этими изменениями слизистая желудка сначала приобретает вид тонкокишечного эпителия, затем — толстокишечного эпителия. Чем дальше заходит процесс метаплазии, тем больше вероятность развития аденокарциномы — железистого рака желудка.
Данный нарушенный процесс обновления клеток в слизистой желудка лежит в основе образования атрофии при гастрите. Прослеживается определённый патогенетический каскад, спровоцированный Н. pylori: от инфекционного гастрита через стадии атрофии, метаплазии и дисплазии к раку желудка. Особенно опасно появление неполной — толстокишечной — метаплазии.
Повреждение слизистой оболочки желудка при аутоиммунном гастрите реализуется через другой механизм: нарушение иммунитета приводит к образованию антител, повреждению ткани желудка иммунными комплексами. Чаще всего антитела вырабатываются к фактору Касла, который отвечает за всасывание витамина В12, и G-клеткам. Из-за этого постепенно снижается кислотность желудка, изменяется структура слизистой, снижается выработка соляной кислоты. В желудке нарушается всасывание железа и витаминов, развивается В12-дефицитная анемия. При этом заболевании в 90 % случаев выявляются антитела к париетальным клеткам, вырабатывающим соляную кислоту, и к Н + /К +- АТФазе, в 60 % случаев — антитела к фактору Касла.
Классификация и стадии развития атрофического гастрита
Сиднейская классификация гастритов
В последующем эта классификация дополнялась и уточнялась в связи с новыми научными данными. Сейчас для правильной формулировки диагноза «хронический гастрит» важно установить причину заболевания, распространённость поражения, степени активности и атрофии.
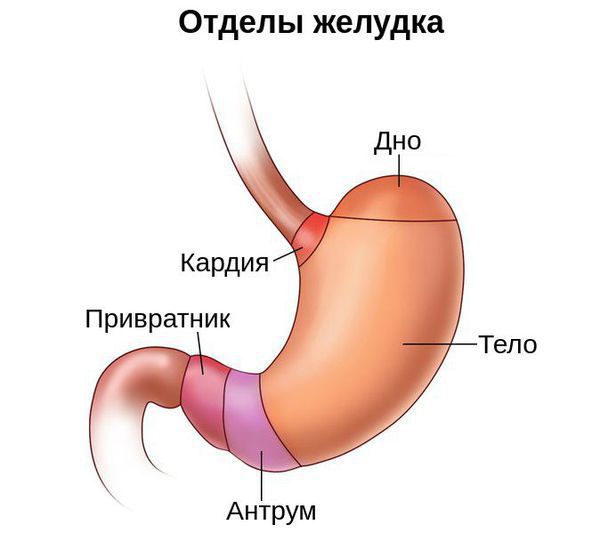
Условно желудок можно поделить на пять отделов: кардия, свод (дно, или фундальный отдел), тело, антрум и привратник. Атрофия может затронуть как один из этих отделов, так и весь желудок. В связи с этим выделяют диффузный атрофический гастрит (в фундальном, антральном или другом отделе) и мультифокальный атрофический гастрит (во всём желудке).
Морфологическая классификация гастрита широко применяется в практике, т. к. именно гистологические характеристики процесса помогают определить прогноз и тактику лечения пациента. Для этого используют визуально-аналоговую шкалу. Она позволяет оценить морфологическую картину слизистой желудка по:
Степень атрофии также оценивается по визуально-аналоговой шкале, изображённой на схеме ниже. По выраженности атрофии и её виду выделяют три категории изменений слизистой оболочки желудка:
При этом учитывается локализация и степень выраженности атрофических изменений (слабая, средняя, сильная), а также наличие и площадь очагов кишечной метаплазии.
Развитие болезни проходит определённые стадии:
Осложнения атрофического гастрита
Выраженный атрофический гастрит всегда сопровождается В12-дефицитной анемией, при которой париетальные клетки, вырабатывающие соляную кислоту, практически отсутствуют. Витамин В12, поступающий с пищей, не всасывается, что приводит к хронической анемии с характерными проявлениями в виде быстрой утомляемости, нарушения зрения и вкусовых ощущений, мышечной слабости, головокружений, чувства покалывания и онемения в конечностях.
При ахлоргидрии — отсутствии соляной кислоты в желудочном соке — происходит к выраженное нарушение пищеварения, ухудшается переработка пищи, снижается всасывание отдельных микроэлементов и витаминов.
Диагностика атрофического гастрита
Гастрит — диагноз морфологический, т. е. он основан не на симптомах, а на изменениях строения слизистой желудка. Поэтому он может считаться объективным только после оценки слизистой желудка, взятой во время биопсии. Этим занимается патоморфолог. Только с помощью морфологического исследования можно достоверно выявить атрофию, воспаление и деструкцию слизистой желудка.
Клинический диагноз гастрита, т. е. диагноз без морфологического исследования, практически не имеет смысла. Симптомы диспепсии, которые заставляют больного обратиться к врачу, носят лишь функциональный характер и не всегда указывают на те морфологические изменения, которые составляют суть гастрита.
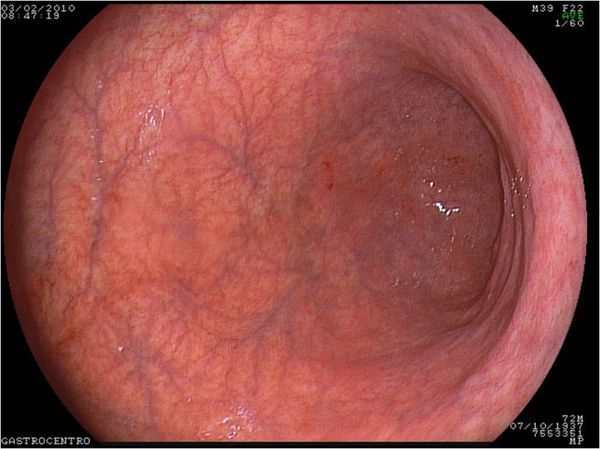
Изменения слизистой можно обнаружить при проведении эзофагогастродуоденоскопии (ЭГДС) — осмотре желудка и двенадцатиперстной кишки с помощью эндоскопа (через видео-трубку). Но результаты этого исследования являются субъективными и только косвенным образом могут указывать на наличие гастрита: они не позволяют оценить степень его прогрессирования.
Оптимальным методом является морфологическое исследование биоптатов. Также в практике широко используется быстрый уреазный тест — определение H. pylori методом оценки количества аммиака в мочевине, образуемого этими бактериями. К другим способам относятся дыхательный тест и иммуноферментные анализы.
Крайне важно провести диагностику Н. pylori до лечения и после уничтожения бактерий, чтобы контролировать эффективность выбранной схемы терапии. Это связано с появлением штаммов бактерий, устойчивых к антибиотикам.
Дефекты пищеварения хорошо выявляет анализ кала (микроскопическое исследование) — достаточно простой метод, который позволяет обнаружить косвенные признаки снижения выработки соляной кислоты, а также изменения, характерные для патологии других органов пищеварительной системы. Так, при атрофическом гастрите в кале появляется большое количество неизменённых мышечных волокон, перевариваемой клетчатки соединительной ткани и внутриклеточного крахмала.
Лечение атрофического гастрита
Современная терапия хронического гастрита предполагает воздействие на причины заболевания, в частности устранение H. pylori и лечение аутоиммунного гастрита.
Устранить аутоиммунные механизмы повреждения слизистой желудка можно только благодаря гормональной терапии. Назначение глюкокортикостероидов оправдано только при сопутствующей В12-дефицитной анемии.
Совершенно другой подход при обнаружении инфекции H. pylori и лабораторных подтверждений атрофических изменений. Он предполагает эрадикацию — уничтожение H. pylori. Терапия назначается после проведения суточной рН-метрии. При значении рН менее 6, несмотря на пониженную выработку соляной кислоты, назначаются ингибиторы протонной помпы (ИПП); при анацидном состоянии (рН ≥ 6) ИПП исключаются из схемы эрадикации и назначаются только антибиотики.
Через 4-6 недель после окончания антихеликобактерной терапии необходимо провести контрольное исследование — С13-уреазный дыхательный тест.
Хронический химикоиндуцированный или желчный рефлюкс-гастрит объединяет большую группу больных, включая:
Цель лечения — нормализовать моторику желудочно-кишечного тракта и связывание желчных кислот.
Тактика лечения зависит от основной причины гастрита:
Прогноз. Профилактика
Прогноз заболевания серьёзнее у пациентов старше 50 лет, т. к. в этом возрасте метапластические процессы развиваются гораздо быстрее и чаще приводят к появлению рака. Эффективность лечения зависит от степени выраженности атрофии и площади поражения. Большое значение имеет ранее начало лечения и полное устранение H. pylori (иногда лечение помогает только времено подавить активность инфекции [13] ). При выявлении H. pylori после проведённой терапии необходимо повторное лечение.
Предраковые изменения на фоне атрофического гастрита (кишечная метаплазия и дисплазия) представляют наибольшую опасность. При этом своевременная диагностика и полное удаление H. pylori уже через пять лет восстанавливают слизистую желудка и значительно уменьшают площадь метаплазии.
Лечение атрофического гастрита
Состояние, при котором уменьшается секреция желудочного сока в организме, опасно для здоровья любого человека. При атрофическом гастрите к такой патологии обычно приводит постепенное истончение слизистой оболочки желудка. Нарушения происходят из-за частых стрессов, неправильного питания, курения и злоупотребления алкоголем. Кроме того, хроническая форма гастрита также представляет опасность. При ней слизистая воспалена, что влияет на регенерацию ее клеток. Постепенно развивается атрофический гастрит, при котором лечение нужно начинать как можно скорее. В противном случае может начаться внутреннее желудочное кровотечение.
Симптомы атрофического гастрита
Заболевание обычно начинается без каких-либо характерных признаков. Стенки слизистой оболочки могут становиться все тоньше, но при этом человек не ощущает дискомфорта в области ЖКТ. Вначале уменьшаются оболочки дна и тела желудка, а затем уже весь орган подвергается атрофии. На этом этапе развивается анемический синдром. Из-за проблем с пищеварением уменьшается количество гемоглобина в крови. Тогда уже можно диагностировать атрофический гастрит, анемические симптомы которого представляют собой:
Появляются и другие признаки, по которым можно диагностировать атрофический гастрит, к примеру, диспепсические симптомы. Они относятся к категории нарушений в области пищеварения. Это могут быть:
Атрофический гастрит, при котором есть все эти симптомы, довольно легко диагностировать. Однако на начальной стадии врачам не всегда удается сразу определить недуг. С этой целью они назначают различные обследования, помогающие понять, какое именно заболевание ЖКТ вызвало такое состояние пациента.
Причины
Атрофический гастрит вызывает та же инфекция, что и другие формы этого заболевания слизистой оболочки желудка. Нelicobacter pylori живет у 90 % населения планеты непосредственно в ЖКТ. Она не проявляет себя, пока не происходят какие-либо изменения в организме пациента. При этом ей не вредит повышенная кислотность желудка. В определенном количестве она даже помогает ей выживать. Если изменяется объем желудочного сока, то тогда бактерия начинает вести себя агрессивно по отношению к слизистой оболочке. Происходит это только при наличии предрасполагающих факторов атрофического гастрита. К ним принято относить:
Также следует обращать внимание на температуру пищи. Если еда слишком горячая или холодная, со временем это также может спровоцировать развитие заболевания. Постепенно начнется атрофический гастрит, основные симптомы которого встречаются сейчас даже у детей в любом возрасте.
Какой врач лечит атрофический гастрит?
Заболевание проходит бессимптомно несколько недель и даже месяцев. Но если есть подозрение на атрофический гастрит, и симптомы начинают проявляться, лечение назначает только:
Что такое атрофический гастрит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Жуковой М. А., гастроэнтеролога со стажем в 22 года.
Определение болезни. Причины заболевания
Атрофический гастрит — это наиболее коварный тип хронического гастрита, при котором изменяются париетальные клетки желудка, из-за чего слизистая оболочка становится тоньше, а железы желудка, вырабатывающие соляную кислоту, атрофируются. Это закономерно приводит к недостаточной выработке соляной кислоты и нарушению переваривания пищи.
Первоначально заболевание повреждает слизистую оболочку дна желудка (фундального отдела), а затем нарушает продукцию соляной кислоты и пепсиногена, которые обеспечивают желудочное пищеварение [4].
Так как желудок является начальным звеном пищеварительной системы, нарушение его функции неизбежно влияет на состояние других органов: недостаточно переработанная в механическом и химическом отношении пища нарушает работу тонкого и толстого кишечника, а также поджелудочной железы.
Гастрит с атрофией желёз отличается прогрессирующим течением болезни и более высокой частотой озлокачествления [1]. Известно, что рак желудка не развивается на фоне неизменённой слизистой желудка — ему предшествуют изменения, называемые предраковыми, к которым и относится атрофический гастрит. Длительное течение этой болезни способствует появлению клеток, характерных для тонкого кишечника, вместо желудочных, а избыточное разрастание клеток слизистой провоцирует развитие опухоли.
Атрофический гастрит возникает и прогрессирует по разнообразным причинам, связанным с воздействием на слизистую оболочку желудка. Принято разделять их на две группы — экзогенные (внешние) и эндогенные (внутренние).
Наиболее значимыми факторами развития считаются инфекция Helicobacter pylori (H. pylori) и аутоиммунный гастрит, связанный с выработкой антител к собственным париетальным клеткам [6]. H. Pylori обнаруживают у 80 % с атрофическим гастритом, тогда как аутоиммунный гастрит считается достаточно редким заболеванием. Чаще всего оно встречается у женщин. Он может сопровождаться клиническими проявлениями, а может протекать бессимптомно, т. е. обнаружиться только при гистологическом исследовании после проведения биопсии. При хроническом аутоиммунном гастрите образуются антитела к париетальным клеткам, вырабатывающим соляную кислоту, и внутреннему фактору Касла — белку, который связывает витамин B12, поступающий с пищей, и переводит его в усвояемую форму.
Важную роль в появлении атрофического гастрита играет длительный приём лекарств. Чаще всего он связан с нестероидными противовоспалительными средствами — аспирином, ибупрофеном, диклофенаком, дифлунизалом, пироксикамом, индометацином, кетопрофеном, напроксеном, сулиндаком и др. Также гастрит может развиться после приёма антибиотиков и таких препаратов, как инсулин, сульфаниламид, гормональные препараты, противотуберкулёзные средства. Кроме того, химическое воздействие на слизистую желудка оказывает рефлюкс — процесс заброса агрессивного содержимого кишечника в желудок, вследствие чего повреждается слизистая желудка и развиваются дальнейшие атрофические изменения.
Существенными причинами появления заболевания также являются возрастные изменения: у людей до 30 лет атрофические процессы встречаются в 5 % случаев, до 50 лет — в 30 % случаев, после 50 лет — в 50-70 % случаев. Возможна и генетически обусловленная перестройка слизистой желудка по типу гипо- и атрофии.
К остальным причинам развития атрофического гастрита относят эмоциональные нагрузки, депрессию, сахарный диабет, гипертиреоз, дефицит железа и витамина В12, гипоксию (нехватку кислорода в тканях) при лёгочной и сердечной недостаточности, а также сочетание взаимоусиление нескольких воздействующих факторов [3].
Симптомы атрофического гастрита
Клиническая картина хронического гастрита связана с местными и общими расстройствами. Часто болезнь может протекать бессимптомно, особенно у людей после 50 лет. Симптомы, как правило, связаны с недостаточной работой желудка и зависят от степени поражения определённого звена пищеварения.
Выработка соляной кислоты постепенно снижается, вплоть до полного её отсутствия. Часто присоединяется сопутствующая патология: панкреатит, холецистит, энтероколит. В компенсированной стадии, когда потеря париетальных клеток ещё не приводит к значительному снижению кислотности, диспепсические симптомы могут быть менее выражены, большинство функций желудка сохранены, при этом гистологическая оценка выявляет атрофию. Поэтому понятие атрофический гастрит (морфологический диагноз) и гастрит с пониженной кислотностью (функциональное состояние) неоднозначны.
У людей с аутоиммунным гастритом выявляются антитела к париетальным клеткам, сопутствует анемия, вызванная дефицитом витамина B12, и значительное снижение секреции соляной кислоты.
Патогенез атрофического гастрита
При гастрите оба слоя эпителия желудка вовлечены в патологический процесс. Заселение слизистой H. pylori вызывает хроническое повреждение клеток, ослабляет защитные свойства слизистой желудка, что ведёт к повреждению клеточных ядер свободными радикалами и токсинами. При этом изменяется клеточная структура, нарушается специализация клеток, появляются «гибридные» клетки, которые имеют свойства предраковых. Данный процесс называется кишечной метаплазией. В связи с этими изменениями слизистая желудка сначала приобретает вид тонкокишечного эпителия, затем — толстокишечного эпителия. Чем дальше заходит процесс метаплазии, тем больше вероятность развития аденокарциномы — железистого рака желудка.
Данный нарушенный процесс обновления клеток в слизистой желудка лежит в основе образования атрофии при гастрите. Прослеживается определённый патогенетический каскад, спровоцированный Н. pylori: от инфекционного гастрита через стадии атрофии, метаплазии и дисплазии к раку желудка. Особенно опасно появление неполной — толстокишечной — метаплазии.
При резко выраженной атрофии фундальных желёз возникает компенсаторная, рикошетная гиперпродукция гастрина, также увеличивается активность G-клеток. У людей после 50 лет более выражены явления атрофии с метаплазией железистого эпителия по кишечному типу. Риск появления рака желудка на фоне аутоиммунного гастрита в 3-10 раз выше, чем у других людей. Сочетание такого гастрита с инфекционным существенно ухудшает прогноз [5].
Классификация и стадии развития атрофического гастрита
По принятой в Сиднее в 1990 году классификации, диагноз гастрита должен учитывать локализацию патологических изменений, гистологические характеристики, выявленные при исследовании биоптатов, эндоскопические находки и вероятные причины развития болезни [5].
| По типу | По локализации изменений | По эндоскопическими признакам | По причинам развития |
|---|---|---|---|
| •⠀Острый •⠀Хронический | •⠀Антральный (в антруме) •⠀Фундальный (в своде желудка) •⠀Пангастрит (во всём желудке) | •⠀Эритематозный (поверхностный) •⠀Эрозивный (с появлением эрозий) •⠀Геморрагический (с очагами кровоизлияния) •⠀Атрофический (с атрофией желёз) •⠀Гиперплазия складок (с разрастанием клеток слизистой) | •⠀Тип А (аутоиммунный гастрит) •⠀Тип В (связан с H. pylori) •⠀Тип С (реактивный гастрит) •⠀Особые формы |
| Также выделяют фазы ремиссии и обострения, стадии компенсации и декомпенсации | |||
В последующем эта классификация дополнялась и уточнялась в связи с новыми научными данными. Сейчас для правильной формулировки диагноза «хронический гастрит» важно установить причину заболевания, распространённость поражения, степени активности и атрофии.
Условно желудок можно поделить на пять отделов: кардия, свод (дно, или фундальный отдел), тело, антрум и привратник. Атрофия может затронуть как один из этих отделов, так и весь желудок. В связи с этим выделяют диффузный атрофический гастрит (в фундальном, антральном или другом отделе) и мультифокальный атрофический гастрит (во всём желудке).
При этом учитывается локализация и степень выраженности атрофических изменений (слабая, средняя, сильная), а также наличие и площадь очагов кишечной метаплазии.
Осложнения атрофического гастрита
Выраженный атрофический гастрит всегда сопровождается В12-дефицитной анемией, при которой париетальные клетки, вырабатывающие соляную кислоту, практически отсутствуют. Витамин В12, поступающий с пищей, не всасывается, что приводит к хронической анемии с характерными проявлениями в виде быстрой утомляемости, нарушения зрения и вкусовых ощущений, мышечной слабости, головокружений, чувства покалывания и онемения в конечностях.
Самым серьёзным осложнением атрофического гастрита является рак желудка. Развитие злокачественной опухоли проходит несколько этапов на протяжении нескольких лет [5]. При этом железы желудка перестают вырабатывать соляную кислоту и гастрин, приобретают свойства тонко- или толстокишечных желёз. Такие изменённые железы в процессе зарождения рака становятся всё более незрелыми, метаплазия эпителия переходит от полного типа (тонкокишечного) к неполному (толстокишечному) типу. Такой процесс существенно повышает риск развития опухоли.
При ахлоргидрии — отсутствии соляной кислоты в желудочном соке — происходит к выраженное нарушение пищеварения, ухудшается переработка пищи, снижается всасывание отдельных микроэлементов и витаминов.
Диагностика атрофического гастрита
Гастрит — диагноз морфологический, т. е. он основан не на симптомах, а на изменениях строения слизистой желудка. Поэтому он может считаться объективным только после оценки слизистой желудка, взятой во время биопсии. Этим занимается патоморфолог. Только с помощью морфологического исследования можно достоверно выявить атрофию, воспаление и деструкцию слизистой желудка.
Клинический диагноз гастрита, т. е. диагноз без морфологического исследования, практически не имеет смысла. Симптомы диспепсии, которые заставляют больного обратиться к врачу, носят лишь функциональный характер и не всегда указывают на те морфологические изменения, которые составляют суть гастрита.
Изменения слизистой можно обнаружить при проведении эзофагогастродуоденоскопии (ЭГДС) — осмотре желудка и двенадцатиперстной кишки с помощью эндоскопа (через видео-трубку). Но результаты этого исследования являются субъективными и только косвенным образом могут указывать на наличие гастрита: они не позволяют оценить степень его прогрессирования.
Во время гастроскопии (ФГДС) выявляются истончение слизистой, уменьшение складок и усиление сосудистого рисунка. Чтобы обнаружить дисплазию или метаплазию, можно воспользоваться хромографией. Для этого слизистую желудка окрашивают специальным красителем: изменённые участки приобретают окраску, отличающую их от здоровой ткани. На УЗИ можно обнаружить сопутствующую патологию органов пищеварительной системы — печени, желчного пузыря, поджелудочной железы.
Способность париетальных клеток выделять соляную кислоту изучается при помощи рН-метрии. Это исследование проводится одномоментно с проведением ФГДС. От его результатов зависит тактика лечения и прогноз заболевания. Также он помогает контролировать эффективность терапии. Так как при атрофическом гастрите кислотность снижена, pH может колебаться в пределах 3-6.
Лабораторными маркерами атрофического гастрита являются уровень пепсиогена I, пепсиогена II и гастрина-17 в крови. Определить его можно при помощи гемотеста. Снижение выработки пепсиногена I и II указывает на уменьшение функционирующих главных клеток.
Научно доказана возможность скрининга с помощью анализа крови для выявления атрофического гастрита и рака желудка [8]. Существенное значение имеет определение антител к фактору Кастла и антител к париетальным клеткам желудка в сыворотке крови. Тест значительно чувствителен — положителен у 95 % пациентов с В12-дефицитной анемией, хотя специфичность теста низкая: эти антитела могут присутствовать у небольшого процента людей с сахарным диабетом 1-го типа, тиреотоксикозом и аутоиммунным тиреоидитом.
Диагностика H. pylori необходима при любом варианте гастрита. Выяснив причину болезни, можно устранить инфекцию и прерывать патогенетический каскад заболевания и предупредить грозные осложнения, особенно на ранних стадиях [11]. Методы диагностики инфекции могут быть прямыми и косвенными. Настоятельно рекомендуется использовать несколько методов, чтобы исключить ложноположительные и ложноотрицательные результаты.
Оптимальным методом является морфологическое исследование биоптатов. Также в практике широко используется быстрый уреазный тест — определение H. pylori методом оценки количества аммиака в мочевине, образуемого этими бактериями. К другим способам относятся дыхательный тест и иммуноферментные анализы.
Крайне важно провести диагностику Н. pylori до лечения и после уничтожения бактерий, чтобы контролировать эффективность выбранной схемы терапии. Это связано с появлением штаммов бактерий, устойчивых к антибиотикам.
Дефекты пищеварения хорошо выявляет анализ кала (микроскопическое исследование) — достаточно простой метод, который позволяет обнаружить косвенные признаки снижения выработки соляной кислоты, а также изменения, характерные для патологии других органов пищеварительной системы. Так, при атрофическом гастрите в кале появляется большое количество неизменённых мышечных волокон, перевариваемой клетчатки соединительной ткани и внутриклеточного крахмала.
Важно также исследовать кровь по общим показателям. При атрофическом гастрите и В12-дефицитной анемии в анализе крови можно обнаружить снижение уровня гемоглобина.
Лечение атрофического гастрита
Современная терапия хронического гастрита предполагает воздействие на причины заболевания, в частности устранение H. pylori и лечение аутоиммунного гастрита.
Устранить аутоиммунные механизмы повреждения слизистой желудка можно только благодаря гормональной терапии. Назначение глюкокортикостероидов оправдано только при сопутствующей В12-дефицитной анемии.
Совершенно другой подход при обнаружении инфекции H. pylori и лабораторных подтверждений атрофических изменений. Он предполагает эрадикацию — уничтожение H. pylori. Терапия назначается после проведения суточной рН-метрии. При значении рН менее 6, несмотря на пониженную выработку соляной кислоты, назначаются ингибиторы протонной помпы (ИПП); при анацидном состоянии (рН ≥ 6) ИПП исключаются из схемы эрадикации и назначаются только антибиотики.
Согласно исследованиям американских учёных [6], игнорирование наличия H. pylori при назначении антисекреторной терапии приводит к тому, что воспаление распространяется на всю слизистую оболочку желудка. В итоге через 10-15 лет хронический воспалительный процесс приводит к развитию атрофии главных желёз, повышая риск появления рака желудка. Поэтому при наличии показаний для длительного назначения ИПП необходимо предварительно пройти исследование для выявления H. pylori, а также курс эрадикационной терапии при положительном результате.
Первая линия терапии включает ИПП в полной суточной дозе (40 мг) и два антибиотика: кларитромицин + амоксициллин либо кларитромицин и фуразолидон. Пациентам с резко пониженной секреторной функцией вместо ингибиторов кислотной секреции показано назначение висмута субцитрата (де-нол). Если проводимая терапия не привела к полному уничтожению H. pylori, считается, что бактерия устойчива к проводимому лечению. В таком случае необходимо определить чувствительность бактерии к антибиотикам, применяемым в практике [2].
Если первая линия терапии неэффективна, проводится вторая линия терапии: препарат висмута (висмута трикалия дицитрат), ИПП, тетрациклин и метронидазол. Длительность лечения составляет 7-14 дней.
В России широко используются препараты висмута в качестве терапии первой и второй линии (в комбинации трёх препаратов), чаще других назначается де-нол (улькавис). Назначение висмута при лечении хронического гастрита оправдано, т. к. нет необходимости быстро купировать боль, как при обострении язвенной болезни, когда применяются схемы с ИПП. Малосимптомное течение хронического гастрита позволяет провести эрадикацию на основе висмутсодержащих препаратов.
Через 4-6 недель после окончания антихеликобактерной терапии необходимо провести контрольное исследование — С13-уреазный дыхательный тест.
После устранения инфекции уже через месяц снижается активность гастрита. Если атрофия ещё не успела развиться, то можно говорить о полном излечении болезни. При атрофическом гастрите нормализуется клеточное обновление слизистой желудка, прерывается патогенетический каскад, что не даёт развиться раку желудка [9].
Прогноз. Профилактика
Прогноз заболевания серьёзнее у пациентов старше 50 лет, т. к. в этом возрасте метапластические процессы развиваются гораздо быстрее и чаще приводят к появлению рака. Эффективность лечения зависит от степени выраженности атрофии и площади поражения. Большое значение имеет ранее начало лечения и полное устранение H. pylori. При выявлении инфекции после проведения терапии необходимо повторное лечение.
Существенно влияет на прогноз заболевания площадь распространения метаплазии и атрофического процесса. Если метаплазия распространилась на 20 % слизистой, то риск ракового развития достигает почти 100 %. По статистике, хронический атрофический гастрит в 13 % случаев неизбежно заканчивается онкологией [10]. Большое значение для прогноза болезни имеет и снижение выработки соляной кислоты, т. к. при этом нарушаются механизмы противоопухолевой защиты.
Принципиально важно постоянное наблюдение пациентов с хроническим гастритом. Оно предполагает эндоскопию с биопсией и гистологическим исследованием, которое должно проводиться не реже двух раз в год. Чем больше степень воспалительных изменений, тем выше риск развития атрофии. Если атрофический гастрит уже развился, то необходимо установить его стадию. Это позволит определить, входит ли пациент в группу риска развития рака желудка [10][12].
Предраковые изменения на фоне атрофического гастрита (кишечная метаплазия и дисплазия) представляют наибольшую опасность. При этом своевременная диагностика и полное удаление H. pylori уже через пять лет восстанавливают слизистую желудка и значительно уменьшают площадь метаплазии.
Список литературы
Данная статья использована в качестве основы для видео для пациентов Чернова И.С., Жукова М.А. Атрофический гастрит.
Атрофический гастрит: что мы понимаем под этим состоянием. Современные подходы к диагностике и лечению
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
В клинической практике мы довольно часто сталкиваемся с диагнозом «атрофический гастрит». Однако до сих пор остается много вопросов относительно того, является ли он самостоятельным заболеванием или исходом других форм гастритов? Равнозначны ли понятия атрофический гастрит и аутоиммунный атрофический и гипоацидный гастрит? Что на самом деле скрывается за этим диагнозом? Какие методы помогут подтвердить диагноз и как лечить таких пациентов? На эти и другие вопросы мы постараемся ответить в данной статье.
Важность проблемы определяется тем, что желудок является начальным звеном пищеварительного конвейера, и нарушение его функции незамедлительно сказывается на состоянии других органов пищеварения, вызывая сбой в работе тонкой и толстой кишки, поджелудочной железы, печени и приводя к увеличению содержания патогенных бактерий в кишечнике. Хронический атрофический гастрит относят к предраковым состояниям желудка, на фоне данного заболевания часто развиваются такие предраковые изменения, как кишечная метаплазия и дисплазия эпителия слизистой желудка, а также гиперпролиферация эпителия слизистой желудка, способствующая развитию опухолей [1].
Хронический гастрит (ХГ) занимает центральное место среди заболеваний желудка. И не только потому, что он является наиболее распространенным заболеванием пищеварительной системы. Более существенно то, что ХГ, почти как правило, предшествует или сопутствует таким серьезным по течению и прогнозу болезням, как язва и рак желудка. В основе ХГ лежат воспалительные, дисрегенераторные, дистрофические и атрофические процессы в слизистой оболочке желудка, приводящие, в конечном счете, к ее функциональной недостаточности.
В 1990 г. в Сиднее (Австралия) была принята новая классификация гастритов, получившая названия Сиднейской системы, согласно которой диагноз гастрита должен формулироваться на основании 4–х признаков заболевания:
1. Локализация патологического процесса.
2. Гистологические признаки, выявленные при исследовании биоптатов.
3. Макроскопические признаки, выявленные при эндоскопии.
4. Вероятные этиологические факторы (табл. 1).
Более поздняя Хьюстоновская классификация внесла в Сиднейскую систему важные дополнения, в соответствии с которыми различают:
• Хронический неатрофический гастрит (прежде всего вызванный H. pylori)
• Хронический атрофический гастрит
• Мультифокальный гастрит (как исход длительно текущего гастрита, ассоциированного с H. pylori)
• Аутоиммунный гастрит
• Особые формы гастрита.
Распространенность атрофического гастрита
Большинство исследователей придерживается мнения, что ХГ страдает более 1/3 взрослого населения, однако из них к врачам обращается всего лишь 10–15%. Хеликобактерный гастрит преобладает и составляет 80–90% всех гастритов, аутоиммунный сотавляет всего лишь 10%. Истинная распространенность атрофии слизистой оболочки (СО) желудка неизвестна, но если рассматривать его, как проявление аутоиммунного и исход длительно текущего хеликобактерного гастрита, его распространенность может достигать 50–60%!
Причины и патогенез атрофического гастрита
Атрофический гастрит – мультифакторное состояние. Существует более десятка причин, каждая из которых способна приводить к атрофии слизистой оболочки и, соответственно, к развитию функциональной недостаточности желудка. Развитие атрофических изменений в СО может быть результатом патологического процесса или возрастных инволюционных изменений,также возможна генетически обусловленная гипо– или атрофия СО желудка.
Наиболее частыми этиологическими факторами, вызывающими атрофический гастрит, признаны инфекция Helicobacter pylori (Н. pylori) и аутоиммунный гастрит, который встречается довольно редко [2].
Атрофический гастрит, ассоциированный с Н. pylori
С Н. pylori связывают возникновение подавляющего большинства атрофических гастритов. Бактерии Н. рylori, персистируя на желудочном эпителии, вызывают хронический хеликобактерный поверхностный гастрит. Длительно существующий поверхностный хеликобактерный гастрит без соответствующего лечения трансформируется в атрофический.
Мультифокальный атрофический гастрит характеризуется вовлечением тела и антрального отдела желудка с прогрессирующим развитием атрофических изменений слизистой – уменьшением количества желез и их частичным замещением кишечным эпителием (кишечная метаплазия). Пациенты с данным видом хронического гастрита имеют повышенный риск развития карциномы желудка.
Аутоиммунный хронический атрофический гастрит
Данный тип хронического гастрита связан с образованием аутоантител (к париеталным клеткам и внутреннему фактору Кастла). Антитела связываются с микроворсинками париетальных клеток и делают невозможным соединение витамина В12 с внутренним фактором Касла. Считается, что выработка антител к H+K+–АТФазе париетальных клеток является одной из причин ахлоргидрии. Повреждение антителами собственных (фундальных) желез приводит к их потере. При этом в теле и дне желудка развивается прогрессивная атрофия главных и париетальных клеток с недостаточностью внутреннего фактора Кастла, что может приводить к пернициозной анемии.
Аутоиммунный гастрит часто сочетается с другой аутоиммунной патологией и нередко развивается в рамках так называемого аутоиммунного полигландулярного синдрома [3].
Гистологические изменения при аутоиммунном атрофическом гастрите зависят от фазы заболевания:
а) в раннюю фазу отмечается многоочаговая диффузная инфильтрация собственной пластинки мононуклеарными клетками и эозинофилами, а также очаговая Т–клеточная инфильтрация собственных желез желудка с их разрушением. Наблюдают очаговую гиперплазию мукоидных клеток (псевдопилорическая метаплазия), а также гипертрофические изменения париетальных клеток;
б) в более позднюю фазу заболевания усиливается лимфоцитарное воспаление, атрофия собственных желез желудка и очаговая кишечная метаплазия. Последняя стадия характеризуется диффузным атрофическим гастритом с вовлечением тела и дна желудка с небольшими явлениями кишечной метаплазии. Антральный отдел не поражен.
Условно в желудке различают 4 отдела:
1. Кардиальный отдел – самый начальный отдел, в который переходит пищевод.
2. Свод (дно, фундальный отдел) – куполообразная часть желудка, расположенная в самом верху.
3. Тело желудка – отдел, где пища находится во время переваривания.
4. Пилорическая (привратниковая) часть, она заканчивается пилорическим сфинктером, ограничивающим полость желудка от полости двенадцатиперстной кишки.
Атрофия может затрагивать все отделы желудка или каждый из них в отдельности. В этой связи патоморфологи выделяют «диффузный» (фундальный, антральный или тотальный), а также «мультифокальный» атрофический гастрит. Физиологические и клинические проявления атрофии в разных отделах желудка могут быть совершенно разными [4]; СО фундального отдела желудка, как его основная функциональная составляющая часть, представлена тремя основными популяциями клеток: добавочными – слизеобразующими, вырабатывающими муцин, париетальными, секретирующими соляную кислоту и главными – продуцирующими пепсины [5]. Атрофический процесс может захватывать как все железы, так и избирательно поражать те или иные клетки. Так, описаны формы аутоиммунного гастрита, поражающего только париетальные клетки. Атрофия желез заключается в уменьшении численности клеток, продуцирующих пепсины, и париетальных клеток, выделяющих соляную кислоту. Атрофия может затрагивать одну или обе популяции клеток, число которых меняется независимо друг от друга. Атрофия желез тела желудка может быть компенсирована за счет увеличения его объема, увеличения высоты складок, гипертрофии СО антрального отдела и появления в составе антральных желез париетальных клеток. Однако такой компенсации может и не быть, и атрофия СО может охватывать весь желудок.
Таким образом, на фоне существования десятков причин и морфофункциональных вариантов атрофии, диагноз «хронический атрофический гастрит» является лишь собирательным понятием, который совершенно не отражает реальную картину структурной организации желудка и физиологию желудочной секреции.
Неизменным следствием атрофии СО является функциональная недостаточность желудка, что определяет довольно широкую гамму клинических проявлений.
Основными функциями желудка являются:
1. Депонирование пищи.
2. Частичное переваривание. В желудке начинается переваривание белков и клетчатки.
• Под действием соляной кислоты денатурируются белки и набухает растительная клетчатка.
• Под действием пепсина и гастриксина белки расщепляются до пептидов и аминокислот. Пепсин вырабатывается главными клетками в виде пепсиногена, который под воздействием соляной кислоты переходит в активную форму.
3. Частичное всасывание. В желудке могут всасываться некоторые лекарства (ацетилсалициловая кислота, барбитураты) и алкоголь.
4. Проведение пищи до кишечника. Пища в среднем находится в желудка 3–10 часов. Причем жидкость эвакуируется незамедлительно, дольше всего задерживается жирная пища. Блуждающие нервы усиливают мышечную активность, а симпатические уменьшают.
5. Бактерицидная функция реализуется за счет действия соляной кислоты.
Поэтому неизменным спутником гипоацидных состояний, а также длительного приема ингибиторов протонной помпы (омепразол) является дисбактериоз.
6. Кроветворная функция (синтез внутреннего фактора Кастла).
Из–за выраженного снижения функциональной активности желудка, при атрофическом гастрите ведущим является синдром диспепсии, в отличие от гиперацидного гастрита, где преобладает болевой синдром.
1. Синдром диспепсии: ухудшение аппетита, отрыжка воздухом или тухлой пищей, тошнота. Характерно чувство тяжести, переполнения желудка, кокосмия (плохой запах изо рта), слюнотечение, неприятный привкус во рту.
2. Синдром избыточного бактериального роста также часто лидирует в клинической картине. Его развитие связано с нарушением бактерицидной функции соляной кислоты. Проявляется он урчанием, вздутием в животе, непереносимостью молочных продуктов, неустойчивым стулом. При частых поносах может наступить похудание, анемия.
3. Анемический синдром связан:
а) с нарушением всасывания витамина В12 из–за снижения выработки внутреннего фактора Кастла;
б) и/или железа (нарушение процесса восстановления трехвалентного железа в двухвалентное под действием соляной кислоты);
в) фолиеводефицитная анемия может развиваться из–за нарушений кишечной микрофлоры.
4. Также имеет место болевой синдром, но связанный не со спазмом гладкой мускулатуры, а с растяжением желудка из–за нарушения эвакуаторной функции желудка. Боли, как правило, тупые, ноющие, усиливающиеся после приема пищи, без четкой локализации (т.е. носят не спастический, как при гиперацидном гастрите, а дистензионный характер).
5. Дистрофический синдром, обусловленный полигиповитаминозами (Р,С,А,Д), белковой недостаточностью, вследствие нарушения переваривания белков.
При осмотре: атрофичный «полированный язык», при обострениях – язык обложен густым белым налетом. При пальпации болезненность обычно отсутствует. Секреция прогрессивно снижается вплоть до ахлоргидрии. Часто присоединяется сопутствующая патология: панкреатит, холецистит, энтероколит.
Гастроскопия
Гастроскопия является ведущим методом диагностики атрофического гастрита. Она выявляет истончение слизистой, которая приобретает бледно–сероватый цвет, размер ее складок уменьшается, выраженность сосудистого рисунка увеличивается (рис. 1 и 2).
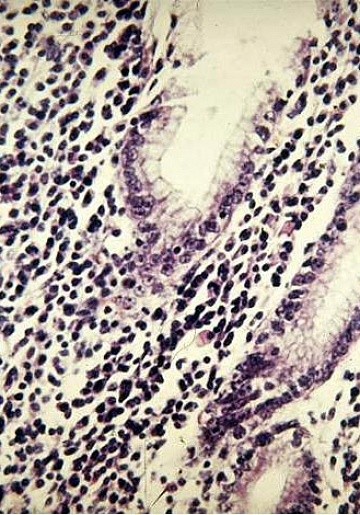
При атрофическом гастрите участки истонченной слизистой могут чередоваться с участками кишечной метаплазии, которая может быть более или менее выраженной, и иметь различную распространенность. Кишечная метаплазия традиционно рассматривалась, как предраковое изменение слизистой оболочки желудка (рис. 3).
Гистология
Атрофия выражается в уменьшении толщины СО, толщины зоны слизистого эпителия и глубины желез. Наряду с этим атрофия может проявляться и в разрежении желез. Морфологическое исследование является одним из ключевых и достоверных методов выявления атрофических, воспалительных и деструктивных изменений в СО фундального и антрального отдела желудка, но при условии выполнения качественной морфологической диагностики (Good Morphological Practice) [4].
Для выявления дисплазии и метаплазии можно прибегнуть к методу хромографии, когда измененные участки окрашиваются специальным индикатором в соответствующий цвет (рис. 4).
УЗИ является дополнительным методом диагностики при атрофическом гастрите и в основном нацелено на выявление сопутствующей патологии поджелудочной железы, желчного пузыря, печени и т.д. УЗИ–признаки атрофического гастрита далеко не всегда выявляются, при выраженном патологическом процессе можно увидеть уменьшение размеров желудка и «сглаживание» его поверхности (уменьшение высоты желудочных складок).
Оценка функциональной активности желудка
Функциональное исследование желудка включает:
1) рН–метрию, которая позволяет определить секреторную активность париетальных клеток;
2) определение активности пепсинов или общей протеолитической активности содержимого желудка.
Материал для исследования может быть получен при зондировании или при гастроскопии.
Суточная рН–метрия является «золотым стандартом» оценки секреторной функции желудка при атрофическом гастрите. Ее проведение необходимо для определения тактики лечения пациента, прогноза и контроля эффективности терапии. Как правило, атрофический гастрит сопровождается пониженной кислотностью. Среднесуточная рН может колебаться от 3 до 6.
Лабораторные маркеры атрофического гастрита
1. В последние годы все большую популярность получает метод исследования содержания в сыворотке крови пепсиногена I, пепсиногена II и гастрина–17 в качестве маркеров атрофии СО фундального и антрального отделов желудка. Этот малоинвазивный метод позволил выделить несколько разновидностей атрофического гастрита в теле желудка и в антральном отделе. Пепсиноген I и II синтезируются и секретируются главными клетками желудка. После попадания в просвет желудка они превращаются в протеолитический фермент пепсин. Снижение уровня пепсиногена I коррелирует со снижением количества главных клеток при атрофии слизистой желудка. Измерение уровней пепсиногена I и пепсиногена II, а также их соотношения в сыворотке крови используется в качестве скринингового метода для выявления атрофического гастрита и рака желудка. Чувствительность и специфичность данного метода относительно невелика (84,6 и 73,5% соответственно) [5].
2. Определение антипариетальных антител и антител к внутреннему фактору Кастла в сыворотке крови.
Антипариетальные антитела направлены против микросомальных компонентов париетальных клеток желудка. Тест положителен у 95% пациентов с пернициозной анемией, хотя специфичность теста низкая. Антитела к париетальным клеткам присутствуют у 25–30% пациентов с аутоиммунным тиреоидитом.
При определении антител к внутреннему фактору следует не допускать введения витамина В12 в течение 48 часов перед взятием образца. Антитела к внутреннему фактору могут присутствовать у 3–6% людей с гипертироидизмом или инсулинозависимым диабетом.
3. Определение уровня гастрина в сыворотке крови.
Для аутоиммунного хронического гастрита характерно повышение уровня гастрина. Необходимо проведение дифференциальной диагностики с гастриномой (синдром Золлингера–Эллисона).
Диагностика инфекции Helicobacter pylori
Диагностика Helicobacter pylori необходима при любом гастрите. Она помогает выявить причину поражения желудка, т.к. в большинстве случаев этиологическим фактором атрофии признанна длительно текущая инфекция Helicobacter pylori. Существуют 2 группы методов – прямые и косвенные [А.А. Шептулин, В.А. Киприанис/Диагностика и лечение инфекции Helicobacter pylori: основные положения согласительного совещания «Маастрихт–3»//Российский журнал гастроэнтерологии, гепатологии, колопроктологии, 2006, № 2, с. 88–91]. Следует помнить, что достоверность тестов зависит от выбранного метода и используемых методик и реактивов.
«Золотым стандартом» достоверности признано морфологическое исследование биоптатов.
Принципиальное значение для практики имеет проведение диагностики Н. pylori–инфекции до лечения – первичная диагностика, и после проведения противохеликобактерной терапии – контроль эффективности выбранной схемы лечения.
Анализ кала – дешевый и простой метод, который позволяет выявить косвенные признаки секреторной недостаточности желудка. Так, при атрофическом гастрите в кале появляется большое количество (+++) неизмененных мышечных волокон, соединительной ткани, перевариваемой клетчатки и внутриклеточного крахмала, а также признаки, свидетельствующие о сопутствующем дисбактериозе.
Принципы медикаментозной терапии атрофического гастрита
Если лечение гиперацидных состояний на сегодняшний день достигло больших успехов, то в терапии гипоацидного атрофического гастрита и по сей день много «белых пятен». Практикующий врач, каждый раз сталкиваясь с атрофией СО желудка, оказывается перед непростым выбором: назначать или не назначать антацидные и антисекреторные препараты, проводить ли полноценный курс эрадикации и т.д.
Давайте попробуем разобраться во всех тонкостях лечения атрофического гастрита и наметить алгоритм действия.
1. Этиотропная терапия. Во–первых, необходимо выявить причину атрофического гастрита и, по возможности, устранить ее. Как мы уже сказали, основными причинами атрофии СО желудка являются длительно текущий гастрит, ассоциированный с Helicobacter pylori, и аутоиммунный гастрит. Таким образом, при обнаружении атрофических изменений СО на гастроскопии при гистологическом исследовании или лабораторными методами (пенсиноген I и II ) необходимо во всех случаях провести диагностику НР–инфекции и при ее обнаружении назначить эрадикационную терапию. Также всем пациентам определяют лабораторные маркеры аутоиммунной патологии (антипариетальные АТ и АТ к фактору Кастла).
К сожалению, устранить аутоиммунные механизмы поражения СО желудка на сегодняшний день практически невозможно, вопрос о назначении глюкокортикостероидов встает только тогда, когда гастрит сопровождает пернициозная анемия. В остальных случаях побочные эффекты ГКС будут преобладать над клинической эффективностью.
Эрадикационная терапия при атрофическом гастрите имеет важную особенность: прежде чем решить вопрос о выборе антисекреторного препарата, необходимо провести суточную рН–метрию. При рН менее 6, несмотря на пониженную секрецию, назначаются ингибиторы протоновой помпы (ИПП). И лишь при анацидном состоянии (рН ≥ 6) ИПП исключаются из схемы эрадикации и назначаются только антибиотики.
Данные в отношении возможности обратного развития атрофии и кишечной метаплазии после эрадикации инфекции противоречивы. Считается, что эффективная эрадикация H. pylori даже на этапе атрофии приводит к прерыванию каскада патологических реакций в слизистой оболочке желудка и может рассматриваться, как профилактика развития рака желудка. В пользу эрадикации H. pylori у пациентов с атрофическим гастритом свидетельствует целый ряд работ, результаты которых доказывают, что эрадикация инфекции сопровождается нормализацией регенераторных процессов в слизистой оболочке желудка.
Диетотерапия. В фазе обострения хронического аутоиммунного гастрита рекомендуется диета №1а, обеспечивающая функциональное, механическое, термическое и химическое щажение желудка. Через 2–3 дня по мере ликвидации острых симптомов больных переводят на диету № 1. По мере ликвидации воспаления больным хроническим аутоиммунным гастритом показана постепенно нарастающая стимуляция функциональных желез. Для этого назначают диету № 2. Цель этой диеты – механическое щажение желудка с сохранением химических раздражителей.
2. Патогенетическая терапия. Общими группами лекарственных препаратов для лечения атрофичекого гастрита вне зависимости от причины являются следующие:
I. Препараты заместительной терапии
Заместительная терапия включает в себя назначение препаратов соляной кислоты и ферментов желудочного сока.
• Натуральный желудочный сок принимают по 1–2 ст. ложки 3–4 р/сут. во время еды.
• Ацидин–пепсин–таблетки, содержащие ацидин и пепсин, из которых в воде образуется соляная кислота. Принимают по 1 таб. (500 мг) 3 р/д, запивая водой.
• Препараты желудочных ферментов: одним из перспективных современных препаратов, направленных на коррекцию секреторной недостаточности желудка, является Абомин®.
Абомин® – препарат, получаемый из слизистой оболочки желудка телят и ягнят молочного возраста. Содержит сумму протеолитических ферментов. Назначается по 1 таб. (по 0,2 г с содержанием в 1 таблетке 50 000 ЕД) 3 раза в сутки во время еды в течение 1–2 мес. При недостаточной эффективности разовая доза может быть увеличена до 2–3 таб. на прием, а курс лечения продлен до 3 мес.
Препарат обычно переносится без побочных явлений, в отдельных случаях отмечаются легкая тошнота, изжога.
Под действием Абомина® осуществляется протеолиз белков пищи до уровня полипептидов и частично аминокислот. Препарат может применяться не только при хроническом атрофическом гастрите, но и при острых нарушениях пищеварительной функции (острый гастрит, гастроэнтерит). Безопасен и может применяться даже у детей грудного возраста.
Прием Абомина® в значительной степени улучшает клиническую картину заболевания (уменьшается тяжесть в эпигастрии, тошнота, отрыжка, диарея), приводит к нормализации лабораторных показателей (в анализах кала уменьшается количество непереваренных мышечных волокон, клетчатки).
При развитии у пациента В12–дефицитной анемии, заместительная терапия должна включать парентеральное введение витамина В12.
II. Средства, стимулирующие секрецию соляной кислоты
В настоящее время существует большое количество лекарственных препаратов, которые «теоретически» должны оказать стимулирующее действие на париетальные клетки. Однако в реальной клинической практике эффективноть большинства из них весьма низкая, а продолжительность действия короткая.
Следует все же упомянуть о некоторых методах стимулирующей терапии:
• минеральные воды (Есентуки №4,17, Нарзан, Миргородская) применяют в теплом виде за 15–20 мин до еды;
• отвар шиповника, а также лимонный, капустный, томатный соки, разведенные кипяченой водой;
• лекарственные сборы (подорожник, зверобой, полынь, чабрец). Особенно широко в практике используется плантаглюцид – гранулы листьев подорожника, который применяют по 1 ч.л 3 р/сут. с теплой водой за 20 мин до еды;
• Лимонтар (лимонная и янтарная кислота) по 1 таб. 3 р/сут. за 20 мин до еды.
III. Средства, влияющие на трофику и регенерацию СО желудка (гастропротекторы)
К этой группе можно отнести солкосерил, довольно эффективный препарат, однако его назначение более оправдано при эрозивном гастрите и язвенной болезни.
IV. Обволакивающие и вяжущие средства, обладающие противовоспалительным эффектом Препараты этой группы образуют тонкую пленку из гелеобразного вещества, покрывающего воспаленные участки. Обволакивающим и вяжущим действием обладают препараты висмута и алюминия.
V. Средства, влияющие на моторику желудка
Цизаприд, домперидон и другие прокинетики в случаях ослабления тонуса и перистальтики желудка, гастродуоденального рефлюкса и снижения тонуса нижнего пищеводного сфинктера.
В период ремиссии атрофического гастрита главным принципом лечения является стимулирующая и заместительная терапия, которая назначается с целью компенсации секреторной недостаточности.
Хронический атрофический гастрит
Причины болезни
Изнутри желудок выстлан тонкой, нежной слизистой оболочкой. В норме она имеет светло-розовый оттенок, ровные складочки, блестит, словно начищенный самовар. Под воздействием агрессивных факторов клетки стареют, хиреют, деление их замедляется, а процесс регенерации сходит на нет. Клетки отмирают. Наступает атрофия, вследствие которой вырабатывается все меньше желудочного сока, происходит нарушение кислотности, недостаточное переваривание пищи. Атрофичная слизистая желудка перерождается в слизистую кишечника, мутирует, разрастается.
Второй причиной считают аутоиммунные процессы. При втором сценарии заболевание развивается более стремительно. Конкретный механизм запуска этого процесса еще до конца не изучен. Ясно только, какие факторы могут повлиять на скорость патологического процесса. Отмечают: генетическую предрасположенность, соматические заболевания, недостаток витаминов, наличие вредных привычек, безрежимность питания, вирусные инфекции.
Атрофический гастрит чаще бывает очаговым. Название само говорит, что слизистая желудка повреждена только местами, а не вся поверхность атрофирована. Между воспаленными сегментами находятся здоровые участки слизистой, которые берут на себя секрецию соляной кислоты, тем самым компенсируя ее количество.
Признаки заболевания
Наблюдается тошнота, отрыжка, повышенное газообразование, распирание, боли в желудке, снижение аппетита или его отсутствие, неустойчивый стул, неприятный привкус, запах изо рта.
При очаговом атрофическом гастрите часто нет никаких симптомов.
При лечении атрофического очагового гастрита учитывается кислотность. В зависимости от этого назначаются препараты.
Назначается антисекреторные препараты: Омепразол, Нольпаза, антациды Алмагель, Фосфалюгедь, цитопротекторы Де-нол, Викалин, Ребамипид. При положительном тесте на H.pylori проводят антибактериальную терапию, схемы подбираются индивидуально. После прохождения курса антибактериальной терапии рекомендуется пропить курс пробиотиков.
Для устранения диспепсических расстройств назначаются прокинетики: Итоприд, Тримедат, Церукал.
При болях прописывают спазмолитики Но-шпа, Папаверин.
В редких случаях, если кислотность значительно пониженная, назначается заместительная терапия, препараты которой пациент принимает пожизненно. Это Ацидин-пепсин, Абоминпепсидил, а также заместительная терапия полиферментными препаратами Креон, Пангрол.
Возможно, ли прийти к полному выздоровлению?
Вопрос спорный. Мнения специалистов разделились на тех, кто считает, что своевременное, современное комплексное лечение может способствовать выздоровлению и полному восстановлению слизистой желудка.
Диета при хроническом атрофическом гастрите
Первое, с чего нужно начать, это наладить режимпитания. По возможности есть в одно то же время. Пища должна употребляться небольшими порциями, мелко порезана или вовсе гомогенизирована.
В рационе питания рекомендуются: нежирные сорта мяса, рыбы, подсушенный белый хлеб, яйца, нежирный творог, сыр, отварной рис, овощные бульоны, картофель, кабачки, свеклу, капусту, помидоры, сезонные фрукты, ягоды.
Что исключить из рациона
Пшено, перловка, ячневая крупа могут вызывать дискомфорт. Крепкий кофе, чай, квас, жирное молоко, сливки могут спровоцировать обострение заболевания.
Алкогольные напитки, курение – главные враги, их нужно запретить или на выздоровление не стоит надеяться. Наше здоровье – в наших руках!
Антральный атрофический гастрит
Патологические изменения слизистой оболочки желудка часто становятся следствием хронического гастрита. При таком состоянии ткани органа постепенно истончаются, что приводят к образованию очагов воспаления, проблемам с пищеварением. Отличие антрального атрофического гастрита в том, что он локализуется в определенной части желудка. При нем нарушается эвакуаторная функция в двенадцатиперстную кишку, что приводит к серьезным проблемам с перевариванием пищи. Кроме того, больные могут чувствовать постоянную тошноту, у них пропадает аппетит, после еды беспокоит сильная отрыжка.
Причины болезни
Атрофический гастрит в антральном отделе желудка вызывает бактерия Helicobacter pylori. Она не представляет опасности, пока иммунитет работает исправно. В норме эта бактерия встречается почти у 90 % населения планеты. Но как только начинают влиять внешние факторы, иммунитет угнетается, общее состояние здоровья ухудшается, бактерия начинает вести себя агрессивно в отношении слизистой оболочки желудка. К факторам, провоцирующим антральный атрофический гастрит, относятся:
Кроме того, негативно влияют на состояние ЖКТ патологии сосудов, ожоги тела, аутоиммунные нарушения. Доказано, что наличие в теле глистов также может спровоцировать активность Helicobacter pylori. Если бактерия может размножаться, ее жизнедеятельности ничто не препятствует, то впоследствии развиваются серьезные осложнения. При антральном атрофическом гастрите это могут быть злокачественные опухоли, а также язвы.
После заражение происходит следующее:
Какой врач лечит антральный атрофический гастрит?
При появлении симптомов заболевания, в частности, тошноты, рвоты, острой боли в области желудка, нужно записаться на прием к такому врачу как:
Хронический атрофический гастрит: что пишет патологоанатом, что должен понять и сделать клиницист
Владимир Трофимович Ивашкин, академик РАМН, доктор медицинских наук:
– Пришло время для выступления Алексея Владимировича Кононова из Омска.
Алексей Владимирович Кононов, профессор:
– Дорогие коллеги, мы сегодня поговорим с вами о взаимоотношениях специалистов в таком сложном деле, как канцерпревенция и курации пациентов с предраковыми состояниями и предраковыми изменениями. Центральной проблемой канцерпревенции стоит проблема атрофии слизистой оболочки, которая является феноменом, располагающимся между собственно воспалительными изменениями слизистой оболочки желудка и предраковыми изменениями, которые вот Сергей Владимирович Кашин блестяще демонстрировал и называл дисплазией эпителия. Мне больше нравится термин «неоплазия», который подчеркивает необратимость этих процессов даже в виде низкой степени градации неоплазии. Таким образом, и у патологоанатома, и у клинициста встает один вопрос – это идентификация, детекция атрофии слизистой оболочки желудка и интерпретация этого заключения.
Что делать, когда термин «атрофия», «атрофический гастрит» появляется в патологоанатомическом заключении? На сегодняшний день как будто бы проблем с этим нет. Существует основной классификационный вариант для оценки атрофии слизистой оболочки – это модифицированная сиднейская система, где в визуально-аналоговой шкале эти состояния ранжированы на уровни: нет атрофии, слабая, умеренная, выраженная, как в теле, так и в антральном отделе желудка. Но проблема состоит вот в чем. Проблема состоит в том, что для точной идентификации атрофии даже по модифицированной сиднейской системе необходим не один фрагмент слизистой оболочки, не два фрагмента, а 5 фрагментов, взятых по протоколу: по большой и малой кривизне тела желудка, в области угла желудка и по большой и малой кривизне в антральном отделе желудка. Больше того, когда в 2008 году мы получили новую классификацию хронического гастрита, где атрофия и воспаления оцениваются как интегральные понятия на уровне целого органа, то это взятие биоптата из 5 точек является просто необходимой процедурой, без которой система, которая получила название OLGIM, просто не работает.
Вот это визуально-аналоговая шкала, отечественный вариант ее. По уровню абсцисс и ординат пиктограммы изменения слизистой оболочки – слабая, выраженная, умеренная атрофия в теле, в антральном отделе, а на перекрестии стадия, выраженность на уровне целого органа атрофических изменений. Точно так же построена шкала для оценки воспалительных изменений, которые называются степенью гастрита, там тоже пиктограммы. Смотрите, вот это воспалительный инфильтрат, причем здесь интегрально и нейтрофильные лейкоциты, и мононуклеары, которые, по сути, собой представляют воспалительный ответ слизистой оболочки, и мукозальный иммунитет одновременно. Проблема состоит в том, что появилось новое понимание атрофии слизистой оболочки. Это не просто уменьшение объема желез в теле и антральном отделе, но и замена их метаплазированным эпителием. Это так называемая метапластическая атрофия, и вот ее место в каскаде Пелайо Корреа. Причем сам, кстати, Пелайо Корреа очень положительно относится к этому термину и идентификации кишечной метаплазии с оценкой вместе с атрофией слизистой оболочки. Проблема возникает в другом. Иногда воспалительный инфильтрат настолько раздвигает желудочные железы, что возникает феномен так называемой неопределенной атрофии.
Вот давайте полечим больного, воспалительный инфильтрат рассосется частично в результате апоптоза воспалительных клеток, частично в результате миграции по лимфатическим сосудам, межтканевым щелям и так далее, а потом мы посмотрим. Но если выраженная кишечная метаплазия, то она никуда не исчезнет. Эксперты Маастрихт-4 считают, что метаплазия не подвергается обратному развитию, поэтому вот понимание кишечной метаплазии приобрело некоторое такое мистическое направление. Вдобавок она еще разработана по типам – полная, неполная метаплазия, тонкокишечная, толстокишечная, тип IIA, IIВ и так далее. Все это приводит к тому, что появляются мысли: а не является ли собственно кишечная метаплазия прекурсором, предшественником рака желудка кишечного типа? Ну, по этому поводу написаны горы статей и сломаны многочисленные копья, на сегодняшний день все упирается в Кохрановский обзор от сентября прошлого года. Доказательных, совершенно выстроенных по критериям медицины, основанной на доказательствах, исследований в отношении того, что кишечная метаплазия предрак, нет, поэтому давайте прислушаемся к личному мнению Дэвида Грэхема, который высказывается, как всегда, четко, ясно и совершенно понятно: кишечная метаплазия на сегодняшний день – это надежный показатель атрофии слизистой оболочки. Есть кишечная метаплазия – значит, есть атрофия слизистой оболочки.
Кстати говоря, вот наши прибалтийские коллеги опубликовали в январском номере этого года «Вирховского архива» – уважаемый, авторитетнейший патологоанатомический журнал Европы – такую статью, где они сравнили кишечную метаплазию, взятую в качестве детекции атрофии, и систему OLGIM. Оказалось, что критерий согласия экспертов выше там, где в качестве маркера атрофии применяли кишечную метаплазию. Правда, деликатно замечают наши коллеги, есть стадии атрофического гастрита, когда только кишечной метаплазии для детекции собственно атрофии недостаточно. Что еще пишут про кишечную метаплазию и атрофию? Оказывается, мы можем очень тесно сотрудничать с врачами эндоскопической диагностики. Мы можем говорить об уровне выраженности атрофических изменений, определяя стадию, а врачи эндоскопической диагностики определяют площадь очагов кишечной метаплазии, как это блестяще показал сегодня Сергей Владимирович, и вот это сочетание дает более точный прогноз канцерогенеза у конкретного пациента. Неопластические изменения, собственно, опухолевые уже изменения, когда эпителиальная клетка встала на опухолевый путь. Началось все с падуанских вопросов почти 20 лет назад, все это закончилось хорошо известной вам, уважаемые коллеги, Венской классификацией неоплазии пищеварительного тракта, которая построена, наверное, как образец для всех последующих патологоанатомических и параклинических классификаций.
Вот здесь вот слева обозначены изменения, которые находит врач эндоскопической диагностики и патологоанатом в своем заключении, а справа написано, что должен делать клиницист с пациентом. Определены дефиниции, что такое неоплазия, что такое неоплазия низкой степени, что такое неоплазия высокой степени. Мы можем просто посмотреть, пока я говорю, следующие слайды. Пожалуйста, следующий, еще следующий слайд. Неопределенная неоплазия. Вот так же, как неопределенная атрофия, так и неопределенная неоплазия – то ли это изменения регенеративные, то ли это уже действительно опухолевый процесс. А вот здесь интересная работа, которая опубликована в прошлом году в американском журнале «Клинические патологии», которая нас призывает интегрировать два этих представления – атрофию слизистой оболочки и неопластические изменения. Вот когда мы сумеем интегрировать оба этих понятия в своих заключениях, мы сможем дать точный прогноз. Я хотел бы подчеркнуть, что опухолевые изменения клеток слизистой оболочки желудка возникают не в воздухе, они возникают на фоне и в сочетании с атрофическими изменениями слизистой оболочки вообще.
Какие возможны утешения? Только ли наблюдать? Только ли брать биопсии и ставить диагноз? Сегодня мы знаем новые молекулярные клеточные мишени, открывшиеся сравнительно недавно для хорошо известного препарата на основе ионов висмута. Ну, во-первых, антиоксидантное свойство висмута. Свободные радикалы нейтрофильных лейкоцитов, возникающие при кислородном взрыве в них, нарушают ДНК стволовых клеток слизистой оболочки желудка до уровня двунитевых разрывов. Эти двунитевые разрывы подвергаются репарации, но при этом возникают мутации, накопление которых может закончиться канцерогенезом. Таким образом, препараты висмута в условиях воспалительной инфильтрации слизистой оболочки защищают ДНК, предотвращают процесс маргинализации. Это вторичная профилактика. Опять же, ионный эффект висмута великолепно продемонстрирован в попытке создания нового препарата, где висмут будет в составе растворимого соединения, и ионная активность его будет повышаться.
2 года назад Нобелевскую премию получили молекулярные биологи за изучение серпантинных рецепторов и G-белков, которые являются регуляторными путями клетки. Оказывается, в них вмешивается висмут и запускает в стволовых клетках пролиферативный стимул, и проводя эрадикацию с помощью солей висмута мы попутно решаем и вторую задачу – мы мобилизируем и стимулируем местные стволовые клетки в слизистой оболочке желудка, и если не устраняем атрофию, то по крайней мере препятствуем ее обратному развитию. Что еще появилось нового в отношении ионов висмута как фармакопрепаратов? Появились следующие результаты. Это работа, которая известна пока еще только в препринте, январский номер, она еще не вышла. О чем говорит препринт? Культура ткани и ионы висмута. Оказывается, ионы висмута обладают меньшей степенью повреждения бактериальной клетки Helicobacter рylori, нежели висмут металлический, который нанесен в виде монослоя, атомарный висмут, на носители, которые взаимодействуют с бактериальной клеткой. Нанотехнологии и антибактериальный эффект препаратов висмута – это новое.
Давайте обсудим клинический пример. Пациенту 55 лет, с диспептическими жалобами, выполнена эндоскопическая биопсия слизистой оболочки желудка. Что получил патологоанатом и что он написал? «Два фрагмента слизистой оболочки – тело и антральный отдел». Я хочу обратить ваше внимание – два фрагмента. Дальше патологоанатом по классификационной схеме, модифицированной сиднейской системе описывает ситуацию. Все очень правильно, в каждом кусочке, и он определяет изменения в теле и антральном отделе желудка. Что должен делать клиницист, получив такое заключение? Ну, прежде всего, принять, что верифицирован Helicobacter-ассоциированный атрофический гастрит. Очень хорошо. Затем он должен отметить про себя, что идентифицировать стадию по системе OLGA и. соответственно, риск рака желудка невозможно. О чем еще должен подумать клиницист? Он должен подумать, что, конечно, риск рака желудка есть, особенно если это атрофия у пациента старше 50 лет, но риск не определен. Затем он должен выполнить наверняка эрадикационную терапию, а вот уже когда он будет выполнять контрольное эндоскопическое исследование через 4 недели после окончания эрадикационной терапии, то тут необходимо, просто необходимо взять 5 биоптатов из совершенно точно по протоколу указанных точек и определить стадию атрофии по системе OLGA. Вот так это все выглядит в идеале, а вот так это выглядит в только что рассматриваемом примере, причем это обычная практика.
Давайте посмотрим, как это выглядит вообще на популяционном уровне. Вот посмотрите, 20 тысяч гастробиоптатов от 9 тысяч пациентов, и только 4% исследований могут быть оценены с позиции определения риска рака желудка 3-й, 4-й стадии по классификации OLGA. Давайте посмотрим, что в Америке происходит. Роберт Максимилиан Гента, известный патологоанатом-гастроэнтеролог, эксперт ВОЗ по опухолям пищеварительного тракта, проделал точно такое же исследование, что проделали мы, только в 20 раз больше, там было 400 тысяч биоптатов. Но он получил тот же самый процент: только 4% пригодны для оценки риска рака желудка по современной классификации. Второй клинический пример. У пациента 45 лет при эндоскопическом исследовании верифицирован видимый участок изменений в виде площадки 0,5х0,7 см, из которого взят биоптат. Что пишет патологоанатом? Один биоптат. Патологоанатом пишет: «Морфологические признаки очаговой эпителиальной дисплазии/неоплазии, – ну, «дисплазия» и «неплазия», как мы с вами договорились, это термины-синонимы, – низкой степени (тубулярная аденома с неоплазией низкой степени)».
О чем должен думать клиницист? Не сговариваясь с Сергеем Владимировичем, мы обсудили эту ситуацию, поэтому я могу только прокомментировать. Ну, прежде всего, принять наличие у пациента предопухолевого состояния или даже предопухолевого заболевания. Затем необходимо отметить, что степень риска развития рака желудка определить невозможно. Во-первых, один фрагмент. Взятый рядышком фрагмент может показать дисплазию/неоплазию высокой степени, а еще третий может показать инвазивную карциному. Значит, весь объем образования должен быть представлен достаточно репрезентативно при повторных биопсиях, если нет возможности выполнить мукозальную резекцию так, как это написано в Европейских рекомендациях по предраковым состояниям. Ну, и, наконец, что делать врачу-гастроэнтерологу или терапевту в данной ситуации? Он должен, по крайней мере, заказать повторное исследование для того, чтобы взять биоптаты из визуально измененного участка, а также обязательно 5 биоптатов по системе OLGA для того, чтобы точно определить риск рака желудка у пациента.
Что же должен в ответ вот на эти замечания, которые сделал патологоанатом, выполнить клиницист? Как он должен интерпретировать эту ситуацию? Ну, прежде всего, констатировать успешную эрадикацию, но на этом отнюдь не успокоиться. Он должен отметить, что уровень атрофических изменений остался прежним – что, в общем, не удивительно – и это уровень, который говорит о риске рака желудка, в 5-6 раз большем, чем в популяции. Обратить особое внимание на инфильтрацию нейтрофильными лейкоцитами, то есть активность воспаления. Это скрытая угроза повреждения ДНК стволовых клеток, особенно атрофически измененной слизистой оболочки, опасность канцерогенных мутаций. А что же сделать с пациентом? А обратиться к рекомендациям Российской гастроэнтерологической ассоциации. И я хочу закончить теми же рекомендациями, которые уже цитировал глубокоуважаемый Сергей Владимирович. При хроническом гастрите, в том числе атрофическом, после окончания эрадикационной терапии возможно продолжение лечения препаратом висмута от 4 до 8 недель для обеспечения защиты слизистой оболочки желудка. Благодарю вас, уважаемые коллеги!