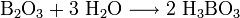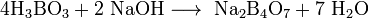Бор что это
Бор что это
Значение слова «бор»
[От нем. Bohr — бурав]
Источник (печатная версия): Словарь русского языка: В 4-х т. / РАН, Ин-т лингвистич. исследований; Под ред. А. П. Евгеньевой. — 4-е изд., стер. — М.: Рус. яз.; Полиграфресурсы, 1999; (электронная версия): Фундаментальная электронная библиотека
Бор (лес) — хвойный лес.
Бор (элемент) — химический элемент.
Бор (скандинавская мифология) — один из скандинавских богов-прародителей, отец Одина.
Бор (растение) (лат. Milium) — род растений семейства злаки.
Бор (волна) — аномально высокая приливная волна в устьях рек (см. Солитон).
Бор, или Префиксное дерево — структура данных.
Бор (футбольный клуб) — сербский футбольный клуб из города Бор.
Бор (платформа) — железнодорожная платформа на Приморском направлении Октябрьской железной дороги.
Бор (судно) — одномачтовое судно.
Бор — кратер на видимой стороне Луны.
Источник: «Толковый словарь русского языка» под редакцией Д. Н. Ушакова (1935-1940); (электронная версия): Фундаментальная электронная библиотека
бор I
1. лес с преобладанием одного вида хвойных деревьев (чаще всего сосны) ◆ Сосновый, пронизанный солнцем бор вызывал тихое умиление в душе уставшего фельдшера, до того воевавшего на знойном степном пыльном юге. Василь Быков, «Болото», 2001 г. (цитата из НКРЯ)
Фразеологизмы и устойчивые сочетания
бор II
1. хим. химический элемент с атомным номером 5, обозначается химическим символом B, неметалл ◆ Зола — калийно-фосфорно-известковое удобрение — включает большое количество микроэлементов (бор, марганец, железо, серу, цинк, кобальт, молибден, медь) Анатолий Савченко, «Как хороши, как свежи эти розы…» // «Homes & Gardens» (цитата из НКРЯ)
2. хим. простое вещество, неметалл, очень твёрдые тёмно-серые кристаллы ◆ Если самая уязвимая деталь замка — дужка изготовлена из сверхпрочного сплава стали и бора, значит, перед вами действительно стоящая вещь. «Мужское хозяйство: Посторонним вход воспрещён» // «Автопилот» (цитата из НКРЯ)
Фразеологизмы и устойчивые сочетания
бор III
1. приспособление для бурения, сверления
бор IV
1. ботан. род растений семейства злаков ()
Фразеологизмы и устойчивые сочетания
бор V
1. геогр. большая приливная волна, возникающая в устьях некоторых рек и узких заливов и движущаяся с высокой скоростью против течения реки в виде водяного вала с опрокидывающимся гребнем
1. город в России (Нижегородская область)
Делаем Карту слов лучше вместе

Спасибо! Я обязательно научусь отличать широко распространённые слова от узкоспециальных.
Насколько понятно значение слова профилировать (глагол), профилирует:
Бор (элемент)
2,04 (шкала Полинга)
Содержание
История и происхождение названия
Впервые получен в 1808 году французскими физиками Ж. Гей-Люссаком и Л. Тенаром нагреванием борного ангидрида B2O3 с металлическим калием. Через несколько месяцев бор получил Х. Дэви электролизом расплавленного B2O3.
Нахождение в природе
Среднее содержание бора в земной коре 4 г/т. Несмотря на это, известно около 100 собственных минералов бора; в «чужих» минералах он почти не встречается. Это объясняется прежде всего тем, что у комплексных анионов бора (а именно в таком виде он входит в большинство минералов) нет достаточно распространенных аналогов. Почти во всех минералах бор связан с кислородом, а группа фторсодержащих соединений совсем малочисленна. Элементарный бор в природе не встречается. Он входит во многие соединения и широко распространён, особенно в небольших концентрациях; в виде боросиликатов и боратов, а также в виде изоморфной примеси в минералах входит в состав многих изверженных и осадочных пород. Бор известен в нефтяных и морских водах (в морской воде 4,6 мг/л [4] ), в водах соляных озёр, горячих источников и грязевых вулканов.
Основные минеральные формы бора:
Также различают несколько типов месторождений бора:
Получение
Наиболее чистый бор получают пиролизом бороводородов. Такой бор используется для производства полупроводниковых материалов и тонких химических синтезов.
1. Метод металлотермии (чаще восстановление магнием или натрием):
2. Термическое разложение паров бромида бора на раскаленной (1000—1200 °C) вольфрамовой проволоке в присутствии водорода (метод Ван-Аркеля):
Физические свойства
Чрезвычайно твёрдое вещество (уступает только алмазу, нитриду углерода, нитриду бора (боразону), карбиду бора, сплаву бор-углерод-кремний, карбиду скандия-титана). Обладает хрупкостью и полупроводниковыми свойствами (широкозонный полупроводник).
10 В имеет очень высокое сечение поглощения тепловых нейтронов, поэтому 10 В в составе борной кислоты применяется в атомных реакторах для регулирования реактивности.
Химические свойства
По многим физическим и химическим свойствам неметалл бор напоминает кремний.
Химически бор довольно инертен и при комнатной температуре взаимодействует только со фтором:

При нагревании бор реагирует с другими галогенами с образованием тригалогенидов, с азотом образует нитрид бора BN, с фосфором — фосфид BP, с углеродом — карбиды различного состава (B4C, B12C3, B13C2). При нагревании в атмосфере кислорода или на воздухе бор сгорает с большим выделением теплоты, образуется оксид B2O3:
С водородом бор напрямую не взаимодействует, хотя известно довольно большое число бороводородов (боранов) различного состава, получаемых при обработке боридов щелочных или щелочноземельных металлов кислотой:
При сильном нагревании бор проявляет восстановительные свойства. Он способен, например, восстановить кремний или фосфор из их оксидов:
Данное свойство бора можно объяснить очень высокой прочностью химических связей в оксиде бора B2O3.
При отсутствии окислителей бор устойчив к действию растворов щелочей. В горячей азотной, серной кислотах и в царской водке бор растворяется с образованием борной кислоты 
Оксид бора 
При взаимодействии борной кислоты со щелочами возникают соли не самой борной кислоты — бораты (содержащие анион BO3 3− ), а тетрабораты, например:
Применение
Элементарный бор
Бор (в виде волокон) служит упрочняющим веществом многих композиционных материалов.
Также бор часто используют в электронике для изменения типа проводимости кремния.
Бор применяется в металлургии в качестве микролегирующего элемента, значительно повышающего прокаливаемость сталей.
Соединения бора
Карбид бора применяется в компактном виде для изготовления газодинамических подшипников.
Пербораты / пероксобораты (содержат ион [B2(O2)2(OH)4]2 − ) Технический продукт содержит до 10,4 % «активного кислорода», на их основе производят отбеливатели, «не содержащие хлор» («персиль», «персоль» и др.).
Отдельно также стоит указать на то что сплавы бор-углерод-кремний обладают сверхвысокой твёрдостью и способны заменить любой шлифовальный материал (кроме алмаза, нитрида бора по микротвёрдости), а по стоимости и эффективности шлифования (экономической) превосходят все известные человечеству абразивные материалы.
Борная кислота (H3BO3) широко применяется в атомной энергетике в качестве поглотителя нейтронов в ядерных реакторах типа ВВЭР (PWR) на «тепловых» («медленных») нейтронах. Благодаря своим нейтронно-физическим характеристикам и возможности растворяться в воде, применение борной кислоты делает возможным плавное (не ступенчатое) регулирование мощности ядерного реактора путем изменения её концентрации в теплоносителе — так называемое «борное регулирование».
Нитрид бора активированный углеродом является люминофором с свечением в УФ от синего до жёлтого цвета и обладает самостоятельной фосфоресценцией в темноте и активируется органическими веществами при нагреве до 1000 °C. Изготовление люминофоров из нитрида бора, состава BN/C не имеет промышленного назначения, но являлся широкой любительской практикой в первой половине XX века.
Бороводороды и борорганические соединения
Ряд производных бора (бороводороды) являются чрезвычайно эффективными ракетными топливами (диборан B2H6, пентаборан, тетраборан и др.), а некоторые полимерные соединения с водородом и углеродом являются чрезвычайно стойкими к химическим воздействиям и высоким температурам (как широко известный пластик Карборан-22).
Боразон и его гексагидрид
Нитрид бора (боразон) подобен (по составу электронов) углероду. На его основе образуется обширная группа соединений, чем-то подобные органическим.
Биологическая роль
Бор — важный микроэлемент, необходимый для нормальной жизнедеятельности растений. Недостаток бора останавливает их развитие, вызывает у культурных растений различные болезни. В основе этого лежат нарушения окислительных и энергетических процессов в тканях, снижение биосинтеза необходимых веществ. При дефиците бора в почве в сельском хозяйстве применяют борные микроудобрения (борная кислота, бура и другие), повышающие урожай, улучшающие качество продукции и предотвращающие ряд заболеваний растений.
Стоимость
Бор что это
Полезное
Смотреть что такое «Бор» в других словарях:
Бор — Бор: В Викисловаре есть статья «бор» Бор (лес) хвойный лес. Бор (элемент) химический элемент … Википедия
Бор-11 — Бор(B) Атомный номер 5 Внешний вид простого вещества Твёрдый, хрупкий, блестяще чёрный. полуметалл Свойства атома Атомная масса (молярная масса) 10.811 а. е. м. (г/моль) Радиус атома … Википедия
БОР — (Bohr) Нильс Хенрик Давид (7.10.1885, Копенгаген, 18.11.1962, там же), датский физиктеоретик, один из создателей квантовой теории. В 1920 возглавил созданный по его инициативе Ин т теоретич. физики в Копенгагене. В 1943 45 в эмиграции в… … Философская энциклопедия
БОР — муж., хим. горючее вещество, добываемое из буры и служащее основанием борной кислоте. II. БОР муж. (брать) браньё, взятие, отпуск и прием; бору нет, говорят купцы, разбору, спросу на товар. | костр., ·торг. базар, рынок, торжок; новинный бор,… … Толковый словарь Даля
БОР — муж., хим. горючее вещество, добываемое из буры и служащее основанием борной кислоте. II. БОР муж. (брать) браньё, взятие, отпуск и прием; бору нет, говорят купцы, разбору, спросу на товар. | костр., ·торг. базар, рынок, торжок; новинный бор,… … Толковый словарь Даля
Бор — 1. БОР, а, предлож. о боре, в бору; мн. боры, ов; м. Сосновый лес, растущий на сухом возвышенном месте. Дремучий, вековой бор. Собирать в бору бруснику. Бор шумит. ◊ С бору (да) с сосенки. Кто попало, без разбору (о случайном подборе, составе… … Энциклопедический словарь
бор — 1. БОР, а, предлож. о боре, в бору; мн. боры, ов; м. Сосновый лес, растущий на сухом возвышенном месте. Дремучий, вековой бор. Собирать в бору бруснику. Бор шумит. ◊ С бору (да) с сосенки. Кто попало, без разбору (о случайном подборе, составе… … Энциклопедический словарь
Бор — (borum, стар. назв. boracium и boron, последнее принято еще итеперь у англичан; хим. форм. В; атомный вес 11) не металлическийэлемент, в свободном состоянии известный в двух аллотропическихвидоизменениях: аморфном и кристаллическом. В аморфном… … Энциклопедия Брокгауза и Ефрона
БОР-5 — БОР 5 … Википедия
БОР — • БОР (Bohr) Oгe Нильс (р. 1922), датский физик. Получил образование в Копенгагенском и Лондонском университетах. С 1956 г. преподавал физику в Копенгагенском университете. Был также директором Института теоретический физики (1963 70),… … Научно-технический энциклопедический словарь
Бор что это
Бор— элемент главной подгруппы третьей группы, второго периода периодической системы химических элементов Д.И.Менделеева, с атомным номером 5. Обозначается символом B ( Borium ). В свободном состоянии бор— бесцветное, серое или красное кристаллическое либо тёмное аморфное вещество. Известно более 10 аллотропных модификаций бора, образование и взаимные переходы которых определяются температурой, при которой бор был получен.
История и происхождение названия химического элемента Бор
Впервые получен в 1808 году французскими физиками Ж. Гей-Люссаком и Л. Тенаром нагреванием борного ангидрида B2O3 с металлическим калием. Через несколько месяцев бор получил Х. Дэви электролизом расплавленного B2O3.
Получение
Наиболее чистый бор получают пиролизом бороводородов. Такой бор используется для производства полупроводниковых материалов и тонких химических синтезов.
1. Метод металлотермии (чаще восстановление магнием или натрием):
2. Термическое разложение паров бромида бора на раскаленной (1000—1200°C) танталовой проволоке в присутствии водорода:
Физические свойства
Чрезвычайно твёрдое вещество (уступает только алмазу, нитриду углерода, нитриду бора (боразону), карбиду бора, сплаву бор-углерод-кремний, карбиду скандия-титана). Обладает хрупкостью и полупроводниковыми свойствами (широкозонный полупроводник).
Химические свойства
По многим физическим и химическим свойствам неметалл бор напоминает кремний.
Химический бор довольно инертен и при комнатной температуре взаимодействует только со фтором:

При нагревании бор реагирует с другими галогенами с образованием тригалогенидов, с азотом образует нитрид бора BN, с фосфором— фосфид BP, с углеродом— карбиды различного состава (B4C, B12C3, B13C2). При нагревании в атмосфере кислорода или на воздухе бор сгорает с большим выделением теплоты, образуется оксид B2O3:
С водородом бор напрямую не взаимодействует, хотя известно довольно большое число бороводородов (боранов) различного состава, получаемых при обработке боридов щелочных или щелочноземельных металлов с кислотой:
При сильном нагревании бор проявляет восстановительные свойства. Он способен, например, восстановить кремний или фосфор из их оксидов:
Данное свойство бора можно объяснить очень высокой прочностью химических связей в оксиде бора B2O3.
При отсутствии окислителей бор устойчив к действию растворов щелочей. В горячей азотной, серной кислотах и в царской водке бор растворяется с образованием борной кислоты 
Оксид бора 
При взаимодействии борной кислоты со щелочами возникают соли не самой борной кислоты— бораты (содержащие анион BO3 3- ), а тетрабораты, например:
Применение
Элементарный бор
Бор (в виде волокон) служит упрочняющим веществом многих композиционных материалов.
Также бор часто используют в электронике для изменения типа проводимости кремния.
Бор применяется в металлургии в качестве микролегирующего элемента, значительно повышающего прокаливаемость сталей.
Соединения бора
Карбид бора применяется в компактном виде для изготовления газодинамических подшипников.
Отдельно также стоит указать на то что сплавы бор-углерод-кремний обладают сверхвысокой твёрдостью и способны заменить любой шлифовальный материал (кроме нитрида углерода, алмаза, нитрида бора по микротвёрдости), а по стоимости и эффективности шлифования (экономической) превосходят все известные человечеству абразивные материалы.
Сплав бора с магнием (диборид магния MgB2) обладает, на данный момент, рекордно высокой критической температурой перехода в сверхпроводящее состояние среди сверхпроводников первого рода. Появление вышеуказанной статьи стимулировало большой рост работ по этой тематике.
Борная кислота (H3BO3) широко применяется в атомной энергетике в качестве поглотителя нейтронов в ядерных реакторах типа ВВЭР (PWR) на «тепловых» («медленных») нейтронах. Благодаря своим нейтронно-физическим характеристикам и возможности растворяться в воде, применение борной кислоты делает возможным плавное (не ступенчатое) регулирование мощности ядерного реактора путем изменения ее концентрации в теплоносителе— так называемое «борное регулирование».
Бороводороды и борорганические соединения
Ряд органических производных бора (бороводороды) являются чрезвычайно эффективными ракетными топливами (диборан(B2H4), пентаборан, тетраборан и др.), а некоторые полимерные соединения с водородом и углеродом являются чрезвычайно стойкими к химическим воздействиям и высоким температурам, например широко известный пластик Карборан-22.
Биологическая роль
Бор — важный микроэлемент, необходимый для нормальной жизнедеятельности растений. Недостаток бора останавливает их развитие, вызывает у культурных растений различные болезни. В основе этого лежат нарушения окислительных и энергетических процессов в тканях, снижение биосинтеза необходимых веществ. При дефиците бора в почве в сельском хозяйстве применяют борные микроудобрения (борная кислота, бура и другие), повышающие урожай, улучшающие качество продукции и предотвращающие ряд заболеваний растений.
Один из редких типов дистрофии роговицы связан с геном, кодирующим белок-транспортер, предположительно регулирующий внутриклеточную концентрацию бора.
Бор, Borum, В (5)
Природные соединения бора (Boron, франц. Воге, нем. Bor), главным образом нечистая бура, известны с раннего средневековья. Под названиями тинкал, тинкар или аттинкар (Tinkal, Tinkar, Attinkar) бура ввозилась в Европу из Тибета; она употреблялась для пайки металлов, особенно золота и серебра. В Европе тинкал назывался чаще боракс (Воrax) от арабского слова bauraq и персидского — burah. Иногда боракс, или борако, обозначал различные вещества, например соду (нитрон). Руланд (1612) называет боракс хризоколлой — смолой, способной «склеивать» золото и серебро. Лемери (1698) тоже называет боракс «клеем золота» (Auricolla, Chrisocolla, Gluten auri). Иногда боракс обозначал нечто вроде «узды золота» (capistrum auri). В Александрийской эллинистической и византийской химической литературе борахи и борахон, а также в арабской (bauraq) обозначали вообще щелочь, например bauraq arman (армянский борак), или соду, позже так стали называть буру.
В 1702 г. Гомберг, прокаливая буру с железным купоросом, получил «соль» (борную кислоту), которую стали называть «успокоительной солью Гомберга» (Sal sedativum Hombergii); эта соль нашла широкое применение в медицине. В 1747 г. Барон синтезировал буру из «успокоительной соли» и натрона (соды). Однако состав буры и «соли» оставался неизвестным до начала XIX в. В «Химической номенклатуре» 1787 г. фигурирует название horacique асid (борная кислота). Лавуазье в «Таблице простых тел» приводит (radical boracique). В 1808 г. Гей-Люссаку и Тенару удалось выделить свободный бор из борного ангидрида, нагревая последний с металлическим калием в медной трубке; они предложили назвать элемент бора (Вога) или бор (Воге). Дэви, повторивший опыты Гей-Люссака и Тенара, тоже получил свободный бор и назвал его бораций (Boracium). В дальнейшем у англичан это название было сокращено до Boron. В русской литературе слово бура встречается в рецептурных сборниках XVII — XVIII вв. В начале XIX в. русские химики называли бор буротвором (Захаров, 1810), буроном (Страхов,1825), основанием буровой кислоты, бурацином (Севергин, 1815), борием (Двагубский, 1824). Переводчик книги Гизе называл бор бурием (1813). Кроме того, встречаются названия бурит, борон, буронит и др.
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
| IA | IIA | IIIB | IVB | VB | VIB | VIIB | —- | VIIIB | —- | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |
| Период | ||||||||||||||||||
| 1 | 1 H Водород | 2 He Гелий | ||||||||||||||||
| 2 | 3 Li Литий | 4 Be Бериллий | 5 B Бор | 6 C Углерод | 7 N Азот | 8 O Кислород | 9 F Фтор | 10 Ne Неон | ||||||||||
| 3 | 11 Na Натрий | 12 Mg Магний | 13 Al Алюминий | 14 Si Кремний | 15 P Фосфор | 16 S Сера | 17 Cl Хлор | 18 Ar Аргон | ||||||||||
| 4 | 19 K Калий | 20 Ca Кальций | 21 Sc Скандий | 22 Ti Титан | 23 V Ванадий | 24 Cr Хром | 25 Mn Марганец | 26 Fe Железо | 27 Co Кобальт | 28 Ni Никель | 29 Cu Медь | 30 Zn Цинк | 31 Ga Галлий | 32 Ge Германий | 33 As Мышьяк | 34 Se Селен | 35 Br Бром | 36 Kr Криптон |
| 5 | 37 Rb Рубидий | 38 Sr Стронций | 39 Y Иттрий | 40 Zr Цирконий | 41 Nb Ниобий | 42 Mo Молибден | (43) Tc Технеций | 44 Ru Рутений | 45 Rh Родий | 46 Pd Палладий | 47 Ag Серебро | 48 Cd Кадмий | 49 In Индий | 50 Sn Олово | 51 Sb Сурьма | 52 Te Теллур | 53 I Иод | 54 Xe Ксенон |
| 6 | 55 Cs Цезий | 56 Ba Барий | * | 72 Hf Гафний | 73 Ta Тантал | 74 W Вольфрам | 75 Re Рений | 76 Os Осмий | 77 Ir Иридий | 78 Pt Платина | 79 Au Золото | 80 Hg Ртуть | 81 Tl Таллий | 82 Pb Свинец | 83 Bi Висмут | (84) Po Полоний | (85) At Астат | 86 Rn Радон |
| 7 | 87 Fr Франций | 88 Ra Радий | ** | (104) Rf Резерфордий | (105) Db Дубний | (106) Sg Сиборгий | (107) Bh Борий | (108) Hs Хассий | (109) Mt Мейтнерий | (110) Ds Дармштадтий | (111) Rg Рентгений | (112) Cp Коперниций | (113) Uut Унунтрий | (114) Uuq Унунквадий | (115) Uup Унунпентий | (116) Uuh Унунгексий | (117) Uus Унунсептий | (118) Uuo Унуноктий |
| 8 | (119) Uue Унуненний | (120) Ubn Унбинилий | ||||||||||||||||
| Лантаноиды * | 57 La Лантан | 58 Ce Церий | 59 Pr Празеодим | 60 Nd Неодим | (61) Pm Прометий | 62 Sm Самарий | 63 Eu Европий | 64 Gd Гадолиний | 65 Tb Тербий | 66 Dy Диспрозий | 67 Ho Гольмй | 68 Er Эрбий | 69 Tm Тулий | 70 Yb Иттербий | 71 Lu Лютеций | |||
| Актиноиды ** | 89 Ac Актиний | 90 Th Торий | 91 Pa Протактиний | 92 U Уран | (93) Np Нептуний | (94) Pu Плутоний | (95) Am Америций | (96) Cm Кюрий | (97) Bk Берклий | (98) Cf Калифорний | (99) Es Эйнштейний | (100) Fm Фермий | (101) Md Менделевий | (102) No Нобелей | (103) Lr Лоуренсий | |||
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |
198095, г.Санкт-Петербург, ул.Швецова, д.23, лит.Б, пом.7-Н, схема проезда
Бор — интересный, полезный и перспективный химический элемент
Бор — простой элемент химической таблицы Менделеева. Открыт был около 200 лет 
Свойства бора
Если просмотреть несколько вполне авторитетных справочников, то можно с удивлением обнаружить значительные различия в числовых показателях. Так, внешний вид кристаллов бора описывается как серый, бесцветный и темно-бурый порошок. Вещество — кристаллическое или аморфное. Температура плавления колеблется от 2075 до 2300 °С, температура кипения — от 2550 до 3860 °С.
Дело в том, что у бора есть два стабильных изотопа и 10 аллотропных состояний. Кроме того, чистый бор получить крайне сложно, ввиду его сродства с другими элементами (кислородом, алюминием, углеродом). Даже сотые доли процента примеси влияют на физические свойства вещества. Например, элементарный бор бесцветен, а «кристаллический бор», полученный и описанный в 1808-м году Гей-Люссаком, на самом деле являлся боридом алюминия.
Свойства бора зависят от процентного соотношения изотопов. Известно, что бор мигрирует в природе; в процессе миграции соотношение изотопов может меняться, но что вызывает это перераспределение изотопов, точно не известно до сих пор.
Кристаллический бор — очень твердое, но хрупкое вещество. По физическим и химическим свойствам сходен с кремнием. Кристаллическая структура бора в некоторой степени аналогична упорядоченной структуре кристаллов алмаза, но она сложнее, в ней присутствует еще и самая сильная химическая связь — ковалентная. Благодаря этому, соединения бора отличаются уникальной твердостью, устойчивостью к высоким температурам, к химическим воздействиям кислот и щелочей. Например, диборид гафния плавится при температуре +3250 °С, диборид тантала не вступает в реакцию даже при нагревании с «царской водкой» (смесью концентрированной соляной кислоты и азотной кислоты), а боразон (кристаллический нитрид бора) царапает алмаз.
Альтернативная органика
Бороводороды похожи на углеводороды. В перспективе, на основе бороводородов ученые надеются получать более энергоэффективное топливо для авиации, химически и термически стойкие полимеры.
Применение

— Борирование (насыщение бором поверхностных слоев) сталей. Добавка сплава бора и железа делает сталь прочнее, устойчивее к температурным и химическим воздействиям, повышает ее антикоррозионные свойства.
— Почти половина всего используемого бора идет на производство боросиликатных стекол, обладающих повышенной термической и химической устойчивостью, жаропрочных стекол для народного хозяйства и стекол для лабораторной посуды.
— Около трети производимых соединений бора расходуется на производство моющих средств и отбеливателей «без хлора».
— Соединения бора входят в состав эмалей, глазурей, металлургического флюса, композитных материалов; микроудобрений для повышения урожайности культурных растений; гербицидов и инсектицидов; средств пожаротушения, косметических средств; катализаторов в органическом синтезе.
— Карбид бора и боразон уступают по твердости лишь алмазу, при этом, они намного 
— Из карбида бора изготавливают некоторые виды подшипников.
— Бор очень востребован в атомной энергетике. Его сплавы и раствор борной кислоты используются для «борного» регулирования течения ядерной реакции, так как бор обладает способностью поглощать нейтроны, вызывающие цепную реакцию и, таким образом, замедляет или даже вовсе прекращает реакцию деления в атомном реакторе. Из соединений бора и из чистого бора делают регулирующие стержни, а изменяя концентрацию борной кислоты в растворе, можно плавно влиять на скорость реакции в реакторе. Бор также применяется для защиты от нейтронного излучения.
— Фторид бора используется в счетчиках нейтронов.
— Бура и борная кислота применяются в медицине в качестве антисептика, лекарства от эпилепсии. Бор используют в радиотерапии злокачественных опухолей. Соединения бора входят в состав препаратов против болезней суставов.
— Соединения бора с водородом, а также с водородом и углеродом применяются в ракетном топливе, в производстве стойких к агрессивным веществам и высоким температурам пластиков.
— Аморфную форму нитрида бора иногда называют белым графитом и используют аналогично — в качестве высокотемпературной смазки. Как из графита получают алмаз, также при высоких давлениях получают боразон — исключительно твердый, огнестойкий и химически стойкий материал.
В магазине Prime Chemicals Group по хорошим ценам продаются различные реактивы в розницу и оптом, в том числе борная кислота, а также лабораторная посуда, средства защиты, лабораторное оборудование и приборы. Есть доставка по Москве и Московской области, перед оформлением заказа можно получить консультацию квалифицированных менеджеров.
Бор что это
Для получения аморфного бора (по Вёлеру и Девиллю) в раскаленный чугунный тигель всыпают смесь 100 ч. борного ангидрида с 60 ч. металлического натрия и покрывают все слоем прокаленной поваренной соли (от 40 до 50 ч.); наступает бурная реакция, причем часть борного ангидрида отдает свой кислород натрию; бор выделяется в свободном состоянии, и вместе с тем образуется бура; сплав перемешивают железным прутом, выливают в воду, подкисленную соляной кислотой, и собирают остающийся нерастворенным бор на фильтре; в виде аморфного порошка он легко проходит через поры бумаги, висит в воде и сообщает ей бурую окраску, так что его считают в воде растворимым; сушить порошок следует на пористых фарфоровых пластинках при обыкновенной температуре, так как при более сильном подогревании бор легко загорается. Берцелиус приготовлял его, нагревая борофтористый калий KBF 4 с металлическим калием. Магний, а также уголь и фосфор восстановляют бор из его окиси. Аморфный бор легко реагирует со многими веществами: загораясь при накаливании на воздухе, он соединяется не только с кислородом, но и с азотом; кислоты, особенно при нагревании, окисляют его в борную кислоту; щелочи действуют подобным же образом, с выделением водорода; при высокой температуре металлы, сера, хлор, бром прямо соединяются с бором.
Для получения кристаллического видоизменения плотно набивают небольшой тигель аморфным бором, просверливают в массе небольшое отверстие, достаточное для того, чтобы вставить палочку металлического алюминия, и помещают плотно закрытый тигель в другой, больших размеров, а промежуточное пространство засыпают углем; наружный тигель закрывают крышкой, замазывают и накаливают 1 ½ —2 часа при температуре около 1500°. По охлаждении растворяют алюминий в едком натре и обрабатывают остаток соляной кислотой. Полученный таким образом бор представляет просвечивающие красновато-желтые квадратные кристаллы уд. веса 2,68, по свойствам напоминающие алмаз; они обладают большой способностью лучепреломления и твердостью: чертят, подобно алмазу, корунд и сапфир. Известно несколько разновидностей кристаллического бора, получающихся различными способами, но все они не представляют химически чистого вещества, а содержат углерод и алюминий, другие же только углерод. По исследованиям Гампе, здесь имеются определенные химические соединения состава В 48 Al 3 C 2 и B 12 Al. Кристаллический бор несравненно более постоянен относительно химических деятелей, чем аморфный: он весьма трудно окисляется при накаливании в чистом кислороде; точно так же он хорошо сопротивляется действию кислот, за исключением царской водки. Весьма интересны определения теплоемкости кристаллического бора (Вебер): оказывается, что она быстро возрастает с повышением температуры подобно тому, как это наблюдается и для угля. Такого рода факт весьма важен для убеждения в общности закона Дюлонга и Пти (см. Теплоемкость), так как определения, сделанные при низких сравнительно температурах, дают для атомной теплоемкости числа, которые значительно менее требуемых законом; напр., при —40° теплоемкость равна 0,1915, а при +233° она уже доходит до 0,3663.
В своих соединениях бор функционирует как трехатомный элемент, на что указывает и место его в периодической системе (см. это сл.): он помещается в третьей группе вместе с алюминием и в одном ряду с углеродом (В = 11; С = 12). Непосредственным соседством с этим последним элементом объясняется до известной степени существование аллотропических видоизменений бора. Таким образом, общая формула борных соединений будет BX 3 (где Х = Cl, Br, ОН и т. п.). Из них, как уже упомянуто, наиболее важными и, между прочим, единственными источниками для получения всех других соединений являются борная кислота и ее соли.
Na 2 B 4 O 7 + 2HCl + 5H 2 O = 4B(OH) 3 + 2NaCl.
Борная кислота кристаллизуется из воды в перламутровых просвечивающих листочках, жирных на ощупь, уд. веса 1,434 (при 15° Ц.); 1 ч. кислоты растворяется в 25,6 ч. воды при 15° и в 2,9 ч. кипящей воды; вещество растворимо также в летучих эфирных маслах и в алкоголе, с парами которого летит при нагревании, образуя сложные эфиры; алкогольный раствор свободной кислоты (или солей ее в присутствии серной кислоты) горит зеленым пламенем, что служит для открытия борных соединений (при этом опыте следует избегать медных солей и солей хлористоводородной кислоты, также окрашивающих пламя спирта в зеленый цвет). Кислотные свойства борной кислоты весьма слабы: водный раствор ее окрашивает синюю лакмусовую бумажку в слабо красный цвет, а куркумовую в бурый, подобно щелочам; на слабый кислотный характер вещества указывает также способность его соединяться в довольно прочные сочетания с кислотами серной (Шульц-Селлак) и фосфорной (Г. Г. Густавсон, А. Фогель). Но если борная кислота в водяных растворах малоэнергична и вытесняется из солей другими кислотами, даже угольной, то в безводном состоянии, в виде ангидрида, она является энергическим кислотным окислом, вытесняющим ангидриды многих сильных кислот, что зависит от сравнительно малой летучести борного ангидрида. В технике борная кислота имеет немало применений: громадные количества ее идут на приготовление буры; в Швеции ее употребляют под именем асептина для консервирования мяса, молока, пива и т. п.; далее, борной кислотой пропитывают светильни стеариновых свеч (для того, чтобы сделать золу светильни легкоплавкой); она же идет для приготовления гюинетовой зелени (см. это сл.) и входит в состав различных эмалей и глазурей; борнокислая закись марганца употребляется при изготовлении скоро высыхающих масляных красок и т. п.
2H 3 ВО+ = В 2 О 3 + 3H 2 O.
4Н 3 ВО 3 — 5Н 2 О = Н 2 В 4 О 7
Водородистый бор. При сплавлении борной кислоты с избытком порошкообразного магния или аморфного бора с 3 ч. магния получается соединение, которое при действии соляной кислоты дает бесцветную газообразную смесь водорода с водородистым бором; она обладает неприятным запахом, горит ярким зеленым пламенем и дает при этом, как продукты горения, борную кислоту и воду. Если ввести в пламя холодный фарфоровый предмет, то на нем осаждается аморфный бор. В чистом виде вещество не получено; анализ его дает числа, указывающие на формулу ВН 3 (Jones и Taylor «Chem. Soc.» 1881, 293)
Азотистый бор BN образуется, как уже указано, прямым соединением азота с бором при накаливании; получен Бальменом в 1842 г. при нагревании борного ангидрида с цианистым калием. По Вёлеру, вещество готовят, накаливая в платиновом тигле тесную смесь 1 ч. сплавленной буры с 2 ч. нашатыря; образующуюся пористую массу обрабатывают водой и соляной кислотой. Азотистый бор представляет белый аморфный, мягкий на ощупь, легкий порошок, не плавящийся в сильном жару, отличающийся замечательным постоянством по отношению к химическим деятелям; азотная и соляная кислоты, щелочные растворы, водород и хлор при накаливании на него не действуют; при сплавлении с едким кали и при накаливании с парами воды вещество дает аммиак.
Фтористый бор BF 3 получен Гей-Люссаком и Тенаром при накаливании фтористого кальция с борным ангидридом; удобнее готовить его нагреванием упомянутых веществ с крепкой серной кислотой:
3СаF 2 + 4В 2 О 3 + 3H 2 SO 4 = 8CaSO 4 + 2BF 3 + 3Н 2 O.
Бор что это
(молярная масса)
(первый электрон)
Бор (B, лат. borum ) — химический элемент 13-й группы, второго периода периодической системы (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе III группы, или к группе IIIA) с атомным номером 5. Бесцветное, серое или красное кристаллическое либо тёмное аморфное вещество. Известно более 10 аллотропных модификаций бора, образование и взаимные переходы которых определяются температурой, при которой бор был получен.
Содержание
История и происхождение названия
Впервые получен в 1808 году французскими химиками Ж. Гей-Люссаком и Л. Тенаром нагреванием борного ангидрида B2O3 с металлическим калием. Через несколько месяцев бор получил Хэмфри Дэви электролизом расплавленного B2O3.
Название элемента произошло от арабского слова бурак (араб. بورق ) или персидского бурах (перс. بوره ), которые использовались для обозначения буры.
Нахождение в природе
Среднее содержание бора в земной коре составляет 4 г/т. Несмотря на это, известно около 100 собственных минералов бора; в «чужих» минералах он почти не встречается. Это объясняется, прежде всего, тем, что у комплексных анионов бора (а именно в таком виде он входит в большинство минералов) нет достаточно распространённых аналогов. Почти во всех минералах бор связан с кислородом, а группа фторсодержащих соединений совсем малочисленна. Элементарный бор в природе не встречается. Он входит во многие соединения и широко распространён, особенно в небольших концентрациях; в виде боросиликатов и боратов, а также в виде изоморфной примеси в минералах входит в состав многих изверженных и осадочных пород. Бор известен в нефтяных и морских водах (в морской воде 4,6 мг/л), в водах соляных озёр, горячих источников и грязевых вулканов.
Основные минеральные формы бора:
Также различают несколько типов месторождений бора:
Крупнейшее месторождение России находится в Дальнегорске (Приморье). Оно относится к боросиликатному типу. В этом одном компактном месторождении сосредоточено не менее 3 % всех мировых запасов бора. На действующем при месторождении горно-химическом предприятии выпускается боросодержащая продукция, которая удовлетворяет потребности отечественной промышленности. При этом 75 % продукции идёт на экспорт в Корею, Японию и Китай.
Получение
Физические свойства
Чрезвычайно твёрдое вещество (уступает только алмазу, нитриду бора (боразону), карбиду бора, сплаву бор-углерод-кремний, карбиду скандия-титана). Обладает хрупкостью и полупроводниковыми свойствами (широкозонный полупроводник).
У бора — самый высокий предел прочности на разрыв 5,7 ГПа.
Изотопы бора
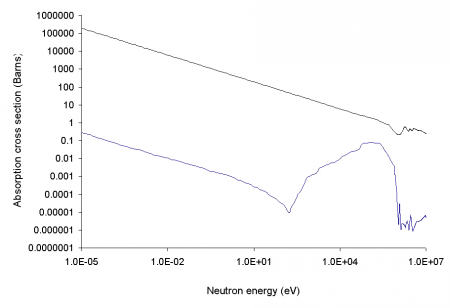
В природе бор находится в виде двух изотопов 10 B (19,8 %) и 11 B (80,2 %).
10 B имеет очень высокое сечение захвата тепловых нейтронов, равное 3837 барн (для большинства нуклидов это сечение близко к единицам или долям барна), причём при захвате нейтрона образуются два нерадиоактивных ядра (альфа-частица и литий-7), очень быстро тормозящиеся в среде, а проникающая радиация (гамма-кванты) при этом отсутствует, в отличие от аналогичных реакций захвата нейтронов другими нуклидами:
10 B + n → 11 B* → α + 7 Li + 2,31 МэВ.
Поэтому 10 B в составе борной кислоты и других химических соединений применяется в атомных реакторах для регулирования реактивности, а также для биологической защиты от тепловых нейтронов. Кроме того, бор применяется в нейтрон-захватной терапии рака.
Кроме двух стабильных, известно ещё 12 радиоактивных изотопов бора, из них самым долгоживущим является 8 B с периодом полураспада 0,77 с.
Происхождение
Все изотопы бора возникли в межзвёздном газе в результате расщепления тяжелых ядер космическими лучами, или при взрывах сверхновых.
Химические свойства
По многим физическим и химическим свойствам неметалл бор напоминает кремний.
Химически бор довольно инертен и при комнатной температуре взаимодействует только со фтором:
При нагревании бор реагирует с другими галогенами с образованием тригалогенидов, с азотом образует нитрид бора BN, с фосфором — фосфид BP, с углеродом — карбиды различного состава (B4C, B12C3, B13C2). При нагревании в атмосфере кислорода или на воздухе бор сгорает с большим выделением теплоты, образуется оксид B2O3:
С водородом бор напрямую не взаимодействует, хотя известно довольно большое число бороводородов (боранов) различного состава, получаемых при обработке боридов щелочных или щелочноземельных металлов кислотой:
При сильном нагревании бор проявляет восстановительные свойства. Он способен, например, восстановить кремний или фосфор из их оксидов:
Данное свойство бора можно объяснить очень высокой прочностью химических связей в оксиде бора B2O3.
При отсутствии окислителей бор устойчив к действию растворов щелочей. Растворяется в расплаве смеси гидроксида и нитрата калия:
В горячей азотной, серной кислотах и в царской водке бор растворяется с образованием борной кислоты H3BO3.
Оксид бора B2O3 — типичный кислотный оксид. Он реагирует с водой с образованием борной кислоты:
При взаимодействии борной кислоты со щелочами возникают соли не самой борной кислоты — бораты (содержащие анион BO3 3− ), а тетрабораты, например:
В 2014 г. исследователями из Германии был получен бис(диазаборолил) бериллия, в котором атомы бериллия и бора образуют двухцентровую двухэлектронную связь (2c-2e), впервые полученную и нехарактерную для соседних элементов в Периодической таблице.
Применение
Элементарный бор
Бор (в виде волокон) служит упрочняющим веществом многих композиционных материалов.
Также бор часто используют в электронике в качестве акцепторной добавки для изменения типа проводимости кремния.
Бор применяется в металлургии в качестве микролегирующего элемента, значительно повышающего прокаливаемость сталей.
Бор применяется и в медицине при бор-нейтронозахватной терапии (способ избирательного поражения клеток злокачественных опухолей).
Соединения бора
Карбид бора применяется в компактном виде для изготовления газодинамических подшипников.
Пербораты / пероксобораты (содержат ион [B2(O2)2(OH)4]2 − ) [B4O12H8] − ) применяются как окислительные агенты. Технический продукт содержит до 10,4 % «активного кислорода», на их основе производят отбеливатели, не содержащие хлор («персиль», «персоль» и др.).
Отдельно также стоит указать на то, что сплавы бор-углерод-кремний обладают сверхвысокой твёрдостью и способны заменить любой шлифовальный материал (кроме алмаза, нитрида бора по микротвёрдости), а по стоимости и эффективности шлифования (экономической) превосходят все известные человечеству абразивные материалы.
Сплав бора с магнием (диборид магния MgB2) обладает, на данный момент, рекордно высокой критической температурой перехода в сверхпроводящее состояние среди сверхпроводников первого рода. Появление вышеуказанной статьи стимулировало большой рост работ по этой тематике.
Борная кислота (B(OH)3) широко применяется в атомной энергетике в качестве поглотителя нейтронов в ядерных реакторах типа ВВЭР (PWR) на «тепловых» («медленных») нейтронах. Благодаря своим нейтронно-физическим характеристикам и возможности растворяться в воде применение борной кислоты делает возможным плавное (не ступенчатое) регулирование мощности ядерного реактора путём изменения её концентрации в теплоносителе — так называемое «борное регулирование».
Борная кислота применяется также в медицине и ветеринарии.
Нитрид бора, активированный углеродом, является люминофором со свечением от синего до жёлтого цвета под действием ультрафиолета. Обладает самостоятельной фосфоресценцией в темноте и активируется органическими веществами при нагреве до 1000 °C. Изготовление люминофоров из нитрида бора, состава BN/C не имеет промышленного назначения, но широко практиковалось химиками-любителями в первой половине XX века.
Боросиликатное стекло — стекло обычного состава, в котором заменяют щелочные компоненты в исходном сырье на окись бора (B2O3).
Фторид бора BF3 при нормальных условиях является газообразным веществом, используется как катализатор в оргсинтезе, а также как рабочее тело в газонаполненных детекторах тепловых нейтронов благодаря захвату нейтронов бором-10 с образованием ядер лития-7 и гелия-4, ионизирующих газ (см. реакцию выше).
Бороводороды и борорганические соединения
Ряд производных бора (бороводороды) являются эффективными ракетными топливами (диборан B2H6, пентаборан, тетраборан и др.), а некоторые полимерные соединения бора с водородом и углеродом стойки к химическим воздействиям и высоким температурам (как широко известный пластик Карборан-22).
Боразон и его гексагидрид
Нитрид бора (боразон) подобен (по составу электронов) углероду. На его основе образуется обширная группа соединений, в чём-то подобных органическим.
Биологическая роль
Бор — важный микроэлемент, необходимый для нормальной жизнедеятельности растений. Недостаток бора останавливает их развитие, вызывает у культурных растений различные болезни. В основе этого лежат нарушения окислительных и энергетических процессов в тканях, снижение биосинтеза необходимых веществ. При дефиците бора в почве в сельском хозяйстве применяют борные микроудобрения (борная кислота, бура и другие), повышающие урожай, улучшающие качество продукции и предотвращающие ряд заболеваний растений.
Один из редких типов дистрофии роговицы связан с геном, кодирующим белок-транспортер, предположительно регулирующий внутриклеточную концентрацию бора.
Бор что это
Полезное
Смотреть что такое «бор» в других словарях:
Бор — Бор: В Викисловаре есть статья «бор» Бор (лес) хвойный лес. Бор (элемент) химический элемент … Википедия
Бор-11 — Бор(B) Атомный номер 5 Внешний вид простого вещества Твёрдый, хрупкий, блестяще чёрный. полуметалл Свойства атома Атомная масса (молярная масса) 10.811 а. е. м. (г/моль) Радиус атома … Википедия
БОР — (Bohr) Нильс Хенрик Давид (7.10.1885, Копенгаген, 18.11.1962, там же), датский физиктеоретик, один из создателей квантовой теории. В 1920 возглавил созданный по его инициативе Ин т теоретич. физики в Копенгагене. В 1943 45 в эмиграции в… … Философская энциклопедия
БОР — муж., хим. горючее вещество, добываемое из буры и служащее основанием борной кислоте. II. БОР муж. (брать) браньё, взятие, отпуск и прием; бору нет, говорят купцы, разбору, спросу на товар. | костр., ·торг. базар, рынок, торжок; новинный бор,… … Толковый словарь Даля
БОР — муж., хим. горючее вещество, добываемое из буры и служащее основанием борной кислоте. II. БОР муж. (брать) браньё, взятие, отпуск и прием; бору нет, говорят купцы, разбору, спросу на товар. | костр., ·торг. базар, рынок, торжок; новинный бор,… … Толковый словарь Даля
Бор — 1. БОР, а, предлож. о боре, в бору; мн. боры, ов; м. Сосновый лес, растущий на сухом возвышенном месте. Дремучий, вековой бор. Собирать в бору бруснику. Бор шумит. ◊ С бору (да) с сосенки. Кто попало, без разбору (о случайном подборе, составе… … Энциклопедический словарь
Бор — (borum, стар. назв. boracium и boron, последнее принято еще итеперь у англичан; хим. форм. В; атомный вес 11) не металлическийэлемент, в свободном состоянии известный в двух аллотропическихвидоизменениях: аморфном и кристаллическом. В аморфном… … Энциклопедия Брокгауза и Ефрона
БОР-5 — БОР 5 … Википедия
БОР — • БОР (Bohr) Oгe Нильс (р. 1922), датский физик. Получил образование в Копенгагенском и Лондонском университетах. С 1956 г. преподавал физику в Копенгагенском университете. Был также директором Института теоретический физики (1963 70),… … Научно-технический энциклопедический словарь
Бор что это
Полезное
Смотреть что такое «Бор» в других словарях:
Бор — Бор: В Викисловаре есть статья «бор» Бор (лес) хвойный лес. Бор (элемент) химический элемент … Википедия
Бор-11 — Бор(B) Атомный номер 5 Внешний вид простого вещества Твёрдый, хрупкий, блестяще чёрный. полуметалл Свойства атома Атомная масса (молярная масса) 10.811 а. е. м. (г/моль) Радиус атома … Википедия
БОР — (Bohr) Нильс Хенрик Давид (7.10.1885, Копенгаген, 18.11.1962, там же), датский физиктеоретик, один из создателей квантовой теории. В 1920 возглавил созданный по его инициативе Ин т теоретич. физики в Копенгагене. В 1943 45 в эмиграции в… … Философская энциклопедия
БОР — муж., хим. горючее вещество, добываемое из буры и служащее основанием борной кислоте. II. БОР муж. (брать) браньё, взятие, отпуск и прием; бору нет, говорят купцы, разбору, спросу на товар. | костр., ·торг. базар, рынок, торжок; новинный бор,… … Толковый словарь Даля
БОР — муж., хим. горючее вещество, добываемое из буры и служащее основанием борной кислоте. II. БОР муж. (брать) браньё, взятие, отпуск и прием; бору нет, говорят купцы, разбору, спросу на товар. | костр., ·торг. базар, рынок, торжок; новинный бор,… … Толковый словарь Даля
Бор — 1. БОР, а, предлож. о боре, в бору; мн. боры, ов; м. Сосновый лес, растущий на сухом возвышенном месте. Дремучий, вековой бор. Собирать в бору бруснику. Бор шумит. ◊ С бору (да) с сосенки. Кто попало, без разбору (о случайном подборе, составе… … Энциклопедический словарь
бор — 1. БОР, а, предлож. о боре, в бору; мн. боры, ов; м. Сосновый лес, растущий на сухом возвышенном месте. Дремучий, вековой бор. Собирать в бору бруснику. Бор шумит. ◊ С бору (да) с сосенки. Кто попало, без разбору (о случайном подборе, составе… … Энциклопедический словарь
БОР-5 — БОР 5 … Википедия
БОР — • БОР (Bohr) Oгe Нильс (р. 1922), датский физик. Получил образование в Копенгагенском и Лондонском университетах. С 1956 г. преподавал физику в Копенгагенском университете. Был также директором Института теоретический физики (1963 70),… … Научно-технический энциклопедический словарь
Бор что это
Для получения аморфного бора (по Вёлеру и Девиллю) в раскаленный чугунный тигель всыпают смесь 100 ч. борного ангидрида с 60 ч. металлического натрия и покрывают все слоем прокаленной поваренной соли (от 40 до 50 ч.); наступает бурная реакция, причем часть борного ангидрида отдает свой кислород натрию; бор выделяется в свободном состоянии, и вместе с тем образуется бура; сплав перемешивают железным прутом, выливают в воду, подкисленную соляной кислотой, и собирают остающийся нерастворенным бор на фильтре; в виде аморфного порошка он легко проходит через поры бумаги, висит в воде и сообщает ей бурую окраску, так что его считают в воде растворимым; сушить порошок следует на пористых фарфоровых пластинках при обыкновенной температуре, так как при более сильном подогревании бор легко загорается. Берцелиус приготовлял его, нагревая борофтористый калий KBF 4 с металлическим калием. Магний, а также уголь и фосфор восстановляют бор из его окиси. Аморфный бор легко реагирует со многими веществами: загораясь при накаливании на воздухе, он соединяется не только с кислородом, но и с азотом; кислоты, особенно при нагревании, окисляют его в борную кислоту; щелочи действуют подобным же образом, с выделением водорода; при высокой температуре металлы, сера, хлор, бром прямо соединяются с бором.
Для получения кристаллического видоизменения плотно набивают небольшой тигель аморфным бором, просверливают в массе небольшое отверстие, достаточное для того, чтобы вставить палочку металлического алюминия, и помещают плотно закрытый тигель в другой, больших размеров, а промежуточное пространство засыпают углем; наружный тигель закрывают крышкой, замазывают и накаливают 1 ½ —2 часа при температуре около 1500°. По охлаждении растворяют алюминий в едком натре и обрабатывают остаток соляной кислотой. Полученный таким образом бор представляет просвечивающие красновато-желтые квадратные кристаллы уд. веса 2,68, по свойствам напоминающие алмаз; они обладают большой способностью лучепреломления и твердостью: чертят, подобно алмазу, корунд и сапфир. Известно несколько разновидностей кристаллического бора, получающихся различными способами, но все они не представляют химически чистого вещества, а содержат углерод и алюминий, другие же только углерод. По исследованиям Гампе, здесь имеются определенные химические соединения состава В 48 Al 3 C 2 и B 12 Al. Кристаллический бор несравненно более постоянен относительно химических деятелей, чем аморфный: он весьма трудно окисляется при накаливании в чистом кислороде; точно так же он хорошо сопротивляется действию кислот, за исключением царской водки. Весьма интересны определения теплоемкости кристаллического бора (Вебер): оказывается, что она быстро возрастает с повышением температуры подобно тому, как это наблюдается и для угля. Такого рода факт весьма важен для убеждения в общности закона Дюлонга и Пти (см. Теплоемкость), так как определения, сделанные при низких сравнительно температурах, дают для атомной теплоемкости числа, которые значительно менее требуемых законом; напр., при —40° теплоемкость равна 0,1915, а при +233° она уже доходит до 0,3663.
В своих соединениях бор функционирует как трехатомный элемент, на что указывает и место его в периодической системе (см. это сл.): он помещается в третьей группе вместе с алюминием и в одном ряду с углеродом (В = 11; С = 12). Непосредственным соседством с этим последним элементом объясняется до известной степени существование аллотропических видоизменений бора. Таким образом, общая формула борных соединений будет BX 3 (где Х = Cl, Br, ОН и т. п.). Из них, как уже упомянуто, наиболее важными и, между прочим, единственными источниками для получения всех других соединений являются борная кислота и ее соли.
Na 2 B 4 O 7 + 2HCl + 5H 2 O = 4B(OH) 3 + 2NaCl.
Борная кислота кристаллизуется из воды в перламутровых просвечивающих листочках, жирных на ощупь, уд. веса 1,434 (при 15° Ц.); 1 ч. кислоты растворяется в 25,6 ч. воды при 15° и в 2,9 ч. кипящей воды; вещество растворимо также в летучих эфирных маслах и в алкоголе, с парами которого летит при нагревании, образуя сложные эфиры; алкогольный раствор свободной кислоты (или солей ее в присутствии серной кислоты) горит зеленым пламенем, что служит для открытия борных соединений (при этом опыте следует избегать медных солей и солей хлористоводородной кислоты, также окрашивающих пламя спирта в зеленый цвет). Кислотные свойства борной кислоты весьма слабы: водный раствор ее окрашивает синюю лакмусовую бумажку в слабо красный цвет, а куркумовую в бурый, подобно щелочам; на слабый кислотный характер вещества указывает также способность его соединяться в довольно прочные сочетания с кислотами серной (Шульц-Селлак) и фосфорной (Г. Г. Густавсон, А. Фогель). Но если борная кислота в водяных растворах малоэнергична и вытесняется из солей другими кислотами, даже угольной, то в безводном состоянии, в виде ангидрида, она является энергическим кислотным окислом, вытесняющим ангидриды многих сильных кислот, что зависит от сравнительно малой летучести борного ангидрида. В технике борная кислота имеет немало применений: громадные количества ее идут на приготовление буры; в Швеции ее употребляют под именем асептина для консервирования мяса, молока, пива и т. п.; далее, борной кислотой пропитывают светильни стеариновых свеч (для того, чтобы сделать золу светильни легкоплавкой); она же идет для приготовления гюинетовой зелени (см. это сл.) и входит в состав различных эмалей и глазурей; борнокислая закись марганца употребляется при изготовлении скоро высыхающих масляных красок и т. п.
2H 3 ВО+ = В 2 О 3 + 3H 2 O.
4Н 3 ВО 3 — 5Н 2 О = Н 2 В 4 О 7
Водородистый бор. При сплавлении борной кислоты с избытком порошкообразного магния или аморфного бора с 3 ч. магния получается соединение, которое при действии соляной кислоты дает бесцветную газообразную смесь водорода с водородистым бором; она обладает неприятным запахом, горит ярким зеленым пламенем и дает при этом, как продукты горения, борную кислоту и воду. Если ввести в пламя холодный фарфоровый предмет, то на нем осаждается аморфный бор. В чистом виде вещество не получено; анализ его дает числа, указывающие на формулу ВН 3 (Jones и Taylor «Chem. Soc.» 1881, 293)
Азотистый бор BN образуется, как уже указано, прямым соединением азота с бором при накаливании; получен Бальменом в 1842 г. при нагревании борного ангидрида с цианистым калием. По Вёлеру, вещество готовят, накаливая в платиновом тигле тесную смесь 1 ч. сплавленной буры с 2 ч. нашатыря; образующуюся пористую массу обрабатывают водой и соляной кислотой. Азотистый бор представляет белый аморфный, мягкий на ощупь, легкий порошок, не плавящийся в сильном жару, отличающийся замечательным постоянством по отношению к химическим деятелям; азотная и соляная кислоты, щелочные растворы, водород и хлор при накаливании на него не действуют; при сплавлении с едким кали и при накаливании с парами воды вещество дает аммиак.
Фтористый бор BF 3 получен Гей-Люссаком и Тенаром при накаливании фтористого кальция с борным ангидридом; удобнее готовить его нагреванием упомянутых веществ с крепкой серной кислотой:
3СаF 2 + 4В 2 О 3 + 3H 2 SO 4 = 8CaSO 4 + 2BF 3 + 3Н 2 O.
Бор элемент. Свойства бора. Применение бора
От цыпленка к человеку. Обычно, говорят: — «От обезьяны». Но, речь не об эволюции, а о доказательстве важности бора для организма.
До 1981-го года элемент считали несущественным, не требующим включения в рацион. Убеждения ученых пошатнули цыплята.
Их выращивание шло успешнее, если в питание входил бор. Его необходимость курам, доказали в 1985-ом, а к 1990-ым дело дошло и до человека.
Выяснилось, что бор – элемент, поддерживающий плотность костной ткани.
К тому же, вещество удерживает в норме выработку, как мужского, так и женского гормона, то есть, эстрогена и прогестерона.
Вот такой «бесполезный» элемент. Далее, информация для тех, кто относится к нему со всем уважением.
Свойства бора
Бор – химический элемент, стоящий в таблице Менделеева под 5-ым номером. Строение у вещества атомное.
Такое характерно для металлов, однако, бор к ним не относится. Элемент является исключением среди своей группы неметаллов.
Атомная решетка обеспечивает герою статьи рекордный предел прочности на разрыв – 5,7 гектопаскалей.
Не удивительно, что волокнистый бор – хим. элемент, добавляемый в композиционные материалы.
Их создают искусственно, складывая из компонентов с различными свойствами. В итоге, получаются легкие, но жесткие, прочные и износостойкие конструкции.
Атомы бора состоят и 5-ти протонов и стольки же, или 6-ти, нейтронов. Соответственно, есть два природных изотопа: — 10-ый и 11-ый.
На электронных оболочках атома элемента вращаются 5 частиц. Два электрона располагаются на ближней к ядру орбите, а три – на дальней.
Поэтому, стандартная валентность бора равна +3-ем. Под валентностью понимается способность атома формировать с другими элементами определенное количество химических связей.
Три электрона, готовые к взаимодействию, обеспечивают 5-му элементу высокую химическую активность.
Соединения бора – единственные его представители в природе. В свободном виде 5-ый элемент получают лишь в лабораториях.
При этом, конечный бор был загрязнен примесями не более, чем на 10%. Удалось рассмотреть внешность элемента.
Это жесткое, серое вещество. Расплавить его удается лишь при 4000 градусов Цельсия.
Два природных изотопа бора значительно разнятся в характеристиках, в частности, в сечении захвата тепловых нейтронов.
Последние, провоцируют атомные реакции. Сечение захвата – способность ядра бора улавливать медленные нейтроны. Если показатель велик, можно регулировать ход реакции, останавливать ее.
Значит, вещества с большим сечением захвата подходят для стержней атомных реакторов. Из изотопов бора годится лишь один. Какой именно, расскажем в следующей главе.
Применение бора
Для стержней реакторов годится легкий изотоп бора, то есть, B10. У него не просто большое сечение захвата, а первое среди всех элементов таблицы Менделеева.
У 11-го бора, напротив, показатель самый маленький. Соответственно, тяжелую версию 5-го вещества можно применять в горячей зоне реакторов. То есть, B11 – отличный конструкционный материал для атомных станций.
Это газ, необходимый в счетчиках тепловых нейтронов. Их, так же, называют борными. Аппаратура служит в качестве приемника излучения.
В атомных реакторах, и не только, приходится кстати тугоплавкость и жаропрочность бора.
В итоге, изделия из борированной стали могут служит в агрессивных средах, выдерживать повышенные ударные нагрузки.
Карбиды бора, то есть соединения с углеродом, долгое время применялись зуботехниками. Задумывались, почему бормашины так называются?
Потому что сверла в аппаратах сделаны из сплава с карбидом 5-го элемента. Такими сверление зубов наиболее быстро и эффективно.
Их удельная проводимость больше, чем у диэлектриков, но меньше, чем у металлов.
Полупроводники нужны в интегральных схемах, транзисторах, оптоэлектронике.
Секрет материалов в том, что с повышением температуры они начинают проводить ток лучше. Обычные же проводники при жаре, напротив, теряют свойства.
Добыча бора
В соединениях бор извлекают из земных недр. На тонну породы, в среднем, приходятся 4 грамма 5-го элемента.
Они наиболее насыщенны элементом. Интересно, что добывать его можно даже из морских растений. В них 5-го вещества 120 микрограммов на кило.
Из минералов бором наиболее богат улексит. Его залежи, к примеру, разрабатывают в Чили. Общие запасы камня оцениваются в 30 000 000 тонн.
Все залежи находятся в пустыне Атакама. Первые поставки отсюда начались еще в середине 19-го века, сразу после постройки в стране железной дороги.
Сколько в те годы стоил бор, не говориться. Однако, можем узнать современный ценник.
Цена бора
Стоимость продукции зависит от вида и объемов. Так, в металлургии нужен чистый, аморфный бор.
Аморфным называют твердое вещество, но не имеющее кристаллической решетки.
Если промышленники приобретают кристаллический элемент, то максимально измельченный.
Так вот, порошок аморфного бора в фасовке по 15 килограммов стоит около 9000 рублей.
Однако, есть предложения, где кило оценивают лишь в 50 рублей. Здесь уже нужно собирать досье на поставщика.
Причиной низкой стоимости может быть загрязненность бора, большой процент примесей. Хотя, встречаются и честные предложения, особенно, при оптовых поставках.
Что касается соединений 5-го элемента, за карбиды дают от 100-та до 700-от рублей. Это ценник за 1000 граммов.
Разброс стоимости обоснован разными формулами и свойствами карбидов. За кило борного ангидрита приходится выложить в районе 250-ти, а за нитрид – несколько тысяч рублей.
Встречается и органобор. Это комплексное удобрение, ведь, если бы 5-ый элемент ни был нужен растениям, как и человеческому организму, его бы не добывали из водорослей. Типичная фасовка органобора – литровая. Ее стоимость — 350-400 рублей.
Значение слова бор
Словарь Ушакова
1.
2.
3.
Словарь топонимов Новосокольнического района Псковской области
Фразеологический словарь русского языка
Фразеологический словарь (Волкова)
► Набирали на шахту народ с бору да с сосенки.
► Непонятно, откуда у них сыр бор загорелся.
Военно-морской Словарь
распространение приливной волны вверх по течению реки через устье. Вода принимает вид стены высотой до 9 м и более, движется со скоростью до 16 км/ч, поднимается вверх по реке на 80 км и более (на Амазонке до 300 км). Несет разрушение в прибрежной полосе.
Словарь охотничьих терминов и выражений
красный лес: сосна, ель, пихта.
Словарь по мифологии М. Ладыгина.
Источники:
Энциклопедический словарь
Словарь Ожегова
БОР 1 , а, о боре, в бору, мн. ы, ов, м. Сосновый лес.
• С бору да с сосенки (разг. неодобр.) случайно, откуда попало, без разбору.
| прил. боровой, ая, ое. Боровая дичь (пернатая лесная дичь).
БОР 2 , а, м. (спец.). Стальное сверло в бормашине.
Словарь Ефремовой
Энциклопедия Брокгауза и Ефрона
— название растений, по преимуществу видов проса (см.) Panicum, щетинницы (см.) Setaria и просяника (см.) Milium. Б., боровицею зовется в Олонецкой, Владимирской губ. также вереск (см.; Calluna), произрастающий на боровых местах.
Для получения аморфного бора (по Вёлеру и Девиллю) в раскаленный чугунный тигель всыпают смесь 100 ч. борного ангидрида с 60 ч. металлического натрия и покрывают все слоем прокаленной поваренной соли (от 40 до 50 ч.); наступает бурная реакция, причем часть борного ангидрида отдает свой кислород натрию; бор выделяется в свободном состоянии, и вместе с тем образуется бура; сплав перемешивают железным прутом, выливают в воду, подкисленную соляной кислотой, и собирают остающийся нерастворенным бор на фильтре; в виде аморфного порошка он легко проходит через поры бумаги, висит в воде и сообщает ей бурую окраску, так что его считают в воде растворимым; сушить порошок следует на пористых фарфоровых пластинках при обыкновенной температуре, так как при более сильном подогревании бор легко загорается. Берцелиус приготовлял его, нагревая борофтористый калий KBF 4 с металлическим калием. Магний, а также уголь и фосфор восстановляют бор из его окиси. Аморфный бор легко реагирует со многими веществами: загораясь при накаливании на воздухе, он соединяется не только с кислородом, но и с азотом; кислоты, особенно при нагревании, окисляют его в борную кислоту; щелочи действуют подобным же образом, с выделением водорода; при высокой температуре металлы, сера, хлор, бром прямо соединяются с бором.
Для получения кристаллического видоизменения плотно набивают небольшой тигель аморфным бором, просверливают в массе небольшое отверстие, достаточное для того, чтобы вставить палочку металлического алюминия, и помещают плотно закрытый тигель в другой, больших размеров, а промежуточное пространство засыпают углем; наружный тигель закрывают крышкой, замазывают и накаливают 1 ½ —2 часа при температуре около 1500°. По охлаждении растворяют алюминий в едком натре и обрабатывают остаток соляной кислотой. Полученный таким образом бор представляет просвечивающие красновато-желтые квадратные кристаллы уд. веса 2,68, по свойствам напоминающие алмаз; они обладают большой способностью лучепреломления и твердостью: чертят, подобно алмазу, корунд и сапфир. Известно несколько разновидностей кристаллического бора, получающихся различными способами, но все они не представляют химически чистого вещества, а содержат углерод и алюминий, другие же только углерод. По исследованиям Гампе, здесь имеются определенные химические соединения состава В 48Al3C2 и B 12 Al. Кристаллический бор несравненно более постоянен относительно химических деятелей, чем аморфный: он весьма трудно окисляется при накаливании в чистом кислороде; точно так же он хорошо сопротивляется действию кислот, за исключением царской водки. Весьма интересны определения теплоемкости кристаллического бора (Вебер): оказывается, что она быстро возрастает с повышением температуры подобно тому, как это наблюдается и для угля. Такого рода факт весьма важен для убеждения в общности закона Дюлонга и Пти (см. Теплоемкость), так как определения, сделанные при низких сравнительно температурах, дают для атомной теплоемкости числа, которые значительно менее требуемых законом; напр., при —40° теплоемкость равна 0,1915, а при +233° она уже доходит до 0,3663.
В своих соединениях бор функционирует как трехатомный элемент, на что указывает и место его в периодической системе (см. это сл.): он помещается в третьей группе вместе с алюминием и в одном ряду с углеродом (В = 11; С = 12). Непосредственным соседством с этим последним элементом объясняется до известной степени существование аллотропических видоизменений бора. Таким образом, общая формула борных соединений будет BX 3 (где Х = Cl, Br, ОН и т. п.). Из них, как уже упомянуто, наиболее важными и, между прочим, единственными источниками для получения всех других соединений являются борная кислота и ее соли.
Борная кислота Н 3 ВО 3, или В(ОН) 3, Acidum boricum, получена впервые в 1802 г. из буры Гомбергом, откуда ее название «Sal sedativum Hombergii»; в 1808 г. Гей-Люссак и Тенар (и почти одновременно с ними Деви) разложили ее на бор и кислород; химический состав установлен Берцелиусом в 1824 г. В природе вещество встречается в вулканических местностях (в Тоскане, в Калифорнии) по краям небольших озер или бассейнов, образовавшихся через сгущение водяных паров, вырывающихся из трещин в земле (фумаролы, или suffioni). Борная кислота летуча с парами воды, а потому увлекается ими из глубины земли и мало-помалу выкристаллизовывается по мере испарения воды из упомянутых бассейнов. Такая природная борная кислота носит у минералогов название «сассолин». Соли борной кислоты встречаются в природе в виде минералов, каковы боронатрокальцит, борнокислый кальций-натрий, борацит — борнокислый магний и др. Кроме того, борная кислота найдена в морской воде и во многих минеральных источниках. Главная масса ее добывается в Тоскане, из фумарол; здесь, как уже указано, во многих местах из трещин в земле или нарочно устроенных буровых скважин вырываются горячие водяные пары, смешанные с азотом, сернистым водородом, небольшим количеством борной кислоты (около 1/1 0 %), аммиаком и др. веществами. Для эксплуатации этого естественного источника борной кислоты пользуются следующим способом, хорошо сообразующимся с местными условиями: над трещинами, выделяющими пары, устраивают вместилища для воды из плитняка и цемента и в такие бассейны напускают воду (высотою до 2 метр.) из близлежащих источников. Пар, с силой вырывающийся из земли, проходит через воду и отдает ей часть содержащейся в нем борной кислоты.
Через 24 часа содержание борной кислоты в воде достигает известного максимума — ½ процента; эту воду спускают в особую цистерну для отстаивания и вновь наполняют бассейн свежей водой: отстоявшийся слабый раствор борной кислоты выпаривают до кристаллизации, причем необходимое тепло доставляется теми же фумаролами. С этой целью над ними помещают свинцовые чрены в 125 метр. длины, 2,5 метра ширины и 20 сантиметров глубины, так, чтобы действию горячих паров было подвержено все дно сосуда, поддерживаемого железными брусьями. Прозрачный раствор постоянно притекает с одного конца чрена, поставленного несколько наклонно, и этот приток посредством особого приспособления регулируется таким образом, что с другого конца постоянно оттекает более концентрированный раствор, способный кристаллизоваться. Этот раствор поступает в бассейн, подогреваемый парами фумарол, и после осветления охлаждается в деревянных сосудах, выложенных свинцовыми листами, где и кристаллизуется; маточный раствор отделяют и вновь сгущают, что дает новую порцию борной кислоты, уже менее чистой; различные порции смешивают и таким образом получают препарат среднего достоинства, который и составляет продажную борную кислоту. Эта последняя содержит до 25 % подмесей, именно аммиачных и сернокислых солей и употребляется для приготовления буры. В Тоскане таким путем добывается свыше 2,5 миллионов килогр. борной кислоты. Причина образования внутри земли паров, содержащих борную кислоту, в настоящее время с достоверностью не известна. Дюма объясняет это нахождением на некоторой глубине в земле залежей сернистого бора В 2S3, разлагающегося при действии воды на борную кислоту и сернистый водород. Варингтон, Вёлер, Девилль и Попп приписывают это разложению не сернистого, а азотистого бора, BN; Баллей и Бишоф — действию растворов нашатыря на минералы, содержащие борную кислоту. Для получения химически чистой борной кислоты к раствору 1 ч. буры в 4 ч. горячей воды прибавляют столько соляной кислоты, чтобы жидкость сильно окрашивала лакмус в красный цвет; по охлаждении почти вся борная кислота выделяется в виде тонких чешуек, которые отделяют от маточного раствора отжиманием и окончательно очищают перекристаллизацией:
Борная кислота кристаллизуется из воды в перламутровых просвечивающих листочках, жирных на ощупь, уд. веса 1,434 (при 15° Ц.); 1 ч. кислоты растворяется в 25,6 ч. воды при 15° и в 2,9 ч. кипящей воды; вещество растворимо также в летучих эфирных маслах и в алкоголе, с парами которого летит при нагревании, образуя сложные эфиры; алкогольный раствор свободной кислоты (или солей ее в присутствии серной кислоты) горит зеленым пламенем, что служит для открытия борных соединений (при этом опыте следует избегать медных солей и солей хлористоводородной кислоты, также окрашивающих пламя спирта в зеленый цвет). Кислотные свойства борной кислоты весьма слабы: водный раствор ее окрашивает синюю лакмусовую бумажку в слабо красный цвет, а куркумовую в бурый, подобно щелочам; на слабый кислотный характер вещества указывает также способность его соединяться в довольно прочные сочетания с кислотами серной (Шульц-Селлак) и фосфорной (Г. Г. Густавсон, А. Фогель). Но если борная кислота в водяных растворах малоэнергична и вытесняется из солей другими кислотами, даже угольной, то в безводном состоянии, в виде ангидрида, она является энергическим кислотным окислом, вытесняющим ангидриды многих сильных кислот, что зависит от сравнительно малой летучести борного ангидрида. В технике борная кислота имеет немало применений: громадные количества ее идут на приготовление буры; в Швеции ее употребляют под именем асептина для консервирования мяса, молока, пива и т. п.; далее, борной кислотой пропитывают светильни стеариновых свеч (для того, чтобы сделать золу светильни легкоплавкой); она же идет для приготовления гюинетовой зелени (см. это сл.) и входит в состав различных эмалей и глазурей; борнокислая закись марганца употребляется при изготовлении скоро высыхающих масляных красок и т. п.
Он имеет вид прозрачной стекловидной массы, быстро мутнеющей на воздухе вследствие поглощения влажности; в воде растворяется с разогреванием и дает при этом описанный выше нормальный гидрат Н 3 ВО 3. Окиси различных металлов растворяются в расплавленном борном ангидриде и дают бесцветные или окрашенные стекла; при этом могут образоваться средние соли борной кислоты, отвечающие нормальному гидрату Н 3 ВО 3, напр. Na 3 ВО 3 и Mg 3B2 О 6; в водных растворах всегда получаются соли с меньшим количеством оснований (см. ниже). Если из сплава окиси с борным ангидридом удалить действием сильного жара избыток ангидрида, то некоторые окислы выделяются в кристаллическом виде. На этом основаны замечательные опыты Эбельмена над получением искусственных драгоценных камней; он получал напр. кристаллический глинозем, шпинель — соединение MgO с Al 2 О 3, встречающееся в природе, и др.
производным ее является столь важная в практике бура. Другие соли соответствуют еще более сложным гидратам, которые все могут быть произведены от нормального гидрата через отнятие некоторого числа частиц воды от нескольких частиц Н 3 ВО 3.
Водородистый бор. При сплавлении борной кислоты с избытком порошкообразного магния или аморфного бора с 3 ч. магния получается соединение, которое при действии соляной кислоты дает бесцветную газообразную смесь водорода с водородистым бором; она обладает неприятным запахом, горит ярким зеленым пламенем и дает при этом, как продукты горения, борную кислоту и воду. Если ввести в пламя холодный фарфоровый предмет, то на нем осаждается аморфный бор. В чистом виде вещество не получено; анализ его дает числа, указывающие на формулу ВН 3 (Jones и Taylor «Chem. Soc.» 1881, 293)
Азотистый бор BN образуется, как уже указано, прямым соединением азота с бором при накаливании; получен Бальменом в 1842 г. при нагревании борного ангидрида с цианистым калием. По Вёлеру, вещество готовят, накаливая в платиновом тигле тесную смесь 1 ч. сплавленной буры с 2 ч. нашатыря; образующуюся пористую массу обрабатывают водой и соляной кислотой. Азотистый бор представляет белый аморфный, мягкий на ощупь, легкий порошок, не плавящийся в сильном жару, отличающийся замечательным постоянством по отношению к химическим деятелям; азотная и соляная кислоты, щелочные растворы, водород и хлор при накаливании на него не действуют; при сплавлении с едким кали и при накаливании с парами воды вещество дает аммиак.
Фтористый бор BF3 получен Гей-Люссаком и Тенаром при накаливании фтористого кальция с борным ангидридом; удобнее готовить его нагреванием упомянутых веществ с крепкой серной кислотой:
Фтористый Б. представляет бесцветный газ, сгущающийся при —110° в прозрачную бесцветную жидкость, дымящий на воздухе вследствие соединения с водой; 1 объем воды растворяет до 1050 объемов газа (Базаров); весьма прочен; обугливает органические вещества, подобно серной кислоте, отнимая от них воду; не разъедает стекла. При избытке фтористого бора образуется водный раствор газа, способный перегоняться, состава ВF 3 x 2H2 O, называемый фтороборной кислотой, которой соответствуют свои соли. При действии воды эта система изменяется с выделением плавиковой кислоты и образованием борофтористоводородной кислоты, раствор которой разлагается при выпаривании; известны ее соли, напр. KBF 4. Существуют, по-видимому, и другие определенные соединения фтористого бора с водой и плавиковой кислотой.
Бор что это
Бор – химический элемент, играющий важную роль в питании растений. В малых количествах присутствует повсеместно. Является компонентом (действующим веществом) комплексных и микроудобрений, добавляется в минеральные удобрения. Применяется для обработки семян, некорневой подкормки и внесения в почву.
Содержание:
Бор известен человечеству уже более 200 лет, однако, на первый взгляд, в нем нет ничего особенного: ни фантастической истории открытия, ни загадочных легенд о нем, ни выдающихся свойств. Борная кислота – самая слабая из всех кислот, роль бора в организме человека и животных не так велика, как у других элементов, и даже название этого неметалла не связано ни с каким интересным фактом – оно просто дублирует слово, которым арабы обозначали буру, минерал, используемый для получения бора. Тем не менее, бор только на первый взгляд не заслуживает внимания. У него тоже есть, чем «похвастаться»: он светится в темноте, его сплавы с углеродом и кремнием почти так же тверды, как и алмаз, а еще он является компонентом ракетного топлива. [13]
Кристаллы буры (природного соединения бора).
Физические и химические свойства
Бор является элементом III группы главной подгруппы периодической системы Д.И. Менделеева; атомный номер 5, атомная масса 10,811; природный бор состоит из двух стабильных изотопов: В10 (около 19 %) и В11 (около 81 %).
Кристаллический бор имеет серовато-черный цвет, чистый бор бесцветен; по твердости занимает второе место после алмаза.
Искусственно получены радиоактивные изотопы бора с очень малым периодом полураспада.
Металлические свойства у всех элементов этой подгруппы выражены слабее, чем у бора, преобладают неметаллические свойства. По ряду характеристик бор сходен с кремнием. Способен участвовать в реакциях комплексообразования. [3]
Симптомы избытка бора у яблони
Содержание в природе
В природе встречается в составе буры или борной кислоты, а также борных руд:
Бор не встречается в природе в свободном состоянии. [12]
Относится к числу рассеянных микроэлементов и в небольших количествах встречается почти повсеместно. Содержится во всех почвах, горных породах, воде морей, рек, озер, и входит в состав растительных и животных организмов. Изверженные горные породы гораздо беднее бором (0,001 % B2O3) по сравнению с осадочными (0,05 – 0,1% B2O3). Значительное количество этого элемента содержится в золе морских водорослей (0,05 – 1% B2O3), каменного угля (0,1 – 0,1%), а также в морской воде (0,46 %). [1]
Содержание и распределение бора в почвах и растениях зависят от многих химических и физических свойств почв, в частности, от механического состава, содержания и качества гумуса, реакции среды. [1]
Содержание бора в поверхностном слое почв стран СНГ и их усвояемая часть, согласно данным: [6]
Почвы
Сухая почва
Вытяжка H2O
Черноземы
Каштановые
Бурые
Сероземы
В магматических породах
Распределение валового бора по профилю почвы тесно связано с гранулометрическим составом ее генетических горизонтов. Как правило, содержание бора выше в горизонтах с большей долей тяжелых гранулометрических фракций. Значительная часть бора связана с органическим веществом почвы. [3]
Содержание бора в различных типах почв
Усвояемые формы бора в почве представлены в большинстве случаев борной кислотой и ее растворимыми солями. Борная кислота, как образующаяся в самой почве, так и вносимая с удобрениями, является весьма подвижным соединением, фиксируется слабо и может вымываться осадками. Поэтому почвы в районах с большим увлажнением бедны подвижными формами бора. [7]
Потребность с/х культур в боре и симптомы их недостатка, согласно данным: [14] [11]
Неправильное развитие апексных точек роста
Замедленное развитие пыльцы Уменьшение количества завязей
Неправильное развитие плода
Растрескивание стеблей с внутренним некрозом (делает растения восприимчивыми к заболеваниям)
Зернобобовые
Масличные
Отмирание верхушечных стеблей (до цветения)
Овощные
Осыпание цветков и завязей
Образование и отмирание боковых побегов
Недоразвитие корневой системы
Утолщения на концах корешков
Оранжевая окраска корней
Отмирание молодых листьев
Появление на сердечке малых деформированных листьев;
Увядание старых листьев, их обожженный вид
Загнивание корней с образованием сначала закрытого, а затем открытого дупла
Почернение точек роста стебля
Кустистый вид растения из-за роста новых листьев в нижней части стебля
Ломкость черешков молодых листьев
Потемнение плодов + образуются бурые пятна (участки отмерших тканей)
Плоды уродливой формы
Уменьшение в размерах листьев и черешков
Ослабление корневой системы
Потемнение и почернение соцветий
Образование дупла в стебле с почерневшими краями
Пропашные
Отмирание точек роста корней
Появление мелких клубней с трещинами
Покоричневение и сосудистые кольца в пяточной части клубней.
Свекла сахарная, кормовая, столовая
Отмирание молодых листьев
Появление малых деформированных листьев на сердечке;
Увядание старых листьев, их обожженный вид
Загнивание корней с образованием сначала закрытого, а затем закрытого дупла
Кормовые
Пожелтение (хлороз) верхушек стеблей
Отмирание верхушек стеблей
Низкий урожай семян
Кукуруза на силос и зеленую массу
Плодовые
Сморщивание листьев (иногда они бывают ненормально толстые и хрупкие)
Появление мелких, растрескавшихся плодов
Частичное отмирание плодов
Ягодные
Изменение листовых пластинок:
Листья тонкие, удлиненные, с глубокими вырезами
Листья изогнутые, с неровной поверхностью, нечеткой зубчатостью и свернуты вниз
Чашевидность листьев, их деформация и коричневая окраска по краям
Подвижный бор
Известкование почвы уменьшает доступность бора для растений. Причина его слабой подвижности заключается в том, что органические соединения бора в присутствии извести становятся более стойкими и менее доступными для растений. [7]
Дерново-подзолистые почвы
Серые лесные почвы
Черноземы
Каштановые и светло-каштановые почвы
Солончаки и солонцы
Красноземы
Песчаные и супесчаные почвы
Роль в растении
Биохимические функции
Бор является одним из наиболее важных микроэлементов растений, хотя не требуется животным и грибам. В растениях бор может находиться в свободной форме и в виде комплексов с органическими соединениями. Мембранный транспорт бора может осуществляться пассивной диффузией, с помощью аквапоринов (NIPs), а также активным путем – анионными обменниками (BORs). [8]
Бор по своей физиологической роли отличается от других микрокомпонентов питания: анионы бора не были идентифицированы в качестве компонента какого-либо специфического энзима. [5] Он не относится ни к структурным компонентам, ни к активаторам ферментов. [3]
Функции бора связаны со следующими основными процессами:
Физиологические функции бора в растении изучены не до конца.
В клетке
Предполагают, что ряд физиологических эффектов, вызываемых бором, может быть связан с регулированием в клеточных компартментах содержания ионизированного кальция. Бор является хорошим комплексообразователем и так же, как и кальций, легко образует координационные связи с веществами, имеющими соседние ОН-группы в цис-положении. Следовательно, существует возможность прямой конкуренции между бором и кальцием за места связывания на полимерах клеточной стенки. [8]
Недостаток (дефицит) бора в растениях
Недостаток бора обычно проявляется у растений на почвах с высокими значениями pH, на известкованных, карбонатных, а также на почвах, утяжеленных гранулометрическим составом.
Бор не может реутилизироваться, и поэтому типичным симптомом его дефицита является отмирание конусов нарастания и подавление роста корней. [8]
Первые
Вторичные
Симптомы дефицита бора
При недостатке бора нарушается формирование генеративных органов растений, подавляется рост почек и молодых листьев.
При остром дефиците терминальные почки отмирают. Междоузлия становятся укороченными, растения приобретают признаки кустистости и «розеточности». У листьев появляется межжилковый хлороз. Типичные признаки недостатка бора – опадение почек и цветков, торможение формирования плодов. [3]
Наиболее чувствительны к недостатку бора свекла, лен, цветная капуста, брюква, турнепс, яблоня, груша.
Избыток бора
Высокие дозы бора вызывают у растений токсикоз, задержку роста, при этом, бор в первую очередь накапливается в листовых пластинках. Избыток бора вызывает своеобразный ожог нижних листьев, появляется краевой некроз, листья желтеют, отмирают и опадают. Также они могут закручиваться вверх или вниз, приобретать куполообразную форму. [11] [14]
Различные сельскохозяйственные культуры неодинаково реагируют на повышенное содержание бора в почве. Содержание бора в подвижной форме свыше 30 мг/кг является причиной тяжелых заболеваний растений и животных.
Порог токсичности бора определяется не только его содержанием, но и количеством, соотношением других элементов питания. Хорошая обеспеченность растений кальцием и фосфором повышает их требовательность к обеспеченности этим элементом. [14]
Общие симптомы избытка бора
Огурец
Томат
Содержание бора в удобрениях, %, согласно данным: [3] [9]