Caco3 что это
Caco3 что это
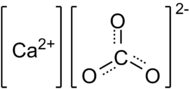
Карбонат Кальция
Химическое название
Химические свойства
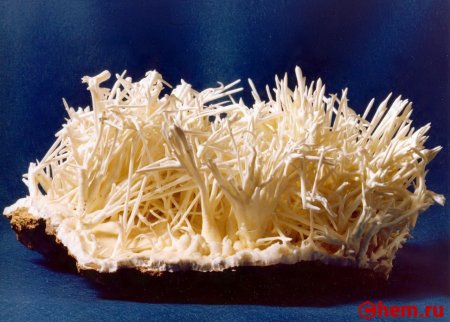
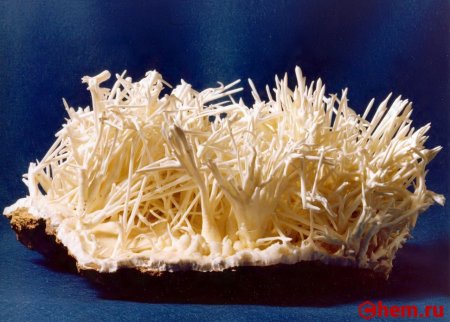
Кальция Карбонат, что это такое? Это неорганическое хим. соединение, соль, образованная Ca и угольной кислотой. Химическая формула Карбоната Кальция: CaCO3. В природе вещество можно обнаружить в кальците, ватерите, арагоните, мраморе, известняке, обычном меле, яичной скорлупе. Это достаточно распространенный минерал, в соответствии с химической формулой имеет три полиморфные модификации.
По внешнему виду – белые кристаллы без запаха или мелкий порошок. Вещество не растворяется в воде, спирте, растворимо в разбавленной азотной и соляной кислоте (при этом выделяется углекислый газ). Согласно Википедии, молярная масса вещества = 100,1 грамм на моль.
Углекислый кальций изготавливают из минералов, в основном мрамора. В лабораторных условиях соединение можно получить с помощью реакции кальцинации оксида Ca, в итоге образуется гидроксид Ca, через который проводят СО2 и осаждается карбонат. Для химических свойств характерна реакция разложения Карбоната Кальция, при которой под действием высокой температуры, вещ-во расщепляется на негашеную известь и углекислый газ. Также для химического соединения характерна реакция с водой и СО2, с образованием гидрокарбоната Ca.
Фармакологическое действие
Противоязвенное, восполняющее дефицит кальция, антацидное.
Фармакодинамика и фармакокинетика
При попадании средства в пищеварительный тракт происходит нейтрализация соляной кислоты, снижается кислотность желудочного сока в целом. Эффект от применения Карбоната Кальция наступает достаточно быстро, однако при прекращении действия может возникнуть обратное действие, секреция желудочного сока усиливается. Вещество нормализует уровень электролитов, угнетает активность остеокластов, замедляет процессы разрушения костной ткани.
Показания к применению
Углекислый кальций назначают:
Противопоказания
Побочные действия
Карбонат Кальция может спровоцировать развитие аллергических реакций, диспепсии (газообразование, боли, диарея, запор), вторичного усиления желудочной секреции, гиперкальциемии, алкалоза.
Карбонат Кальция, инструкция по применению (Способ и дозировка)
Индивидуальный режим дозирования. В качестве антацида углекислый кальций назначают в дозировке от 500 мг до 1 грамма. При профилактике остеопороза применяют до 1,2 грамм в сутки.
Для детей дозировку корректируют. Назначают 300-600 мг вещества в день.
Передозировка
При передозировке может возникнуть гиперкациемия (прием более 2 грамм в сутки). Симптомы: общая слабость, головные боли, анорексия, отсутствие аппетита, рвота, запоры, чувство жажды, вялость, полиурия, болезненные ощущения в суставах и мышцах, сбои сердечного ритма, заболевания почек.
Показано промыть желудок, дать пострадавшему энтеросорбенты, проводить симптоматическое лечение.
Взаимодействие
Сочетанный прием средства с тетрациклиновыми антибиотиками может привести к снижению их эффективности и плазменной концентрации.
При сочетании препарата с тиазидными диуретиками выше риск развития метаболического алкалоза и гиперкальциемии.
Карбонат Кальция замедляет процессы абсорбции других лекарств.
При сочетании средства с левотироксином, оно снижает эффект от приема анаболика.
Особые указания
При продолжительном лечении средством рекомендуют контролировать плазменную концентрацию кальция.
При приеме больших доз препарата и больших количеств молочной продукции может развиться гиперкальциемия и молочно-щелочной синдром.
Нельзя применять лекарство в таблетированной форме для лечения рахита, кариеса и остеопороза в качестве антацида.
Детям
Для детей нужно скорректировать дозировку.
При беременности и лактации
Вещество часто назначают беременным женщинам и кормящим мамам.
Препараты, в которых содержится (Аналоги)
Торговые названия средства: Кальция карбонат, Витакальцин, Аддитива кальций, Скоралайт, УПСАВИТ Кальций. В комбинации с магния карбонатом: Тамс, Ренни, Рамни, Эндрюс антацид. В сочетании с колекальциферолом средство входит в состав следующих лекарств: Идеос, Ревиталь Кальций Д3, Кальций-Д3 Никомед, Натекаль Д3, Компливит кальций Д3. С магния гидроксидом: Гастрик, Витрум Маг. Комплексные средства: Альфадол-Са, Витрум Бьюти Люкс, Витрум Остеомаг, Гевискон, Кальцемин и так далее.
Отзывы
Вещество часто назначают для лечения дефицита кальция детям и взрослым пациентам, это хорошее средство от изжоги. Лекарство хорошо переносится, его добавляют в состав различных препаратов, разной ценовой категории. Пациенты отмечают высокую эффективность и отсутствие побочных реакции при использовании любых препаратов на его основе.
Цена Карбоната Кальция, где купить
Купить Кальция Карбонат пищевой на развес можно по цене 250 рублей за кг. Стоимость таблеток Ренни составляет порядка 150 рублей за 12 таблеток.
Образование: Окончила Ровенский государственный базовый медицинский колледж по специальности «Фармация». Окончила Винницкий государственный медицинский университет им. М.И.Пирогова и интернатуру на его базе.
Опыт работы: С 2003 по 2013 г. – работала на должностях провизора и заведующего аптечным киоском. Награждена грамотами и знаками отличия за многолетний и добросовестный труд. Статьи на медицинскую тематику публиковались в местных изданиях (газеты) и на различных Интернет-порталах.
Карбонат кальция: способы получения и химические свойства
Карбонат кальция CaCO3 — соль кальция и угольной кислоты. Белый, при прокаливании разлагается, плавится без разложения под избыточным давлением CO2. Практически не растворяется в воде.
Относительная молекулярная масса Mr = 100,09; относительная плотность для тв. и ж. состояния d= 2,93; tпл = 1242º C при избыточном давлении.
Способ получения
2. В результате взаимодействия при комнатной температуре оксида кальция и углекислого газа происходит образование карбоната кальция:
3. Гидроксид кальция вступает в взаимодействие с углекислым газом и образует карбонат кальция и воду:
Качественная реакция
Качественная реакция на карбонат кальция — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
1. При взаимодействии с хлороводородной кислотой, карбонат кальция образует хлорид кальция, углекислый газ и воду:
Химические свойства
1. Карбонат кальция разлагается при температуре выше 900 — 1200º С, с образованием оксида кальция и углекислого газа:
2. Карбонат кальция вступает в реакцию со многими сложными веществами :
2.1. Карбонат кальция реагирует с оксидами :
2.1.1. Карбонат лития вступает в взаимодействие с оксидом кремния при 800º С и образует на выходе силикат кальция и углекислый газ:
2.2. Карбонат кальция реагирует с кислотами :
2.2.1. При взаимодействии с разбавленной хлороводородной кислотой карбонат кальция образует хлорид кальция, углекислый газ и воду:
2.2.3. Карбонат кальция взаимодействует с сероводородной кислотой при 900º С и образует сульфид кальция, воду и углекислый газ:
3. Карбонат кальция реагирует с простыми веществами:
3.1. Карбонат кальция при 800 — 850º С вступает в реакцию с углеродом (коксом) образуя оксид кальция и угарный газ:
CaCO3 + C = CaO + 2CO
Карбонат кальция
| Карбонат кальция | ||||
 | ||||
  | ||||
| Общие | ||||
|---|---|---|---|---|
| Систематическое наименование | карбонат кальция | |||
| Традиционные названия | углекислый кальций | |||
| Химическая формула | CaCO3 | |||
| Физические свойства | ||||
| Состояние (ст. усл.) | твёрдые белые кристаллы | |||
| Молярная масса | 100.0869 г/моль | |||
| Плотность | (кальцит) 2.74 г/см³ (арагонит) 2.83 г/см³ | |||
| Термические свойства | ||||
| Температура плавления | (кальцит) 825 °C, (арагонит) 1339 °C | |||
| Температура разложения | 900−1000 °C | |||
| Химические свойства | ||||
| pKa | 9.0 | |||
| Растворимость в воде | (25 °C) 0.00015 г/100 мл | |||
| Оптические свойства | ||||
| Показатель преломления | 1,60 | |||
| Структура | ||||
| Кристаллическая структура | тригональная, пространств. гр. 3 2/m | |||
| Безопасность | ||||
| Токсичность | ||||
| Задание | Вычислите массу карбоната кальция, который может прореагировать с концентрированным раствором соляной кислоты объемом 200 мл (массовая доля HCl 34%, плотность 1,168кг/л). Определите объем диоксида углерода, выделяющийся в результате этой реакции. |
| Решение | Запишем уравнение реакции: |
Найдем массу раствора соляной кислоты, а также массу растворенного вещества HCl в нем:
msolution =0,2 × 1,168 = 0,2336 кг = 233,6 г.
msolute (HCl) = ω (HCl) / 100% ×msolution;
msolute (HCl) = 34 / 100% × 233,6 = 79,424 г.
Рассчитаем количество моль соляной кислоты (молярная масса равна 36,5 г/моль):
n(HCl) = m (HCl) / M (HCl);
n (HCl) = 79,424 / 36,5 = 2,176 моль.
Согласно уравнению реакции n (HCl) :n (CO2) =2: 1. Значит,
n(CO2) = ½ n(HCl) = ½×2,176 = 1,088моль.
Тогда, объем выделившегося диоксида углерода будет равен:
V (CO2) = 1,088 × 22,4 = 24,37л.
Согласно уравнению реакции n(HCl) :n (CaCO3) =2: 1. Значит,количество вещества карбоната кальция будет равно:
n (CaCO3) = ½ ×n (NaOH) = ½× 2,176 = 1,088моль.
Тогда масса карбоната кальция, вступившего в реакцию будет равна (молярная масса – 100 г/моль):
m (CaCO3) = 1,088 × 100 = 108,8г.
| Задание | Вычислите массу оксида кальция, который потребуется для получения карбоната кальция по реакции взаимодействия с диоксидом углерода массой 3,5 г. |
| Решение | Запишем уравнение реакции взаимодействия оксида кальция и диоксида углерода с образованием карбоната кальция: |
Рассчитаем количество вещества диоксида углерода (молярная масса – 44 г/моль):
n (CO2) = 3,5 / 44 = 0,08 моль.
n (CaO) = n (CO2) = 0,08 моль.
Найдем массу оксида кальция (молярная масса – 56 г/моль):
Карбонат кальция
| Карбонат кальция | |||
|---|---|---|---|
| |||
 | |||
| Систематическое наименование | карбонат кальция | ||
| Традиционные названия | углекислый кальций | ||
| Хим. формула | CaCO3 | ||
| Состояние | твёрдые белые кристаллы | ||
| Молярная масса | 100.0869 г/моль | ||
| Плотность | (кальцит) 2.74 г/см³ (арагонит) 2.83 г/см³ | ||
| Температура | |||
| • плавления | (кальцит) 825 °C, (арагонит) 1339 °C | ||
| • разложения | 900−1000 °C | ||
| Давление пара | 0 ± 1 мм рт.ст. | ||
| Константа диссоциации кислоты pKa | 9.0 | ||
| Растворимость | |||
| • в воде | (25 °C) 0,0014 г | ||
| Показатель преломления | 1,60 | ||
| Кристаллическая структура | тригональная, пространств. гр. 2/m | ||
| ГОСТ | ГОСТ 4530-76 | ||
| Рег. номер CAS | 471-34-1 | ||
| PubChem | 10112 | ||
| Рег. номер EINECS | 207-439-9 | ||
| SMILES | |||
| Кодекс Алиментариус | E170 | ||
| RTECS | FF9335000 | ||
| ChEBI | 3311 | ||
| ChemSpider | 9708 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
В природе встречается в виде многочисленных минералов, например, кальцита, арагонита и ватерита, является главной составной частью известняка, мрамора, мела, входит в состав скорлупы яиц птиц.
Нерастворим в воде и этаноле.
Зарегистрирован как белый пищевой краситель (E170).
Содержание
Применение
Используется как белый пищевой краситель E170. Являясь основой мела, используется для письма на досках. Используется в быту для побелки потолков, покраски стволов деревьев, для подщелачивания почвы в садоводстве.
Массовое производство/использование
Очищенный от примесей, карбонат кальция широко используется в бумажной и пищевой промышленности, в качестве наполнителя при производстве пластмасс, красок, резины, продукции бытовой химии, в строительстве.
При производстве бумаги карбонат кальция применяют одновременно в качестве отбеливателя, наполнителя, а также раскислителя.
Используется при производстве силикатного стекла, — материала для производства оконного стекла, стеклянных бутылок, стекловолокна.
Применяется при производстве предметов гигиены (например, зубной пасты), в медицине.
В пищевой промышленности часто используется в качестве препарата препятствующего слеживанию и для препятствования слипания в комки сухих молочных продуктах.
При употреблении сверх рекомендованной дозы (1,5 г в день) может вызывать молочно-щелочной синдром (синдром Бернетта). Рекомендован при болезнях костных тканей.
Производители пластмассы — одни из основных потребителей чистого карбоната кальция (более 50% всего потребления). Используемый в качестве наполнителя и красителя, карбонат кальция необходим при производстве поливинилхлорида (PVC), полиэфирных волокон (кримплен, лавсан, и т. п.), полиолефинов. Изделия из данных видов пластмасс распространены повсеместно — это трубы, сантехника, кафельная плитка, черепица, линолеум, ковровые покрытия, и т.п. Карбонат кальция составляет порядка 20% красящего пигмента, используемого при производстве красок.
В строительстве
Строительство — ещё один из основных потребителей карбоната кальция. Например, в качестве наполнителя шпаклёвок и герметиков.
Также карбонат кальция является важным составным элементом при производстве продукции бытовой химии — средств для чистки сантехники, кремов для обуви.
Карбонат кальция широко применяется для раскисления кислых почв.
Нахождение в природе
Карбонат кальция находится в минералах в виде полиморфов:
Тригональная кристаллическая структура кальцита является наиболее распространенной.
Минералы карбоната кальция находятся в следующих горных породах:
Геология
Залежи карбоната кальция в виде меловых пластов — отложений известковых раковин моллюсков, в основном, мелового периода является распространенным минералом на всех континентах.
В природе встречаются три кристаллические модификации (минералы с одинаковым химическим составом, но с различной кристаллической структурой): кальцит, арагонит и фатерит (ватерит).
Некоторые горные породы (известняк, мел, мрамор, травертин и другие известковые туфы) практически полностью состоят из карбоната кальция с различными примесями.
Кальцит является устойчивой кристаллической модификацией карбоната кальция и встречается в самых разнообразных геологических условиях: в осадочных, метаморфических и магматических горных породах.
Около 10 % всех осадочных пород составляют известняки, сложенные преимущественно кальцитовыми остатками раковин морских организмов. Арагонит является второй по распространённости кристаллической модификацией CaCO3 и в основном формируется в раковинах моллюсков и скелетах некоторых других организмов.
Также арагонит может образовываться и в неорганических процессах, например в карстовых пещерах или гидротермальных источниках.
Фатерит является наименее стабильной разновидностью этого карбоната, и очень быстро превращается в воде либо в кальцит, либо в арагонит. В природе встречается относительно редко, когда его кристаллическая структура стабилизирована теми или иными примесями.
Получение
Подавляющее количество карбоната кальция, добывающееся из полезных ископаемых, используется в промышленности. Чистый карбонат кальция (например, для производства продуктов питания или использования в фармацевтических целях), может быть изготовлен из природного минерала с малым количеством вредных примесей, например, из мрамора.
В лаборатории карбонат кальция может быть приготовлен предварительным гашением оксида кальция — негашеной извести. При этом образуется гидроксид кальция, и затем в суспензию продувается углекислый газ для получения карбоната кальция:
Химические свойства
При нагревании до 900—1000 °C разлагается на кислотный оксид — углекислый газ CO2 и основный оксид — негашёную известь CaO:
Растворяется в воде при избытке углекислого газа образуя кислую соль — гидрокарбонат кальция Ca(HCO3)2:
Из-за этой реакции образуются сталактиты, сталагмиты. Природные подземные воды, обильные углекислом газом, растворяют плохо растворимый карбонат кальция с образованием много лучше растворимого в воде гидрокарбоната кальция, при выделении подземной воды в виде капель с потолков пещер при попадании в воздух с низкой концентрацией углекислого газа происходит обратная реакция превращения гидрокарбоната кальция в плохо растворимый осадок карбоната кальция, образующего красивые природные формы в пещерах, и из-за этого же механизма образуются карстовые пещеры.
При обжиге с температурой свыше 1500 °C с углеродом, например, в форме кокса, образует карбид кальция и угарный газ:
CaCO3: разложение, получение, химические свойства, применение
Карбонат кальция – неорганическое соединение без запаха и вкуса, относящееся по классификации химических веществ к средним солям. Его химическая формула – CaCO3. Это соединение белого цвета, обычно входит в состав мела. Разложение CaCO3 происходит при его прокаливании в определенных условиях.
Получение
Чтобы получить это вещество, проводят смешивание в несколько этапов. Для начала производят известковое молоко (гидроксид кальция), путем взаимодействия твердого оксида кальция (СаО) и воды. Гидроксид в воде растворяется, поэтому его фильтруют до получения прозрачного раствора – известковой воды. Через нее уже пропускают углекислый газ (СО2), в результате чего она мутнеет, а потом образуется белый осадок в виде карбоната. Процесс осуществляется согласно следующим реакциям:
Также при определенной температуре происходит разложение СаСО3.
Химические свойства
Карбонат кальция в воде не растворяется и имеет молярную массу, равную 100 г/моль. Осуществляется разложение CaCO3 при температуре от 900 до 1000 градусов Цельсия. Так как соль образована слабой кислотой (Н2СО3) и сильным основанием (Са(ОН)2), то она гидролизуется по аниону, находясь в щелочной среде.
Карбонат кальция вступает в следующие реакции:
В настоящее время в Сети выложено много видео с реакциями этого вещества, где показан и процесс разложения CaCO3.
Применение
Карбонат кальция применяют в качестве пищевой добавки (краситель Е170), при производстве бытовой химии, шпатлевок в строительстве, полимеров, в медицине в качестве средства, восполняющего дефицит кальция.
Многоликий карбонат кальция: в природе, в промышленности, в быту.



Карбонат кальция (углекислый кальций) —неорганическое химическое соединение, соль угольной кислоты и кальция. Химическая формула — CaCO3.
Карбонат кальция является распространенным минералом. В природе встречаются три полиморфные модификации (минералы с одинаковым химическим составом, но с различной кристаллической структурой): кальцит, арагонит и фатерит (ватерит).
Некоторые горные породы (известняк, мел, мрамор, травертин и другие известковые туфы) практически полностью состоят из карбоната кальция с некоторыми примесями. Кальцит является стабильным полиморфом карбоната кальция и встречается в самом разнообразном геологическом окружении: в осадочных, метаморфических и магматических горных породах. Около 10 % всех осадочных пород составляют известняки, сложенные преимущественно кальцитовыми остатками раковин морских организмов. Арагонит является вторым по устойчивости полиморфом CaCO3 и в основном образуется в раковинах моллюсков и скелетах некоторых других организмов. Также арагонит может образовываться и в неорганических процессах, например в карстовых пещерах или гидротермальных источниках. Фатерит является наименее стабильной разновидностью этого карбоната, и очень быстро превращается в воде либо в кальцит, либо в арагонит. В природе встречается относительно редко, когда его кристаллическая структура стабилизирована теми или иными примесями
Известняки широко распространены в природе. Их огромные залежи, образовавшиеся миллионы лет назад из скелетов морских животных, составляют примерно 20% от общего количества осадочных пород. О месте и роли известняков в истории Земли говорит уже тот факт, что в геологии целая эпоха развития планеты называется меловым периодом.
Образовались известняки в результате не очень сложных, но длительных геохимических процессов. Реки ежегодно выносят в моря многие миллионы тонн извести в виде взвеси и в растворенном виде. При встрече речной воды с соленой морской образуется своеобразный «геохимический барьер», на котором растворимые соединения, в том числе и известь, выпадают в осадок, смешиваясь с илом. Часть бикарбоната кальция остается в растворенном состоянии и постепенно поглощается морскими растениями и животными.
В результате в течение миллионов лет огромное множество раковин погибших моллюсков и кораллов образовало колоссальные скопления углекислого кальция. Так возникли различные известняки, среди которых по породообразующим организмам различают коралловые, ракушечные, нуммулитовые, мшанковые, водорослевые и др.
Ракушечный карбонат кальция (или ракушечник) представляет собой довольно пористую породу, состоящую почти полностью из целых или раздробленных раковин морских организмов. Здесь встречаются раковины моллюсков разных видов, размеров.
Иногда внутренняя поверхность раковин покрыта щетками мелких прозрачных кристалликов кальцита. Если такой образец рассматривать при солнечном свете, то создается впечатление, что в камень вкраплены изысканные драгоценности.
Животные же класса мшанковых, напротив, характеризуются микроскопическими размерами: их длина доходит до 1 мм. Наибольшего разнообразия эти щупальцевые организмы достигали в палеозое, о чем свидетельствуют известняки с их окаменелостями.
Эти и другие разновидности известняков дают богатейший материал не только для геологии, но и для других наук, изучающих историю Земли: палеонтологии, палеоботаники и пр.
По форме слагающих компонентов выделяют также известняки оолитовые (гранулы 0,2-2 мм) и пизолитовые (гранулы и конкреции более 2 мм).
Интереснейшими проявлениями карбоната кальция являются сталактиты и сталагмиты. Эти пещерные образования, которые терпеливо создает природа, не только потрясают воображение, но и способны навевать поэтические настроения, как, например, у Сюлли-Прюдома:
Если присмотреться, то можно увидеть, что поверхность сталактитов из-за проступающих в некоторых местах мелких кристалликов кальцита кажется сахаристой, а под бугристо-сахаристой корочкой карбонатной породы обнаруживаются прозрачные, солнечно-желтоватые, иногда с радужной поверхностью кристаллы кальцита.
Иногда из этой грубой, «невзрачной» известняковой породы выкристаллизовываются роскошные каменные цветы. В трещинах, прожилках, жеодах можно обнаружить кристаллы кальцита, сросшиеся в пучки, напоминающие хризантемы, георгины, гвоздики. А на изломе внешне ничем не примечательного известнякового камня вдруг «расцветает» изысканная кальцитовая «ромашка». Схожесть с цветами усиливается окраской кальцитовых кристаллов, которые в зависимости от примесей могут быть коричневыми, желтыми, бежевыми, красными, розовыми, белыми или бесцветными.
Известняки химического происхождения встречаются в виде плотных известняков; оолитовых известняков; известкового туфа.
Известняки применяются в качестве строительного материала в цементной промышленности, в металлургии. В размолотом виде карбонат кальция используется как удобрение.
Минерал, основный карбонат меди. Образует зелёные массы натёчной формы с радиально-волокнистым строением. Кристаллы мелкие, имеют столбчатый, пластинчатый, игольчатый вид. Красивейший поделочный камень насыщенно зеленого цвета.
Входит в состав раковин и эндоскелета большинства скелетных беспозвоночных, а также покровных структур некоторых одноклеточных организмов. Широко применяется в строительстве и химических производствах. В чистом виде кальцит белый или бесцветный.
Из примесей наибольшее значение имеет Fe; меньше Mn, Ca. Используют для производства огнеупоров и вяжущих материалов, в химической промышленности. Может быть бесцветный, белый, серо-белый, желтоватый, коричневый, сиреневато-розовый.
Натуральный камень белого, чаще молочного цвета, в основе которого крепкие панцири и раковины морских обитателей. Можно облицовывать марши крылечных лестниц и террасы. Натуральный состав ракушечника «разбавляет» песок — от 5 до 40%.
Образует призматические, столбчатые, таблитчатые, игольчатые и копьевидные кристаллы. Входит в состав перламутрового слоя раковин многих видов моллюсков, в экзоскелет кораллов. Арагонитом сложены тончайшие слои жемчуга. Меняет окраску от бесцветной до черной.
В ряде случаев включает примеси глинистых минералов, доломита, кварца, реже гипса, пирита и органических остатков, которые определяют название известняков. Обычно светло-серого цвета. Имеет универсальное применение в промышленности, сельском хозяйстве и строительстве.
Исландский шпат CaCO3
Кристаллы ромбической формы. Строение делает этот камень простым в обработке. Высокое двойное лучепреломление света. Кристаллы имеют различную окраску, преимущественно бледного с примесями. Используется в оптических и оптоэлектронных системах
Цвет — бесцветный или белый, желтоватый, буроватый (за счёт примеси гидроксидов железа и глинистых частиц). Спайность совершенная. Широко используется в строительстве. Ассоциируется с кальцитом, обладающим сходными диагностическими признаками
Цвет желтовато-белый, серый, красновато-коричневый, бледно-зелёный, иногда белый. Важная руда для получения железа. Присутствует практически во всех разновидностях окисленных железистых кварцитов. Используется в горном деле, как утяжелитель буровых растворов, и металлургической промышленности.
Метаморфическая горная порода, состоящая только из кальцита с примесями других минералов. Имеет различную окраску в зависимости от примесей. Используется для строительства.
Мраморный оникс CaCO3
Своеобразная разновидность мрамора с полосами. Образовался вследствие слияния и наслаивания расплавившихся горных пород. Полосы в камне бывают разного характера. Очень популярный поделочный камень.
Лазурит на карбонате 2CuCO3-Cu(OH)2
Представляет собой голубой карбонат меди, сопутствует малахиту и имеет сходное с ним происхождение. По химическому составу лазурит представляет собой водный карбонат меди. Минерал синего цвета со стеклянным блеском, хрупкий.
Карбонат кальция: строение, свойства, образование, применение
Видео: Карбонат кальция: строение, свойства, образование, применение
Содержание:
В карбонат кальция представляет собой неорганическое соединение, химическая формула которого CaCO3. В основном он содержится в таких минералах, как кальцит и арагонит. Он также составляет известняк, осадочную породу, в которой присутствует минерал кальцит.
Этот важный карбонат металла получают промышленным путем путем добычи и измельчения содержащих его минералов; В основном для этой цели используется мрамор. Другой процесс заключается в использовании оксида кальция, который превращается в гидроксид кальция, осаждая из него карбонат кальция путем добавления диоксида углерода. Таким способом получаются кристаллы самых разных размеров.
Их также можно использовать для промышленного производства CaCO.3, в малых масштабах, скорлупа моллюсков, скорлупа яиц и устрицы, в которых она присутствует.
Карбонат кальция, присутствующий в известняке, растворяется диоксидом углерода в воде, образуя бикарбонат кальция. Это действие может вызвать образование пещер и вызвать защелачивание воды; событие, имеющее большое значение для поддержания жизни в нем.
Карбонат кальция имеет множество применений в промышленности в качестве наполнителя для пластика и бумаги. В медицине он используется для контроля кислотности желудочного сока; как пищевая добавка кальция; для контроля фосфатемии у пациентов с хронической почечной недостаточностью и др.
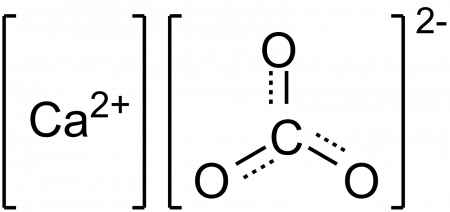
Состав
Формула карбоната кальция, CaCO3, указывает на то, что соотношение ионов Са 2+ и CO3 2- 1: 1; то есть для каждого Ca 2+ есть СО3 2- двойник взаимодействует с ним электростатически. Таким образом, ионная связь приводит к тому, что эти ионы образуют структурные узоры, определяющие кристалл.
Эта гексагональная фаза (β-CaCO3) соответствует полиморфу. Есть еще два: орторомбический (λ-CaCO3) и еще более плотный гексагональный (μ-CaCO3). Изображение ниже помогает лучше визуализировать счастливый шестиугольник:
Однако в зависимости от температуры (и для этой соли, в меньшей степени, от давления) ионы в своих колебаниях перестраиваются в другие структуры; это уже упомянутые полиморфы (β, λ и μ).
Как они звучат, они не очень хорошо известны, если только они не будут упомянуты вместе с их минералогическими названиями в будущих разделах.
Жесткость белка
Кристаллы CaCO3 Они не одиноки: они могут содержать примеси, такие как катионы других металлов, которые их окрашивают; или белки, включающие органическую матрицу, которая так или иначе способствует его естественной твердости.
Белки уменьшают напряжение, которое кристаллы испытывают друг относительно друга под давлением или ударами. Как? Когда он зажат между стеклами, действует как «прокладка» (аналогично набору «кирпич-цемент-кирпич»).
Вот почему это соединение или минерал является биосовместимым, и неудивительно, что он входит в состав ногтей, ракушек, ракушек или костей ежей. Это стало источником вдохновения для тех, кто занимается разработкой новых материалов.
Свойства
Другие имена
Молярная масса
Физическое описание
Белый порошок без запаха.
Вкус
Точки плавления и кипения
Он разлагается за счет выделения CO2 прежде, чем он даже растает или закипит.
Растворимость
Практически не растворим в воде и спирте. Быстро растворяется в разбавленных уксусной и соляной кислотах. Однако гидроксиды снижают его растворимость. Между тем соли аммония и диоксид углерода увеличивают растворимость карбоната кальция в воде.
Плотность
Разложение
При температуре около 825 ºC он разлагается на оксид кальция (известь) и диоксид углерода (CO2).
pH
Показатель преломления
-1,7216 при 300 нм и 1,6584 при 589 нм (кальцит).
-1,5145 при 300 нм и 1,4864 при 589 нм (арагонит).
Несовместимости
С кислотами, квасцами и солями аммония.
Энтальпия плавления
36 кДж / моль при 800 ° C (кальцит).
Константа произведения растворимости
Твердость
Фазовые переходы
Арагонит является метастабильным и необратимо превращается в кальцит при нагревании на сухом воздухе до 400 ° C.
Реактивность
Карбонат кальция реагирует с кислотами, выделяя диоксид углерода, ионный кальций и воду.
Карбонат кальция соединяется с водой, насыщенной диоксидом углерода, что эквивалентно угольной кислоте (H2CO3), с образованием бикарбоната кальция.
Обучение
Мел, мрамор и известняк, первые два минерала и скалистый материал третий, содержат карбонат кальция и имеют осадочное происхождение. Считается, что они образовались в результате отложения улиток в течение миллионов лет.
PH может быть наиболее важным фактором в образовании полиморфов при температуре 24ºC. Ватерит является основным продуктом в диапазоне pH от 8,5 до 10; арагонит имеет pH 11; и кальцит при pH> 12.
Кроме того, известно, что многие пресноводные водоросли образуют кристаллы кальцита при выращивании в среде, насыщенной кальцием. Кроме того, микроводоросли способны вызывать осаждение карбоната кальция.
Формы карбоната кальция
На изображениях ниже показаны три основные формы или полиморфы карбоната кальция:
Сверху вниз представлены полиморфы кальцита, арагонита и фатерита. Обратите внимание с первого взгляда на разницу между морфологией его кристаллов (цвет типичен для его происхождения и характеристик окружающей среды).
Ватерит более непрозрачен, чем кальцит, последний даже становится полностью прозрачным (исландский шпат) и поэтому используется в ювелирных изделиях и оптике. Между тем кристаллы арагонита напоминают небольшие вытянутые монолиты.
Если образцы этих трех полиморфов наблюдать под электронным микроскопом, их кристаллы (с сероватыми тонами из-за того, что метод не позволяет разрешать цвет), будут обнаружены те же морфологии, что и в макроскопических масштабах; то есть невооруженным глазом.
Среди этих трех полиморфов кальцит является наиболее распространенным и стабильным, за ним следует арагонит и, наконец, ватерит, самая редкая из форм CaCO.3
Приложения
Промышленное
Карбонат кальция увеличивает сопротивление скручиванию и растяжению синтетического и натурального каучука, сохраняя его эластичность. Он используется в строительной промышленности в качестве ингредиента в цементе и в качестве сырья для производства извести. Его использование было сокращено, потому что он поврежден кислотными дождями.
Карбонат кальция используется для очистки железа. В форме извести удаляет присутствующий в металле диоксид серы. Используется для очистки свеклы от сахара. Когда-то он использовался как мел для школьной доски, но теперь его заменили гипсом.
Карбонат кальция смешивают со шпатлевкой, которая используется при установке стекла. Грунт используется в качестве наполнителя микропористой пленки, используемой в подгузниках. Он также используется в качестве наполнителя в пластиках, таких как ПВХ. Кроме того, это увеличивает прочность пластика.
Карбонат кальция используется для увеличения укрывистости красок. Он используется в качестве наполнителя для бумаги, потому что он дешевле древесного волокна и может составлять более 10% бумаги.
Врачи
Он используется в качестве антацида для борьбы с повышенной кислотностью желудка и облегчения расстройства желудка. Он используется в качестве пищевой добавки с кальцием, а также для лечения и профилактики остеопороза. Он используется при лечении гиперфосфатемии у пациентов с хронической почечной недостаточностью.
Он использовался для уменьшения нежелательных эффектов ингибиторов протеазы, используемых при лечении ВИЧ, с уменьшением диареи, наблюдаемой у пациентов.
Он вызывает снижение артериального давления у беременных с гипертонией и преэклампсией, поскольку оба эти фактора могут быть связаны с повышенным потреблением кальция из-за присутствия плода.
Другие
Карбонат кальция используется в сельском хозяйстве в качестве удобрения и для борьбы с кислотностью почвы. Он используется как консервант, фиксатор цвета и укрепление пищевых продуктов.
Кроме того, он входит в состав зубной пасты и служит абразивом в виде порошка при чистке и стирке.
Кальций углекислый — востребованный промышленный реактив
Кальций углекислый — неорганическое вещество, 
Соединение распространено в естественной среде в виде различных минералов, его можно встретить в животном мире. Кальцит, арагонит и ватерит почти полностью состоят из CaCO3. Его много в мраморе, доломите, меле, известняке, скорлупе яиц птиц и пресмыкающихся, в раковинах моллюсков.
Для промышленности реактив получают очисткой природного сырья от содержащихся в нем примесей.
Свойства
Кальций углекислый — практически не водорастворимое мелкокристаллическое вещество белого цвета, без вкуса и запаха. Не растворим в этиловом спирте. Разлагается при нагревании. Не токсичен. Не горит и не взрывается.
В обычных условиях в воде не растворим, но в присутствии двуокиси углерода переходит в форму гидрокарбоната кальция Ca(HCO3)2. Взаимодействует с кислотами. Реагирует с углеродом: при обычных температурах образуется оксид кальция CaO и угарный газ CO; при очень высоких температурах (процесс обжига) образуется карбид CaC2. Реагирует с галогеноводородами, оксидами и многими другими соединениями.
 |  |
| Банка для реактивов 2000 мл, с делениями | Кальций углекислый ч,пищ., имп. Е170 (кальций карбонат, кальцит) |
Это интересно
На свойстве карбоната кальция образовывать с водой и двуокисью углерода водорастворимый бикарбонат основано все разнообразие сталагмитов, сталактитов и карстовых пещер. В подземных водах обычно содержится много углекислоты, поэтому они растворяют углекислый кальций, образуя бикарбонат. Капли воды, богатые гидрокарбонатом, просачиваются в пещеру, в воздухе которой углекислоты почти нет. Происходит обратная химическая реакция и гидрокарбонат выпадает в осадок, превращаясь в нерастворимый карбонат. Так постепенно образуются наросты на полу и потолках пещер. Карстовые пещеры образуются по такому же принципу — подземные потоки постепенно растворяют и вымывают карбонат кальция из горной породы, оставляя пустоты разных форм и размеров.
Применение
• Более половины всего производимого реактива используется для изготовления пластиков (ПВХ, лавсана, кримплена, полиолефинов). Вещество применяется при изготовлении труб, сантехнических изделий, оконных пакетов, кафеля, линолеума и многого другого.
• В резинотехнической, лакокрасочной индустрии, в производстве отделочных материалов — наполнитель и краситель.
• В целлюлозно-бумажной отрасли — для отбеливания, как наполнитель и нейтрализатор кислоты.
• Наполнитель шпаклевок и герметиков в строительстве.
• Для изготовления оконных стекол, стеклотары, стекловолокна в стекольной отрасли.
• В фармакологии — наполнитель в таблетках; для получения лекарств для лечения пониженной свертываемости крови, заболеваний костных тканей, сердца, ЖКТ. Препараты углекислого кальция показаны при изжоге, раке молочной железы, для профилактики остеопороза, детского рахита и кариеса.
• Краситель Е170, антислеживающий агент в пищепроме.
• В производстве зубных паст, продуктов гигиены.
• Для изготовления бытовой химии, например, чистящих средств, обувных кремов.
• В сельском хозяйстве и садоводстве — для нейтрализации почв с высокой кислотностью; как известковое удобрение.
• Входит в состав школьного мела.
• Для побелки стволов деревьев и защиты их от УФ-излучения и грызунов.
• Реактив высокой чистоты востребован для производства люминофоров.
Карбонат кальция, характеристика, свойства и получение, химические реакции
Карбонат кальция, характеристика, свойства и получение, химические реакции.
Карбонат кальция – неорганическое вещество, имеет химическую формулу СаСО3.
Краткая характеристика карбоната кальция:
Карбонат кальция – неорганическое вещество белого цвета.
Химическая формула карбоната кальция СаСО3.
Карбонат кальция при прокаливании разлагается. Однако при избыточном давлении углекислого газа (СО2) плавится без разложения.
Встречается в виде трех кристаллических модификаций:
– кальцита (известняк, мел, мрамор);
– фатерита или ватерита.
Кальцит и арагонит являются устойчивыми кристаллическими модификациями. Фатерит является наименее стабильной разновидностью карбоната кальция, и очень быстро превращается в воде либо в кальцит, либо в арагонит. Фатерит в природе встречается относительно редко.
Зарегистрирован как белый пищевой краситель E170.
Физические свойства карбоната кальция:
| Наименование параметра: | Значение: |
| Химическая формула | СаСО3 |
| Синонимы и названия иностранном языке | calcium carbonate (англ.) |
углекислый кальций (рус.)
Получение карбоната кальция:
Промышленный способ получения карбоната кальция заключается в разработке его месторождений в природе.
В лаборатории карбонат кальция получают гашением негашеной извести и последующим продуванием углекислого газа.
Так как гидроксид кальция растворяется в воде в небольшом количестве, то после отфильтровывания известкового молока получается прозрачный раствор – известковая вода, которая мутнеет при пропускании через неё диоксида углерода (углекислого газа). В результате образуется карбонат кальция, который выпадает в осадок.
Химические свойства карбоната кальция. Химические реакции карбоната кальция:
Карбонат кальция – это средняя соль, образованная сильным основанием (гидроксид кальция Ca(OH)2) и слабой кислотой (угольная кислота H2CO3).
Водные растворы CaCO3 имеют слабую щелочную реакцию.
1. реакция термического разложения карбоната кальция – обжиг известняка:
В результате реакции образуются оксида кальция и оксид углерода (IV). Обжиг известняка – это промышленный способ получения углекислого газа. Технологически этот процесс в промышленности реализуют в специальных шахтных печах.
2. реакция карбоната кальция и углерода (графита, кокса):
CaCO3 + C → CaO + 2CO (t = 800-850 °C).
В результате реакции образуются оксид кальция и оксида углерода (II).
3. реакция карбоната кальция и фтороводорода:
4. реакция взаимодействия карбоната кальция и сероводорода:
В результате реакции образуются сульфид кальция, вода и оксид углерода (IV).
Аналогичные реакции протекают и с другими галогеноводородами.
5. реакция взаимодействия карбоната кальция и азотной кислоты:
6. реакция взаимодействия карбоната кальция и угольной кислоты:
В результате реакции образуется гидрокарбонат кальция.
7. реакция взаимодействия карбоната кальция и бромной кислоты:
В результате реакции образуются бромат кальция, вода и оксид углерода (IV).
Аналогично проходят реакции карбоната кальция и с другими кислотами.
8. реакция взаимодействия карбоната кальция, оксида углерода (IV) и воды:
В результате реакции образуется гидрокарбонат кальция. Реакция протекает при комнатной температуре.
9. реакция взаимодействия карбоната кальция и оксида кремния:
В результате реакции образуются метасиликат кальция и оксида углерода (IV).
10. реакция взаимодействия карбоната кальция и оксида титана:
В результате реакции образуются титанат кальция и оксида углерода (IV). Реакция протекает при сплавлении реакционной смеси.
11. реакция взаимодействия карбоната кальция, оксида серы и кислорода:
В результате реакции образуются сульфат кальция и оксида углерода (IV). Данная реакция представляет собой метод очистки смеси газов от SO2.
12. реакция взаимодействия карбоната кальция, оксида свинца и кислорода:
13. реакция взаимодействия карбоната кальция и гидроксида натрия:
В результате реакции образуются карбонат натрия и гидроксид кальция. При этом гидроксид натрия в качестве исходного вещества используется в виде водного раствора.
14. реакция взаимодействия карбоната кальция и хлорида аммония:
В результате реакции образуются хлорид кальция, аммиак, вода и оксид углерода (IV). Реакция протекает при кипении.
15. реакция взаимодействия карбоната кальция и сульфида калия:
В результате реакции образуются карбонат калия и сульфид кальция.
16. реакция взаимодействия карбоната кальция и сульфида натрия:
В результате реакции образуются карбонат натрия и сульфид кальция.
Применение и использование карбоната кальция:
Карбонат кальция используется во множестве отраслей промышленности и для бытовых нужд:
– для письма на досках;
– в быту для побелки потолков, покраски стволов деревьев;
– в целлюлозно-бумажной промышленности – в производстве бумаги в качестве отбеливателя, наполнителя, а также раскислителя;
– в качестве пищевой добавки в пищевой промышленности;
– при производстве предметов гигиены (например, зубной пасты) и лекарственных средств;
– при производстве силикатного стекла ;
– в качестве наполнителя при производстве шпаклёвок и герметиков,
Примечание: © Фото //www.pexels.com, //pixabay.com
карбонат кальция реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие карбоната кальция
реакции
Польза и вред карбоната кальция
Пищевая добавка карбонат кальция обозначается как Е 170 и в природе встречается в виде привычного мела. Вещество относится к неорганическим пигментам и используется в пищевой промышленности, медицине, строительстве, других отраслях.
Карбонат кальция не растворяется в воде и спирте, обладает свойствами разрыхлителя, антиокислителя, красителя. В материале разберем, какую пользу несет вещество и ознакомимся с оптимальными дозировками, чтобы исключить опасные побочные эффекты.
Состав пищевой добавки Е 170
Химическая формула добавки Е 170 — CaCO3. Очищенный мел поступает в продажу в форме белого порошка мелкой фракции. Источником карбоната служит мрамор. Также соль угольной кислоты присутствует в панцирях ракообразных и моллюсков.
Где добывают карбонат кальция?
Для изготовления промышленной добавки Е 170 берут природное сырье, которое содержится в минералах: ватерите, арагоните, кальците. Источником углекислого кальция также служат мрамор, известняк, мел. Сырье перерабатывают и очищают от примесей перед продажей. Наиболее ценен карбонат кальция, полученный из мрамора.
Ведущие производители добавки — 10 европейских компаний, включая Omya (Швейцария) и Imerys (Франция). С начала XXI века заводы по переработке углекислого кальция действуют в Китае. Свои меловые месторождения есть и в России. Карбонаты добывают в Белгородской и Воронежской областях. Промышленным производством занимаются предприятия АО «Мелстром», ООО «Воронежглавмел» и ОАО «Клинцевский силикатный завод».
Краситель Е170 (карбонат кальция) — вреден или нет?
Потребляемый в разумных дозировках карбонат кальция вред организму не наносит. По этой причине пищевой краситель разрешен к применению в России. При превышении суточной нормы вещество может вызвать отравление, симптомами которого становятся:
Избежать этих неприятных последствий помогает соблюдение дозировки.
В сутки медики рекомендуют применять взрослому человеку не более 1,2–1,5 г карбоната кальция.
Применение карбоната кальция в промышленности
Углекислый кальций используется сразу в нескольких отраслях промышленности.
Кроме того, вещество используется при производстве очистных сооружений и фильтров, а также в сельском хозяйстве — для восстановления кислотности грунта.
Применение в продуктах питания
Природный карбонат кальция применим в кулинарии как натуральный пищевой краситель, разрыхлитель, регулятор кислотности, наполнитель.
Также вещество предупреждает слеживание и комкование сыпучих изделий.
Карбонат кальция встречается в составе молочных и молочнокислых продуктов: сыра, сгущенки, сливок, йогуртов. Также полезную добавку используют при приготовлении детского питания, консервов, шоколадных плиток.
Польза и вред карбоната кальция для организма
Как мы уже выяснили, карбонат кальция не несет вреда организму. Доказательством тому служит использование в фармацевтике: вещество присутствует в БАДах и витаминных препаратах, направленных на устранения дефицита кальция.
Польза Е 170 очевидна: вещество поддерживает жизнедеятельность организма, стабилизирует кровяное давление, стимулирует работу сердечной мышцы, отвечает за свертываемость крови и формирование костных структур.
Для лучшего усвоения карбонат кальция рекомендуется употреблять совместно с витамином D.
Польза и вред карбоната кальция
Чтобы понять, наносит ли карбонат кальция вред или дает пользу, важно разобраться в особенностях его состава. Природный минерал, известный всем нам как белый мел, химическая наука относит к красящим веществам неорганического происхождения. В действующей классификации пищевых добавок карбонату кальция присвоен код Е 170.
В естественных условиях вещество:
Кроме того, кальций является частью яичной скорлупы, а также беспозвоночных организмов: губок, моллюсков и пр. Собственно, окаменевшие останки этих животных считаются основным источником образования карбоната в природной среде.
Е170 — что за состав?
По химическому составу карбонат кальция относится к солям угольной кислоты. Лабораторный процесс получения этого вещества двухступенчатый:
Очищенный кальций, т. е. краситель Е 170, — белый порошок, который не растворяется в воде и этиловом спирте.
Где добывают карбонат кальция?
Залежи карбоната кальция в форме меловых отложений имеются на всех континентах. Добычей занимается множество компаний, но 70 % производства принадлежит десятку фирм из Европы, среди которых лидируют швейцарская Omya и французская Imerys. Однако около 10 лет назад добычей природных карбонатов и изготовлением Е 170 активно занялись китайские предприятия. Сейчас их доля на рынке постоянно растет, постепенно сужая сбыт европейской продукции.
Меловые пласты, пригодные для добычи карбоната кальция, есть и на российской территории, например, в Белгороде и Воронеже.
Лучший порошок получается в результате промышленной обработки мрамора. Для изготовления фармацевтического компонента и пищевого красителя Е 170 камень подвергается измельчению и многоступенчатой очистке.
Применение карбоната кальция в промышленности
Физико-химические свойства карбоната кальция обусловили широкий потенциал его применения в разных отраслях промышленности. Мел используется при производстве:
Также природный карбонат кальция задействуется в разнообразных промышленных системах очистки. Он эффективно заменяет опасные синтетические препараты, чем помогает сохранять экологию. Углекислый кальций полезен для сельхозугодий — с его помощью восстанавливают и поддерживают кислотно-щелочной баланс почвы.
Применение в продуктах питания
При производстве продуктов питания очищенный карбонат кальция играет тройную роль:
Помимо карбоната производители продуктов питания используют для улучшения их свойств цитрат (соль лимонной кислоты) и другие добавки, закодированные буквой Е и цифровыми обозначениями.
Вреден или нет краситель Е170 (карбонат кальция) в пище?
Поступающий в нормальных количествах в организм вместе с пищей карбонат кальция вреда не наносит. Потенциальная опасность существует только при значительной передозировке вещества. Переизбыток Е 170, т. е. гиперкальцемия, может выражаться приступами рвоты и тошноты, болями в животе, раздражительностью, нарушением координации движений. Но повторимся — это редчайшие ситуации, когда человек существенно злоупотреблял пищевой добавкой.
Разрешенная медиками доза углекислого кальция составляет 1,2–1,5 грамма. В продуктах питания количество добавки Е 170 значительно меньше, поэтому она считается максимально безопасной. О безвредности этого компонента пищи свидетельствует тот факт, что вещество законодательно разрешено к использованию практически во всех странах, включая РФ.
Фармацевтическая польза и вред карбоната кальция для организма человека
Карбонат кальция способен положительно влиять на состояние человеческого организма, обеспечивая комплексную пользу:
Благодаря этим свойствам карбонат используют в составе фармацевтических биоактивных добавок. Правильно дозированное применение таких препаратов помогает компенсировать дефицит кальция. Однако польза обеспечивается только качественным, хорошо очищенным веществом природного происхождения.
Вред от использования меловых добавок, напомним, может быть связан только с передозировкой.
Карбонат кальция, характеристика, свойства и получение, химические реакции


Краткая характеристика карбоната кальция:
Карбонат кальция – неорганическое вещество белого цвета.
Химическая формула карбоната кальция СаСО3.
Карбонат кальция (углекислый кальций) – неорганическое химическое соединение, соль угольной кислоты и кальция.
Практически не растворяется в воде. Не растворяется в этаноле. Легко растворяется в кислотах с выделением углекислого газа.
Карбонат кальция при прокаливании разлагается. Однако при избыточном давлении углекислого газа (СО2) плавится без разложения.
Карбонат кальция – основная составная часть осадочных и горных пород (известняк, мел, мрамор, доломит, травертин, арагонит, известковые туфы), а также входит в состав скорлупы яиц птиц. Природные запасы карбоната кальция огромны, является распространенным минералом, обнаружен на всех континентах Земли. Некоторые из указанных горных пород практически полностью состоят из карбоната кальция с небольшими примесями.
Встречается в виде трех кристаллических модификаций:
– кальцита (известняк, мел, мрамор);
– фатерита или ватерита.
Кальцит и арагонит являются устойчивыми кристаллическими модификациями. Фатерит является наименее стабильной разновидностью карбоната кальция, и очень быстро превращается в воде либо в кальцит, либо в арагонит. Фатерит в природе встречается относительно редко.
Зарегистрирован как белый пищевой краситель E170.
Месторождения камня известняка
Некоторые горные цепи целиком сложены из этого минерала. Широко распространена порода в массивах Альп и Крыма.
Из континентов богата камнем ещё Северная Америка, а вот Австралия в этом смысле отстала: её образующие породы кальцита не содержат.
Самые плодоносные месторождения сосредоточены на Кавказе, в Сибирском регионе, на Урале. Китай – важный поставщик строительной разновидности минерала – мергеля.
Очень перспективным современным источником известняка признано Ждановское месторождение, которое разработано на территории РФ в Оренбургской области.
Физические свойства карбоната кальция:
| Наименование параметра: | Значение: |
| Химическая формула | СаСО3 |
| Синонимы и названия иностранном языке | calcium carbonate (англ.) углекислый кальций (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | белые тригональные кристаллы |
| Цвет | белый |
| Вкус | без вкуса |
| Запах | без запаха |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность арагонита (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 2830 |
| Плотность арагонита (состояние вещества – твердое вещество, при 20 °C), г/см3 | 2,83 |
| Плотность кальцита (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 2740 |
| Плотность кальцита (состояние вещества – твердое вещество, при 20 °C), г/см3 | 2,74 |
| Температура разложения, °C | 900-1000 |
| Температура плавления арагонита, °C | 1339 |
| Температура плавления кальцита, °C | 825 |
| Молярная масса, г/моль | 100,0869 |
| Растворимость в воде (25 oС), г/л | 0,013 |
Влажность
При воздействии воды физические свойства мела начинают изменяться. В частности снижается его прочность. Изменения происходят уже при 1-2% влажности. При 25-35% в 2-3 раза увеличивается прочность на сжатие. Вместе с этим проявляются другие физические свойства мела. Порода становится пластичной. Это проявление существенно осложняет процесс переработки вещества. В ходе этого мел начинает налипать на элементы машин (на ковш экскаватора, ленточный конвейер, питатель, кузов транспортного средства). Зачастую физические свойства мела (вязкость и пластичность) не позволяют осуществлять добычу с нижних горизонтов, хотя здесь он считается качественным.
Получение карбоната кальция:
Промышленный способ получения карбоната кальция заключается в разработке его месторождений в природе.
В лаборатории карбонат кальция получают гашением негашеной извести и последующим продуванием углекислого газа.
Оксид кальция (негашеная известь) смешивается с водой. В результате образуется так называемое известковое молоко (гидроксид кальция).
CaO + H2O → Ca(OH)2.
Так как гидроксид кальция растворяется в воде в небольшом количестве, то после отфильтровывания известкового молока получается прозрачный раствор – известковая вода, которая мутнеет при пропускании через неё диоксида углерода (углекислого газа). В результате образуется карбонат кальция, который выпадает в осадок.
Ca(OH)2 + CO2 → CaCO3.
Откуда берутся школьные мелки
Каждый ребенок знает обычный мел, не раз держал его у доски или рисовал на асфальте. А сколько открытий и истин было совершено с помощью ничем не примечательного белого кусочка. Как же из рассыпчатого порошка получаются прочные кирпичики? Может его смешивают с клеем? Оказывается, главное связующее вещество — гипс, а способ изготовления называется метод литья.
Предварительно очищенный от песчинок меловой порошок смешивают в смесителе с гипсом и красителями. Затем смесь ссыпают в бочку и вручную разводят до получения однородной массы. Готовый раствор с помощью шпателя в течение 15 минут, пока он не застыл, разливают по резиновым пресс-формам. Гипс, как и цемент, быстро схватывается, вступая в реакцию с водой.
После того как смесь застынет, изделия извлекают из формы. Для этого ее накрывают металлической решеткой и аккуратно переворачивают, а затем легким постукиванием мелки выбивают из ячеек и отправляют в печь. В течение 40 минут вся содержащаяся в них влага испаряется, и кирпичики мела становятся твердыми и готовыми к использованию.
Человечество всегда будет волновать тема окружающего мира, каким он станет в будущем. По многочисленным докладам и сообщениям ученых, численность населения к 2100 году достигнет 10 миллиардов человек, что неминуемо приведет к истощению минеральных ресурсов, на образование которых потребовались миллионы лет. Главный путь решения проблемы — рациональное и комплексное использование исчерпаемых и невозобновляемых ресурсов.
Химические свойства карбоната кальция. Химические реакции карбоната кальция:
Карбонат кальция – это средняя соль, образованная сильным основанием (гидроксид кальция Ca(OH)2) и слабой кислотой (угольная кислота H2CO3).
Водные растворы CaCO3 имеют слабую щелочную реакцию.
Химические свойства карбоната кальция аналогичны свойствам карбонатов других металлов. Поэтому для него характерны следующие химические реакции:
1. реакция термического разложения карбоната кальция – обжиг известняка:
CaCO3 → CaO + CO2 (t = 900-1200 °C).
В результате реакции образуются оксида кальция и оксид углерода (IV). Обжиг известняка – это промышленный способ получения углекислого газа. Технологически этот процесс в промышленности реализуют в специальных шахтных печах.
2. реакция карбоната кальция и углерода (графита, кокса):
CaCO3 + C → CaO + 2CO (t = 800-850 °C).
В результате реакции образуются оксид кальция и оксида углерода (II).
3. реакция карбоната кальция и фтороводорода:
CaCO3 + 2HF → CaF2 + CO2 + H2O.
В результате реакции образуются фторид кальция, оксид углерода (IV) и вода. При этом фтороводород в качестве исходного вещества используется в виде разбавленного раствора.
4. реакция взаимодействия карбоната кальция и сероводорода:
CaCO3 + H2S → CaS + H2O + CO2 (t = 900 °C).
В результате реакции образуются сульфид кальция, вода и оксид углерода (IV).
Аналогичные реакции протекают и с другими галогеноводородами.
5. реакция взаимодействия карбоната кальция и азотной кислоты:
CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 + H2O.
В результате реакции образуются нитрат кальция, оксид углерода (IV) и вода.
6. реакция взаимодействия карбоната кальция и угольной кислоты:
CaCO3 + H2CO3 → Ca(HCO3)2.
В результате реакции образуется гидрокарбонат кальция.
7. реакция взаимодействия карбоната кальция и бромной кислоты:
CaCO3 + 2HBrO3 → Ca(BrO3)2 + H2O + CO2.
В результате реакции образуются бромат кальция, вода и оксид углерода (IV).
Аналогично проходят реакции карбоната кальция и с другими кислотами.
8. реакция взаимодействия карбоната кальция, оксида углерода (IV) и воды:
CaCO3 + CO2 + H2O → Ca(HCO3)2.
В результате реакции образуется гидрокарбонат кальция. Реакция протекает при комнатной температуре.
9. реакция взаимодействия карбоната кальция и оксида кремния:
CaCO3 + SiO2 → CaSiO3 + CO2 (t ≈ 800 °C).
В результате реакции образуются метасиликат кальция и оксида углерода (IV).
10. реакция взаимодействия карбоната кальция и оксида титана:
CaCO3 + TiO2 → CaTiO3 + CO2 (t = 800-1100 °C).
В результате реакции образуются титанат кальция и оксида углерода (IV). Реакция протекает при сплавлении реакционной смеси.
11. реакция взаимодействия карбоната кальция, оксида серы и кислорода:
2CaCO3 + 2SO2 + O2 → 2CaSO4 + 2CO2.
В результате реакции образуются сульфат кальция и оксида углерода (IV). Данная реакция представляет собой метод очистки смеси газов от SO2.
12. реакция взаимодействия карбоната кальция, оксида свинца и кислорода:
4CaCO3 + 2PbO + O2 → 2Ca2PbO4 + 4CO2 (t ≈ 800 °C).
В результате реакции образуются ортоплюмбат кальция и оксида углерода (IV). Первоначально карбонат кальция и оксид свинца хорошо смешивают друг с другом. Смесь нагревают в трубке для сожжения в потоке воздуха, свободного от диоксида углерода, до среднекрасного каления (около 800°C). Температура не должна превышать 850°C.
13. реакция взаимодействия карбоната кальция и гидроксида натрия:
CaCO3 + 2NaOH → Na2CO3 + Ca(OH)2.
В результате реакции образуются карбонат натрия и гидроксид кальция. При этом гидроксид натрия в качестве исходного вещества используется в виде водного раствора.
14. реакция взаимодействия карбоната кальция и хлорида аммония:
CaCO3 + 2NH4Cl → CaCl2 + 2NH3 + H2O + CO2 (to).
В результате реакции образуются хлорид кальция, аммиак, вода и оксид углерода (IV). Реакция протекает при кипении.
15. реакция взаимодействия карбоната кальция и сульфида калия:
CaCO3 + K2S → K2CO3 + CaS (t ≈ 1200 °C).
В результате реакции образуются карбонат калия и сульфид кальция.
16. реакция взаимодействия карбоната кальция и сульфида натрия:
Na2S + CaCO3 → Na2CO3 + CaS (t ≈ 1200 °C).
В результате реакции образуются карбонат натрия и сульфид кальция.
Камень известняк: магические свойства и знаки зодиака
В магии с камнем связывают легенду, что он развивает экстрасенсорные возможности каждого человека, открывает путь к ясновидению.
Это талисман от лени и для творческого воображения. Астрологи включили известняк в перечень универсальных камней, подходящих большинству Знаков зодиака.
Исключают только Скорпионов – среди них больше всего людей, склонных к оккультизму и чёрной магии. А известняк по своей ауре – проводник светлой энергии и высоких духовных вибраций. Мистическому уклону Скорпионов это противоречит, и талисман-известняк «не дружит» с волевым и агрессивным знаком.
Что касается остальных – минерал охотно делится своими бодрящими и вдохновляющими свойствами и помогает владельцу видеть исход ситуации.
Производство качественных марок
К ключевым требованиям, предъявляемым к продукции из мела, помимо доли карбонатов, относится крупность — тонина помола. Она выражается в остатке на ситах определенного размера или в процентном содержании частиц заданной величины (к примеру, 90% частиц размером 2 мкр).
Появление новых производственных линий по изготовлению лакокрасочной, резинотехнической, полимерной и прочей продукции, для которой в качестве сырья используется мел, спровоцировало резкий дисбаланс между его выпуском и потреблением. Это особенно отчетливо проявилось в бумажной промышленности. Предприятия этой отрасли предъявляют особые требования к меловому порошку, который заменил каолин в производстве.
Выпуск качественных марок сосредоточен на заводах в Белгородской обл. Кроме Шебекинского предприятия, выпускающего сепарированный мел, были созданы новые комбинаты. Так, в 1995 году на Лебединском ГОКе появился завод по переработке — ЗАО «Руслайм». Он был сооружен по испанскому проекту с предполагаемой производительностью 120 тыс. тонн/год. Завод производит до 10 разных марок мела. По своему качеству они нисколько не уступают зарубежным аналогам и соответствуют международным стандартам. Предприятие оснащено самым современным технологическим оборудованием, операции на линиях механизированы и автоматизированы.
По проекту на Стойленском ГОКе был построен завод с производительностью меловой продукции высокого качества 300 тысяч тонн. При этом планы предприятия предусматривают последующее увеличение мощности.
Применение и использование мела:
Мел используется в быту и различных отраслях народного хозяйства:
Ссылка на источник
Промышленное освоение
Большие залежи мела присутствуют в Белгородской и Воронежской областях. Менее качественное вещество присутствует в Знаменской, Заслоновской, Валуйской и других залежах. На этих месторождениях выявляются сравнительно низкие показатели СаСО3 (не более 87%). Кроме этого, в породе присутствуют различные примеси. Поэтому на указанных месторождениях без глубокого обогащения нельзя получить качественную продукцию. Физические свойства мела на таких залежах позволяют использовать его при изготовлении извести, а также в мелиоративных мероприятиях для раскисления почв. Воронежские месторождения относят к турон-коньякскому возрасту. Здесь добывается более качественный мел. Свойства и применение породы, полученной на этих месторождениях, изучаются достаточно давно. Продукт, добытый в Воронежской обл., отличается высоким содержанием СаСО3 (до 98,5%). При этом доля некарбонатных примесей меньше 2%. Добычу на месторождениях, однако, затрудняют физические свойства мела. В частности его высокая водонасыщенность. Доля влаги в породе — около 32%.
Особенности возникновения
Примерно восемьдесят тысяч лет назад, когда, по предположениям историков, планета была населена всевозможными видами динозавров, в море жили миллионы моллюсков, имеющие панцирь. Именно они заложили основы формирования меловых залежей, которые сейчас повсеместно добываются и используются современным человеком.
Происходило формирование кальцийсодержащего вещества, находящегося в панцирях и раковинах морских существ, благодаря наличию растворенного кальция в воде и особенностей физиологии упомянутых моллюсков. Когда эти моллюски прекращали свое существование, с течением времени на дне соленых водоемов появлялись толстые слои меловых кальцитовых отложений.
Главные составляющие компоненты
В состав минеральной породы входит большое количество компонентов. К ним относят:
Выявление качественных залежей
Изначально считалось, что механические и химические свойства мела одинаковы на всем месторождении. Однако на практике при продолжительной эксплуатации района, особенно после перехода добывающего и перерабатывающего предприятия на выпуск более качественной продукции, выявляются различия по этим характеристикам. Поэтому на некоторых месторождениях выполняется геолого-технологическое картирование. Исследователи, изучая химические свойства мела и его механические характеристики на разных участках залежи, обозначают районы скопления качественной породы.
Распускаемость породы
Одним из ключевых критериев в процессе анализа физических свойств породы на новом месторождении либо участке, вовлеченном в действующую технологическую линию переработки, является поведение мела при измельчении. Как выше было сказано, на разных пластах залежи вещество имеет разные механические характеристики. Визуально выявить эти отличия не представляется возможным в большинстве случаев. Определение поведения мела в процессе его сухого измельчения в технологическом процессе осуществляется посредством установления показателя его распускаемости во влажной среде при механическом воздействии. Для этого используется специальное оборудование.
Карбонат кальция – это
Определение и формула
Неорганическое соединение, соль угольной кислоты и кальция
Альтернативное название
Формула
Формула карбоната кальция
Химическая формула: CaCO3.
Краткая характеристика карбоната кальция:
Карбонат кальция – неорганическое вещество белого цвета.
Химическая формула карбоната кальция СаСО3.
Карбонат кальция (углекислый кальций) – неорганическое химическое соединение, соль угольной кислоты и кальция.
Практически не растворяется в воде. Не растворяется в этаноле. Легко растворяется в кислотах с выделением углекислого газа.
Карбонат кальция при прокаливании разлагается. Однако при избыточном давлении углекислого газа (СО2) плавится без разложения.
Встречается в виде трех кристаллических модификаций:
– кальцита (известняк, мел, мрамор);
– фатерита или ватерита.
Кальцит и арагонит являются устойчивыми кристаллическими модификациями. Фатерит является наименее стабильной разновидностью карбоната кальция, и очень быстро превращается в воде либо в кальцит, либо в арагонит. Фатерит в природе встречается относительно редко.
Зарегистрирован как белый пищевой краситель E170.
Физические свойства карбоната кальция:
| Наименование параметра: | Значение: |
| Химическая формула | СаСО3 |
| Синонимы и названия иностранном языке | calcium carbonate (англ.) |
углекислый кальций (рус.)
Плотность карбоната кальция
Плотность (кальцит) 2,74 г/см³, (арагонит) 2,83 г/см³.
Температура плавления карбонат кальция
Температура плавления (кальцит) 825° C, (арагонит) 1339° C,
Температура разложения карбоната кальция
Температура разложения 900-1000° C.
Химические свойства карбоната кальция. Химические реакции карбоната кальция:
Карбонат кальция – это средняя соль, образованная сильным основанием (гидроксид кальция Ca(OH)2) и слабой кислотой (угольная кислота H2CO3).
Водные растворы CaCO3 имеют слабую щелочную реакцию.
Химические свойства
Растворяется в воде при избытке углекислого газа образуя кислую соль — гидрокарбонат кальция Ca(HCO3)2:
Из-за этой реакции образуются сталактиты, сталагмиты. Природные подземные воды, обильные углекислом газом, растворяют плохо растворимый карбонат кальция с образованием много лучше растворимого в воде гидрокарбоната кальция, при выделении подземной воды в виде капель с потолков пещер при попадании в воздух с низкой концентрацией углекислого газа происходит обратная реакция превращения гидрокарбоната кальция в плохо растворимый осадок карбоната кальция, образующего красивые природные формы в пещерах, и из-за этого же механизма образуются карстовые пещеры.
При обжиге с температурой свыше 1500 °C с углеродом, например, в форме кокса, образует карбид кальция и угарный газ:
Биологическое значение
Карбонат кальция считается нетоксичным веществом. ПДК 180 мг/дм³ (в воде, с обязательным контролем по ионам кальция). ЛД50 на крысах около 6400 мг/кг.
Получение карбоната кальция
Промышленный способ получения карбоната кальция заключается в разработке его месторождений в природе.
В лаборатории карбонат кальция получают гашением негашеной извести и последующим продуванием углекислого газа.
Оксид кальция (негашеная известь) смешивается с водой. В результате образуется так называемое известковое молоко (гидроксид кальция).
Так как гидроксид кальция растворяется в воде в небольшом количестве, то после отфильтровывания известкового молока получается прозрачный раствор – известковая вода, которая мутнеет при пропускании через неё диоксида углерода (углекислого газа). В результате образуется карбонат кальция, который выпадает в осадок.
Где добывают карбонат кальция?
Залежи карбоната кальция в форме меловых отложений имеются на всех континентах. Добычей занимается множество компаний, но 70 % производства принадлежит десятку фирм из Европы, среди которых лидируют швейцарская Omya и французская Imerys. Однако около 10 лет назад добычей природных карбонатов и изготовлением Е 170 активно занялись китайские предприятия. Сейчас их доля на рынке постоянно растет, постепенно сужая сбыт европейской продукции.
Меловые пласты, пригодные для добычи карбоната кальция, есть и на российской территории, например, в Белгороде и Воронеже.
Лучший порошок получается в результате промышленной обработки мрамора. Для изготовления фармацевтического компонента и пищевого красителя Е 170 камень подвергается измельчению и многоступенчатой очистке.
Получение
Подавляющее количество карбоната кальция, добывающееся из полезных ископаемых, используется в промышленности. Чистый карбонат кальция (например, для производства продуктов питания или использования в фармацевтических целях), может быть изготовлен из природного минерала с малым количеством вредных примесей, например, из мрамора.
В лаборатории карбонат кальция может быть приготовлен предварительным гашением оксида кальция — негашеной извести. При этом образуется гидроксид кальция, и затем в суспензию продувается углекислый газ для получения карбоната кальция:
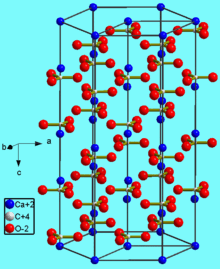
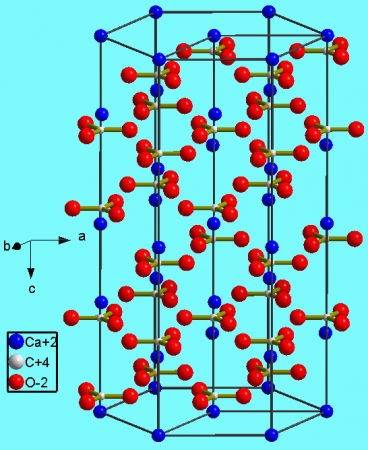
Нахождение в природе
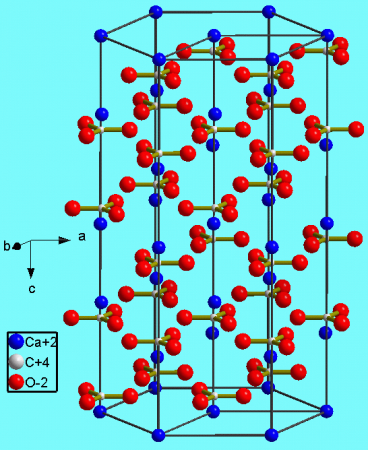
Кристаллическая структура кальцита
Карбонат кальция находится в минералах в виде полиморфов:
Тригональная кристаллическая структура кальцита является наиболее распространенной.
Минералы карбоната кальция находятся в следующих горных породах:
Геология
Залежи карбоната кальция в виде известняковых и меловых пластов — распространенное явление в земной коре. Они имеют органическое, реже хемогенное происхождение.
Органическое происхождение связано отложениями останков древних морских организмов: зоопланктона, моллюсков, кораллов и др., в основном, в меловой период.
Такие горные породы как известняк, мел, мрамор, травертин и другие известковые туфы практически полностью состоят из карбоната кальция с различными примесями.
В природе встречаются три кристаллические модификации карбоната кальция (минералы с одинаковым химическим составом, но с различной кристаллической структурой): кальцит, арагонит и фатерит (ватерит).
Кальцит является наиболее устойчивой и распространённой кристаллической модификацией карбоната кальция. Около 10 % всех осадочных пород составляют известняки, сложенные кальцитовыми останками раковин простейших морских организмов.
Арагонит является второй по устойчивости и распространённости кристаллической модификацией CaCO3. В основном формируется в раковинах моллюсков и скелетах кораллов. Также арагонит может образовываться при неорганических процессах (хемогенное происхождение), например, в карстовых пещерах или гидротермальных источниках в результате химического осаждения из водных растворов или при испарении воды.
Фатерит является наименее стабильной разновидностью карбоната кальция и очень быстро превращается в воде либо в кальцит, либо в арагонит. В природе встречается относительно редко, когда его кристаллическая структура стабилизирована теми или иными примесями.
Применение и использование карбоната кальция:
Карбонат кальция используется во множестве отраслей промышленности и для бытовых нужд:
– для письма на досках;
– в быту для побелки потолков, покраски стволов деревьев;
– в целлюлозно-бумажной промышленности – в производстве бумаги в качестве отбеливателя, наполнителя, а также раскислителя;
– в качестве пищевой добавки в пищевой промышленности;
– в качестве наполнителя при производстве пластмасс, красок, резины, продукции бытовой химии и пр.;
– при производстве предметов гигиены (например, зубной пасты) и лекарственных средств;
– при производстве силикатного стекла;
– в качестве наполнителя при производстве шпаклёвок и герметиков,
– в сельском хозяйстве для раскисления кислых почв.
Массовое производство/использование
Таблетки из карбоната кальция
Очищенный от примесей, карбонат кальция широко используется в бумажной и пищевой промышленности, в качестве наполнителя при производстве пластмасс, красок, резины, продукции бытовой химии, в строительстве.
При производстве бумаги карбонат кальция применяют одновременно в качестве отбеливателя, наполнителя, а также раскислителя.
Используется при производстве силикатного стекла, — материала для производства оконного стекла, стеклянных бутылок, стекловолокна.
Применяется при производстве предметов гигиены (например, зубной пасты), в медицине.
В пищевой промышленности часто используется в качестве препарата препятствующего слеживанию и для препятствования слипания в комки сухих молочных продуктах.
При употреблении сверх рекомендованной дозы (1,5 г в день) может вызывать молочно-щелочной синдром (синдром Бернетта). Рекомендован при болезнях костных тканей.
Производители пластмассы — одни из основных потребителей чистого карбоната кальция (более 50% всего потребления). Используемый в качестве наполнителя и красителя, карбонат кальция необходим при производстве поливинилхлорида (PVC), полиэфирных волокон (кримплен, лавсан, и т. п.), полиолефинов. Изделия из данных видов пластмасс распространены повсеместно — это трубы, сантехника, кафельная плитка, черепица, линолеум, ковровые покрытия, и т.п. Карбонат кальция составляет порядка 20% красящего пигмента, используемого при производстве красок.
В строительстве
Строительство — ещё один из основных потребителей карбоната кальция. Например, в качестве наполнителя шпаклёвок и герметиков.
Также карбонат кальция является важным составным элементом при производстве продукции бытовой химии — средств для чистки сантехники, кремов для обуви.
Карбонат кальция широко применяется для раскисления кислых почв.
Применение карбоната кальция в промышленности
Физико-химические свойства карбоната кальция обусловили широкий потенциал его применения в разных отраслях промышленности. Мел используется при производстве:
Также природный карбонат кальция задействуется в разнообразных промышленных системах очистки. Он эффективно заменяет опасные синтетические препараты, чем помогает сохранять экологию. Углекислый кальций полезен для сельхозугодий — с его помощью восстанавливают и поддерживают кислотно-щелочной баланс почвы.
Применение в продуктах питания
Природный карбонат кальция применим в кулинарии как натуральный пищевой краситель, разрыхлитель, регулятор кислотности, наполнитель.
Также вещество предупреждает слеживание и комкование сыпучих изделий.
Карбонат кальция встречается в составе молочных и молочнокислых продуктов: сыра, сгущенки, сливок, йогуртов. Также полезную добавку используют при приготовлении детского питания, консервов, шоколадных плиток.
Польза и вред карбоната кальция для организма
Как мы уже выяснили, карбонат кальция не несет вреда организму. Доказательством тому служит использование в фармацевтике: вещество присутствует в БАДах и витаминных препаратах, направленных на устранения дефицита кальция.
Польза Е 170 очевидна: вещество поддерживает жизнедеятельность организма, стабилизирует кровяное давление, стимулирует работу сердечной мышцы, отвечает за свертываемость крови и формирование костных структур.
Для лучшего усвоения карбонат кальция рекомендуется употреблять совместно с витамином D.
Фармакодинамика и фармакокинетика
При попадании средства в пищеварительный тракт происходит нейтрализация соляной кислоты, снижается кислотность желудочного сока в целом. Эффект от применения Карбоната Кальция наступает достаточно быстро, однако при прекращении действия может возникнуть обратное действие, секреция желудочного сока усиливается. Вещество нормализует уровень электролитов, угнетает активность остеокластов, замедляет процессы разрушения костной ткани.
Показания к применению
Углекислый кальций назначают:
Противопоказания
Передозировка
Показано промыть желудок, дать пострадавшему энтеросорбенты, проводить симптоматическое лечение.
Взаимодействие
Сочетанный прием средства с тетрациклиновыми антибиотиками может привести к снижению их эффективности и плазменной концентрации.
При сочетании препарата с тиазидными диуретиками выше риск развития метаболического алкалоза и гиперкальциемии.
Карбонат Кальция замедляет процессы абсорбции других лекарств.
Особые указания
При продолжительном лечении средством рекомендуют контролировать плазменную концентрацию кальция.
При приеме больших доз препарата и больших количеств молочной продукции может развиться гиперкальциемия и молочно-щелочной синдром.
Детям
Для детей нужно скорректировать дозировку.
При беременности и лактации
Вещество часто назначают беременным женщинам и кормящим мамам.


 . В природе встречается в виде минералов — кальцита, арагонита и ватерита, является главной составной частью известняка, мрамора. Нерастворим в воде и этаноле.
. В природе встречается в виде минералов — кальцита, арагонита и ватерита, является главной составной частью известняка, мрамора. Нерастворим в воде и этаноле.