Что такое оксид водорода
Что такое оксид водорода
Оксид водорода
Оксид водорода
| Вода | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид водорода |
| Традиционные названия | вода |
| Химическая формула | Н2O |
| Молярная масса | 18,01528 г/моль |
| Физические свойства | |
| Плотность вещества | 0,9982 г/см³ |
| Состояние (ст. усл.) | жидкость |
| Динамическая вязкость (ст. усл.) | 0,00101 Па·с (при 20 °C) |
| Кинематическая вязкость (ст. усл.) | 0,01012 см²/с (при 20 °C) |
| Термические свойства | |
| Температура плавления | 0 °C |
| Температура кипения | 99,974 °C |
| Тройная точка | 0,01 °C, 611,73 Па |
| Критическая точка | 374 °C, 22,064 MПа |
| Молярная теплоёмкость (ст. усл.) | 75,37 Дж/(моль·К) |
| Теплопроводность (ст. усл.) | 0,56 Вт/(м·K) |
Вода́ (оксид водорода) — прозрачная жидкость, не имеющая цвета (в малом объёме) и запаха. Химическая формула: Н2O. В твёрдом состоянии называется льдом или снегом, а в газообразном — водяным паром. 71 % поверхности Земли покрыто водой (океаны, моря, озера, реки).
Является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы).
Вода имеет ключевое значение в создании и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды.
Содержание
Физические и химические свойства
Физические свойства
Вода обладает рядом необычных особенностей:
Все эти особенности связаны с наличием водородных связей. Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По причине этого, а так же того, что ион водорода не имеет внутренних электронных слоев и обладает малыми размерами, он может проникать в электронную оболочку отрицательно поляризованного атома соседней молекулы. Благодаря этому, каждый атом кислорода притягивается к атомам водорода других молекул и наоборот. Каждая молекула воды может участвовать максимум в четырёх водородных связях: 2 атома водорода — каждый в одной, а атом кислорода — в двух. При таянии льда часть связей рвётся, что позволяет уложить молекулы воды плотнее; при нагревании воды связи продолжают рваться, и плотность её растёт, но при температуре выше 4 °С этот эффект слабее, чем обычное тепловое расширение; при испарении рвутся все оставшиеся связи. Разрыв связей требует много энергии, отсюда высокая температура и удельная теплота плавления и кипения и высокая теплоёмкость. Вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями.
По сходным причинам вода является хорошим растворителем полярных веществ. Каждая молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
Это свойство воды используется живыми существами. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде. [2] Вода необходима для жизни всех без исключения одноклеточных и многоклеточных живых существ на Земле.
Вода имеет показатель преломления n=1,33 в оптическом диапазоне. Однако она сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60% парникового эффекта. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, на чем основан принцип действия микроволновой печи.
Агрегатные состояния
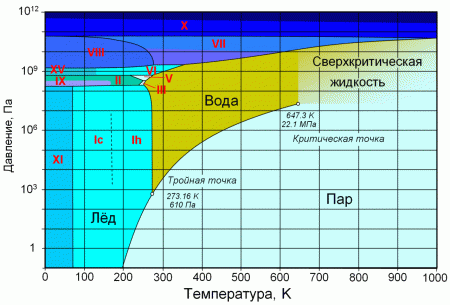
При атмосферном давлении вода замерзает (превращается в лёд) при температуре в 0 °C и кипит (превращается в водяной пар) при температуре 100 °C. При снижении давления температура плавления воды медленно растёт, а температура кипения — падает. При давлении в 611,73 Па (около 0,006 атм) температура кипения и плавления совпадает и становится равной 0,01 °C. Такое давление и температура называются тройной точкой воды. При более низком давлении вода не может находится в жидком состоянии, и лёд превращается непосредственно в пар. Температура возгонки льда падает со снижением давления.
При росте давления температура кипения воды растёт, плотность водяного пара в точке кипения тоже растёт, а жидкой воды — падает. При температуре 374 °C (647 K) и давлении 22,064 МПа (218 атм) вода проходит критическую точку. В этой точке плотность и другие свойства жидкой и газообразной воды совпадают. При более высоком давлении нет разницы между жидкой водой и водяным паром, следовательно, нет и кипения или испарения.
Так же возможны метастабильные состояния — пересыщенный пар, перегретая жидкость, переохлаждённая жидкость. Эти состояния могут существовать длительное время, однако они неустойчивы и при соприкосновении с более устойчивой фазой происходит переход. Например, нетрудно получить переохлаждённую жидкость, охладив чистую воду в чистом сосуде ниже 0 °C, однако при появлении центра кристаллизации жидкая вода быстро превращается в лёд.
Изотопные модификации воды
И кислород, и водород имеют природные и искусственные изотопы. В зависимости от типа изотопов, входящих в молекулу, выделяют следующие виды воды: Лёгкая вода (просто вода), Тяжёлая вода (дейтериевая) и Сверхтяжёлая вода(тритиевая).
Химические свойства
Вода является наиболее распространённым растворителем на Земле, во многом определяющим характер земной химии, как науки. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ. Её иногда рассматривают, как амфолит — и кислоту и основание одновременно (катион H+ анион OH-). В отсутствие посторонних веществ в воде одинакова концентрация гидроксид-ионов и ионов водорода (или ионов гидроксония), pKa ≈ ок. 16.
Сама по себе вода относительно инертна в обычных условиях, но её сильно полярные молекулы сольватируют ионы и молекулы, образуют гидраты и кристаллогидраты. Сольволиз, и в частности гидролиз, происходит в живой и неживой природе, и широко используется в химической промышленности.
Вода в природе
Атмосферные осадки
Осадки согласно направлению
| «Вертикальные» осадки | «Горизонтальные» осадки | Свободно-парящие структуры |
|---|---|---|
| Дождь | Роса | Облака |
| Дождь со снегом | Иней | Туман |
| Изморось | Атмосферное оледенение | Морская пена |
| Переохлаждённая морось | Гололёд | |
| Снег | ||
| Снежная крупа | ||
| Снежные зерна | ||
| Ледяная крупа | ||
| Ледяной дождь | ||
| Град | ||
| Ледяные кристаллы |
Осадки согласно состоянию
| Жидкие осадки | Твёрдые осадки |
|---|---|
| Дождь | Снег |
| Дождь со снегом | Снежная крупа |
| Изморось | Снежные зерна |
| Переохлаждённая морось | Ледяная крупа |
| Роса | Ледяной дождь |
| Град | |
| Ледяные кристаллы | |
| Иней | |
| Атмосферное оледенение | |
| Гололёд |
Виды воды
Вода на Земле может существовать в трёх основных состояниях — жидком, газообразном и твёрдом и в свою очередь приобретать самые разные формы, которые зачастую соседствуют друг с другом. Водный пар и облака в небе, морская вода и айсберги, горные ледники и горные же реки, водоносные слои в земле. Вода способна растворять в себе много веществ, приобретая тот или иной вкус. Из-за важности воды, «как источника жизни» её нередко подразделяют на типы.
Характеристики вод
По особенностям происхождения, состава или применения, выделяют, в числе прочего:
Исследования воды
Гидрология
Гидроло́гия — наука, изучающая природные воды, их взаимодействие с атмосферой и литосферой, а также явления и процессы, в них протекающие (испарение, замерзание и т. п.).
Предметом изучения гидрологии являются все виды вод гидросферы в океанах, морях, реках, озёрах, водохранилищах, болотах, почвенных и подземных вод.
Гидрология исследует круговорот воды в природе, влияние на него деятельности человека и управление режимом водных объектов и водным режимом отдельных территорий; проводит анализ гидрологических элементов для отдельных территорий и Земли в целом; даёт оценку и прогноз состояния и рационального использования водных ресурсов; пользуется методами, применяемыми в географии, физике и других науках. Данные гидрологии моря используются при плавании и ведении боевых действий надводными кораблями и подводными лодками.
Океанология подразделяется на биологию океана, химию океана, геологию океана, физическую океанологию, и взаимодействие океана и атмосферы.
Биологическая роль
Вода играет уникальную роль, как вещество, определяющее возможность существования и саму жизнь всех существ на Земле. Она выполняет роль универсального растворителя, в котором происходят основные биохимические процессы живых организмов. Уникальность воды состоит в том, что она достаточно хорошо растворяет как органические, так и неорганические вещества, обеспечивая высокую скорость протекания химических реакций и в то же время — достаточную сложность образующихся комплексных соединений. Благодаря водородной связи, вода остаётся жидкой в широком диапазоне температур, причём именно в том, который широко представлен на планете Земля в настоящее время.
Применение
Земледелие
Выращивание достаточного количества сельскохозяйственных культур на открытых засушливых землях требует значительных расходов воды на ирригацию, доходящих до 90% в некоторых странах.
Питьё и приготовление пищи
Живое человеческое тело содержит от 55% до 78% воды, в зависимости от веса и возраста. Потеря организмом человека более 10 % воды может привести к смерти. Для нормального функционирования организма человеку нужно усвоить от 1 до 7 литров воды за день в зависимости от температуры и влажности окружающей среды, физической активности и пр.
Растворитель
Вода является растворителем для многих веществ. Она используется для очистки как самого человека, так и различных объектов человеческой деятельности. Вода используется как растворитель в промышленности.
Теплоноситель
Среди существующих в природе жидкостей вода обладает наибольшей теплоёмкостью. Теплота её испарения выше теплоты испарения любых других жидкостей, а теплота кристаллизации уступает лишь аммиаку. В качестве теплоносителя воду используют в тепловых сетях, для передачи тепла по теплотрассам от производителей тепла к потребителям. Воду в качестве льда используют для охлаждения в системах общественного питания, в медицине. Большинство атомных электростанций используют воду в качестве теплоносителя.
Пожаротушение
В пожаротушении вода зачастую используется не только как охлаждающая жидкость, но и для изоляции от огня в составе пены.
Спорт
Многие вида спорта проходят на водных поверхностях, на льду, на снегу и даже в воде. Это подводное плавание, хоккей, лодочные виды спорта, биатлон и пр.
Инструмент
Вода используется как инструмент для разрыхления, раскалывания и даже резки пород и материалов. Она используется в добывающей промышленности, горном деле и в производстве. Достаточно распространены установки по резке водой различных материалов: от резины до стали. Вода, выходящая под давлением несколько тысяч атмосфер способна разрезать стальную пластину толщиной несколько миллиметров, или более при добавлении абразивных частиц.
Водорода оксид: получение и свойства
Самым важным и распространенным веществом на нашей планете, несомненно, является вода. Что может сравниться с ней по важности? Известно, что жизнь на Земле стала возможной только с появлением жидкости. Что такое вода (оксид водорода) с химической точки зрения? Из чего он состоит и какими свойствами обладает? Попробуем разобраться в этой статье.
Водород и его соединения
Самый легкий атом во всей периодической таблице — водород. Он также занимает двойное положение, находясь как в подгруппе галогенов, так и в первой группе щелочных металлов. Чем объясняются эти характеристики? Электронное строение оболочки своего атома. У него есть только один электрон, который он может свободно оставить или присоединить к себе, образуя пару и завершая внешний уровень.
Однако водород также легко образует летучие молекулы веществ, взаимодействуя с неметаллами. Например:
Вообще водород образует множество соединений. Однако наиболее важным веществом, в которое он входит, является оксид водорода, формула которого — H2O. Это самое известное соединение, которое даже ученик начальной школы, еще не знакомый с химией, узнает по формуле. Ведь вода (а это высший оксид водорода) — не только очень распространенное вещество, но и источник жизни на нашей планете.
Само название элемента отражает его главную суть: водород, то есть «оживляющий воду». Как и любой другой оксид, он также представляет собой бинарное соединение с рядом физических и химических свойств. Кроме того, есть также особые характеристики, которые отличают воду от всех других соединений.
Также важным классом соединений, образующих водород, являются кислоты, как органические, так и минеральные.
Химические свойства водорода
С точки зрения химической активности водород — довольно сильный восстановитель. Во многих реакциях он проявляет именно эти свойства. Однако при взаимодействии с еще более сильными металлами он становится окислителем.
Взаимодействие водорода с оксидами металлов очень важно в промышленности. Ведь это один из способов получить последнее в чистом виде. Гидрогенотермия — это металлургический метод синтеза чистых металлов из их оксидов восстановлением водородом.
Реакция водорода с оксидом имеет следующий общий вид: MexOy + H2 = H2O + Me.
Конечно, это не единственный способ синтезировать чистые металлы. Есть и другие. Однако восстановление оксидов водородом — довольно прибыльный и простой процесс получения энергии, нашедший широкое применение.
Еще одна интересная особенность заключается в том, что при смешивании с воздухом газообразный водород может образовывать взрывоопасную смесь. Его название — взрывоопасный газ. Для этого смешивание следует производить из расчета два объема водорода на один кислород.
Вода — оксид водорода
Мы уже говорили, что этот оксид очень важен. А теперь охарактеризуем его с точки зрения химии. Действительно ли это соединение относится к этому классу неорганических веществ?
Для этого он попытается написать формулу немного иначе: H2O = HON. Суть та же, количество атомов то же, однако теперь очевидно, что перед нами гидроксид. Какими свойствами он должен обладать? Рассмотрим диссоциацию соединения:
В результате свойства получаются кислыми, так как в растворе присутствуют катионы водорода. Кроме того, они не могут быть основными, потому что щелочи образуют только металлы.
Поэтому еще одно название, которое имеет оксид водорода — кислородсодержащая кислота простейшего состава. Поскольку такое сложное переплетение характерно для данной молекулы, следовательно, ее свойства будут особенными. И свойства отталкиваются структурой молекулы, поэтому мы ее проанализируем.
Строение молекулы воды
Впервые об этой модели подумал Нильс Бор, он имеет первенство и авторство в этом вопросе. Он установил следующие характеристики.
Как схематично выглядит рассматриваемый оксид водорода, вы можете увидеть на фото ниже.
Физические свойства оксида водорода
Можно выделить несколько основных характеристик.
Как мы уже отмечали выше, характеристики свойств зависят от конструкции. Итак, вот оно. Способность образовывать водородные связи привела к аналогичным характеристикам этого соединения.
Водорода оксид: химические свойства
С точки зрения химии активность воды довольно высока. Особенно если речь идет о реакциях, сопровождающихся нагреванием. С чем способен взаимодействовать оксид водорода?
Уравнение реакций оксида водорода можно представить в качестве примера следующим образом: SO3 + H2O = H2SO4.
Распространение в природе
Мы уже выяснили, что это вещество является самым распространенным в мире. Указываем процент в предметах.
Этот список можно продолжать долго, потому что трудно вспомнить хоть что-то, что не включает воду или когда-то не было включено. Или он образовался без участия этого оксида.
Способы получения
Производство оксида водорода не имеет промышленного значения. Ведь проще использовать готовые источники — реки, озера и другие водоемы, чем тратить огромное количество энергии и реагентов. Поэтому в лаборатории уместно получать только дистиллированную воду высокой степени очистки.
Для этих целей используются некоторые устройства, например, кадры. Такая вода нужна для проведения множества химических взаимодействий, так как сырая вода содержит большое количество примесей, солей, ионов.
Биологическая роль
Сказать, что вода используется везде, значит ничего не сказать. Невозможно представить свою жизнь без этой связи. С раннего утра до заката человек постоянно использует его как в бытовых, так и в промышленных целях.
Свойства оксида водорода предполагают его использование в качестве универсального растворителя. И не только в лаборатории. Но также и у живых существ, где каждую секунду происходят тысячи биохимических реакций.
Кроме того, сама вода участвует во многих синтезах, она также служит их побочным продуктом. КАЖДЫЙ ЧЕЛОВЕК НА ЗЕМЛЕ ЗА 60 ЛЕТ ПРОХОДИТ ЧЕРЕЗ около 50 ТОНН ЭТОГО УДИВИТЕЛЬНОГО ВЕЩЕСТВА!
Окись водорода применяют:
сложно определить сферу жизни, в которой можно обойтись без воды. Единственные живые существа, которые не имеют в своем составе оксида водорода и живут без него, — это вирусы. Именно поэтому человеку сложно бороться с этими организмами.
Что такое оксид водорода
ВОДА – оксид водорода H2O.
В течение многих столетий вода считалась простым веществом. Лишь в 1783 французский химик Антуан Лоран Лавуазье (1743–1794) сумел разложить ее. Он показал, что вода состоит из водорода и кислорода, а в 1789 дал первую оценку ее количественного состава: 15% водорода и 85% кислорода. В дальнейшем количественный анализ воды проводили многие ученые. Долгое время образцовыми считались результаты французского химика и физика Жозефа Луи Гей-Люссака (1778–1850), полученные около 1808: 13,27% водорода и 86,73% кислорода. Только в 1821 шведский химик Йенс Якоб Берцелиус (1779–1848) и французский физик и химик Пьер Луи Дюлонг (1785–1838) сделали более правильный анализ воды и нашли, что она содержит 11,1% водорода и 88,9% кислорода, что очень близко к современным значениям (11,19% водорода и 88,81% кислорода).
Изучая объемные отношения реагирующих газов, Гей-Люссак показал, что один объем кислорода и два объема водорода при взаимодействии дают два объема водяного пара (при температуре выше 100° С). На основании этих результатов с учетом закона Авогадро был сделан вывод, что две частицы водяного пара образуются из одной частицы кислорода и двух частиц водорода. Таким образом была выведена формула воды H2O.
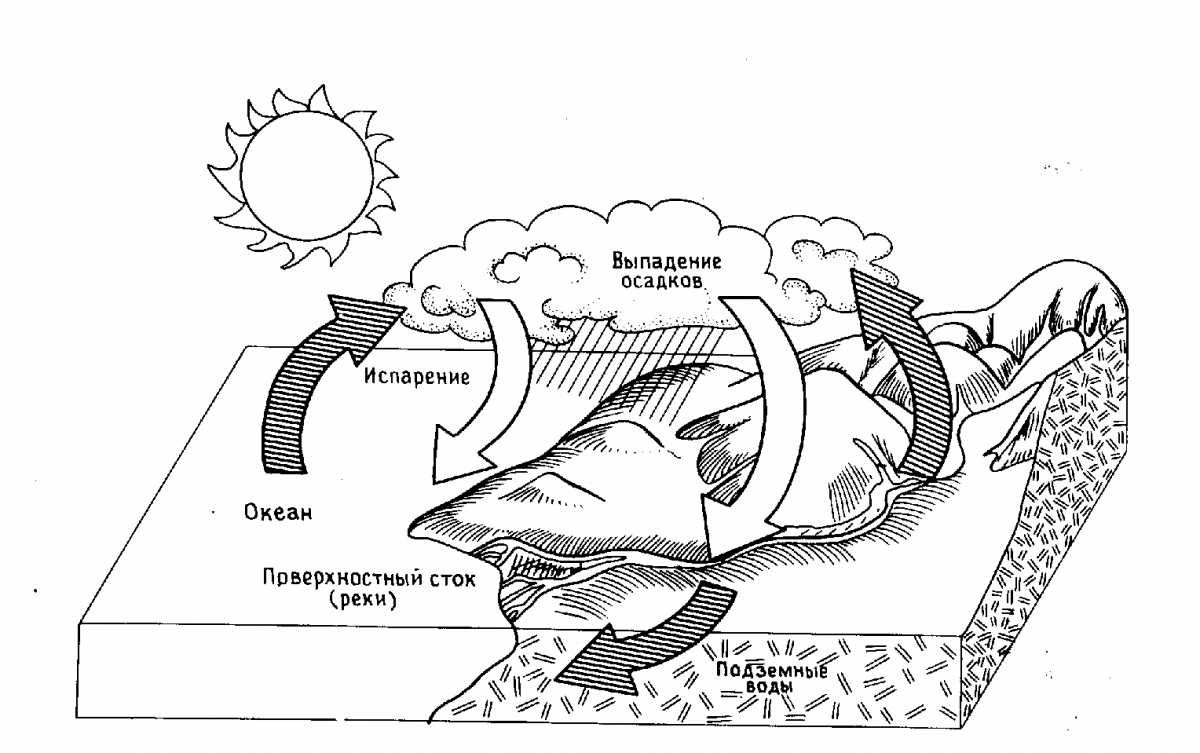
На нашей планете вода играет очень важную роль. В природе она совершает непрерывный круговорот. Под влиянием солнечной энергии жидкая вода (главным образом, в теплых морях и океанах) превращается в пар, который поднимается в верхние слои атмосферы. Это происходит благодаря тому, что водяной пар легче воздуха. Так происходит образование облаков, которые ветрами переносятся в другие части планеты, где в виде дождя и других осадков вода попадает на поверхность земли. Здесь она образует ручьи и реки, которые возвращают испаренную воду в океаны (рис. 1).
Чистой воды в природе нет. Даже наиболее чистая дождевая вода при падении через атмосферу растворяет газы и захватывает пыль. При ее испарении всегда остается небольшой остаток – около 0,03 г на литр. На поверхности земли вода дополнительно растворяет многие твердые вещества. Часть ее впитывается в почву. В глубине земли продолжается растворение различных веществ, так что при выходе на поверхность вода иногда образует минеральные источники. Ключевая и колодезная вода от растворенных в ней солей часто бывает жесткой.
Речная (пресная) вода содержит до 0,5 г растворенных солей в одном литре. В конце концов, все это попадает в море. Таким образом, море, испаряя чистую воду, получает взамен воду с растворенными в ней веществами. Количество солей, поставляемое реками в моря и океаны, огромно. Так, река Дон ежегодно вносит в Азовское море около 16 млн. т солей, Дунай в Черное море – 9 млн. т.
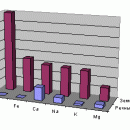
В океанской воде содержится около 35 г солей в литре. Столько же имеется в водах большинства морей. Однако для закрытых морей встречаются отклонения от средней солености, связанные с числом впадающих рек, средней температурой и другими факторами. Балтийское море содержит лишь 3–8 г солей на литр, а Красное – до 45 г. В соленых озерах содержание солей может быть намного больше: в Мертвом море – 228 г в одном литре, в оз. Эльтон – 270 г. В морской воде растворен, в основном, хлорид натрия; кроме того, имеются и другие соли натрия, магния, кальция.
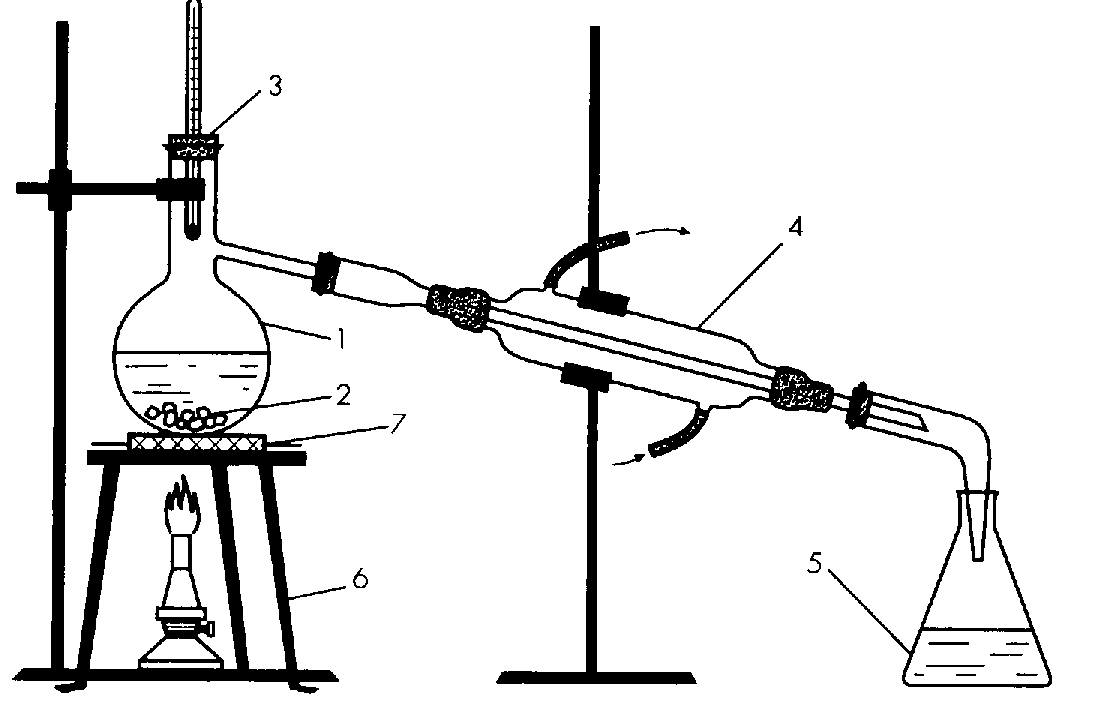
Для научной работы, а также для фармацевтических и других целей, воду перегоняют (рис. 2). Для этого ее превращают в пар, который затем охлаждают, получая чистую дистиллированную воду. Примеси остаются в перегонном сосуде.
Природная вода содержит следы «тяжелой» воды (оксида дейтерия) D2O. Физические свойства H2O и D2O заметно различаются.
| H2O | D2O | |
| t плав.,°С | 0,0 | 3,8 |
| t кип., °С | 100,0 | 101,4 |
Свойства воды служат точкой отсчета для многих физических величин. Так, температуры замерзания и кипения воды лежат в основе шкалы Цельсия. Один литр – это объем 1 кг чистой воды, взвешенной при +4 °С (при этой температуре вода имеет максимальную плотность).
Многие физические свойства воды аномальны по сравнению с другими жидкостями. Одной из причин этого служат малые размеры молекул воды – минимальные среди всех жидких веществ при обычных условиях. Однако наиболее важным свойством воды является ее способность образовывать прочные водородные связи.
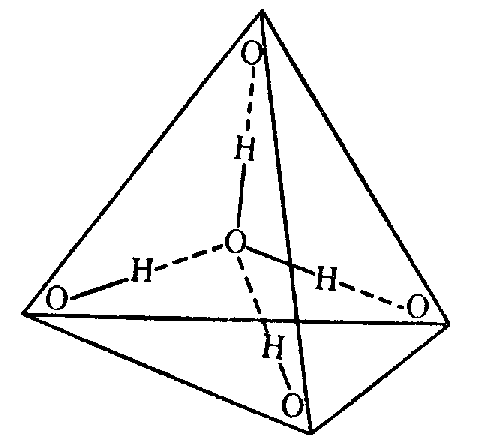
В водяном паре при температуре кипения и атмосферном давлении присутствует около 1% димеров, в которых молекулы воды объединены в пары водородными связями. В жидком и твердом состоянии каждая молекула воды образует четыре водородные связи: две как донор протонов и две – как акцептор протонов. Водородные связи молекулы воды направлены приблизительно к вершинам правильного тетраэдра (рис. 3.).
Если бы водородных связей не было, то температуры плавления и кипения воды были бы существенно ниже, как это наблюдается у других водородных соединений неметаллов. Водородные связи являются причиной и другого уникального свойства воды – при плавлении ее плотность возрастает. При 0°С плотность льда (0,9168 г/см 3 ) меньше, чем плотности жидкой воды (0,9998 г/см 3 ), поэтому лед плавает на поверхности воды. Если бы у льда была более высокая плотность, по мере замерзания он опускался бы на дно, что сделало бы жизнь в водоемах зимой невозможной.
Чтобы превратить воду в пар, надо затратить много энергии – около 44 кДж/моль. При обратном переходе пара в жидкую воду выделяется то же количество теплоты.
Вода устойчива при нагревании вплоть до 1000°С. При более высоких температурах она частично разлагается на водород и кислород. Эти же продукты образуются при электролизе воды.
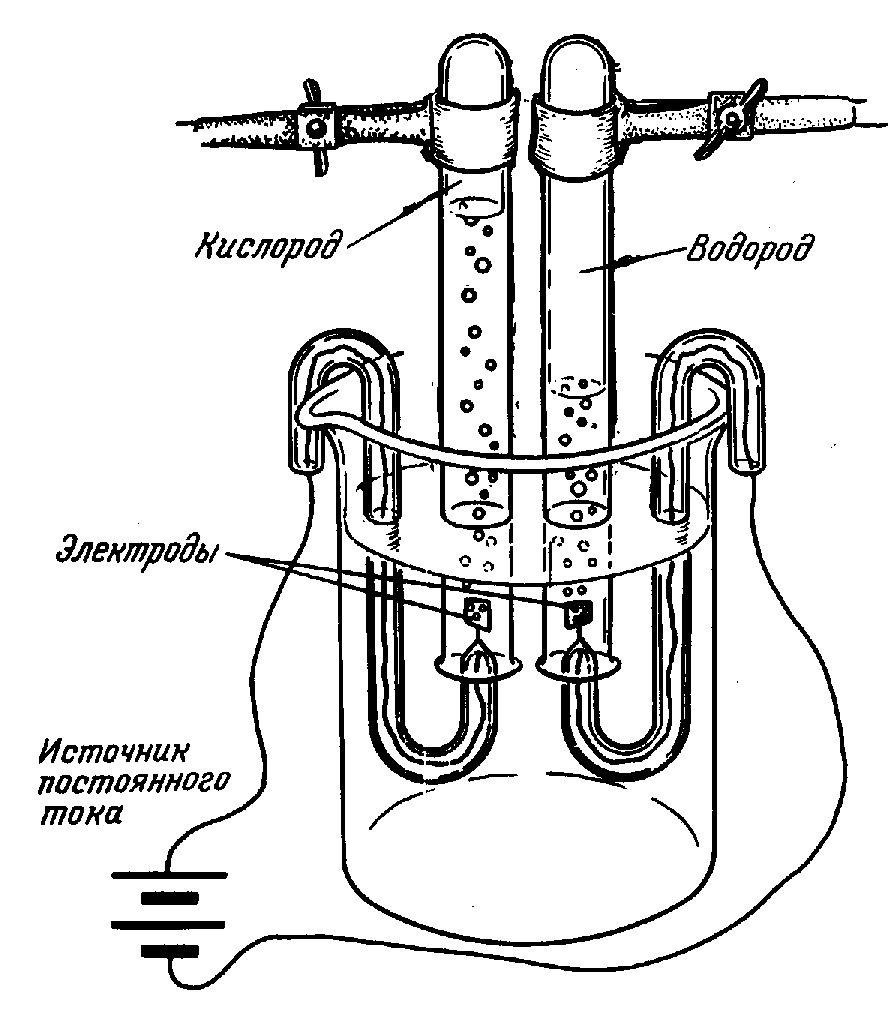
Разложение воды искрами электрической машины заметили еще в 1789, а годом позже воду разложили с помощью гальванического электричества. В России это впервые было сделано профессором С.-Петербургской Медико-Хирургической Академии В.В. Петровым летом 1802 посредством огромной «гальвани-вольтовой батареи», состоявшей из 4200 медных и цинковых кружков. Электролиз чистой воды идет очень медленно. Для более быстрого разложения воды электрическим током в нее добавляют какую-либо кислоту, щелочь или соль. Этот процесс иногда используют для получения чистого водорода и кислорода (рис. 4).
Вода вступает в химическое взаимодействие со многими простыми веществами. Большинство таких реакций протекает при высокой температуре. Только наиболее активные металлы (щелочные и щелочноземельные) и неметаллы (галогены) реагируют с водой при комнатной температуре. Однако при одновременном воздействии воды и окислителей даже при обычной температуре происходит разрушение металлов средней активности (таких как железо) в результате коррозии.
Очень сильными восстановителями вода восстанавливается до водорода, очень сильными окислителями – окисляется до кислорода.
Вода взаимодействует со многими основными оксидами с образованием гидроксидов. В реакциях воды с большинством кислотных оксидов образуются кислоты.
РЕАКЦИИ ВОДЫ
| С простыми веществами: | |
| металлами | неметаллами |
| 2Na + 2H2O = 2NaOH + H2 | Cl2 + H2O⇋ HCl + HClO |
| 2Fe + 3H2O = Fe2O3 + 3H2 (600 °C) | H2O + C ⇋ CO + H2 (800–1000 °C) |
| С оксидами: | |
| основными | кислотными |
| CaO + H2O = Ca(OH)2 | SO3 + H2O = H2SO4 |
| Na2O + H2O = 2NaOH | N2O5 +H2O = 2HNO3 |
| Термическое разложение: 2Н2О⇋ 2Н2 + О2 | |
Некоторые сложные вещества полностью разлагаются водой – подвергаются необратимому гидролизу:
Вода может служить катализатором. Например, щелочные металлы и водород реагируют с хлором только в присутствии следов воды. Иногда вода является каталитическим ядом, например, для железного катализатора при синтезе аммиака.
В результате образования водородных связей твердая вода (лед) имеет рыхлую структуру с обширными замкнутыми полостями двух типов: больших и малых. В этих полостях могут размещаться молекулы других веществ, имеющие соответствующие размеры. Они удерживаются в них ван-дер-ваальсовыми силами. Так образуются газовые гидраты – клатраты, соединения типа «гость-хозяин», в которых «гостями» являются молекулы газов или легкокипящих жидкостей (благородные газы, галогены, углеводороды и др.), а «хозяевами» – молекулы воды, образующие кристаллический каркас. По внешнему виду газовые гидраты напоминают снег или рыхлый лед, но могут существовать только при повышенном давлении и отрицательной (по Цельсию) температуре. Наиболее важным на сегодняшний день газовым гидратом является гидрат природного газа метана, колоссальные скопления которого обнаружены в недрах земли, в особенности на шельфе морей и океанов.
Вода хорошо растворяет многие вещества, имеющие ионное строение (соли, щелочи), а также вещества, молекулы которых полярны. Наличие в жидкой воде ассоциатов (элементов кристаллической структуры) наряду с большим дипольным моментом молекул приводит к высокой диэлектрической проницаемости воды (ε = 78,3 при 25 °С). Это вызывает заметное ослабление кулоновского притяжения в водной среде, а, следовательно, способствует электролитической диссоциации ионных и полярных ковалентных соединений. При этом полярные молекулы воды участвуют в процессе гидратации за счет притяжения соответствующих полюсов полярных молекул воды к образующимся катионам и анионам. В ряде случаев образующиеся связи являются настолько прочными, что можно говорить о возникновении аквакомплексов. Аквакомплексы обнаружены не только в водных растворах, но и во многих кристаллических структурах.
Твердые вещества, как правило, лучше растворяются при нагревании. При этом вещества с очень прочной кристаллической решеткой мало растворимы в воде. К ним относятся хлориды, бромиды и иодиды серебра и свинца, сульфаты щелочноземельных металлов и свинца, большинство гидроксидов, сульфидов, ортофосфатов и карбонатов металлов.
Газы обычно плохо растворяются в воде. Исключение составляют газообразные вещества, взаимодействующие с водой, например аммиак, хлороводород или диоксид серы. Растворимость всех газов возрастает при увеличении давления и, как правило, понижается при нагревании.
В жидкой воде одна из каждых 10 миллионов молекул диссоциирует, образуя ионы: катионы водорода Н + и гидроксид-ионы ОН – :
Н2О ⇋ Н + + ОН –
| Индикатор | Кислотная среда | Нейтральная среда | Щелочная среда |
| Лакмус | Красный | Фиолетовый | Синий |
| Фенолфталеин | Бесцветный | Бесцветный | Малиновый |
| Метиловый оранжевый | Розовый | Оранжевый | Желтый |
| Вещества | Сильные | Слабые |
| Основания | NaOH, KOH, Ca(OH)2, Ba(OH)2 | NH3 |
| Кислоты | HCl, HBr, HI, H2SO4, HNO3 | H3PO4, H2CO3, H2S |
Соли при растворении в воде диссоциируют на катионы металла и анионы кислоты. Растворы многих солей имеют кислотную или щелочную среду за счет обратимого гидролиза по катиону или по аниону (см. ГИДРАТАЦИЯ, ГИДРАТЫ, ГИДРОЛИЗ).
| СОЛЬ | ГИДРОЛИЗ | СРЕДА РАСТВОРА | рН | ||||||||||||||||||
| Катион | Анион | ||||||||||||||||||||
| сильного основания | сильной кислоты | — | нейтральная | 7 | |||||||||||||||||
| сильного основания | слабой кислоты | по аниону | щелочная | > 7 | |||||||||||||||||
| слабого или малорастворимого основания | сильной кислоты | По катиону | кислотная | 7 + + HCO3 – HCO3 – + H2O ⇋ H2CO3 + OH – Вода используется во многих технологических процессах главным образом как охлаждающая жидкость, транспортирующая среда для сыпучих материалов (например, золы), важнейший растворитель, реагент. Тяжелую воду применяют в качестве эффективного замедлителя нейтронов. Обычная вода не токсична, однако тяжелая вода опасна для млекопитающих. Вода является жизненно важным веществом. Она является обязательным компонентом всех живых существ. Организм взрослого человека массой 65 кг содержит до 40 кг воды. Вода является растворителем, составной частью клеток, участником биохимических реакций. Она играет важную роль в терморегуляции. У взрослого человека суточная потребность в воде составляет примерно 2,4 кг. Сюда включается вода, поступающая в организм с твердой и жидкой пищей, в виде напитков, а также вода, образующаяся в результате дыхательных процессов (около 300 г). Очень важен минеральный состав питьевой воды. Человек употребляет для питья воду, содержащую от 0,02 до 2 г минеральных веществ на 1 л. Большое значение имеют вещества, находящиеся в малых концентрациях, но играющие важную роль в физиологических процессах организма. Например, длительное употребление питьевой воды, содержащей фтора менее 0,6 мг/л, ведет к кариесу зубов, а потребление воды с концентрацией фтора более 1 мг/л вызывает флюороз. Если в питьевую воду попадают возбудители инфекционных заболеваний, она может явиться фактором их распространения. Многие возбудители кишечных инфекций сохраняют свою жизнеспособность в воде в течение нескольких месяцев. При определении качества питьевой воды немаловажное значение имеют свойства, воспринимаемые органами чувств (органолептические свойства): температура, прозрачность, цвет, запах, вкус, жесткость. Питьевая вода должна быть безопасной в эпидемиологическом отношении, безвредной по химическому составу, благоприятной по органолептическим свойствам. Чтобы использовать для питья природную воду, ее обычно очищают. С этой целью применяют как физические (фильтрование, отстаивание), так и химические (хлорирование, озонирование) методы. В 1 мл питьевой воды должно быть не более 100 микроорганизмов (число бактерий группы кишечных палочек – не более 3). Не менее жесткие ограничения накладываются на содержание химических веществ.
Общая жесткость питьевой воды должна быть не выше 7,0 ммоль/л, а сухой остаток – 1000 мг/л. Значения рН не должны выходить за пределы 6,0–9,0. Ресурсы питьевой воды не безграничны. Проблема обеспечения питьевой водой растущего народонаселения является одной из наиболее острых экологических проблем современности. На возобновляемые водные ресурсы – речной сток воды – оказывает влияние не только растущее загрязнение окружающей среды, но и глобальное потепление климата Земли. Хотя в ряде районов России увеличение количества атмосферных осадков и повышение температуры воздуха в холодное время года благоприятно отражаются на стоке воды рек, на северо-западе и юге нашей страны наметилась тенденция к уменьшению количества ежегодно возобновляющихся водных ресурсов. Для предотвращения водного кризиса, помимо усиления административных мер по охране природных ресурсов, необходимо экологическое образование население. Это должно помочь правильному восприятию взаимосвязей между всеми сферами Земли, включая ее водную оболочку. Кольман Я., Рём К.-Г. Наглядная биохимия (перевод с нем.) – М., Мир, 2000 Что такое оксид водорода | |||||||||||||||||
| RTECS | ZC0110000 | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ChEBI | 15377 | ||||||||||||||||||||
| ChemSpider | 937 | ||||||||||||||||||||
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |||||||||||||||||||||
Вода (оксид водорода) — бинарное неорганическое соединение с химической формулой H 2 O : молекула воды состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью. При нормальных условиях представляет собой прозрачную жидкость, не имеющую цвета (при малой толщине слоя), запаха и вкуса. В твёрдом состоянии называется льдом (кристаллы льда могут образовывать снег или иней), а в газообразном — водяным паром. Вода также может существовать в виде жидких кристаллов (на гидрофильных поверхностях).
Вода является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы).
Исключительно важна роль воды в глобальном кругообороте вещества и энергии, возникновении и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды. Вода является важнейшим веществом для всех живых существ на Земле.
Всего на Земле около 1400 млн кубических километров воды. Вода покрывает 71 % поверхности земного шара (океаны, моря, озёра, реки, льды — 361,13 млн квадратных километров). Бо́льшая часть земной воды (97,54 %) принадлежит Мировому океану — это солёная вода, непригодная для сельского хозяйства и питья. Пресная же вода находится в основном в ледниках (1,81 %) и подземных водах (около 0,63 %), и лишь небольшая часть (0,009 %) в реках и озерах. Материковые солёные воды составляют 0,007 %, в атмосфере содержится 0,001 % от всей воды нашей планеты.
Содержание
Химические названия
С формальной точки зрения вода имеет несколько различных корректных химических названий:
Образование воды
Известно, что 2 объема водорода взаимодействуют с 1 объемом кислорода с образованием воды. При реакции выделяется большое количество тепла, как и при горении свечи. Продукт реакции — вода — не похожа на исходные вещества — водород и кислород. Следовательно, превращение, происходящее при взаимодействии водорода и кислорода, должно быть отнесено к химическим реакциям.
В соответствии с атомно-молекулярной теорией мы начинаем рассуждение, предполагая, что в реакции участвуют молекулы H2 и O2. В результате реакции образуются молекулы воды. Связи между атомами в реагирующих веществах разрываются и атомы перегруппировываются. При этом возникают новые связи в молекулах продукта реакции. Эти превращения легко представить с помощью молекулярных моделей. Молекулярную модель можно представить как две молекулы H2 (четыре атома) и одна молекула O2 (два атома). Если эти молекулы будут реагировать с образованием воды, то связи между атомами в молекулах водорода и кислорода должны разорваться. Затем «завязываются» новые связи и образуются две молекулы воды. Отметим, что в результате реакции происходит перегруппировка атомов, но общее число атомов при этом не изменяется.
Пример образования молекул воды
Один миллион молекул кислорода реагирует с достаточно большим количеством молекул водорода с образованием воды. Сколько молекул воды образуется? Сколько молекул водорода требуется для этой реакции?
Для получения 100 молекул воды расходуется 100 молекул водорода и 50 молекул кислорода. Таким образом, для получения 1 моля воды (6,02 · 10 23 молекул) нам потребуется 1 моль водорода (6,02 · 10 23 молекул) и 0,5 моля кислорода (3,01 · 10 23 молекул). Результаты приведены в таблице:
| Водород | Кислород | Вода | |
|---|---|---|---|
| Число молекул | 2 | 1 | 2 |
| 4 | 2 | 4 | |
| 100 | 50 | 100 | |
| 6,02 · 10 23 | 3,01 · 10 23 | 6,02 · 10 23 | |
| Число молей | 1 | 0,5 | 1 |
| 2 | 1 | 2 | |
| 10 | 5 | 10 |
Если реагируют 1 моль чистого водорода и 0,5 моля чистого кислорода, образуется 1 моль воды. Количество тепла, выделяющееся при образовании 1 моля воды, равно 68000 кал. Если же мы возьмем только 0,025 моля чистого водорода, то потребуется 0,5 · 0,025 моля кислорода. При этом образуется 0,025 моля воды. Если получено только 0,025 моля воды, то выделяется лишь 0,025 · 68 000 = 1700 кал тепла.
Источником этой тепловой энергии должны быть сами реагирующие вещества (водород и кислород), так как к системе извне подводится только тепло, необходимое для поджигания смеси. Отсюда можно сделать вывод, что вода содержит меньше энергии, чем реагирующие вещества, используемые для ее получения. Реакция, при которой выделяется тепло, называется экзотермической. Количество тепла, выделяющееся при сгорании 1 моля водорода (68 000 кал, или 68 ккал), называется молярной теплотой сгорания водорода.
Свойства
Физические свойства
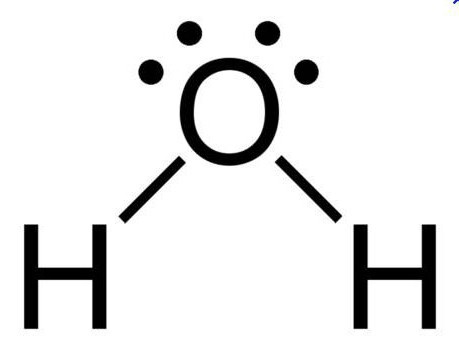
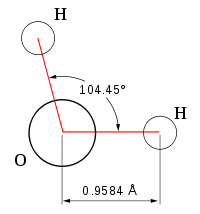
Вода при нормальных условиях находится в жидком состоянии, тогда как аналогичные водородные соединения других элементов являются газами (H2S, CH4, HF). Атомы водорода присоединены к атому кислорода, образуя угол 104,45° (104°27′). Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По этой причине молекула воды обладает большим дипольным моментом (p = 1,84 Д, уступает только синильной кислоте). Каждая молекула воды образует до четырёх водородных связей — две из них образует атом кислорода и две — атомы водорода. Количество водородных связей и их разветвлённая структура определяют высокую температуру кипения воды и её удельную теплоту парообразования. Если бы не было водородных связей, вода, на основании места кислорода в таблице Менделеева и температур кипения гидридов аналогичных кислороду элементов (серы, селена, теллура), кипела бы при −80 °С, а замерзала при −100 °С.
При переходе в твёрдое состояние молекулы воды упорядочиваются, при этом объёмы пустот между молекулами увеличиваются, и общая плотность воды падает, что и объясняет меньшую плотность (больший объём) воды в фазе льда. При испарении, напротив, все водородные связи рвутся. Разрыв связей требует много энергии, отчего у воды самая большая удельная теплоёмкость среди прочих жидкостей и твёрдых веществ. Для того чтобы нагреть один литр воды на один градус, требуется затратить 4,1868 кДж энергии. Благодаря этому свойству вода нередко используется как теплоноситель. Помимо большой удельной теплоёмкости, вода также имеет большие значения удельной теплоты плавления (333,55 кДж/кг при 0 °C) и парообразования (2250 кДж/кг).
| Температура, °С | Удельная теплоёмкость воды, кДж/(кг*К) |
|---|---|
| -60 (лёд) | 1,64 |
| -20 (лёд) | 2,01 |
| -10 (лёд) | 2,22 |
| 0 (лёд) | 2,11 |
| 0 (чистая вода) | 4,218 |
| 10 | 4,192 |
| 20 | 4,182 |
| 40 | 4,178 |
| 60 | 4,184 |
| 80 | 4,196 |
| 100 | 4,216 |
Физические свойства разных изотопных модификаций воды при различных температурах:
| Модификация воды | Максимальная плотность при температуре, °С | Тройная точка при температуре, °С |
|---|---|---|
| H2O | 3,9834 | 0,01 |
| D2O | 11,2 | 3,82 |
| T2O | 13,4 | 4,49 |
| H2 18 O | 4,3 | 0,31 |
Вода обладает также высоким поверхностным натяжением, уступая в этом только ртути. Относительно высокая вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями.
Вода является хорошим растворителем полярных веществ. Каждая молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
Это свойство воды используется живыми существами. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде. Вода необходима для жизни всех без исключения одноклеточных и многоклеточных живых существ на Земле.
Вода обладает отрицательным электрическим потенциалом поверхности.
Вода имеет показатель преломления n=1,33 в оптическом диапазоне. Однако она сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60 % парникового эффекта. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, на чём основан принцип действия микроволновой печи.
Агрегатные состояния
По состоянию различают:
При нормальном атмосферном давлении (760 мм рт. ст., 101 325 Па) вода переходит в твёрдое состояние при температуре в 0 °C и кипит (превращается в водяной пар) при температуре 100 °C (значения 0 °C и 100 °C были выбраны как соответствующие температурам таяния льда и кипения воды при создании температурной шкалы «по Цельсию»). При снижении давления температура таяния (плавления) льда медленно растёт, а температура кипения воды — падает. При давлении в 611,73 Па (около 0,006 атм) температура кипения и плавления совпадает и становится равной 0,01 °C. Такие давление и температура называются тройной точкой воды. При более низком давлении вода не может находиться в жидком состоянии, и лёд превращается непосредственно в пар. Температура возгонки (сублимации) льда падает со снижением давления. При высоком давлении существуют модификации льда с температурами плавления выше комнатной.
С ростом давления температура кипения воды растёт:
| Давление, атм. | Температура кипения (Ткип), °C |
|---|---|
| 0,987 (10 5 Па — нормальные условия) | 99,63 |
| 1 | 100 |
| 2 | 120 |
| 6 | 158 |
| 218,5 | 374,1 |
При росте давления плотность насыщенного водяного пара в точке кипения тоже растёт, а жидкой воды — падает. При температуре 374 °C (647 K) и давлении 22,064 МПа (218 атм) вода проходит критическую точку. В этой точке плотность и другие свойства жидкой и газообразной воды совпадают. При более высоком давлении и/или температуре исчезает разница между жидкой водой и водяным паром. Такое агрегатное состояние называют «сверхкритическая жидкость».
Вода может находиться в метастабильных состояниях — пересыщенный пар, перегретая жидкость, переохлаждённая жидкость. Эти состояния могут существовать длительное время, однако они неустойчивы и при соприкосновении с более устойчивой фазой происходит переход. Например, можно получить переохлаждённую жидкость, охладив чистую воду в чистом сосуде ниже 0 °C, однако при появлении центра кристаллизации жидкая вода быстро превращается в лёд.
Оптические свойства
Они оцениваются по прозрачности воды, которая, в свою очередь, зависит от длины волны излучения, проходящего через воду. Вследствие поглощения оранжевых и красных компонентов света вода приобретает голубоватую окраску. Вода прозрачна только для видимого света и сильно поглощает инфракрасное излучение, поэтому на инфракрасных фотографиях водная поверхность всегда получается чёрной. Ультрафиолетовые лучи легко проходят через воду, поэтому растительные организмы способны развиваться в толще воды и на дне водоёмов, инфракрасные лучи проникают только в поверхностный слой. Вода отражает 5 % солнечных лучей, в то время как снег — около 85 %. Под лёд океана проникает только 2 % солнечного света.
Изотопные модификации
И кислород, и водород имеют природные и искусственные изотопы. В зависимости от типа изотопов водорода, входящих в молекулу, выделяют следующие виды воды:
Последние три вида возможны, так как молекула воды содержит два атома водорода. Протий — самый лёгкий изотоп водорода, дейтерий имеет атомную массу 2,0141017778 а. е. м., тритий — самый тяжёлый, атомная масса 3,0160492777 а. е. м. В воде из-под крана тяжелокислородной воды (H2O 17 и H2O 18 ) содержится больше, чем воды D2O 16 : их содержание, соответственно, 1,8 кг и 0,15 кг на тонну.
Хотя тяжёлая вода часто считается мёртвой водой, так как живые организмы в ней жить не могут, некоторые микроорганизмы могут быть приучены к существованию в ней.
По стабильным изотопам кислорода 16 O, 17 O и 18 O существуют три разновидности молекул воды. Таким образом, по изотопному составу существуют 18 различных молекул воды. В действительности любая вода содержит все разновидности молекул.
Химические свойства
Вода является наиболее распространённым растворителем на планете Земля, во многом определяющим характер земной химии, как науки. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ.
Её иногда рассматривают как амфолит — и кислоту и основание одновременно (катион H + анион OH − ). В отсутствие посторонних веществ в воде одинакова концентрация гидроксид-ионов и ионов водорода (или ионов гидроксония), pKa ≈ 16.
Вода — химически активное вещество. Сильно полярные молекулы воды сольватируют ионы и молекулы, образуют гидраты и кристаллогидраты. Сольволиз, и в частности гидролиз, происходит в живой и неживой природе, и широко используется в химической промышленности.
Воду можно получать:
Под воздействием очень высоких температур или электрического тока (при электролизе), а также под воздействием ионизирующего излучения, как установил в 1902 году Фридрих Гизель при исследовании водного раствора бромида радия, вода разлагается на молекулярный кислород и молекулярный водород:
Вода реагирует при комнатной температуре:
Вода реагирует при нагревании:
Вода реагирует в присутствии катализатора:
Волновая функция основного состояния воды
Вода на Земле может существовать в трёх основных состояниях:
Вода может приобретать различные формы, которые могут одновременно соседствовать и взаимодействовать друг с другом:
Вода способна растворять в себе множество органических и неорганических веществ. Из-за важности воды как источника жизни, её нередко подразделяют на типы по различным принципам.
Виды воды по особенностям происхождения, состава или применения:
Вода, входящая в состав другого вещества и связанная с ним физическими связями, называется влагой. В зависимости от вида связи, выделяют:
Вещество, содержащее влагу, называют влажным веществом. Влажное вещество, не способное более сорбировать (поглощать) влагу, — насыщенное влагой вещество.
Вещество, в котором содержание влаги пренебрежимо мало при данном конкретном применении, называют сухим веществом. Гипотетическое вещество, совершенно не содержащее влагу, — абсолютно сухое вещество. Сухое вещество, составляющее основу данного влажного вещества, называют сухой частью влажного вещества.
Смесь газа с водяным паром носит название влажный газ (парогазовая смесь — устаревшее название).
В природе
В атмосфере нашей планеты вода находится в виде капель малого размера, в облаках и тумане, а также в виде пара. При конденсации выводится из атмосферы в виде атмосферных осадков (дождь, снег, град, роса). В совокупности жидкая водная оболочка Земли называется гидросферой, а твёрдая — криосферой. Вода является важнейшим веществом всех живых организмов на Земле. Предположительно, зарождение жизни на Земле произошло в водной среде.
Мировой океан содержит более 97,54 % земной воды, ледники — 1,81 %, подземные воды — около 0,63 %, реки и озера — 0,009 %, материковые солёные воды — 0,007 %, атмосфера — 0,001 %.
Атмосферные осадки
Вода за пределами Земли
Вода — чрезвычайно распространённое вещество в космосе, однако из-за высокого внутрижидкостного давления вода не может существовать в жидком состоянии в условиях вакуума космоса, отчего она представлена только в виде пара или льда.
Одним из наиболее важных вопросов, связанных с освоением космоса человеком и возможности возникновения жизни на других планетах, является вопрос о наличии воды за пределами Земли в достаточно большой концентрации. Известно, что некоторые кометы более, чем на 50 % состоят из водяного льда. Не стоит, впрочем, забывать, что не любая водная среда пригодна для жизни.
В результате бомбардировки лунного кратера, проведённой 9 октября 2009 года НАСА с использованием космического аппарата LCROSS, впервые были получены достоверные свидетельства наличия на спутнике Земли водяного льда в больших объёмах.
Вода широко распространена в Солнечной системе. Наличие воды (в основном в виде льда) подтверждено на многих спутниках Юпитера и Сатурна: Энцеладе, Тефии, Европе, Ганимеде и др. Вода присутствует в составе всех комет и многих астероидов. Учёными предполагается, что многие транснептуновые объекты имеют в своём составе воду.
Вода в виде паров содержится в атмосфере Солнца (следы), атмосферах Меркурия (3,4 %, также большие количества воды обнаружены в экзосфере Меркурия), Венеры (0,002 %), Луны, Марса (0,03 %), Юпитера (0,0004 %), Европы, Сатурна, Урана (следы) и Нептуна (найден в нижних слоях атмосферы).
Содержание водяного пара в атмосфере Земли у поверхности колеблется от 3—4 % в тропиках до 2·10 −5 % в Антарктиде.
Кроме того, вода обнаружена на экзопланетах, например HD 189733 A b, HD 209458 b и GJ 1214 b.
Жидкая вода, предположительно, имеется под поверхностью некоторых спутников планет — наиболее вероятно, на Европе — спутнике Юпитера.
Биологическая роль
Вода играет уникальную роль как вещество, определяющее возможность существования и саму жизнь всех существ на Земле. Она выполняет роль универсального растворителя, в котором происходят основные биохимические процессы живых организмов. Уникальность воды состоит в том, что она достаточно хорошо растворяет как органические, так и неорганические вещества, обеспечивая высокую скорость протекания химических реакций и в то же время — достаточную сложность образующихся комплексных соединений.
Благодаря водородной связи, вода остаётся жидкой в широком диапазоне температур, причём именно в том, который широко представлен на планете Земля в настоящее время.
Поскольку у льда плотность меньше, чем у жидкой воды, вода в водоёмах замерзает сверху, а не снизу. Образовавшийся слой льда препятствует дальнейшему промерзанию водоёма, это позволяет его обитателям выжить. Существует и другая точка зрения: если бы вода не расширялась при замерзании, то не разрушались бы клеточные структуры, соответственно замораживание не наносило бы ущерба живым организмам. Некоторые существа (тритоны) переносят замораживание/оттаивание — считается что этому способствует особый состав клеточной плазмы, не расширяющейся при замораживании.
Применение
Выращивание достаточного количества сельскохозяйственных культур на открытых засушливых землях требует значительных расходов воды на ирригацию, доходящих до 90 % в некоторых странах.
Для питья и приготовления пищи
Живое человеческое тело содержит от 50 % до 75 % воды, в зависимости от веса и возраста. Потеря организмом человека более 10 % воды может привести к смерти. В зависимости от температуры и влажности окружающей среды, физической активности и т. д. человеку нужно выпивать разное количество воды. Ведётся много споров о том, сколько воды нужно потреблять для оптимального функционирования организма.
Питьевая вода представляет собой воду из какого-либо источника, очищенную от микроорганизмов и вредных примесей. Пригодность воды для питья при её обеззараживании перед подачей в водопровод оценивается по количеству кишечных палочек на литр воды, поскольку кишечные палочки распространены и достаточно устойчивы к антибактериальным средствам, и если кишечных палочек будет мало, то будет мало и других микробов. Если кишечных палочек не больше, чем 3 на литр, вода считается пригодной для питья.
Вода является растворителем для многих веществ. Она используется для очистки как самого человека, так и различных объектов человеческой деятельности. Вода используется как растворитель в промышленности.
В качестве теплоносителя
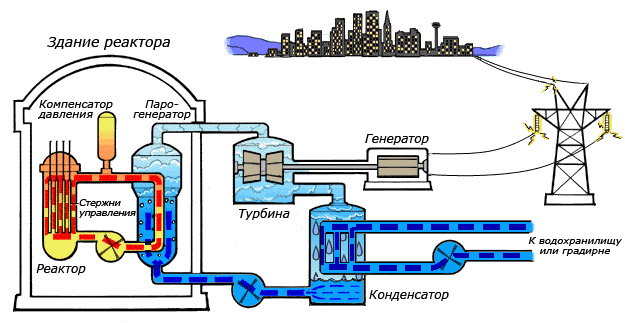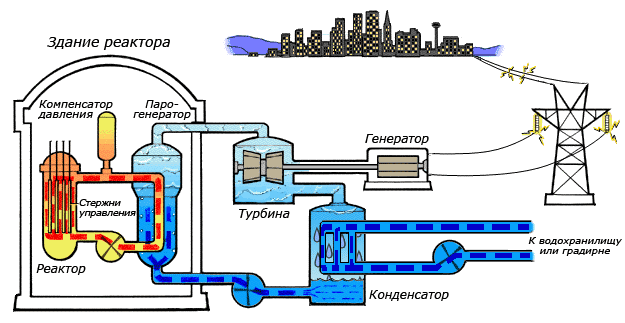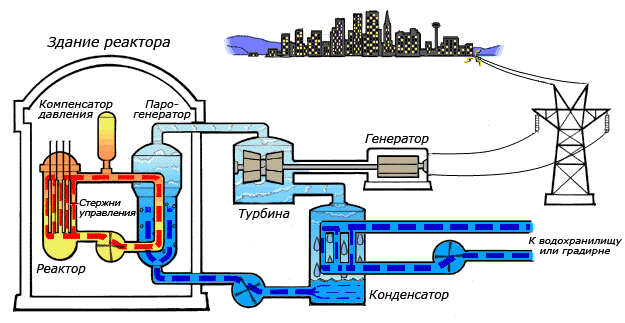
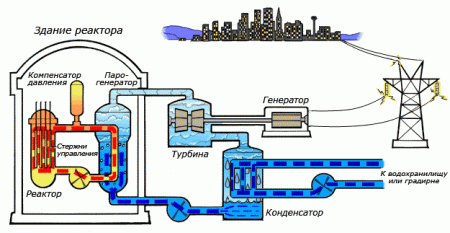
Среди существующих в природе жидкостей вода обладает наибольшей теплоёмкостью. Теплота её испарения выше теплоты испарения любых других жидкостей, а теплота кристаллизации уступает лишь аммиаку. В качестве теплоносителя воду используют в тепловых сетях, для передачи тепла по теплотрассам от производителей тепла к потребителям. Воду в виде льда используют для охлаждения в системах общественного питания, в медицине. Большинство атомных электростанций используют воду в качестве теплоносителя.
Во многих ядерных реакторах вода используется не только в качестве теплоносителя, но и замедлителя нейтронов для эффективного протекания цепной ядерной реакции. Также существуют тяжеловодные реакторы, в которых в качестве замедлителя используется тяжёлая вода.
В пожаротушении вода зачастую используется не только как охлаждающая жидкость, но и для изоляции огня от воздуха в составе пены, так как горение поддерживается только при достаточном поступлении кислорода.
Многими видами спорта занимаются на водных поверхностях, на льду, на снегу и даже под водой. Это подводное плавание, хоккей, лодочные виды спорта, биатлон, шорт-трек и др.
В качестве инструмента
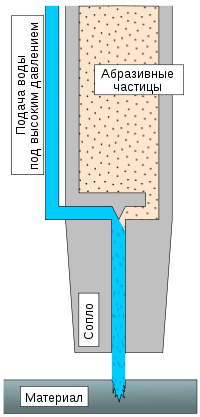
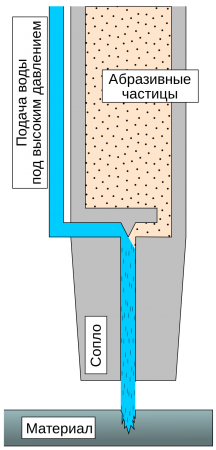
Вода используется как инструмент для разрыхления, раскалывания и даже резки пород и материалов. Она используется в добывающей промышленности, горном деле и в производстве. Достаточно распространены установки по резке водой различных материалов: от резины до стали. Вода, выходящая под давлением несколько тысяч атмосфер способна разрезать стальную пластину толщиной несколько миллиметров, или более при добавлении абразивных частиц.
Вода применяется как смазочный материал для смазки подшипников из древесины, пластиков, текстолита, подшипников с резиновыми обкладками и др. Воду также используют в эмульсионных смазках.
Исследования
Происхождение воды на планете
Происхождение воды на Земле является предметом научных споров. Некоторые учёные считают, что вода была занесена астероидами или кометами на ранней стадии образования Земли, около четырёх миллиардов лет назад, когда планета уже сформировалась в виде шара. В настоящее время установлено, что вода появилась в мантии Земли не позже 2,7 миллиардов лет назад.
Гидрология
Гидроло́гия — наука, изучающая природные воды, их взаимодействие с атмосферой и литосферой, а также явления и процессы, в них протекающие (испарение, замерзание и т. п.).
Предметом изучения гидрологии являются все виды вод гидросферы в океанах, морях, реках, озёрах, водохранилищах, болотах, почвенных и подземных вод.
Гидрология исследует круговорот воды в природе, влияние на него деятельности человека и управление режимом водных объектов и водным режимом отдельных территорий; проводит анализ гидрологических элементов для отдельных территорий и Земли в целом; даёт оценку и прогноз состояния и рационального использования водных ресурсов; пользуется методами, применяемыми в географии, физике и других науках. Данные гидрологии моря используются при плавании и ведении боевых действий надводными кораблями и подводными лодками.
Гидрология подразделяется на океанологию, гидрологию суши и гидрогеологию.
Океанология подразделяется на биологию океана, химию океана, геологию океана, физическую океанологию, и взаимодействие океана и атмосферы.
Гидрология суши подразделяется на гидрологию рек (речную гидрологию, потамологию), озероведение (лимнологию), болотоведение, гляциологию.
Гидрогеология
Гидрогеоло́гия (от др.-греч. ὕδωρ «водность» + геология) — наука, изучающая происхождение, условия залегания, состав и закономерности движений подземных вод. Также изучается взаимодействие подземных вод с горными породами, поверхностными водами и атмосферой. В сферу этой науки входят такие вопросы, как динамика подземных вод, гидрогеохимия, поиск и разведка подземных вод, а также мелиоративная и региональная гидрогеология. Гидрогеология тесно связана с гидрологией и геологией, в том числе и с инженерной геологией, метеорологией, геохимией, геофизикой и другими науками о Земле. Она опирается на данные математики, физики, химии и широко использует их методы исследования. Данные гидрогеологии используются, в частности, для решения вопросов водоснабжения, мелиорации и эксплуатации месторождений.
Водорода оксид: описание вещества, получение, свойства
Что собой представляет кислородное соединение водорода? Оксид данного элемента обладает определенными физическими и химическими свойствами. Попробуем понять двойственность признаков данного соединения и выявить его отличительные характеристики.
Определение
Самым важным и распространенным на нашей планете веществом является именно кислородное соединение водорода. Оксид его знаком нам в качестве обычной воды. Сложно представить себе какое-то иное соединение, которое имеет такое же значение для живых организмов. Оксидами принято называть бинарные соединения, в составе которых есть кислород. Важным условием при этом является расположение кислорода в конце химической формулы.
Классификация
В настоящее время выделяют три группы оксидов. Основными считают кислородные соединения, которые образованы металлами, имеющими низкую валентность (один или два). В качестве исключений из общего правила можно рассмотреть оксиды бериллия и цинка. Несмотря на то что валентность этих металлов равна двум, их кислородные соединения относят к амфотерным оксидам. Особенностью амфотерных соединений считают их взаимодействие с кислотами и щелочами. Двойственные свойства также проявляют оксиды металлов, имеющих валентность три.
Кислотные оксиды образуются неметаллами, а также металлами с валентностью от четырех до семи. К какой группе относится соединение водорода? Оксид данного элемента проявляет двойственные химические свойства, поэтому считается амфотерным соединением.
Получение в лаборатории
Восстановление оксидов водородом является одним из способов получения воды. Данный процесс используется в промышленности для переработки металлолома, выделения из него черных и цветных металлов. Гидрирование относится к термическому и каталитическому процессу, одним из продуктов которого является жидкая вода.
Распространенность в природе
Физические свойства и особенности строения
При нормальных условиях вода является бесцветной жидкостью, не имеющей вкуса и запаха. Данное вещество считается отличным полярным растворителем, поэтому многие процессы протекают именно в водной среде. Температура ее кипения составляет 100 градусов. При нулевой же температуре вода превращается в лед. Данное соединение имеет дипольное строение, а объяснить это можно особенностями молекулы. Так как у кислорода остаются незадействованными две электронные пары, в оксиде sp3 гибридное состояние имеет атом кислорода, величина валентного угла составляет 110 градусов.
Химические свойства
Конечным продуктом такого взаимодействия является щелочь.
Помимо реакций с оксидами, вода способна к взаимодействию с металлами. Щелочные металлы (без нагревания) образуют щелочь, при этом образуется и газообразный водород.
Металлы средней активности (при нагревании) образуют в реакции с водой оксид и водород. Малоактивные металлы, которые располагаются в электрохимическом ряду напряжений металлов после водорода, не способны взаимодействовать с водой.
Последовательность лабораторного получения воды может быть представлена в следующем виде: водород-оксид. Реакция, протекающая в этом случае, является экзотермической и сопровождается выделением большого количества тепловой энергии. Конечным продуктом ее является оксид водорода. Уравнение реакции имеет вид: 2Н2+О2=2Н2О
Дипольное строение молекулы воды объясняет возможность образования этим неорганическим соединением водородных связей, имеющих ковалентный характер. У этого соединения самое высокое значение теплопроводности, поэтому именно вода является тем веществом, которое применяют в отопительных системах.
Биологическое значение
Невозможно представить жизнь человека без воды. Этот универсальный растворитель нужен не только в химической лаборатории. Каждую секунду в живых существах осуществляются сложные биохимические процессы. Вода не только является активным участником многих синтезов, но и выступает в качестве побочного продукта многих из них. За шестьдесят лет своего существования, человек пропускает через свой организм около 50 тонн этого уникального неорганического вещества.
Оксид водорода нашел применение во многих сферах промышленной деятельности человека. Данное соединение незаменимо в медицине, востребовано в сельском хозяйстве.
Например, в теплоэнергетике описываемое химическое соединение является рабочим телом и основным теплоносителем. Электрические станции, базирующиеся на нем, расходуют до 40 кубических метров воды за одну секунду. К примеру, для полного охлаждения конденсатора гидротурбины, необходимо до десяти тысяч кубических метров оксида водорода. В металлургической отрасли вода применяется в качестве охлаждающего вещества для основного оборудования, используются и ее физические характеристики, например высокая теплопроводность.
В химической отрасли она востребована как хороший растворитель, а также отличное «транспортное средство» для перемещения реагентов из одного технологического препарата в другой.
Отметим, что и вывод жидких производственных отходов также осуществляется в виде суспензий и эмульсий. Сложно достоверно оценить те объемы оксида водорода, которые идут на бытовые и промышленные нужды.
Кстати, среди многочисленных существ, которые обитают на нашей планете, не нуждаются в воде только вирусы.
Вода и её полезные свойства
«Жизнь – это одушевленная вода»
Леонардо да Винчи, XVв.
Вода (оксид водорода) — бинарное неорганическое соединение с химической формулой Н2O. Молекула воды состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью.
При нормальных условиях представляет собой прозрачную жидкость, не имеющую цвета (при малой толщине слоя), запаха и вкуса. В твёрдом состоянии называется льдом (кристаллы льда могут образовывать снег или иней), а в газообразном — водяным паром. Вода также может существовать в виде жидких кристаллов (на гидрофильных поверхностях). Составляет приблизительно около 0,05 % массы Земли.
Большая часть земной воды — солёная, непригодная для сельского хозяйства и питья. Доля пресной составляет около 2,5 %, причём 98,8 % этой воды находится в ледниках и грунтовых водах. Менее 0,3 % всей пресной воды содержится в реках, озёрах и атмосфере, и ещё меньшее количество (0,003 %) находится в живых организмах. Является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы).
Исключительно важна роль воды в возникновении и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды.
Вода является важнейшим веществом для всех живых существ на Земле.
Вода и ее полезные свойства для живых существ:
Сложно переоценить то значение, которое имеет оксид водорода для всего живого. Ведь вода и есть сам источник жизни. Известно, что без нее человек не смог бы прожить и недели. Вода, ее свойства и значение просто колоссальны.
Питьевая вода — это вода, которая предназначена для ежедневного неограниченного и безопасного потребления человеком и другими живыми существами. Главным отличием от столовых и минеральных вод является пониженное содержание солей (сухого остатка), а также наличие действующих стандартов на общий состав и свойства (СанПиН 2.1.4.1074-01 — для централизованных систем водоснабжения и СанПиН 2.1.4.1116-02 — для вод, расфасованных в ёмкости).
Вода многих источников пресной воды непригодна для питья людьми, так как может служить источником распространения болезней или вызывать долгосрочные проблемы со здоровьем, если она не отвечает определённым стандартам качества воды.
Вода, которая не вредит здоровью человека, и отвечает требованиям действующих стандартов качества, называется питьевой водой. В случае необходимости, чтобы вода соответствовала санитарно-эпидемиологическим нормам, её очищают или, официально говоря, «подготавливают» с помощью установок водоподготовки.
Водопроводная вода (проточная вода, вода из городского водопровода, городского водоснабжения) — вода, поступающая для потребления из крана, доставляется в дома коммунальным предприятием по водоснабжению. Стала доступна в городах развитого мира на протяжении последней четверти XIX века, и в общем в середине XX века. Как правило, это вода из речных водозаборов.
Сточные воды — любые воды и атмосферные осадки, отводимые в водоёмы с территорий промышленных предприятий и населённых мест через систему канализации или самотёком, свойства которых оказались ухудшенными в результате деятельности человека.
Вода – это важный источник энергоресурсов.
Вода: физические, химические свойства, химическая формула, плотность
Содержание:
Вода, или оксид (окись) водорода Н2О – важнейшая среда, в которой проходят все химико-биологические реакции. На 65-70 % организмы животных и человека состоят из воды. Ее содержание в растениях еще выше – 90 %. Вода – это основа жизни.
Строение воды
Кислород – электроотрицательный элемент, к которому смещены общие электронные пары. На кислороде возникает частично отрицательный заряд, а на водороде – частично положительный. Вода – электрический диполь. Многие свойства воды обусловлены ее полярностью.
Молекулы воды между собой образовывают водородные связи, которые объясняют высокую плотность и температуру кипения. Чем выше температура реакции, тем меньшее количество связей образуется.
Физические свойства воды
Лед всегда всплывает в водоемах или стаканах с водой. Это связано с тем, что плотность горячей и холодной воды отличается. Лед обладает меньшей плотностью, чем жидкая вода.
Воде свойственна высокая теплоемкость, поэтому она медленно нагревается и остывает. С помощью теплофизических свойств воды регулируется климат. Водные бассейны регулируют температуру на нашей планете. Вода задерживает до 60 % теплового излучения нашей планеты, не позволяя ей охлаждаться.
Теплопроводность воды небольшая. Вода в водоемах нагревается не с помощью молекулярной теплопроводности, а путем перемешивания с помощью волн и течений. Если вода не перемешивается, то она нагревается частями и образуется термическая слоистость (стратификация).
Физсвойства воды отражаются в агрегатных состояниях:
В химии физические свойства воды отражаются в количестве связей между молекулами. В парах находятся отдельные молекулы, в жидкостях между ними образуются водородные связи. Если вода находится в состоянии льда, то каждая молекула соединена с соседними молекулами с помощью четырех водородных связей.
Растворимость веществ в воде
Большинство твердых веществ при нагревании растворяется быстрее. Растворимость газов повышается при понижении температуры и повышении давления.
Растворение многих веществ в воде сопровождается образованием оболочки из молекул воды. Данный комплекс называется гидратом. После кристаллизации в составе таких комплексов сохраняется часть молекул воды, образуя кристаллогидрат:
Растворы
Химические свойства воды
Вода – важнейший компонент такой реакции как гидролиз. Гидролиз – взаимодействие соли с водой, в результате которого происходит ионный обмен между молекулами.
Очистка воды
В питьевой воде не должны содержаться примеси и болезнетворные бактерии. Чтобы вода из озер и рек была пригодна для питья, ей дают отстояться в специальных бассейнах. Затем ее фильтруют через слой песка. Очищенную от нерастворимых веществ воду обрабатывают хлором, озоном или ультрафиолетовыми лучами.
Для очищения воды от растворенных в ней веществ используют перегонку, или дистилляцию. Этим способом получают дистиллированную воду. Ее применяют в лабораториях, аптеках, охладительных системах машин и т. д.
Применение воды
Развитие промышленности привело к тому, что многие водоемы загрязнены отходами производства. Поэтому в каждом государстве должны приниматься меры по охране и рациональному использованию природных ресурсов.
Вода – важный ресурс для всего живого на планете. Если ее запасы на Земле иссякнут, то растения, животные и человек погибнут. Вода является более ценным природным богатством, чем нефть и газ, железо и уголь и т. д. Это связано с тем, что воду невозможно ничем заменить.
Что будет если выпить оксид водорода
Оксид: O + 1 любой элемент. Оксид водорода HO, расставляем степень окисления, получаем H2O — вода. Ответ: Ничего, это вода 🙂
Если ответ по предмету Химия отсутствует или он оказался неправильным, то попробуй воспользоваться поиском других ответов во всей базе сайта.
Здесь легко и интересно общаться. Присоединяйся!
Деионизированную воду? В чистом виде? Ну вообше говоря хреново будет. Водно солевой баланс можеь резко нарушиться
каждый день пьём.
выпей и проверь. потом раз скажешь))
ОТ ВОДЫ ЕЩЕ НИКТО НЕ УМЕР.
Страшная вещь, можно умереть если. Не пить несколько дней))))
С утра-кайф. Подсолёную из под огурцов или квашенной капусты.
Мхм
и с родника, отлично
Спасибо и вам всего наилучшего
Ну это тоже не плохо
Только двуоксид водорода
Ага
пей пожалуйста Н2О
если ведро, то ничего не будет, если больше, то надо арбузом заесть перед сном.
Панос.
А для чего его пить?
Для уталения жажды
Бурная
Ничего, это же вода
хотите воду? выпейте на здоровье
Песец это же зверёк такой
Скоро потянет в туалет.
Ну что за тупой вопрос? Выпей, узнаешь.
А зачем тебе это.
А лучше об этом и не думай!
А что, больше нечего пить?
ничего! это вода!

Напьёшься)) Лишь бы не двуокись водорода!))
Не очень
Всего лишь умрешь
Ну это хорошо что просто умру
Это же вода! Ничего не будет!
Уес
Водород двухвалентный в этом оксиде или одновалентный? Атомов водорода сколько в этом оксиде?)) так то и тритьевую воду можно выпить 3Н2О. но какие последствия потом. )))
В одновалентном
Пробовал
Лучше чайку заварить на нем. Или кофейку
Ничего.H2O — оксид водорода. H2O2 — пероксид водорода в просторечии перекись
химию я никогда не любила
смеешься что не знаю
Нет
. выпей яду. Оксид железа(III) — амфотерный оксид с большим преобладанием основных свойств. Красно-коричневого цвета. Термически устойчив до высоких температур. Образуется при сгорании железа на воздухе. Не реагирует с водой. Медленно реагирует с кислотами и щелочами. Восстанавливается монооксидом углерода, расплавленным железом. Сплавляется с оксидами других металлов и образует двойные оксиды — шпинели.
В природе встречается как широко распространённый минерал гематит, примеси которого обусловливают красноватую окраску латерита, краснозёмов, а также поверхности Марса; другая кристаллическая модификация встречается как минерал маггемит.
. вы вопрос задали. а я ответил. что ещё нужно для неуча.
. ну да. вы ещё и писать не умеете.
По моему взгляду вы не только неуч, но и быдло
Чем старше. тем мудрее,как хорошо сказано, спасибо вам.
Пробовал и не раз
Это же вода
Оксид водорода — это вода. А вода — это жизнь. Без воды живые организмы погибнут. Человек без воды может прожить три дня.
Оксид водорода — это вода. А вода — это жизнь. Без воды живые организмы погибнут. Человек без воды может прожить три дня.
Смерть, а вот ДИГИДРОГЕНА МОНООКСИД то ничего это вода
Ну это и есть вода
Нет я не надвами, а над тем что я химию хорошо знаю
ничего это вода
какой моно или ди
в больших дозах memento more
ага захлебнуться можно
я его уже раза видел
Красавчег
можно получить вред своему организму
навредишь самому себе
А ещё лучше его вскипятить и заварки нпсыпать

Я за неделю наверное ведро кофе выжрал, так что надо чайком разбавиться немного)))
Vodichka esche nikomu ne vredila,esli prigodna dlja pit`ja
Надо и желательно каждый день
Да вроде не чего удалишь жажду )
Уес
Кукишь
смесь оксида водорода с C₂H₅OH в соотношении 60/40 является лучшим средством от скуки. В малых дозах. от 250- до 450 мл. рекомендовано Минздравом. Имеет побочный эффект. Головная боль через 8-12 часов после употребления. Устраняется той же смесью но в более меньших объёмах.







Спасибо Лариса! я старался
Вау, респек Руслановт!
Что будет, если выпить оксид водорода?
Ответы и объяснения 1
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
Этого делать не стоит:
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Оксид водорода – вода (с использованием информационных технологий)
Разделы: Химия
Цели урока. Рассмотреть нахождение воды в природе. Ознакомить учащихся со способами получения чистой воды и проблемой сохранения водных ресурсов. Повторить, систематизировать и углубить знания учащихся о составе, физических и химических (окислительно-восстановительных свойствах воды). Сформировать умения предсказывать окислительно-восстановительные свойства вещества, опираясь на его состав.
Демонстрации: модель молекулы воды, взаимодействие натрия и оксида кальция с водой, мультимедийная презентация.
Вступительное слово учителя.
Ребята, позвольте мне зачитать несколько цитат из высказывания величайших людей своего времени:
И вот о том, что такое вода и какие возможности открывает изучение свойств воды мы с вами и поговорим. Приложение 1 Слайд 1 Оксид водорода – вода.
Сегодня на уроке мы рассмотрим следующие вопросы: (Слайд 2)
К сегодняшнему уроку вы получили домашнее задание самостоятельно разобрать и сделать сообщение на тему “Нахождение воды в природе, распределение воды на Земле”, “Круговорот воды в природе”, “Очистка вод”.
Выступления учащихся: 1.Доклад на тему “Вода в природе. Распределение воды на Земле”,(Слайды 4-7); 2. “Круговорот воды в природе”(Слайд 8) рассказывают учащиеся, сопровождая презентацией;
Что же такое вода? (Слайд 9-10)Несмотря на то, что вы не изучали эту тему подробно, я думаю, что вы знаете формулу воды? Какова она? Из каких атомов состоит молекула воды?(Демонстрация шаростержневой модели воды). Каковы физические свойства воды? Вы вероятно знаете их из курса физики.(при н.у. вода жидкость, без цвета, запаха и вкуса, tкип.= 100 ◦ С, tзамерз= 0 ◦ С, p= 1г/мл). Это характеристика химически чистой воды. Вода, которая не содержит никаких примесей. Есть вода чистая, люди ее используют для своих хозяйственных нужд, эта вода содержит в своем составе допустимые растворимые вещества. Но из-за хозяйственной деятельности в природе не всегда вода чистая. Поэтому, прежде чем она попадает к нам по водопроводу эту воду необходимо очистить.
Строение молекулы воды.
А какой тип связи в молекуле воды? (Рассказ учителя о полярности молекулы воды, диполи воды, ассоциации молекул. Демонстрация, слайд 13-15 )
Далее разберем химические свойства воды, т.е. реакции в которые она может вступать. Благодаря биполярности вода может растворять многие вещества с ковалентной полярной и ионной связью (кислоты, соли, основания),(Слайд 16), но, кроме того, вода может и являться реагентом в различных химических реакциях.
1) Зная, что вода реагирует с активными металлами с образованием растворимых в воде оснований (щелочей), с основными и кислотными оксидами допишите уравнения химических реакций (Слайд 22)
1 вариант– нечетные номера; 2 вариант– четные:
Определите, какие из них являются ОВР, для них напишите уравнение электронного баланса, укажите окислитель, восстановитель и процессы окисления и восстановления.
2) Определите массовые доли водорода и кислорода в молекуле воды.(Слайд 23)
3) Задача. К 200 г раствора, массовая доля вещества в котором 0,3, добавили 100 г воды. Вычислите массовую долю растворенного вещества в полученном растворе.(Слайд 24)
Домашнее задание: учебник И.И.Новошинский, Н.С.Новошинская § 12, № 7, 8 стр. 59, (Слайд 25)
1. темы докладов и сообщений:
“Аномальные свойства воды”
“Значение воды для живых организмов”
“ Охрана водных ресурсов”
“ Всегда ли вода Н2О? Что такое тяжелая вода?”
2. Для творческих людей, если будет вдохновение написать стихи о воде.
Вода (Свойства Образование)
Вода это источник жизни на земле, она является универсальным естественным катализатором в химических реакциях, неотъемлемой частью жизнедеятельности любого организма.
Рассматривается как гидроксид водорода и гидроксильная кислота.
Вода покрывает более 71 % всей поверхности земли, при этом проявляя свойства растворителя других химических неорганических и органических веществ.
Доказано, что вода имеет (память), под воздействием звука изменяется рисунок замершего кристалла воды.
Так установлено если полностью удалить воду в ходе реакции между натрием и кислородом то реакция между ними не протекает, так как вода здесь проявляет свойства катализатора.
ВСЕ ПРО ВОДУ
Сколько воды
Вода в природе
Для Земли в участии непосредственно климатических условий и погоды.
Вода за пределами Земли
Вода один из самых распространенных веществ не только на Земле но и в космосе, из за высокого внутри-жидкостного давления и низкой температуры вакуума космоса вода встречается только в виде льда и пара.
Она очень широко распространена в солнечной системе и за ее пределами, в основном это лед.
Вода присутствует в составе всех комет и многих астероидов.
Вода в виде паров встречается не только на Земле но и атмосфере Солнца, Луны, Меркурия, Юпитера и т. д.
Ученые полагают, что в жидком состоянии она находиться на некоторых планетах, или под толстым слоем льда, а также планет приближенных к Земным условиям.
Как очистить воду
Природный источник воды не всегда удовлетворяет своим качеством, так как в ней всегда растворены множество солей, таких как хлорид натрия, нитраты и другие. Для этого питьевая вода поступает на водоочистные сооружения, где проходит неоднократную фильтрацию и очистку.
Для этого она сначала вода проходит через металлические фильтры для удаления механических примесей, далее вода поступает в систему отстойников, где осаждаются мелкие частицы, для ускорения осаждения из воды добавляют коагулянт — вещество, заставляющее взвеси и коллоидные частицы коагулировать и оседать быстрее в основном это хлорид алюминия AlCl3 или сульфат алюминия Al2(SO4)3.
После того как вода отстоится в отстойниках ее пропускают через фильтры, это может быть песок, древесная зола, тканевые фильтры и другие, после фильтрования получается почти чистая вода в состав которой входят соли и микроорганизмы, некоторые из них могут быть болезнетворные.
Для этого подготовленную воду хлорируют и она поступает в большие резервуары где некоторое время отстаивается теряя тем самым хлор и далее поступает по трубам к потребителю.
В сельской местности где нет очистительных станций, люди берут воду из колодцев, скважин и родников, но в случае попадания в землю болезнетворных организмов люди употребляя воду могу заболеть, для этого всю воду в обязательном порядке нужно кипятить для удаления микробов, а также удаления излишка кальция в виде накипи на стенках которая также может отрицательно влиять на организм при длительном его употреблении.
Дистиллированная вода

Получение дистиллированной воды на производстве
В производственных масштабах дистиллированную воду получают аналогично лабораторным, разница заключается в том, что резервуары для нагрева воды, дистиллятор сделаны не из стекла, а из металла покрытые керамическими материалами.
Эту очищенную воду применяют уже в химической промышленности для растворения солей и растворов.
Все состояния воды
Вода в нормальных условиях может находиться в 3 состояниях, жидкое, твердое, газообразное.
Существует предпосылки к появлению 4 состоянию, а именно если пар или жидкую воду мгновенно охладить то не образуются твердого кристаллического образования как при медленном замерзании.
Состояние воды напрямую зависит от температуры окружающей среды, от 0° до 100° это жидкость, от 100° и выше газообразное состояние воды, от 0° и ниже твердое, но это при нормальных условиях.
Если же изменить давление, поднявшись высоко в горы температура закипания будет на много ниже.
Из этого следует, что состояние воды не только зависит от температуры, а и давления окружающей среды, а также входящие в нее соли.
Химические свойства и название воды
Физические свойства
Именно поэтому у воды очень разветвлённая структура связей обеспечивающая высокую температуру кипения и удельную теплоту парообразования.
Чистая вода
Считается в состав которой не входят какие либо соли или другие вещества которые имеют положительные или отрицательные ионы.
Вода также интенсивно поглощает микроволновые излучения ( разогревая как бы изнутри ) проявляя дипольный момент молекул, по этому радиосвязь не работает под водой.
Изотопное состояние воды
Химические свойства воды
Иногда её сравнивают как амфолит — кислота и основание.
Как получить воду
Воду можно получить в ходе химической реакции водорода и кислорода реакция идёт при поджигании со взрывом :
Разложением пероксида водорода :
Реакцией гидрокарбоната натрия с уксусной кислотой :
В ходе нейтрализации некоторых кислот гидроксидами :
CH 3 COOH + NaOH = CH 3 COONa + H2O
Восстановлением металлов из их оксидов водородом :
Реакции с химическими веществами
Со фтором реакция протекает с образованием фтороводорода и кислорода :
Реакция с солями слабых кислот приводит к полному гидролизу :
Вода реагирует с углеродом при нагревании с образованием угарного газа но реакция не стабильна поэтому обратима :
Статья на тему вода.
Похожие страницы:
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.