Что такое титрование
Что такое титрование
ТИТРОВАНИЕ
Смотреть что такое «ТИТРОВАНИЕ» в других словарях:
титрование — прием объемного хим. анализа, состоящий в постепенном прибавлении раствора какого–либо вещества с известным титром к раствору др. вещества, концентрацию которого необходимо установить. Т. широко используется в физиологии микроорганизмов для… … Словарь микробиологии
титрование — субтитрирование, микротитрование, субтитрование, титрирование Словарь русских синонимов. титрование сущ., кол во синонимов: 4 • микротитрование (1) • … Словарь синонимов
ТИТРОВАНИЕ — постепенное прибавление контролируемого количества реагента (напр., кислоты) к анализируемому раствору (напр., щелочи) в титриметрическом анализе … Большой Энциклопедический словарь
ТИТРОВАНИЕ — ТИТРОВАНИЕ, метод, применяемый при объемном анализе для определения концентрации СОЕДИНЕНИЯ в РАСТВОРЕ. Измерение количества, необходимого для завершения реакции с другим соединением. Раствор известной концентрации добавляется в отмеренных… … Научно-технический энциклопедический словарь
ТИТРОВАНИЕ — ТИТРОВАНИЕ, титрования, мн. нет, ср. (спец.). Действие по гл. титровать. «Ширшов открыл свою лабораторию, чтобы прогреть ее для титрования.» Папанин. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
ТИТРОВАНИЕ — процесс добавления раствора известной концентрации (титрованного) к раствору анализируемого вещества до установления эквивалентных соотношений, реагирующих между собой веществ. Эквивалентная точка фиксируется с помощью индикаторов. Применяется… … Геологическая энциклопедия
титрование — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN titration … Справочник технического переводчика
Титрование — Основной прием титриметрического анализа, заключающийся в постепенном прибавлении титрованного раствора из бюретки к исследуемому раствору до достижения эквивалентности Источник … Словарь-справочник терминов нормативно-технической документации
ТИТРОВАНИЕ — основной приём титриметрического (см.), состоящий в постепенном прибавлении раствора реактива известной концентрации из бюретки к анализируемому раствору до окончания реакции (см.). По объёму израсходованного титрованного раствора вычисляют… … Большая политехническая энциклопедия
титрование — постепенное прибавление контролируемого количества реагента (например, кислоты) к анализируемому раствору (например, щёлочи) в титриметрическом анализе. * * * ТИТРОВАНИЕ ТИТРОВАНИЕ, постепенное прибавление контролируемого количества реагента… … Энциклопедический словарь
Титриметрический анализ
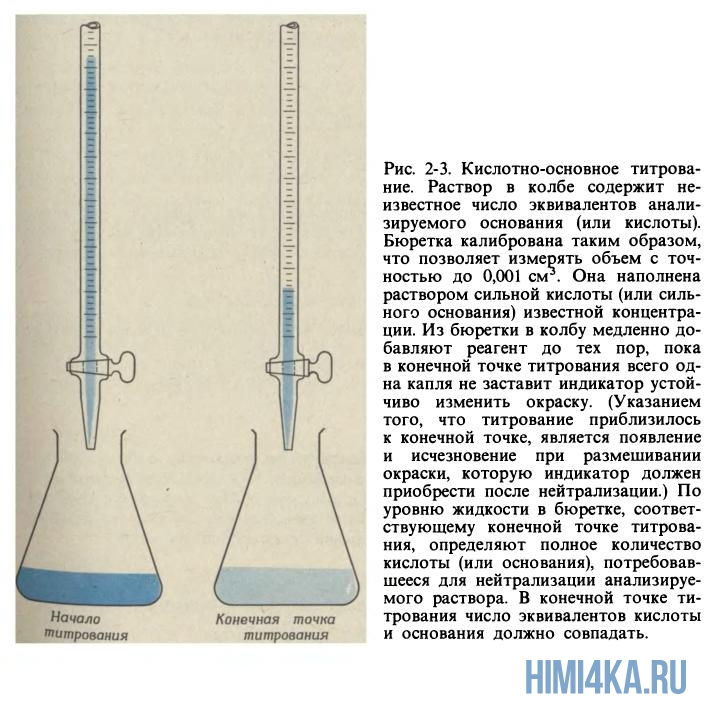
Титриметрический анализ (титрование) — методы количественного анализа в аналитической и фармацевтической химии, основанные на измерении объёма раствора реактива известной концентрации, расходуемого для реакции с определяемым веществом. Титрование — процесс определения титра исследуемого вещества. Титрование производят с помощью бюретки, заполненной титрантом до нулевой отметки. Титровать, начиная от других отметок, не рекомендуется, так как шкала бюретки может быть неравномерной. Заполнение бюреток рабочим раствором производят через воронку или с помощью специальных приспособлений, если бюретка полуавтоматическая. Конечную точку титрования (точку эквивалентности) определяют индикаторами или физико-химическими методами (по электропроводности, светопропусканию, потенциалу индикаторного электрода и т. д.). По количеству пошедшего на титрование рабочего раствора рассчитывают результаты анализа.
Содержание
Виды титриметрического анализа
Титриметрический анализ может быть основан на различных типах химических реакций:
Типы титрования
Различают прямое, обратное титрование и титрование заместителя.
См. также
Ссылки
Полезное
Смотреть что такое «Титриметрический анализ» в других словарях:
ТИТРИМЕТРИЧЕСКИЙ АНАЛИЗ — совокупность методов количественного химического анализа, заключающихся в измерении объема раствора реактива известной концентрации, расходуемого на реакцию с данным количеством (объемом) определяемого вещества. В титриметрическом анализе… … Большой Энциклопедический словарь
титриметрический анализ — – совокупность объемных методов количественного анализа, основанных на определении содержания вещества в растворе неизвестной концентрации с помощью измеренного количества другого раствора, концентрация которого точно известна. Общая химия :… … Химические термины
Титриметрический анализ — (a. titrimetric analysis, analysis by titration; н. Maβanalyse, Titration, Titrimetrie; ф. analyse titrimetrique; и. analisis titrimetrico) совокупность методов количеств. анализа, основанного на измерении кол ва реагента, расходуемого на … Геологическая энциклопедия
титриметрический анализ — Метод кол венного хим. анализа, основ. на измерении кол ва титранта, взаимодейств. с определяемым компонентом. [http://metaltrade.ru/abc/a.htm] Тематики металлургия в целом EN titrimetric analysis … Справочник технического переводчика
Титриметрический анализ — Метод анализа, в котором аналитический сигнал получают измерением объема титрованного раствора, добавляемого к исследуемому раствору Источник … Словарь-справочник терминов нормативно-технической документации
ТИТРИМЕТРИЧЕСКИЙ АНАЛИЗ — совокупность методов количественного хим. анализа, основанных на измерении объёма раствора реактива известной концентрации, расходуемого для реакции с определяемым веществом. В Т. а. используются различные типы хим. реакций: нейтрализации,… … Большая политехническая энциклопедия
титриметрический анализ — совокупность методов количественного химического анализа, заключающихся в измерении объёма раствора реактива известной концентрации, расходуемого на реакцию с данным количеством (объёмом) определяемого вещества. В титриметрическом анализе… … Энциклопедический словарь
титриметрический анализ — titrimetrinė analizė statusas T sritis chemija apibrėžtis Analizės metodai, pagrįsti titranto tūrio ar masės, arba titrantui pagaminti reikalingo elektros kiekio matavimu. atitikmenys: angl. titrimetry; titrimetric analysis; volumetric analysis… … Chemijos terminų aiškinamasis žodynas
титриметрический анализ — [titrimetric analysis] метод количественного химического анализа, основанный на измерении количества титранта, взаимодействующего с определяемым компонентом. Смотри также: Анализ электрометрический анализ химический анализ фазовый анализ … Энциклопедический словарь по металлургии
Титриметрический анализ — метод количественного анализа (См. Количественный анализ), основанный на измерении объёма раствора с точно известной концентрацией реактива, требующегося для реакции с данным количеством определяемого вещества (см. также Объёмный анализ) … Большая советская энциклопедия
Титриметрический анализ
Условия для эффективного титрования
Чтобы титрование было эффективным, должны соблюдаться определенные условия:
Условие 1: Титрант T должен иметь предпочтение для реакции только с аналитом A, а не с другими химическими веществами, которые могут присутствовать в растворе.
Примеры:
Условие 2: Должно быть известно соотношение между количеством молекул титранта, которые реагируют с каждой молекулой аналита, также известное как стехиометрия реакции.
Примеры:
Условие 3: Концентрация титранта (Т) должна быть точно известна. Объем (или иногда вес) смеси проб должен быть точно известен. Опять же, это потребуется при расчете концентрации неизвестного аналита в образце.
Условие 4: Необходим датчик для обнаружения изменений в концентрации одного из реагентов (T или A) или продукта (P), чтобы точно определить, когда к смеси было добавлено точное количество титранта (T) для реакции с аналитом (А). Это называется конечной точкой (иногда, точкой эквивалентности) титрования. В зависимости от выбранного вами метода анализа, в качестве датчика может служить глаз оператора, который обнаружит внезапное изменение цвета раствора. Для более точных измерений концентрации лучше использовать электрохимический датчик.
Условие 5: Наконец, необходимо устройство для точного измерения количества титранта (T), добавляемого к смеси образцов. Как только датчик обнаружит конечную точку, вам нужно будет обратиться к этому измерительному устройству, чтобы определить, сколько титранта было добавлено. Существуют различные типы инструментов для измерения объема титранта, от простых пипеток (метод капельного титрования: опреатор подсчитывает каждую добавленную каплю, затем расчитывается концентрация путем умножения кол-ва капель на определенный коэфициент согласно методике) до автоматических бюреток.
На нашем сайте представлен широкий асортимент необходимых приборов и реагентов HACH LANGE для проведения эффективного титриметрического анализа в соответсвии с вашим применением. В числе определяемых параметров вы найдете: pH, бромное число, диоксид серы, диоксид хлора, жесткость общая (Ca Mg), кислотность, Общее кислотное число (TAN), Общее щелочное число (TBN), содержание влаги (Карл Фишер), содержание соли, сульфит, тиол в нефтепродуктах, хлор свободный и общий, щелочность и пр. В зависимости от необходимой точности мы можем предложить вам универсальные автоматические титраторы, ручные титраторы или же тест наборы (реактивы и необходимые аксессуары):
Компания АкваАналитикс® 💧 является официальными представителем Hach Lange на территории России и стран СНГ. Для получения консультации или подбора лабораторного / промышленного оборудования и реагентов для выполнения титриметрического анализа на вашем предприятии или в лаборатории, свяжитесь с нами удобным для вас способом.
ТИТРОВАНИЕ
ТИТРОВАНИЕ. (от франц. titre – качество, характеристика) – один из методов количественного анализа, основанный на измерении количества реагента, который полностью реагирует с анализируемым веществом. Например, если точно известно, какое количество гидроксида калия (в граммах или молях) израсходовано в реакции с соляной кислотой, то по уравнению реакции KOH + HCl = KCl + H2O легко рассчитать, сколько граммов (или молей) хлороводорода было в анализируемом растворе.
Подобные расчеты можно проводить только для стехиометрических реакций. Этот термин ввел в употребление в 1792 немецкий химик Иеремия Рихтер. Он произвел его от греческих слов, означающих «невидимый» и «измерение», что должно было означать соотношение «невидимых» химических элементов в реакциях. Рихтер впервые в истории химии начала использовать количественные уравнения реакций. Например, по его данным, из 2400 гранов CaCO3 при сильном прокаливании получается 1342 грана CaO, т. е. реакция разложения CaCO3 = CaO + CO2 характеризуется соотношением CaCO3:CaO = 2400:1342 = 1,788, что удивительно хорошо согласуется с современным расчетом, который дает отношение 1,785.
Все реакции, которые используются в количественном анализе, обязательно должны быть стехиометрическими. Для этих реакций коэффициенты, стоящие перед формулами реагентов, показывают, в каких количественных соотношениях находятся реагенты и продукты. Например, соотношение реагентов в реакции окисления щавелевой кислоты перманганатом калия в кислой среде в точности соответствует уравнению
Поэтому эту реакцию можно использовать для точного определения концентрации перманганата в растворе, если известно количество израсходованной щавелевой кислоты (и наоборот). А вот рассчитать точно количество прореагировавшего с перманганатом калия алкена невозможно, так как эта реакция нестехиометрическая: при окислении из алкена образуется диол: R-CH=CH-R + 2[O] ® R-CH(OH)-CH(OH)-R, который может окисляться далее с разрывом углерод-углеродной связи и образованием двух молекул с карбонильной группой (кислоты или кетона). При этом разные опыты, даже проведенные в одинаковых условиях, дадут немного разное количество продуктов и их соотношение; в органической химии выход реакции очень редко бывает в точности равным 100,00%.
Чтобы анализ был точным, необходимо, помимо полного протекания реакции, чтобы реагент добавлялся к анализируемому веществу малыми порциями (например, по одной капле разбавленного раствора), а также чтобы можно было надежно определить момент, когда реакция закончилась. Для выполнения второго условия применяют различные индикаторы.
Индикаторы бывают самые разные. Рассмотрим реакцию питьевой соды с уксусом: NaHCO3 + CH3COOH = CH3COONa + CO2 + H2O. Из этого уравнения следует, что 1 моль соды (84 г) полностью реагируют с 60 г уксусной кислоты. При этом выделяются пузырьки углекислого газа, которые и могут служить индикатором. Если к гидрокарбонату натрия известной массы добавлять по каплям уксус, пока не перестанет выделяться газ, то, измерив объем добавленного раствора и зная его плотность, легко рассчитать количество чистой уксусной кислоты в добавленном растворе и, следовательно, концентрацию уксуса. Например, если для полной реакции с 1,00 г соды потребовалось 10,5 г уксуса, то это значит, что в уксусе было 60/84 = 0,714 г чистой уксусной кислоты, а его крепость составляет (0,714/10,5)100% = 6,8%. При очень точных расчетах химики используют уточненные значения атомных масс элементов (в данном случае 84,01 для гидрокарбоната натрия и 60,05 для уксусной кислоты).
Конечно, описанный опыт по титрованию рассмотрен только для примера. Ведь газ выделяется далеко не во всех химических реакциях, да и заметить последний пузырек газа непросто, особенно если газ частично растворяется, а раствор имеет темную окраску. Поэтому обычно используют специальные индикаторы, изменение цвета которых свидетельствует о достижении конца реакции – так называемой точки эквивалентности.
Одни из самых распространенных индикаторов – кислотно-щелочные. Они применяются в тех случаях, когда в ходе титрования, т.е. постепенного добавления реагента к анализируемому раствору изменяется рН среды. Это происходит, например, если к анализируемому раствору щелочи добавляют раствор кислоты (или наоборот). Анализируемый раствор готовят по объему или по навеске (ее взвешивают на точных аналитических весах обычно до 0,1 мг), которую растворяют в мерной колбе точно известного объема (такие колбы могут иметь объем 10, 25, 50, 100, 200, 250, 500 или 1000 мл). Небольшой объем анализируемого раствора отбирают из мерной колбы с помощью специальных мерных пипеток (их объем также определен с высокой точностью и составляет обычно 10, 20, 25 и 50 мл) и помещают в коническую колбочку для титрования. В эту колбочку по каплям при непрерывном перемешивании добавляют раствор реагента из бюретки до достижения точки эквивалентности.
Объем израсходованного раствора реагента измеряют по делениям бюретки; ее объем может быть равен 10, 25 или 50 мл, а цена деления – 0,1 мл. Существуют и микробюретки емкостью от 1 до 5 мл с ценой деления 0,01 мл. Раствор из бюретки с помощью краника добавляют по каплям к раствору анализируемого вещества. При этом титрование всегда повторяют несколько раз и берут усредненный результат – это повышает точность и надежность анализа. Если концентрацию растворов измерять в единицах моль/л, то по объему растворов анализируемого вещества и реагента можно сразу определить неизвестную концентрацию вещества. Например, если на титрование 25,00 мл раствора KOH пошло 12,55 мл раствора HCl с концентрацией 0,0865 моль/л (ее определяют заранее), то концентрация щелочи равна 0,0865(12,55/25,00) = 0,0432 моль/л. Понятно, что если для титрования использовали раствор серной кислоты, то необходимо учитывать стехиометрический коэффициент 2 в уравнении реакции 2KOH + H2SO4 = K2SO4 + 2H2O. Химики-аналитики, чтобы учесть стехиометрические коэффициенты, обычно используют вместо молярности нормальность раствора. Так, 1 н. раствор H2SO4 соответствует молярной концентрации 0,05 моль/л. Тогда произведение объема на нормальность раствора всегда будет одинаковым и для анализируемого вещества, и для реагента.
Кислотно-основных индикаторов известно множество (около 100), и каждый из них имеет свою область применения. Это можно показать на следующих примерах. При титровании сильной кислоты (HCl) сильной щелочью (NaOH) полная нейтрализация достигается, когда раствор, содержащий NaCl, нейтрален (рН = 7). В этом случае можно пользоваться такими индикаторами как нитразиновый желтый (окраска изменяется от желтой до сине-фиолетовой в интервале рН 6,0 – 7,0) или бромтимоловый синий, имеющий сходные характеристики. При титровании сильной кислоты сильной щелочью (или наоборот) изменение рН в точке эквивалентности бывает настолько резким, что можно использовать и многие другие индикаторы. Например, в указанном примере при концентрациях реагентов 0,1 моль/л после добавления 99,9% всей щелочи рН раствора равен 4, а после добавления 0,1% избытка щелочи рН = 10. Такое резкое изменение рН при титровании может быть вызвано всего 1–2 каплями реактива. Поэтому не будет ошибкой в данном случае воспользоваться и такими индикаторами как метиловый оранжевый (окраска изменяется от красной при рН 3,1 до оранжево-желтой при рН 4) или хорошо известным фенолфталеином (окраска изменяется от бесцветной при рН 8,2 до малиново-красной при рН 10,0).
Если же титровать раствором NaOH слабую кислоту, например, уксусную, то в конце титрования после полной нейтрализации кислоты раствор содержит ацетат натрия CH3COONa, который, вследствие гидролиза, имеет щелочную реакцию (рН около 9). В этом случае уже нельзя пользоваться метиловым оранжевым, но можно – фенолфталеином. С другой стороны, при титровании слабой щелочи (например, раствора аммиака) сильной кислотой (HCl) в точке эквивалентности в растворе присутствует NH4Cl, который из-за гидролиза имеет кислую реакцию (рН около 5), и здесь можно использовать метиловый оранжевый и нельзя – фенолфталеин.
Особый случай – выбор индикатора при титровании многоосновных кислот (например, Н3РО4), а также смесей веществ. Так, растворы NaOH обычно содержат примесь карбоната из-за реакции с углекислым газом воздуха. Если титровать раствор NaOH, содержащий Na2CO3, сильной кислотой в присутствии фенолфталеина, то раствор обесцветится, когда будет нейтрализована вся щелочь и частично – карбонат (это произойдет при рН около 8,5) в соответствии с уравнением
Если к такому раствору добавить метиловый оранжевый и продолжать титрование, то желтая окраска перейдет в розовую, когда прореагирует весь гидрокарбонат (этому соответствует рН около 3,5): NaHCO3 + HCl = NaCl + H2CO3.
Таким образом, используя два кислотно-основных индикатора, можно рассчитать по отдельности содержание щелочи и карбоната в образце.
Если в ходе титрования протекает реакция окисления – восстановления, используются специальные индикаторы, изменяющие свой цвет в зависимости от окислительно-восстановительного потенциала раствора. Часто окрашенный реагент сам может служить индикатором. например, при количественном анализе восстановителей путем их титрования раствором KMnO4, точка эквивалентности определяется по исчезновению розовой окраски перманганата. Таким образом можно, например, определить содержание в растворе железа(II) в соответствии с уравнением 10FeSO4+ 2KMnO4+ 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O. Пока в растворе присутствуют ионы Fe2+, добавляемый KMnO4 обесцвечивается. Как только появится малейший избыток перманганата, раствор приобретает розовую окраску. Так можно анализировать различные восстановители.
Более того, с помощью перманганатометрии можно проводить анализ и окислителей! Для этого используют так называемое обратное титрование. Для этого к известному объему окислителя (например, дихромата калия) добавляют в избытке известное количество восстановителя – железа(II). Реакция K2Cr2O7 + 6FeSO4 + 7H2SO4 = Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O проходит очень быстро. Затем с помощью титрования перманганатом определяют, сколько осталось железа(II) и простым вычитанием рассчитывают, сколько его израсходовалось в первой реакции с дихроматом.
Другой распространенный метод с использованием окислительно-восстановительных реакций – иодометрия (см. ИОД) Он применяют, например, для определения окислителей, которые, реагируя с иодидом калия, окисляют его до свободного иода, например: 10KI + 2KMnO4 + 8H2SO4 = 2MnSO4 + 5I2 + 6K2SO4 + 8H2O. Здесь также используют принцип обратного титрования: количество выделившегося в первой реакции иода можно определяют, используя его реакцию с тиосульфатом натрия: I2 + 2Na2S2O3 = Na2S4O6 + 2NaI. Конец этой реакции определяют по исчезновению окраски иода. Однако когда иода в растворе остается мало, его бледно-желтая окраска почти не видна и трудно заметить момент, когда раствор обесцвечивается полностью. Чтобы повысить точность титрования, ближе к его концу к раствору добавляют немного крахмального раствора: малейшие следы иода окрашивают его в синий цвет. Следовательно, исчезновение синей окраски свидетельствует о том, что реакция прошла полностью. Химики обычно используют очень разбавленные растворы тиосульфата (например, 0,01 моль/л), что значительно повышает точность анализа, поскольку большие объемы раствора измеряются более точно.
Иод очень легко и быстро окисляет аскорбиновую кислоту (витамин С). Поэтому с помощью иодометрического анализа можно даже в домашних условиях определить (конечно, без особой точности) содержание этого витамина, например, в апельсиновом соке. (Применять здесь кислотно-основное титрование нельзя, так как в соке в значительно бoльших количествах содержатся другие органические кислоты – лимонная, яблочная, винная и другие.) Анализ основан на том, что 1 моль аскорбиновой кислоты (176 г) реагирует с 1 моль иода (254 г). Для титрования можно использовать аптечную иодную настойку, считая, что иод не выдохся и она точно 5%-ная (это соответствует концентрации около 0,2 моль/л). Количество израсходованного иода можно оценить с помощью обычной пипетки – по числу капель настойки, использованной в реакции. Так как аскорбиновой кислоты в соке обычно не очень много, на титрование его порции (например, 20 мл) может пойти всего 1–2 капли настойки, что приведет к очень большой ошибке анализа. Чтобы результат был более точным, надо либо взять много сока, либо разбавить иодную настойку; в обоих случаях число капель иода, израсходованных на титрование, увеличится, что и сделает анализ точнее. Химики предпочитают второй путь.
Если настойку разбавить кипяченой водой (химики пользуются дистиллированной) в 40 раз, то концентрация такого раствора будет около 0,005 моль/л; 1,0 мл такого раствора соответствует 0,88 мг аскорбиновой кислоты. Необходимо также определить объем капли (он зависит от типа пипетки, а также от конкретного раствора). Для этого надо с помощью медицинского шприца на 1 или 2 мл отмерить 1 мл разбавленного раствора иода, а затем посчитать, сколько в этом объеме содержится капель (это займет всего несколько минут). Методику желательно отработать вначале на стандартном растворе аскорбиновой кислоты. Его можно приготовить из таблетки с известным содержанием аскорбиновой кислоты – например, 0,1 или 0,5 г. Таблетку надо растворить в 0,5 л кипяченой воды и отобрать с помощью аптечной мензурки 25 мл этого раствора (витамина в нем будет в 20 раз меньше, чем в таблетке). К этому раствору и добавляют разбавленную иодную настойку, не забывая в конце добавить немного жидкого крахмального клейстера. И если, например, на титрование 25 мл раствора пошло 6,0 мл раствора иода, то аскорбиновой кислоты в растворе было 0,88.6 = 5,28 мг, а в исходной таблетке – в 20 раз больше, т.е. 105,6 мг. Такая небольшая ошибка свидетельствует о правильности «домашнего» анализа.
Химики, конечно, не капают из пипетки, а используют точные бюретки с делениями. Кроме того, они часто не готовят даже сами стандартные растворы, а пользуются фабричными; такие растворы в запаянных ампулах называются фиксаналами – они содержат фиксированное количество реагента (обычно 0,1 моль) для точного определения концентрации рабочего раствора. Фиксаналами служат, например, растворы KMnO4, K2Cr2O7, NaCl, H2C2O4, HCl, AgNO3, NaOH и др.
Широкое распространение получили комплексонометрические индикаторы – вещества, образующие с ионами некоторых металлов (многие из которых бесцветны) окрашенные комплексные соединения. Примером может служить эриохром черный Т; раствор этого сложного органического соединения имеет синий цвет, а в присутствии ионов магния, кальция и некоторых других образуются комплексы, окрашенные в интенсивный винно-красный цвет. Анализ ведут так: к раствору, содержащему анализируемые катионы и индикатор, добавляют по каплям более сильный, по сравнению с индикатором, комплексообразователь, чаще всего – трилон Б. Как только трилон полностью свяжет все катионы металлов, произойдет отчетливый переход от красного цвета к синему. По количеству добавленного трилона легко вычислить содержание катионов металла в растворе. С помощью комплексонометрического анализа определяют, например, общую жесткость воды.
Существуют методы титрования, основанные на образовании осадка. Так, с помощью аргентометрии можно определить содержание в растворе хлоридов и бромидов. Для этого раствор титруют раствором AgNO3. Для более четкого установления точки эквивалентности, в анализируемый раствор добавляют 1–2 капли раствора K2Cr2O4. Пока в растворе есть избыток галогенид-ионов, образуются менее растворимые AgCl или AgBr. После полного осаждения этих ионов, сразу появится красноватый осадок Ag2CrO4. Если же надо определить ионы серебра в растворе, его титруют раствором NaCl.
Описанные приемы далеко не исчерпали существующие методы титрования. Широкое распространение получили также методы, в которых за ходом титрования следят с помощью приборов. Например, при кондуктометрическом анализе (от англ. conductivity – электропроводность) измеряют электропроводность раствора, которая меняется в ходе титрования. При потенциометрическом методе измеряют потенциал электрода, погруженного в анализируемый раствор. Фотометрический анализ основан на измерении поглощения света при изменении интенсивности окраски раствора. Разработаны приборы, которые не только определяют точку эквивалентности, но и сами автоматически добавляют по каплям рабочий раствор к анализируемому и выдают готовый результат анализа.
Титрование как метод анализа отличается простотой методики и аппаратуры, а также высокой точностью: с помощью титрования нетрудно определить концентрацию вещества в растворе с точностью до 0,1%. Поэтому титриметрические методы широко применяются в научных исследованиях и при контроле технологических процессов на производстве. Так, при изучении кинетики реакции определяют уменьшение со временем концентрации исходного реагента или рост концентрации продукта реакции; таким способом, например, были выполнены классические работы по механизму реакций замещения в органических соединениях. В промышленности широко используются титраторы – приборы для автоматического выполнения титриметрических анализов. Они очень удобны для проведения массовых однотипных анализов (например, для определения состава сплава в процессе его выплавки или содержания в нем вредных примесей). Такие приборы способны долго работать в отсутствие лаборанта, автоматически отбирать пробы и выдавать результаты анализа. Это особенно важно при необходимости работы с радиоактивными, ядовитыми или взрывчатыми веществами, в запыленных помещениях и т.п.
Что такое титрование?
Ответы на часто задаваемые вопросы о титриметрическом анализе
Посмотрите видеоролик: Что такое титрование?
Титрование — это аналитический метод, предназначенный для количественного определения отдельного вещества (анализируемого компонента), растворенного в образце. Метод основан на наблюдении полного прохождения химической реакции между анализируемым компонентом и добавляемым к раствору реагентом (титрующим веществом) известной концентрации.
анализируемое вещество + реагент (титрант) → продукты реакции
Найдите все ответы на вопросы о титровании!
Титрование — это аналитический метод, предназначенный для количественного определения отдельного вещества (анализируемого компонента), растворенного в образце. Метод основан на наблюдении полного прохождения химической реакции между анализируемым компонентом и добавляемым к раствору реагентом (титрующим веществом) известной концентрации.
анализируемое вещество + реагент (титрант) = продукты реакции
Хорошо известным примером является титрование уксусной кислоты (CH3COOH) в уксусе гидроксидом натрия NaOH:
Титрант добавляется до тех пор, пока реакция не будет полностью завершена. Реакция пригодна для аналитических целей, если момент ее завершения можно легко наблюдать. Это значит, что полноту протекания реакции нужно контролировать подходящим методом, например, потенциометрическим (измерение потенциала специальным датчиком), или с помощью веществ-цветовых индикаторов. Концентрация анализируемого вещества рассчитывается по израсходованному количеству титранта на основе стехиометрии химической реакции. Реакция, используемая для титрования, должна быть быстрой, однозначной, полной и четко наблюдаемой.
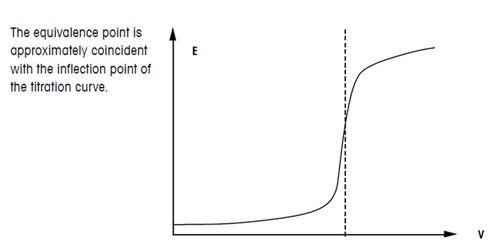
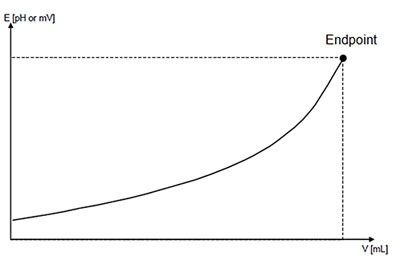
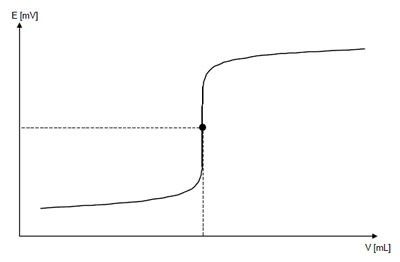
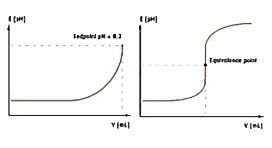
Кривые титрования отображают количественный ход титрования. Они позволяют быстро оценивать метод титрования. Делается различие между логарифмическими и линейными кривыми титрования.
Кривая титрования имеет в своей основе две переменные:
объем титранта как независимая переменная; и отклик раствора, то есть значение pH для кислотно-основного титрования, как зависимая переменная, зависящая от состава двух растворов.
Кривые титрования могут принимать четыре разные формы и должны анализироваться с помощью соответствующих алгоритмов оценки. Этими четырьмя формами являются: симметричная кривая, асимметричная кривая, кривая с минимумами/максимумами и сегментированная кривая.




















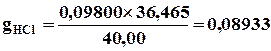 г
г


