Гипохлорид натрия кг что такое
Гипохлорид натрия кг что такое
Натрия Гипохлорит
Химическое название
Натриевая соль хлорноватистой кислоты
Химические свойства
Гипохлорит Натрия — что это такое? Это неорганическое соединение, в составе которого находится до 95% активного хлора. Вещество имеет несколько нетривиальных, исторических названий: «лабарракова вода», «жавелевая вода». Химическая формула гипохлорита натрия: NaOCl. Молекулярная масса соединения = 74,4 грамма на моль. В связи с тем, что вещество достаточно неустойчиво в свободном состоянии, оно чаще всего применяется в форме пентагидрата или водного раствора. У раствора сильный, резкий запах хлора. Безводная форма вещества синтезируется в виде бесцветных кристаллов, которые хорошо растворяются в воде. Пентагидрат обладает желто-зеленым оттенком, кристаллы ромбической формы.
По своим химическим свойствам – это сильный окислитель. Гипохлорид легко разлагается до хлорида Na и кислорода, при нагревании подвергается диспропорционированию. В воде диссоциирует на ионы. Вещество подвергает коррозии большинство металлов.
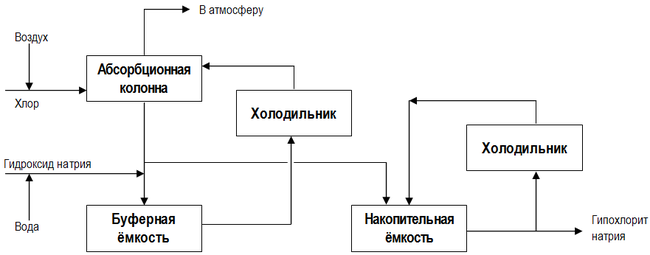
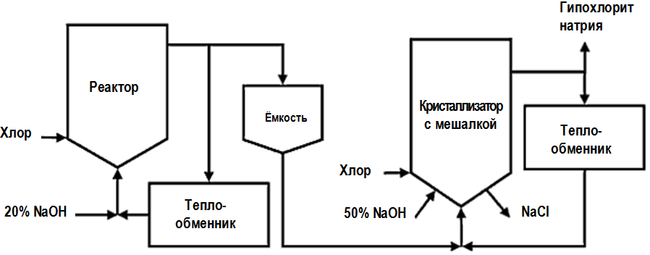
Гипохлорит Натрия производится в огромных количествах. Около половины синтезированного вещества применяют в бытовой химии и медицине, остальное – в промышленности. Существует два метода производства средства: химический, хлорирование водного раствора натрия гидроксида (концентрированный и основной) и электролитический, используют электролизные установки для электролиза водного хлорида натрия.
Химическое соединение активно применяется в промышленности:
Вещество используют в бытовой химии, его часто можно обнаружить в составе отбеливателей, средств для дезинфекции и очистки. В медицине используют наружно или местно в качестве противовирусного, бактерицидного и противогрибкового средства; в небольших концентрациях — для обработки операционных ран, в гинекологии и акушерстве, оториноларингологии, в стоматологии (эндодонтия).
Химическое соединение может оказывать вредное воздействие на организм человека, при вдыхании оказывать удушающий и раздражающий эффект. При попадании средства в глаза вещество вызывает химический ожог, может привести к потере зрения. Средство раздражает кожу, в больших концентрациях вызывает отмирание тканей, язвы и ожоги. После приема внутрь 3-6% раствора у человека развивается ацидоз, раздражение пищевода, более высокие концентрации могут вызвать перфорацию пищеварительного тракта. Несмотря на это, при соблюдении рекомендации по использованию препаратов, воды и бытовой химии, гипохлорит считается достаточно безопасным средством. Не обладает канцерогенными, мутагенными и тератогенными средствами. Токсическая доза при внутривенном введения для человека составляет 45 мг на кг веса; пероральная – 1 грамм на кг. Также считается, что вещество не создает экологических проблем, так как в окружающей среде быстро разлагается до воды, кислорода и поваренной соли. Класс опасности для концентрированных растворов (до 20%): 1 – по химической активности; 3 – опасность для здоровья человека. Не территории Российской Федерации гипохлорит Na выпускают по ГОСТу 11086-76.
Фармакологическое действие
Дезинфицирующее, детоксицирующее, антисептическое, противомикробное.
Фармакодинамика и фармакокинетика
Натрия Гипохлорит – одно из сильнейших антибактериальных средств. Гипохлорит-ион проявляет высокую активность по отношению к множеству известных микроорганизмов, причем действует в достаточно низких концентрациях. Наивысшая активность проявляется при нейтральном рН. Образующиеся при разложении вещества частицы окисляют биополимеры в структуре вредоносных агентов, разрушают молекулы практически всех орг. субстратов. Средство проявляет активность по отношению к грамотрицательным бактериям, кишечной палочке, серрации, синегнойной палочке, грамположительным бактериям, патогенным грибам, простейшим, вирусам. Однако лекарство не действует на возбудители криптоспоридиоза и лямблиоза. Средство не обладает тератогенными, канцерогенными и мутагенными свойствами.
Показания к применению
Применяют наружно и вводят внутрь полости в концентрации 0,06%:
Раствор применяют для инъекционного введения при эндо- и экзотоксикозах, отравлениях, сепсисе, ожогах, заболеваниях печени и почек.
В виде жидкости и гелей вещество используют для дезинфекции оборудования в пищевой промышленности, при обработке поверхностей.
Противопоказания
Натрия Гипохлорит противопоказан к применению:
Побочные действия
Редко вещество вызывает:
Гипохлорит Натрия, инструкция по применению (Способ и дозировка)
Вещество используют для обработки помещения и различных поверхностей в соответствии с рекомендациями.
Лекарство применяют внутривенно, наружно и вводят в полости в форме 0,06% раствора. Следует соблюдать инструкцию по применению.
Передозировка
Нельзя превышать рекомендуемую дозировку и пренебрегать правилами использования гипохлорита Na. Средство может раздражать дыхательные пути, кожу, вызывать эрозии и перфорации ЖКТ, раздражать глаза.
Взаимодействие
Вещество не рекомендуется сочетать с прочими антисептическими средствами и мылом. Перед применением других лекарственных средств рекомендуется тщательно промыть обрабатываемый участок.
Особые указания
Раствором гипохлорита нельзя обрабатывать хирургические инструменты и материалы.
Не допускать попадания средства в глаза и дыхательные пути.
При беременности и лактации
Вещество не используют для инъекционного введения у беременных женщин.
Сферы применения гипохлорита натрия
Самая известная особенность гипохлорита натрия кроется в его антибактериальных свойствах проявляющихся из-за наличия гипохлорит-иона. Гипохлорит – производные соли и эфиры хлорноватистой кислоты. Гипохлорит-ион – окислитель, отвечающий за разложение органики в очищенной воде, при этом для активации этих свойств не требуется большой концентрации вещества и много времени.
Именно вышеописанное свойство определило самое популярное направление использования гипохлорита натрия – бытовое.
Подробнее о характеристиках, свойствах и технических условиях гипохлорит натрия, читайте в соответствующей статье.
Бытовое и промышленное использование
Гипохлорит натрия используется для следующих целей:
Дезинфекция и антибактериальные обработки
Для таких целей используют раствор, полученный заводским способом, заключающимся в поглощении хлора едким натром. Полученные растворы отличаются содержанием активного хлора и щелочности. Выпускаются в стальных цистернах, полиэтиленовых канистрах, бочках. Для целей дезинфекции и обеззараживания проводится орошение, протирание, мытье, замачивание необходимых объектов. Не подлежит обработке гипохлоритом натрия окрашенное и неокрашенное белье и прочие ткани, металлические предметы и конструкции, если они не защищены от коррозии.
Наибольшую популярность применение такого раствора имеется при обеззараживании воды в бассейнах, при производстве отбеливающих свойств, для очищения сточных вод, для дезинфекции медицинских помещений и мест общественного питания, при обработке технологического оборудования для производства продуктов питания.
Отбеливание
В самых популярных бытовых отбеливателях типа «Белизна», гипохлорит натрия и его содержащая хлорноватистая кислота работают на то, чтобы разрушать краситель любого рода. Ежегодно мировые компании производят около 5 миллионов тонн гипохлорита натрия используемого как отбеливатель и пятновыводитель. Его разрешено применять для хлопка, полиэстера, нейлона, льна, вискозы и многих других. Его уникальные особенности способны удалить следы травы и почвы, пятна крови, кофе, и устойчивые пятна от фруктовых соков.
В отбеливающих составах содержание гипохлорита натрия не должно превышать 2-10%. Выпускаются в жидкой форме, в пластике и стекле. Эффективность подтверждена без нагревания и механической обработки. Однако в этом направлении есть и минусы использования гипохлорита натрия. Так его применение приводит к преждевременному изнашиванию, сокращению сроков жизни материалов и тканей, невозможностью использования с металлическими конструкциями и стиральными машинами, короткий срок хранения растворов, специфический запах.
Растворение химических санитарно-технических отложений
Гипохлорит натрия отлично проявляет себя в качестве очистителя санитарно-технических комнат и помещений. Его способность удалять налет от воды, ржавчину и пищевые загрязнения имеет туже природу, что и отбеливание. Из-за этих способностей гипохлорит натрия входит в состав многих магазинных чистящих средств. Как правило, для этих целей применяется раствор с концентрацией данного вещества в пределах 3-6 %. Его можно найти в составе таких средств как: Белизна, Clorox Regular-Bleach, Aquachem Chlorinizor, Tiret, Domestos.
Применение гипохлорита натрия в медицине
Кроме вышеописанных характеристик (в бытовом и промышленном варианте) применение гипохлорита натрия распространено в медицинской отрасли.
И в данной области гипохлорит натрия известен своими обеззараживающими свойствами. Его применяют для дезинфекции ран, как антисептический раствор, противовирусное, противогрибковое, бактерицидное средство. Допустимо применение как наружно, так и в качестве местного использования.
В медицинской области его часто используют для обеззараживания воды. NaOCl «стоит на страже» поддержания гигиенических стандартов с начала XX века, был фаворитом в борьбе с холерой, дизентерией, брюшным тифом. Используется в составе 0,06% раствора наружно, так и для инъекций.
В хирургии распространена практика обработки хирургического инструмента, а также операционных ран раствором гипохлорита натрия. В стоматологии используется для орошения ротовой полости во время проведения хирургических манипуляций.
NaOCl в борьбе с COVID19
В настоящее время отдельно следует упомянуть, что гипохлорит натрия входит во многие средства для дезинфекции и обработки помещений. Всемирная организация здравоохранения называет одной из самых эффективных мер в COVID19 мытье и обработку рук и подручных предметов антибактериальными средствами. Конечно, в настоящее время точно не известно о «живучести» вируса на поверхности, но рекомендация обрабатывать поверхности берет свое начало со схожести коронавируса с другими вирусами, у которых жизнеспособность на поверхностях (от минут до нескольких дней) имеет доказательную базу.
В октябре 2020 года французские ученые в результате опытов сделали вывод, о живучести коронавируса SARS-Cov-2 на бумажных и полимерных банкнотах, стекле и нержавеющей стали в течение 28 дней. Такое открытие говорит о том, что средства дезинфекции как защита от опасного заболевания актуальны как никогда.
Во многие средства для дезинфекции входит гипохлорит натрия как неорганический активный хлор. Хлорактивные соединения имеет высокую эффективность и широкий спектр антивирусной активности, борются с бактериями многих типов, спорами и патогенными флорами, грибами.
Согласно рекомендации ВОЗ концентрация гипохлорита натрия в санитайзерах и жидкостях для обработки помещений должна быть не менее 0,5% по активному хлору.
Гипохлорит натрия в пищевой промышленности
Плохо очищенные поверхности при контакте с пищевыми продуктами приводят к тому, что в продуктах образуется патогенная микрофлора. В связи с чем, на любом производстве при контакте с пищевыми продуктами соблюдение санитарно-технических норм является стратегически важной задачей. Для этих задач гипохлорит натрия стали применять еще в начале ХХ века. Именно тогда опытным путем было выявлено, что данное вещество гораздо более стойкое в отношении всех спор и бактерий.
Гипохлорит натрия в пищевой сфере используется для таких целей как:
ООО «Эверест» предлагает оптовую продажу гипохлорита натрия. Поставки осуществляются в канистрах 25 кг и еврокубах. Оставьте заявку или свяжитесь по телефону: +7 (812) 448-47-55, чтобы получить выгодное предложение.
Гипохлорит натрия. Вся польза Лабарраковой воды
Для чего нужен раствор гипохлорита натрия
Гипохлорит натрия – технический химикат для очистки зараженной воды, оборудования, стоков, кроме того, его используют для отбелки разных материалов, для окисления в фармацевтической отрасли при изготовлении витаминов. Давайте рассмотрим более полный список:
Итак, мы видим, что сфера применения препарата весьма и весьма широка. Если говорить в целом, то львиная доля всего произведенного на планете ГПХН расходуется на отбеливание (67%) и дезинфекцию (33%).
Химические характеристики гипохлорита натрия
Гипохлорит натрия ГОСТ определяет, как продукт хлорирования газом раствора едкого гидрокарбоната натрия. Несмотря на наличие массы других способов его получения, за эталон взят именно этот. В результате реакции получается химическое соединение с формулой NaOCl.
Это вещество называют натриевой солью хлорноватистой кислоты. Кристаллы крайне нестабильны и быстро разлагаются. Относительно стабильная форма получается путем образования пентагидрата.
Гипохлорит натрия и его более агрессивные родственники
Несмотря на то, что гипохлорит натрия требует достаточно осторожного обращения с ним, его рабочий раствор ведет себя спокойно и в подавляющем большинстве случаев не вызывает нареканий. Особенно если его сравнивать с активным хлором, который использовали для обеззараживания воды вплоть до начала 21 века в некоторых странах, в том числе в России, для очистительных мероприятий.
К сожалению, в нашей стране гипохлорит натрия долгое время производился в недостаточных количествах и для водоочистных сооружений поставлялся сжиженный хлор. Это вещество представляет из себя несравнимо более существенную опасность: хранение в сжиженном виде под большим давлением; убойные концентрации хлора в ближайшем воздушном пространстве при переливании, когда не любой противогаз поможет; более активные испарения из уже обработанной, обеззараженной воды, о чем свидетельствует более резкий запах.
Можно еще добавить, что хранение и транспортировка сжиженных активных газов, это не только опасно, но и затратно. Да, гипохлорит натрия требует деликатного обращения, но если его случайно пролить, то такой катастрофы, как если бы это был сжиженный хлор, не будет.
Активный хлор применяется на производственном уровне, а с таки веществом, как хлорная известь — попросту хлорка, многие знакомы на бытовом уровне и раньше использовали ее в личном хозяйстве постоянно. Применение хлорки, которая выпускается в виде нестабильного порошка, состоящего из смеси гипохлорита, хлорида и гидроксида кальция, это эффективно, но мягко говоря, не очень приятно: отмерять, растворять, затаив дыхание — не каждому под силу такие испытания. Еще не всем нравится, когда хлорка мягкими хлопьями украшает воду в бассейне.
Вот по таким простым причинам подавляющее большинство потребителей дезсредств предпочитает гипохлорит натрия. Еще с тех пор, как появились такие удобные для применения в домашнем хозяйстве и менее едкие средства, как «Белизна», «Domestos» и прочие, изготовленные на его основе.
Разновидности гипохлорит натрия
Чтобы читателю было проще увидеть разницу между марками ГПХН, мы свели их основные отличия в таблицу:
Таблица видов ГПХН
Наиболее качественным и чистым можно считать гипохлорит натрия МАРКА А. Именно здесь отмечается самое высокое содержание хлора, самая малая концентрация оснований и железа, соответственно, это дает более высокие результаты в отбелке тканей и дезинфекции. Гипохлорит натрия 25 кг в канистрах производит компания GOODHIM в соответствие со стандартом для марки А (возможна покупка гипохлорита натрия оптом).
Производство гипохлорита натрия
Мировые показатели объемов производства препарата приближаются к нескольким миллионам тонн. Потребности человечества в антисептике постоянно растут вместе с ростом населения, потребления искусственно подготовленной воды и общим развитием цивилизации на планете.
В промышленности используют такие методы получения:
Наиболее эффективным способом получения товарного ГПХН является низкосолевой процесс. В России так производит гипохлорит натрия фирма GOODHIM.
Воздействие на человека и природу
Интересно, что бактерицидное и, вообще, биоцидное действие ГПХН связано с выделением в процессе разложения таких частиц, как синглетный кислород. Это весьма напоминает борьбу некоторых наших клеток, например, гепатоцидов, с инородными микроорганизмами путем синтеза хлорноватистой кислоты.
Для человека ГПХН может нести опасность при проникновении в глаза, на участки незащищенной кожи и при вдыхании. Вдыхание вызывает жжение в глотке, резь в области глаз, кашель и эффект удушения. Поражение глаз способно привести к химическому ожогу с потерей зрения. Длительный контакт с кожей вызывает раздражение, при повышении концентрации – изъязвление и даже некроз.
Прием препарата в пищу ведет к гастропатии, раздражению внутренних поверхностей кишечника и пищевода, иногда – к ацидозу печени и перфорации ЖКТ.
Средство длительное время подвергалось всестороннему исследованию ученых разных стран мира, ведь его эффективность в разы превышала показатели риска и отвергнуть столь действенный дезинфектант было бы безрассудно! В исследованиях была убедительно показана безопасность дезинфектанта при применении по назначению и согласно инструкции. Также было установлено, что соединение не вызывает тенденции к образованию рака, мутации или неправильной беременности.
Заключение
Гипохлорит натрия – один из наиболее распространенных, эффективных и безопасных дезинфектантов и отбеливателей из всех известных человечеству. Вещество отличается доступностью для покупки, низкой ценой и солидным опытом использования. Польза Лабарраковой воды была убедительно показана в борьбе с эпидемиями, для обеззараживания воды, в отбелке целлюлозы и тканей.
Гипохлорит натрия — полезное химическое соединение
Гипохлорит натрия — неорганическое вещество, соль хлорноватистой кислоты 
Жавелевая вода, на самом деле, является водным раствором гипохлорита калия, но название часто используют и для NaOCl. Лабарраковая вода названа в честь француза А. Лабаррака, впервые получившего именно гипохлорит натрия.
Свойства
В чистом виде гипохлорит натрия — мелкокристаллический порошок без цвета, с запахом хлора. Легко растворяется в воде, но влагу из воздуха не поглощает. Тем не менее, из-за своей неустойчивости, вещество достаточно быстро разлагается, оплывает и становится жидким. На практике обычно применяют водные растворы, более устойчивые, чем кристаллическая форма, хотя и растворы постепенно разлагаются, теряя активный хлор. Особенно активно раствор разлагается при нагревании и под действием света, поэтому хранить растворы гипохлорита натрия следует в прохладных, темных помещениях, в прочной таре с антикоррозионным покрытием.
Гипохлорит натрия — очень сильный окислитель; легко вступает в реакции с солями щелочных металлов, аммиаком, оксидами металлов, щелочами. Обладает ярко выраженным коррозионным воздействием на многие металлы. К гипохлориту натрия устойчивы почти все пластики, фторопласты, поливинилхлорид, многие резины, поэтому хранят его, обычно, в стальных емкостях с резиновым покрытием.
Так как в нормальных условиях водные растворы постепенно разлагаются с выделением кислорода, при хранении это нужно учитывать, заполняя емкость не полностью и периодически сбрасывая образовавшийся кислород. С течением времени водный раствор теряет свою активность.
Скорость разложения раствора сильно зависит от рН среды. Наибольшая скорость разложения — в кислой среде, наименьшая — в высокощелочной. Для хранения наиболее пригодны водные растворы с выраженной щелочной реакцией.
Влияние на окружающую среду и человека

Работы с растворами NaOCl должны проводиться с соблюдением техники безопасности и средств защиты. Концентрированные растворы вызывают химический ожог, особенно опасный для глаз — вплоть до полной потери зрения. Воздействие на кожу может привести к раздражению и язвам. Проглатывание — к ожогу пищевода, в тяжелом случае — к прободению ЖКТ. Вдыхание выделяющегося хлора приводит к токсикации, человеку становится трудно дышать.
Применение
— Для обеззараживания воды в системах городского водоснабжения, 
— Для дезинфекционной обработки помещений.
— Для изготовления производственных отбеливателей, дезинфектантов, СМС.
— В химическом производстве — для изготовления гидразина, антраниловой кислоты, метансульфоновой и синтетической аскорбиновой кислоты, модифицированного крахмала, некоторых других веществ, использующихся в производстве пестицидов и инсектицидов.
— В электрохимии — для травления.
— Для удаления из индустриальных газов опасных цианистых соединений.
— В лабораторной химии — ингредиент органического синтеза многих соединений, в том числе кетонов, карбоновых кислот, хлороформа, альдегидов, аминов и многих других.
— В медицине — для дезинфекционной обработки помещений, аппаратов, сантехники, мебели, белья, предметов обихода. Растворы гипохлорита натрия эффективны против большинства патогенов, вирусов (включая ВИЧ, гепатит, ротавирус), бактерий, грибков, токсинов. Применяется для наружной обработки кожи, полоскания горла и носа, для обработки ран в гинекологии, стоматологии, хирургии; для инъекций.
— Входит во множество средств бытовой химии, в том числе таких популярных, как «Белизна», Tiret, Domestos гель.
Что в Белизне тебе моей или Справочное пособие по гипохлориту натрия («хлорке»)
Сегодня читаем о самом простом, самом доступном и самом действенном антисептике — про гипохлорит натрия (он же «Белизна»). Совместимость с различными материалами, техника безопасности, свойства и эффективность не только против коронавируса, но и против страшной плесени и ее микотоксинов. В качестве «вишенки» — контрольная закупка магазинных отбеливателей и оценка их состава. Чтобы узнать как в эпоху пандемии нас дурят производители бытовой химии и прочий «менеджерский брат» — идем под кат. И обязательно закидываем в закладки. Эта информация пригодится еще не раз 😉
Важно! Информацию, предложенную в данной статье, вы не найдете больше ни на одном русскоязычном ресурсе. Поэтому публикую на хабре, на портале высшего пользовательского доверия. Просьба ко всем ресурсам сомнительного качества — давайте ссылку на первоисточник. Не переписывайте без понимания — не плодите бесполезный информационный шум, от которого в последнее время уже и так некуда деться. Разномастному «ученому люду» тоже рекомендую не стесняться писать в своих «методических указаниях» ссылку на Хабр. Я то вижу откуда вы все копируете, книгами 50-60 годов вечно прикрываться не получится 😉 Так что настоятельно рекомендую меня уведомлять об использовании материалов, а в свой список литературы писать можно что-то вроде:
Бесараб, С.В. Что в Белизне тебе моей или Справочное пособие по гипохлориту натрия («хлорке»)[Электронный ресурс] – Режим доступа: — habr.com/ru/post/494512/- Дата доступа: 04.04.2020.
Предисловие от автора. Смотрю колонку «сейчас читают» на хабре и с сожалением вижу, что принцип «пока гром не грянет — мужик не перекрестится» работает даже здесь. Один сплошной коронавирус. И вспоминается сразу мне моя статья, опубликованная в конце января (Коронавирус 2019-nCoV. FAQ по защите органов дыхания и дезинфекции) у которой 30% минусов были с пометкой «не соответствует тематике Хабра». Соответствовать, видимо, начинает лишь тогда, когда указание сверху поступит…
Ладно, чего о грустном говорить. Если пару тысяч читателей еще тогда, в январе, без паники и спешки, смогли купить себе СИЗ и нужные антисептики — можно считать, что цель моя достигнута. А сейчас просто вольюсь в тренд и расскажу об самом простом, доступном и очень эффективном антисептике. Не думаю, что он когда-то сможет исчезнуть так же, как исчез этанол. Сырья хватает, гипохлорит натрия можно производить до тех пор, пока существует электричество…
Есть такая интересная (интересная не только для химика, но и для других специалистов, владеющих английским языком) книга — 100 самых важных химических соединений: Cправочное руководство (The 100 Most Important Chemical Compounds: A Reference Guide). В этом руководстве в разделе солей натрия находятся рядом пищевая сода, карбонат натрия, поваренная соль, гидроксид натрия (средство «Крот») и гипохлорит натрия. В принципе, понятно чем многие из этих солей заслужили такое право. А вот на гипохлорите натрия я остановлюсь сегодня подробнее. Первым делом, конечно же определение:
С момента своего открытия в 1787 году химиком Клодом Луи Бертолле (тем самым, которому мы должны быть благодарны за хлопушки, спичечные головки, салюты и проч. изобретения, где используется т.н. бертолетова соль) гипохлорит натрия достаточно долго выступал сугубо как отбеливающий агент и только примерно с середины 19 века началось его шествие как дезинфектанта. Поэтому пройдусь немного по химическим свойствам, сохраняя «историческую хронологию».
Хлорочка как отбеливатель
Ну а атомарный кислород — очень ядреная штука, один из мощнейших окислителей на нашей планете. Кстати, именно благодаря атомарному кислороду озон проявляет свои бактерицидные свойства. Так что, в некотором роде, озон и гипохлорит натрия — «кислородные братья» 🙂
Отбеливающая способность гипохлорита натрия (и подобных ему химикатов) обусловлена их способностью разрушать светопоглощающие структуры (т.н. хромофоры) в органических молекулах. Притом это могут быть не только хромофоры на тканях. Гипохлорит неплохо отбеливает пятна плесени на плитке, зубные пятна, вызванные флюорозом и удаляет пятна от танинов чая на кружках (т.н. «чайный камень»).
Справедливости ради, стоит отметить, что хлорноватистая кислота образует соли не только с натрием, но и, например, с кальцием. Примером может служить та самая хлорная известь, широко используемая из-за своей дешевизны для дезинфекции складских помещений, животноводческих ферм, туалетов и т.д и т.п. На долю гипохлорита натрия приходится около 83% мирового потребления (в роли отбеливателя/дезинфектанта), на хлорную известь — остается 17%. В 2005 году в мире было использовано около 1 миллиона тонн гипохлорита натрия, причем около 53% этого количества использовалось в домашних хозяйствах для дезинфекции и отбеливания белья (+ мытья, т.к. щелочная среда раствора гипохлорита неплохо омыляет жиры и делает их водорастворимыми). Оставшиеся 47% приходились на очистку сточных вод и подготовку питьевой воды (а также очистку бассейнов и градирен ГЭС от биообрастания/водорослей/моллюсков, отбеливание целлюлозы/бумаги/тканей, и использование в роли реактива для химических синтезов). Водоочистной эффект, кстати, это не только дезинфекция. Это и удаление запахов (NaOCl нейтрализует сероводород и аммиак) и даже обезвреживание цианидов в сточных водах (например, после золотодобычи или гальванических ванн).
Хлорочка, как дезинфектант
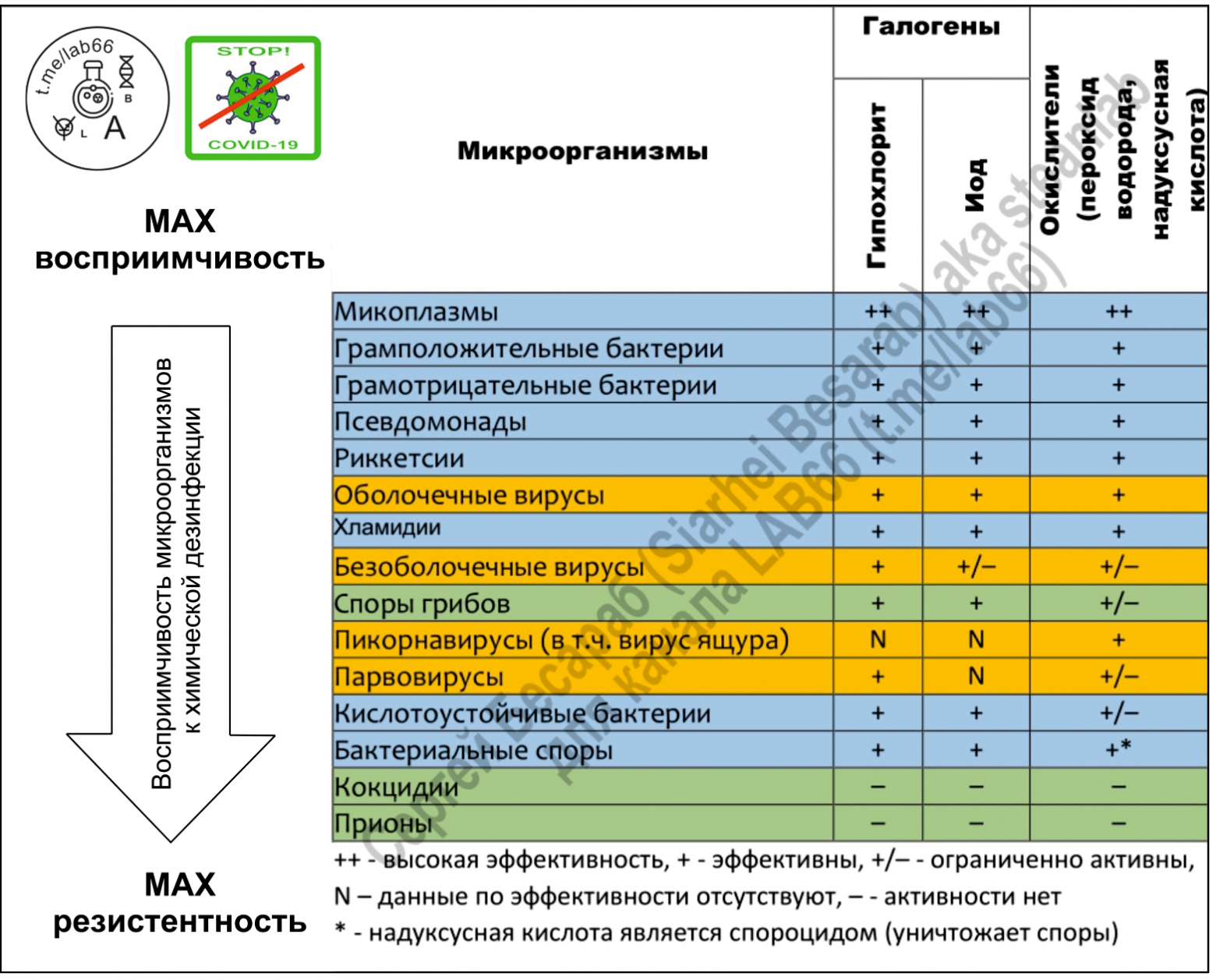
Любое несчастье как индикатор проявляет самые лучшие и самые худшие черты человека. Так и с пандемией коронавируса. Для меня удивительно, что многие трезвомыслящие, прекрасные специалисты, поддавшись панике начали терять голову и выдавать что-то вроде «гипохлорит не убьет коронавирус» (или еще лучше «коронавирус — это ГМО бактерия»). Меня мало волнует мнение многочисленных youtube-блогеров и диванных аналитиков и т.п. с их дилетантскими «рассуждениями о рыбалке» (в канале LAB-66 уже приходится у особо рьяных кликуш и «одержимых мировым заговором» даже требовать диплом о наличии профильного образования). А вот к информации от WHO, CDC, EPA я стараюсь четко прислушиваться. Ожидаемо, что в мартовском бюллетене выпущенном одной из упомянутых организаций (EPA’s Registered Antimicrobial Products for Use Against Novel Coronavirus SARS-CoV-2, the Cause of COVID-19) в списке эффективных «коронавирусных» дезсредств оказалось достаточно много гипохлорита. Удивляться здесь нечему, ведь NaOCl — это одно из оптимальнейших дезсредств (из-за комбинации широкого спектра активности, доступности и отсуствия долгосрочного вреда для окружающей среды). По поводу дезинфицирующего эффекта смотрим картинку (кликабельна):
На всякий случай напоминаю, COVID-19 — это болезнь, вызванная оболочечным вирусом SARS-CoV-2, который содержит внутри своего «конвертика» одноцепочную РНК.
В принципе, любые дезинфицирующие средства на основе хлора, так или иначе действуют через образование HOCl (та самая хлорноватистая кислота). Но сильный бактерицидный эффект гипохлорита связан не только со способностью продуцировать атомарный кислород, но и с действием гидроксильных ионов. Щелочная среда нарушает целостность цитоплазматической мембраны и приводит к необратимому ферментативному ингибированию, изменению клеточного метаболизма и деградации фосфолипидов (как при гипероксидировании липидов). Гипохлорит натрия воздействует на ферментативный аппарат бактерий, способствуя необратимой инактивации, вызванной щелочной средой и хлораминированию вызванному хлором. Т.е. можно сказать, что при обработке гипохлоритом зараженного объекта одновременно происходят реакции омыления липидов, нейтрализации аминокислот и хлораминирования. Таким образом не только дезактивируются многие микроорганизмы, но и происходит деградация липидов и жирных кислот, с образованием ПАВ (=мыла) и глицерина, т.е. уже упомянутая реакция омыления. Гипохлорит не только дезинфицирует, но еще и моет 🙂 Логично, что при таком действии выработать резистентность (как к антибиотикам) практически не реально.
При обработке живых тканей важна еще и такая вещь, как биосовместимость. Это способность химического реагента вообще не реагировать с биологическими тканями на протяжении какого-то периода времени (и иметь умеренную реакционную способность в течение недели, постепенно снижающуюся к 0). Высокие концентрации гипохлорита достаточно агрессивны (см. раздел про технику безопасности), но вот в концентрациях 0,5-1% это очень даже биосовместимый препарат. Поэтому гипохлорит натрия высоких концентраций используется для хлорирования воды на некоторых (!) станциях водоподготовки — 12% раствор — некоторых, потому что чаще всего используют хлор в баллонах. 15% раствор используют для обеззараживания сточных вод на очистных сооружениях. Растворы с концентрацией не менее 10% используются для очистки воды в бассейнах и удаления биопленок. Кстати, именно гипохлорит натрия может быть прекрасным средством для уничтожения возбудителей легионеллёза. Эти микроорганизмы, кстати, очень часто в тех самых биопленках и обитают.
Ну а в дезинфицирующих спреях и салфетках, используемых на твердых поверхностях, чаще всего используются концентрации до 1,5%. Кстати, про то, как сделать самодельные салфетки с гипохлоритом я достаточно давно писал на Patreon в своей статье «Реверс-инжиниринг влажной салфетки или Гипохлорита вам в ленту». Кстати, пользуясь случаем выражаю благодарность всем моим «патронам». Вас мало, но вы поддерживаете серьезно!
Традиционно считается, что для обработки больниц и помещений, загрязненных жидкостями организма (кровью и т.п.) необходимо использовать 0,5% раствор. Такой концентрации достаточно, чтобы дезактивировать клостридиум диффициле в фекалиях или уничтожить какие-нибудь папилломавирусы человека. Для обработки/мытья рук чаще всего используется 0,05% раствор гипохлорита, который готовят из гранул (на картинке — выдержка из инструкции по обеззараживанию в условиях эпидемии лихорадки Эбола):
Замечание 1. о других «хлорных дезинфектантах»
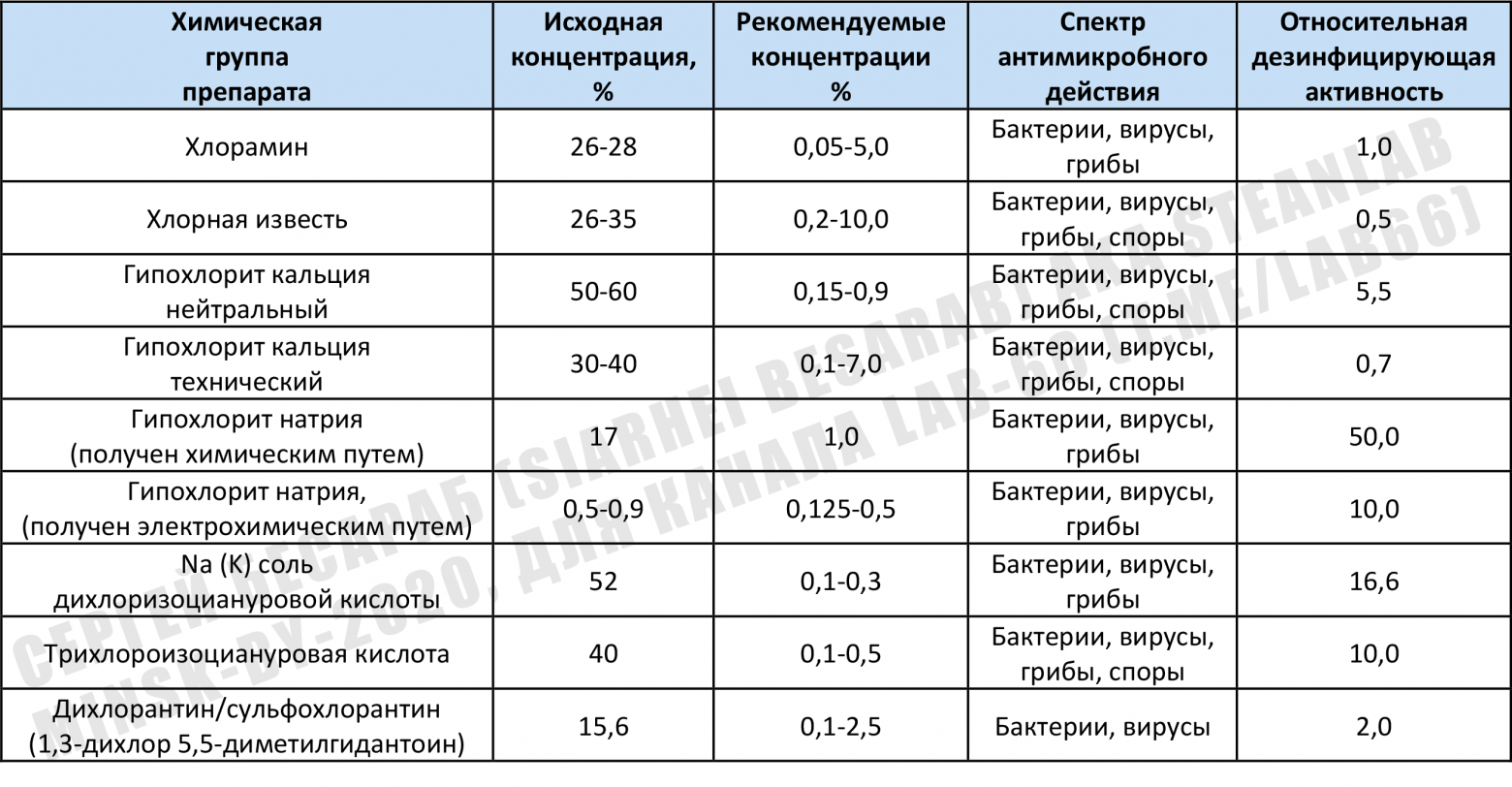
Помимо упомянутых уже мной гипохлорита натрия и гипохлорита кальция, существуют и другие вещества, способные активно продуцировать хлор (ну а хлор с водой = «малостабильная хлорноватистая кислота HOCl» и далее опять см. п. «Хлорочка, как дезинфектант»). Притом там могут быть и вещества органической природы. На просторах интернета я нашел информацию (скорее всего выдранную из какой-то советской книги по гражданского обороне — потому что многие наименования, да и сами препараты давно перестали существовать). Эта таблица дает примерное представление о спектре препаратов и их сравнительной «дезмощности по хлору». Почистил авторски и предлагаю на ваш суд. Можно, по крайней мере, примерно прикинуть/сравнить активность разных дезсредств (если захочется что-то отличное от старого доброго NaOCl):
Сюда ж внесу и замечание от eteh: «… электролизный ГПХН возможен и 5-7%. При получении, соответственно, не проточным электролизом, а мембранным — из соли и воды без добавления дополнительных реагентов. Ну а выше, да, там только отдельно готовить концентрированный щелочной раствор для насыщения хлором».
Замечание 2. «хлорка которая лечит»
В «медразделе» не грешно упомянуть и про применение гипохлорита натрия в стоматологии (ибо именно стоматологи у меня чаще всего интересовались вопросами концентрации, разведения в и т.п.). Гипохлорит натрия является препаратом выбора в эндодонтии и очистке корневых каналов. Чаще всего стоматологами используются концентрации от 0,5% до 5,25% (стандартный — 2%).
Здесь работает правило — низкие концентрации гипохлорита удаляют преимущественно некротические ткани и некоторые виды бактерий, высокие концентрации — повреждают живые ткани, но наиболее полно уничтожают микробы. Кстати, вместо повышения концентрации можно подогреть раствор (50-60 °C), что даст сравнимую с более концентрированным раствором эффективность в удалении мягких тканей и дезинфицировании корневого канала.
Замечание 3. Об очистке воды в полевых условиях
Тема очистки воды достаточно обширна и вполне достойна отдельной статьи. Я же кратко упомяну об очистке воды в полевых условиях. Ведь бывают ситуации, когда ни то что озонатор или уф-лампу использовать, а даже и закипятить воду тяжело. Поэтому у химических обеззараживателей, на мой взгляд, пока особой альтернативы не видно. Хлорное обеззараживание может считаться старейшим вариантом полевой дезинфекции воды. Американские военные еще во время Второй мировой войны в составе сухпайка имели таблетки «Halazone», с натриевой солью 4-[(дихлорамино)сульфонил]бензойной кислоты.
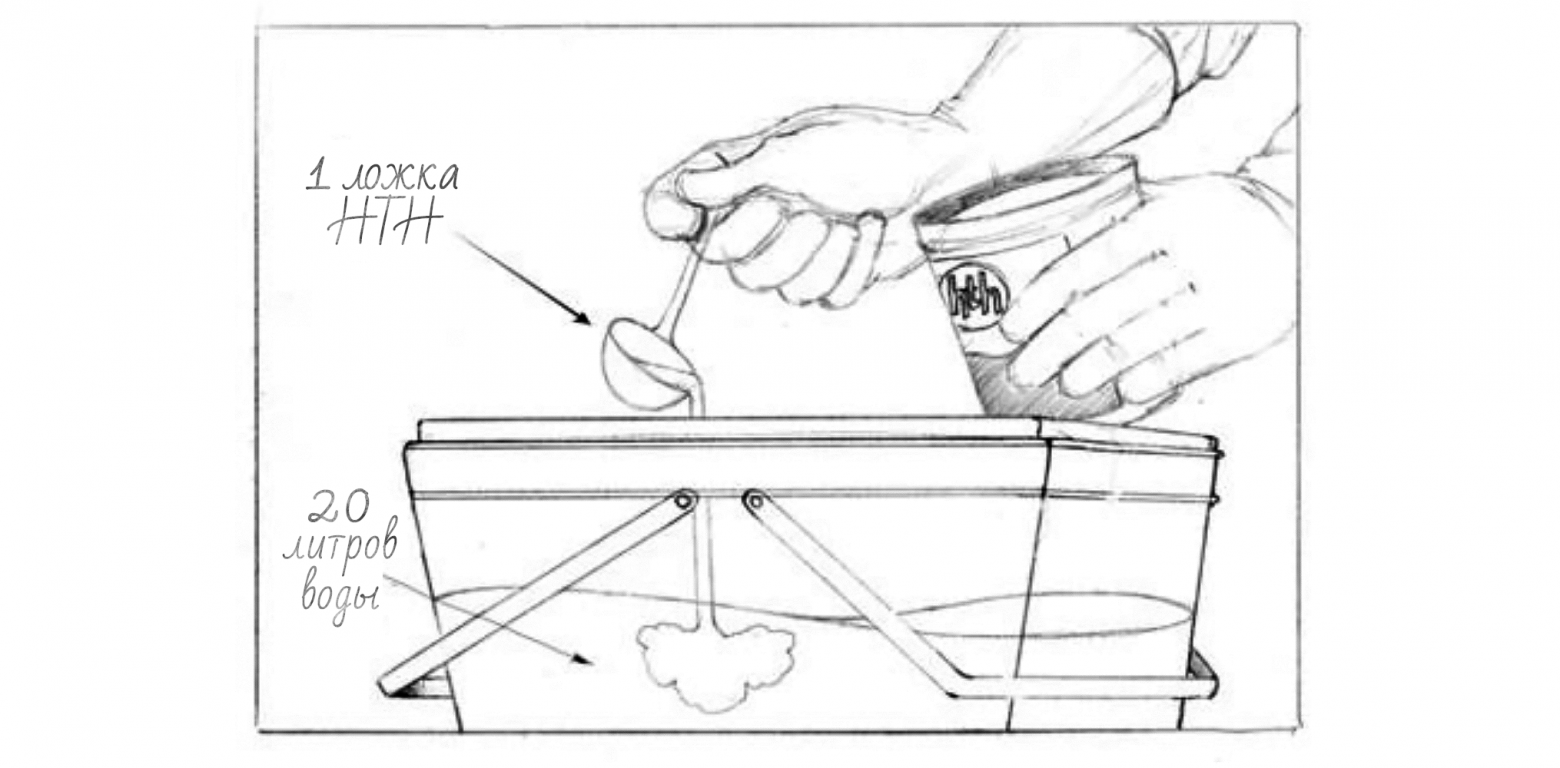
Потом постепенно это вещество вытеснил дихлоризоцианурат натрия (тот самых ДХЦК), именно он был в составе широко известных в узких кругах таблеток «Пантоцид». Американский вариант — это ДХЦК спрессованый с адипиновой кислотой и содой, быстрорастворимые таблетки. Стоит отметить, что для полевой дезинфекции могут использоваться и таблетки для обеззараживания бассейнов (двухкомпонентные, содержащие смесь хлорит+хлорат+карбонат натрия и гидросульфат натрия), продуцирующие диоксид хлора. В целом, такой вариант подходит и для обеззараживания питьевой воды. Причем этот вариант, например, эффективен против лямблий больше чем обычный хлор. Все описанные варианты — удобны in situ (туристы, военные, МЧС и т.п.). Для вариантов вроде стихийного бедствия или какой-нибудь техногенной катастрофы таблетки могут быть недоступны, а то и слишком дороги. Для этой цели вполне можно использовать и Белизну (желательно без всяких ПАВ-ов и отдушек). Необходимо всего пару капель 5% гипохлорита натрия на литр воды с выдержкой в емкости с закрытой крышкой в течение 30-60 минут. Перед непосредственным употреблением желательно крышку открыть и «дать проветриться». Не стоит сразу лить в себя, как бы там ни хотелось пить.
CDC в рамках своей стратегии «Безопасная система водоснабжения» (SWS) для развивающихся стран рекомендует для обеззараживания воды использовать 0,5–1,5% раствор гипохлорита натрия (две-три капли на литр и экспозиция 30 минут). EPA, кстати, советует использовать 8,25% раствор гипохлорита натрия (две капли на литр и экспозиция 30 минут), важное замечание «удвойте количество отбеливателя, если вода мутная, окрашенная или очень холодная. после обработки вода должна иметь слабый запах хлора. Если нет, повторите дозировку и дайте постоять еще 15 минут перед использованием«. Стоит отметить, что на крайний случай, для дезинфекции воды можно использовать и гипохлорит кальция («хлорную известь»).
Замечание 4. «Хлорка» vs плесень, грибки и микотоксины
А затем они повредили его нервную систему русским боевым микотоксином…
Уильям Гибсон «Нейромант»
Существует в немногочисленном мире «химиков, которые в теме» такой «Грааль» как микотоксины.
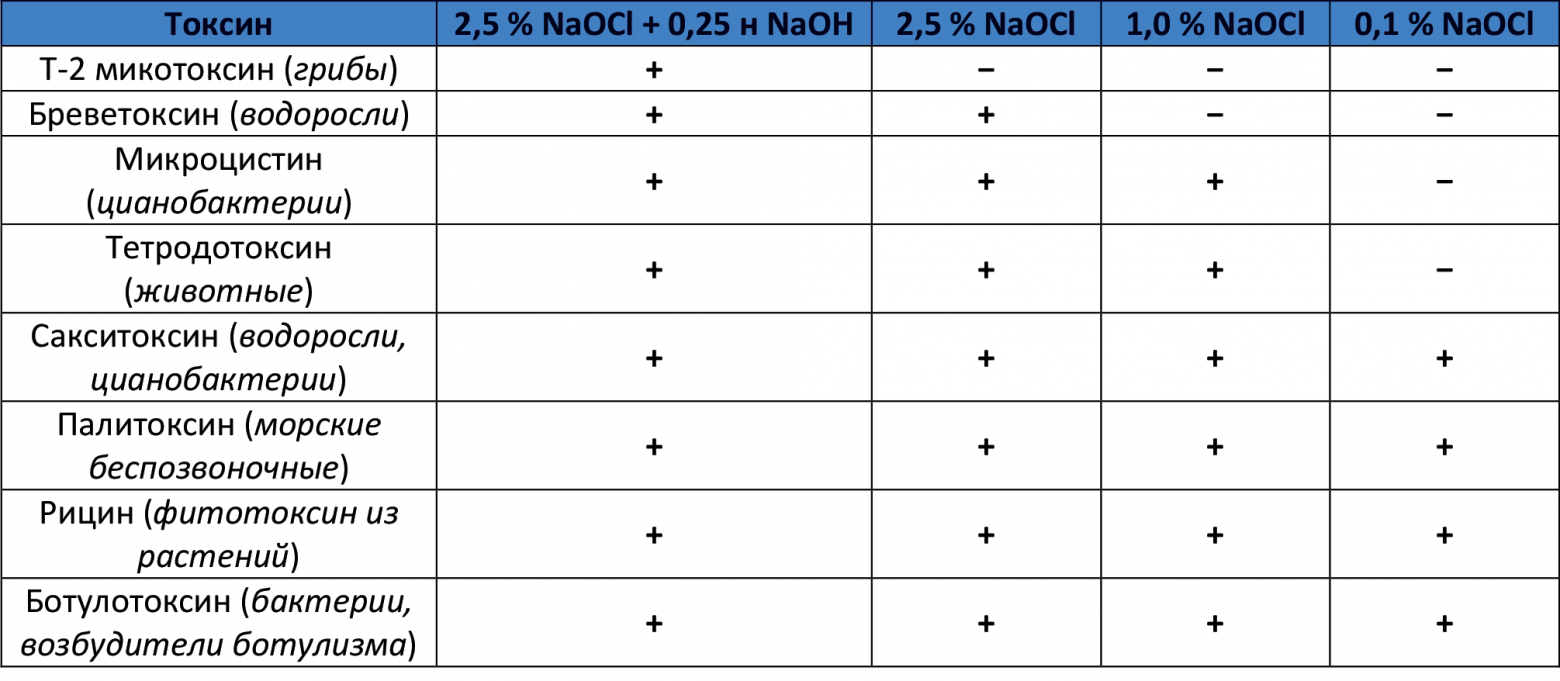
А сводится все к тому, что гипохлорит натрия в определенных концентрациях может использоваться не только для уничтожения микробов и плесневых грибов (см. таблицу в начале раздела «Хлорочка, как дезинфектант«), но и для дезактивации того, что после них осталось, в т.ч. плесневых, растительных токсинов и токсинов животного происхождения.. Более подробно — смотрите таблицу (30-минутная экспозиция). Плюсик — токсин дезактивируется, минус — нет.
T-2 токсин — трихотеценовый микотоксин, чрезвычайно токсичен для эукариотических организмов. Вследствие употребления заплесневевшего зерна или муки возникают отравления человека или сельскохозяйственных животных. Острые токсические симптомы включают рвоту, диарею, раздражение кожи, зуд, сыпь, волдыри, кровотечение и одышку. Если человек подвергается воздействию Т-2 в течение более длительного периода, наблюдается постепенная дегенерация костного мозга и развивается пищевая токсическая алейкия (АТА).
И уже привычно не отмахнешся, не успокоишь себя фразой «да где тот микотоксин и Fusarium, а где я» и водочкой, привычно, не полечишь… Потому что они — много где. На клубнике например:
Так что, вполне себе вариант снижения количества микотоксинов в подозрительных фруктах и овощах — это купание их в щелочном гипохлорите натрия с последующим обычным мытьем. При таком варианте обработки убиваются практически все возможные «поверхностные зайцы».
Стабильность и сроки хранения (=есть ли смысл закупать впрок?)
Его устойчивость зависит от ряда факторов:
Пройдусь по каждому пункту отдельно:
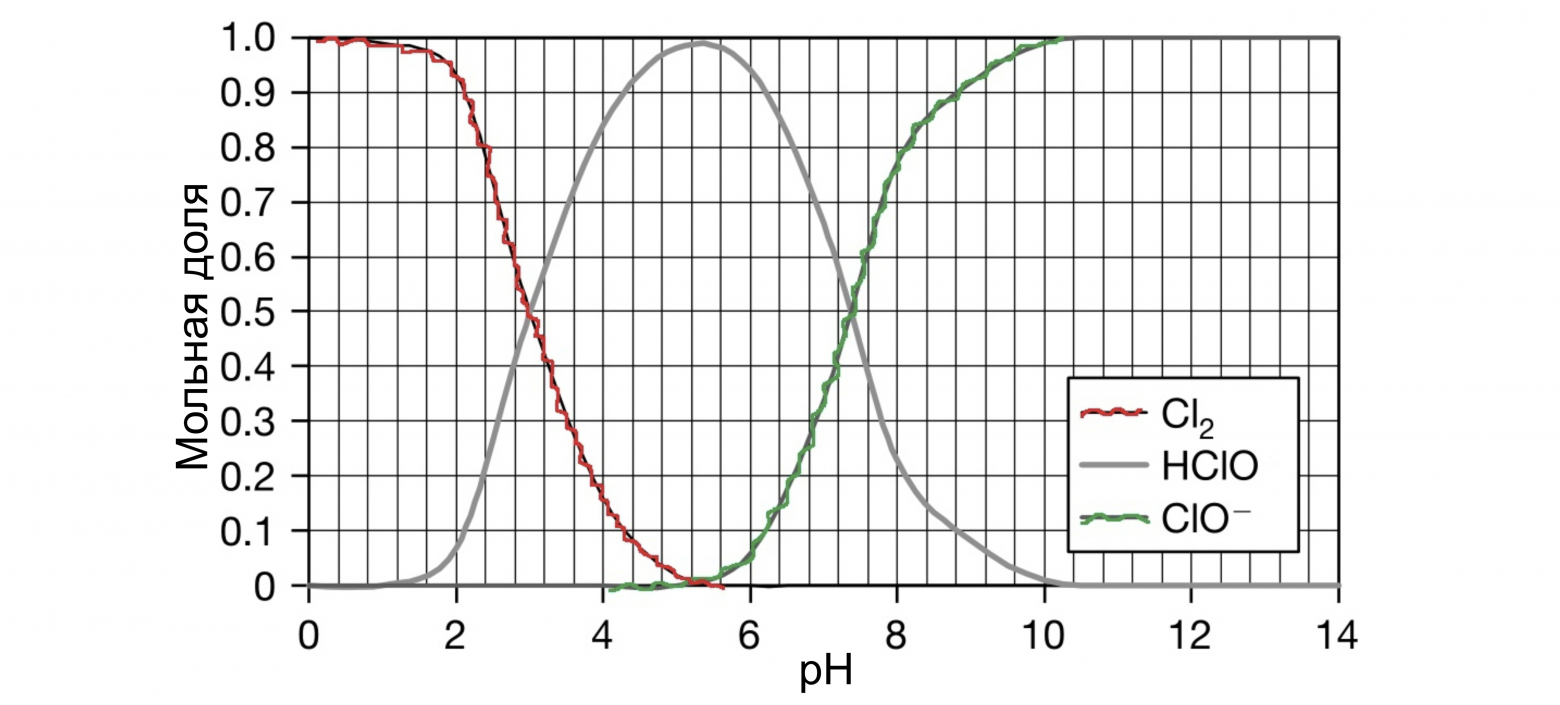
Концентрация: чем более концентрированный раствор, тем быстрее он разлагается, соответственно самые слабые растворы — самые стабильные. Литературные данные указывают на то, что при снижении концентрации гипохлорита натрия в два раза, скорость разложения уменьшается в 5 раз. Это связано с уменьшением общей концентрации ионов и со снижением ионной силы раствора. Разбавление снижает как концентрацию NaOCl, так и концентрацию других ионов (равновесных хлоридов, хлоратов, гидроксидов и т.д. — см. картинку «равновесия рН» ниже).
Температура: распад гипохлорита с повышением температуры в 90% случаев проходит по уравнению (B). Можно держать в уме следующее правило — скорость разложения возрастает в 3–4 раза, для каждых 10 °C для растворов с концентрациями гипохлорита натрия от 5 до 16%. А если напрячься и снизить температуру хранения хлорки до 5 °C (при условии полного отсутствия примесей металлов и других факторов ускоряющих разложение), то хранить в темной бутылке можно будет практически вечно.
Т.е. для хранения оптимальнее высокощелочные растворы, а для экстренной дезинфекции — растворы с низким рН. Хотя, говоря начистоту, повышать рН тоже необходимо до разумного предела. Если pH превышает значение 13 — скорость разложения опять скачкообразно увеличивается. Это происходит из-за увеличения ионной силы раствора, вызванного присутствием сильного избытка щелочи (NaOH). В целом можно использовать за правило — для хлор-содержащих дезсредств используем только щелочную среду. Для пероксидных дезсредств — наиболее эффективна кислая среда. ЧАС-ы несовместимы с кислотами и резко теряют в их присутствии свои дезинфицирующие свойства. Альдегиды (вроде формалина и глутаральдегида) — работают и в кислой, и в щелочной среде)
Воздействие света: воздействие света ускоряет процесс разложения NaOCl в растворе. Современные методы упаковки и использование непрозрачных полиэтиленовых бутылок практически исключают влияние света на стабильность растворов. Янтарные или зеленые стеклянные бутылки также имеют такой же результат. Если важны конкретные цифры — получится вот так:
Для предотвращения разложения гипохлорита требуется контейнер, который отсекает свет ниже 475 нм и пропускает менее 2% при 500 нм.
Подводя итог, можно сказать следующее. Самым долгоиграющим будет препарат, который:
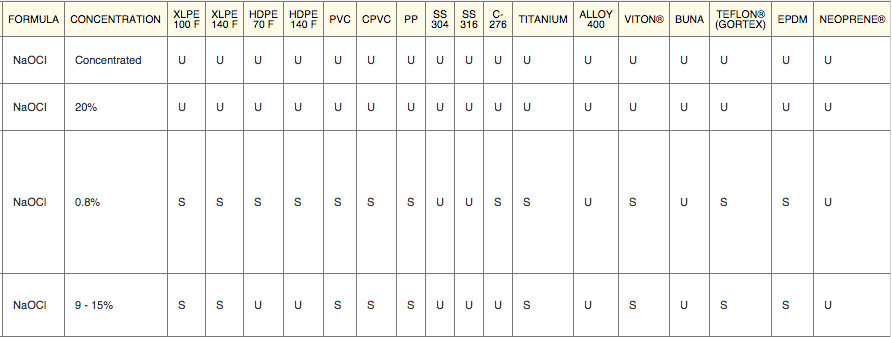
Взято отсюда, буква S = совместимость удовлетворительная (satisfactory), буква U = совместимость неудовлетворительная (unsatisfactory). Табличка кликабельна.
Техника безопасности при работе с гипохлоритом
В целом, типичный (=разбавленный) бытовой отбеливатель вроде белизны не опаснее воды (если с ним уважительно обращаться, бутылочку там подписывать, от детей прятать и т.п.). По статистике, в 2002 году в Великобритании было зафиксировано около 3300 несчастных случаев, связанных с гипохлоритом натрия. И абсолютное большинство из них — употребление дезинфектанта внутрь… Думаю, комментарии излишни.
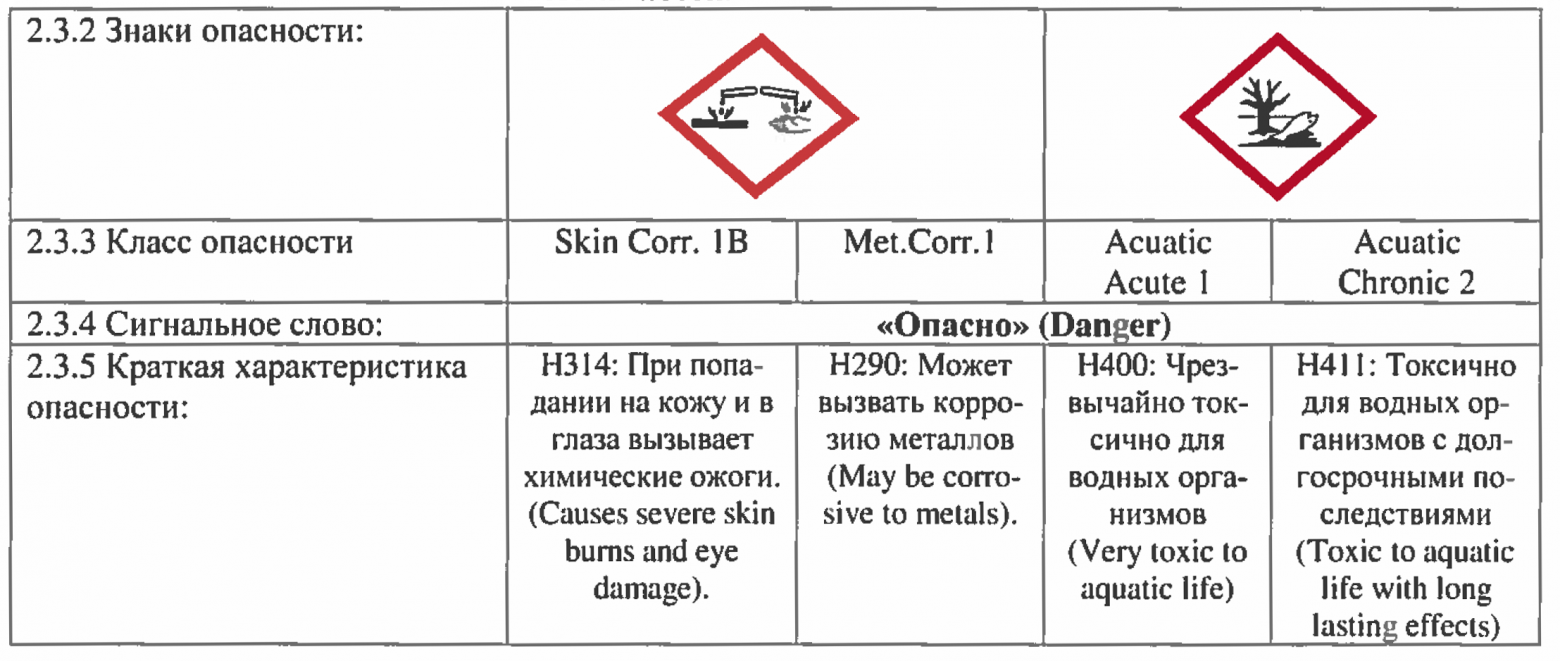
Что касается гипохлорита натрия «промышленной концентрации», т.е. такого которым очищают сточные воды, то он уже относится к суровому первому классу опасности (класс 1B-поражение кожи + класс 1-поражение глаз).
Если расшифровать — при попадании на кожу и в глаза вызывает химические ожоги. Будет вызывать раздражение и при попадании на слизистые оболочки верхних дыхательных путей (при вдыхании). Отдельного упоминания заслуживает и такой камень преткновения, как «хлорка в воде бассейна». Как правило, концентрация гипохлорита натрия, присутствующая в плавательных бассейнах абсолютно не вредна для людей. Но! Но дело меняется, если в воде присутствует большое количество мочевины (смесь мочи и пота), и тут уж хлорноватистая кислота и мочевина вступают в реакцию с образованием ядреных хлораминов (о механизме образования — ниже). Именно хлорамины раздражают слизистые оболочки и дают т.н. «запах хлора». В нормальных бассейнах этого быть не должно (нормальный = тот, в котором меняют воду и работает вентиляция). Если же этого не происходит, то постоянное воздействие летучих хлораминов может даже привести к развитию атопической астмы (см. статью).
Лечение при отравлении:
Учитывая все выше сказанное, решил я прикрепить и небольшую «памятку для врача», чтобы случись что — все было под рукой. Описание действий на случай отравления гипохлоритом натрия. Оно, кстати, примерно такое же, как и в случае отравления щелочью (cкользкое ощущение отбеливателя на коже связано с омылением кожных масел и разрушением тканей). НО! Но это только для чистого гипохлорита натрия. В случае его комбинация с различными бытовыми химикатами — лечить возможно придется от отравления продуктами реакции (см. следующий пункт).
Замечание про «запах хлора»: часто можно услышать от читателей вопрос «чем убрать этот неприятный запах хлора с рук/полумаски/предметов». В таком случае поможет тиосульфат натрия, притом для активного удаления запаха хватит и раствора с концентрацией около 5 мг/л (0,005%). Промываем этим раствором руки или __ (вписать нужное), а затем промываем водой с мылом. Если же тиосульфата найти не удалось, то остается только проверенный способ — «выветривание запаха со временем».
Кстати, для нейтрализации разливов концентрированного гипохлорита натрия (будем считать что 5% и выше) можно также использоваться сульфит натрия, он работает по реакции:
А можно, в случае очень небольшого количества гипохлорита, использовать и перекись водорода, но с осторожностью (!) ибо там выделяется кислород.
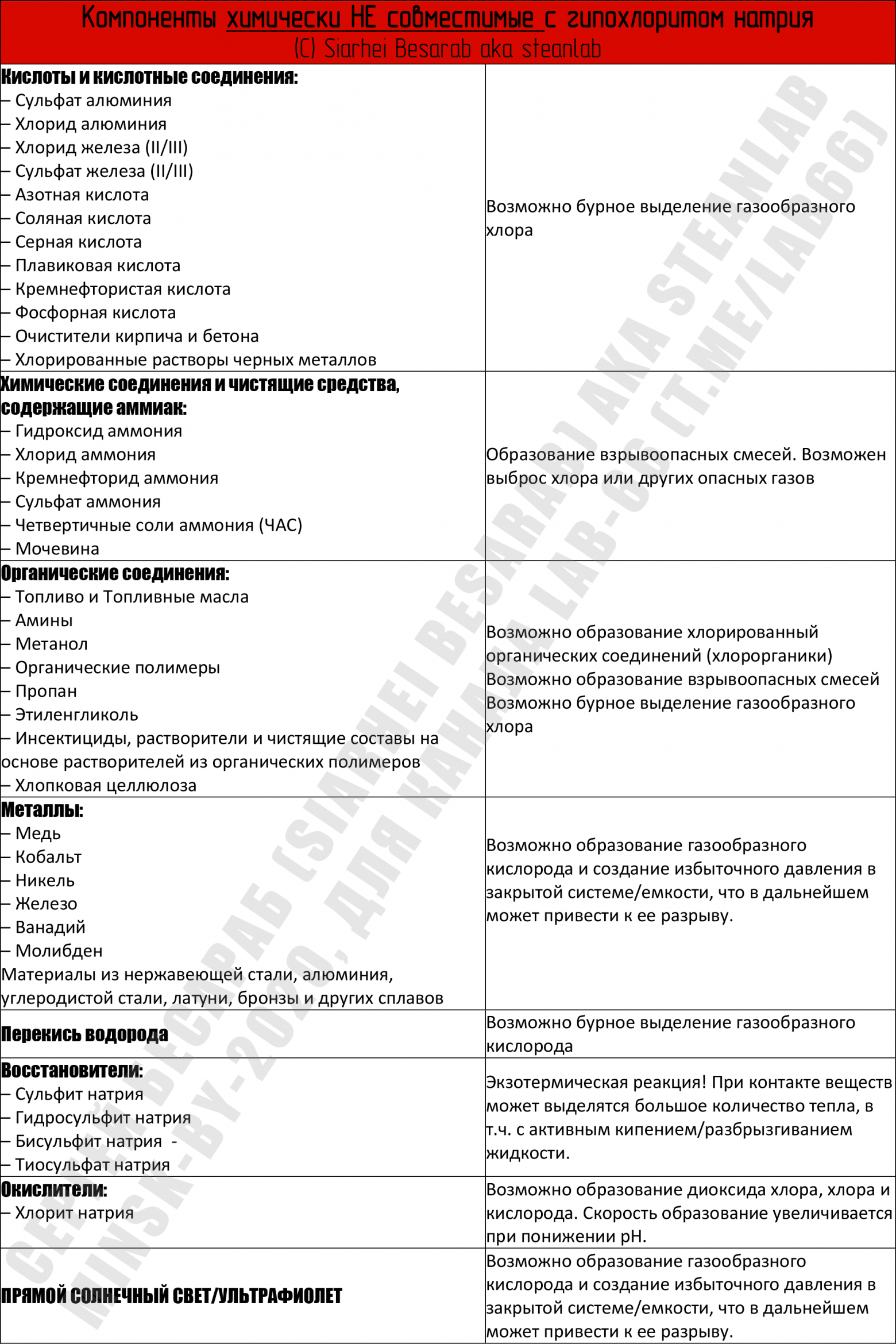
Опасное соседство — НЕсовместимая бытовая химия
При контакте белизны с некоторыми бытовыми моющими средствами, содержащими ПАВы и различные отдушки могут образовываться летучие (!) хлорорганические соединения, вроде четыреххлористого углерода (CCl4) и хлороформа (CHCl3). Классы их опасности каждый может посмотреть сам. Например в статье исследователи показали, что при работе с некоторыми «хитрыми» средствами бытовой химии концентрации этих растворителей повышаются в 8–52 раза для хлороформа и в 1–1170 раз для четыреххлористого углерода выше допустимых соответственно. Самый низкий «выхлоп» летучей хлорорганики дает самый простой отбеливатель (читай «белизна»), а вот самый высокий — средства в форме «густой жидкости и геля» (типа всяких там Доместосов и иже с ними, которые и развести толком нельзя). Поэтому, на будущее, а) стоит всячески избегать «суперэффективных средств с новой формулой» (= дерьма, которое разработал менеджер, а не инженер) и придерживаться классической формулы «лучшая белизна = гипохлорит да вода». И б) использовать при уборке квартиры респираторы с угольным фильтром (=«для задерживания паров растворителей»).
С перекисью водорода гипохлорит натрия реагирует достаточно бурно, с образованием хлорида натрия (ваша любимая поваренная соль) и кислорода:
Гетерогенные реакции гипохлорита с металлами протекают достаточно медленно и дают в результате оксид металла (ну или гидроксид). На примере цинка:
С различными комплексами металлов белизна реагирует не в пример быстрее.
Как уже упоминалось, гипохлорит натрия не любит высокую температуру (выше 30°C), и при нагревании распадается на хлорат натрия и кислород (для 5% раствора температура разложения
40°C), если удастся нагреть до 70°С разложение может протекать со взрывом.
В целом, гипохлорит высоких концентраций негорюч и взрывобезопасен. Но при контакте с органическими горючими веществами (опилки, ветошь и др.) в процессе высыхания может вызывать возгорание. Вообще, такая реакционная способность — это одновременно и благо, т.к. вещество не может долго находится в неизменном состоянии в окружающей среде и быстро дезактивируется (=можно просто смыть в сточные воды).
В качестве выводов — все написанное выше сведено в единую таблицу несовместимых компонентов (кликабельна).
Некоторые из этих соединений можно найти в бытовых, автомобильных и промышленных химикалиях и смесях химикалий = средства для чистки окон, унитазов и поверхностей, обезжиривающие средства, антифризы, средства для очистки воды, химия для бань и бассейнов. Поэтому чаще смотрите на этикетку. Требуйте, чтобы на этикетке писали состав! Покупайте только то средство, где на этикетке есть максимальная информация о составе. Пора уже голосовать рублем за адекватное отношение к покупателю.
Практикум или Вся Белизна Минска
Полностью разобравшись с теорией, теперь мы подходим к самому интересному. К лабораторным занятиям. Как и обещал читателям, я проехался по Минску и собрал все доступные варианты жидкого отбеливателя (именно жидкого, на гели и т.п. я даже не смотрел). Теперь же я хочу рассказать как я их сравнивал и «проверял на вшивость» (= подходят ли они для целей дезинфекции).
В общем, первым делом подбираем себе необходимые СИЗ (по желанию). Как я уже упоминал выше, для большинства задач (и прямых рук) достаточно перчаток. Не зная что в бутылках за смеси, я решил перестраховаться и использовать полный комплект защиты (только со своей полумаски 3М 7502 «коронавирусные» противоаэрозольники 6035 я заменил на угольные патроны класса «газы/пары» — типа ABE1, как в моем случае, или лучше ABEK1. Пойдут и отечественные противогазные коробки и респираторы для работы с парами растворителей.
С предварительными приготовлениями разобрались, и теперь я представляю вашему вниманию всю Белизну Минска! Встречайте беларуских красавиц! Это, кстати, все что удалось найти в гипермаркетах города-героя.
Первым делом я оценил внешний вид, т.е. цвет и консистенцию предлагаемых растворов. Хотя ожидать здесь чего-то экстраординарного не приходится (т.к. по условиям задачи — никаких гелей и прочего «химо-фарша», максимальная простота).
Потом измерил их плотность (кликабельно) + рН, он же водородный показатель.
Плотность измеряем вот такими советскими ареометрами да стеклянным цилиндриком
А рН, рН — уж чем бог пошлет (вплоть до индикаторных бумажек, но учитывайте что краситель в бумажках будет моментально «выгорать» и обесцвечиваться). В моем же дорожном чемоданчике случайно завалялись рН-метры Hanna:
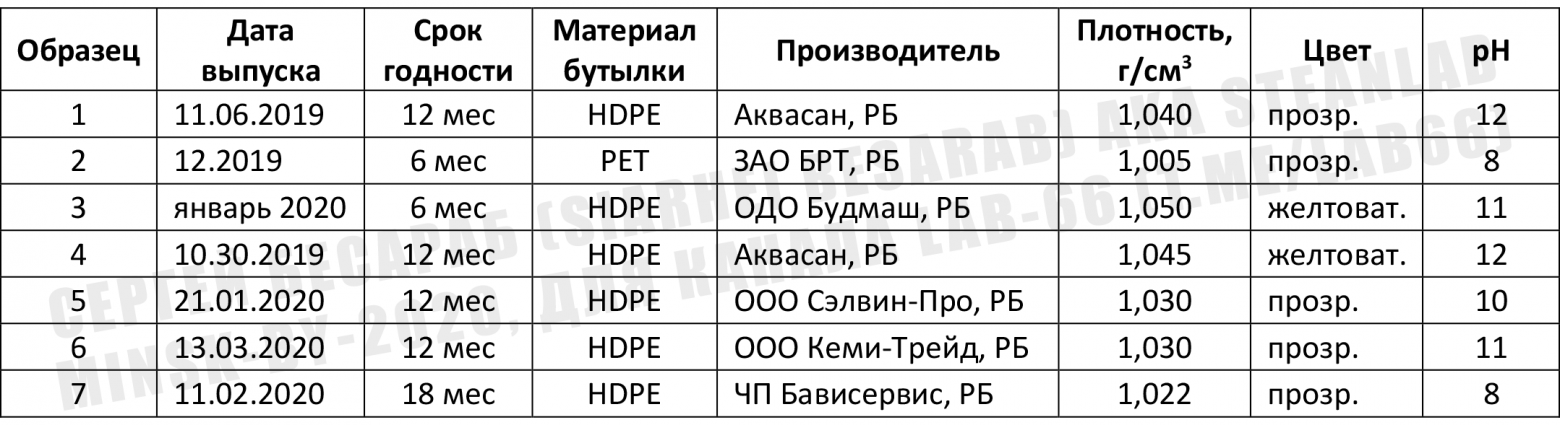
В результате получилась вот такая сводная таблица с данными (кое-что пришлось переписать с этикеток):
Отдельно напишу состав (т.е. то, что там есть еще КРОМЕ гипохлорита натрия, это важно, особенно учитывая всякие хлорамины и летучую хлорорганику, о которых я писал выше). Стиль написания сохранен, чтобы читатель понимал, кто пишет инструкции.
образец 1. Вода, анионный ПАВ – менее 5%, стабилизатор, комплексообразователь
образец 2. Вода
образец 3. Вода, НПАВ менее 5 (%), ароматизатор (свежесть) –менее 5%
образец 4. Вода, анионный ПАВ – менее 5%, стабилизатор, комплексообразователь
образец 5. Вода, щелочь – менее 5%, вода 30% и более
образец 6. Отличие аналитических реакций
В отечественном методе используется серная кислота и реакция:
В американском методе используется уксусная кислота и реакция:
В принципе, разницы по которой работать я лично не вижу, здесь играет роль доступность реагентов, я использовал ГОСТ-скую, т.к. серная кислота не так воняет как уксусная.
Метода ГОСТ Р 57568-2017 (упрощенная):
Для работы нам нужны следующие компоненты:
1)Серная кислота 1н.
Отмеряем 28,6 мл концентрированной серной кислоты (плотность = 1, 84 г/см3) и доводим до литра дистиллированной водой.
2)10 % раствор иодида калия
Взвешиваем 10 грамм иодида калия и растворяем в 90 мл дистиллированной воды. Раствор применяется свежеприготовленный
3)Раствор тиосульфата натрия 0.1н
Взвешиваем 25 г тиосульфата натрия (пентагидрата) и доводим дистиллированной водой до 1 л. Хранить в темной бутылке.
4)Раствор крахмала 1%
Взвешиваем 1 г крахмала (кукурузного, картофельного и т.п., хоть картошку натирайте и заваривайте, но! но не забудьте профильтровать 🙂 ) и размешиваем с 10 мл дистиллированной воды. Затем кипятим в стакане 90 мл дистиллированной воды и когда закипела — вливаем наши 10 мл с крахмалом. Варим, перемешивая 2-3 минуты. Используем свежеприготовленным.
Сама процедура проверки следующая. Отбираем образец гипохлорита объемом 10 мл, и доводим водой до 250 мл. Отбираем из этого объема 10 мл и переносим в стакан, в этот же стакан добавляем 10 мл раствора иодида калия и 20 мл серной кислоты. Хорошо перемешиваем и ставим в темноту на 5 минут. По прошествии 5 минут капаем по каплям (из калиброванной капельницы, а еще лучше бюретки) раствор тиосульфата натрия пока раствор красного цвета (из-за выделившегося иода) не станет прозрачным.
Когда жидкость приобретет соломенный (светло-желтый) цвет — доливаем в стакан 2-3 мл крахмала, раствор синеет.
Теперь потихоньку добавляем тиосульфат пока синий цвет не исчезнет.
Какие могут быть нюансы, влияющие на результат определения? А вот следующие (советую их держать в уме).
Все реактивы, за исключением уксусной кислоты — готовятся по идентичному ГОСТ-овскому методу (п.2-п.4 основной методики). Уксусная кислота (=замена серной кислоты из п.1) для «титрования по американски» готовится растворением 500 мл ледяной уксусной кислоты в 500 мл воды.
Подготовка пробы: отбираем 25 мл исследуемого гипохлорита натрия, переносим в 250 мл колбу/стакан и взвешиваем на весах с точностью до 0,01 грамма. Затем доводим дистиллированной водой до метки в 250 мл. Хорошо перемешиваем. Затем отбираем из этой колбы/стакана 10 мл раствора и переносим в новую колбу/стакан на 250 мл. Добавляем туда 50 мл дистиллированной воды, мешаем, добавляем 25 мл 10% раствора иодида калия и опять мешаем. Раствор приобретает красно-коричневый цвет (см. картинку выше). Добавляем 10 мл нашего раствора уксусной кислоты. Опять мешаем 3-5 минут. Затем титруем, по каплям добавляя раствор 0,1 н. раствор тиосульфата натрия. Считаем объем тиосульфата, который на это идет. После того, как раствор приобретает соломенно-желтую окраску, добавляем 5 мл раствора крахмала и острожно, по капле добавляем в посиневший (см. картинку выше) раствор тиосульфат. Когда синий цвет исчез и раствор стал прозрачным — титрование закончено. Записываем потраченный объем тиосульфата натрия. Концентрация гипохлорита натрия рассчитывается по формуле:
% NaOCl = (Объем потраченного тиосульфата натрия*N*3,723722)/0,04*масса образца гипохлорита
В результате титрования моих образцов получилось следующее (в скобках концентрация гипохлорита, которая считается по формуле: концентрация гипохлорита (NaOCl) = концентрация хлора*1,05:
образец 1. хлор 19.32 г/л = (NaOCl 20, 29 г/л) = 2,029 % раствор
образец 2. хлор 5.67 г/л = (NaOCl 5, 96 г/л) = 0,596 % раствор
образец 3. хлор 32.26 г/л = (NaOCl 33, 87 г/л) = 3,387 % раствор
образец 4. хлор 21.27 г/л = (NaOCl 22, 33 г/л) = 2,233 % раствор
образец 5. хлор 20.74 г/л = (NaOCl 21, 76 г/л) = 2,176 % раствор
образец 6. хлор 18.97 г/л = (NaOCl 19, 91 г/л) = 1,991 % раствор
образец 7. хлор 14.18 г/л = (NaOCl 14, 89 г/л) = 1,489 % раствор
Т.е. если считать что крайняя «короноубойная» концентрация гипохлорита натрия = 0,5%, то выходит что растворы нужно разбавлять в: 4 раза (средство 1, средство 6), 4,4 раза (средство 5) 4,5 раза (средство 4), в 7 раз нужно разбавлять средство 3. Средство 7 разбавляем в 3 раза, а средство 2 — вообще разбавлять не нужно (вот вам и прозрачная тара). Напоследок — фото с победителем:
Гомельский ОДО БУДМАШ! Хабра-привет вам и respect за вашу продукцию :).
На закуску покажу как полученные экспериментальные данные коррелируют с писаниной на этикетке:
образец 1. «гипохлорит натрия – 30% и более» = 2,029 %
образец 2. «гипохлорит натрия (5% или более, но не менее 15%) = 0,596 %
образец 3. «гипохлорит натрия 30 (%) и более» = 3,387 %
образец 4. «гипохлорит натрия – 30% и более» = 2,233 %
образец 5. «гипохлорит натрия – 5% и более, но менее 15%» = 2,176 %
образец 6. « 4%, что в наших краях возможно только если покупать промышленный гипохлорит используемый для нужд водоканалов, ибо белизна — сами видите, какая белизна):
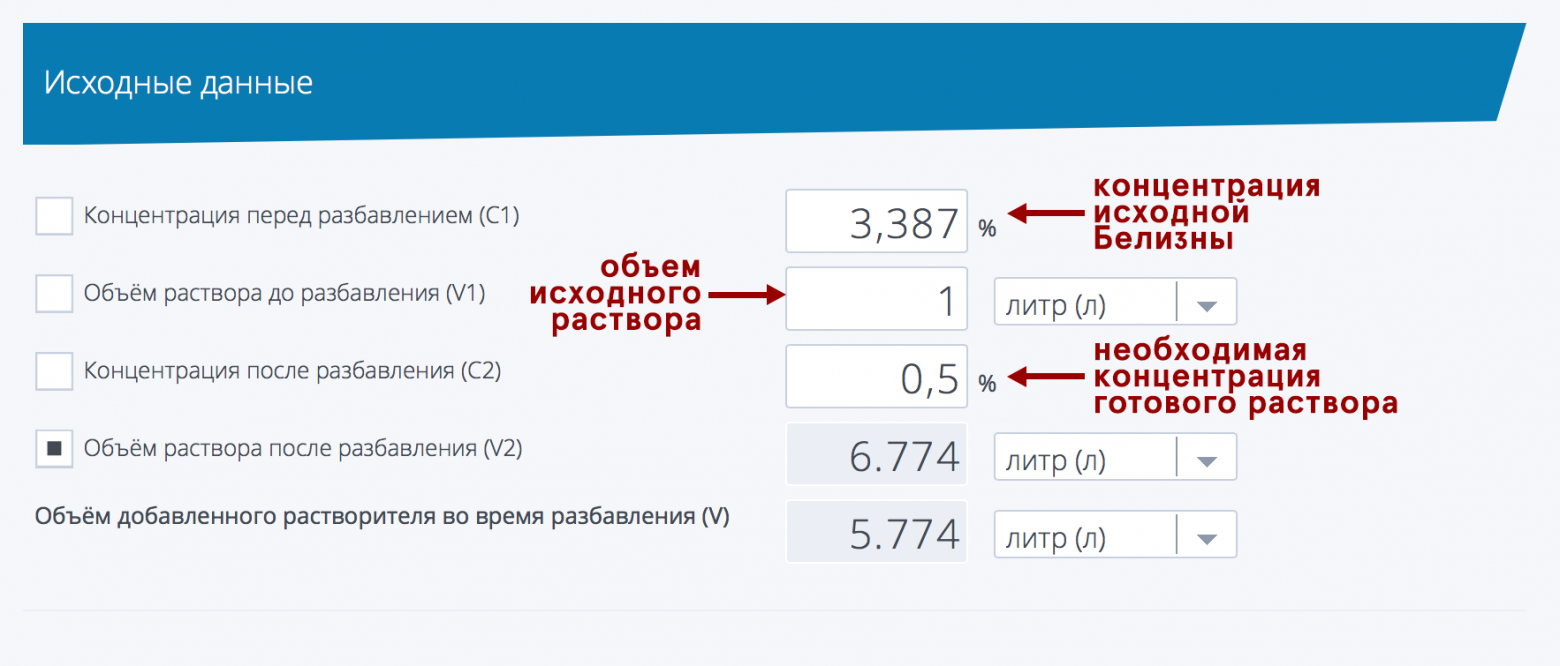
Кстати, допустим вы определились с необходимой для дезинфекции концентрацией, и с концентрацией купленной белизны, но… Но внезапно не знаете как развести ваше средство (фантастический, имхо, сценарий, но мало ли что, мы рождены ж чтоб сказку сделать былью). Для решения такой задачи вам понадобится пойти по ссылке «калькулятор разбавления растворов» и вписать туда нужные цифры. В качестве примера, возьмем нашего победителя, 1 литр белизны с концентрацией гипохлорита натрия 3,387 % от гомельского Будмаш и разведем до 0,5%, чтобы «помыть полы от коронавируса». Калькулятор нам пишет — нужно добавить 5,774 литра воды («растворителя»).
Как видите, ничего сложного. Обеззараживайтесь! 🙂
Краткие выводы
На этом все! Традиционно, предлагаю подписаться на мой научно-технический канал и подключаться к обсуждению!
Фактически, в роли «научного грантодателя» для этой статьи выступают мои «меценаты» с Patreon. Благодаря им все и пишется. Поэтому и ответ они могут получить раньше всех других, и черновики увидеть, и даже предложить свою тему статьи. Так что, если интересно то, о чем я пишу и/или есть что сказать — поспешите стать моим «патроном» (картинка кликабельна):
Автор выражает благодарность своему главному ассистенту — научному сотруднику Юстыне за помощь в испытаниях беларуских гипохлоритов и моей украинской parteigenosse Саше aka infiltree за ____ (впиши сама, ок?) :).
Благодарю всех читателей, которые поддерживают наш канал своими донатами! Без вас ничего бы не вышло. Надеюсь я не слишком затянул с написанием, и правильную Белизну еще можно будет найти в магазинах.
Важно! Если информация из статьи пригодилась вам в жизни, то еще не поздно:
Стать спонсором и поддержать канал/автора (=«на реактивы»)!
Перевод Киви (QIWI) 79176005394
ЯндексДеньги: 410018843026512 (перевод на карту)
WebMoney: 650377296748
BTC: 3QRyF2UwcKECVtk1Ep8scndmCBoRATvZkx
Ethereum (ETH): 0x3Aa313FA17444db70536A0ec5493F3aaA49C9CBf
Patreon — steanlab
Гипохлорит натрия
| Гипохлорит натрия | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Гипохлорит натрия |
| Традиционные названия | Гипохлорит натрия, лабарракова вода, жавелевая вода [К 1] |
| Химическая формула | NaOCl |
| Эмпирическая формула | NaOCl |
| Физические свойства | |
| Молярная масса | 74,443 г/моль |
| Плотность | пентагидрат: 1,574 [1] г/см³; 1,1 [2] г/см³ |
| Термические свойства | |
| Температура плавления | NaOCl · 5H2O [К 2] : 24,4 °C; NaOCl · 2,5H2O: 57,5 [3] °C |
| Температура разложения | 5%-й раствор [2] : 40 |
| Энтальпия образования (ст. усл.) | пентагидрат [К 3] : − 350,4 [3] кДж/моль |
| Химические свойства | |
| Растворимость в воде | NaOCl · 5H2O (20 °C): 53,4 [4] |
| Растворимость в в воде | NaOCl · 2,5H2O (50 °C): 129,9 [4] |
| Классификация | |
| Рег. номер CAS | 7681-52-9 |
| Регистрационный номер EC | 231-668-3 |
| RTECS | NH3486300 |
Соединение в свободном состоянии очень неустойчиво, обычно используется в виде относительно стабильного пентагидрата NaOCl · 5H2O или водного раствора, имеющего характерный резкий запах хлора и обладающего высокими коррозионными свойствами.
Содержание
История открытия
Физические свойства
Безводный гипохлорит натрия представляет собой неустойчивое бесцветное кристаллическое вещество. Элементный состав: Na (30,9 %), Cl (47,6 %), O (21,5 %).
У соединения известно три кристаллогидрата:
Плотность водного раствора гипохлорита натрия при 18 °C [11] :
| 1 % | 2 % | 4 % | 6 % | 8 % | 10 % | 14 % | |
|---|---|---|---|---|---|---|---|
| Плотность, г/л | 1005,3 | 1012,1 | 1025,8 | 1039,7 | 1053,8 | 1068,1 | 1097,7 |
| 18 % | 22 % | 26 % | 30 % | 34 % | 38 % | 40 % | |
| 1128,8 | 1161,4 | 1195,3 | 1230,7 | 1268,0 | 1308,5 | 1328,5 |
Температура замерзания водных растворов гипохлорита натрия различных концентраций [12] :[стр. 458] :
| 0,8 % | 2 % | 4 % | 6 % | 8 % | 10 % | 12 % | 15,6 % | |
|---|---|---|---|---|---|---|---|---|
| Температура замерзания, °C | −1,0 | −2,2 | −4,4 | −7,5 | −10,0 | −13,9 | −19,4 | −29,7 |
Термодинамические характеристики гипохлорита натрия в бесконечно разбавленном водном растворе [13] :
Химические свойства
Разложение и диспропорционирование
Гипохлорит натрия — неустойчивое соединение, легко разлагающееся с выделением кислорода:
При нагревании параллельно происходит реакция диспропорционирования [13] :
Гидролиз и разложение в водных растворах
Растворяясь в воде, гипохлорит натрия диссоциирует на ионы:
Так как хлорноватистая кислота (HOCl) очень слабая (pKa = 7,537 [13] ), гипохлорит-ион в водной среде подвергается гидролизу:
Именно наличие хлорноватистой кислоты в водных растворах гипохлорита натрия объясняет его сильные дезинфицирующие и отбеливающие свойства [13] (см. раздел «Физиологическое действие и воздействие на окружающую среду»).
В сильнощелочной среде (pH > 10), когда гидролиз гипохлорит-иона подавлен, разложение происходит следующим образом [15] :
При температурах выше 35 °C распад сопровождается реакцией диспропорционирования [15] :
При диапазоне pH от 5 до 10, когда концентрация хлорноватистой кислоты в растворе становится заметной, разложение идёт по следующей схеме [15] :

В кислой среде разложение HOCl ускоряется, а в очень кислой среде (pH [13] :
Если для подкисления используется соляная кислота, в результате выделяется хлор:
Пропуская через охлаждённый водный раствор гипохлорита натрия углекислый газ, можно получить раствор хлорноватистой кислоты:
Окислительные свойства
Рассмотрим основные варианты развития окислительно-восстановительного процесса и стандартные электродные потенциалы полуреакций в водной среде [17] [К 7] :
Некоторые окислительно-восстановительные реакции с участием гипохлорита натрия:
Идентификация
Среди качественных аналитических реакций на гипохлорит-ион можно отметить выпадение коричневого осадка метагидроксида при добавлении при комнатной температуре испытуемого образца к щелочному раствору соли одновалентного таллия (предел обнаружения 0,5 мкг гипохлорита):
Коррозионное воздействие
Гипохлорит натрия оказывает довольно сильное коррозионное воздействие на различные материалы, о чём свидетельствуют приведённые ниже данные [24] :



















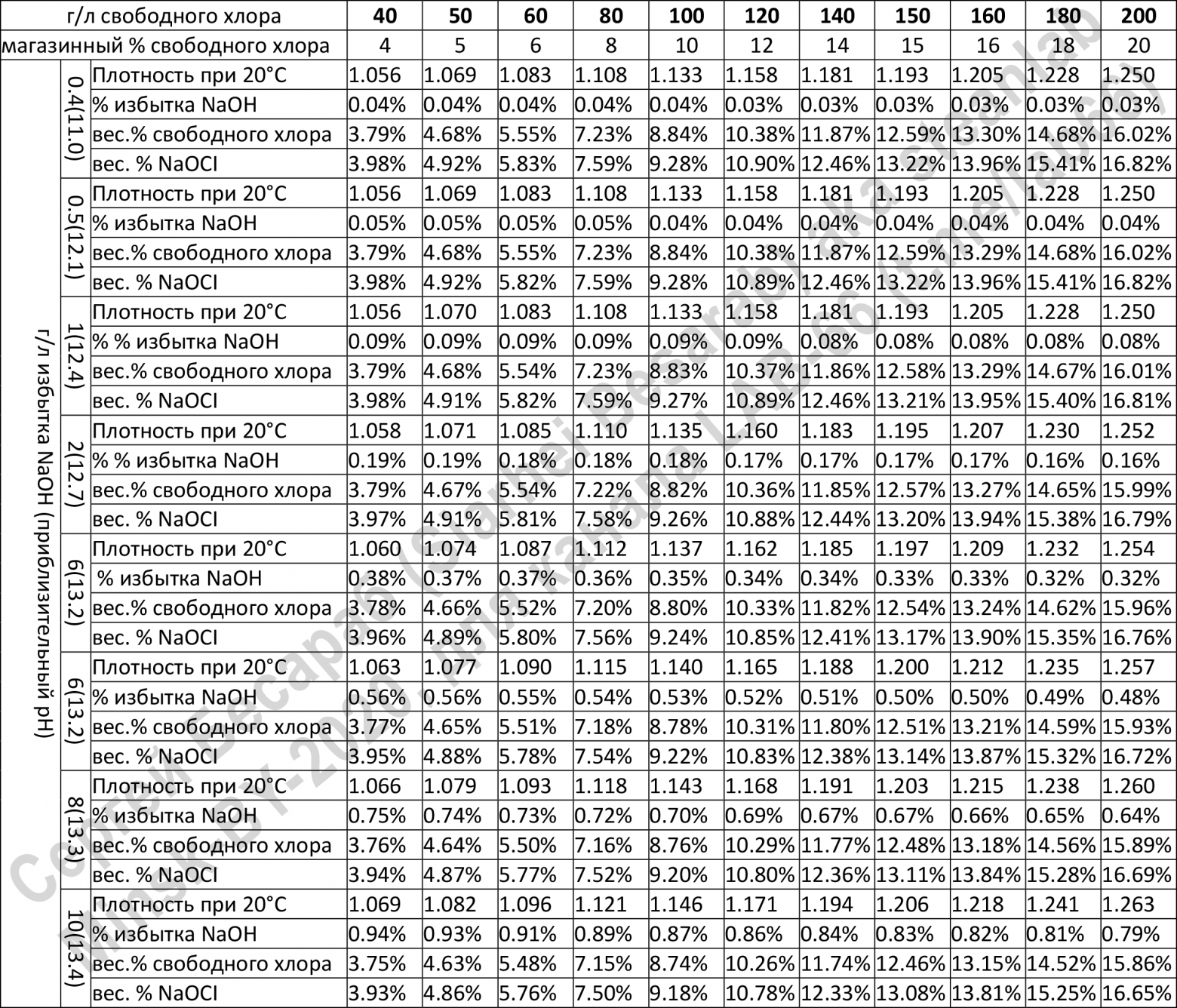


















 [К 12]
[К 12]














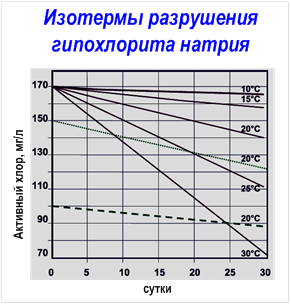
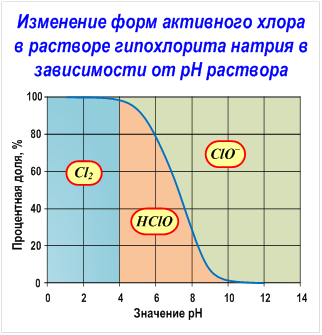 Мы уже упоминали о том, что водные растворы ГПХН неустойчивы и со временем разлагаются даже при обычной температуре, и что наиболее устойчивы растворы с сильнощелочной средой (pH > 11).
Мы уже упоминали о том, что водные растворы ГПХН неустойчивы и со временем разлагаются даже при обычной температуре, и что наиболее устойчивы растворы с сильнощелочной средой (pH > 11).