иммунопатологические процессы характеристика формы
Медицинская учебная литература
Учебная медицинская литература, онлайн-библиотека для учащихся в ВУЗах и для медицинских работников
Иммунопатологические процессы
ОБЩАЯ ХАРАКТЕРИСТИКА ИММУННОЙ СИСТЕМЫ
Иммуногенная реактивность — ответ организма на антигенный стимул. Материальным субстратом иммуногенной реактивности является иммунная, или иммунокомпетентная, система (ИКС). Иммунная система представляет собой совокупность органов, тканей и клеток, обеспечивающих биохимическую, структурную и функциональную однородность и индивидуальность организма путем обнаружения, уничтожения и удаления (элиминации) из него чужеродных антигенов.
Эволюционно иммунная система сформировалась как механизм контроля за однородным и индивидуальным антигенным составом организма. В основе этого механизма лежит способность клеток иммунной системы отличать собственные клетки и белковые соединения от чужеродных. Обнаружение последних сопровождается инактивацией, разрушением и элиминацией их из организма.
Антиген — вещество экзо- или эндогенного происхождения, вызывающее иммунную реакцию, которая заключается в выработке иммунных антител и лимфоцитов, их взаимодействии с антигеном, сопровождающимся его инактивацией и элиминацией.
Виды антигенов.
Антигены разделяют на несколько групп в зависимости от их биохимической структуры, происхождения, пути попадания в организм и других критериев.
По биохимической структуре антигены делят на два вида:
Сами по себе гаптены неиммуногенны. Однако после их соединения с белками или клетками организма они приобретают способность вызывать иммунные реакции.
По происхождению антигены делят на экзо- и эндогенные.
Экзогенные антигены составляют большую часть антигенов:
Эндогенные антигены также подразделяют на:
Иммунная система представлена тремя субсистемами клеток: А, В и Т.
Субсистему А-клеток составляют мононуклеарные клетки — моноциты, тканевые макрофаги и некоторые другие. Эти клетки обладают высокой способностью обнаруживать чужеродные антигены. поглощать их. выявлять их молекулярную структуру, передавать информацию о них Т- и В-лимфоцитам.
Субсистема В-клеток состоит из различных клонов В-лимфоцитов. При первом контакте антигена с В-лимфоцитами часть их превращается в плазматические, антителопродуцирующие клетки. а часть — в долгоживущие, рециркулирующие клетки иммунной памяти. Повторный контакт этих клеток с тем же антигеном сопровождается массированной бласттрансформацией лимфоцитов памяти и трансформацией их в плазматические клетки, вырабатывающие специфические иммуноглобулины — антитела. У человека выделяют 5 основных классов иммуноглобулинов: А, Е, G, М, D.
Субсистема Т-клеток представлена различными клонами Т-лимфоцитов. Их пролиферация и созревание происходят в основном с участием вилочковой железы (тимуса), с чем связано их обозначение: Т-лимфоциты, т. е. тимусзависимые. Первый контакт Т-клеток с антигеном сопровождается их дифференцировкой в зрелые, долгоживущие лимфоциты различных субполяций. включая клетки памяти. При повторном контакте с тем же антигеном клетки памяти превращаются в специфические Т-лимфоциты различных клонов.
В субсистемах Т- и В-лимфоцитов имеются «исполнительные» клетки:
Иммунный ответ организуется клетками всех субсистем ИКС,
сопровождается развитием разнообразных иммунопатологических состояний, реализующихся через воспаление. Инициальным этапом иммунной реакции является распознавание антигена: если он чужероден для организма, информация о нем передается эфферентным клеткам ИКС.
ТИПОВЫЕ ФОРМЫ ИММУНОПАТОЛОГИЧЕСКИХ ПРОЦЕССОВ
Иммунопатологические процессы — это реакции организма, развивающиеся в результате нарушений иммунитета. В большинстве случаев они являются следствием дефекта или истощения одного или нескольких механизмов, необходимых для обеспечения эффективного иммунного ответа.
ВИДЫ ИММУНОПАТОЛОГИЧЕСКИХ ПРОЦЕССОВ
Первичные (наследственные, врожденные). Они являются результатом генетического дефекта, обусловливающего нарушения процессов пролиферации, дифференцировки и функционирования клеток А-, В- или Т-лимфоцитов иммунной системы.
Вторичные (приобретенные в постнатальном периоде онтогенеза). Развиваются под влиянием повреждающих факторов физического характера (например, высокой дозы рентгеновского излучения), химического (например, действия цитостатических агентов) или биологического (например, значительного повышения уровня в крови глюкокортикоидов, повреждения клеток иммунной системы при вирусной или бактериальной инфекции).
По механизмам развития:
По преимущественному повреждению клеток различных иммунных субсистем:
Характеристика отдельных иммунопатологических процессов
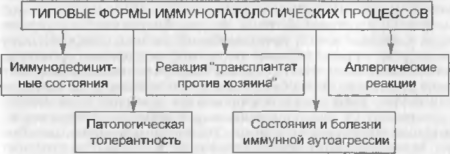
Выделяют несколько основных групп типовых расстройств иммунитета: иммунодефицитные состояния (ИДС), патологическую толерантность, реакцию «трансплантат против хозяина», аллергические реакции, состояния иммунной аутоагрессии (схема 2).
Иммунодефицитные состояния
Иммунодефицитные состояния (или иммунодефициты) характеризуются значительным снижением активности или неспособностью организма к эффективному осуществлению реакций клеточного или гуморального иммунитета. Они проявляются высокой склонностью организма к развитию инфекционных, паразитарных, опухолевых и аллергических заболеваний.
Главным звеном патогенеза иммунодефицитов является блокада процессов деления и/или созревания клеток А-, Т- или В-субсистем ИКС либо деления и дифференцировки их клеток-предшественников.
Примером иммунодефицитного состояния может служить синдром ретикулярной дискинезии. Она характеризуется значительным уменьшением в костном мозге количества стволовых гемопоэтических клеток и блокадой созревания из них лимфо- и моноцитов с развитием дефицита клеток А-, В- и Т-субсистем. Пациенты, страдающие этим синдромом, погибают вскоре после рождения от различных инфекций или злокачественных опухолей.
Схема 2
Нарушения в субсистеме А-клеток проявляются расстройством фагоцитоза, процессов «переработки» и представления антигена лимфоцитам.
Расстройства деления и созревания В- или Т-лимфоцитов обусловливают нарушение реакций гуморального и клеточного иммунитета. В связи с этим у больных часто наблюдаются вирусные, бактериальные и грибковые инфекции, заболеваемость новообразованиями увеличивается более чем в 100 раз.
Виды иммунодефицитных состояний
Синдром приобретенного иммунодефицита (СПИД) является одним из наиболее ярких иммунодефицитных состояний. Впервые описан в научной литературе в 1981 г. Однако ретроспективный анализ свидетельствует о том, что СПИД поражал людей и ранее. Первые случаи синдрома были зарегистрированы в США, Африке, на Гаити. В последние годы установлено, что каждые 12—14 мес число зарегистрированных случаев заболевания удваивается. Наибольшее распространение СПИД имеет среди гомо- и бисексуальных мужчин; наркоманов, вводящих наркотики внутривенно и пользующихся «коллективными» шприцами; реципиентов гемотрансфузий (больные анемиями); детей, родители которых больны СПИДом.
Возбудителем СПИДа является вирус, который обозначают как ВИЧ — вирус иммунодефицита человека или ЛАВ — лимфаденопатический вирус. Он относится к группе ретровирусов подсемейства лентивирусов. Ретровирусы содержат однонитчатую линейную РНК и фермент ревертазу. Репликация вирусной нуклеиновой кислоты идет через стадию синтеза двунитчатой ДНК на матрице РНК, т. е. как бы обратным путем (отсюда название фермента — ревертаза и группы вирусов — ретровирусы).
Попав в организм, возбудитель СПИДа внедряется в клетки, содержащие рецептор Т4, к которому вирусы высокоспецифичны. Наиболее богаты такими рецепторами Т-лимфоциты-хелперы. Однако, помимо этих клеток, вирус способен внедряться также и в моноциты, тканевые макрофаги, клетки глии, нейроны. В ядро клетки-мишени проникает ДНК-копия с РНК вируса, которая внедряется в клеточный геном. Вирус обнаруживается в крови, в ткани слюнных желез, предстательной железы, яичек. Через 6— 8 нед (реже через 8—9 мес) после инфицирования организма в крови появляются антитела к ВИЧ. С этого момента инфицирование организма может быть выявлено современными методами.
Действие ВИЧ на клетки организма приводит к их лизису и уменьшению их числа. В наибольшей мере это относится к Т-лимфоцитам-хелперам. Именно поэтому развивается лимфопения. Одновременно примерно на 80—90 % снижаются количество и функциональная активность Т-лимфоцитов-киллеров. Число В-лимфоцитов, как правило, остается в пределах нормы, но функциональная активность их снижена.
Количество макрофагов и других А-клеток не изменяется, однако нарушаются хемотаксис и внутриклеточное переваривание чужеродных агентов. Нарушается также механизм представления макрофагом антигена Т- и В-лимфоцитам. Эти изменения создают предрасположенность больных СПИДом к инфекциям, лимфоретикулярным опухолям — к саркоме Капоши.
В лимфатических узлах больных СПИДом выявляется гиперплазия фолликулов, в основном за счет увеличения количества Т-супрессоров. С одержание Т-хелперов значительно снижено. В тимусе обнаруживается атрофия эпителиальных и уменьшение числа лимфоидных клеток. Таким образом, СПИД представляет собой вариант комбинированного иммунодефицитного состояния.
Толерантность
Толерантность (от лат. tolerantia — переносимость, терпимость) — состояние, характеризующееся «терпимостью», т. е. отсутствием реакции иммунной системы на чужеродные антигены. При этом состоянии в иммунной системе нарушена выработка иммунных лимфоцитов, либо клетки иммунной системы не вырабатывают антител, либо не реализуется эфферентное звено иммунитета — уничтожение и элиминация носителя чужеродной антигенной информации.
Толерантность может быть подразделена на три разновидности: физиологическую, патологическую и индуцированную.
Основные механизмы патологической толерантности:
Физиологическая толерантность — терпимость иммунной системы антигенов собственных белков организма. При этом те клоны иммунных клеток, которые в период эмбрионального развития подвергаются массированному воздействию антигенов собственных белков, гибнут и выводятся из организма.
Одной из форм физиологической толерантности является изоляционная толерантность. Она распространяется на антигены клеток тканей, изолированных от иммунокомпетентной системы структурно-физиологическими барьерами. К ним относятся ткань головного мозга, хрусталик глаза, яички, щитовидная железа.
Патологическая толерантность. В этом случае речь идет о «терпимости» иммунной системой чужеродных антигенов, чаще всего бактерий, вирусов, многоклеточных паразитов, клеток злокачественных опухолей или трансплантата.
Это происходит тогда, когда специфические иммуноглобулины, взаимодействуя с антигенами клеток не способны инактивировать их. Антигенные детерминанты клеток закрываются («экранируются») этими «недееспособными» антителами или комплексами «антиген—антитело». Т-лимфоциты-киллеры в таком случае не способны обнаружить «экранированную» чужеродную клетку.
Индуцированная толерантность (искусственная, лечебная) достигается с помощью воздействий, целенаправленно подавляющих активность иммунных клеток, таких как ионизирующее излучение, высокие дозы цитостатиков, иммунодепрессанты. Они вызывают лизис, торможение или блокаду деления и созревания клеток иммунной системы. Индуцированную толерантность в медицине используют с целью повышения успеха трансплантации органов и тканей, лечения аллергических реакций.
Реакция «трансплантантат против хозяина» (РТПХ)
Реакция развивается в случае трансплантации реципиенту большой массы тканей донора, содержащих иммунные клетки (например, костного мозга или лейкоцитной массы). Течение РТПХ усугубляется при пониженной активности иммунной системы «хозяина» (например, при воздействии ионизирующего излучения. иммунодепрессантов). РТПХ характеризуется поражением органов и тканей иммунокомпетентной системы реципиента, а также повреждением кожи, желудочно-кишечного тракта (особенно в зоне расположения групповых лимфатических фолликулов — пейеровых бляшек), печени.
Клинико-морфологические проявления РТПХ заключаютсяв развитии некротических и дистрофических поражений указанных органов, лимфопении, анемии, тромбоцитопении, диспепсических расстройств (тошнота, рвота, диарея), увеличении печени. У взрослых описанное состояние обозначают термином «гомологическая болезнь» (следствие гомотрансплантации клеток иммунной системы), у новорожденных — как «рант-болезнь» — болезнь малого роста (в связи с нарушением физического развития ребенка, которому имплантировали ткань, содержащую клетки иммунной системы).
АЛЛЕРГИЧЕСКИЕ РЕАКЦИИ
Аллергия — одна из форм иммунопатологических процессов, характеризующихся повышением чувствительности организма к повторным воздействиям аллергенов. Проявляется аллергия, в отличие от иммунитета, повреждением собственных тканей организма и снижением эффективности его адаптивных реакций. Это нередко приводит к тому, что носитель чужеродного антигена не разрушается до конца или не элиминируется из организма. Вместе с тем в целом аллергия, так же как и иммунитет, способствует поддержанию антигенной индивидуальности и однородности организма путем удаления из него чужеродных агентов-аллергенов.
Аллергические реакции встречаются у 10—20 % населения. Одной из причин широкой распространенности аллергии считаются «химизация» жизни современного человека, прием некоторых лекарственных препаратов, а также иногда профилактические прививки.
Аллергия формируется под воздействием аллергенов — агентов антигенной или гаптенной природы, а также некоторых физических факторов (высокой или низкой температуры, ультрафиолетового и ионизирующего излучений и др.).
Виды аллергенов
Эндогенные аллергены. К ним относятся компоненты клеток и тканей собственного организма (белки, полипептиды, крупномолекулярные полисахариды, липополисахариды), приобретающие аллергенные свойства в результате:
По путям проникновения аллергенов в организм:
В зависимости от вида клеток иммунной системы, принимающих участие в развитии аллергии, условно различают В-лимфоцитзависимые (гуморальные, иммуноглобулиновые) и Т-лимфоцитзависимые («клеточные») аллергические реакции.
К группе В-лимфоцитзависимых относят такие формы аллергии. в механизмах которых ведущую роль играют продуцируемые В-лимфоцитами циркулирующие в крови гуморальные антитела, принадлежащие к различным классам иммуноглобулинов — lgE, IgG, IgM. В-лимфоцитзависимые иммуноглобулиновые реакции гиперчувствительности могут быть «перенесены» от сенсибилизированного организма в другой с помощью сыворотки, содержащей эти аллергические антитела, что называется «пассивным переносом аллергии ”.
К группе Т-лимфоцитзависилых относят аллергические реакции, в патогенезе которых ведущая роль принадлежит Т-лимфоцитам и продуцируемым ими биологически активным веществам — лимфокинам. Последние выполняют роль посредников (медиаторов) в механизмах аллергии. Причинами развития таких реакций могут быть антигены чужеродных тканей и клеток, низкомолекулярные химические соединения, в том числе некоторые местно применяемые лекарственные средства (например, антибиотики), антигены микроорганизмов.
Состояние аллергии этого типа может быть «пассивно» перенесено от больного человека здоровому сенсибилизированными лимфоцитами или «экстрактом» из таких клеток, например при переливании крови или введении сывороточных препаратов.
В зависимости от скорости развития морфологических изменений и клинических проявлений после повторного действия на сенсибилизированный организма антигена (его называют «разрешающим») аллергические реакции (реакции гиперчувствительности) делят на три типа:
Реакции гиперчувствительности немедленного типа проявляются сразу или через несколько минут после повторного контакта организма с аллергеном (например, аллергический ринит, конъюнктивит. анафилактический шок).
Реакции гиперчувствительности позднего типа выявляются через несколько часов (но не позднее 5—6 ч) после контакта с разрешающим антигеном (например, гемолитическая анемия аллергического генеза. некоторые разновидности сывороточной болезни).
Реакция гиперчувствительности замедленного типа регистрируются обычно через несколько часов или, чаще, суток после повторного «разрешающего» воздействия аллергена на сенсибилизированный организм (например, туберкулиновая реакция или контактный дерматит).
В зависимости от особенностей механизмов развития реакции гиперчувствительности немедленного и позднего типов развиваются в результате взаимодействия антигена с антителами сенсибилизированного организма — иммуноглобулинами. Реакция гиперчувствительности замедленного типа реализуется в основном с участием сенсибилизированных клеток — Т-лимфоцитов, их лимфокинов, а также макрофагов. Однако в патогенезе аллергических реакций участвуют механизмы, как правило, не одного, а. возможно, всех типов гиперчувствительности. И поэтому большинство болезней и реакций аллергического генеза являются комбинированными по своему механизму.
СТАДИИ И МЕХАНИЗМЫ РАЗВИТИЯ АЛЛЕРГИЧЕСКИХ РЕАКЦИЙ
В развитии аллергии выделяют три стадии:
I. Иммуногенная стадия начинается с момента первого контакта аллергена с клетками иммунной системы и заключается в инициации аллергической реакции: развивается состояние сенсибилизации, т. е. повышенной чувствительности организма к данному антигену (аллергену). В этот период образуются специфические антитела или сенсибилизированные (активированные) лимфоциты к определенному антигену и накоплению их преимущественно в определенной ткани.
По механизму формирования различают активную и пассивную сенсибилизацию.
II. Патохимическая стадия. После взаимодействия образовавшихся специфических антител или сенсибилизированных лимфоцитов с антигеном начинаются патохимические изменения в организме. В реакциях гиперчувствительности немедленного и позднего типов образование комплекса антиген—антитело в сенсибилизированном организме вызывает активацию клеточных и сывороточных протеолитических и липолитических ферментов, высвобождение клетками крови и тканей медиаторов воспаления.
При развитии аллергических реакций гиперчувствительности замедленного типа патохимическая стадия характеризуется активацией синтеза и высвобождением лимфокинов сенсибилизированными лимфоцитами.
III. Клинико-морфологическая стадия. Образующиеся при аллергизации организма гуморальные антитела и Т-лимфоциты-киллеры, взаимодействуя со свободным либо фиксированным на клетках и неклеточных структурах антигеном, вызывают прямое или опосредованное (через соответствующие медиаторы аллергии) повреждение клеток и тканей.
Для аллергии немедленного и отсроченного типов характерно быстрое развитие местных морфологических изменений вплоть до некроза тканей, а иногда и общих нарушений, включая развитие шока. К наиболее значительным изменениям такого рода относятся:
Структурно-функциональные повреждения при реакции гиперчувствительности замедленного типа связаны с развитием вначале экссудативного воспаления, которое сменяется продуктивным воспалением с выраженной мононуклеарной инфильтрацией тканей. При персистенции антигена макрофаги трансформируются в эпителиоидные клетки с образованием гранулем.
ХАРАКТЕРИСТИКА ОТДЕЛЬНЫХ ВИДОВ АЛЛЕРГИЧЕСКИХ РЕАКЦИЙ
Анафилактический шок развивается у человека в ответ на внутривенное введение антигена, к которому организм хозяина был предварительно сенсибилизирован. Таким антигеном являются чужеродные белки, например антисыворотки, гормоны, ферменты. производные витамина В препараты из группы пенициллина, причем даже в минимальных дозах.
Острая крапивница и отек Квинке — проявления местной анафилаксии или атопической аллергии. Около 10 % населения страдает от местной анафилаксии, возникающей в ответ на попадание в организм аллергенов — пыльцы растений, перхоти животных, домашней пыли и т. п. При этом значительно повышается проницаемость сосудистых стенок с развитием отеков, появлением мучительного кожного зуда, тошноты, болей в животе. иногда рвоты, озноба. При отеке Квинке в результате быстро нарастающего отека области шеи и лица появляются напряжение тканей, увеличение размеров губ, век, носа, ушей, языка. Наступает отек слизистой оболочки трахеи, особенно в области голосовых связок, появляется осиплость голоса и развивается асфиксия. Иногда отек распространяется на слизистые оболочки органов пищеварительного тракта с нарушением глотания и развитием острой кишечной непроходимости. Возможен отек мозга.
Острая сывороточная болезнь возникает после многократных введений чужеродной сыворотки крови при пассивной иммунизации. При этом в крови образуются иммунные комплексы антиген—антитело, которые, осаждаясь в различных тканях, вызывают воспалительные реакции. Появляются лихорадка, кожный зуд, озноб, головная боль, потливость. Иногда развиваются тошнота, рвота, боль в животе, перемежающиеся боли в суставах. Нарастающее острое воспаление сосудов, поврежденных циркулирующими иммунными комплексами (некротизирующий васкулит), проявляется появлением кожных высыпаний, поражением почечных клубочков. Продолжительность заболевания от нескольких дней до 2—3 нед.
Феномен Артюса может развиваться у больного через А — 10 ч после повторного введения в то же место лекарственных препаратов («ягодичные реакции»). В области инъекций развивается экссудативно-некротическая реакция в виде некроза тканей, сопровождающегося выраженным отеком, гиперемией кожи, резкой болезненностью, кожным зудом. В основе феномена лежит экссудативно-некротическая реакция в виде фибриноидного некроза стенок сосудов, что может сопровождаться тромбозом или кровоизлиянием.
Болезни иммунной аутоагрессии (БИА), или аутоиммунные болезни. К ним относят нарушения жизнедеятельности организма, вызванные развитием иммунопатологических реакций, направленных против собственных клеток и неклеточных структур. Сущность этих заболеваний заключается в потере клетками и тканями организма аутотолерантности.
Конкретные причины и механизмы отдельных аутоиммунных заболеваний сложны и еще недостаточно изучены. К числу наиболее исследованных механизмов происхождения БИА относят:
БОЛЕЗНИ ИММУННОЙ АУТОАГРЕССИИ
В зависимости от доминирующего механизма развития выделяют:
В зависимости от числа пораженных органов различают моноорганные (или органоспецифические аутоиммунные болезни) и полиорганные БИА (син.: системные, генерализованные).
При люноорганных БИА аутоагрессивные Т-киллеры или специфические антитела взаимодействуют с антигенными структурами только одного органа.
Примерами являются тиреоидит Хашимото и анемия Аддисона—Бирмера (пернициозная). При тиреоидите Хашимото иммуноглобулины (антитела) строго специфичны по отношению к антигену — белку щитовидной железы тиреоглобулину. В результате этого взаимодействия гибнет функциональная ткань щитовидной железы.
В случае анемии Аддисона—Бирмера в крови выявляются аутоагрессивные иммуноглобулины к измененному внутреннему фактору Касла — гастромукопротеину, образующемуся в слизистой оболочке желудка и являющемуся важнейшем звеном регуляции гемопоэза.
При полиорганных БИА действие аутоиммунных Т-киллеров и антител направлено против антигенных структур многих органов и тканей организма.
Причины: наличие у них сходного антигена, низкая специфичность аутоагрессивных Т-лимфоцитов и антител. Примером может служить системная красная волчанка, при которой аутоиммуноглобулины (аутоантитела) взаимодействуют с определенными антигенами ядер и цитоплазмы клеток многих тканей и органов, в том числе полиморфно-ядерных лейкоцитов.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Иммунопатологические процессы (патологическая анатомия)
Иммунопатологи́ческие проце́ссы — патологические изменения органов иммунной системы и нарушения иммунного ответа.
Основными формами нарушения иммунного ответа являются его недостаточность (иммунодефицит) и чрезмерная выраженность (аллергия).
Содержание
Структура иммунной системы
К иммунной системе относятся органы и ткани, в которых происходит созревание (дифференцировка) Т- и В-лимфоцитов. Выделяют первичные и вторичные органы иммунной системы.
I. Первичные органы иммунной системы
II. Вторичные органы иммунной системы
В первичных (центральных) органах проходит первый этап дифференцировки лимфоцитов, до взаимодействия их с антигеном (этап антиген-независимой дифференцировки). Т-лимфоциты при этом созревают в тимусе (после инволюции тимуса его роль на себя берут многослойные плоские эпителии), В-лимфоциты — в красном костном мозге.
Вторичные (периферические) органы обеспечивают последующее созревание Т- и В-лимфоцитов после взаимодействия их с антигенами (этап антиген-зависимой дифференцировки). В лимфоузлах и в лимфоидной ткани селезёнки дифференцируются как Т-, так и В-лимфоциты. В MALT-структурах и факультативных лимфоидных образованиях созревают в основном В-лимфоциты, в SALT-структурах — преимущественно Т-лимфоциты.
MALT-структуры (MALT — аббревиатура от англ. mucosa-associated lymphoid tissue) — лимфоидная ткань слизистых оболочек пищеварительного тракта, дыхательных и мочеполовых путей, конъюнктивы. К MALT-структурам относятся (1) миндалины кольца Вальдеера—Пирогова, (2) червеобразный отросток слепой кишки, (3) пейеровы бляшки и (4) солитарные фолликулы.
SALT-структурами (SALT — от англ. skin-associated lymphoid tissue) называют небольшие скопления иммунокомпетентных клеток вокруг мелких сосудов в сосочковом и ретикулярном слоях дермы.
Факультативными лимфоидными образованиями называются лимфоидные структуры в виде солитарных фолликулов, возникающие только при патологических процессах в тех органах, где в норме лимфоидная ткань отсутствует. Например, лимфоидные фолликулы формируются в портальных трактах печени при хроническом вирусном гепатите C, в щитовидной железе при аутоиммунном тиреоидите или в слизистой оболочке желудка при геликобактериозе.
Возрастная инволюция тимуса
Тимус подвергается физиологической атрофии (возрастной инволюции). При этом уменьшается прежде всего объём лимфоидной ткани органа. Возрастная инволюция тимуса начинается с 5—7-летнего возраста и в основном завершается к пубертатному периоду (периоду полового созревания). Паренхима тимуса замещается белой жировой тканью (липоматоз тимуса). Однако небольшие фрагменты активной паренхимы сохраняются на протяжении всей жизни человека. Функция тимуса в постинволютивном периоде переходит к покровным тканям, выстланным многослойным плоским эпителием (кожа, некоторые слизистые оболочки, прежде всего слизистая оболочка полости рта). Наглядной иллюстрацией этому являются изменения иммунитета при синдроме Ди Джорджи. Иммунодефицитное состояние при этом заболевании, обусловленное врождённой гипоплазией тимуса, сохраняется первые пять лет жизни ребёнка. В последующие годы, если больной не погибает от проявлений иммунодефицита, функция иммунной системы восстанавливается благодаря тому, что клетки многослойных плоских (сквамозных) эпителиев приобретают способность продуцировать тимические гормоны и, благодаря этому, привлекать предшественников Т-лимфоцитов из костного мозга, обеспечивая их созревание в покровных тканях.
Патология тимуса
В тимусе могут возникать разнообразные патологические процессы: (1) воспаление (тимит), (2) доброкачественные и злокачественные опухоли, (3) пороки развития. Однако наибольшее значение имеют (4) глюкокортикоид-зависимые поражения — акцидентальная трансформация и глюкокортикоид-ассоциированная гиперплазия.
Влияние глюкокортикоидных гормонов на лимфоциты
Глюкокортикоиды (гормоны пучковой зоны коры надпочечников) являются дифференцировочными факторами (т.е. факторами, способствующими созреванию) для всех лимфоцитов, в том числе лимфоцитов тимуса.
1. Глюкокортикоидные гормоны в нормальной концентрации тормозят размножение (пролиферацию) лимфоцитов и способствуют их дифференцировке.
2. При недостатке глюкокортикоидов (хроническая надпочечниковая недостаточность) отмечается усиленная пролиферация лимфоцитов (глюкокортикоид-ассоциированная гиперплазия лимфоидной ткани), но не происходит их созревания. В результате этого образуется большое количество функционально неполноценных лимфоцитов, поэтому развивается иммунодефицитное состояние. Лимфоидные органы (тимус, лимфатические узлы, миндалины, селезёнка и др.) увеличиваются. Значительное увеличение тимуса обозначается термином тимомегалия; увеличение всех групп лимфоузлов называется генерализованной лимфаденопатией.
3. При высокой концентрации глюкокортикоидов в организме, что характерно для хронического дистресс-синдрома, лимфоциты под влиянием этих гормонов разрушаются путём апоптоза (избыток глюкокортикоидов активирует в лимфоцитах программу апоптоза). При этом уменьшается количество лимфоцитов и, следовательно, объём лимфоидной ткани. Уменьшение тимуса обозначается термином акцидентальная трансформация (от лат. accidentalis — случайный). «Случайным» этот процесс был назван потому, что причины его не были ясны. Хронический дистресс-синдром сопровождает различные тяжёлые заболевания (злокачественные опухоли, инфекционные болезни). Акцидентальная трансформация тимуса способствует развитию иммунодефицитного состояния, усугубляя и без того тяжёлое течение основного заболевания.
Глюкокортикоид-ассоциированная гиперплазия лимфоидной ткани
В зависимости от того, в каком периоде онтогенеза развивается хроническая надпочечниковая недостаточность, выделяют две формы глюкокортикоид-ассоциированной гиперплазии лимфоидной ткани: (1) врождённую (лимфатико-гипопластичекий диатез, status thymico-lymphaticus) и (2) приобретённую. Врождённая форма развивается во внутриутробном периоде, приобретённая — в постнатальном онтогенезе.
Для лимфатико-гипопластического диатеза, кроме дисгормональной гиперплазии лимфоидной ткани, характерны пороки развития внутренних органов, прежде всего сердца, в виде гипоплазии. У таких больных в случаях значительного напряжения защитно-приспособительных механизмов (тяжёлое заболевание, травма, оперативное вмешательство, интенсивные физические нагрузки) может наступить внезапная смерть. Её причиной является недостаточность в организме глюкокортикоидных гормонов, вследствие чего развиваются сосудистый коллапс и шок.
Акцидентальная трансформация тимуса
Широкое распространение в отечественной патологической анатомии получила схема морфогенеза акцидентальной трансформации, предложенная Т. Е. Ивановской. Первые четыре стадии акцидентальной трансформации являются обратимыми.
1 стадия — умеренная гиперплазия тимуса в острую фазу стресс-синдрома.
2 стадия — очаговая делимфатизация (гибель лимфоцитов) коры тимических долек.
3 стадия — тотальная делимфатизация коры (стадия инверсии слоёв). Лимфоциты тимуса в мозговом веществе количественно преобладают над тимоцитами коры, и оно в тканевых срезах, окрашенных гематоксилином и эозином, становится темнее коркового (в норме — наоборот).
4 стадия — тотальная делимфатизация тимических долек (как коркового, так и мозгового вещества) и гибель эпителиальных клеток тимуса (стадия гигантских телец Гассаля). В этой стадии тельца Гассаля, в норме расположенные только в мозговом веществе, появляются на территории всей дольки, в том числе и в коре. Их много, они различных размеров (полиморфизм телец Гассаля), некоторые из телец резко увеличены (гигантские тельца). В основном тельца Гассаля образованы детритом (разрушенными эпителиальными клетками), тогда как в норме они состоят из ороговевающих эпителиоцитов.
5 стадия — необратимые атрофические изменения тимуса.
Аллергия (реакции гиперчувствительности)
Аллерги́я (реакции гиперчувствительности) — проявление чрезмерно выраженного иммунного ответа. Антиген, вызывающий аллергию, называется аллерге́ном.
Классификация форм аллергии
Аллергические реакции классифицируют следующим образом:
I. Природа аллергена
II. Скорость развития изменений
Особые варианты аллергии замедленного типа:
III. Механизм развития аллергии (S. Sell, 1978)
Природа аллергена
В зависимости от природы аллергена различают реакции на экзоаллергены, аутоаллергию и реакцию «трансплантат против хозяина».
1. Аллергия на внешние антигены (экзоаллергены). Заболевания, развивающиеся при этом, называются экзогенные аллергозы (например, аллергическая бронхиальная астма, поллинозы).
2. Аутоаллергия — аллергия на собственные антигены (аутоантигены). Заболевания, в основе которых лежит аутоаллергия, называются аутоиммунными.
3. Реакция «трансплантат против хозяина» (РТПХ) — агрессия иммунных факторов, содержащихся в трансплантате, против органов и тканей реципиента. РТПХ чаще развивается при трансплантации костного мозга, сопровождается повреждением различных органов и может привести к смерти больного. Различают три формы РТПХ: (1) взрослую (гомологичная болезнь), (2) детскую (рант-болезнь) и (3) перинатальную (синдром Оменна).
Скорость развития аллергической реакции
По скорости развития изменений выделяют реакции немедленного, отсроченного и замедленного типов.
1. Аллергия немедленного типа (реакции гиперчувствительности немедленного типа, АНТ, реакции ГНТ) развивается обычно в течение нескольких минут. Тканевые изменения при этом описываются термином острое иммунное (аллергическое) воспаление.
2. Аллергия отсроченного (позднего) типа. Реакции позднего типа формируются в течение 1—6 часов.
3. Аллергия замедленного типа (реакции гиперчувствительности замедленного типа, АЗТ, реакции ГЗТ) развивается не менее чем через 24 часа. Тканевые изменения при этом обозначаются как хроническое иммунное (аллергическое) воспаление.
Особые варианты аллергии замедленного типа
Особыми вариантами аллергии замедленного типа являются реакции трансплантационного иммунитета, реакции туберкулинового типа и контактная гиперчувствительность.
1. Реакции трансплантационного иммунитета называют также реакциями отторжения трансплантата или реакцией «хозяин против трансплантата» (РХПТ). При микроскопическом исследовании при этом в трансплантате обнаруживаются два типа изменений: (1) продуктивная воспалительная реакция (лимфогистиоцитарный инфильтрат) и (2) альтернативные изменения клеток трансплантата вплоть до их гибели. Характерными являются тесные контакты клеток инфильтрата и клеток трансплантированной ткани.
2. Реакции туберкулинового типа развиваются при кожных аллергических пробах, с помощью которых можно диагностировать выраженность иммунного ответа на определённый антиген (например, пробы с туберкулином, бруцеллином и другими антигенными препаратами).
3. Контактная гиперчувствительность — реакция замедленного типа в месте контакта покровной ткани (кожи, слизистой оболочки) и аллергена. Эта форма аллергии лежит в основе таких заболеваний, как контактный аллергический дерматит, контактный аллергический хейлит и контактный аллергический стоматит.
Механизм развития аллергической реакции
По S. Sell (1978) различают шесть типов аллергических реакций. Реакции VI типа (гранулематозное воспаление) традиционно рассматриваются как проявления продуктивного воспаления.
1. Реакции I типа (реагиновые реакции, IgE-зависимые реакции) — аллергические реакции, развивающиеся под влиянием IgE (реагинов). При этом происходит дегрануляция тучных клеток (лаброцитов, тканевых базофилов), обусловливающая возникновение (1) отёка, (2) полнокровия микрососудов и (3) бронхоспазма. Некроз обычно не развивается. Характерно наличие в ткани многочисленных эозинофильных гранулоцитов. Выделяют две формы реагиновых реакций — анафилактические и атопические. Анафилакти́ческая реакция (анафилактический шок) при определённых условиях может развиться у каждого человека. В отличие от этого, атопия возникает не у всех людей, а только у предрасположенных лиц. Атопические реакции лежат в основе таких заболеваний, как аллергические формы крапивницы и отёка Квинке, поллинозы (аллергические риносинусопатии), атопическая (неинфекционно-аллергическая) бронхиальная астма, диффузный нейродермит, атопический диатез (экссудативно-катаральный диатез).
2. Реакции II типа (гуморальные цитотоксические реакции) — аллергические реакции, в ходе которых происходит повреждение клеток-мишеней под действием гуморальных иммунных факторов (иммуноглобулинов). Типичными примерами реакций II типа являются взаимодействие «ревматоидного фактора» (IgМ к FC-фрагментам IgG при ревматоидном артрите) и «волчаночного фактора» (антинуклеарные антитела при системной красной волчанке) с клетками организма.
3. Реакции III типа (иммунокомплексные реакции) — повреждение тканей, развивающееся под действием избытка циркулирующих полных иммунных комплексов. Полные иммунные комплексы образованы антигеном, антителами к нему и белками комплемента. Основным проявлением иммунокомплексных реакций является иммунокомплексный васкулит. Наиболее часто в процесс вовлекаются капилляры почечных клубочков (иммунокомплексный гломерулонефрит). Для иммунокомплексного воспаления характерно сочетание альтеративных и экссудативных реакций. Альтеративные изменения проявляются, как правило, фибриноидным некрозом стенок сосудов и периваскулярной ткани. Типично образование фибринозного и геморрагического экссудата.
4. Реакции IV типа (клеточные цитотоксические реакции) — аллергические реакции, при которых происходит разрушение клеток-мишеней под влиянием клеток-киллеров — цитотоксических Т-лимфоцитов и К-клеток. Т-лимфоциты-киллеры разрушают только те клетки, к поверхностным антигенам которых они сенсибилизированы. К-клетки («В-лимфоциты-киллеры») уничтожают клетки-мишени, покрытые антителами (антителозависимая клеточная цитотоксичность).
5. Реакции V типа (аллергические реакции аутоантител) — изменение (утрата или усиление) активности белковых молекул под влиянием аутоантител. Например, аутоантитела к инсулину или к инсулиновым рецепторам клеток инактивируют (нейтрализуют) их, следствием чего может быть развитие сахарного диабета. Аутоантитела к фолликулярным тиреоцитам, напротив, через специальные цитолеммальные рецепторы стимулируют эти клетки и увеличивают продукцию ими тиреоидных гормонов, что является причиной тиреотоксикоза. Следовательно, реакции V типа можно подразделить на два варианта: (1) реакции нейтрализации (инактивации) и (2) реакции стимуляции активности белков организма.
Патологическая аутоиммунизация
Аутоиммуниза́ция (аутоиммунный ответ) — иммунный ответ на собственные антигены. Различают (1) физиологическую (не сопровождающуюся повреждением тканей) и (2) патологическую аутоиммунизацию (аутоаллергию), при которой происходит повреждение тех тканевых структур, против которых направлен аутоиммунный ответ. Значительное повреждение ткани какого-либо органа ведёт к развитию его функциональной недостаточности. Так, при аутоиммунном тиреоидите формируется гипотиреоз (недостаточность продукции тиреоидных гормонов), при аутоиммунном агранулоцитозе развивается лейкопения вследствие разрушения в ходе аутоиммунного ответа нейтрофильных гранулоцитов крови. Выделяют два типа аутоиммунных факторов: (1) факторы клеточного аутоиммунитета (лимфоциты-киллеры, прежде всего аутосенсибилизированные Т-киллеры) и (2) факторы гуморального аутоиммунного ответа (аутоантитела). Основную роль в развитии тканевых повреждений играют клеточные аутоиммунные факторы.
Механизмы патологической аутоиммунизации
В развитии патологической аутоиммунизации играют роль четыре основных механизма: (1) модификация нормального аутоантигена (изменение структуры аутоантигена), (2) секвестрация аутоантигена ткани забарьерного органа (выход элементов ткани забарьерных органов за пределы гистогематического барьера при его повреждении), (3) антигенная мимикрия (сходство эпитопов аутоантигенов и экзоантигенов, вследствие чего иммунный ответ на внешний антиген сопровождается перекрёстным реагированием на сходный аутоантиген) и (4) недостаточность клеток-супрессоров.
Аутоиммунные болезни
Аутоимму́нные болезни — заболевания, при которых аутоаллергия является основным звеном патогенеза. Выделяют три группы аутоиммунных болезней: органоспецифические, органонеспецифические и аутоиммунные болезни промежуточного типа. При аутоиммунных заболеваниях в поражённом органе формируется лимфоцитарный или лимфоплазмоцитарный инфильтрат.
1. Органоспецифические аутоиммунные болезни развиваются вследствие повреждения гистогематических барьеров и характеризуются первичным поражением какого-либо одного забарьерного органа (например, щитовидной железы при тиреоидите Хасимото, тимуса при аутоиммунном тимите).
2. Органонеспецифические аутоиммунные болезни отличаются первичным вовлечением в процесс многих органов. При этом в одних случаях аутоиммунное поражение формируется в соединительных тканях (диффузные болезни соединительных тканей), в других — в стенках кровеносных сосудов (системные васкулиты). К диффузным болезням соединительных тканей относятся ревматоидный артрит, системная красная волчанка, системная склеродермия, полимиозит (дерматомиозит), болезнь Бехтерева (анкилозирующий спондилоартрит). Среди системных васкулитов наиболее часто встречаются нодулярный полиартериит (узелковый периартериит), неспецифический аортоартериит Такаясу, височный артериит Хортона, гранулематоз Вегенера. Ведущим механизмом развития патологической аутоиммунизации при этих заболеваниях является недостаточная функция клеток-супрессоров.
3. В основе большинства аутоиммунных болезней промежуточного типа лежат аллергические реакции аутоантител (аллергические реакции V типа).
Псевдоаутоиммунные болезни
От аутоиммуных заболеваний необходимо отличать псевдоаутоиммунные болезни (болезни с аутоиммунными нарушениями), при которых формирующийся аутоиммунный ответ не является ведущим фактором в патогенезе. Типичное псевдоаутоиммунное заболевание — ревматизм, тканевые повреждения при котором обусловлены прежде всего действием факторов агрессии Streptococcus pyogenes, а патологическая аутоиммунизация вносит менее существенный вклад в развитие болезни.
Иммунодефицитные состояния
Иммунодефици́тные состоя́ния (иммунодефици́ты) — патологические изменения, характеризующиеся недостаточностью иммунного ответа. Они являются фоном для развития (1) инфекционных процессов (оппортунистических инфекций), (2) злокачественных опухолей, а также (3) некоторых аутоиммунных заболеваний (при недостаточности гуморального и сохранности клеточного звена иммунитета).
Первичные иммунодефициты
Первичные иммунодефициты — наследственные и приобретённые в пренатальном периоде иммунодефицитные состояния. К ним относятся (1) первичные дефициты клеточного иммунитета (например, синдром Ди Джо́рджи — гипоплазия тимуса), (2) первичные дефициты гуморального иммунитета (например, синдром Бру́тона — полное отсутствие иммуноглобулинов), (3) первичные комбинированные дефициты, при которых развивается недостаточность как клеточного, так и гуморального иммунитета (например, атаксия-телеангиэктазия Луи-Бар), (4) первичные дефекты фагоцитов и (5) недостаточность белков комплемента.
Вторичные иммунодефициты
Втори́чные иммунодефици́ты — иммунодефицитные состояния, развивающиеся в постнатальном онтогенезе.
К ним относятся следующие формы иммунодефицитов:
1. Иммунодефицит при хроническом дистрессе. Длительный интенсивный стресс (хронический дистресс-синдром) сопровождается увеличением содержания в организме глюкокортикоидных гормонов, которые в высоких концентрациях оказывают иммунодепрессивный эффект.
2. Нозоге́нные иммунодефициты. Нозогенными (от греч. nosos — болезнь) называются иммунодефициты, развитие которых связано с каким-либо тяжёлым заболеванием. Чаще всего выраженный вторичный иммунодефицит формируется при вирусных инфекциях (например, при ВИЧ-инфекции или кори), а также при злокачественных новообразованиях.
3. Ятроге́нные иммунодефициты. Ятрогенные (обусловленные лечением) иммунодефициты, как правило, возникают при назначении цитостатиков и длительном применении препаратов глюкокортикоидных гормонов (лекарственный иммунодефицит). В некоторых случаях иммунодефицит может быть обусловлен лучевой терапией (радиогенный иммунодефицит), когда облучению подвергаются значительные объёмы тканей. К ятрогенным иммунодефицитам относится постоперационный иммунодефицит у больных, перенёсших операции с массивной хирургической травмой тканей, и оперированных в условиях общего наркоза. Пик постоперационного иммунодефицита приходится на 2—3 сутки после хирургического вмешательства. Постоперационным иммунодефицитом объясняется повышение частоты оппортунистических и госпитальных инфекций в этом периоде, прежде всего постоперационных пневмоний.
4. Возрастной иммунодефицит. Возрастной иммунодефицит обусловлен старением организма.
5. Алимента́рные иммунодефициты. К алиментарным иммунодефицитам приводят недостаточность белка, витаминов и микроэлементов в пище. Из микроэлементов наиболее важное значение для нормальной функции иммунной системы имеют цинк и кобальт.
6. Физиологический гравидарный иммунодефицит. При беременности под влиянием плацентарного гормона хорионического гонадотропина возникает физиологическое иммунодефицитное состояние. Хорионический гонадотропин начинает секретироваться клетками трофобласта уже с 8-го дня беременности. Иммунодефицит при беременности необходим для нормального вынашивания плода, поскольку плодное яйцо является чужеродным для материнского организма. При патологическом течении беременности формируется иммунный ответ на антигены плодного яйца и развивается реакция отторжения. Острое отторжение проявляется самопроизвольным выкидышем (при сроке гестации до 28 недель) или преждевременными родами (при сроке гестации более 28 недель). Пролонгированное отторжение плодного яйца характеризуется иммунокомплексными повреждениями внутренних органов, прежде всего почек, и носит название гестоза, или позднего токсикоза беременности.