изоферменты это множественные формы ферментов которые
3. Множественные формы ферментов.
Изоферменты, или изоэнзимы,– это множественные формы фермента, катализирующие одну и ту же реакцию, но отличающиеся друг от друга по физическим и химическим свойствам, в частности по сродству к субстрату, максимальной скорости катализируемой реакции (активности), электрофоретической подвижности или регуляторным свойствам.
В живой природе имеются ферменты, молекулы которых состоят из двух и более субъединиц, обладающих одинаковой или разной первичной, вторичной или третичной структурой. Субъединицы нередко называют протомерами, а объединенную олигомерную молекулу – мультимером
Органные — ферменты гликолиза в печени и мышцах.
Клеточные — малатдегидрогеназа цитоплазматическая и митохондриальная (ферменты разные, но катализируют одну и ту же реакцию).
Гибридные — ферменты с четвертичной структурой, образуются в результате нековалентного связывания отдельных субъединиц (лактатдегидрогеназа — 4 субъединицы 2 типов).
Мутантные — образуются в результате единичной мутации гена.
Аллоферменты — кодируются различными аллелями одного и того же гена.
Термин «множественные формы фермента» применим к белкам, катализирующим одну и ту же реакцию и встречающимся в природе в организмах одного вида. Термин «изофермент» применим только к тем множественным формам ферментов, которые появляются вследствие генетически обусловленных различий в первичной структуре белка (но не к формам, образовавшимся в результате модификации одной первичной последовательности).
Собственно множественные формы (истинные) — это ферменты, синтез которых кодируется одним и тем же аллелем одного и того же гена, у них одинаковая первичная структура и свойства, но после синтеза на рибосомах они подвергаются модификации и становятся разными, не смотря на то, что и катализируют одну и ту же реакцию.
4. Тип катализируемой химической реакции в сочетании с названием субстрата (субстратов) служит основой для систематического наименования ферментов. Согласно международной классификации, ферменты делят на шесть главных классов по механизму действия, в каждом из которых несколько подклассов: 1) оксидоредуктазы; 2) трансферазы; 3) гидролазы; 4) лиазы; 5) изомеразы; 6) лигазы (синтетазы).
Оксидоредуктазы. К классу оксидоредуктаз относят ферменты, катализирующие с участием двухсубстратов окислительно-восстановительные реакции, лежащие в основе биологического окисления. Систематические названия их составляют по форме «донор: акцептор оксидоредуктаза». Например, лактат: НАД + оксидоредуктаза для лактатдегидрогеназы (ЛДГ).
Различают следующие основные оксидоредуктазы: аэробные дегидрогеназы или оксидазы, катализирующие перенос протонов (электронов) непосредственно на кислород; анаэробные дегидрогеназы, ускоряющие перенос протонов (электронов) на промежуточный субстрат, но не на кислород; цитохромы, катализирующие перенос только электронов. К этому классу относят также гемсодержащие ферменты каталазу и пероксидазу, катализирующие реакции с участием перекиси водорода.
Трансферазы. К классу трансфераз относят ферменты, катализирующие реакции межмолекулярного переноса различных атомов, групп атомов и радикалов. Наименование их составляется по форме «донор: транспортируемая группа – трансфераза».
Различают трансферазы, катализирующие перенос одноуглеродных остатков, ацильных, гликозильных, альдегидных или кетонных, нуклеотидных остатков, азотистых групп, остатков фосфорной и серной кислот и др. Например: метил- и формилтрансферазы, ацетилтрансферазы, амино-трансферазы, фосфотрансферазы и др.
Гидролазы. В класс гидролаз входит большая группа ферментов, катализирующих расщепление внутримолекулярных связей органических веществ при участии молекулы воды. Наименование их составляют по форме «субстрат-гидролаза». К ним относятся: зстеразы – ферменты, катализирующие реакции гидролиза и синтеза сложных эфиров; гликозидазы, ускоряющие разрыв гликозидных связей;фосфатазы и пептидгидролазы, катализирующие гидролиз фосфоангидридных и пептидных связей; амидазы, ускоряющие разрыв амидных связей, отличных от пептидных, и др.
Лиазы. К классу лиаз относят ферменты, катализирующие разрыв химических связей без участия воды. Эти реакции сопровождаются образованием двойной связи или присоединением групп к месту разрыва двойной связи. Ферменты обозначают термином «субстрат-лиазы». Например, фумарат-гидратаза (систематическое название «L-малат-гидролаза») катализирует обратимое отщепление молекулы воды от яблочной кислоты с образованием фумаровой кислоты. В эту же группу входят декарбоксилазы (карбоксилиазы), амидин-лиазы и др.
Изомеразы. К классу изомераз относят ферменты, катализирующие изомерные превращения. Систематическое название их составляют с учетом типа реакции: «субстрат – цис-транс-изомераза». Если изомеризация включает внутримолекулярный перенос группы, фермент получает название «мутаза».
К этому же классу относят рацемазы и эпимеразы, действующие на амино- и оксикислоты, углеводы и их производные; внутримолекулярные оксидоредуктазы, катализирующие взаимопревращения альдоз и кетоз; внутримолекулярные трансферазы, переносящие ацильные, фосфорильные и другие группы, и т.д.
Лигазы (синтетазы). К классу лигаз относят ферменты, катализирующие синтез органических веществ из двух исходных молекул с использованием энергии распада АТФ (или другого нуклеозидтрифосфата). Систематическое название их составляют по форме «X : Y лигаза», где X и Y обозначают исходные вещества. В качестве примера можно назвать L-глутамат: аммиак лигазу (рекомендуемое сокращенное название «глутаминсинтета-за»), при участии которой из глутаминовой кислоты и аммиака в присутствии АТФ синтезируется глутамин.
5. ОСНОВНЫЕ СВОЙСТВА ФЕРМЕНТОВ
К ферментам применимы три основных критерия, характерных и для неорганических катализаторов. В частности, они остаются неизмененными после реакции, т.е. освобождаясь, могут вновь реагировать с новыми молекулами субстрата (хотя нельзя исключить побочных влияний условий среды на активность фермента). Ферменты способны оказывать действие в ничтожно малых концентрациях (например, одна молекула фермента реннина, содержащегося в слизистой оболочке желудка теленка, створаживает около 10 6 молекул казеиногена молока за 10 мин при температуре 37°С).
Наличие либо отсутствие фермента или любого другого катализатора не оказывает влияния на величину константы равновесия и свободной энергии (ΔG). Катализаторы лишь повышают скорость, с которой система приближается к термодинамическому равновесию, не сдвигая точки равновесия. Химические реакции с высокой константой равновесия и отрицательной величиной ΔG принято называть экзергоническими. Реакции с низкой константой равновесияи соответственно положительной величиной ΔG (они обычно не протекают спонтанно) называются эндерго-ническими. Для начала и завершения этих реакций необходим приток энергии извне. В живых системах экзергонические процессы обычно сопряжены с эндергоническими реакциями, обеспечивая последние необходимым количеством энергии.
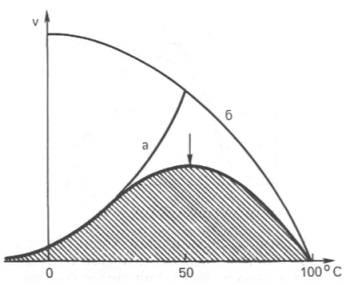
Рис. 4.16. Зависимость скорости катализируемой ферментом реакции от температуры.
Ферменты, являясь белками, обладают рядом характерных для этого класса органических соединений свойств, отличающихся от свойств неорганических катализаторов.
Термолабильность ферментов. Скорость химических реакций зависит от температуры, поэтому катализируемые ферментами реакции также чувствительны к изменениям температуры. Установлено, что скорость большинства биохимических реакций повышается в 2 раза при повышении температуры на 10°С и, наоборот, снижается в 2 раза при понижении температуры на 10°С. Этот показатель получил название температурного коэффициента. Однако вследствие белковой природы фермента тепловая денатурация при повышении температуры будет снижать эффективную концентрацию фермента с соответствующим снижением скорости реакции. Так, при температуре, не превышающей 45–50°С, скорость реакции увеличивается согласно теории химической кинетики. При температуре выше 50°С на скорость реакциибольшое влияние начинает оказывать тепловая денатурация белка-фермента, приводящая к полному прекращению ферментативного процесса
Зависимость активности ферментов от рН среды. Ферменты обычно наиболее активны в пределах узкой зоны концентрации водородных ионов, соответствующей для животных тканей в основном выработанным в процессе эволюции физиологическим значениям рН среды 6,0–8,0. При графическом изображении на кривой колоколообразной формы имеется определенная точка, в которой ферментпроявляет максимальную активность; эту точку называют оптимумом рН среды для действия данногофермента (рис. 4.17). При определении зависимости активности фермента от концентрации водородныхионов реакцию проводят при разных значениях рН среды, обычно при оптимальной температуре и наличии достаточно высоких (насыщающих) концентраций субстрата. В табл. 4.3 приводятся оптимальные значения рН среды для ряда ферментов.
Из данных табл. 4.3 видно, что рН-оптимум действия ферментов лежит в пределах физиологических значений. Исключение составляют пепсин, рН-оптимум которого 2,0 (при рН 6,0 он не активен и не стабилен). Объясняется это, во-первых, структурной организацией молекулы фермента и, во-вторых, тем, что пепсин является компонентом желудочного сока, содержащего свободную соляную кислоту, которая создает оптимальную кислую среду для действия этого фермента. С другой стороны, рН-оптимум аргиназы лежит в сильнощелочной зоне (около 10,0); такой среды нет в клетках печени, следовательно, in vivo аргиназа функционирует, по-видимому, не в своей оптимальной зоне рН среды.
ИЗОФЕРМЕНТЫ
Изоферменты, или изоэнзимы,– это множественные формы фермента, катализирующие одну и ту же реакцию, но отличающиеся друг от друга по физическим и химическим свойствам, в частности по сродству к субстрату, максимальной скорости катализируемой реакции (активности), электрофоретической подвижности или регуляторным свойствам.
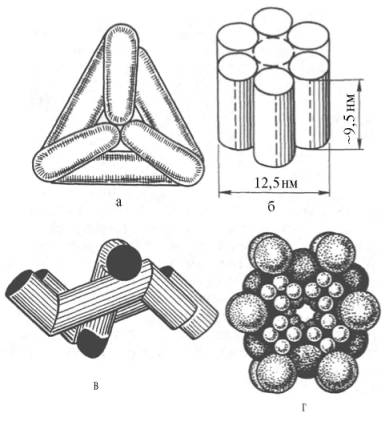
Рис. 4.5. Модели строения некоторых олигомерных ферментов.
В живой природе имеются ферменты, молекулы которых состоят из двух и более субъединиц, обладающих одинаковой или разной первичной, вторичной или третичной структурой. Субъединицы нередко называют протомерами, а объединенную олигомерную молекулу – мультимером (рис. 4.5; см. главу 1).
Считают, что процесс олигомеризации придает субъединицам белков повышенную стабильность и устойчивость по отношению к действию денатурирующих агентов, включая нагревание, влияние протеиназ и др. Однако на нынешнем этапе знаний нельзя ответить однозначно на вопрос о существенности четвертичной структуры для каталитической активности ферментов, поскольку пока отсутствуют методы, позволяющие в «мягких» условиях разрушить только лишь четвертичную структуру. Применяемые обычно методы жесткой обработки (экстремальные значения рН, высокие концентрации гуанидинхлорида или мочевины) приводят к разрушению не только четвертичной структуры, но и вторичной и третичной структур стабильного олигомерного фермента, протомеры которого оказываются денатурированными и, как следствие этого, лишенными биологической активности.
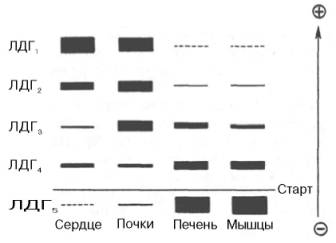
Следует указать на отсутствие ковалентных, главновалентных связей между субъединицами. Связи в основном являются нековалентными, поэтому такие ферменты довольно легко диссоциируют на протомеры. Удивительной особенностью таких ферментов является зависимость активности всего комплекса от способа упаковки между собой отдельных субъединиц. Если генетически различимые субъединицы могут существовать более чем в одной форме, то соответственно и фермент, образованный из двух или нескольких типов субъединиц, сочетающихся в разных количественных пропорциях, может существовать в нескольких сходных, но не одинаковых формах. Подобные разновидности фермента получили название изоферментов (изоэнзимов или, реже, изозимов). В частности, если фермент состоит из 4 субъединиц двух разных типов – Н и М (сердечный и мышечный), то активный фермент может представлять собой одну из следующих комбинаций: НННН, НННМ, ННММ, НМММ, ММММ, или Н4, Н3М, Н2М2, НМ3, М4, соответствующую изоферментам ЛДГ1, ЛДГ2, ЛДГ3, ЛДГ4 и ЛДГ5. При этом синтез Н- и М-типов осуществляется различными генами и в разных органах экспрессируется по-разному.
В одних случаях субъединицы имеют почти идентичную структуру и каждая содержит каталитически активный участок (например, β-галакто-зидаза, состоящая из 4 субъединиц). В других случаях субъединицы оказываются неидентичными. Примером последних может служить трипто-фансинтаза, состоящая из 2 субъединиц, каждая из которых наделена собственной (но не основной) энзиматической активностью, однако, только будучи объединенными в макромолекулярную структуру, обе субъединицы проявляют триптофансинтазную активность.
Термин «множественные формы фермента» применим к белкам, катализирующим одну и ту же реакцию и встречающимся в природе в организмах одного вида. Термин «изофермент» применим только к тем множественным формам ферментов, которые появляются вследствие генетически обусловленных различий в первичной структуре белка (но не к формам, образовавшимся в результате модификации одной первичной последовательности).
Рис. 4.6. Распределение и относительные количества изоферментов ЛДГ в различных органах. Экстракты нанесены на линию, отмеченную надписью «Старт». При заданных условиях опыта (рН) 4 изофермента ЛДГ движутся к аноду, а один (ЛДГ5) – к катоду. Красным цветом выделены основные изоформы ЛДГ для данного органа.
ИЗОФЕРМЕ́НТЫ
Том 11. Москва, 2008, стр. 35
Скопировать библиографическую ссылку:
ИЗОФЕРМЕ́НТЫ (от изо … и ферменты ) (изоэнзимы, изозимы), множественные формы ферментов, катализирующие идентичные реакции, но обладающие генетически детерминированными отличиями в первичной структуре пептидной цепи; они могут различаться также функциональными свойствами и пространственной структурой. Множественные формы ферментов, которые образуются в результате посттрансляционных модификаций или изменяют свою конформацию и свойства при взаимодействии с разл. соединениями (т. н. конформер ы), к И. не относятся. Соотношение разных форм И. может отличаться в разл. органах и тканях одного и того же организма, отражая специфич. особенности протекающих в них процессов обмена веществ. Напр., при спермиогенезе исчезает ряд гликолитич. ферментов, характерных для соматич. клеток; при этом начинают экспрессироваться гены гликолитических И., специфичных только для сперматозоидов. На соотношение И. влияет физиологич. состояние организма и происходящие в нём патологич. процессы, что позволяет использовать анализ изоферментных спектров в диагностич. целях (напр., появление в крови специфич. И. лактатдегидрогеназы и креатинкиназы при инфаркте миокарда или И. аминотрансфераз и некоторых др. ферментов при поражениях печени). Ряд И. используется для диагностики генетич. аномалий. И., синтез которых контролируется кодоминантными аллелями одного гена, называют аллоэнзимами (их структурные и функциональные отличия минимальны). Для выявления И. используют разл. виды хроматографии и электрофореза, а также иммунохимич. методы.
ИЗОФЕРМЕНТЫ
ИЗОФЕРМЕНТЫ (син.: множественные формы ферментов, изозимы) — молекулярные формы (разновидности) определенного фермента, отличающиеся только по физико-химическим свойствам; определение изоферментного спектра различных ферментов в сыворотке крови является одним из важных методов клин, энзимодиагностики. Изоферменты обнаружены в тканях человека, животных, растений и микроорганизмов. Известно св. 50 ферментов, представленных в виде Изоферментов в различных органах и тканях человека, животных и растений.
Изоферменты могут отличаться друг от друга по четвертичной структуре, т. е. по характеру и количеству субъединиц, входящих в состав их молекул, по электрофоретической подвижности, адсорбционным свойствам, сродству к субстрату, оптимальному значению pH, субклеточной локализации, специфичности в отношении коферментов (см.) и т. д. Так, напр., большинство органов и тканей человека и животных содержит пять Изоферментов лактатдегидрогеназы (ЛДГ), каждый из которых представляет собой различные комбинации из четырех субъединиц двух типов с мол. весом 34 500, условно обозначенных «Н» и «М» (см. Лактатдегидрогеназа). Оба типа субъединиц различаются по аминокислотному составу, последовательности остатков аминокислот в молекуле, иммунохим. и электрофоретическим свойствам. Синтез субъединиц контролируется двумя различными генами. Малатдегидрогеназа (МДГ) представлена в различных тканях человека и животных двумя И., один из которых локализован в митохондриях, а другой — в цитоплазме. Оба эти И. различаются по специфичности в отношении НАД и чувствительности к ингибиторам (напр., оксалату). И. изоцитратдегидрогеназы (ИЦДГ; КФ 1.1.1. 41 и 1.1.1.42) различаются по специфичности к коферментам (НАД и НАДФ), а также по субклеточной локализации: НАД-ИЦДГ локализована в митохондриях, а НАДФ-ИЦДГ и в митохондриях, и в цитоплазме. Митохондриальная и цитоплазматическая НАДФ-ИЦДГ различаются между собой по каталитическим, электрофоретическим и иммунохим. свойствам.
Для идентификации и разделения И. используют различные физ.-хим. методы исследования: различные виды электрофореза (см.), адсорбционную и ионообменную хроматографию (см.), гель-фильтрацию (см.) и др. Наиболее широкое распространение как самый доступный получил метод электрофореза в полиакриламидном геле (диск-электрофорез). Различия в электрофоретических свойствах являются основой для классификации многих И. Для обозначения И. приводится сокращенное название фермента с соответствующим подстрочным порядковым номером, который характеризует электрофоретическую подвижность И. при определенном значении pH. Напр., И. лактатдегидрогеназы обозначаются как ЛДГ1, ЛДГ2, ЛДГ3 и т. д.
Биол, значение наличия множественных форм ферментов еще не ясно. Предполагают, что И. играют определенную роль в регуляции метаболических процессов в клетке. Возможно, что И. обеспечивают приспособляемость организма к изменениям окружающей среды и обусловливают специфичность обмена, характерную именно для данной ткани. Поэтому многие ферменты, занимающие ключевые позиции в обмене веществ, имеют И. (ЛДГ, МДГ, ферменты, катализирующие окислительное фосфорилирование, различные аминотрансферазы). Возможно, что различные И. одного и того же фермента специфически катализируют прямую или обратную реакции определенной ферментативной реакции (см. Лактатдегидрогеназа). О важной роли И. в тонкой регуляции метаболических процессов свидетельствует изменение их спектра под влиянием ряда воздействий и физиол, факторов (денервации, различных гормонов, охлаждения, гипоксии и др.). Отмечено изменение в характере распределения различных И. в тканях человека и животных в эмбриогенезе. Однако для изученных ферментов пока не найдено специфических эмбриональных форм И.
Спектр И. в количественном и качественном отношении в различных тканях человека и животных различен и часто строго специфичен. Это имеет большое диагностическое значение. Поскольку биосинтез отдельных И. и их субъединиц контролируется различными генами, предполагают, что видоизменение гена влечет за собой появление атипичных И. в тканях и крови. Т. о., возникает возможность использования определения спектров И. для диагностики генетических аномалий. Ряд патологических процессов, особенно дегенеративно-деструктивного характера, связан с изменением проницаемости клеточных мембран, что является причиной изменения спектра И. в сыворотке крови больного. Поэтому определение И. в крови и тканях человека находит все более широкое применение в клинике. Для решения некоторых вопросов диагностики, патогенеза и терапии ряда заболеваний определение изоферментных спектров имеет существенное преимущество по сравнению с определением общей активности того или иного фермента. Наибольшее диагностическое значение имеет определение изофермент-ного спектра ЛДГ, который меняется при инфаркте миокарда (резко повышается активность ЛДГ1 и ЛДГ2). Изменения спектра И. ЛДГ в сыворотке крови сохраняются дольше, чем изменения суммарной активности фермента, и могут обнаруживаться тогда, когда общая активность ЛДГ возвращается к норме. Отклонения спектра И. ЛДГ от нормы отмечены при заболеваниях гепатобилиарной системы, при мышечных дистрофиях, опухолевых заболеваниях, остром лейкозе, патол, процессах в легких (острые очаговые и крупозная пневмонии, обострение хронической пневмонии и др.).
Диагностическим тестом служат также изменения спектров И. и других ферментов, напр, значительное увеличение катодных фракций МДГ (в особенности митохондриальной фракции) в сыворотке крови больных циррозом печени но сравнению с сывороткой крови больных хроническим гепатитом. Определение спектра И. и общей активности МДГ в крови находит широкое применение для диагностики и оценки тяжести асфиксии у новорожденных. Изменения активности И. кислой фосфатазы отмечаются при болезни Гоше (см. Гоше болезнь), раке предстательной железы и множественной миеломе. Для диагностики ряда заболеваний печени используют определение спектра И. щелочной фосфатазы (см. Фосфатазы).
Определение И. аминотрансфераз (см.) также имеет диагностическую ценность. В печени, почках, сердечной мышце человека обнаруживаются два И. аспартат-аминотрансферазы (КФ 2.6.1.1; АсАТ). Один из них локализуется в митохондриях, другой — в цитоплазме клеток. Ок. 79% всей активности АсАТ приходится на долю митохондриального И. и лишь 21% на долю цитоплазматического. При тяжелом течении болезни Боткина в сыворотке крови обнаруживается два И. АсАТ, тогда как в норме и при легком течении заболевания — только один.
При повреждениях скелетной мускулатуры, а также при инфаркте миокарда в сыворотке крови повышается активность креатинкиназы (см.), а также изменяется спектр ее И.
Библиография: Генетика изоферментов, под ред. Д. К. Беляева, М., 1977, библиогр.; Иванов И. И., Коровкин Б. Ф. и Маркелов И. М. Введение в клиническую энзимологии), Л., 1974, библиогр.; Комаров Ф. И., Коровкин Б. Ф. и Меньшиков В. В. Биохимические исследования в клинике, Л., 1976; Ленинджер А. Биохимия, пер. с англ., с. 217 и др., М., 1976; Проблемы медицинской химии, под ред. В. С. Шапота и Э. Г. Ларского, с. 5, М., 1973; Уилкинсон Д. Изоферменты, пер. с англ., М., 1968; Успехи биологической химии, под ред. В. Л. Кретовича и др., т. 9, с. 55, М., 1972; Enzyme nomenclature, Amsterdam, 1965; Карlan N. О. Symposium on multiple forms of enzymes and control mechanisms, Bact. Rev., v. 27, p. 155, 1963; Latner A. L. Isoenzymes, Advanc. clin. Chem., v. 9, p. 69, 1967.
Множественные формы ферментов
Это ферменты, которые катализируют одинаковые реакции, но отличаются по физико-химическим свойствам. По происхождению можно выделить две группы таких ферментов: а) изоферменты — это ферменты, в которых различия генетически детерминированы; б) множественные формы, образующиеся в результате модификации молекул фермента после его синтеза.
Классификация изоферментов: а) по органной локализации — ферменты гликолиза в мышцах и печени; б) по внутриклеточной локализации — малатдегидрогеназа митохондриальная и цитоплазматическая; в) изоферменты, образующиеся в результате мутаций структурных генов; г) гибридные формы, образующиеся путем нековалентного связывания нескольких одинаковых или разных полипептидных цепей. Так, ЛДГ состоит из 4-х цепей 2-х видов — H и M. Из них возможно образование пяти изоферментов — Н4, Н3М, Н2М2, М3Н и М4. Н4 и Н3М преобладают в миокарде, а М4 — в скелетной мускулатуре и печени.
Медицинские аспекты энзимологии
Ферменты плазмы крови
В крови могут присутствовать следующие ферменты:
Секреторные (плазмоспецифические) — синтезируются в печени и в норме постоянно выделяются в кровь, где выполняют свои функции (например, ферменты свертывания крови).
Экскреторные — образуются органами пищеварительной системы (поджелудочной железой, слизистой оболочкой кишечника, печенью) и в норме выделяются с желчью (например, щелочная фосфатаза). При патологических состояниях могут появляться в крови.
Индикаторные (клеточные) — попадают в кровь из клеток органов и тканей при их некрозе (гибели клеток), повышении проницаемости клеточных мембран или усилении пролиферации клеток, продуцирующих фермент. Таким образом, определение активности ряда ферментов в крови имеет диагностическую ценность.
Выход ферментов из клеток в кровь зависит от размера молекул фермента: чем меньше размер, тем легче ферменты попадают в кровь. На уровень ферментов в крови влияет также продолжительность их жизни (скорость обновления). Дольше всех «живут» ферменты костной ткани, мышц, ЦНС, меньше — ферменты печени, жировой ткани, клеток крови.
Области применения ферментов в медицине
Для скрининг-диагностики — выборочные тесты при подозрении на какое-то заболевание.
Для диагностики заболеваний (креатинкиназа и ее изофермент МВ — для диагностики инфаркта миокарда; аланинаминотрансфераза — для диагностики заболеваний печени) и оценки глубины повреждения ткани (ферменты цитоплазмы и митохондрий).
Для дифференциальной диагностики (при инфаркте миокарда наблюдается некроз кардиомиоцитов и выход характерных (изо)ферментов в кровь; приступ стенокардии не сопровождается указанными явлениями).
Для лечения заболеваний:
а) заместительная терапия (при заболеваниях ЖКТ используют пепсин, панкреатин, фестал, панзинорм, мезим-форте);
б) для лечения заболеваний и устранения патологических процессов используют ферменты с целью:
разрушения омертвевшей ткани (при лечении ожогов, язв, абсцессов — трипсин, химотрипсин, нуклеаза);
разжижения вязких секретов при лечении бронхитов (трипсин, химотрипсин, бронхолитин);
для сглаживания послеоперационных рубцов (протеазы, лидаза, нуклеазы);
для разрушения тромбов (стрептокиназа, фибринолизин).
Для пролонгированного действия используют иммобилизованные ферменты — ферменты, связанные с твердым носителем или спрятанные в полимерную капсулу. Такие энзимы обладают рядом преимуществ: высокой специфичностью действия, простотой в обращении, возможностью многократного использования. Они применяются, в частности, для лечения тромбозов и ожогов, в лабораторной практике как реагенты для анализа, в промышленности, в том числе фармацевтической, — для синтеза аминокислот, спиртов, витаминов, гормонов, лекарственных препаратов.
Использование ферментов в стоматологии: для лечения кариеса, пульпита, периодонтита, гингивита, афтозного стоматита, язв полости рта.
Ферменты могут использоваться как самостоятельно (таблетки, порошки, аэрозоли, растворы), так и в иммобилизованной форме (гели, мази, пасты).