Как использовать чистотел
Как использовать чистотел
Чистотел
Инструкция
Торговое название
Международное непатентованное название
Лекарственная форма
Состав
Одна пачка содержит
активное вещество – чистотела трава 30 г
Описание
Фармакотерапевтическая группа
Прочие препараты для лечения заболеваний кожи
Фармакологические свойства
Показания к применению
— для лечения различных кожных заболеваний (труднозаживающие раны, аллергия, зуд, сыпи, псориаз, гнойничковые поражения кожи у юношей, чесотка, мокнущие экземы)
— для удаления бородавок, мозолей, темных пятен на коже
Способ применения и дозы
Для наружного применения.
4 столовые ложки травы помещают в стеклянную или эмалированную посуду, заливают 200 мл (1 стакан) горячей кипяченой воды, закрывают крышкой и настаивают на кипящей водяной бане в течение 15 мин. Охлаждают при комнатной температуре 45 мин, процеживают через двойной слой марли, оставшееся сырье отжимают. Объем полученного настоя доводят кипяченой водой до 200 мл. Применяют наружно для ванн (1-2 стакана настоя на ванну).
Курс лечения определяет лечащий врач.
Побочные действия
Противопоказания
— бронхиальная астма
— стенокардия, декомпенсация сердечной деятельности
— повышенная чувствительность к препарату
— детский возраст до 12 лет
— эпилепсия, неврологические заболевания
Лекарственные взаимодействия
Особые указания
Применяется по назначению и под наблюдением врача.
Чистотел относится к ядовитым растениям. Длительное и неправильное применение чистотела может привести к отравлению. Из за выраженной способности вызывает судороги, чистотел не следует применять больным эпилепсией и другими неврологическими заболеваниями.
Беременность и период лактации
Не применяется при беременности и в период лактации
Особенности влияния препарата на способность управлять автотранспортом или потенциально опасными механизмами
Передозировка
Симптомы: жажда, тошнота, рвота, паралич дыхания.
Лечение: промывание желудка (при приема внутрь), симптоматическая терапия
Форма выпуска и упаковка
По 30 г препарата в пакеты полиэтиленовые или из полимерного и комбинированного материала или полипропиленовые вложенные в пачку картонную, на которую наносят краткую аннотацию по медицинскому применению на государственном и русском языках.
Пачку покрывают пленкой полиэтиленовой или полипропиленовой, затем укладывают в групповую транспортную тару из картона коробочного вместе с соответствующим количеством инструкций по медицинскому применению на государственном и русском языках.
Условия хранения
Хранить в сухом месте при температуре не выше 25 °C.
Хранить в недоступном для детей месте!
Срок хранения
Не использовать по истечении срока годности
Условия отпуска из аптек
Производитель
Владелец регистрационного удостоверения
Адрес организации, принимающей на территории Республики Казахстан претензии от потребителей по качеству продукции (товара)
г. Шымкент, мкр. Химфармзавода, 2/1,
тел./факс +7 (7252) 50-34-50, 50-37-06, 50-35-13,
Чистотела трава : инструкция по применению
Инструкция
кусочки листьев, стеблей, цветков и плодов различной формы, проходящие сквозь сито (5600). Цвет серовато-зеленый с желтыми вкраплениями. Запах своеобразный.
Состав
Фармакотерапевтическая группа
Прочие средства, применяемые в дерматологии.
Настой чистотела травы оказывает местное противовоспалительное действие.
Показания к применению
Наружно: в составе комплексной терапии заболеваний кожи (дерматит, псориаз, экзема).
Применение по указанным назначениям основывается только на опыте продолжительного применения.
Способ применения и дозы
Около 20 г (6 столовых ложек) сырья помещают в эмалированную или другую подходящую посуду, заливают водой комнатной температуры 200 мл (1 стакан), закрывают крышкой, нагревают в кипящей воде (водяной бане) 15 мин. Охлаждают при комнатной температуре 45 мин, процеживают. Оставшееся сырье отжимают. Объем полученного настоя доводят кипяченой водой до 200 мл.
Наружно применяют для ванн (1-2 стакана настоя на ванну), в виде примочек (без разбавления).
Перед применением настой рекомендуется взбалтывать.
Длительность курса лечения определяется врачом с учетом особенностей заболевания, достигнутого эффекта и переносимости лекарственного средства.
Применение во время беременности и кормления грудью
Не следует применять во время беременности и кормления грудью.
Применение у детей
Применение у детей до 18 лет не рекомендовано в связи с отсутствием достаточных данных.
Влияние на способность управления автомобилем и работу с движущимися механизмами
Исследования не проводились.
Побочное действие
Возможны аллергические реакции (в том числе гиперемия, зуд и высыпания на коже).
В случае возникновения побочных реакций, в том числе не указанных в данной инструкции, следует прекратить применение лекарственного средства и обратиться к врачу.
Противопоказания
Повышенная чувствительность к биологически активным веществам препарата, беременность, период лактации, детский возраст до 18 лет.
Передозировка
Информация о случаях передозировки при наружном применении отсутствует. При приеме внутрь возможно развитие тошноты, рвоты, болей в животе, диареи, желтухи, нарушений со стороны печени (повышение уровней в крови билирубина и печеночных ферментов, включая случаи развития токсического гепатита и печеночной недостаточности). При возникновении указанных симптомов необходимо обратиться к врачу. Лечение симптоматическое.
Меры предосторожности
Перед применением проконсультируйтесь с врачом. Лечение проводят под контролем врача. Если во время лечения симптомы сохраняются или происходит ухудшение состояния, необходимо прекратить применение лекарственного средства и обратиться к врачу.
Взаимодействие с другими лекарственными средствами
Информация отсутствует. В случае одновременного применения других лекарственных средств необходимо проконсультироваться с врачом.
Условия и сроки хранения
Как использовать чистотел
Рак желудка остается одним из самых распространенных заболеваний в мире. Ежегодно регистрируется почти 800 тыс. новых случаев и 628 тыс. смертей от этого заболевания. В числе стран-«лидеров» находится и Россия. Заболеваемость данным видом новообразований значительно возрастает в возрасте после 50 лет, т.е. у лиц пожилого и старческого возраста. Вероятность возникновения опухоли у мужчин в 2 раза выше, чем у женщин [1–3, 5].
Лечение рака желудка на сегодняшний день основывается на комплексном подходе. Наряду с хирургической тактикой и лучевой терапией используется консервативное ведение больных с предраковыми заболеваниями желудка и раком желудка. При этом социальное положение людей пожилого возраста не позволяет приобретать дорогие препараты, а также использовать дорогостоящие эндоскопические операции.
Цель работы
Разработать эффективный и безопасный фитотерапевтический метод лечения больных пожилого и старческого возраста, способствующий регрессии предраковых и ранних стадий злокачественных образований желудка; на примере состояния липидного метаболизма доказать отсутствие отрицательного его влияния на организм в целом.
Материалы и методы исследования
Клинико-лабораторные исследования проведены у 58 больных возрастом от 60 до 89 лет с различными предраковыми заболеваниями желудка. Больные были разделены на 2 группы. Первая группа (группа сравнения) – больные (n=16), которым после обнаружения изменений в слизистой оболочке желудка проводилась симптоматическая терапия (они отказывались от какого-либо другого лечения). Пациентам второй группы (основная группа) (n=42) назначалось комбинированное терапевтическое лечение. Средний возраст обследуемых в первой группе составлял 62,3±5,4 лет, во второй – 63,7±4,9 года. Полипы желудка в первой группе больных диагностированы у 7 мужчин (из них аденоматозные – у 2, гиперплазиогенные – у 5 больных) и 3 женщин (из них аденоматозные – у 1, гиперплазиогенные – у 2 больных), дисплазии III степени – у 4 больных (1 мужчина, 3 женщины), доброкачественные подслизистые опухоли – у 2 пациентов (1 мужчина, 1 женщина). Полипы желудка во второй группе больных диагностированы у 11 мужчин (из них аденоматозные – у 3, гиперплазиогенные – у 8 больных) и 22 женщин (из них аденоматозные – у 13, гиперплазиогенные – у 9 больных), дисплазии III степени – у 5 больных (3 мужчины, 2 женщины), ранние раки – у 4 больных (4 женщины).
При подтверждении предракового заболевания желудка (метаплазии, дисплазии) больным предлагалось комбинированное лечение в несколько этапов.
I этап направлен на ликвидацию раздражающего фактора, эрадикацию геликобактер пилори, состоял из двух антибактериальных препаратов: кларитромицина 500 мг 2 раза в день и метронидазола 250 мг 3 раза в день с добавлением препарата висмута – викаира по 1 т. 3 раза в день (предпочтение викаиру отдавалось из-за дешевизны: он дешевле Де-Нола в десятки раз). С целью эрадикации геликобактер пилори длительность лечения составляла 7–8 дней. Микроорганизмы в ряде случаев по-прежнему оставались на слизистой оболочке, но количество их значительно уменьшалось. Это отмечалось визуально по интенсивности окраски геликотест-полосок, а также при микроскопическом исследовании. При дуоденогастральном рефлюксе назначали антирефлюксные препараты, в частности церукал, мотилиум в таблетированном или в инъекционном виде. Одновременно с антибактериальными препаратами назначался настой чистотела большого по 2 ст. л. 3 раза в день за 40 мин до еды лежа 15 мин 7 дней.
II этап: настойка золотого уса по 1 ч. Л. 3 раза в день за 40 мин до еды 18–20 дней.
III этап: настой чистотела большого по 2 ст. л. 3 раза в день за 40 мин до еды 3 недели.
IV этап: настойка золотого уса по 1 ч. Л. 3 раза в день за 40 мин до еды 3 недели.
Настой чистотела большого и настойка золотого уса приготавливались по рецепту, их дозировка была щадящей для организма человека (патент на изобретение № 2467758 от 27.11.2012 г.) [4].
Научные исследования проводились при информированном согласии больного согласно международным требованиям ВОЗ (правила GCP – Good Clinical Practice), предъявляемым к медицинским исследованиям с участием человека (Женева, 1993).
Больным проводилось эндоскопическое обследование верхних отделов желудочно-кишечного тракта. Использовалось эндоскопическое оборудование: эзофагогастрофиброскопы японских фирм «Olympus»-Gif-E и «Pentax» PG-29P, для взятия биопсийного материала применялись биопсийные щипцы. При подозрении на предраковое заболевание желудка обязательно производилась биопсия. Биоптат помещался в 10%-ный раствор формалина. Также производился забор (биопсия) тканей на микрофлору желудка биопсийными щипцами. Для оценки микрофлоры в момент эндоскопии брались два кусочка тканей со слизистой оболочки средней трети и антрального отдела желудка. Определяли геликобактер пилори (Нр) и дрожжеподобный мицелий. Нр оценивался и по геликотесту с помощью специальных тест-полосок. Гистологические исследования проводились в патологоанатомических отделениях Республиканской клинической больницы № 4 г. Саранска и в Республиканском онкологическом диспансере.
Методы исследования
Больным выполняли общеклинические и биохимические исследования. Биохимические анализы крови больным проводились до и после комбинированного лечения в динамике с целью определения возможного токсического воздействия разработанной лечебной схемы на организм.
Оценивали состояние липидного обмена в плазме крови. Липиды из плазмы крови экстрагировали хлороформметаноловой смесью (Хиггинс Дж. А., 1990). Липиды фракционировали методом тонкослойной хроматографии (Хиггинс Дж. А., 1990; Vaskovsky V.E. et al., 1975). Молекулярный анализ проводили на денситометре Model GS-670 (BIO-RAD, США) с соответствующим программным обеспечением (Phosphor Analyst/PS Sowtware). Контрольные сроки оценки биохимических показателей и показателей липидного обмена: до лечения, 5-е, 10-е, 15-е, 30-е сутки в процессе лечения.
Полученные цифровые экспериментальные данные обработаны методом вариационной статистики с использованием t-критерия Стьюдента и χ2.
Результаты исследования и их обсуждение
Проведенные исследования показали, что чаще предраковые заболевания локализуются в антральном отделе желудка (31 (73,8%) больной), реже (11 (26,2%) больных) – в верхней трети тела или свода желудка по данным эндоскопической диагностики. Макровизуальная эндоскопическая картина слизистой оболочки желудка определялась в виде ее истончения, на фоне которой могли быть гиперплазии разных оттенков или разной высоты, протрузии, полипы, дефекты в виде эрозий или язвенных поражений.
У всех обследованных больных, как в основной группе, так и в группе сравнения, на тест-полосках определялся геликобактер пилори. При микроскопическом исследовании же Нр не всегда (12 (28,6%) больных) регистрировался визуально. В ряде случаев (19 (42,5% больных) геликобактер пилори в пищеводе в количественном отношении определялся больше, чем в желудке.
По данным эндоскопических исследований желудка после первого сеанса комбинированного терапевтического лечения в 32 (76,2%) наблюдениях у больных основной группы полипы исчезали полностью, в остальных – уменьшались в размерах. Дисплазии тяжелой степени (III степени), а также ранние стадии злокачественных образований регрессировали после одного сеанса лечения. Это подтверждалось и при гистологических исследованиях. В биоптатах микроскопически не обнаруживалась патологическая картина в виде аденоматозных или гиперпластических полипов, дисплазий, а также аденокарцином. Подчеркнем, что после трех сеансов комбинированной терапии полипы до 2,0 см высотой полностью регрессировали (рис. 1, 2).
Клинические примеры приведены ниже.
Больная П., 62 лет. 4.05.07г. жалобы на тяжесть в эпигастрии, отрыжку воздухом. ЭГДФС: Полушаровидный полип (0,8×0,8см) большой кривизны середины тела желудка. Смешанный гастрит. Дуоденит. НР (+++). Микроскопия от 7.05.2007 г.: аденоматозный полип слизистой желудка с признаками полиморфизма желез, осклизнением эпителия, очагами поверхностных эрозий и элементами грубой интестинальной перестройки. Лечение: I этап — Пилобакт 1 полоска утр., 1 полоска на ночь 7 дней, чистотел большой по 2 ст. л. 3 раза в день за 40 мин до еды 7 дней. II этап — золотой ус 1 ч. Л. 3 раза в день за 40 мин до еды 3 недели. III этап — чистотел большой по 2 ст. л. 3 раза в день за 40 мин до еды 3 недели; IV этап – золотой ус 1 ч. Л. 3 раза в день за 40 мин до еды 3 недели.ЭГДФС: Регрессия полипа. Субатрофический гастрит. НР (+) с антрального отдела желудка. Микроскопия от 9.08.2007 г.: слизистая желудка с признаками очаговой атрофии желёз, слабовыраженной полиморфноклеточной инфильтрацией в строме.
Больная М., 60 лет. Жалобы на тошноту после еды и тяжесть в эпигастрии. 12.05.2009 г. ЭГДФС: Афтозные гиперплазии антрального отдела (эрозии до 0,2 см, гиперемированные гиперплазии до 0,7 см) желудка. Смешанный гастрит. Поверхностный дуоденит. Дуоденогастральный рефлюкс. НР (+++). Микроскопия от 17.05.2009 г.: картина гиперпластического полипа желудка. Лечение: I этап — Викаир по 1 таб. 3 раза в день, метронидозол по 1 таб. 3 р. за 30 мин. до еды 7 дней, Чистотел большой по 2 ст. л. 3 раза в день 7 дней. II этап — золотой ус 1 ч. Л. 3 раза в день за 40 мин до еды 3 недели. III этап — чистотел большой по 2 ст. л. 3 раза в день за 40 мин до еды 3 недели; IV этап – золотой ус 1 ч. Л. 3 раза в день за 40 мин до еды 3 недели. 16.10.2009 г.: жалоб нет. ЭГДФС: Полная регрессия полипа. Атрофический гастрит. Микроскопия от 16.10.2009 г.: фрагмент слизистой желудка с диффузной умеренно выраженной воспалительной инфильтрацией в строме.
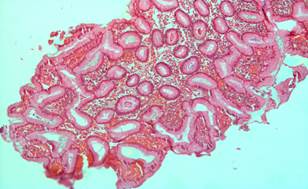
Рис. 1. Фрагменты гиперпластического (аденоматозного) полипа слизистой желудка (до лечения).
Окраска гематоксилин эозином. × 200
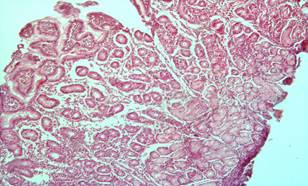
Рис. 2. Фрагменты слизистой желудка с признаками гиперплазии отдельных желёз, участками атрофии желёз, полиморфноклеточной инфильтрацией в строме (после лечения). Окраска гематоксилин эозином. × 200
Эндоскопический контроль в отдаленном периоде (до 5 лет) удалось провести 34 (81,0%) больным. Рецидивов не выявлено ни в одном случае.
Положительный эффект терапии выражался и в том, что на ее фоне не отмечались существенные расстройства гомеостаза, подтвержденные биохимическими исследованиями. В биохимических показателях крови до лечения и после проведенного комбинированного лечения по специальной схеме не было значительных отклонений от нормы. Общее состояние больных при проведении терапии и после нее не страдало, а в конце терапии субъективно отмечалось улучшение состояния.
В патогенезе различных заболеваний, в том числе и предопухолевой патологии, значительную роль играют нарушения липидного обмена, что обусловлено важностью липидов в молекулярной организации и функционировании живых структур. Проведенные нами исследования показали, что предопухолевые заболевания желудка тесно сопряжены с липидными дестабилизациями в плазме крови (табл. 1).
Содержание некоторых липидов в плазме крови (M±m)
Механизм действия средства основан на получении химического.
Инструкция
Показания к применению
Средство используют для ухода за кожей, обладающей избыточным ороговением в виде мозолей, бородавок и папиллом.
Инструкция
Состав
дистиллированная вода, натрия гидроокись или калия гидроокись.
Фармакологические свойства
Механизм действия средства основан на получении химического ожога от воздействия едких веществ на месте применения. За несколько дней Правильный чистотел стирает косметические дефекты с кожи. Для этого один раз в день, на протяжении пяти дней одну каплю вещества наносят на бородавку или папиллому.
Показания к применению
Средство используют для ухода за кожей, обладающей избыточным ороговением в виде мозолей, бородавок и папиллом.
Способ применения и дозы
Особые указания
Не применять жидкость для ухода за кожей лица. Не допускать попадания жидкости на здоровые участки и слизистые оболочки. При попадании жидкости на здоровую кожу рекомендовано промывание пораженного участка струей воды в течение 10-15 минут, затем сделать примочку 5% раствором лимонной кислоты.
Почему появляются папилломы? Кто находится в группе риска?
Главная причина папиллом на теле — это вирус папилломы человека (ВПЧ), который при попадании в организм остается в нем навсегда. Папилломавирус имеет более 170 штаммов, и они делятся на 3 группы с высоким, средним и низким уровнем онкогенности. Хотя такое деление условно, и злокачественная опухоль может появиться на месте поражения низкоонкогенным штаммом и, наоборот, не развиться при заражении высокоонкогенным.
Папилломы — главный признак заражения ВПЧ, но они появляются не у всех, кто столкнулся с этим вирусом, и их возникновение можно предотвратить.
Как передается ВПЧ, вызывающий папилломы
Итак, причиной появления папиллом выступает папилломавирус человека, который передается от вирусоносителя контактным путем. Основной способ — при половом акте. Вероятность заражения особенно высока при беспорядочных половых связях. ВПЧ выступает самым распространенным заболеванием, передающимся половым путем (ЗППП). Чаще всего при таком способе заражения развиваются аногенитальные бородавки — сосочковидные разрастания на слизистой оболочке половых органов.
Появление папиллом не всегда связано с сексуальными контактами. Стандартный жизненный цикл ВПЧ рассчитан на заражение через микротрещины на коже, просто передача вируса через слизистые происходит проще, поэтому такое случается чаще. ВПЧ проникает в организм:
ВПЧ устойчив к антисептикам и влажности, особенно часто им заражаются при посещении общественных мест: туалетов, бассейнов, саун, спортзалов и душевых. Поэтому здесь обязательно необходимо пользоваться индивидуальными предметами гигиены.
Что провоцирует появление папиллом
Папилломавирус есть в организме почти 80% сексуально активного населения. Но не у всех возникают внешние проявления в виде папиллом, поскольку при хорошем иммунитете вирус успешно подавляется иммунными клетками. ВПЧ в организме находится в клетках кожи и слизистых — на поверхности, а не в глубоких слоях дермы. Долгие годы вирус может ничем не беспокоить. Причиной папиллом на теле человека становится ослабление иммунитет под влиянием следующих факторов:
Большое количество новообразований указывает на сильное снижение иммунитета. В таком случае особенно остро необходима консультация дерматолога и других узкоспециализированных врачей: венеролога, иммунолога.
Можно ли предотвратить появление папиллом
На 100% обезопасить себя от заражения ВПЧ очень сложно. Можно только свести риск попадания вируса в организм к минимуму, соблюдая элементарные правила. Как предотвратить появление папиллом:
Чтобы минимизировать риск возникновения папиллом, необходимо поддерживать иммунитет, не допуская воздействия на организм факторов, провоцирующих его ослабление. При появлении папиллом стоит обратиться к дерматологу, который определит, насколько опасно новообразование и при необходимости проведет удаление безопасным методом, не дающим каких-либо осложнений.
Что делать при отравлении чистотелом
Чистотел – скромное неприхотливое растение, основной компонент многих рецептов народной медицины. Его используют для изготовления мазей, настоек, отваров, которые обладают бактерицидными и ранозаживляющими действиями. Но длительное лечение, превышение дозировки, несоблюдение мер предосторожности при обращении ядовитыми веществами провоцируют отравление чистотелом. Безобидная на первый взгляд трава способна вызвать отек легких и остановку сердца.
Характерные особенности чистотела

Некоторые плоды растений содержат сочную структуру (элайсому), которой муравьи кормят своих личинок. Семена чистотела внешне напоминают элайсому, что заставляет насекомых доставлять их в муравейники. Во влажной, теплой среде семена благополучно всходят.
При разломе прямого стебля чистотела выделяется густой сок, который на открытом воздухе окрашивается в оранжевый цвет. Латинизированное название растения в переводе означает «ласточка». В древности считалось, что птицы лечат своих ослепших птенцов соком травы, закапывая его в глаза.
Полезное действие растения
Отравление различными частями чистотела может произойти как при внутреннем, так и при наружном употреблении. Но при соблюдении рекомендованных дозировок растение приносит ощутимую пользу для организма:
Диуретические свойства ядовитой травы не используются в народной и официальной медицине из-за высокой токсичности травы. По этой же причине его перестали применять в терапии глазных патологий после участившихся случаев изъязвления слизистой оболочки.
На основе чистотела был синтезирован препарат для профилактики и лечения злокачественных опухолей. Прием фармакологического средства не заменяет основное лечение и химиотерапию.
Из семян растения изготавливают жирное масло, которое обладает антикоррозийным действием. Ярко-оранжевый сок из стебля используют для приготовления красителей, в том числе биологических объектов. Противомикробное свойство растения применяется для дезинфекции и регенерации обожженных кожных покровов.
Ядовитые свойства чистотела
Состав травы разнообразен. Самая большая концентрация ядовитых соединений накапливается в стебле и корнях. К опасным для жизни человека токсичным веществам относятся алкалоиды, перечисленные далее:
Отравление человека может произойти под действием любого компонента из химического состава чистотела. А при совокупности ядовитых свойств интоксикация приведет к тяжелым осложнениям и смертельному исходу.
На пастбищах сельскохозяйственных угодий животные обходят участки, на которых растет чистотел. При заготовке сена фермеры стараются не допустить попадания в корм даже отдельных экземпляров растения, сохраняющего ядовитые свойства в засушенном виде.
Лечение чистотелом противопоказано при беременности, в период грудного вскармливания. Категорически запрещено использовать средства на основе сока растения в терапии детей и подростков, обладающих повышенной проницаемостью кровеносных сосудов. Ядовитая трава способна спровоцировать рецидивы хронических заболеваний печени и мочевыделительной системы человека. Людям с системными патологиями следует проконсультироваться с эндокринологом и дерматологом перед использованием настоев или настоек чистотела.
Как можно отравиться чистотелом

Нельзя собирать лекарственные травы, растущие вдоль магистралей, больших дорог, во дворах многоэтажных домов, около промышленных предприятий. Чистотел способен активно поглощать токсины из окружающей атмосферы.
Главная ошибка, которую совершают люди при лечении ядовитой травой, – постепенное или быстрое повышение дозы с целью скорого выздоровления. Алкалоиды чистотела способны накапливаться в клетках и тканях, поэтому каждая лишняя капля принятого средства спровоцирует смертельное отравление. Наличие у человека патологий мочевыделительной системы ограничивает использование растения из-за нарушения фильтрации крови и (или) выведения мочи.
Некоторые пациенты реанимационных палат подходили к терапии комплексно, желая избавиться от всех заболеваний сразу. Они прижигали папилломы соком чистотела и одновременно пили настойку чистотела для лечения желчного пузыря. Даже здоровая печень быстро выйдет из строя, не перенеся избыточной нагрузки. Гепациты не способны обезвредить и переработать такое количество токсичных соединений. Происходит разрушение клеток печени, некроз тканей биологического фильтра. Продолжение «терапии» оканчивается обширным абсцессом.
Симптомы отравления ядовитым растением

Опасность такой интоксикации заключается в возможности еще большей передозировки. Люди начинают принимать чистотел в повышенном количестве для облегчения своего состояния.
При хроническом отравлении пострадавшие не способны осознать проблему, сделать правильный вывод о причине плохого самочувствия. Интоксикация выявляется на стадии значительного повреждения печени, почек, сердца, кровеносных сосудов.
Острая форма отравления развивается при случайном или намеренном пероральном приеме большой дозы алкалоидов чистотела. У пострадавшего развиваются такие признаки интоксикации:
Первая помощь и лечение интоксикации чистотелом

При попадании сока чистотела на кожные покровы или слизистые оболочки необходимо смыть токсичное вещество струей воды и обработать дезинфицирующими растворами. В случае, когда ядовитое вещество проникло в желудочно-кишечный тракт, нужно вызвать рвоту:
Комплексного антидота при интоксикации чистотелом не существует. Доктор госпитализирует пациента для проведения лечения препаратами, нейтрализующими действие алкалоидов. Дальнейшая терапия основана на устранении симптомов отравления солевыми растворами с глюкозой, диуретическими препаратами.
Лечение эндометриоза
Правильное лечение эндометриоза опытным врачом позволит женщине избавиться от опасного заболевания, восстановить нормальное функционирование матки и придатков. Неприятный недуг способен вызывать бесплодие и развивается в 80% случаев в детородном возрасте у пациенток, не достигших менопаузы. Узнайте, можно ли вылечить эндометриоз навсегда и какие виды терапии практикуются.
Что такое эндометриоз
Перед лечением нужно разобраться в специфике гинекологического заболевания. Человеческая матка состоит из тела, шейки и труб, внутри устлана специальным слоем – эндометрием. Главная его функция – репродуктивная. Во время беременности ткань нарастает на внутренней поверхности матки, яйцеклетка внедряется в толщу слизистой и прикрепляется. Появляются сосуды, которые с помощью плаценты обеспечивают жизнедеятельность плода. Если беременность не наступила, слизистая поверхность матки отслаивается и выходит с кровью, то есть у женщины начинаются месячные.Болезнь может возникнуть при попадании крови из полости матки на другие органы малого таза. Эндометриоз – это патологический процесс разрастания эндометрия. Существует болезнь в двух формах;
Эндометриоз вызывает внутренний воспалительный процесс в брюшной полости. Изменение в строении органов приводит к нарушениям их работы. Очень часто это заболевание путают с миомой. Эндометриоз приводит к поражению поверхности матки, возникновению узлов и спаек, что чревато невозможностью эмбриона к прикреплению, т.е. вызывает бесплодие. Современная гинекология не изучила все причины патологического недуга. Самые вероятные – это иммунные и гормональные нарушения, наследственный фактор, нервные расстройства, стресс.
Симптомы при эндометриозе
Коварная болезнь чревата появлением признаков только на поздней стадии. Пациентка может страдать недугом долгое время, даже не догадываясь о нем. Симптомы при эндометриозе:
Как быстро развивается эндометриоз
В зависимости от окружающих факторов, генетической предрасположенности, возраста – эндометриоз развивается у каждой женщины по-разному. При хорошем иммунитете клетки слизистой матки не приживутся в другой среде или это займет длительное время. При тяжелых родах, гормональных сбоях, эндометриозу может понадобится менее 6 месяцев чтобы развиться. Гинеколог сможет с высокой точностью поставить диагноз, вылечить заболевание и проконтролировать возникновение рецидивов. Опытный врач назначит такие методы диагностики эндометриоза:
Как лечить эндометриоз
Лечение эндометриоза подбирают индивидуально в зависимости от формы заболевания пациентки. Консервативный метод применяют у женщин детородного возраста. Он включает прием препаратов (гормональных обезболивающих, противовоспалительных). Если не наступает улучшение состояния пациентки, применяют хирургический метод лечения. Операцию проводят при больших кровопотерях, спаечном процессе, болевом синдроме. Узнать подробнее, как лечить эндометриоз матки медикаментозно или оперативно можно у лечащего врача.
Лечение эндометриоза препаратами
Для молодой женщины важно сохранить репродуктивную функцию, поэтому к возрастной категории 25-45 лет применяется лечение эндометриоза препаратами. Комплексный подход, различные схемы дают возможность получить хороший эффект за малый промежуток времени. Кроме гормональных препаратов, применяют симптоматическую терапию. Лечение заключается в купировании боли, тошноты, спазма.
Гормональные препараты
Таблетки от эндометриоза дают возможность контролировать длительность менструального цикла, а в результате – рост эндометрия. Назначаются препараты для лечения эндометриоза после тщательного анализа гормонального фона. При правильном применении они не вызовут негативных эффектов. Длительность приема и дозу врач подбирает индивидуально. Гормональные препараты при эндометриозе:
Схема лечения эндометриоза
Правильная схема лечения эндометриоза та, которую назначает ваш врач-гинеколог после всестороннего обследования. Доктор подбирает все средства индивидуально, особенно это касается гормонов. Схема включает в себя не только прием таблеток и инъекций по назначенному курсу, но и подмывания, спринцевания, специальные тампоны, компрессы, народные методы. Эти методы могут позволить женщине избавиться от проблемы. В среднем лечение будет длиться от 6 до 9 месяцев.
Тампоны при эндометриозе
Применяют в гинекологии тампоны при эндометриозе. Особенно они эффективны, когда заболевание затронуло шейку матки, влагалище. Тампоны бывают фабричного производства, пропитанные экстрактами трав, гиалоурановой, молочной кислотой. Их действие направлено на восстановление функциональности, уменьшению болезненности полового акта. Так же, тампоны можно сделать самостоятельно. Для этого берут валик ваты и стерильный бинт, складывают в 6-8 слоев. Хорошо промачивают в масле или настое. Оставляют тампон во влагалище на ночь. Курс лечения 5-6 недель.
Спринцевание
Применение спринцеваний при эндометриозе может назначаться врачом для уменьшения разрастания эндометрия в матке и за ее пределами, уменьшению воспалительных процессов. Проводиться лечение с помощью спринцовки для ирригаций или обычной спринцовки с мягким наконечником. Используются при эндометриозе аптечные препараты (порошки, готовые растворы: Тантум Роза, Фурацилин) и отвары лекарственных трав.
Хирургическое лечение
Радикальный способ лечения – операция. Назначается она после тщательного обследования. Чтобы сохранить возможность репродуктивной функции, широко применяется лапароскопия. Хирургическое лечение эндометриоза таким методом малоинвазивно, предполагает быстрое удаление тканей эндометрия и обладает хорошим косметическим эффектом. Оперативное вмешательство проходит через маленькие разрезы, через которые врач может удалять очаги поражения в матке и других органах. Либо проводится выскабливание по механике аборта.
Как вылечить эндометриоз народными средствами
Врачи могут подсказать, как вылечить эндометриоз народными средствами. Женщины опасаются употреблять гормональные препараты, боясь побочных эффектов, на помощь приходят – травы, продукты животноводства и пчеловодства. Узнайте, как лечить эндометриоз матки в домашних условиях у врача с помощью простых рецептов. Комбинирование разных методов дает отличный результат и предупреждает рецидивы.
Лечение травами
Проверенное годами лечение эндометриоза травами дает стойкий эффект. Множество медикаментов на растительной основе принимают при гинекологических нарушениях. Средство из боровой матки, красной щетки принимают внутрь в виде трав или капель на спиртовой основе. Сборы с бузиной, листьями малины, ежевики позволяют предотвратить разрастание эндометрия в полости матки.
Крапива
Чистотел
Красивое растение чистотел является природным бактерицидным и фунгицидным лекарем. Оно способно угнетать новообразования в организме человека. Применять чистотел при эндометриозе следует с осторожностью. При превышении указанной дозировки у пациента могут развиться побочные действия. Рецепты с чистотелом:
Лечение прополисом
Когда народные и медикаментозные методы не помогают, лечение эндометриоза прополисом дает хороший эффект. Уникальный состав этого продукта пчеловодства помогает затормозить разрастание эпителия. Действенным является любое его употребление: настойки, компрессы, свечи, тампоны. Настойку прополиса на спирту можно купить в аптеке и развести (1 ложка на стакан воды), чтобы спринцеваться, делать компрессы.
Профилактика
Чтобы предупредить развитие недуга, необходимо регулярно посещать гинеколога. Профилактика эндометриоза включает в себя следующее:
Наблюдаться необходимо у опытного врача, который своевременно обнаружит заболевание, окажет помощь, назначит лечение. Проявляется заболевание и у женщин, не имеющих проблем с зачатием, порой, обнаруживается совершенно случайно. Если у вас менструация болезненная, идет не раз в месяц, а чаще или реже, не обладает определенным циклом – это повод обратится к доктору.
Хронический цистит: новое в диагностике и лечении
Рост хронических инфекционно-воспалительных заболеваний мочеполовой сферы, характеризующихся вялым, рецидивирующим течением, устойчивым к этиотропной терапии, представляет серьезную медицинскую проблему. Наиболее частым их проявлением является цистит
Рост хронических инфекционно-воспалительных заболеваний мочеполовой сферы, характеризующихся вялым, рецидивирующим течением, устойчивым к этиотропной терапии, представляет серьезную медицинскую проблему. Наиболее частым их проявлением является цистит. Цистит — изменение слизистой оболочки мочевого пузыря воспалительного характера, сопровождающееся нарушением его функции [1, 2]. Как правило, циститом страдают женщины трудоспособного возраста. В случае распространения воспалительного процесса глубже слизистой оболочки процесс приобретает хроническое течение. По данным литературы хронизация процесса выявлена более чем в трети случаев. Возникает она на фоне органических и функциональных изменений мочевого пузыря или у людей с серьезными сопутствующими заболеваниями [3, 4]. Хронический цистит сопровождается в той или иной мере выраженным болевым симптомом, приводит к социальной дезадаптации пациентов, временной или постоянной потере трудоспособности, а реабилитация требует дополнительных бюджетных вложений [5]. Большинство рецидивов возникают в первые 3 месяца после излечения предшествующего эпизода [6]. Более 60% случаев острого неосложненного цистита остается без должного лечения. В случае самопроизвольного излечения неосложненного цистита заболевание рецидивирует в течение года почти у половины женщин [7].
Этиология и патогенез
Мочевой пузырь у женщин обладает значительной резистентностью, которая обусловлена наличием ряда антибактериальных механизмов, постоянно и эффективно действующих у здоровых женщин. Инвазия бактерий в мочевой пузырь не является основным условием развития воспалительного процесса, что имеет большое число клинических и экспериментальных подтверждений. Нормальный ток мочи и своевременное опорожнение мочевого пузыря предотвращают инфицирование мочевых путей. Своевременное выделение даже инфицированной мочи снижает риск адгезии бактериальной клетки к рецепторам слизистой оболочки.
Слизистая оболочка мочевого пузыря обладает бактериостатической активностью, особенно по отношению к кишечной палочке, благодаря выработке специфических мукополисахаридов и секреторного IgA. Кроме того, моча может содержать специфические и неспецифические ингибиторы роста бактерий, иммуноглобулины класса А и G. Неповрежденный уротелий обладает значительной фагоцитарной активностью. При возникновении цистита в организме человека первоначально происходит активация местного и гуморального иммунитета в виде выработки антител. Известно, что при хронических заболеваниях возникает транзиторная дисфункция иммунной системы [9], в то же время в большинстве случаев цистит является вторичным, то есть осложняет течение имеющихся заболеваний мочевого пузыря, уретры, почек, половых органов [1].
Нередко рецидивы обусловлены персистенцией инфекции, но в подавляющем большинстве случаев объясняются реинфекцией [10]. Под персистирующей инфекцией понимают наличие инфекции одного вида или штамма, и рецидив возникает, как правило, в течение 1–2 недель после прекращения лечения. Реинфекция это повторный инфекционный процесс, обусловленный другим возбудителем. Обычно она развивается через несколько недель после окончания терапии [5, 11].
Ведущую роль в патогенезе любых хронических воспалительных заболеваний играет гипоксия тканей и транзиторная дисфункция иммунной системы [9, 12]. Под хроническим воспалением понимают процессы, протекающие недели и месяцы, при которых повреждающий фактор, реактивные изменения и рубцевание развиваются одновременно [13]. Традиционно по времени возникновения хронического воспалительного процесса считается срок более 60 дней.
Специфической предпосылкой хронического воспалительного процесса является невозможность завершения острого воспаления регенерацией, протекающей на фоне нарушенного тканевого гомеостаза [14]. В результате при хроническом воспалении нередко имеет место смена фаз затихания и обострения процесса, что накладывает отпечаток и на его морфологию. Если при остром течении воспалительных процессов на первое место выступают альтеративные и сосудисто-экссудативные изменения, то при подостром и хроническом — пролиферативные, завершающиеся новообразованием соединительной ткани, то есть склерозом [15]. Подслизистые структуры в стенке мочевого пузыря играют основополагающую роль, поскольку между эпителиальными клетками нет капилляров, и жизнедеятельность клеток эпителия зависит от эффективности диффузии кислорода и питательных веществ из подлежащей соединительной ткани (через ее межклеточное вещество и базальную мембрану) [16].
Наличие очагов хронического воспаления зависит от возрастных и конституциональных особенностей эпителиальных тканей, модифицирующих как клеточную устойчивость, так и метаболический фон, на котором развивается процесс воспаления. Развитию хронического воспаления содействуют в первую очередь возрастное увеличение чувствительности клеток к окислительному стрессу. В то же время при гипоксии ускорятся процесс мобилизации и деления незрелых эпителиальных клеток [12], блокируется их созревание. Известно, что незрелый эпителий обладает повышенной способностью клеток к бактериальной адгезии. Баткаев Э. А., Рюмин Д. В. (2003) в исследованиях, когда возбудителем цистита была кишечная палочка, обратили внимание на возраст пациенток. Так, у женщин до 55 лет рецидивы болезни в течение года происходили в 36%, в то время как рецидивы у женщин старше этого возраста возникли в 53% [17].
Классификация хронических циститов [18]:
В зависимости от характера и глубины морфологических изменений хронический цистит делится на катаральный, язвенный, полипозный, кистозный, инкрустирующий, некротический.
Клиническая картина
Хронический цистит в фазу обострения проявляется теми же симптомами, что и острый цистит. Кроме того, могут играть роль симптомы основной патологии, послужившей хронизации процесса (симптомы камня мочевого пузыря, атонии и т. д.). При обострении заболевания наиболее частой причиной жалоб пациенток является учащенное болезненное мочеиспускание. При хронических заболеваниях, в зависимости от степени поражения мочевого пузыря, боль может быть постоянной, иногда с мучительными позывами на мочеиспускание; локализуется в области лобка либо в глубине малого таза. Боль может появляться или усиливаться в связи с актом мочеиспускания. В последнем случае она возникает либо перед началом мочеиспускания вследствие растяжения стенок мочевого пузыря, либо во время акта мочеиспускания, но чаще всего — в его конце. Следует помнить о том, что боль в мочевом пузыре с нарушением акта мочеиспускания может возникнуть при воспалительных заболеваниях женских половых органов [19].
Диагностика хронических циститов является сложной проблемой, требующей от врача использования ряда клинических и параклинических методов, аналитического подхода к их результатам. Клинический этап обследования должен включать тщательный сбор анамнеза, с учетом данных о состоянии половой сферы пациентки, связи заболевания с половой жизнью; осмотр в «зеркалах» для исключения вагинизации уретры, наличия уретрогименальных спаек. Базово-диагностический этап включает лабораторные исследования, обязательной составляющей которых является бактериологическое исследование мочи, определение чувствительности флоры к антибиотикам; УЗИ и при необходимости рентгеновское исследование органов малого таза и верхних мочевых путей, исследование пациенток на наличие ИППП. Анализ результатов бактериологических посевов мочи, выполненных в нашей клинике, у больных хроническим рецидивирующим циститом показал, что традиционно принятый диагностический критерий бактериурии 10 5 КОЕ в 1 мл средней порции мочи был выявлен только в 21,3%. Многие исследователи обращают внимание на то, что в клинической практике феномен «малой бактериурии» недооценен [11, 20]. У пациенток с наличием хронического цистита и угрозой рецидива мы принимаем во внимание бактериурию 10 3 КОЕ в 1 мл.
Завершающим и обязательным этапом обследования является эндоскопическое обследование. Для выяснения причины хронизации процесса выполняется цистоскопия. Однако это достаточно субъективный метод, при котором часто возникают трудности в интерпретации визуальной картины поверхности слизистой оболочки мочевого пузыря [20]. Кроме того, хроническое воспаление сопровождается хронической индукцией регенерационного микроокружения, идентичного опухолевому, то есть в эпителии могут появляться гистологические изменения, относящиеся к предраковым: гиперплазия, дисплазия, метаплазия [12]. Многие авторы признают необходимость выполнения мультифокальных биопсий для понимания и правильной морфометрической характеристики процессов, происходящих в стенке мочевого пузыря [2, 21].
При хронических воспалительных заболеваниях в мочевом пузыре оптимально от 8 до 15 биоптатов, хотя эффективность рандомных биопсий в свете онконастороженности оспаривается некоторыми авторами [22, 23]. Биопсия — всегда дополнительная травма, провоцирующая воспалительные изменения, а в редких случаях кровотечения и перфорации стенки мочевого пузыря.
Дифференцировать явления хронического цистита от неопластических изменений, а также объективно оценить изменения состояния слизистой и подслизистой структур мочевого пузыря позволяет оптическая когерентная томография (ОКТ) и ее вариант кросс-поляризационная ОКТ (КП ОКТ) [24, 25]. Метод ОКТ демонстрирует оптические свойства ткани в поперечном сечении. Изображение может быть получено в реальном времени с разрешением 10–15 мкм. Принцип ОКТ подобен B-скану ультразвука. Оптическое изображение формируется за счет различия оптических свойств внутритканевых слоев или структур — коэффициента обратного рассеяния тканей [22, 23]. КП ОКТ несет большую информацию о ткани, поскольку ряд компонентов слоистой структуры органов (например, коллаген) способен рассеивать зондирующее излучение не только в основную поляризацию (нижнее изображение), совпадающую с поляризацией зондирующей волны, но и в ортогональную (верхнее изображение). Компактный переносной оптический томограф, созданный в Институте прикладной физики РАН Нижнего Новгорода, оснащен съемным зондом, совместимым с эндоскопическим оборудованием. Во время эндоскопических манипуляций гибкий зонд — сканер оптического когерентного томографа c торцевой оптикой (внешний диаметр 2,7 мм) проводится через инструментальный канал 8 Ch операционного цистоскопа 25 Ch и прижимается под контролем зрения к интересующему участку стенки мочевого пузыря. Исследование ОКТ выполняется последовательно в правой и левой гемисферах, нижнем, среднем и верхних сегментах мочевого пузыря. Время получения одного изображения — 1–2 секунды. Визуально измененные зоны изучаются прицельно. При необходимости из оптически подозрительных зон выполняются прицельные биопсии. Анализ клинических данных показал, что ОКТ с хорошей чувствительностью (98–100%) и специфичностью (71–85%) выявляет неоплазию в мочевом пузыре. В результате мониторирования хронических циститов с ОКТ, проведенных в нашей клинике, выполнение биопсии снизилось на 77,6% (рис. 1). На рис. 1 а цистоскопическое изображение, зонд — сканер оптического когерентного томографа под устьем: отек и умеренная гиперемия под устьем мочевого пузыря. На рис. 1 б оптическое изображение до лечения: эпителиальный слой утолщен, подслизистые структуры плохо дифференцируются от верхнего эпителиального слоя за счет инфильтрации; изображение отнесено к подозрительным на неоплазию в результате очаговой потери слоистости. На рис. 1 в динамическое исследование после комплексного лечения через 5 недель: эпителиальный слой нормальной толщины, подслизистые структуры хорошо дифференцируются.
Включение методов оптической визуализации ОКТ и КП ОКТ в исследование стенки мочевого пузыря на наш взгляд является перспективным, поскольку позволяет проводить дифференциальную диагностику хронического цистита с заболеваниями, имеющими сходную клиническую симптоматику, исключая/или минимизируя выполнение биопсий. Выявление на ОКТ-изображениях очаговой пролиферации эпителия, а также изображений с нарушенной структурной организацией (граница эпителий/подслизистые структуры нечеткая или неровная) позволяет выделить пациенток, требующих пристального внимания в отношении угрозы малигнизации и, следовательно, их длительного мониторинга.
Наличие тонкого/атрофичного эпителиального слоя слизистой оболочки мочевого пузыря на ОКТ-изображении позволяет заподозрить эстрогенный дефицит, направить больного на консультацию к гинекологу. У женщин в постменопаузе эстрогенный дефицит является причиной урогенитальных расстройств.
У пациенток, длительно страдающих хроническим циститом, на КП ОКТ-изображении выявляется выраженное утолщение подслизистых структур, имеющих повышенный контраст, что свидетельствует о склеротическом процессе в стенке мочевого пузыря (рис. 2). На рис. 2 а КП ОКТ-изображение нормального мочевого пузыря: эпителиальный слой нормальной толщины, подслизистые структуры, мышечный слой в норме. На рис. 2 б КП ОКТ-изображение мочевого пузыря при хроническом рецидивирующем цистите: эпителиальный слой атрофичен (прямая поляризация — нижнее изображение), подслизистые структуры разволокнены; слой, содержащий колагеновые волокна, менее контрастен, расширен и определяется практически на весь кадр изображения (обратная поляризация — верхнее изображение). На рис. 2 в КП ОКТ-изображение мочевого пузыря пациентки с травмой позвоночника. Изменения идентичны изображению 2 б.
Таким образом, КП ОКТ позволяет объективно оценивать изменения, происходящие в подслизистых структурах стенки мочевого пузыря, и в зависимости от этого проводить коррекцию лечения.
Лечение
Если диагноз хронического бактериального цистита в большинстве случаев не вызывает затруднений, то лечение не всегда оказывается эффективным, а прогноз не всегда благоприятным, так как в ряде случаев не удается выявить, а затем и устранить причину возникновения заболевания. Лечение хронических циститов требует от врача широкого кругозора, знаний проблем гинекологии, неврологии, иммунологии. В период становления болезни структурные изменения опережают клинические проявления, и, наоборот, в процессе выздоровления нормализация нарушенных функций наступает раньше восстановления поврежденных структур, т. е. морфологические проявления запаздывают по сравнению с клиническими [16]. Только зрелые эпителиоциты резистентны к бактериям, в то время как барьерная функция эпителия при наличии эпителиоцитов с умеренно дифференцированной ультраструктурой нарушена. Для лечения и профилактики хронических рецидивирующих инфекций нижних мочевых путей применяется этиотропная антибактериальная терапия 7–10-дневными курсами. Исследования Возианова А. Ф., Романенко А. М. с соавт. (1994) показали, что полное восстановление зрелых поверхностных клеток эпителия мочевого пузыря после их повреждения длится не менее 3 недель [26]. Таким образом, при отсутствии настороженности у лечащего врача и отсутствии должного внимания к длительности патогенетического лечения, очередной рецидив может наслоиться на репаративную фазу предыдущего процесса. Это в свою очередь приводит к усилению коллагенообразования, дискорреляциям и склерозу подэпителиальных структур, играющих основную роль в гомеостазе слизистой оболочки мочевого пузыря, его иннервации [27]. Таким образом возникает замкнутый круг: неадекватное лечение — хроническое воспаление — реактивные изменения и рубцевание подслизистых структур — гипоксия ткани — незавершенная регенерация эпителия — очередное обострение процесса.
Лечение хронических рецидивирующих циститов:
Этиологическое лечение — это антибактериальная терапия, основанная на следующих принципах: длительность (до 7–10 дней); выбор препарата с учетом выделенного возбудителя и антибиотикограммы; назначение антибиотиков с бактерицидным действием. Препаратами, к которым выделен наибольший процент чувствительных штаммов возбудителей мочевой инфекции в России, являются: фосфомицин — 98,6%, мециллинам — 95,4%; нитрофурантоин — 94,8% и ципрофлоксацин — 92,3% [28]. Наиболее предпочтительными являются норфлоксацин, ципрофлоксацин, пефлоксацин и левофлоксацин из-за отсутствия нежелательных побочных реакций.
Выбор антибактериального препарата должен производиться на основе данных микробиологического исследования. Если при остром неосложненном цистите предпочтение следует отдавать коротким курсам антибактериальной терапии (3–5-дневным), то при хроническом рецидивирующем — продолжительность антибактериальной терапии должна составлять не менее 7–10 дней для полной эрадикации возбудителя, который при хронических циститах может локализоваться в подслизистых структурах стенки мочевого пузыря [1, 5].
Антибактериальная терапия. Препаратами выбора являются фторхинолоны (ципрофлоксацин, офлоксацин, норфлоксацин, левофлоксацин, ломефлоксацин), которые обладают очень высокой активностью в отношении E. сoli и других грамотрицательных возбудителей уроинфекций. Нефторированные хинолоны — налидиксовая, пипемидовая, оксолиновая кислоты утратили свое лидирующее значение, в связи с высокой резистентностью к ним микрофлоры, и не могут являться препаратами выбора при рецидивирующих инфекциях мочевых путей [18, 29].
Выбор фторхинолонов обусловлен широким спектром антибактериальной активности, особенностями фармакокинетики и фармакодинамики, созданием высоких концентраций в крови, моче и тканях. Биодоступность фторхинолонов не зависит от приема пищи, они обладают длительным периодом полувыведения, что позволяет принимать препараты 1–2 раза в сутки. Их отличает хорошая переносимость и возможность применения при почечной недостаточности. Для норфлоксацина период полувыведения 3–4 часа, для лечения обострения цистита рекомендуется принимать по 400 мг 2 раза в день 7–10 дней. Ципрофлоксацин считается наиболее мощным антибиотиком из группы фторхинолонов, поскольку, обеспечивая бактерицидный эффект в небольших концентрациях, обладает широким спектром антибактериальной активности и быстро распределяется и накапливается в тканях и биологических жидкостях с высокими интрацеллюлярными концентрациями в фагоцитах (принимают 500 мг 2 раза в день). В настоящее время созданы препараты, обеспечивающие удобство приема — 1 раз в день. Примером может быть Ифиципро ® ОД, который является новой формулой с постепенным высвобождением ципрофлоксацина.
При выявлении ИППП необходим курс антибактериальной терапии с включением макролидов, тетрациклинов, фторхинолонов, направленный на эрадикацию возбудителя, с последующим контролем микрофлоры.
Патогенетическое лечение начинают с рекомендаций по соблюдению режима труда и отдыха и назначения соответствующего питания. Назначают обильное питье. Усиленный диурез способствует вымыванию бактерий и других патологических примесей. Уменьшаются дизурические явления вследствие действия концентрированной мочи на слизистую оболочку мочевого пузыря. Пища должна быть полноценной по содержанию белков и витаминов и способствовать кишечной перистальтике. В настоящее время разработаны патогенетически обоснованные алгоритмы консервативной терапии воспалительных заболеваний нижних мочевых путей [18].
Наличие современных антибиотиков и химиотерапевтических препаратов позволяет быстро и эффективно вылечивать рецидивы инфекций мочевыводящих путей и проводить профилактику их возникновения. Необоснованность и нерациональность антибактериальной терапии являются факторами, приводящими к хронизации процесса и нарушениям иммунорегуляторных механизмов с развитием иммунодефицитных состояний. Важно, что иммунодефицитное состояние может не иметь клинических проявлений [30]. Понятие «иммунодефицит» включает состояния, при которых наблюдается отсутствие или снижение уровня одного или нескольких факторов иммунитета. Исследования, проведенные в нашей клинике, показали, что у пациенток с хроническими циститами имеются отклонения в иммунном статусе в виде повышения или понижения показателей от среднестатистической нормы у 33,3%. Альтернативой назначению антибактериальных препаратов является стимуляция иммунных механизмов организма пациента при назначении иммунотерапевтических препаратов. Одним из таких препаратов является лиофилизированный белковый экстракт, полученный путем фракционирования щелочного гидролизата некоторых штаммов E. coli. Препарат выпускается в капсулах, имеет торговое наименование Уро-Ваксом. Стимуляция неспецифических иммунных защитных механизмов Уро-Ваксомом является приемлемой альтернативой низкодозной длительной химиопрофилактике инфекций мочевыводящих путей [31].
Заслуживает внимания применение поливалентных бактериофагов в лечении хронического рецидивирующего цистита, что особенно актуально для пациентов с поливалентной аллергией к антибактериальным препаратам или наличием полирезистентных возбудителей. Несмотря на отсутствие плацебо-контролируемых исследований применения пиобактериофагов, клиническая эффективность указанных препаратов не вызывает сомнений [18].
Важнейшим звеном патогенетической терапии цистита, способной предотвратить хронизацию воспаления, является иммуномодулирующая терапия. Регуляторами иммунных реакций являются цитокины, основная их составляющая — интерфероны (ИНФ). Функции ИНФ в организме разнообразны, однако наиболее важной функцией ИНФ является антивирусная. Кроме того, ИНФ участвуют также в антимикробной защите, обладают антипролиферативными, иммуномодулирующими свойствами. ИНФ способны модулировать активность и других клеток, например нормальных киллеров, увеличивать лизис клеток-мишеней, продукцию иммуноглобулинов, фагоцитарную активность макрофагов и их кооперативное взаимодействие с Т- и В-лимфоцитами. Гамма-ИНФ ингибирует рост опухолевых клеток и подавляет внутриклеточное размножение бактерий и простейших [9, 30]. Существуют препараты, содержащие экзогенные ИНФ. Однако индукторы ИНФ имеют преимущества перед ними, поскольку лишены антигенных свойств, синтез их в организме всегда строго сбалансирован и, таким образом, организм огражден от перенасыщения интерферонами [32]. Впервые для комплексного лечения хронических рецидивирующих циститов нами был применен тилорон, торговое название препарата «Лавомакс ® » (таблетки 125 мг). Прием препарата «Лавомакс ® » позволил добиться ремиссии заболевания у 90%, эрадикация микрофлоры в моче достигнута в 66,7%. Результаты наших исследований показали несомненную перспективность использования Лавомакса ® не только для лечения, но и для профилактики хронических циститов.
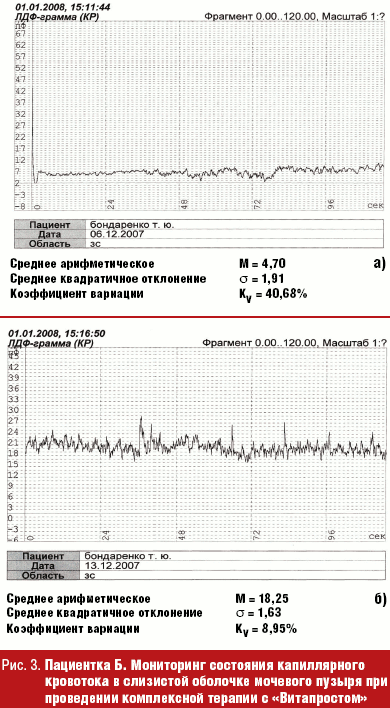
Хронический процесс, с учетом сопутствующей патологии пациенток, требует обязательного применения препаратов для борьбы с гипоксией тканей — антигипоксантов (Солкосерил 200 мг по 1 таблетке 2 раза в день, курс 14 дней); венотоников (Эскузан 20); антиагрегантов, которые улучшают «текучесть» крови по капиллярам. Типичным представителем группы антиагрегантов является Трентал, оказывающий сосудорасширяющее, антиагрегантное, ангиопротективное действие (100 мг 2–3 раза в сутки, курсом до 30 дней), действующее вещество — пентоксифиллин. Пентоксифиллин-Акри удобен в приеме, так как имеет таблетированную форму 100 мг, улучшает микроциркуляцию и снабжение тканей кислородом в основном в конечностях, центральной нервной системе, в меньшей степени в почках. Существует масса препаратов, улучшающих артериальное и венозное кровообращение. Однако на сегодняшний день есть препарат, который способен восстанавливать микроциркуляцию и тонус мышц мочевого пузыря; доказано его благотворное влияние на показатели иммунитета. Это хорошо зарекомендовавший себя в лечении заболеваний предстательной железы Простатилен — комплекс полипептидов, выделенных из тканей предстательной железы крупного рогатого скота [33]. Нас заинтересовала способность пептидов (цитомединов) выступать в организме в качестве биорегуляторов. Действие их предположительно осуществляется через рецепторы, расположенные на поверхности клеток. В результате их введения в организм происходит выброс эндогенных регуляторных пептидов, пролонгируется эффект цитомединов [34]. Традиционно используемый в лечении патологии мужской половой сферы препарат «Витапрост ® » (суппозитории ректальные 50 мг) был впервые применен в клинике урологии Нижнего Новгорода для лечения хронических рецидивирующих циститов у женщин. Изучая капиллярный кровоток в слизистой мочевого пузыря у пациенток с хроническим рецидивирующим циститом методом лазерной допплеровской флоуметрии (ЛДФ) [35, 36], мы получили объективно доказанный эффект от применения этого препарата (рис. 3). На рис. 3 а мониторинг до лечения, показатель микроциркуляции (ПМ) — 4,7 перфузионных единицы. На рис. 3 б мониторинг после лечения (ПМ — 18,25 перфузионных единицы).
До лечения у больных выявлялся застойный тип кровотока со сниженной активностью компонентов микроциркуляторного русла и ишемией тканей. Примененный в качестве патогенетической терапии в лечении хронических циститов биостимулирующий препарат «Витапрост ® » способствовал быстрому исчезновению воспалительного процесса, стимуляции регенераторных процессов, что мы контролировали КП ОКТ. Назначенный препарат позволил достичь быстрого эффекта анальгезии, помог достичь социальной адаптации пациенток в достаточно в короткий срок.
Лечение рецидивирующих инфекций нижних мочевых путей, протекающих на фоне ИППП, при наличии диспластических процессов в задней уретре, зоне шейки мочевого пузыря, мочепузырного треугольника должно быть направлено на эрадикацию атипичных возбудителей, восстановление муцинового слоя уротелия. Образование мукополисахаридного слоя, покрывающего в норме эпителий мочевого пузыря, считается гормонально-зависимым процессом: эстрогены влияют на его синтез, прогестерон на его выделение эпителиальными клетками. Применение женских половых гормонов интравагинально ведет к пролиферации влагалищного эпителия, улучшению кровоснабжения, восстановлению транссудации и эластичности стенки влагалища, увеличению синтеза гликогена, восстановлению популяции лактобацилл во влагалище, кислого рН. Примером эстрогена для лечения урогенитальных нарушений является препарат эстриола — Овестин, имеется таблетированная форма 2 мг и в виде вагинальных свечей по 0,5 мг. При использовании любой формы Овестин назначается 1 раз в сутки.
При наличии выраженного болевого синдрома назначают нестероидные противовоспалительные препараты, подавляющие синтез простагландинов, оказывающие выраженное обезболивающее действие. Назначают индометацин, диклофенак и другие. Препараты используются в обычных дозах в течение 10–21 дня, поддерживающие дозировки до 2 месяцев. Эффект от нестероидных противовоспалительных препаратов, как правило, сохраняется в течение 3–4 месяцев после их отмены [1].
Назначение антигистаминных и антисеротониновых препаратов необходимо для устранения этиологического и патогенетического факторов. Это может быть препарат «Перитол» — блокатор Н1-гистаминорецепторов с выраженным антисеротониновым действием. Он также стабилизирует тучные клетки и препятствует их дегрануляции с освобождением биологически активных веществ. Антихолинэстеразная активность его сказывается на накопительной функции мочевого пузыря. Препарат принимают с 2 мг — 1 раз в день, постепенно увеличивая дозу до 4 мг — 3 раза в сутки в течение 3–4 недель. Задитен (кетотифен) назначается в дозе 0,5–1 мг — 2 раза в сутки 2–3 месяца. Назначаются и другие антигистаминные препараты (Диазолин, Тавегил, Кларитин) в обычном режиме в течение 1–3 месяцев.
Местное лечение
Выраженным антигистаминным действием, а также способностью восстанавливать гликоз — амино-гликановый компонент муцина обладает природный мукополисахарид — Гепарин, который можно вводить внутрипузырно по 10 000 ЕД 3 раза в неделю в течение 3 месяцев. Местная противовоспалительная терапия включает инстилляции различных лекарственных препаратов или их сочетаний в мочевой пузырь. Для инстилляции используются растворы Диоксидина, нитрата серебра в разведении 1:5000, 1:2000, 1:1000 в 1–2% концентрации. Для инстилляции широко используются растворы коллоидного серебра. Антимикробный эффект коллоидного серебра зарегистрирован в отношении более чем 650 видов микроорганизмов, среди которых грамположительные и грамотрицательные бактерии, вирусы, простейшие, спорообразующие, анаэробы. Коллоидное серебро активно в отношении различных видов протея и синегнойной палочки, бактерии Коха [1, 5, 37].
Следует отметить, однако, что применение без достаточных показаний катетеризации мочевого пузыря является опасным, поскольку доказано, что 80% нозокомиальных инфекций связаны с введением уретральных катетеров [38].
Немедикаментозные методы лечения, такие как лечебная физкультура, физиотерапевтические процедуры, направлены на укрепление мышц тазового дна и нормализацию тазового кровообращения.
Профилактика
В качестве профилактики обострений у женщин с рецидивирующей инфекцией нижних мочевых путей рекомендованы в субингибирующих дозах ежедневно или после полового акта ципрофлоксацин 125 мг, нитрофурантоин 50 мг, норфлоксацин 200 мг, фосфомицин по 3 г каждые 10 дней в течение 6 месяцев. У женщин в постменопаузе применение заместительной гормональной терапии эстриолом ведет к снижению риска обострения заболевания до 11,8 раза по сравнению с плацебо [19, 28].
Анализ обращаемости пациенток по поводу обострений хронического цистита, проведенный на нашей кафедре, показал, что пик приходится на конец мая, начало июня, а также октябрь-ноябрь. В связи с этим целесообразно рекомендовать курсы профилактического лечения именно в эти периоды.
Таким образом, универсальный метод лечения хронических рецидивирующих циститов отсутствует. От лечащего врача требуется дифференцированный подход к методам лечения, адекватным этиологическим и патогенетическим факторам, а также индивидуальным особенностям течения заболевания пузыря у каждой пациентки.
По вопросам литературы обращайтесь в редакцию.
О. С. Стрельцова, кандидат медицинских наук
В. Н. Крупин, доктор медицинских наук, профессор
ГОУ ВПО «НижГМА», Нижний Новгород
Неоперативные методы лечения миомы матки
Лейомиома матки — одно из самых распространенных заболеваний у женщин, однако, несмотря на успехи в диагностике миомы матки, до настоящего времени не существует «золотого» стандарта лечения, что обусловлено как нерешенными проблемами патогенеза миомы матк
Лейомиома матки — одно из самых распространенных заболеваний у женщин, однако, несмотря на успехи в диагностике миомы матки, до настоящего времени не существует «золотого» стандарта лечения, что обусловлено как нерешенными проблемами патогенеза миомы матки, так и традиционно сложившимися представлениями «о бесполезности» матки при реализованной репродуктивной функции. Поэтому наиболее распространенным методом лечения миомы матки остается гистерэктомия. Подобный радикализм у большинства больных не обоснован, поскольку практически отсутствует риск озлокачествления и отмечается прогресс в появлении методов, тормозящих рост опухоли и вызывающих регресс симптомов заболевания [1, 4] Использование малоинвазивных и неинвазивных методов лечения на ранних этапах развития миомы матки позволяет остановить развитие заболевания, привести к его регрессу и не допустить в дальнейшем нарушения репродуктивной функции [2, 3].
Эпидемиология. Факторы риска
Частота возникновения миомы матки составляет 15–17% у женщин старше 30 лет и 30–35% у женщин, достигших пременопаузального возраста [1, 5]. Однако в последние годы наблюдается тенденция к «омоложению» миомы матки — возникновение ее у женщин до 30 лет, что обусловлено как совершенствованием диагностики, так и широким распространением «агрессивных» акушерских и гинекологических вмешательств. Частое сочетание миомы матки с доброкачественными заболеваниями эндометрия, эндометриозом осложняет течение заболевания и затрудняет тактику лечения.
Средний возраст выявления миомы матки составляет 32,8 ± 0,47 года, а показания к активному хирургическому лечению появляются примерно к 45 годам. Установлено, что развитие этой опухоли занимает в среднем 5 лет и в 84% случаев узлы являются множественными [1, 5,].
Эпидемиологические исследования выявили ряд факторов риска развития этой опухоли — этнические, генетические, паритет, вредные привычки, питание [1, 7]. У афро-американских женщин встречаемость миомы матки самая высокая, причем возникают в более молодом возрасте, достигают больших размеров и частота анемий выше, особенно по сравнению с кавказскими и азиатскими женщинами. Объяснением служит повышенный уровень циркулирующих эстрогенов по сравнению с женщинами другой расы.
Исследования близнецов и семей выявили генетический фактор риска [1]. Так, вероятность развития этой опухоли значительно выше и возникает в более молодом возрасте у женщин, матери и/или сестры которых страдали этим заболеванием. Недавно был определен фактор наследственности, как предполагают, играющий роль в этиологии опухоли матки. Хотя 50–60% миом матки являются кариотипически нормальными, однако часто встречаются аберрации, которые затрагивают хромосомы 6, 7, 12 и 14 (Gross K. L., 2001). Перестройки в этих хромосомах последовательно влияют на две недавно обнаруженные группы генов белка — HMGIC и HMGIY. Они кодируют те белки, которые, вероятно, играют роль в транскрипции и могут играть свою роль в аномальном росте миом. Однако, несмотря на доказательство наследования, не выявлено, какие именно генные мутации могут привести к развитию данного заболевания, а следовательно, не существует и превентивных мер.
Отсутствие детей и раннее наступление менархе повышает в 2–3 раза риск развития миомы. Причем степень уменьшения риска тем выше, чем больше детей в семье, — так у женщин с тремя доношенными беременностями риск снижается на 50–90%, хотя не выявлено никакой корреляции между возрастом при первых родах и миомами, а также для женщин 45 лет и старше защитный эффект parity не столь очевиден [7]. Объяснить это можно либо более высокой степенью риска вследствие более длительного периода с момента последних родов, либо более длительного периода воздействия стероидных гормонов в целом. Противоречивы данные о действии оральных контрацептивов. Однако в большинстве работ доказано, что применение оральных контрацептивов не повышает риск развития миомы матки. Так же как и нет никаких доказательств увеличения роста и количества миоматозных узлов на фоне приема заместительной гормональной терапии (ЗГТ) (Luoto R., 2002).
Избыточный вес, особенно в сочетании с низкой физической активностью на фоне хронического стресса, повышает риск миомы матки в 2–3 раза, причем прибавка веса после 18 лет влияет более значительно, чем ожирение в детском и пубертатном возрасте. Это объясняется повышенной периферической конверсией в жировых клетках андрогенов в эстрогены под воздействием ароматазы и более высокой биодоступностью факторов роста, типа инсулиноподобного фактора роста-1 (ИПФР-1).
Не выявлено корреляций с курением, хотя теоретически курение могло бы снижать риск миомы матки, поскольку напоминает состояние, характерное для относительного дефицита эстрогена, т. е. с характерными признаками остеопороза, ранней менопаузой и более низкими показателями рака эндометрия [5]. Однако данные, которыми мы располагаем сегодня, достаточно противоречивы, и только некоторые исследователи отмечают среди курильщиц уменьшение риска на 30–50% [1, 16].
Аналогии между опухолями гладкой мускулатуры и атеросклеротическими бляшками и, следовательно, возможную корреляцию между атерогенными факторами и риском миомы матки изучали Faerstein et al. Исследователи зафиксировали увеличение риска миом в 2,1 раза у пациенток до 35 лет с артериальной гипертензией, принимающих гипотензивную терапию дольше пяти лет и при длительности заболевания не менее пяти лет.
Таким образом, дальнейшие исследования, особенно посвященные цитогенетическим и молекулярным аспектам миом, приведут нас к определению тех генетических локусов, которые играют важную роль в индуцировании данных опухолей.
Патоморфология. Патогенез
Лейомиома матки представляет собой доброкачественную опухоль моноклонального происхождения, развивающуюся из гладкомышечных клеток и содержащую различное количество волокнистой соединительной ткани. Большинство ученых считают, что миома матки соответствует критериям истинной опухоли, о чем свидетельствуют: моноклональный характер развития миомы (как и большинство опухолей, в том числе и злокачественных), большие размеры и автономный рост опухоли, обусловленный воздействием факторов роста и цитокинов, активизация процесса неоангиогенеза, генетическая нестабильность (до 40% миом имеют генетические нарушения), т. е. вследствие мутаций уменьшается точность воспроизведения генетического аппарата, нарушается механизм репарации ДНК, изменяется регуляция клеточного цикла в поврежденных клетках, что приводит к неуклонной опухолевой прогрессии [1, 4, 25].
По мнению большинства ученых, миомы возникают в результате множественных соматических мутаций в нормальных клетках миометрия, что ведет к постепенному снижению регуляции их роста. Опухоль растет из клетки-прародительницы, в которой произошла первоначальная мутация и является следствием нарушения тканевого гомеостаза, поддерживаемого балансом клеточной пролиферации и апоптоза. В последнее десятилетие установлено, что образование и рост опухоли связаны с изменениями сложных взаимодействий между стероидными гормонами и их рецепторами, местными факторами роста и состоянием внеклеточного матрикса [20, 25, 12].
В настоящее время наибольшее подтверждение находит теория Fujii S., согласно которой развитие гладкомышечных клеток мезодермального происхождения происходит на эмбриональном этапе длительно: от 14 до 30 недель внутриутробного периода развития. Поэтому эти еще недифференцированные клетки за счет длительного периода внутриутробного развития могут подвергаться воздействию многочисленных факторов из организма матери (тропных гормонов, половых стероидов, факторов роста) и окружающей среды. Эти клетки-предшественники (уже с соматическими мутациями) сохраняются в миометрии и начинают расти после менархе. Их рост продолжается в течение многих лет на фоне выраженной активности яичников под действием как эстрогенов, так и прогестерона [12, 20, 27].
Также возможен и другой путь образования клеток-предшественников, при котором неопластическая трансформация миометрия может происходить в результате соматических мутаций нормального миометрия под влиянием половых стероидов и факторов роста. Однако молекулярные изменения, инициирующие эту трансформацию, до конца неизвестны.
Этиология и патофизиология остаются малопонятными, хотя к настоящему времени и определены основные молекулярно-генетические детерминанты возникновения этого заболевания. К ним относятся цитогенетические нарушения, изменения половых стероидов и гормональной чувствительности тканей, нарушение процесса ангиогенеза. В ткани миоматозных узлов в 40–50% имеются опухоль-специфические дефекты хромосом, определяемые кариотипически, что подтверждает роль генетических механизмов в росте и развитии миомы матки. Согласно современным представлениям, рост миомы происходит главным образом за счет пролиферации, стимулированной половыми стероидами через факторы роста по аутокринно-паракринному механизму, при относительно низкой готовности опухолевых клеток к апоптозу.
Несомненно, миома матки является гормонозависимой опухолью. До настоящего времени не известны механизмы, запускающие рост опухоли, но несомненна центральная роль половых стероидов — эстрогенов, прогестерона и их рецепторов в моделировании роста, дифференцировки и функции миометрия. Известно, что ключевую роль в контроле роста и развития миоматозных узлов играют эстрогены. Подтверждением этому служит повышенный уровень экспрессии эстрогеновых рецепторов в ткани узлов, по сравнению с неизмененным миометрием [8], а также стимулирующий эффект эстрогенов на синтез ДНК и клеточную пролиферацию в тканях матки. Также имеются данные о повышении уровня антигена клеточной пролиферации Ki-67 в нормальном миометрии [11] и усиление роста миомы матки преимущественно в лютеиновую фазу [20], что подтверждает роль прогестерона в индуцировании митогенного эффекта факторов роста. Очевидно, влияние эстрогенов и прогестерона комплементарны, т. е. эстроген создает условия для стимуляции пролиферации прогестероном [13]. Это подтверждается и работами, в которых прогестерон вызывает увеличение экспресии PCNA и эпидермального фактора роста в клетках миомы, тогда как эстрадиол в тех же клетках увеличивает экспрессии PCNA и ЭФР-рецептора [25, 11]. Следовательно, сочетанное действие эстрадиола и прогестерона стимулирует пролиферативный потенциал клеток миомы.
Другим потенциальным механизмом образования миомы матки является торможение механизмов апоптоза [12, 17]. В многочисленных работах доказано влияние половых стероидов не только на пролиферативные процессы, но и на регуляцию апоптоза в миометрии. Установлено, что протеин Bcl-2, тормозящий апоптоз, значительно меньше экспрессируется при лейомиоме по сравнению с нормальным миометрием. Причем эстрадиол, подавляя экспрессию этого протеина, снижает апоптоз.
Таким образом, развитие пролиферативных процессов, к которым относится и лейомиома матки, обусловлено не только повышенной пролиферацией клеток, но, возможно, и ослаблением индукции апоптоза.
В реализации влияния половых стероидов участвуют местные ауто- и паракринные факторы (факторы роста, цитокины и др.), продукция которых находится под контролем эстрогенов и прогестерона. Митогенное действие эстрогенов опосредовано местными регулирующими ростовыми факторами. Результатом их избыточной продукции является ускорение клеточной пролиферации, гипертрофия клеток, увеличение объема межклеточного матрикса, и нередко отмечается сочетание этих явлении [8]. Наиболее значимыми факторами роста для миомы являются трансформирующий фактор роста-бета (ТФР-бета), стимулирующее влияние на продукцию которого оказывает также и прогестерон. Эстрогены действуют и на межклеточный матрикс, оказывая непосредственное стимулирующее влияние на коллаген типа I и III и протеин коннексин-43 щелевидных межклеточных контактов [14].
Таким образом, стероидные гормоны могут оказывать стимулирующее влияние на пролиферацию опухолевой ткани путем воздействия и на местные факторы роста, продуцируемые гладкомышечными клетками и фибробластами [14, 25]. Влияние медиаторов различных факторов клеточного роста, также как и половых стероидов, осуществляется через клеточные рецепторы, концентрация и чувствительность которых играют важную роль в регуляции опухолевого роста. Основными модуляторами клеточного роста, обладающими выраженными митогенными свойствами на миометрий и ткань миомы, являются ИПФР-1, эпидермальный фактор роста (ЭФР), ТФР-бета и группа ангиогенных факторов роста. В настоящее время ангиогенез рассматривается как ключевой фактор в развитии опухолевых процессов. Это касается и роли ангиогенеза в патогенезе миомы матки. Основными индукторами процесса ангиогенеза являются сосудистый эндотелиальный фактор роста (СЭФР-А), ангиогенин и основной фактор роста фибробластов (ФРФ-2).
Противоположным действием на ангиогенез и, следовательно, ограничивающим рост опухолевой ткани обладают ингибиторы ангиогенеза. Одним из основных является эндостатин, который является не только мощным ингибитором ангиогенеза, но и специфическим ингибитором пролиферации клеток эндотелия. СЭФР — является важнейшим фактором, определяющим процессы образования новых сосудов и повышенную сосудистую проницаемость. Гипоксия ткани внутри миоматозного узла стимулирует экспрессию СЭФР и, таким образом, вызывает отек узла, что обусловлено способностью СЭФР повышать проницаемость сосудов [38]. Экспрессия СЭФР в тканях матки и яичников может регулироваться гормональным путем — половыми стероидами. Следует отметить, что ТФР-бета и ФРФ могут являться и факторами, модулирующими рост сосудов; ФРФ являются потенциальными митогенами, в то время как ТФР-бета — выраженный ингибитор пролиферации клеток эндотелия. Полагают, что ФРФ стимулируют ангиогенез, непосредственно воздействуя на эндотелиальные клетки, в то время как ТФР-бета оказывает опосредованное непрямое влияние, стимулируя другие клеточные типы к выделению факторов, стимулирующих клетки эндотелия.
Процессы ангиогенеза в миомах неразрывно связаны с морфогенезом этих опухолей и в значительной степени определяют особенности возникновения, характер роста и клинико-морфологические варианты (простая и пролиферирующая миома матки), и, по мнению ряда авторов, методы лечения миомы матки в перспективе должны быть связаны с возможностью воздействия на процессы ангиогенеза [6, 14].
Следовательно, половые стероиды осуществляют регуляцию роста миомы посредством комплекса факторов, регулирующих пролиферацию, апоптоз и ангиогенез в опухолевой ткани.
Таким образом, многочисленные исследования, посвященные патогенезу данного заболевания, выявили ряд факторов роста и рецепторов, влияющих на пролиферацию гладкомышечных клеток, апоптоз, продукцию межклеточного вещества, на пролиферацию и миграцию эндотелиоцитов, играющих важную роль в процессе развития опухоли. Полученные научные данные внесли не только определенную ясность в понимание механизмов влияния половых стероидов на рост миомы матки, но наметили новые направления в медикаментозном лечении.
Диагностика. Клиника
Основными инструментальными методами диагностики миомы матки являются ультразвуковое исследование (УЗИ), значительно реже — компьютерная томография (КТ) и магнитно-резонансная томография (МРТ). В последние два десятилетия гистероскопия и лапароскопия обеспечили новый метод диагностики и лечения миомы матки. Информативным методом распознавания субмукозной и интерстициальной с центропетальным ростом миомы матки является гистероскопия (точность достигает 99,2%). Достоинство метода — возможность одновременной биопсии эндометрия, с целью диагностики сопутствующих гиперпластических процессов. Лапароскопия используется преимущественно при необходимости дифференциальной диагностики миомы и опухоли яичника, а также для распознавания вторичных изменений в миоматозных узлах, являющихся противопоказанием к консервативной терапии.
У половины пациентов болезнь протекает бессимптомно и диагностируется только при гинекологическом или ультразвуковом исследовании. Но у каждой второй женщины возникают симптомы заболевания, которые ухудшают качество жизни и требуют лечения. Симптомы зависят от количества, размеров и расположения миоматозных узлов, а также от степени вторичных дегенеративных и воспалительных изменений в ткани узлов. Основные симптомы лейомиомы матки: 1) обильные, длительные менструации и/или ациклические кровотечения, которые сопровождаются слабостью, утомляемостью, приводят к развитию железодефицитной анемии, 2) тянущие боли внизу живота (у 20–30% больных), очень редко возникают острые боли, связанные с нарушением кровотока в миоматозных узлах, и сопровождаются повышением температуры, слабостью, 3) при больших размерах лейомиомы матки может происходить давление на соседние органы: мочевой пузырь, прямую кишку, что проявляется учащенным мочеиспусканием, запорами, 4) бесплодие, невынашивание беременности, осложнения во время родов наблюдаются у каждой третьей пациентки с множественными миомами.
Тактика ведения
Несмотря на то, что миома матки является наиболее часто выявляемым заболеванием, в тактике ведения больных данной патологией остается много нерешенных вопросов и противоречий. В разных странах имеются различные подходы к лечению заболевания, отличаются и показания к радикальным операциям. Тактика ведения больных миомой матки включает три основных направления: выжидательное, консервативное и активное воздействие на опухоль.
Выжидательное ведение больных с миомой матки возможно только при отсутствии симптоматики и небольших по размеру (до 10–12 недель) опухолях при реализованной репродуктивной функции и заключается в активном амбулаторном наблюдении: динамическое ультразвуковое исследование, цитологический контроль состояния эпителия шейки матки и эндометрия, определение уровня онкомаркеров. Однако, учитывая частоту встречаемости сопутствующей патологии при миоме матки, только у небольшого числа пациентов мы можем ограничиться выжидательной тактикой ведения.
Консервативное ведение больных миомой матки заключается преимущественно в гормональном лечении, хотя в последние годы предложены противофибротические средства, антиангиогенные, аналоги соматостатина (в настоящий момент эти препараты находятся на стадии клинических испытаний). Среди гормональных препаратов несомненное лидерство принадлежит аналогам гонадолиберина и антигестагенному препарату — мифепристону (RU 486). Эти препараты используются как в качестве самостоятельного лечения, показания к которому четко определены, так и в качестве адъювантной терапии, имеющей определенные преимущества и недостатки.
Активная тактика ведения больных с миомой матки делится на два основных направления: хирургическое лечение и малоинвазивные вмешательства. Хирургический метод продолжает оставаться основным методом лечения данной категории больных — до 80% больных подвергаются гистерэктомии или миомэктомии. Однако многие женщины в наше время стремятся отложить деторождение на более поздний возраст, когда, к сожалению, значительно чаще развивается лейомиома матки. Поэтому совершенствование медикаментозного лечения и малоинвазивных, органосохраняющих технологий является основной тенденцией в современных условиях.
Методы лечения
Поиск и применение новых лекарственных средств и малоинвазивных технологий, приближающихся по эффективности к гистерэктомии и не вызывающих побочных эффектов, является альтернативным лечением миомы матки.
В настоящее время можно выделить три основных подхода к лечению миомы матки.
Традиционно терапевтическое лечение миомы матки основывается на воспроизведении медикаментозной псевдоменопаузы и/или индукции гипоэстрогении. Медикаментозная терапия в качестве монотерапии, как правило, назначается пациенткам при бессимптомном течении заболевания и при небольших (соответствующих менее 12 нед беременности) размерах опухоли [1, 15, 16). На протяжении довольно длительного времени использовались гестагены: норэтистерон (Норколут, Примолют-нор), дидрогестерон (Дюфастон) и др. Однако результаты лечения были малоэффективны. Основываясь на прогестероновой гипотезе развития миомы матки, малоэффективные результаты лечения производными прогестерона вполне объяснимы. В настоящее время применение гестагенов оправдано только при сочетании миомы матки (небольших размеров) с гиперпластическими процессами эндометрия и аденомиозом у женщин позднего репродуктивного или пременопаузального периода при постоянном динамическом наблюдении. Современное медикаментозное лечение включает применение агонистов гонадотропин-релизинг гормона (аГн-РГ) либо в качестве долгосрочной монотерапии, либо как этап комбинированного метода [15, 16].
Однако при несомненной эффективности этих препаратов, даже при минимальном курсе лечения (3–4 месяца), они обладают выраженным побочным действием, связанным с развитием эстроген-дефицитного состояния. Механизм действия этих препаратов заключается в подавления гонадотропной функции гипофиза, вследствие которой развивается гипоэстрогения и блокада продукции прогестерона. Очевидно, агонисты гонадолиберина действуют непосредственно и на опухолевую ткань, что подтверждается наличием рецепторов к гонадолиберину, снижением уровня рецепторов к эпидермальному фактору роста, подавлением продукции ТФР-бета и пролактина непосредственно в ткани лейомиомы матки (при лечении этими препаратами). Возможна также непосредственная стимуляция аналогами гонадолиберина процессов апоптоза в опухолевой ткани, что подтверждается повышением экспрессии рецепторов Fas и их лигандов (маркеры апоптоза). Десенситизация гипофиза и подавление функции яичников приводят к уменьшению объема матки и лейомиомы примерно на 50–65% и прекращению меноррагий, благодаря развитию аменореи, что позволяет скорректировать анемию до операции. Оптимальным режимом введения данных препаратов является короткий 3–4-месячный курс с ежемесячными инъекциями. Важной особенностью действия аГн-РГ является снижение кровоснабжения узлов, что стимулирует процесс апоптоза, а также уменьшает кровопотерю и сокращает длительность оперативного вмешательства. Побочные эффекты аГн-РГ связаны с гипоэстрогенией, проявляющейся вазомоторными симптомами, снижением минеральной плотности костной ткани, что ограничивает длительность приема и требует корригирующей терапии.
Принципиально новым препаратом, применяемым при лечении больных с миомой матки, является антипрогестин — мифепристон. Мифепристон — это синтетический стероид, обладающий одновременно антипрогестероновой и антиглюкокортикоидной активностью. Механизм действия заключается в связывании с прогестероновыми рецепторами, вследствие чего блокируется их функция. Суточная доза препарата — 50 мг в течение трех месяцев перорально, непрерывно. Эффективность препарата сравнима с эффективностью аналогов гонадолиберина — на 40–49% уменьшаются размеры матки и узлов. Основная особенность действия этого препарата — отсутствие гипоэстрогении, поэтому не наблюдается ни вазомоторных симптомов, ни снижения минеральной плотности костной ткани. У большинства женщин с миомой матки развивается аменорея при 3-месячном и более длительном курсе лечения. Первоначально мифепристон у больных с миомой матки применялся в качестве предоперационной подготовки, что являлось вполне обоснованным, так как при минимальных побочных эффектах (слабые приливы, тошнота) удается добиться снижения размеров опухоли и уменьшения менометроррагий. В настоящее время проводятся научные исследования по применению этого препарата и в качестве единственного метода лечебного воздействия в более длительном режиме [10, 22, 23].
Недавно предложены совершенно новые подходы к лечению миомы матки — блокирование действия специфических факторов роста [16, 28]. Действие одной группы препаратов (так называемая антифибротическая терапия) основывается на том, что лейомиомы содержат большое количество внеклеточного матрикса, состоящего из фибронектина, коллагена типа 1, 3 и протеогликанов. Доказано, что ТФР-бета и ФРФ увеличивают продукцию межклеточного вещества гладкомышечными клетками и снижают образование коллагеназы. Пирфенидон — антифиброзный препарат, ингибирует синтез ДНК, клеточную пролиферацию и продукцию коллагена в гладкомышечных клетках лейомиомы и нормального миометрия, вызванную вышеназванными факторами роста. Этот препарат обладает дозозависимым действием, минимальным количеством побочных эффектов и не оказывают токсического воздействия на гладкомышечные клетки. (В настоящее время проводятся клинические испытания.)
Действие другой группы препаратов основывается на ингибировании ангиогенеза [6, 14, 16]. Несколько факторов роста принимают участие в процессе ангиогенеза: ФРФ, ТФР, СЭФР (последний является важнейшим, так как синтезируется большинством линий опухолевых клеток и обладает многосторонним влиянием). Двумя основными механизмами эти факторы роста индуцируют рост лейомиомы матки: первый — усиление пролиферации, миграции гладкомышечных клеток сосудов и эндотелиоцитов; второй — стимуляция формирования кровеносных сосудов. Пока только единственный препарат, обладающий ингибирующим влиянием на ангиогенез, — интерферон-альфа прошел клиническое испытание на 20 больных с лейомиомой матки. Показано достоверное уменьшение объема образования уже после первой недели лечения. Таким образом, ингибирование ангиогенеза, посредством воздействия на перечисленные факторы роста, представляет собой одну из наиболее перспективных стратегий лечения лейомиомы матки.
Следовательно, для большинства пациентов более привлекательным остается медикаментозное лечение в качестве единственного метода. Поэтому поиск новых лекарственных средств, позволяющих избежать оперативное вмешательство и в то же время не приводящих к выраженным побочным эффектам, поможет решить важную проблему женского здоровья.
Другим направлением в органосберегающих методах лечения миомы матки, которые бы при высокой эффективности обладали и максимальной (достаточной) безопасностью, стала разработка в конце 90-х годов нового неинвазивного хирургического метода, который получил название «Неинвазивная абляция миомы матки воздействием фокусированного ультразвука (ФУЗ) под контролем ядерно-магнитно-резонансной томографии».
Об эффективности и безопасности ФУЗ-МРТ-абляции сообщали C. M. Tempany и соавт. (2000), Rabinovici J. и соавт. (2002), а Jolesz F. A., Hynynen K. (2002) назвали метод ФУЗ «идеальной операцией». Технология ФУЗ-МРТ представляет собой сочетание высокоинтенсивного фокусированного ультразвука, луч которого неинвазивно нагревает выбранные участки ткани миомы и вызывает их термический некроз, и магнитно-резонансной томографии. Звуковые волны проходят сквозь ткани, не вызывая их повреждения, и за счет фокусировки волн происходит локальный нагрев ткани миомы до 55–90 °С, что вызывает термическую коагуляцию в четко ограниченной области, не оказывая никакого вредного воздействия на окружающие ткани, т. е. ФУЗ-МРТ-абляция обеспечивает локальный селективный коагуляционный некроз в малом объеме ткани (в точке фокуса), что используется для прецизионной неинвазивной абляции опухолей.
Процесс лечения состоит в последовательных воздействиях (так называемых соникаций) на небольшие фрагменты опухоли, что приводит к нагреванию их и селективному коагуляционному некрозу. Механизм действия ФУЗ-абляции включает как прямое, так и опосредованное повреждающее воздействие. Прямое — это термическое воздействие за счет высвобождения энергии звуковой волны. Опосредованное — за счет изменения локального кровотока и нарушения питания опухолевой ткани. Доказано, что при нагревании ткани до 60 °С в течение 1 секунды происходит гибель всех клеток за счет их дегидратации, повреждения сосудистых структур, денатурации белков и разрушения коллагеновых волокон. Иммуногистохимические исследования показали, что данный метод вызывает летальное или сублетальное повреждение опухолевой ткани и исчезновение ее пролиферативной активности, при этом избирательность воздействия и полная безопасность ФУЗ для интактных тканей, окружающих миому, обусловлены также разницей в перфузии крови в миоматозном узле по сравнению с нормальным миометрием и преимущественным расположением сосудов по периферии узла миомы.
ФУЗ-МРТ-абляция особенно эффективна для лечения миомы матки вследствие высокого содержания экстрацеллюлярного матрикса, хорошо поглощающего тепло. Для доброкачественной опухоли нет необходимости элиминации каждой ее клетки, поэтому достаточно произвести коагуляцию в отдельных точках внутри миомы, что позволяет сократить объем миоматозных узлов и матки и тем самым уменьшить меноррагии, боли и давление на соседние органы малого таза, значительно улучшить качество жизни.
Продолжительность процедуры ФУЗ-абляции зависит от объема и количества узлов и в среднем составляет 3–4 часа. Эта процедура проводится амбулаторно, без общей анестезии, во время нее пациентка находится в сознании. После лечения пациентки обычно наблюдаются в стационаре в течение двух часов, что обусловлено только периодом действия седативных препаратов премедикации, и на следующий день уже трудоспособны.
Показаниями к ФУЗ-МРТ-абляции миомы матки являются: меноррагии, болевой синдром, симптомы сдавления соседних органов, размеры миоматозных узлов от 2 до 15 см, интерстициально-субсерозные, интерстициальные и интерстициально-субмукозные узлы, при количестве миоматозных узлов не более 5.
Противопоказаниями для ФУЗ-МРТ-абляции миомы следующие: субсерозные миомы на ножке, сочетанная гинекологическая патология — воспалительные процессы в малом тазу, бесплодие, образования в яичниках, гиперплазия эндометрия; онкологические заболевания, нереализованная репродуктивная функция, размеры миоматозных узлов менее 2 см, выраженное retroflexio-versio матки, грубые послеоперационные рубцы на передней брюшной стенке, ожирение II–III степени, тяжелые аллергические реакции на контрастные вещества, а также клаустрофобия, наличие крупных ферромагнитных имплантантов, наличие искусственных водителей ритма сердца (противопоказания для проведения МРТ).
Индивидуализация применения ФУЗ-МРТ-абляции миомы матки заключается в определении «доступности» миоматозных узлов для фокусированного ультразвука (предпочтительна локализация узлов по передней стенке и в дне матки), определении МРТ-типов миомы, необходимости проведения дополнительных манипуляций (висцеральный массаж, наполнение мочевого пузыря физиологическим раствором и т. д.), при этом интраоперационная эффективность ФУЗ-МРТ-абляции миомы снижается.
Обычно проводится либо «малая» процедура, при которой абляции подвергается около 30–35% объема миоматозного узла, либо «большая» — коагулируется не менее 70% объема. После «малой» процедуры не происходит значительного уменьшения размеров опухоли, тем не менее в 80% случаев отмечается значительная положительная динамика, исчезновение жалоб, болей и прекращение кровотечений. Кроме того, снижается пролиферативная активность миомы, и рост узлов прекращается. Это объясняется уменьшением плотности ткани после ФУЗ-МРТ-абляции — узлы становятся более «мягкими» и не оказывают выраженного давления на окружающие ткани. В настоящее время проводится лечение миом матки диаметром до 9 см, а в случае большого размера миомы — предварительная гормональная терапия в течение трех месяцев, с целью сокращения узлов и возможности проведения процедуры. Группой исследователей из США изучена безопасность и эффективность операций фокусированным ультразвуком под контролем МРТ для неинвазивного лечения лейомиомы матки [3, 24]. Согласно этим данным происходит уменьшение миомы через 3 мес на 37%, через 6 мес на 48% [19, 24]. За последние 2 года получено 30 беременностей у женщин, перенесших ФУЗ-МРТ-абляцию миомы матки и 13 родов без осложнений [26]. Среди осложнений ФУЗ-МРТ-абляции выделяют незначительную воспалительную реакцию (субфебрильная температура) и ожог I степени.
Таким образом, ФУЗ-МРТ-абляция имеет определенные преимущества по сравнению с малоинвазивными и инвазивными методами лечения: