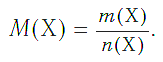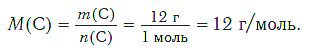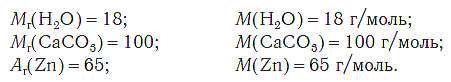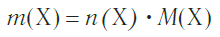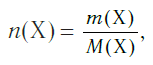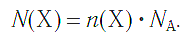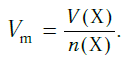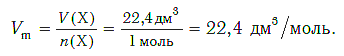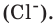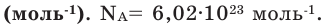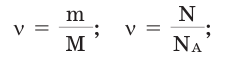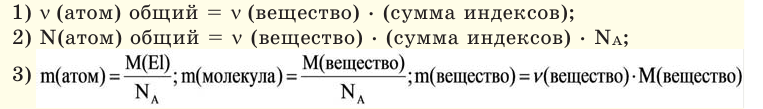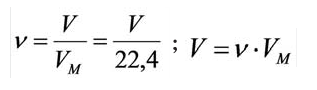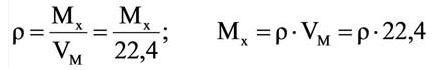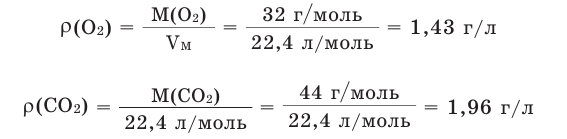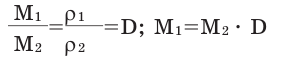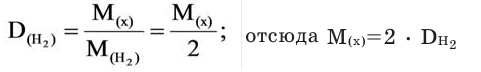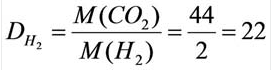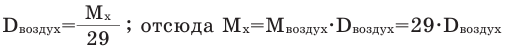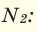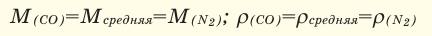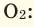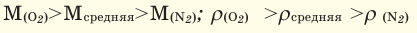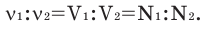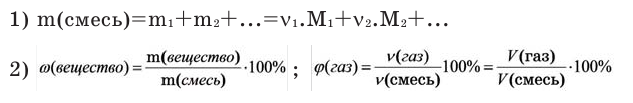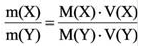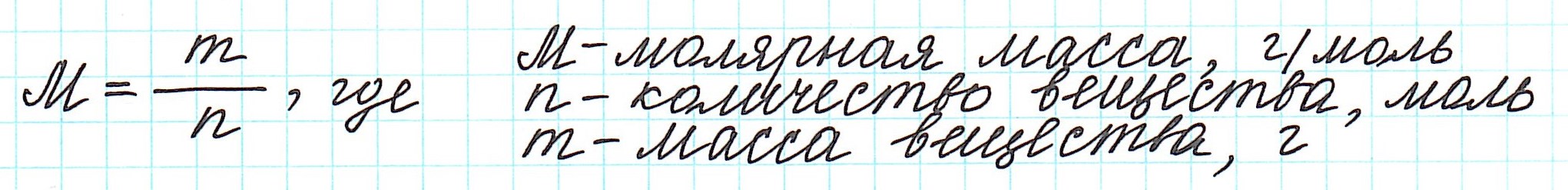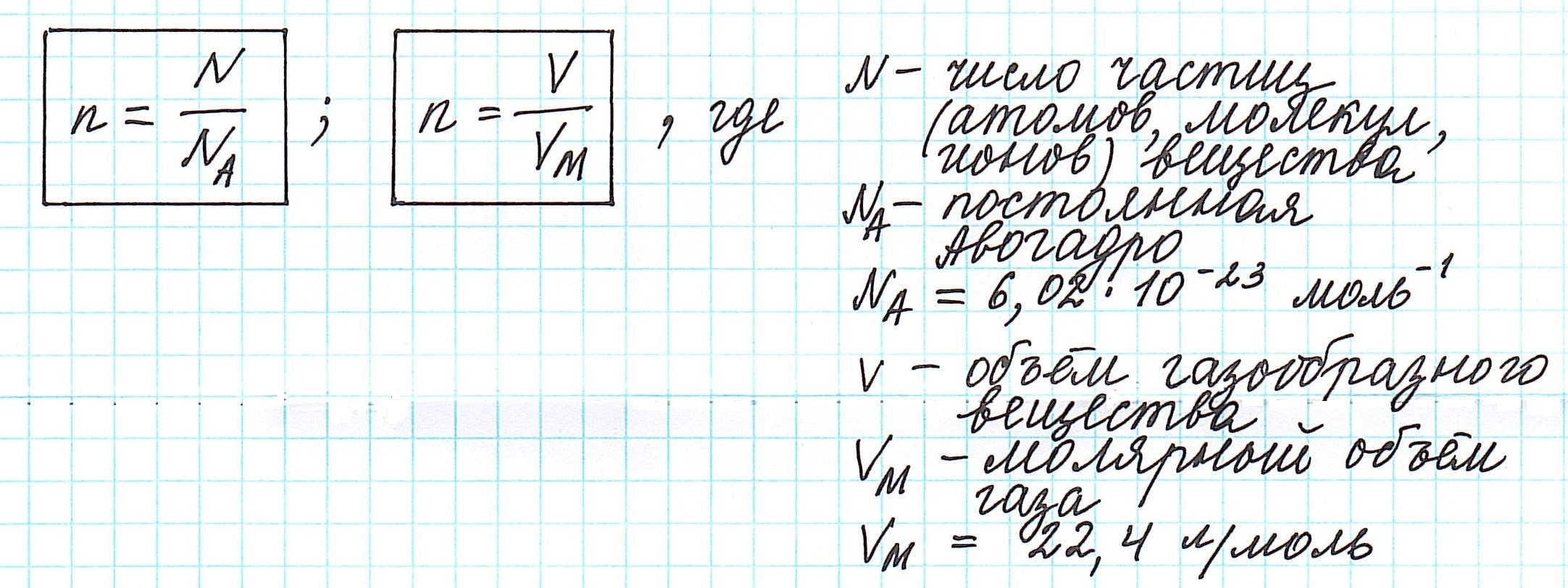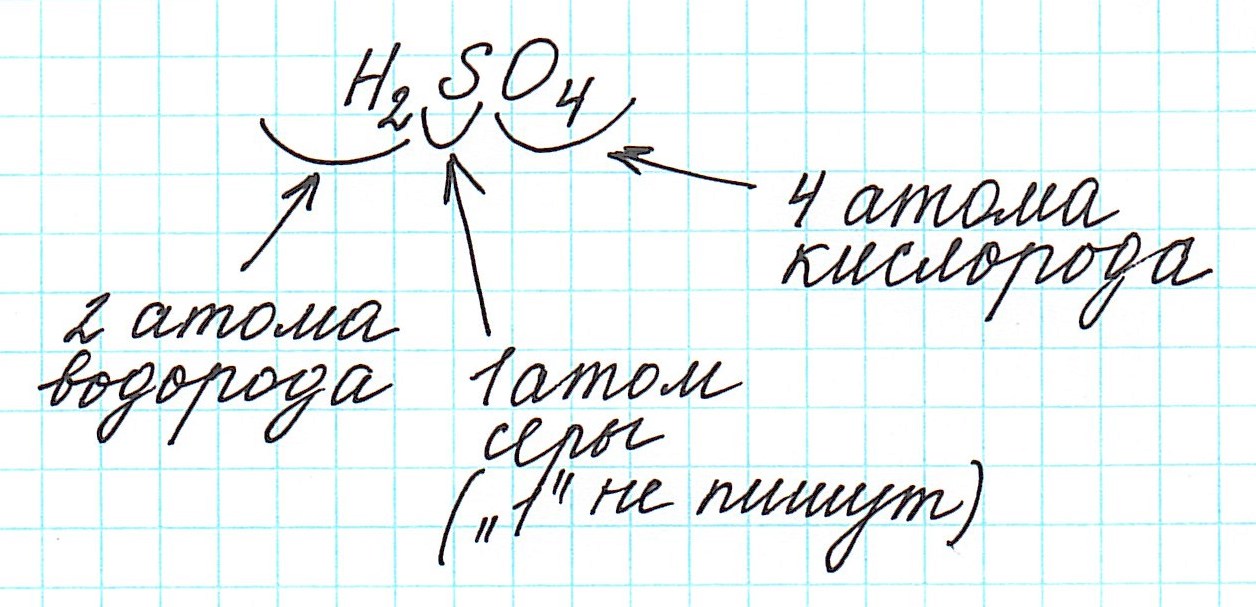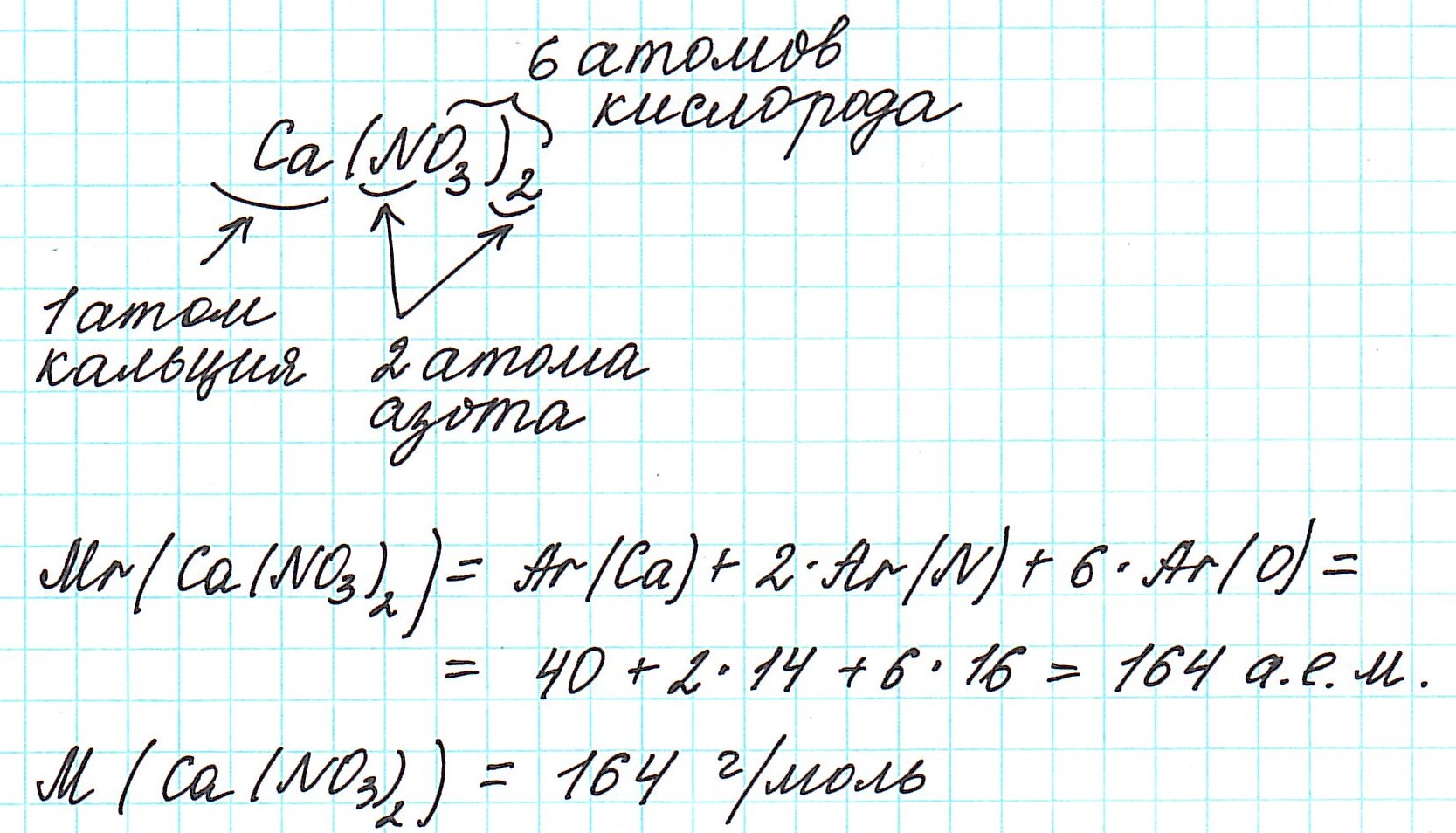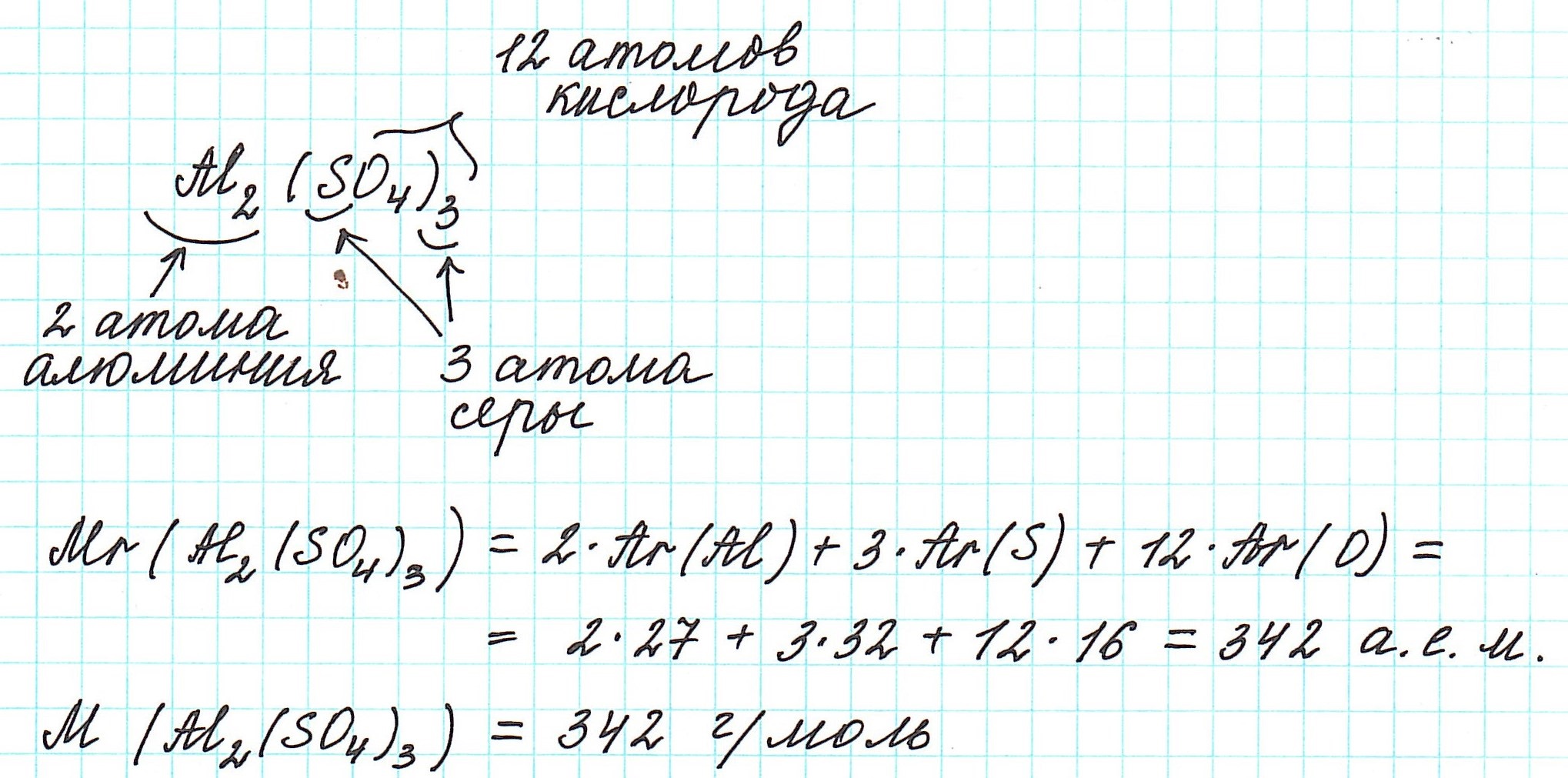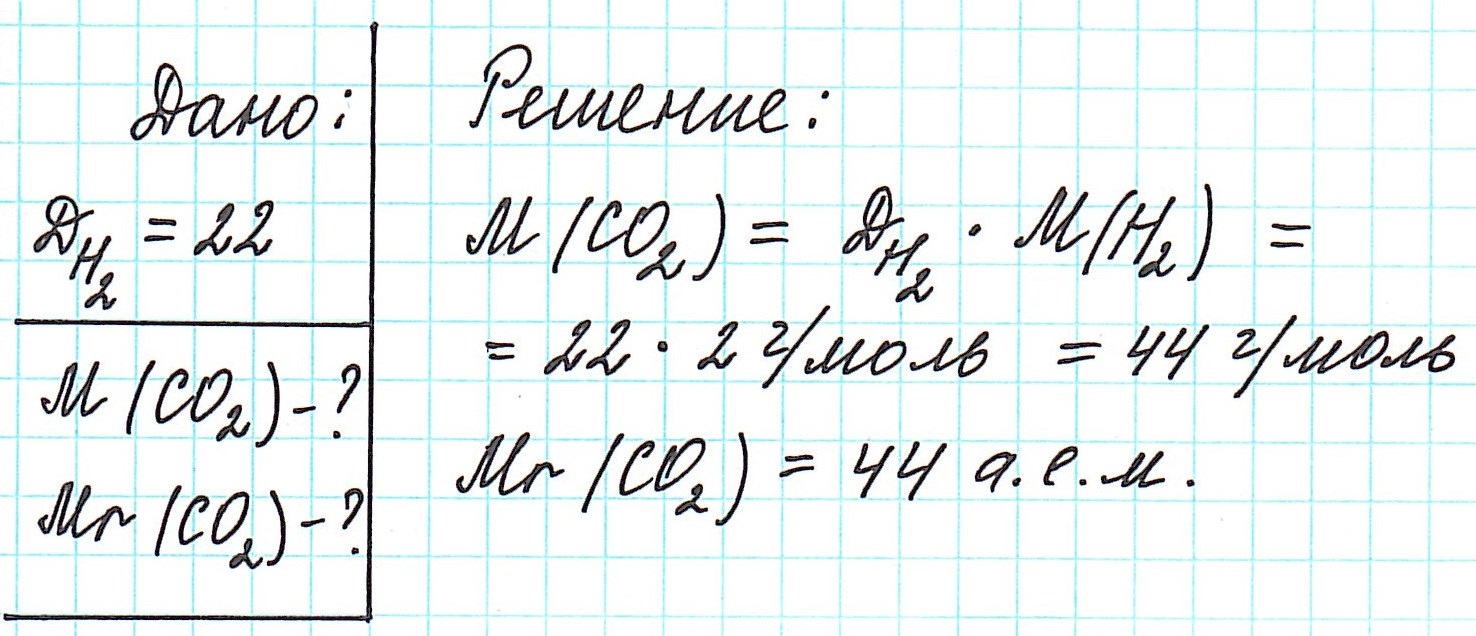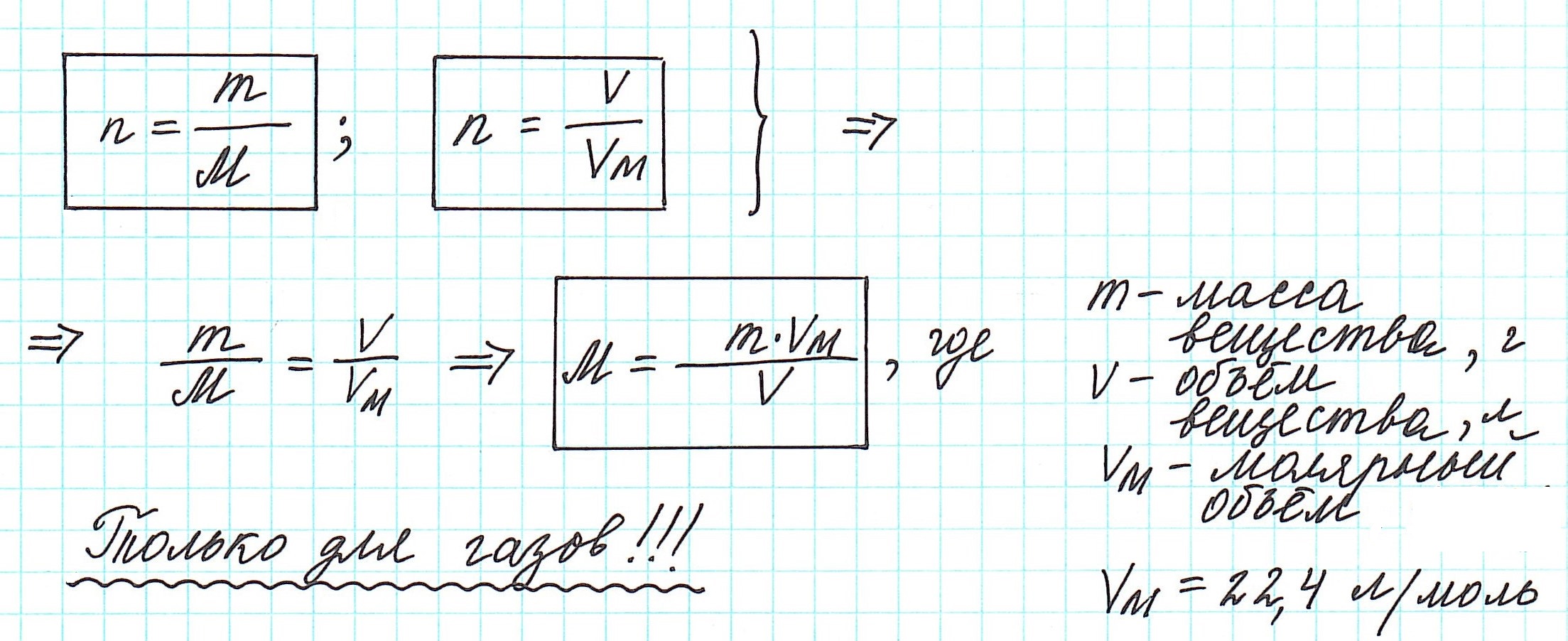Как определить молярную массу вещества
Как определить молярную массу вещества
Молярная масса

Средняя оценка: 4.2
Всего получено оценок: 798.
Средняя оценка: 4.2
Всего получено оценок: 798.
Атомы и молекулы – мельчайшие частицы вещества, поэтому в качестве единицы измерения можно выбрать массу одного из атомов и выражать массы других атомов в соотношении с выбранной. Так что же такое молярная масса, и какова ее размерность?
Что такое молярная масса?
Основоположником теории атомных масс был ученый Дальтон, который составил таблицу атомных масс и принял массу атома водорода за единицу.
Молярная масса – это масса одного моля вещества. Моль, в свою очередь, – количество вещества, в котором содержится определенное количество мельчайших частиц, которые участвуют в химических процессах. Количество молекул, содержащихся в одном моле, называют числом Авогадро. Эта величина является постоянной и не изменяется.
Таким образом, молярная масса вещества – это масса одного моля, в котором находится 6,02*10^23 элементарных частиц.
Число Авогадро получило свое название в честь итальянского ученого Амедео Авагадро, который доказал, что число молекул в одинаковых объемах газов всегда одинаково
Молярная масса в Международной системе СИ измеряется в кг/моль, хотя обычно эту величину выражают в грамм/моль. Эта величина обозначается английской буквой M, а формула молярной массы выглядит следующим образом:
где m – масса вещества, а v – количество вещества.

Как найти молярную массу вещества?
Вычислить молярную массу того или иного вещества поможет таблица Д. И. Менделеева. Возьмем любое вещество, например, серную кислоту.Ее формула выглядит следующим образом: H2 SO4. Теперь обратимся к таблице и посмотрим, какова атомная масса каждого из входящих в состав кислоты элементов. Серная кислота состоит из трех элементов – водород, сера, кислород. Атомная масса этих элементов соответственно – 1, 32, 16.
Молярная масса вещества численно равна относительной молекулярной массе, если структурными единицами вещества являются молекулы. Молярная масса вещества также может быть равна относительной атомной массе, если структурными единицами вещества являются атомы.
Вплоть до 1961 года за атомную единицу массы принимали атом кислорода, но не целый атом а его 1/16 часть. При этом химическая и физическая единицы массы не были одинаковыми. Химическая была на 0,03% больше, чем физическая.
В настоящее время в физике и химии принята единая система измерения. В качестве стандартной е.а.м. выбрана 1/12 часть массы атома углерода.

Молярная масса любого газа или пара измеряется очень легко. Достаточно использовать контроль. Один и тот же объем газообразного вещества равен по количеству вещества другому при одинаковой температуре. Известным способом измерения объема пара является определение количество вытесненного воздуха. Такой процесс осуществляется с использованием бокового отвода, ведущего к измерительному устройству.
Понятие молярной массы является очень важным для химии. Ее расчет необходим для создания полимерных комплексов и множества других реакций. В фармацевтике с помощью молярной массы определяют концентрацию данного вещества в субстанции. Также молярная масса важна при провидении биохимических исследований (обменный процесс в элементе).
В наше время благодаря развитию науки известны молекулярные массы практически всех составляющих крови, в том числе и гемоглобина.
Что мы узнали?
В 8 классе по химии важной темой является «молярная масса вещества». Молярная масса – важное физическое и химическое понятие. Молярная масса — характеристика вещества, отношение массы вещества к количеству молей этого вещества, то есть масса одного моля вещества. измеряется она в кг/моль или грамм/моль.
Урок 5. Моль и молярная масса
В уроке 5 «Моль и молярная масса» из курса «Химия для чайников» рассмотрим моль как единицу измерения количества вещества; дадим определение числу Авогадро, а также научимся определять молярную массу и решать задачи на количество вещества. Базой для данного урока послужат основы химии, изложенные в прошлых уроках, так что если вы изучаете химию с нуля, то рекомендую их просмотреть хотя бы мельком.
Единица измерения количества вещества
До этого урока мы обсуждали лишь индивидуальные молекулы и атомы, а их массы мы выражали в атомных единицах массы. В реальной жизни с индивидуальными молекулами работать невозможно, потому что они ничтожно малы. Для этого химики взвешивают вещества ни в а.е.м., а в граммах.
Чтобы перейти от молекулярной шкалы измерения масс в лабораторную шкалу, используют единицу измерения количества вещества под названием моль. 1 моль содержит 6,022·10 23 частиц (атомов или молекул) и является безразмерной величиной. Число 6,022·10 23 носит название Число Авогадро, которое определяется как число частиц, содержащихся в 12 г атомов углерода 12 C. Важно понимать, что 1 моль любого вещества содержит всегда одно и то же число частиц (6,022·10 23 ).
Молярная масса вещества
Молярная масса – это масса 1 моля вещества, выраженная в граммах. Молярную массу одного моля любого химического элемента без труда находят из таблицы Менделеева, так как молярная масса численно равна атомной массе, но размерности у них разные (молярная масса имеет размерность г/моль). Запишите и запомните формулы для вычисления молярной массы, количества вещества и числа молекул:
где m — масса вещества, n — количество вещества (число молей), М — молярная масса, N — число молекул, NA — число Авогадро. Благодаря молярной массе вещества химики могут вести подсчет атомов и молекул в лаборатории просто путем их взвешивания. Этим и удобно использование понятия моль.
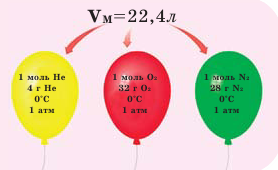
На рисунке изображены четыре колбы с различными веществами, но в каждой из них всего 1 моль вещества. Можете перепроверить, используя формулы выше.
Задачи на количество вещества
Пример 1. Сколько граммов Н2, Н2O, СН3ОН, октана (С8Н18) и газа неона (Ne) содержится в 1 моле?
Решение: Молекулярные массы (в атомных единицах массы) перечисленных веществ приведены в таблице Менделеева. 1 моль каждого из названных веществ имеет следующую массу:
Поскольку массы, указанные в решении примера 1, дают правильные относительные массы взвешиваемых молекул, указанная масса каждого из перечисленных веществ содержит одинаковое число молекул. Этим и удобно использование понятия моля. Нет даже необходимости знать, чему равно численное значение моля, хотя мы уже знаем, что оно составляет 6,022·10 23 ; эта величина называется числом Авогадро и обозначается символом NA. Переход от индивидуальных молекул к молям означает увеличение шкалы измерения в 6,022·10 23 раз. Число Авогадро представляет собой также множитель перевода атомных единиц массы в граммы: 1 г = 6,022·10 23 а.е.м. Если мы понимаем под молекулярной массой массу моля вещества, то ее следует измерять в граммах на моль; если же мы действительно имеем в виду массу одной молекулы, то она численно совпадает
с молекулярной массой вещества, но выражается в атомных единицах массы на одну молекулу. Оба способа выражения молекулярной массы правильны.
Пример 2. Сколько молей составляют и сколько молекул содержат 8 г газообразного кислорода O2?
Решение: Выписываем из таблицы Менделеева атомную массу атома кислорода (O), которая равна 15,99 а.е.м, округляем до 16. Так как у нас молекула кислорода, состоящая из двух атомов O, то ее атомная масса равна 16×2=32 а.е.м. Хорошо, а теперь переводим ее в молярную массу: 32 а.е.м = 32 г/моль. Это означает, что 1 моль (6,022·10 23 молекул) O2 имеет массу 32 грамма. Ну и в заключении по формулам выше находим количество вещества (моль) и число молекул, содержащихся в 8 граммах O2:
Пример 3. 1 молекула Н2 реагирует с 1 молекулой Сl2, в результате чего образуются 2 молекулы газообразного хлористого водорода НСl. Какую массу газообразного хлора необходимо использовать, чтобы он полностью прореагировал с 1 килограммом (кг) газообразного водорода?
Решение: Молекулярные массы H2 и Cl2 равны 2,0160 и 70,906 г/моль соответственно. Следовательно, в 1000 г H2 содержится
Даже не выясняя, сколько молекул содержится в одном моле вещества, мы можем быть уверены, что 496 моля Cl2 содержат такое же число молекул, как и 496,0 моля, или 1000 г, H2. Сколько же граммов Cl2 содержится в 496 молях этого вещества? Поскольку молекулярная масса Cl2 равна 70,906 г/моль, то
Пример 4. Сколько молекул H2 и Cl2 принимает участие в реакции, описанной в примере 3?
Решение: В 496 молях любого вещества должно содержаться 496 моля × 6,022·10 23 молекул/моль, что равно 2,99·10 26 молекул.
Чтобы наглядно показать, сколь велико число Авогадро, приведем такой пример: 1 моль кокосовых орехов каждый диаметром 14 сантиметров (см) мог бы заполнить такой объем, какой занимает наша планета Земля. Использование молей в химических расчетах рассматривается в следующей главе, но представление об этом пришлось ввести уже здесь, поскольку нам необходимо знать, как осуществляется переход от молекулярной шкалы измерения масс к лабораторной шкале.
Надеюсь урок 5 «Моль и молярная масса» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.
Молярная, молекулярная и атомная массы
Молярная масса (для обозначения в формулах используется буква М) — характеристика вещества, отражающая количество граммов, которое содержится в одном его моле. Измеряется эта величина в г/моль. Интересно, что в Международной системе единиц указано, что параметр должен выражаться в кг/моль. Но г/моль является более удобной единицей измерения, поэтому именно она обычно используется на практике.
За единицу отсчёта атом элемента был взят за нейтральность и широкую распространённость в природе его изотопа. Но учёные не сразу ориентировались на углерод. Сначала были попытки создания водородной шкалы исходя из того, что водород наиболее лёгкий элемент, потом — кислородной. Но когда оказалось, что в природе это вещество является смесью изотопов с массой от 16 до 18, единица стала неприемлемой, поэтому её заменили углеродной.
С массой атомной молярная тоже может быть одинаковой, если простое вещество состоит из одного атома. Для каждого элемента её легко определить по таблице Менделеева — вместе с порядковым номером она указана в ячейке.
Определение атомной массы для каждого химического элемента было непростой задачей. Для этого учёные взвешивали все существующие в земной коре изотопы и вычисляли их среднее значение с учётом процентной распространённости в природе. Что касается синтетических элементов, то их определяли по наиболее стабильному изотопу.
Определение в сложных веществах
Для простых веществ, состоящих из одного атома, параметр считается так же, как для элемента. Молярная масса углерода всегда равна 12. Этот показатель справедлив и для натрия. Как простое вещество, этот мягкий серебристо-белый металл содержит в себе 23 г/моль, а купрум (так на латинском обозначается медь) — 63,5 г/моль. Газ также может состоять из одного элемента, например, гелий, искомый параметр которого 4 г/моль.
Но существуют и газы, которые образованы двумя молекулами (водород, азот, кислород, хлор, фтор и другие) или тремя (озон). Для них нужно не забывать умножать атомную массу на число молекул. Для сложных веществ параметр можно рассчитать аналогичным образом:
Исходя из этого, формулу молярной массы можно вывести следующим образом: М (XxYy) = М (Хx) + М (Yy) = x * М (Х) + y * М (Y). Таким образом, вычислить этот параметр для любого органического или неорганического вещества совсем несложно.
Главное, иметь под рукой таблицу Менделеева, тогда никакие онлайн-калькуляторы не потребуются.
Расчёты в смеси
Задачу можно усложнить, попробовав посчитать этот показатель в смеси, где в разных пропорциях входят различные соединения. Идеальным примером для этого является воздух. В нем можно выделить следующие составляющие:
Искомый параметр будет вычисляться следующим образом: 0,23*32+0,76*28+0,01*40. Результат равен 29,04 г/моль (можно округлить до 29).
Конечно, в воздухе содержатся и другие вещества (углекислый и инертные газы, водород и т. д. ), но их масса составляет менее десятой процента, поэтому для простоты их допускается не учитывать.
Применение в химических задачах
С этим параметром связано множество других формул. Зная его, можно вычислить количество вещества (n). Для этого нужно разделить его фактическую массу на молярную (n = m / M). Чтобы узнать число частиц в нём (N), полученное значение n нужно умножить на константу Авогадро (N A). Получается 6,02*10 23 (N = n * N A) Именно столько структурных единиц содержится в одном моле любого соединения или простого вещества. С другой стороны, зная показатель n, можно найти m по формуле n * M. В итоге получается ещё одна формула: M = m / n.
В учебнике может ждать такая задача: «Найдите массу 0,75 моль азота N2». Начать нужно с нахождения массы одного атома азота. По таблице Менделеева она равняется 14 г. Молекула состоит из двух атомов, следовательно, масса одного моля азота как простого вещества будет иметь значение 28, а масса 0,75 моль — 21 грамм.
Не менее распространена в мире химии физическая величина под названием молярный объём (V m). Её получают как отношение молярной массы к плотности вещества (M /ρ). Размерность этой величины — м 3 /моль или л/моль (кубический метр или литр на моль). В стандартных условиях для идеального газа её значение принимается за 22,41. Конечно, в реальных условиях наблюдаются отклонения от этого значения, но для решения задач ими можно пренебречь, поскольку они минимальны.
Величину для газа можно найти по формуле M = V m * ρ. Но более правильным будет вычислять её с учётом всех условий по уравнению Менделеева — Клайперона. Оно выглядит следующим образом: p * V = m * R * T / M, где p — давление, V — объём, m — масса, R — константа, равная 8,314, T — температура, M — молярная масса.
Иногда требуется найти параметр для эквивалента (MЭ). Он будет напрямую зависеть от класса соединения и его формулы. Для кислот эквивалентное число (z) соответствует количеству атомов водорода в составе (один для HCl, два для H2SO4, три для H3PO4), для щелочей — групп OH (одна для KOH, две для Ca (OH)2). Для веществ, эквивалент которых равен единице, результат не меняется, для всех остальных МЭ находится как М/ z. Исходя из этого:
Химия может быть понятной и доступной только для тех, кто последовательно подходит к её изучению и уделяет внимание каждой теме, читая учебники или просматривая видеоуроки. Но старания стоят того, ведь эта наука невероятно важная и интересная, она может дать объяснение составу и строению любого объекта окружающей среды, а на основе этих данных можно узнать практически всё о его свойствах и научиться волшебству превращения одних веществ в другие.
Молекулярная физика. Молярная масса.
Молярной массой вещества М называют массу вещества, взятого в количестве 1 моль:
где m0 — масса молекулы данного вещества.
Поскольку для любого тела его масса m связана с количеством молекул N в нем соотношением
то из 
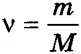
Количество вещества равно отношению массы вещества к его молярной массе. Из 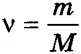


выражение для числа молекул в теле с массой m и молярной массой M.
Урок 9. Молярная масса и молярный объем
В уроке 9 «Молярная масса и молярный объем» из курса «Химия для чайников» выясним, что подразумевается под молярной массой и молярным объемом; приведем формулы для их вычисления. Напоминаю, что в прошлом уроке «Химическое количество вещества и моль» мы выяснили, что такое химическое количество вещества; рассмотрели моль в качестве единицы количества вещества, а также познакомились с постоянной Авогадро.
Молярная масса
Вы знаете, что одинаковое химическое количество любых веществ содержит одно и то же число структурных единиц. Но у каждого вещества его структурная единица имеет собственную массу. Поэтому и массы одинаковых химических количеств различных веществ тоже будут различны.
Молярная масса — это масса порции вещества химическим количеством 1 моль.
В Международной системе единиц молярная масса выражается в кг/моль. В химии чаще используется дольная единица — г/моль.
Определим молярную массу углерода. Масса углерода химическим количеством 1 моль равна 0,012 кг, или 12 г. Отсюда:
Молярная масса любого вещества, если она выражена в г/моль, численно равна его относительной молекулярной (формульной) массе.
На рисунке 47 показаны образцы веществ (H2O, CaCO3, Zn), химическое количество которых одно и то же — 1 моль. Как видите, массы разных веществ химическим количеством 1 моль различны.
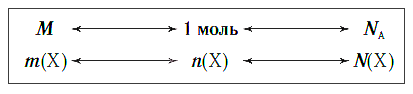
Молярная масса является важной характеристикой каждого отдельного вещества. Она отражает зависимость между массой и химическим количеством вещества. Зная одну из этих величин, можно определить вторую — массу по химическому количеству:
и, наоборот, химическое количество по массе:
а также число структурных единиц:
Взаимосвязь между этими тремя характеристиками вещества в любом его агрегатном состоянии можно выразить простой схемой:
Молярный объем
Подобно молярной массе, молярный объем газа равен отношению объема данного газообразного вещества V(Х) к его химическому количеству n(Х) :
Так как объем газа зависит от температуры и давления, то при проведении различных расчетов берутся обычно объемы газов при нормальных условиях (сокращенно — н. у.). За нормальные условия принимаются температура 0 °С и давление 101,325 кПа.
Установлено, что при нормальных условиях отношение объема любой порции газа к химическому количеству газа есть величина постоянная и равная 22,4 дм 3 /моль. Другими словами, молярный объем любого газа при нормальных условиях:
Пример 1. Вычислите химическое количество SiO2, масса которого равна 240 г.
Пример 2. Определите массу серной кислоты H2SO4, химическое количество которой 2,5 моль.
Пример 3. Сколько молекул CO2 и сколько атомов кислорода содержится в углекислом газе массой 110 г?
Пример 4. Какой объем занимает кислород химическим количеством 5 моль при нормальных условиях?
Краткие выводы урока:
Надеюсь урок 9 «Молярная масса и молярный объем» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Данный урок был заключительным в главе «Основные химические понятия».
Как правильно рассчитать молярную массу в химии?
Содержание:
Молекулы – это мелкие частицы, массу которых невозможно измерить на обычных весах. Для удобства в расчетах ученые ввели понятие «моль», исходя из которого появилось понятие «молярная масса».
Молярная масса (М) – масса одного моля, которая выражается в г/моль. Она часто численно совпадает с относительной атомной или молекулярной массой.
Как найти молярную массу в химии
Задача. Найти молярную массу фтора F2.
Задача. Нужно рассчитать молярную массу хлорида кальция CaCl2.
Исходя из химической формулы, в молекуле хлорида кальция находится два атома хлора, поэтому относительную атомную массу хлора необходимо умножить на два.
Особенности молярной массы
Задача. Найти молярную массу и относительную атомную массу калия.
Решение. Атомную массу элемента можно найти по Периодической таблице Дмитрия Ивановича Менделеева.
Т. к. калий К – металл, а не газообразное вещество, значит, атомную массу ни на какие индексы перемножать не нужно.
Т. о., относительная атомная и молярная масса калия совпадают.
Задача. Посчитать относительную атомную и молярную массу кислорода.
Решение. Относительная атомная масса Аr кислорода равна 16. Т. к. кислород – это газ, значит, относительную атомную массу необходимо умножить на индекс 2.
Т. о., относительная атомная и молярная масса кислорода не совпадают.
Формулы нахождения молярной массы
Задача. Найдите молярную массу и формулу вещества, если известно, что масса вещества равна 2 г, а количество вещества равно 1 моль.
Дано:
Решение:
М=2 г/1 моль=2 г/моль
Молярной массе 2 г/моль соответствует газ водород Н2.
Ответ: М=2 г/моль, химическая формула – Н2.
Содержание:
Количество вещества:
В чём разница между понятиями «масса» и «количество»
Если мы будем производить подобные расчеты, соответствующие этому заданию, для простых веществ, образованных различными элементами, то всякий раз получим одно и то же число —
Например, в 1 моле водородного газа содержится 


Количество частиц, содержащихся в 1 моле химических веществ ( 
Количество вещества можно вычислить по следующей формуле:
Молярная масса
Молярной массой называют массу 1 моля вещества, выраженного в граммах. Молярная масса обозначается
буквой М, единицей измерения является г/моль.
При выражении молярной массы вещества в граммах, она численно бывает равна его относительной молекулярной массе (если состоит из молекул). Для сравнения запишем (таблица 1):
Как видно из вышесказанного, понятие молярная масса применяется как к химическим элементам, так и к простым и сложным веществам с молекулярным и немолекулярным строением.
На основе количества вещества (моль) можно производить следующие вычисления. Если известно мольное количество вещества:
Закон Авогадро и молярный объём газов
Обратите внимание на рисунки. Почему, несмотря на разные массы газов, они занимают одинаковый объём?
В начале XIX века итальянский ученый Авогадро, проведя наблюдения над свойствами газов в различных условиях и проанализировав открытые прежде законы о газах (Бойля-Мариотта, Гей-Люссака и др.) в 1811 году сформулировал новый закон о газах. Закон Авогадро звучит следующим образом: в равных объемах различных газов при одинаковых условиях (одинаковых температуре и давлении) содержится одинаковое число молекул.
Итальянский ученый. В 1811 году им был открыт закон о газах, который впоследствии был назван его именем.
Мы уже знаем, что 1 моль любого вещества содержит 
Было вычислено, что при нормальных условиях объем 1 моля любого газа или смеси газов составляет примерно 22,4 л. Объем 1 моля газа при нормальных условиях (н.у.) называют молярным объемом данного газа, выраженным знаком 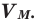
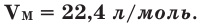
Здесь 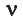
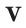
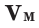
Нормальные условия означают: температура 0°С, 1 атм давления 1атм — 101,3 кПа
Для вычисления плотности какого-либо газа X в нормальных условиях (н.у.), следует его молярную массу разделить на молярный объем:
Например, вычислим плотности кислорода и углекислого газа при нормальных условиях:
Плотность твёрдых и жидких веществ при н.у. вычисляется по формуле 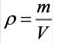
Для того, чтобы определить, масса какого из газов с одинаковыми объемами и при одинаковых условиях бывает тяжелее, пользуются понятием относительной плотности. Отношение плотностей различных газов при одинаковых условиях равно отношению их молярных масс. Относительная плотность обозначается буквой D и не имеет единицы измерения. Формула относительной плотности следующая:
В таком случае, относительная плотность углекислого газа по водороду вычисляется следующим образом:
Так как средняя молярная масса воздуха, состоящего из смеси газов, примерно равна 29 г/моль, то формула его относительной плотности следующая:
Способы вычисления средней молярной массы газовой смеси
Здесь: 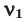
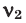
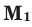
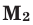

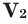
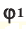
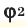
Среднюю молярную массу 1 моля смеси из двух различных газов можно вычислить по следующей формуле: 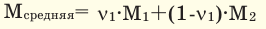
При смешивании газов с одинаковыми молярными массами, которые при одинаковом давлении не вступают друг с другом в реакцию, плотность газовой смеси (при н.у.), а также их средняя молярная масса остаются неизменными. Например, при смешивании 
При смешивании газов с различными молярными массами, при одинаковом давлении, средняя молярная масса (при н.у.) и плотность полученной газовой смеси приобретают значение между молярными массами и плотностями смешиваемых газов. Например, при смешивании 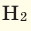
При добавлении газа с большей молярной массой в тот или иной газ при постоянном давлении плотность газовой смеси увеличивается, а при добавлении газа с меньшей молярной массой — уменьшается.
Закон объемных отношений
В химических реакциях соотношение объемов, вступающих в реакцию, и полученных газов равно соотношению их коэффициентов. Например:
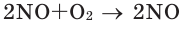
Численное соотношение объемов, молей и молекул газов равно друг другу.
Можно производить следующие вычисления по смесям:
3) Массовое соотношение двух газов:
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Telegram и логотип telegram являются товарными знаками корпорации Telegram FZ-LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
Как определить молярную массу вещества
Моль, молярная масса
В химических процессах участвуют мельчайшие частицы – молекулы, атомы, ионы, электроны. Число таких частиц даже в малой порции вещества очень велико. Поэтому, чтобы избежать математических операций с большими числами, для характеристики количества вещества, участвующего в химической реакции, используется специальная единица – моль.
Моль — это такое количество вещества, в котором содержится определенное число частиц (молекул, атомов, ионов), равное постоянной Авогадро
Постоянная Авогадро NA определяется как число атомов, содержащееся в 12 г изотопа 12 С:
Таким образом, 1 моль вещества содержит 6,02 • 10 23 частиц этого вещества.
Исходя из этого, любое количество вещества можно выразить определенным числом молей ν (ню). Например, в образце вещества содержится 12,04 • 10 23 молекул. Следовательно, количество вещества в этом образце составляет:
где N – число частиц данного вещества;
NA – число частиц, которое содержит 1 моль вещества (постоянная Авогадро).
Молярная масса вещества (M) – масса, которую имеет 1 моль данного вещества.
Эта величина, равная отношению массы m вещества к количеству вещества ν, имеет размерность кг/моль или г/моль. Молярная масса, выраженная в г/моль, численно равна относительной относительной молекулярной массе Mr (для веществ атомного строения – относительной атомной массе Ar).
Например, молярная масса метана CH4 определяется следующим образом:
M(CH4)=16 г/моль, т.е. 16 г CH4 содержат 6,02 • 10 23 молекул.
Молярную массу вещества можно вычислить, если известны его масса m и количество (число молей) ν, по формуле:
Соответственно, зная массу и молярную массу вещества, можно рассчитать число его молей:
или найти массу вещества по числу молей и молярной массе:
Необходимо отметить, что значение молярной массы вещества определяется его качественным и количественным составом, т.е. зависит от Mr и Ar. Поэтому разные вещества при одинаковом количестве молей имеют различные массы m.
Пример 
Решение
Молярная масса метана M(CH4) равна 16 г/моль;
молярная масса этана M(С2Н6) = 2 • 12+6=30 г/моль.
Отсюда:
Таким образом, моль – это порция вещества, содержащая одно и то же число частиц, но имеющая разную массу для разных веществ, т.к. частицы вещества (атомы и молекулы) не одинаковы по массе.
Вычисление ν используется практически в каждой расчетной задаче.
Образцы решения задач
Задача №1. Вычислите массу (г) магния, взятого количеством вещества 0, 5 моль?
M (Mg ) = Ar ( Mg ) = 24 г/моль (из периодической системы)
m ( Mg ) = 24 г/моль · 0,5 моль = 12 г
Ответ: m ( Mg ) =12 г
Задача №2. Вычислите массу (г) 12,04 · 10 23 молекул оксида цинка Zn О ?
n (Zn O )= 12,04 * 10 23 молекул
следовательно, формула для расчёта
M(ZnO) = Ar(Zn) + Ar(O) = 65 + 16 = 81 г / моль
m = 81 г/моль · (12,04 * 10 23 /6.02 · 10 23 1/моль) = 162 г
Задания для закрепления
Заполните таблицу (округляя числа до целых )
Как найти молярную массу
Видео:
Содержание:
Молярная масса является важным физическим свойством веществ. Это очень полезно при анализе, сравнении и прогнозировании других физических и химических свойств, таких как плотность, температура плавления, температура кипения и количество вещества, которое реагирует с другим веществом в системе. В этой статье мы будем обсуждать пять различных методов; используя атомные массы, уравнение, высоту точки кипения, понижение температуры замерзания и осмотическое давление, для расчета молярной массы.
Ключевые области покрыты
1. Что такое молярная масса
— определение, уравнение для расчета, объяснение
2. Как найти молярную массу
— Несколько методов для расчета молярной массы с примерами
3. Почему важно знать молярную массу вещества
— Применение молярной массы
Ключевые термины: число Авогадро, высота точки кипения, калузиус-клапейрон, криоскопическая константа, эбуллиоскопическая константа, депрессия точки замерзания, молярность, молярная масса, молекулярная масса, осмотическое давление, относительная атомная масса
Что такое молярная масса
Как найти молярную массу
Молярная масса вещества может быть рассчитана с использованием нескольких методов.
Эти методы подробно обсуждаются ниже.
1.Как найти молярную массу, используя атомные массы
Молярная масса молекулы может быть определена с использованием атомных масс. Это может быть сделано просто путем добавления молярной массы каждого присутствующего атома. Молярная масса элемента приведена ниже.
Давайте рассмотрим следующие примеры, чтобы понять эту технику. Далее приведены расчеты для соединений с одним и тем же атомом, комбинации нескольких разных атомов и комбинации большого количества атомов.
Примеры расчета
1. Расчет молярной массы Н2 и HCl
3. Молярная масса С6ЧАС12О6
2. Как найти молярную массу с помощью уравнения
Молярная масса может быть рассчитана с использованием уравнения, приведенного ниже. Это уравнение используется для определения неизвестного соединения.
Пример расчета
Возьмите следующий пример.
Соединение D находится в растворе. Детали даны следующим образом.
Затем определение может быть выполнено кислотно-основным титрованием. Поскольку это сильное основание, титруйте раствор сильной кислотой (например, HCl, 1,0 моль / л) в присутствии индикатора фенолфталеина. Изменение цвета указывает на конечную точку (например, при добавлении 15,00 мл HCl) титрования, и теперь все молекулы неизвестного основания титруют добавленной кислотой. Тогда молярная масса неизвестного соединения может быть определена следующим образом.
3. Как найти молярную массу по высоте точки кипения
Повышение температуры кипения представляет собой явление, которое описывает, что добавление соединения к чистому растворителю увеличило бы температуру кипения этой смеси до более высокой температуры кипения, чем у чистого растворителя. Следовательно, молярная масса этого добавленного соединения может быть найдена с использованием разности температур между двумя точками кипения. Если точка кипения чистого растворителя составляет Трастворитель и точка кипения раствора (с добавленным соединением) составляет ТрешениеРазница между двумя точками кипения может быть приведена ниже.
С использованием Соотношение Клаузиуса и Клапейрона и закон Рауля, мы можем получить связь между ΔT и моляльностью решения как,
Из приведенного выше уравнения мы можем получить значение для моляльности решения. Поскольку количество растворителя, используемого для приготовления этого раствора, известно, мы можем найти значение для молей добавленного соединения.
Теперь, когда мы знаем моли соединения в растворе и массу добавленного соединения, мы можем определить молярную массу соединения, используя уравнение,
4. Как найти молярную массу из депрессии точки замерзания
Понижение точки замерзания противоположно повышению температуры кипения. Иногда, когда соединение добавляют к растворителю, температура замерзания раствора ниже, чем у чистого растворителя. Тогда приведенные выше уравнения немного модифицированы.
Значение ΔT является отрицательным значением, поскольку точка кипения теперь ниже, чем начальное значение. Молярность раствора может быть получена так же, как в методе повышения температуры кипения.
Здесь Кеизвестен как криоскопическая константа, Это зависит только от свойств растворителя.
Остальные расчеты такие же, как в методе повышения точки кипения. Здесь, моли добавленного соединения также могут быть рассчитаны с использованием приведенного ниже уравнения.
Затем молярную массу можно рассчитать, используя значение для молей добавленного соединения и массы добавленного соединения.
5. Как найти молярную массу по осмотическому давлению
Π = MRT
Когда Π осмотическое давление,
Молярность решения определяется следующим уравнением.
Объем раствора может быть измерен, а молярность может быть рассчитана, как указано выше. Следовательно, моли соединения в растворе могут быть измерены. Тогда молярная масса может быть определена с помощью уравнения,
Почему важно знать молярную массу вещества
Резюме
МОЛЯРНАЯ МАССА И ОТНОСИТЕЛЬНАЯ МОЛЕКУЛЯРНАЯ МАССА: В ЧЕМ ОТЛИЧИЕ И ПОЧЕМУ ОНИ ЧИСЛЕННО РАВНЫ
Как вычислить молярную массу вещества? В каких единицах она измеряется?
А еще есть относительная молекулярная масса. Почему она относительная и численно равна молярной массе? Может быть это одно и то же?
Вот сколько вопросов возникает сразу в отношении такого простого на первый взгляд понятия, как молярная масса.
Разберемся по порядку и научимся ее определять.
Относительная атомная масса
Огромнейший вклад в развитие и обоснование понятия относительная атомная масса внесли в разное время французский ученый Гей-Люссак, итальянский ученый А.Авогадро и шведский ученый Й.Я. Берцелиус.
Не углубляясь в историю вопроса, вспомним, что любой химический элемент представляет собой определенную разновидность атомов. Сегодня мы знаем, что атомы химических элементов имеют свои особые характеристики.
И самая главная из них, определяющая практически все остальные, это заряд ядра. А так как заряд ядра обусловлен присутствием в нем протонов, а заряд одного протона равен +1, то и количество протонов, соответственно, также является важнейшей характеристикой атомов химических элементов.
Основную массу атома составляет ядро, которое кроме протонов содержит еще и нейтроны. Масса последних сопоставима с массой первых. Оболочку атома составляют электроны.
По числу частиц в атоме, а точнее, по их суммарной массе, атомы химических элементов можно условно разделить на тяжелые и легкие. Например, легким элементом является водород, так как его атомы имеют самую маленькую массу. А свинец — это уже тяжелый элемент. Масса его атома в 302 раза тяжелее массы атома водорода.
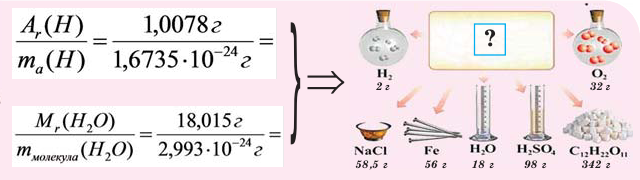
Но тем не менее, как бы мы не делили все атомы на тяжелые или легкие, абсолютная масса (mA) каждого из них ничтожно мала, как мала и масса составляющих их частиц. Например,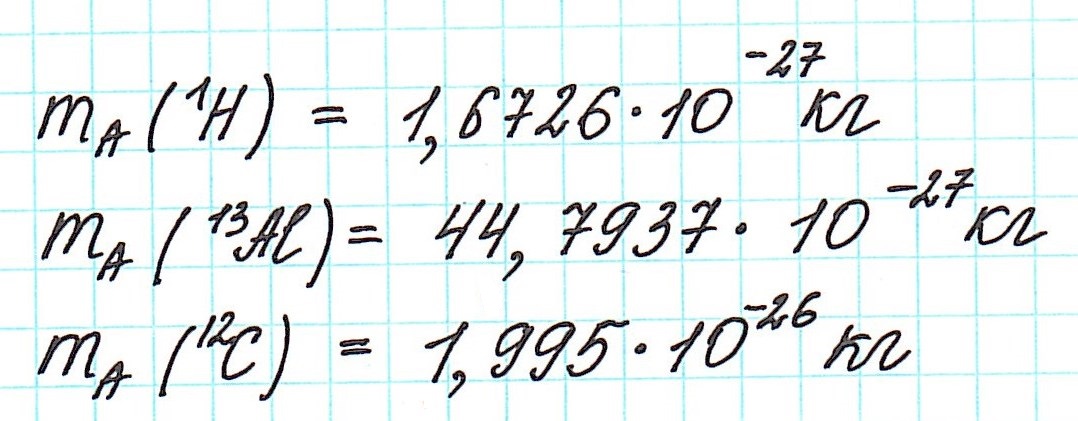
Величина, с которой сравнивают массу атома
Первоначально еще Дальтон сравнивал массы атомов с массой атома водорода, как самого легкого. Позднее появилась так называемая кислородная единица, равная 1/16 части массы атома кислорода. К ней перешли потому, что большинство атомов химических элементов образуют соединения с кислородом.
Однако, с развитием атомной физики и эта единица стала крайне неудобной. Все потому, что кислород в природе имеет несколько изотопов (а именно 3 устойчивых, всего же их 16). А изотопы, как известно, отличаются своей атомной массой. Из-за большого разнообразия изотопов и их различной устойчивости кислородная единица утратила свою актуальность.
Почему именно углерод? Да потому, что:
— у углерода всего 2 изотопа: 12 С и 13 С; причем первого 98,9%;
— количество органических веществ (их основу составляет, как известно, именно углерод) в сотни раз больше, чем неорганических;
— при переходе от кислородной единицы к углеродной уже посчитанные относительные атомные массы всех элементов изменились не существенно, что оказалось очень удобным.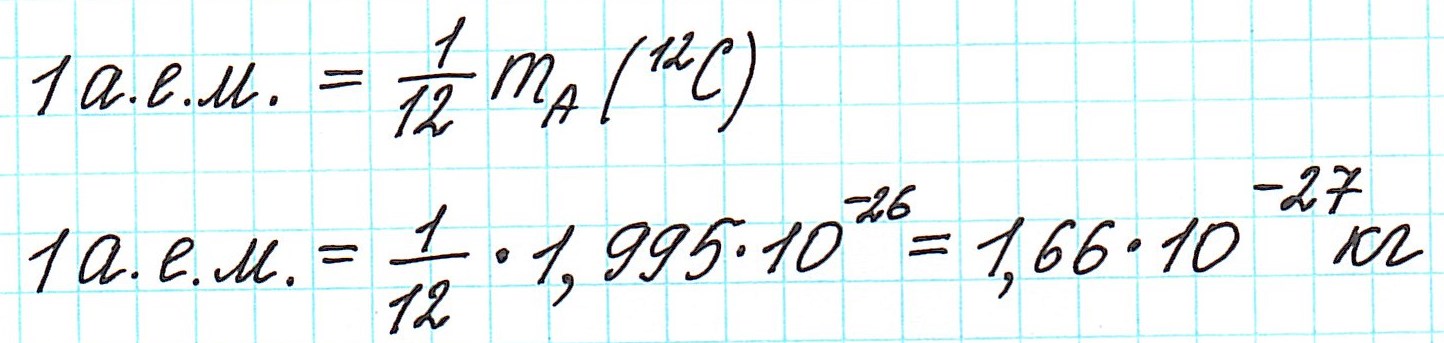
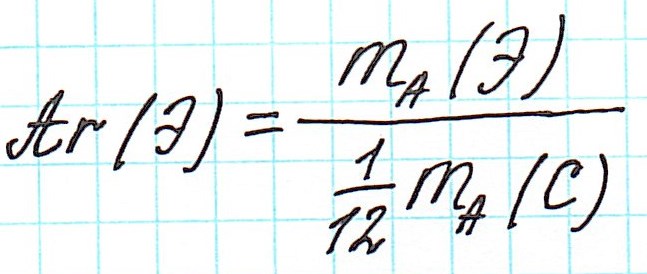
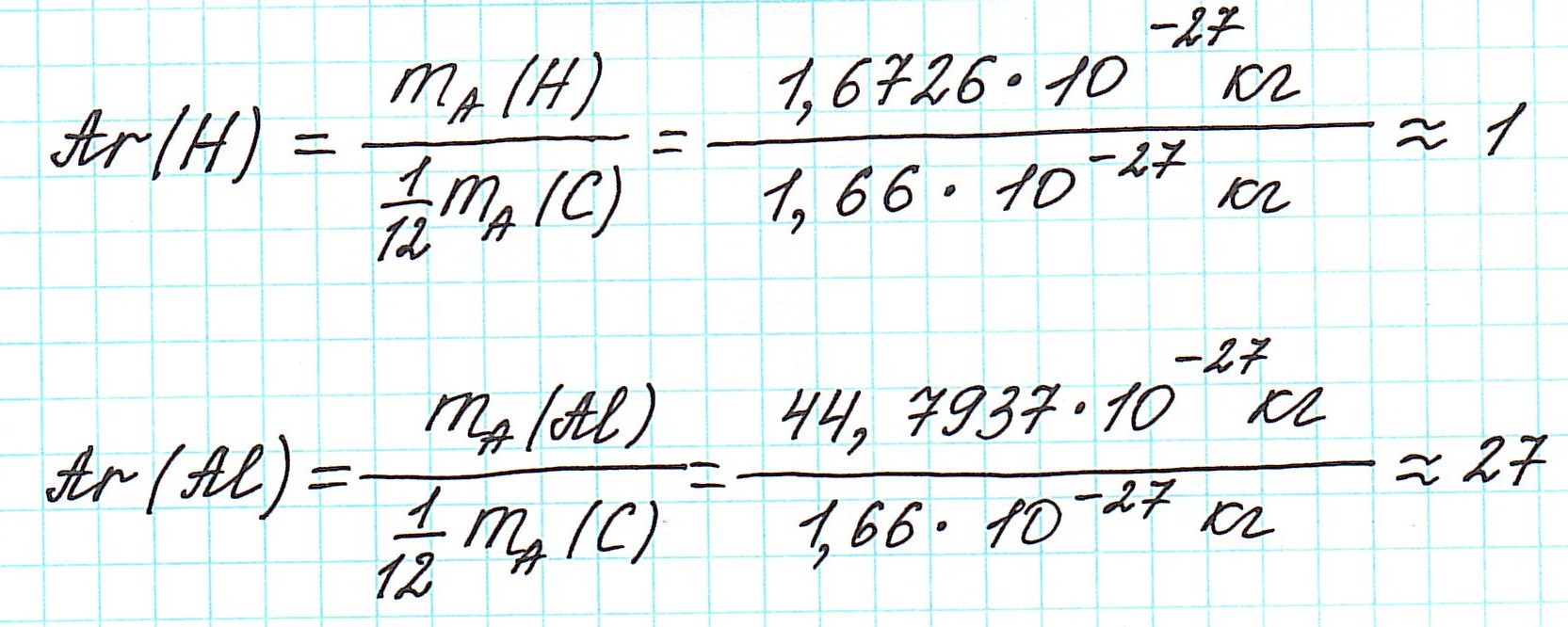
Почему атомная масса дробная?
Вернемся к строению атома.
Масса атома складывается из массы всех составляющих его частиц.
Массы протона и нейтрона приняты равными 1. А вот массой электрона обычно пренебрегают (по крайней мере в химии), так как даже относительная она безнадежно мала (0,0005485799090659(16) а.е.м.). То есть можно сказать, что масса атома определяется массой его ядра.
В составе ядра целое количество частиц. Например, в атоме одного из изотопов кислорода 8 протонов и 8 нейтронов. Значит, его Ar должна быть равна 16. Так почему же Ar представлена в периодической системе химических элементов в виде десятичной дроби? Для кислорода это Ar(О)=15,9994.
Например, химический элемент кислород в природе состоит на 99,76% из изотопа 16 О, на 0,04% из изотопа 17 О и на 0,20% из изотопа 18 О. Таким образом, Ar для кислорода является средним значением, учитывающим относительное содержание его изотопов.
Относительная молекулярная масса
А как же найти относительную молекулярную массу?
Дело в том, что молекулы характерны для веществ с ковалентными связями: вода H2O, серная кислота H2SO4, глюкоза C6H12O6 и т.д. И к ним в полной мере можно применить термин «относительная молекулярная масса».
Так как молекулы состоят из атомов, то относительная молекулярная масса (Mr) будет складываться из их относительных атомных масс. Например: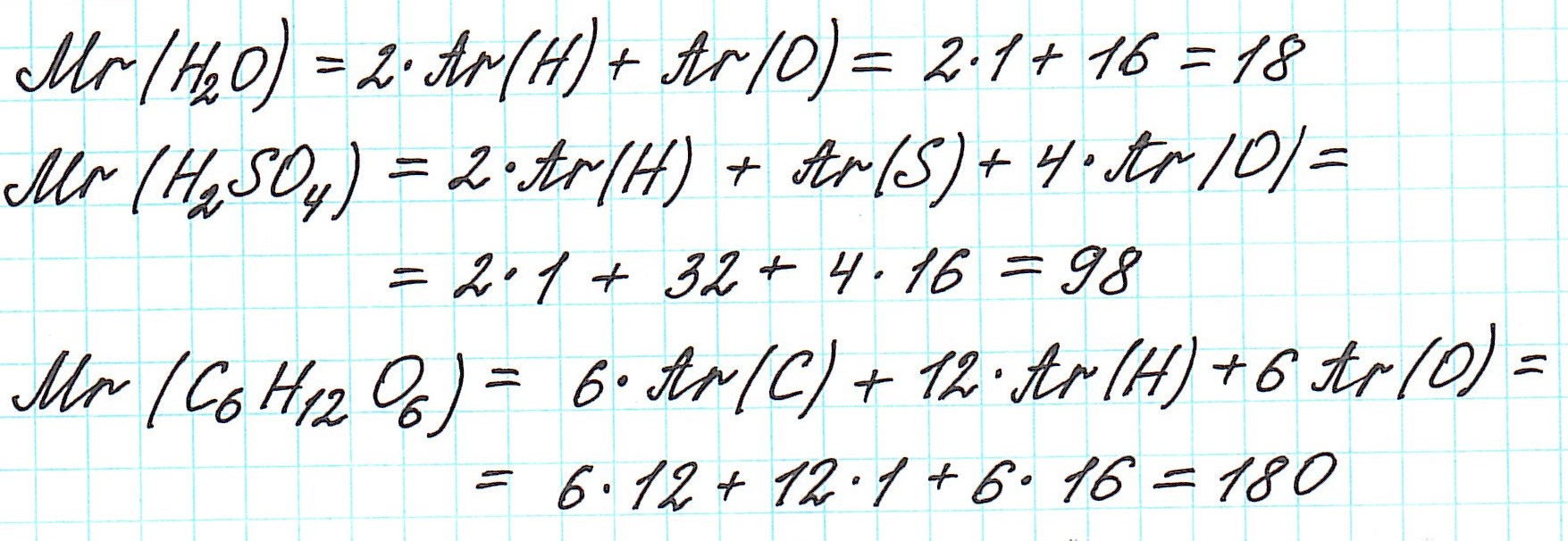
Точно так же, как относительную атомную массу (Ar), относительную молекулярную массу (Mr) будем сопоставлять с 1/12 частью атома изотопа углерода 12 С.
В последующем говорим о Mr.
Количество вещества и молярная масса
В практических расчетах все-таки требуется вычислять массы, взятые в граммах, килограммах ато и в тоннах (если речь идет о каком-то производстве, например).
Как же поступают тогда?
Количество вещества, которое содержит столько же частиц (атомов, ионов, молекул – в зависимости от строения), что и 12 г изотопа углерода 12 С, назвали молем.
Один моль вещества (любого!) всегда содержит 6,02·10 23 его частиц ( постоянная Авогадро ).
Ну, а так как атомы элементов отличаются по своей массе, то и 1 моль вещества тоже будет отличаться по массе.
Массу одного моля вещества называют молярной массой (М) и вычисляют в г/моль.
Таким образом, молярная масса и количество вещества связаны соотношением:
Можно также определить и такие отношения, связанные с количеством вещества:
Почему же относительная молекулярная и молярная массы равны?
Итак, относительная молекулярная и молярная массы, как следует из их определений – это не одно и то же.
Докажем, каким образом обе массы численно могут быть равны:
Как вычислить молярную массу вещества
Мы уже знаем, что относительная молекулярная масса складывается из относительных атомных масс.
При нахождении относительной молекулярной массы (Mr), а значит и молярной (М), выполняем следующие действия :
1) правильно записываем формулу вещества;
2) анализируем качественный состав (атомы каких элементов составляют вещество) и количественный состав (в каких количествах находятся эти атомы – смотрим по индексам, которые стоят справа внизу от знака химического элемента);
3) в периодической системе химических элементов находим элементы, атомы которых составляют вещество, и округляем относительную атомную массу, стоящую рядом со знаком элемента, до целого числа (! у хлора – до 35,5);
4) складываем относительные атомные массы всех элементов с учетом количества атомов.
Рассмотрим еще примеры:
Как вычислить молярную массу вещества, находящегося в газообразном состоянии
Это означает, что в данных условиях отношение масс газов друг к другу является отношением их молярных масс:


Вычислить молярную массу вещества (а, значит, и относительную молекулярную), находящегося в газообразном состоянии, можно, используя молярный объем газа (VM):
Итак, подведем итог:
Без вычисления молярной массы не обходится решение практически ни одной задачи. Если вы поняли, что такое молярная и относительная молекулярная массы и как их вычислять, но еще не умеете решать задачи с их применением, то самое время научиться.
Разбор простых типовых задач по химии в книге, которую вы можете совершенно БЕСПЛАТНО скачать здесь.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
или на Одноклассниках

Ваше мнение для нас важно!
Как определить молярную массу вещества
— Как вычислить молекулярную и молярную массы вещества?
— Моль, молярная масса
Как вычислить молекулярную и молярную массы вещества?
Для этого нужно сложить массы всех атомов в этой молекуле.
В молекуле воды Н2О 2 атома водорода и 1 атом кислорода. Атомная масса водорода = 1, а кислорода = 16. Поэтому молекулярная масса воды равна 1 + 1 + 16 = 18 атомных единиц массы, а молярная масса воды =18 г/моль.
Моль, молярная масса
Любая задача по химии решается через количество вещества. Необходимо помнить основные формулы:
или общую формулу:
Определите массу иодида натрия NaI количеством вещества 0,6 моль.
Молярная масса иодида натрия составляет:
M(NaI)= M(Na) + M(I) = 23 + 127 = 150 г / моль
Определяем массу NaI:
m(NaI) = n(NaI)·M(NaI) = 0,6 · 150 = 90 г.
Определите количество вещества атомного бора,содержащегося в тетраборате натрия Na2B4O7 массой 40,4 г.
Молярная масса тетрабората натрия составляет 202 г/моль.
Определяем количество вещества Na2B4O7:
Вспомним, что 1 моль молекулы тетрабората натрия содержит 2 моль атомов натрия, 4 моль атомов бора и 7 моль атомов кислорода (см. формулу тетрабората натрия).
Тогда количество вещества атомного бора равно:
Молекулярная масса
п.1. Относительная атомная и молекулярная масса
Массы атомов и молекул, из которых состоят вещества, очень малы. Поэтому их чаще измеряют не в килограммах, а используют внесистемную единицу – атомную единицу массы.
Относительную атомную массу проще всего найти, пользуясь таблицей Менделеева.
Например:
\(A_r(\mathrm
\(A_r(\mathrm
\(A_r(\mathrm
\(A_r(\mathrm
На практике при решении учебных задач относительные атомные массы округляют и единицу измерения а.е.м. не пишут.
п.2. Количество вещества. Постоянная Авогадро
Например:
В 5 молях углерода будет содержаться \(N=5\cdot N_A\approx 6,022\cdot 10^<23>\approx 3,01\cdot 10^<24>\) атомов углерода. Причём, всё равно, будут ли эти атомы углерода образовывать уголь, графит или алмаз.
Аналогично, в 5 молях воды будет \(N=5\cdot N_A\approx 3,01\cdot 10^<24>\) молекул воды. Причём, независимо от того, в каком агрегатном состоянии находится вода: в виде пара, жидкости или льда.
Т.е., «количество вещества» всегда говорит нам о «количестве частиц», независимо от других параметров.
п.3. Молярная масса
Например:
Найдем молярную массу этилового спирта \begin
п.4. Молярный объем
Это свойство газов часто используется при изучении различных веществ и явлений в физике и химии.
п.5. Задачи
Задача 1. Масса кристалла серы равна 16 г. Сколько молекул серы \(\mathrm
Задача 2*. В кислородном генераторе на космическом корабле было получено 1,6 кг кислорода \(\mathrm
Молярная масса соединений
Химия, молярная масса, элементы, таблица Менделеева
В химии очень часто для расчетов нужно знать молярную массу вещества.
Ничего сложного в ее расчете нет: берется стандартный атомный вес элементов, входящих в молекулу, умножается на количество атомов соответствующего элемента в молекуле и умножается на 1 г/моль, константу молярной массы (это чтобы получить соответствующую размерность (г/моль), так как молярная масса, это, собственно, масса одного моля вещества).
Собственно, стандартные атомные веса можно найти в справочнике Таблица Менделеева. Это и делается в калькуляторе ниже.
Как пользоваться калькулятором? — просто вводим формулу соединения, нажимаем на кнопку «рассчитать» и получаем результат.
Желательно при этом соблюдать стандартную нотацию, например,
C2H5OH,
H2O,
Na2SO4,
причем Na2SO4 надо вводить так, как написано, но не так, как здесь — na2so4, а то появляется неоднозначность при определении элементов.
Молярная масса
Моля́рная ма́сса вещества — масса одного моля вещества. Для отдельных химических элементов молярной массой является масса одного моля отдельных атомов этого элемента. В этом случае молярная масса элемента, выраженная в г/моль, численно совпадает с массой атома элемента, выраженной в а.е.м. (атомная единица массы). Однако надо чётко представлять разницу между молярной массой и молекулярной массой, понимая, что они равны лишь численно и отличаются по размерности. [1]
Молярные массы сложных молекул можно определить, суммируя молярные массы входящих в них элементов.
Например, молярная масса воды (H2O) есть MH2O = 2 MH +MO = 2·1+16 = 18 (г/моль).
Стоит отметить, что, например, молярная масса кислорода как элемента = 16 (г/моль), а в газообразном состоянии (O2) = 32 (г/моль).
Молярная масса некоторых веществ
| Вещество | г/моль |
|---|---|
| Азот | 28 |
| Аргон | 40 |
| Водород | 2 |
| Водяные пары | 18 |
| Гелий | 4 |
| Воздух | 29 |
| Кислород | 32 |
| Литий | 6 |
| Неон | 20 |
| Серебро | 108 |
| Молибден | 96 |
| Углекислый газ | 44 |
Примечания
Полезное
Смотреть что такое «Молярная масса» в других словарях:
молярная масса — molio masė statusas T sritis fizika atitikmenys: angl. molar mass vok. molare Masse, f; Molmasse, f rus. мольная масса, f; молярная масса, f pranc. masse molaire, f … Fizikos terminų žodynas
молярная масса — molio masė statusas T sritis Standartizacija ir metrologija apibrėžtis Medžiagos dalelių, kurių skaičius lygus Avogadro konstantai, masė, t. y. masė m, padalyta iš medžiagos kiekio n: M = m/n. atitikmenys: angl. molar mass vok. molare Masse, f;… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
молярная масса — molinė masė statusas T sritis chemija apibrėžtis Vieno medžiagos molio masė. atitikmenys: angl. molar mass rus. молярная масса … Chemijos terminų aiškinamasis žodynas
молярная масса — molio masė statusas T sritis Energetika apibrėžtis Medžiagos dalelių, kurių skaičius lygus Avogadro konstantai, masė, t. y. medžiagos masė, padalyta iš medžiagos kiekio. atitikmenys: angl. molar mass vok. molare Masse, f; Molmasse, f rus.… … Aiškinamasis šiluminės ir branduolinės technikos terminų žodynas
Молярная масса эквивалента — Величина Мэквх, численно равная произведению молярной массы вещества х на фактор эквивалентности и рассчитываемая по формуле Мэквх = Мх × fэквх, где Мх молярная масса вещества х, г; fэквх фактор эквивалентности. Примечание. Величина Мэквх… … Словарь-справочник терминов нормативно-технической документации
МОЛЯРНАЯ МАССА — физ. величина, равная отношению массы к кол ву в ва. Единица М. м. (в СИ) кг/моль. М = m/n, где М М. м. в кг/моль, m масса в ва в кг, п кол во в ва в молях. Числовое значение М. м., выраж. в кг/моль, равно относит. молекулярной массе, делённой на … Большой энциклопедический политехнический словарь
Молярная концентрация эквивалента — Величина Сэквх, численно равная частному от деления массовой концентрации вещества х на молярную массу его эквивалента и рассчитываемая по формуле где Стх массовая концентрация вещества х, г; Мэквх молярная масса эквивалента вещества х, г.… … Словарь-справочник терминов нормативно-технической документации
МОЛЯРНАЯ MАCCA — физ. величина, равная отношению массы газа (или др. тела) к количеству вещества, которое в нём содержится; обозначается буквой Μ; М = m/n. где т масса вещества, n количество вещества. Числовое значение М в тысячу раз меньше относительной… … Большая политехническая энциклопедия
Молярная концентрация — Концентрация величина, характеризующая количественный состав раствора. Согласно правилам ИЮПАК, концентрацией растворённого вещества (не раствора) называют отношение количества растворённого вещества или его массы к объёму раствора (моль/л, г/л) … Википедия
Молярная масса вещества онлайн
Введение в химические формулы
Относительная атомная и молекуряная масса
Отличительные особенности
В отношении других калькуляторов, рассчитывающих молярную массу вещества, этот калькулятор обладает следующими особенностями:
— Формула может содержать скобки например
— Формула может содержать коэффициент
Если есть необходимость рассчета массовых долей каждого химическго элемента в формуле то стоит воспользоваться калькулятором Массовая доля вещества онлайн
Интересные факты
Молярные массы каких химических элементов не округляются?
синтаксис
molar формула[!]
Внимание! Химические элементы в формуле должны быть указаны так, как в таблице Менделеева.
простой пример покажет какая цена ошибки не соблюдать регистр (прописные или строчные символы) букв
В любую часть формулы, можно вставить служебный символ(восклицательный знак).
Что же он нам дает?
Он все параметры огругляет до того уровня точности, который используется в школьной программе. Это очень удобно именно для тех, кто решает школьные задачи.
Например молярная масса воды в школьных учебниках равна 18, а если учитывать более точные алгоритмы, то получаем что молярная масса равна 18.01528. Разница небольшая, но если делать расчет например массовой доли химического вещества, получается небольшое, но очень неприятное расхождение в выходных параметрах, которое может ввести в заблуждение неопытных пользователей калькулятора.
Примеры
Рассчитать молярную и молекулярную массу вещества
пишем запрос molar NaMgU3O24C18H27