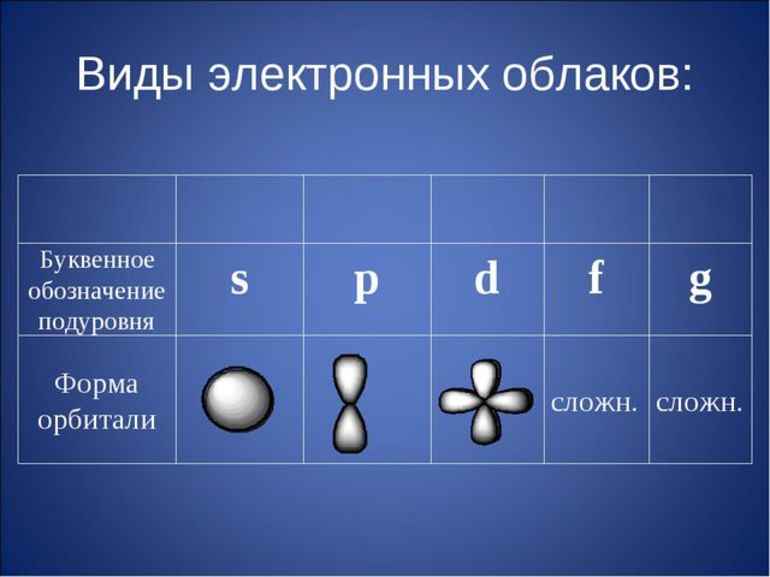
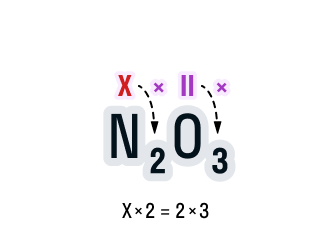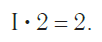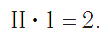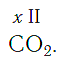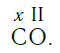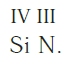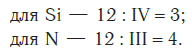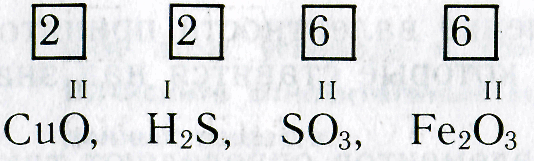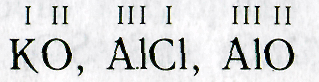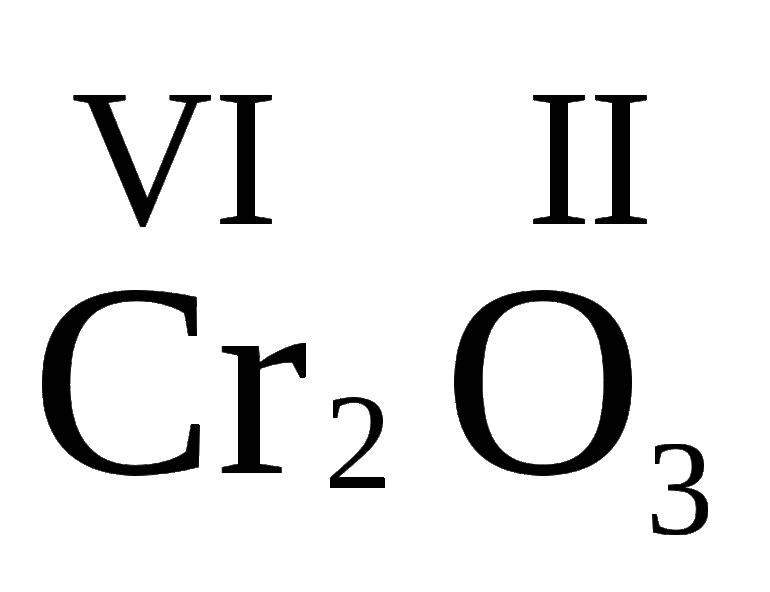Как определить валентность элемента
Как определить валентность элемента
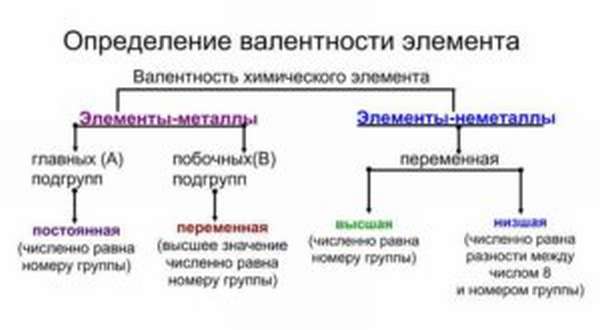
Валентность и степень окисления
Валентность
Определяют валентность по числу связей, которые один атом образует с другими. Для примера рассмотрим две молекулы
Для определения валентности нужно хорошо представлять графические формулы веществ. В этой статье вы увидите множество формул. Сообщаю вам также о химических элементах с постоянной валентностью, знать которые весьма полезно.
В электронной теории считается, что валентность связи определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии. Мы касались с вами темы валентных электронов и возбужденного состояния атома. На примере фосфора объединим эти две темы для полного понимания.
Подавляющее большинство химических элементов обладает непостоянным значением валентности. Переменная валентность характерна для меди, железа, фосфора, хрома, серы.
Степень окисления
Численно степень окисления равна условному заряду, который можно приписать атому, руководствуясь предположением, что все электроны, образующие связи, перешли к более электроотрицательному элементу.
Зная изменения электроотрицательности в периодах и группах периодической таблицы Д.И. Менделеева, можно сделать вывод о том какой элемент принимает «+», а какой минус. Помогают в этом вопросе и элементы с постоянной степенью окисления.
Самостоятельно определите степени окисления атомов в следующих веществах: RbOH, NaCl, BaO, NaClO3, SO2Cl2, KMnO4, Li2SO3, O2, NaH2PO4. Ниже вы найдете решение этой задачи.
Сравнивайте значение электроотрицательности по таблице Менделеева, и, конечно, пользуйтесь интуицией 🙂 Однако по мере изучения химии, точное знание степеней окисления должно заменить даже самую развитую интуицию 😉
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Валентность и степень окисления
Валентность
Валентность — это способность атомов химических элементов образовывать определенное число химических связей с атомами других химических элементов.
Обменный механизм образования ковалентной связи — в образовании связи участвуют одноэлектронные атомные орбитали, т.е. каждый из атомов предоставляет по одному неспаренному электрону.
Донорно-акцепторный механизм — образование связи происходит за счет электронной пары одного из атомов (атом-донор) и вакантной орбитали другого атома (атом-акцептор):
Таким образом, атомы могут образовывать химическую связь не только за счет неспаренных электронов на внешнем энергетическом уровне, но и за счет неподеленных электронных пар, или свободных орбиталей на этом уровне.
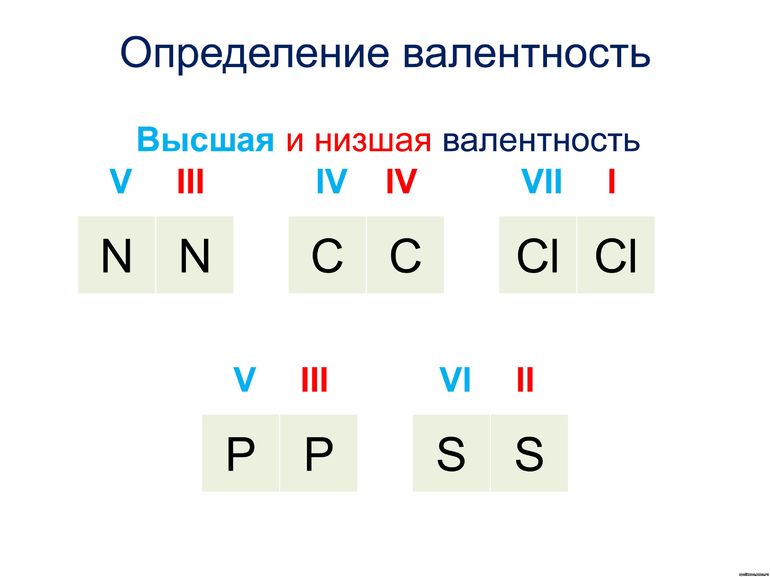
Большинство элементов характеризуются высшей, низшей или промежуточной валентностью в соединениях.
Для большинства элементов высшая валентность, как правило, равна номеру группы, низшая валентность определяется по формуле: 8 — № группы. Промежуточная валентность – это число между низшей и высшей валентностями.
Обратите внимание! Степень окисления и валентность — это не одно и то же. Хотя иногда степени окисления совпадают с валентностями. Стпень окисления — это условный заряд атома, он может быть и положительным и отрицательным. А вот образовать отрицательное число связей атом никак не может.
| Элемент | Валентность |
| Фтор F | I |
| Кислород О | II |
| Металлы IA группы (Li, Na, K, Rb, Cs, Fr) | I |
| Металлы IIA группы (Be, Mg, Ca, Sr, Ba, Ra) | II |
| Алюминий Al | III |
Как определить валентность атома в соединении?
Рассмотрим валентные возможности атомов второго периода. В силу некоторых ограничений они не соответствуют традиционным «школьным» представлениям.
+3Li 1s 2 
Следовательно, литий может образовывать одну связь и валентность лития I.
+4Be 1s 2 
+4Be * 1s 2 

Таким образом, на внешнем э нергетическом уровне бериллия в возбужденном энергетическом состоянии есть 2 неспаренных электрона и две вакантные электронные орбитали. Следовательно, бериллий может образовать 2 связи по обменному механизму, т.е. валентность бериллия равна номеру группы и равна II.
Электронная конфигурация атома бора в основном состоянии +5B 1s 2 2s 2 2p 1 :
+5B 1s 2 

+5B 1s 2 

Следовательно, бор может образовывать 3 связи по обменному механизму (за счет неспаренных электронов). Валентность бора в соединениях — III.
Однако, при этом у бора остается еще одна вакантная электронная орбиталь. Следовательно, бор может выступать, как акцептор электронной пары.
За счет 3 неспаренных электронов на p-подуровне азот может образовывать 3 связи по обменному механизму (валентность III), и еще 1 связь азот может образовать по донорно-акцепторному механизму за счет неподеленной электронной пары. Таким образом, максимальная валентность азота в соединениях — IV. На примере азота можно убедиться, что высшая валентность атома и максимальная степень окисления — разные величины, которые далеко не всегда совпадают. Возбужденное состояние с 5 неспаренными электронами для атома азота не реализуется, т.к. на 2 энергетическом уровне есть только s и p орбитали.
Валентность
Понятие валентности
Валентность — это способность атома химического элемента образовывать определенное число химических связей с другими атомами.
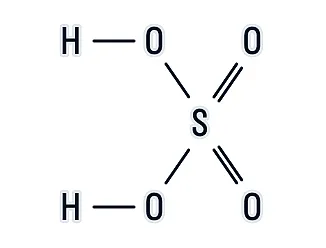
Рассмотрим структурную формулу H2SO4, с помощью которой можно определить, как атомы связаны между собой в веществе:
Исходя из структуры, можно сделать выводы:
атомы водорода H имеют одну химическую связь, то есть одновалентны;
сера S имеет шесть химических связей, то есть шестивалентна;
каждый атом кислорода O имеет две химические связи — двухвалентен.
Валентность обозначается римской цифрой над знаком химического элемента в формуле. Например:
Атом натрия имеет валентность, равную 1, а атом кислорода — равную 2.
Постоянная и переменная валентность
Среди всех элементов выделяют две группы: с постоянной и переменной валентностью.
У элементов с постоянной валентностью в любом соединении она одинакова. Эти элементы и проявляемую ими валентность придется выучить.
O, Be, Mg, Ca, Ba, Zn
Переменная валентность меняется в зависимости от соединения. Элементов с переменной валентностью большинство. Как правило, они характеризуются высшей, промежуточной и низшей валентностью:
высшая валентность для элементов главных подгрупп совпадает с номером группы (№гр);
низшая валентность вычисляется по формуле: 8 − №гр;
промежуточная валентность — число между низшей и высшей валентностью. Обычно промежуточные валентности соответствуют четности группы.
Пример: как определить валентность по таблице Менделеева
Сера S располагается в группе VIА таблицы Менделеева. Значит:
высшая валентность серы равна VI;
вычислим низшую валентность: 8 − 6 = 2. Низшая валентность равна II;
сера расположена в группе VI — это четное число. Значит, промежуточными валентностями будут все четные числа между низшей и высшей валентностью. В случае с серой между числами 2 и 6 расположено только одно четное число — 4. Промежуточная валентность серы — IV.
В таблице собрали все возможные валентности для некоторых химических элементов.
Как определить валентность химического элемента с переменной валентностью в соединении
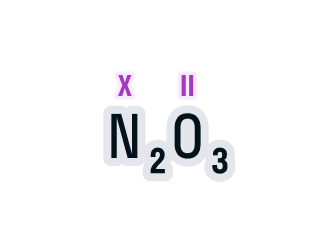
Определим валентность азота в соединении N2O3.
Над элементами с постоянной валентностью подпишем ее значение, в нашем случае это кислород:
Общее число валентностей каждого элемента в соединении должно совпадать. Находится общее число валентностей с помощью умножения валентности на число атомов данного химического элемента в соединении.
Считаем: общее число валентностей кислорода равно 2 · 3. Значит, общее число валентностей азота в данном соединении будет равно x · 2. Получаем уравнение: х · 2 = 2 · 3.
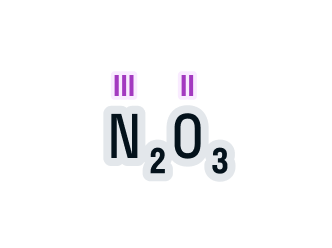
Вычислим х в получившемся уравнении:
Валентность азота в данном химическом соединении равна трем.
Встречаются бинарные соединения (то есть соединения, состоящие только из двух видов атомов), в которых неизвестны валентности обоих атомов элементов. Как найти валентности химических элементов в этом случае?
Для определения значения валентности необходимо запомнить, что неметаллы в бинарных соединениях, расположенные на втором месте, проявляют свою низшую валентность.
Например, в сульфидах (FeS) сера расположена на втором месте и проявляет низшую валентность, равную двум.
Тогда валентность железа в данном сульфиде можно рассчитать по приведенному выше алгоритму — ее значение равно двум.
В хлоридах (например, AgCl) хлор проявляет низшую валентность, равную единице.
Как составить формулу химического соединения по значениям валентностей элементов
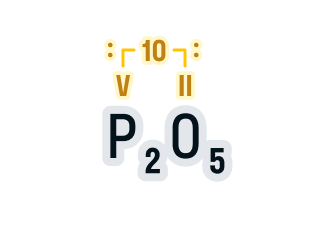
Составим формулу оксида фосфора (V).
Записываем обозначения элементов и над ними указываем валентности. Валентность фосфора в данном соединении указана в названии вещества (V), а валентность кислорода всегда равна II.
Находим НОК валентностей, в нашем случае 5 · 2 = 10. Для удобства запишем его над формулой:
Делим НОК на валентность каждого элемента, а результат записываем в индекс:
10 : 5 = 2 — индекс фосфора;
10 : 2 = 5 — индекс кислорода.
Вопросы для самопроверки
Что такое валентность в химии? Можно ли сказать, что валентность и степень окисления — это одно и то же?
Как узнать высшую и низшую валентность какого-либо химического элемента?
Назовите три химических элемента с валентностью, равной единице.
Среди перечисленных химических элементов выберите те, у которых валентность переменная: K, S, Al, Cu, Ca, P, Si, Mn, Mg, O.
Определите значения валентностей каждого химического элемента в следующих соединениях: FeCl3, Cl2O7, CuS, AlP.
Составьте химические формулы веществ:
Хлорид железа (II).
Оксид углерода (IV).
Верно ли, что значение высшей валентности химических элементов увеличивается по периоду слева направо в таблице Менделеева?
Тему «Валентность» проходят на уроках химии в 8-м классе, и без ее понимания сложно двигаться дальше, а уж тем более сдавать государственные экзамены. Онлайн-курс подготовки к ЕГЭ по химии от Skysmart поможет освежить знания за все годы школьной программы, заполнить пробелы и снять стресс перед экзаменом. Вводный урок бесплатный!
Урок 6. Валентность
В уроке 6 «Валентность» из курса «Химия для чайников» дадим определение валентности, научимся ее определять; рассмотрим элементы с постоянной и переменной валентностью, кроме того научимся составлять химические формулы по валентности. Напоминаю, что в прошлом уроке «Химическая формула» мы дали определение химическим формулам и их индексам, а также выяснили различия химических формул веществ молекулярного и немолекулярного строения.
Вы уже знаете, что в химических соединениях атомы разных элементов находятся в определенных числовых соотношениях. От чего зависят эти соотношения?
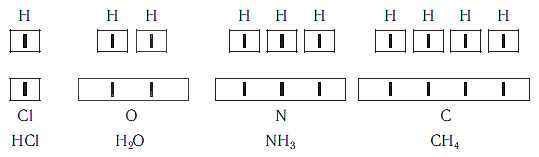
Рассмотрим химические формулы нескольких соединений водорода с атомами других элементов:
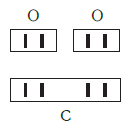
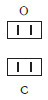
Нетрудно заметить, что атом хлора связан с одним атомом водорода, атом кислорода — с двумя, атом азота — с тремя, а атом углерода — с четырьмя атомами водорода. В то же время в молекуле углекислого газа СО2 атом углерода связан с двумя атомами кислорода. Из этих примеров видно, что атомы обладают разной способностью соединяться с другими атомами. Такая способность атомов выражается с помощью численной характеристики, называемой валентностью.
Валентность — численная характеристика способности атомов данного элемента соединяться с другими атомами.
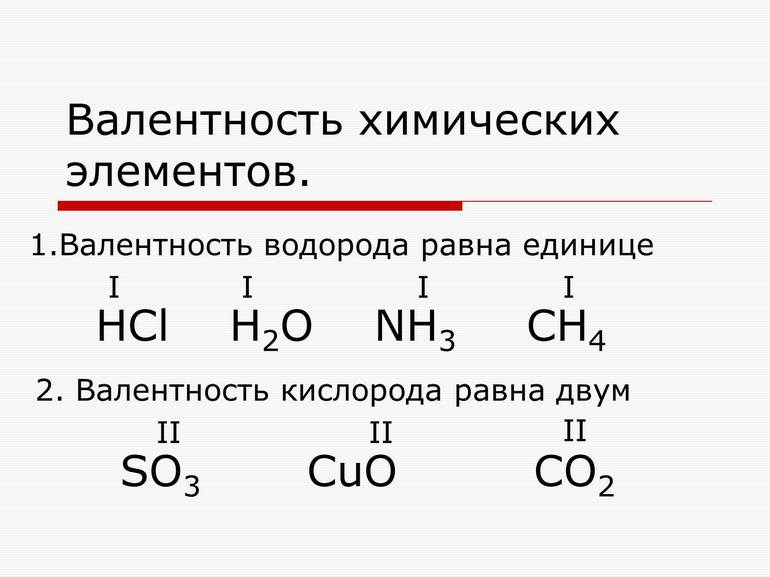
Поскольку один атом водорода может соединиться только с одним атомом другого элемента, валентность атома водорода принята равной единице. Иначе говорят, что атом водорода обладает одной единицей валентности, т. е. он одновалентен.
Валентность атома какого-либо другого элемента равна числу соединившихся с ним атомов водорода. Поэтому в молекуле HCl у атома хлора валентность равна единице, а в молекуле H2O у атома кислорода валентность равна двум. По той же причине в молекуле NH3 валентность атома азота равна трем, а в молекуле CH4 валентность атома углерода равна четырем. Если условно обозначить единицу валентности черточкой |, вышесказанное можно изобразить схематически:
Следовательно, валентность атома любого элемента есть число, которое показывает, со сколькими атомами одновалентного элемента связан данный атом в химическом соединении.
Численные значения валентности обозначают римскими цифрами над символами химических элементов:
Определение валентности
Однако водород образует соединения далеко не со всеми элементами, а вот кислородные соединения есть почти у всех элементов. И во всех таких соединениях атомы кислорода проявляют валентность, равную двум. Зная это, можно определять валентности атомов других элементов в их бинарных соединениях с кислородом. (Бинарными называются соединения, состоящие из атомов двух химических элементов.)
Чтобы это сделать, необходимо соблюдать простое правило: в химической формуле вещества суммарные числа единиц валентности атомов каждого элемента должны быть одинаковыми.
Так, в молекуле воды H2O общее число единиц валентности двух атомов водорода равно произведению валентности одного атома на соответствующий числовой индекс в формуле:
Так же определяют число единиц валентности атома кислорода:
По величине валентности атомов одного элемента можно определить валентность атомов другого элемента. Например, определим валентность атома углерода в молекуле углекислого газа СО2:
Существует и другое соединение углерода с кислородом — угарный газ СО, в молекуле которого атом углерода соединен только с одним атомом кислорода:
Постоянная и переменная валентность
Как видим, углерод соединяется с разным числом атомов кислорода, т. е. имеет переменную валентность. У большинства элементов валентность — величина переменная. Только у водорода, кислорода и еще нескольких элементов она постоянна (см. таблицу).
Составление химических формул по валентности
Зная валентность элементов, можно составлять формулы их бинарных соединений. Например, необходимо записать формулу кислородного соединения хлора, в котором валентность хлора равна семи. Порядок действий здесь таков.
Записываем рядом символы элементов в следующем виде:
Затем находим НОК валентностей обоих элементов. Оно равно 12 ( IV·III ).
Определяем индексы каждого элемента:
Записываем формулу соединения: Si3N4.
В дальнейшем при составлении формул веществ не обязательно указывать цифрами значения валентностей, а необходимые несложные вычисления можно выполнять в уме.
Краткие выводы урока:
Надеюсь урок 6 «Валентность» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Как определить валентность химических элементов?
Валентность химических элементов – это способность у атомов хим. элементов образовывать некоторое число химических связей. Принимает значения от 1 до 8 и не может быть равна 0.
Валентность химических элементов (Таблица)
Как можно определить валентность в соединениях:
Валентность химических элементов может быть постоянной и переменной. Постоянная в основном у металлов главных подгрупп, переменная у неметаллов и металлов побочных подгруп.
Таблица валентности химических элементов
Электроотрицательность. Степень окисления и валентность химических элементов
Электроотрицательность — способность атома какого-либо химического элемента в соединении оттягивать на себя электроны связанных с ним атомов других химических элементов.
Электроотрицательность, как и прочие свойства атомов химических элементов, изменяется с увеличением порядкового номера элемента периодически:
Степень окисления
Степень окисления – условный заряд атома химического элемента в соединении, рассчитанный исходя из предположения, что все связи в его молекуле ионные, т.е. все связывающие электронные пары смещены к атомам с большей электроотрицательностью.
Как рассчитать степень окисления элемента в соединении?
Степень окисления химических элементов в простых веществах всегда равна нулю.
Существуют элементы, проявляющие в сложных веществах постоянную степень окисления:
| Щелочные металлы, т.е. все металлы IA группы — Li, Na, K, Rb, Cs, Fr | +1 |
| Все элементы II группы, кроме ртути: Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd | +2 |
| Алюминий Al | +3 |
| Фтор F | -1 |
Существуют химические элементы, которые проявляют в подавляющем большинстве соединений постоянную степень окисления. К таким элементам относятся:
| водород H | +1 | Гидриды щелочных и щелочно-земельных металлов, например: |
| кислород O | -2 | Пероксиды водорода и металлов: Фторид кислорода — |
Алгебраическая сумма степеней окисления всех атомов в молекуле всегда равна нулю. Алгебраическая сумма степеней окисления всех атомов в ионе равна заряду иона.
Высшая (максимальная) степень окисления равна номеру группы. Исключения, которые не попадают под это правило, — элементы побочной подгруппы I группы, элементы побочной подгруппы VIII группы, а также кислород и фтор.
Химические элементы, номер группы которых не совпадает с их высшей степенью окисления (обязательные к запоминанию)
| Кислород | VI | +2 (в OF2) |
| Фтор | VII | |
| Медь | I | +2 |
| Железо | VIII | +6 (например K2FeO4) |
Низшая степень окисления металлов всегда равна нулю, а низшая степень окисления неметаллов рассчитывается по формуле:
Отталкиваясь от представленных выше правил, можно установить степень окисления химического элемента в любом веществе.
Валентность
Валентность — число химических связей, которые образует атом элемента в химическом соединении.
Валентность атомов обозначается римскими цифрами: I, II, III и т.д.
Валентные возможности атома зависят от количества:
Валентные возможности атома водорода
Было сказано, что на валентные возможности могут влиять три фактора — наличие неспаренных электронов, наличие неподеленных электронных пар на внешнем уровне, а также наличие вакантных (пустых) орбиталей внешнего уровня.
Мы видим на внешнем (и единственном) энергетическом уровне один неспаренный электрон. Исходя из этого, водород может точно иметь валентность, равную I. Однако на первом энергетическом уровне есть только один подуровень — s, т.е. атом водорода на внешнем уровне не имеет как неподеленных электронных пар, так и пустых орбиталей.
Таким образом, единственная валентность, которую может проявлять атом водорода, равна I.
Валентные возможности атома углерода
Рассмотрим электронное строение атома углерода. В основном состоянии электронная конфигурация его внешнего уровня выглядит следующим образом:
Т.е. в основном состоянии на внешнем энергетическом уровне невозбужденного атома углерода находится 2 неспаренных электрона. В таком состоянии он может проявлять валентность, равную II.
Однако атом углерода очень легко переходит в возбужденное состояние при сообщении ему энергии, и электронная конфигурация внешнего слоя в этом случае принимает вид:
Несмотря на то что на процесс возбуждения атома углерода тратится некоторое количество энергии, траты с избытком компенсируются при образовании четырех ковалентных связей.
По этой причине валентность IV намного более характерна для атома углерода. Так, например, валентность IV углерод имеет в молекулах углекислого газа, угольной кислоты и абсолютно всех органических веществ.
Помимо неспаренных электронов и неподеленных электронных пар на валентные возможности также влияет наличие вакантных ( ) орбиталей валентного уровня.
Наличие таких орбиталей на заполняемом уровне приводит к тому, что атом может выполнять роль акцептора электронной пары, т.е. образовывать дополнительные ковалентные связи по донорно-акцепторному механизму.
Так, например, вопреки ожиданиям, в молекуле угарного газа CO связь не двойная, а тройная, что наглядно показано на следующей иллюстрации:
Резюмируя информацию по валентным возможностям атома углерода:
Валентные возможности атома азота
Как видно из иллюстрации выше, атом азота в своем обычном состоянии имеет 3 неспаренных электрона, в связи с чем логично предположить о его способности проявлять валентность, равную III. Действительно, валентность, равная трём, наблюдается в молекулах аммиака (NH3), азотистой кислоты (HNO2), треххлористого азота (NCl3) и т.д.
Выше было сказано, что валентность атома химического элемента зависит не только от количества неспаренных электронов, но также и от наличия неподеленных электронных пар.
Связано это с тем, что ковалентная химическая связь может образоваться не только, когда два атома предоставляют друг другу по одному электрону, но также и тогда, когда один атом, имеющий неподеленную пару электронов — донор( ) предоставляет ее другому атому с вакантной ( ) орбиталью валентного уровня (акцептору). Т.е.
для атома азота возможна также валентность IV за счет дополнительной ковалентной связи, образованной по донорно-акцепторному механизму. Так, например, четыре ковалентных связи, одна из которых образована по донорно-акцепторному механизму, наблюдается при образовании катиона аммония:
Несмотря на то что одна из ковалентных связей образуется по донорно-акцепторному механизму, все связи N-H в катионе аммония абсолютно идентичны и ничем друг от друга не отличаются.
Валентность, равную V, атом азота проявлять не способен. Связано это с тем, что для атома азота невозможен переход в возбужденное состояние, при котором происходит распаривание двух электронов с переходом одного из них на свободную орбиталь, наиболее близкую по уровню энергии.
Атом азота не имеет d-подуровня, а переход на 3s-орбиталь энергетически настолько затратен, что затраты энергии не покрываются образованием новых связей.
Многие могут задаться вопросом, а какая же тогда валентность у азота, например, в молекулах азотной кислоты HNO3 или оксида азота N2O5? Как ни странно, валентность там тоже IV, что видно из нижеследующих структурных формул:
Пунктирной линией на иллюстрации изображена так называемая делокализованная π-связь. По этой причине концевые связи NO можно назвать «полуторными». Аналогичные полуторные связи имеются также в молекуле озона O3, бензола C6H6 и т.д.
Резюмируя информацию по валентным возможностям атома азота:
Как самостоятельно определить валентность по таблице Менделеева
Различные химические элементы отличаются по своей способности создавать химические связи, то есть соединяться с другими атомами. Поэтому в сложных веществах они могут находиться только в определенных соотношениях. Разберемся, как определить валентность по таблице Менделеева.
Что такое валентность?
В качестве единицы используется эта характеристика для водорода, которая принята равной I. Это свойство показывает, с каким числом одновалентных атомов может соединиться данный элемент. Для кислорода эта величина всегда равна II.
Знать эту характеристику необходимо, чтобы верно записывать химические формулы веществ и уравнения реакций. Знание этой величины поможет установить соотношение между числом атомов различных типов в молекуле.
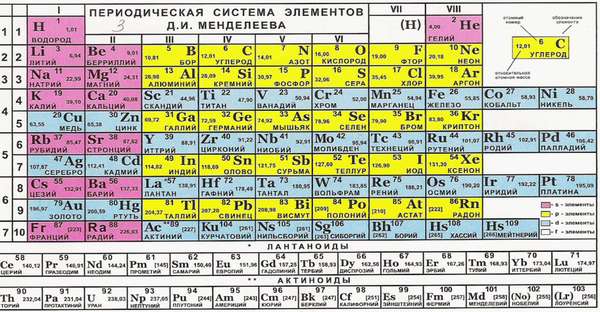
Чем поможет периодическая таблица?

Такие свойства имеют металлы главных подгрупп. Почему? Номер группы соответствует числу электронов на внешней оболочке. Эти электроны называются валентными. Именно они отвечают за возможность соединяться с другими атомами.
Группу составляют элементы с похожим устройством электронной оболочки, а сверху вниз возрастает заряд ядра. В короткопериодной форме каждая группа делится на главную и побочную подгруппы. Представители главных подгрупп — это s и p-элементы, представители побочных подгрупп имеют электроны на d и f-орбиталях.
Как определить валентность химических элементов, если она меняется? Она может совпадать с номером группы или равняться номеру группы минус восемь, а также принимать другие значения.
Важно! Чем выше и правее элемент, тем его свойство образовывать взаимосвязи меньше. Чем он более смещен вниз и влево, тем она больше.

В основном (невозбужденном) состоянии у серы два неспаренных электрона находятся на подуровне 3р. В таком состоянии она может соединиться с двумя атомами водорода и образовать сероводород. Если сера перейдет в более возбужденное состояние, то один электрон перейдет на свободный 3d-подуровень, и неспаренных электронов станет 4.
Сера станет четырехвалентной. Если сообщить ей еще больше энергии, то еще один электрон перейдет с подуровня 3s на 3d. Сера перейдет в еще более возбужденное состояние и станет шестивалентной.
Постоянная и переменная
Иногда способность к образованию химических связей может меняться. Она зависит от того, в какое соединение входит элемент. Например, сера в составе H2S двухвалентна, в составе SO2 четырехвалентна, а в SO3 — шестивалентна. Наибольшее из этих значений называется высшим, а наименьшая — низшим. Высшую и низшую валентности по таблице Менделеева можно установить так: высшая совпадает с номером группы, а низшая равняется 8 минус номер группы.

Это интересно! Что такое алканы: строение и химические свойства
В соединениях низшую валентность проявляет тот элемент, который находится выше и правее в периодической таблице, соответственно, высшую — тот, который левее и ниже.
Часто способность образовывать химические связи принимает больше двух значений. Тогда по таблице узнать их не получится, а нужно будет выучить. Примеры таких веществ:
Как определить валентность элемента в формуле соединения? Если она известна для других составляющих вещества, это несложно. Например, требуется рассчитать это свойство для хлора в NaCl. Натрий — элемент главной подгруппы первой группы, поэтому он одновалентен. Следовательно, хлор в этом веществе тоже может создать только одну связь и тоже одновалентен.
Важно! Однако так не всегда можно узнать это свойство для всех атомов в сложном веществе. Для примера возьмем HClO4. Зная свойства водорода, можно только установить, что ClO4 — одновалентный остаток.
Как еще узнать эту величину?
Способность образовывать определенное количество связей не всегда совпадает с номером группы, и в некоторых случаях ее придется просто заучить. Здесь на помощь придет таблица валентности химических элементов, где приведены значения этой величины. В учебнике химии за 8 класс приведены значения способности соединяться с другими атомами наиболее распространенных видов атомов.
| Н, F, Li, Na, K | 1 |
| O, Mg, Ca, Ba, Sr, Zn | 2 |
| B, Al | 3 |
| C, Si | 4 |
| Cu | 1, 2 |
| Fe | 2, 3 |
| Cr | 2, 3, 6 |
| S | 2, 4, 6 |
| N | 3, 4 |
| P | 3, 5 |
| Sn, Pb | 2, 4 |
| Cl, Br, I | 1, 3, 5, 7 |
Применение

Однако рассматриваемое понятие применяют в методических целях. С его помощью легко объяснить, почему атомы разных видов соединяются в тех соотношениях, которые мы наблюдаем, и почему эти соотношения для разных соединений различны.
На данный момент подход, согласно которому соединение элементов в новые вещества всегда объяснялось с помощью валентности по таблице Менделеева независимо от типа связи в соединении, устарел. Сейчас мы знаем, что для ионной, ковалентной, металлической связей существуют разные механизмы объединения атомов в молекулы.
Полезное видео
Подведем итоги
По таблице Менделеева определить способность к образованию химических связей возможно не для всех элементов. Для тех, которые проявляют одну валентность по таблице Менделеева, она в большинстве случаев равна номеру группы. Если есть два варианта этой величины, то она может быть равна номеру группы или восемь минус номер группы. Существуют также специальные таблицы, по которым можно узнать эту характеристику.
Валентность. Определение валентности. Элементы с постоянной валентностью.
Необходимо четко усвоить следующие принципы:
Существуют элементы с постоянной валентностью (их относительно немного) и элементы с переменной валентностью (коих большинство).
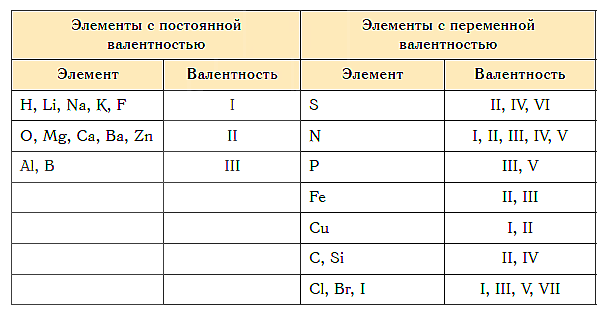
Элементы с постоянной валентностью необходимо запомнить:
Остальные элементы могут проявлять разную валентность.
Высшая валентность элемента в большинстве случаев совпадает с номером группы, в которой находится данный элемент.
Например, марганец находится в VII группе (побочная подгруппа), высшая валентность Mn равна семи. Кремний расположен в IV группе (главная подгруппа), его высшая валентность равна четырем.
Следует помнить, однако, что высшая валентность не всегда является единственно возможной. Например, высшая валентность хлора равна семи (убедитесь в этом!), но известны соединения, в которых этот элемент проявляет валентности VI, V, IV, III, II, I.
Если известна валентность одного из элементов в бинарном соединении, можно найти валентность другого.
Зная валентности двух элементов, можно составить формулу бинарного соединения.
Ответ прост: берите минимально возможные значения х и у. В приведенном примере эти минимальные (натуральные!) значения как раз и равны 1 и 2.
Несмотря на все сказанное, в большинстве случаев можно руководствоваться правилом: берите наименьшие значения индексов.
Вот, собственно, и все основные моменты.
Хотите узнать, почему «классическое» определение валентности часто не «работает»? Почему валентность железа в FeO не равна двум? Почему для описания комплексных веществ используется понятие «координационное число»?
Как определить валентность химического элемента по таблице
Когда мы говорим о химии, мы подразумеваем строительные блоки Вселенной. Все элементы действуют как кирпичи конструктора Лего, присоединяясь друг к другу, пока не создадут нечто большее, например, металлы, воду, химические соединения и даже живых существ. Иногда они не стыкуются и разваливаются или взрываются, ухудшая свои основные формы. Именно эти связи и реакции составляют Вселенную, какой мы ее знаем и видим.
Хотя все вещи на нашей планете состоят из отдельных атомов и элементов, различия между объектами и видами заключаются в способности элементов сочетаться с другими элементами. Как вы, наверное, уже знаете, валентность элемента измеряет его способность сочетаться с другими, а число электронов внутри внешней оболочки элемента называется валентностью.
Как определить валентность элемента
Второй метод — посмотреть на общее количество электронов, а затем вычислить их число по атомному номеру. Как только вы узнаете количество электронов, вы можете легко вычислить валентность. Все атомы, кроме водорода, имеют два электрона в первой электронной оболочке и до восьми в каждой последующей. Например, атомный номер хлора равен 17, что делает конфигурацию электронов равной:
То есть валентность хлора равна 7. Кислород имеет восемь электронов, два в первой оболочке и шесть во внешних оболочках, давая ему число 2. Вы можете рассчитать многоэлементные молекулы таким же образом. Например, чтобы определить тетраоксид фосфора, вы должны умножить атомы кислорода (валентность 2) и вычесть из валентности фосфора 5, получив число 3.
Ознакомьтесь с электронной конфигурацией каждого уровня оболочки. Каждый атом имеет два электрона на своей внутренней оболочке и до восьми электронов на каждой оболочке. Например, поскольку литий имеет три электрона, он будет иметь два внутри и один электрон на своей внешней оболочке.
Правило октета
При определении атома или молекулы (для которой вы не можете использовать периодическую таблицу), химики используют правило октета. Согласно этому правилу, атомы и химические вещества объединяются таким образом, чтобы образовать восемь электронов во внешней оболочке любого соединения, которое они образуют. Когда атом или молекула имеет от одного до четырех электронов в своей внешней оболочке, он имеет положительную валентность, то есть он жертвует свои свободные электроны. Когда число электронов составляет:
— вы определяете его способности путем вычитания электронного числа из 8. Это потому, что атом или молекула легче принимает электроны для достижения стабильности.
Определение по таблице Менделеева
С помощью этого метода вы не можете найти валентность меди, золота или железа, потому что у них много активных электронных оболочек. Это справедливо для всех переходных металлов в колонках 3–10, более тяжелых элементов в колонках с 11 по 14, лантаноидов (элементы 57–71) и актинидов (элементы 89–103).
Определение зависимости от химических формул
Вы можете определить переходный элемент или радикал в конкретном соединении, заметив, как он сочетается с элементами известной валентности. Эта стратегия основана на правиле октета, которое говорит нам о том, что элементы и радикалы объединяются, чтобы создать стабильную внешнюю оболочку из восьми электронов.
Например, железо (Fe) представляет собой переходный металл, который может проявлять множественные валентности. Когда он сочетается с сульфатным радикалом с образованием сульфата железа, FeSO4, он должен иметь +2 поскольку сульфатный радикал, определяется по связи, которую он образует с водородом.
Видео
Из этого видео вы узнаете, как определять валентность элементов по формулам.
Валентность химических элементов

Средняя оценка: 4.5
Всего получено оценок: 4456.
Средняя оценка: 4.5
Всего получено оценок: 4456.
При рассмотрении химических элементов можно заметить, что количество атомов у одного и того же элемента в разных веществах разнится. Каким же образом правильно записать формулу и не ошибиться в индексе химического элемента? Это легко сделать, если иметь представление, что такое валентность.
Для чего нужна валентность?
Валентность химических элементов – это способность атомов элемента образовывать химические связи, то есть присоединять к себе другие атомы. Количественной мерой валентности является число связей, которые образует данный атом с другими атомами или атомными группами.
В настоящее время валентность представляет собой число ковалентных связей (в том числе возникших и по донорно-акцепторному механизму), которыми данный атом соединен с другими. При этом не учитывается полярность связей, а значит, валентность не имеет знака и не может быть равной нулю.
Ковалентная химическая связь – это связь, осуществляемая за счет образования общих (связывающих) электронных пар. Если между двумя атомами имеется одна общая электронная пара, то такая связь называется одинарной, если две – двойной, если три – тройной.
Как находить валентность?
Первый вопрос, который волнует учеников 8 класса, начавших изучать химию – как определить валентность химических элементов? Валентность химического элемента можно посмотреть в специальной таблице валентности химических элементов

Валентность водорода принята за единицу, так как атом водорода может образовывать с другими атомами одну связь. Валентность других элементов выражаем числом, которое показывает, сколько атомов водорода может присоединить к себе атом данного элемента. Например, валентность хлора в молекуле хлористого водорода равна единице. Следовательно формула хлористого водорода будет выглядеть так: HCl. Так как и у хлора и у водорода валентность равна единице, никакой индекс не используется. И хлор и водород являются одновалентными, так как одному атому водорода соответствует один атом хлора.
Очень многие элементы образуют соединения с кислородом. Кислород всегда является двухвалентным. Поэтому в формуле воды H2O, где встречаются всегда одновалентный водород и двухвалентный кислород, рядом с водородом ставится индекс 2. Это значит, что молекула воды состоит из двух атомов водорода и одного атома кислорода.
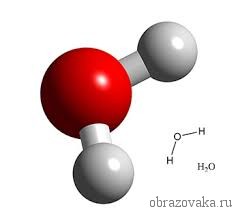
Не все химические элементы имеют постоянную валентность, у некоторых она может изменяться в зависимости от соединений, где используется данный элемент. К элементам с постоянной валентностью относятся водород и кислород, к элементам с переменной валентностью относятся, например, железо, сера, углерод.
Как определить валентность по формуле?
Если у вас перед глазами нет таблицы валентности, но есть формула химического соединения, то возможно определение валентности по формуле. Возьмем для примера формулу оксид марганца – Mn2O7
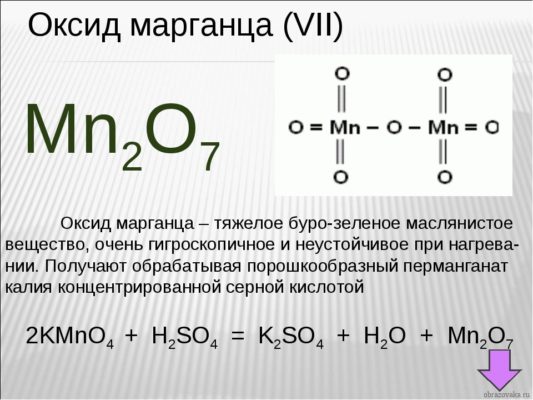
Как известно, кислород является двухвалентным. Чтобы выяснить, какой валентностью обладает марганец, необходимо валентность кислорода умножить на число атомов газа в этом соединении:
Получившееся число делим на количество атомов марганца в соединении. Получается:
7 (VII) – валентность марганца в данном соединении
Что мы узнали?
В данной теме раскрывается информация о том, что такое валентность. Валентность – способность образовывать химические соединения посредством присоединения к атомам одного элемента атомов другого элемента. Валентность бывает постоянная и переменная. Зная валентность того или иного элемента, можно легко научиться записывать формулы соединений.
Как определить валентность.
В этой статье рассмотрим способы и поймем, как определить валентность элементов таблицы Менделеева.
В химии принято, что валентность химических элементов можно узнать по группе (колонке) в таблице Менделеева. В действительности не всегда валентность элемента соответствует номеру группы, но в большинстве случаев определенная валентность по такому методу даст правильный результат часто элементы, в зависимости от разных факторов, имеют не одну валентность.
За единицу валентности принята валентность атома водорода, равная 1, то есть водород одновалентен. Поэтому валентность элемента указывает на то, со сколькими атомами водорода соединён один атом рассматриваемого элемента. Например, HCl, где хлор – одновалентен; H2O, где кислород – двухвалентен; NH3, где азот – трёхвалентен.
Как определить валентность по таблице Менделеева.
Таблица Менделеева содержит в себе химические элементы, которые размещены в ней по определенным принципам и законам. Каждый элемент стоит на месте, который определяется его характеристиками и свойствами и каждый элемент имеет свой номер. Горизонтальные линии называются периодами, которые возрастают от первой строки вниз. Если период состоит из двух рядов (что указано сбоку нумерацией), то такой период называется большим. Если он имеет только один ряд, то называется малым.
Валентностью называют способность атома образовывать некоторое количество химических связей с атомами других элементов. Как определить валентность по таблице Менделеева поможет понять знание видов валентности.
Виды валентности
Постоянная (у металлов главных подгрупп)
Переменная (у неметаллов и металлов побочных подгрупп)
Высшая (равна номеру группы)
Низшая (равна разности между числом 8 и номером группы)
Для элементов побочных подгрупп (а к ним относятся только металлы) валентность нужно запоминать, тем более что в большинстве случае она равна I, II, реже III. Также придется заучить валентности химических элементов, которые имеют более двух значений. Или постоянно держать под рукой таблицу валентности элементов.
Алгоритм определения валентности по формулам химических элементов.
1. Записать формулу химического соединения.
2. Обозначить известную валентность элементов.
3. Найти наименьшее общее кратное валентности и индекса.
4. Найти соотношение наименьшего общего кратного к количеству атомов второго элемента. Это и есть искомая валентность.
5. Сделать проверку путём перемножения валентности и индекса каждого элемента. Их произведения должны быть равны.
Пример: определим валентность элементов сульфида водорода.
1. Запишем формулу:
2. Обозначим известную валентность:
3. Найдём наименьшее общее кратное:
4. Найдём соотношение наименьшего общего кратного к количеству атомов серы:
Определение валентности химических элементов
Валентность — что это за способность у атомов
Валентность — это выраженная в числовом виде способность атома химического элемента образовывать химические связи с определенным количеством других атомов.
Валентность записывают римскими цифрами над химическим элементом. Она принимает значения от 1 до 8, не может быть равна нулю.
H I 2 O I I — атом кислорода образовывает ковалентную связь с двумя атомами водорода. Валентность водорода равна одному, а валентность кислорода — двум.
История возникновения понятия
Термин «валентность» начали использовать около 1425 года — тогда его использовали в значениях «препарат» или «экстракт». В современном понимании его впервые употребили в 1884 году, когда ученые объяснили и описали феномен валентности.
Открытие феномена валентности произошло не сразу. Уильям Хиггинс в 1789 году предположил в своей работе, что между малейшими частицами вещества, т. е. атомами в современной терминологии, существуют связи.
Полную концепцию предложил Эдуард Франкленд, которого считают основоположником представлений о валентности. Это произошло в 1852 году, когда химик ввел понятие «соединительной силы». Свои выводы Франкленд сделал на основе предыдущих работ, а также наблюдений за способностью разных металлов к насыщению. К тому же, он сравнивал составы органических производных металлов с неорганическими соединениями. Так он установил частные закономерности, которые впоследствии послужили основой современного понимания валентности.
Всего три года спустя, в 1861 А. М. Бутлеров сформулировал основу современной теории валентности. Он установил различия между свободными атомами и атомами в соединении, а также обнаружил, что «химическое значение» атомов, т. е. их валентность, в разных соединениях может быть разной.
Впоследствии ученые обобщили знания о валентности и сформировали полную систему знаний по этой теме.
Современные представления о валентности
Как показывает история возникновения понятия «валентность», теория химической связи прошла через долгую эволюцию.
В современной науке валентность в соединениях с ковалентной связью определяется как число двухэлектронных двухцентровых связей. При этом к соединениям с ионной кристаллической структурой применять понятие валентность некорректно из-за характера связи в них. Химическая связь в таких вещества формируется не за счет образования общих электронных пар.
В неорганической химии понятие валентности используется нечасто, оно более распространено в органической химии. В неорганической более распространено понятие степень окисления, т. к. большинство неорганических веществ, в отличие от органических, имеет немолекулярное строение.
Чем отличается от степени окисления
Степень окисления (СО) — это условный заряд атома химического элемента в соединении и характеристика его поведения в окислительно-восстановительной реакции.
Особенность степени окисления в том, что в простых соединениях она всегда равна нулю. В сложных веществах СО определяют на основе постоянных степеней окисления составляющих элементов.
При определении СО элементов в бинарном веществе одному элементу приписывают условный положительный заряд «+», а другому условный отрицательный заряд «−». Так происходит, поскольку электроны связи смещаются от менее электроотрицательных элементов к более электроотрицательным, в результате атомы приобретают частичные заряды.
Электроотрицательность — это способность атома притягивать к себе электроны.
Более электроотрицательный элемент притягивает электроны и получает знак «−», поскольку электроны — отрицательно заряженные частицы. Менее электроотрицательный элемент отдает электроны и становится положительно заряженным.
Таким образом, понятия валентность и степень окисления родственны, но не тождественны. СО обозначает условный электрический заряд атома, если считать, что электроны полностью переходят от более электроотрицательного атома к менее электроотрицательному. Валентность характеризует количество общих электронных пар, которые может образовать атом.
Еще одно различие заключается в том, что степень окисления может быть положительной, отрицательной, равной нулю и даже дробной величиной. А валентность — это целое положительное число.
Валентность и степень окисления можно определить у элемента в одном и том же веществе. Они могут как совпадать, так и различаться.
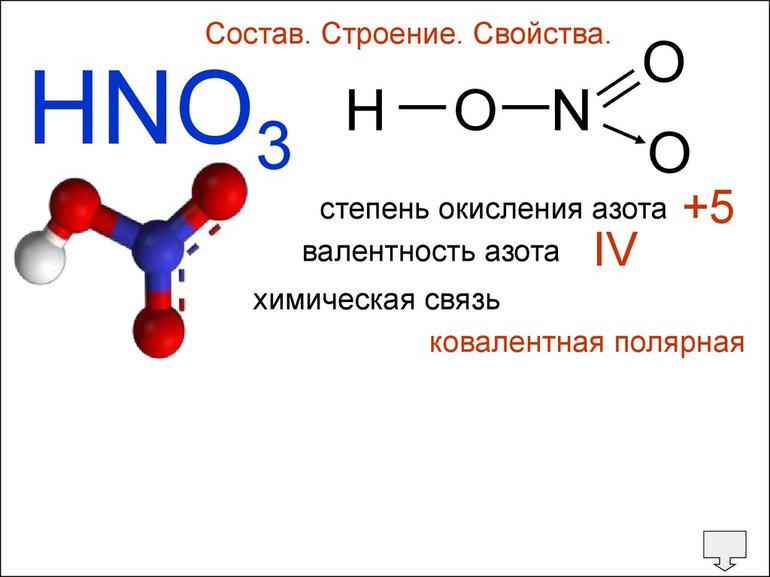
В азотной кислоте H N O 3 валентность азота равна IV, а степень окисления элемента равна +5. В аммиаке N H 3 валентность азота равна III, а степень окисления равна −3.
В некоторых случаях можно определить валентность не отдельного элемента, а группы элементов.
Валентность кислотного остатка азотной кислоты N O 3 равна I.
Виды валентности, как определить для химических элементов
Выделяют два вида валентности:
Постоянная валентность свойственна в основном металлам главных подгрупп.
Переменная — неметаллам и металлам побочных подгрупп. Элементов с переменной валентностью большинство.
Элементы с постоянной валентностью представлены в сводной таблице ниже.
| Валентность | Химические элементы |
| I | H, Na, K, Li, Rb, Cs, Fr |
| II | O, Be, Mg, Ca, Ba, Zn, Sr, Ra |
| III | Al, B |
У элементов с переменной валентностью обычно выделяют два типа валентности:
Высшая валентность обычно равна номеру группы элемента.
Низшую валентность находят как разность между количеством групп в периодической таблице элементов Менделеева (то есть числом 8) и номером группы элемента.
Элементы VII группы основной подгруппы A называют галогенами. В школьном курсе химии в соединениях галогены чаще всего имеют валентность I, но в некоторых соединениях их валентность может быть другой.
Как определить валентность?
Как определить валентность по таблице Менделеева?
Согласно школьному определению валентность — это способность химического элемента образовывать то или иное количество химических связей с другими атомами.
Как известно, валентность бывает постоянной (когда химический элемент образует всегда одно и то же количество связей с другими атомами) и переменной (когда в зависимости от того или иного вещества валентность одного и того же элемента изменяется).
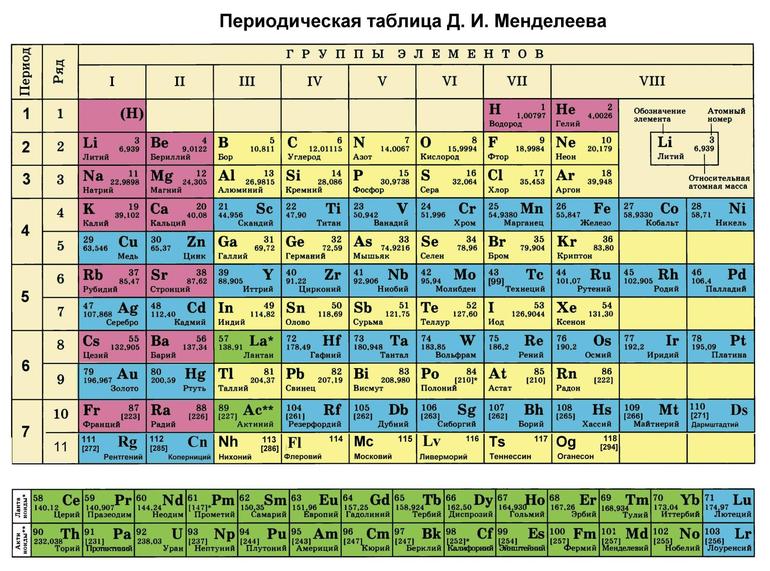
Определить валентность нам поможет периодическая система химических элементов Д. И. Менделеева.
Действуют такие правила:
1) Максимальная валентность химического элемента равняется номеру группы. Например, хлор находится в 7-й группе, а значит, у него максимальная валентность равна 7. Сера: она в 6-й группе, значит, у неё максимальная валентность равна 6.
2) Минимальная валентность для неметаллов равна 8 минус номер группы. Например, минимальная валентность того же хлора равна 8 – 7, то есть 1.
Увы, из обоих правил имеются исключения.
Например, медь находится в 1-й группе, однако максимальная валентность меди равна не 1, а 2.
Кислород находится в 6-й группе, но у него валентность почти всегда 2, а вовсе не 6.
Полезно помнить ещё следующие правила:
3) Все щелочные металлы (металлы I группы, главной подгруппы) всегда имеют валентность 1. Например, валентность натрия всегда равна 1, потому что это щелочной металл.
4) Все щёлочно-земельные металлы (металлы II группы, главной подгруппы) всегда имеют валентность 2. Например, валентность магния всегда равна 2, потому что это щёлочно-земельный металл.
5) Алюминий всегда имеет валентность 3.
6) Водород всегда имеет валентность 1.
7) Кислород практически всегда имеет валентность 2.
8) Углерод практически всегда имеет валентность 4.
Следует помнить, что в разных источниках определения валентности могут отличаться.
Более или менее точно валентность можно определить как количество общих электронных пар, посредством которых данный атом связан с другими.
Согласно такому определению, валентность азота в HNO3 равна 4, а не 5. Пятивалентным азот быть не может, потому что в таком случае вокруг атома азота кружилось бы 10 электронов. А такого не может быть, потому что максимум электронов составляет 8.
Как определить валентность элемента
Для бинарных соединений, т. е. образованных двумя элементами типа 
Если в формуле бинарного соединения нет индексов, то валентности элементов одинаковые. Зная валентность одного элемента, можно написать валентность другого, например:
Если валентность одного элемента равна единице, то валентность другого элемента равна индексу при одновалентном элементе, например:
Определение возможной валентности элемента по его положению в таблице Менделеева
Чтобы составить химическую формулу бинарного соединения, надо знать последовательность элементов в формуле (какой элемент первый) и их валентность.
Правила очередности элементов в формул е и проявляемая валентность следующие.
Примеры определения валентности
Пример 1. Составьте формулу соединения (т.е. вещества) алюминия с кислородом (оксида алюминия).
Решение. Алюминий — металл, поэтому он 1-й в формуле: АlаОb. Валентности кислорода (II) и алюминия (III) — постоянные, следовательно, вид формулы:
Минимальные целые числа, удовлетворяющие равенству а • III = b • II, это а = 2, b = 3. Здесь валентность одного элемента равна индексу при другом элементе, х = b, у = а. Следовательно, искомая формула: Аl2O3.
Пример 2. Составьте формулу соединения серы с кислородом при условии, что сера проявляет свою высшую валентность.
Решение. Сера и кислород — неметаллы. В таблице Менделеева сера находится ниже кислорода, она 1-я в формуле SaOb. Высшая валентность серы равна номеру ее группы (VI) в таблице Менделеева:
Минимальные целые числа, удовлетворяющие равенству а • VI = b • II, это а = 1, b = 3. Здесь валентность одного элемента не равна индексу при другом элементе, х ≠ b, у ≠ а. Искомая формула: SO3.
Пример 3. Составьте формулу соединения серы с фосфором, в котором валентность фосфора — V.
Решение. Оба элемента S и Р — неметаллы. Первым в формуле записываем фосфор, так как он находится левее, чем сера, в таблице Менделеева: PaSb.
Валентность фосфора P(V) указана в задании. Сера (2-й элемент в формуле) проявляет свою низшую валентность S(II). Чтобы удовлетворялось равенство ах = by для соединения 
Пример 4. Составьте химические формулы бинарных соединений с кислородом (оксидов) следующих элементов: a) Li; б) Са; в) Sn(IV); г) С(II); д) Р(III); е) P(V).
Решение. Во всех этих формулах кислород — 2-й в формуле. Там, где валентности элементов нечетные, индекс при кислороде равен валентности соответствующего элемента, а индекс при элементе равен двум — валентности кислорода. В формулах оксидов веществ б) и г) индексов нет, т.к. валентности элементов одинаковые и равны II. В формуле оксида олова, чтобы суммарная валентность кислорода равнялась валентности олова, пишем при кислороде индекс «2». Формулы оксидов:
Конспект урока «Определение валентности на примерах».
Химия
План урока:
Валентность
Представьте на минуточку, что атомы не могли бы соединяться между собой, какой вид имела бы планета, а вопрос: «Существовала ли вообще Солнечная система?» Именно благодаря тому, что атомы соединяются между собой, существуют вещества, а также и мы.
Вернёмся к деталям, мы их будем сравнивать с атомами, а их внешний вид, с количеством связей, которые они могут образовать.
Представим, что в нашем распоряжении есть вот такие детали.
Валентность элементов обусловлена количеством неспаренных электронов на внешнем уровне.
Они могут отличаться цветом, формой, однако их объединяет количество связей, которые они способны образовать. Иначе говоря, что щелочные металлы одновалентны.
Это правило срабатывает и для элементов II группы, только они будут иметь вид двойных деталей.
Как возможно Вы заметили, или вспомнили с темы строение атома, что высшая валентность определяется номером группы, но не всегда ей равна. Исключением с данного правила являются атомы элементов таких как азот, фтор и кислород.
Почему фтор, находясь в VII группе, имеет валентность постоянную равную единице. В то время, для других его родственников, она будет равнять I, III, V или даже VII.
Причины постоянной и переменной валентности
Для большинства элементов характерно иметь переменную валентность. Но для некоторых она будет постоянной. Некоторые элементы Вам уже известны, пополнит этот список кислород и цинк, которые всегда двухвалентны, алюминий имеет число связей III.
Расположение элементов в периодической таблице подсказывает, о количестве связей, которые могут они образовать.
Определение валентности элементов по формулам
На рисунке изображены молекулы известных Вам веществ: это аммиак NH3, запах этого газа очень резкий и его трудно забыть, если хоть раз ощущали запах нашатырного спирта, с помощью его приводят людей в чувство после обморока.
Молекула Н2О окружает нас повсюду. Во всех этих соединениях имеются атомы водорода, только в разных количествах. Давайте попробуем определить валентность по формуле вещества. Вспомним, что водород одновалентен. Если в аммиаке водорода насчитываем 3 атома, значит азот, условно, можем изобразить в виде такой детали.
Как видно с рисунка, он имеет валентность III. Поэтому принципу определим валентность углерода, приходим к выводу, что он четырёхвалентен.
Но не всегда мы видим структурные формулы, которые отображают связи между атомами, и не всегда имеем дело с одновалентными элементами. Возьмём, к примеру, вещество состава Р2О5. На два атома фосфора приходится 5 атомов кислорода. Постоянную валентность имеет кислород, которая равняется II. Чтобы определить, какую валентность будет иметь фосфор, необходимо выполнить следующие математические действия.
Встречаются такие соединения, где необходимо определить валентность остатков, входящих в состав кислот. Например, вещество состава Mg3(PO4)2.
Выполним согласно алгоритму. Магний всегда двухвалентен.
Искомая валентность кислотного остатка равна III. Следует заметить, что в веществе всегда находиться элемент, который проявляет постоянную валентность.
При написании уравнений реакций возникает необходимость составления формул веществ. Рассмотрим реакцию обмена между оксидом алюминия и соляной кислотой.
В результате обмена образуется два вещества состава AlCl и НО. Чтобы определить количественный состав в веществах, воспользуемся следующим алгоритмом.
Составление химических формул по валентности
Уравнение приобретает вид
Обратите внимание, что количество атомов отличается в реагентах и продуктах, его необходимо уравнять.
Составим формулы веществ по валентности элементов.
Немаловажную роль наравне с валентностью играет такое понятие как степень окисления (СО).
Термин валентность применим для соединений, имеющих молекулярное строение. Но, как известно, ещё существуют вещества ионного строения, которые образуются за счёт электростатического притяжения между разноимёнными зарядами. Каким образом они образуются? Чтобы ответить на данный вопрос, вспомним об электроотрицательности.
При образовании вещества, одни атомы будут отдавать свои электроны, другие – принимать. Рассмотрим на примере соединений молекулярного строения Cl2, HCl и ионного NaCl.
Обратите внимание, что вещества молекулярного строения, имеют структурную формулу, соединение атомов между собой показывается в виде черты – между ними. Для веществ имеющих строение, отличающее от молекулярного, более применимо понятие степени окисления, которое имеет универсальное применение для всех типов веществ.
А вот какую степень окисления имеет простое вещество. Атомы равноценные партнёры, поэтому она будет нулевая.
Правила определения степени окисления
Подобно валентности, для определённых элементов свойственна постоянная степень окисления. Это металлы, которые отличаются малым количеством электронов внешнего слоя. Отличительной характеристикой их будет невозможность иметь отрицательный заряд, поскольку они ВСЕГДА отдают электроны.
Все эти значения вытекают с периодической системы, которая помогает определить степени окисления элементов.
С таблицы видно, что для большинства элементов эта величина не постоянная.
Чтобы вычислить степень окисления элементов в соединениях, будем руководствоваться следующими правилами.
Как бы то ни было, природа не ограничивается бинарными соединениями. Существует множество веществ состоящих из 2 и более элемента. Впрочем вычисление совсем не отличается, первоначально определяем элементы, имеющие постоянную степень окисления, а дальше проделав нехитрые математические действия находим СО для остальных. Главное правило, чтобы вещество было нейтральным, количество плюсов должно равняться количеству минусов.
К примеру, в веществе H2SO3 самым электроотрицательным является кислород, он заберёт электроны как в водороде, так и в серы, вследствие этого имеет отрицательную СО, а Hи Sстанут положительными. В этом соединение имеются 2 элемента, имеющих известную СО – это Н и О.
Обратите внимание, на нахождение СО в кислотном остатке. В данном случае, мы приравниваем не к 0, а к заряду аниона.
Здесь у серы х внизу
Сайт о жизни студентов во всех ее проявлениях
Как определить валентность элемента?
Существует несколько определений понятия «валентность». Чаще всего этим термином называют способность атомов одного элемента присоединять определённое число атомов других элементов. Часто у тех, кто только начинает изучать химию, возникает вопрос: Как определить валентность элемента?. Сделать это несложно, зная несколько правил.
Валентности постоянные и переменные

В приведённом примере атом фтора связан только с одним одновалентным атомом H, значит валентность его тоже равна 1. Атом серы в H2S присоединяет к себе уже два атома H, поэтому она в данном соединении двухвалентна. С двумя водородными атомами связан и кальций в его гидриде CaH2, а значит, и его валентность равна двум.

Атом серы в первом случае присоединяет к себе два кислородных атома, то есть всего образует 4 химические связи (один кислород образует две связи, значит сера — два раза по 2), то есть валентность ее равна 4.

Обратите внимание на то, что атом H одновалентен в любом соединении. Всегда (кроме иона гидроксония H3O(+)) равна 2 валентность кислорода. По две химические связи как с водородом, так и с кислородом образует кальций. Это элементы с постоянной валентностью. Кроме уже указанных, постоянную валентность имеют:
Атом серы, в отличие от рассмотренных случаев, в соединении с водородом имеет валентность, равную II, а с кислородом может быть и четырех- и шестивалентна. Про атомы таких элементов говорят, что они имеют переменную валентность. При этом максимальное ее значение в большинстве случаев совпадает с номером группы, в которой находится элемент в Периодической системе (правило 1).
Из этого правила есть много исключений. Так, элемент 1 группы медь, проявляет валентности и I, и II. Железо, кобальт, никель, азот, фтор, напротив, имеют максимальную валентность, меньшую, чем номер группы. Так, для Fe, Co, Ni это II и III, для N — IV, а для фтора — I.
Минимальное значение валентности всегда соответствует разнице между числом 8 и номером группы (правило 2).
Однозначно определить, какова же валентность элементов, у которых она переменная, можно только по формуле определенного вещества.
Определение валентности в бинарном соединении
Рассмотрим, как определить валентность элемента в бинарном (из двух элементов) соединении. Здесь возможны два варианта: в соединении валентность атомов одного элемента известна точно или же обе частицы с переменной валентностью.
Случай первый:
Случай второй:
Определение валентности по формуле трехэлементной частицы.
Далеко не все химические вещества состоят из двухатомных молекул. Как определить валентность элемента в трёхэлементной частице? Рассмотрим этот вопрос на примере формул двух соединения K2Cr2O7.
Если же вместо калия в формуле будет присутствовать железо, или другой элемент с переменной валентностью, нам потребуется знать, какова же валентность кислотного остатка. Например, нужно вычислить валентности атомов всех элементов в соединении с формулой FeSO4.
Следует отметить, что термин «валентность» чаще использую в органической химии. При составлении формул неорганических соединений чаще используют понятие «степень окисления».
Как определить валентность если она переменная. Что такое валентность
1. Постоянная валентность
2. Переменная валентность
§ 11. Валентность химических элементов
НС1 Н 2 О NH 3 СН 4
Хлороводород вода аммиак метан
Как видно из приведенных примеров, атомы элементов хлора, кислорода, азота, углерода обладают свойством присоединять не любое, а только определенное число атомов водорода. Таким же свойством обладают и другие элементы в различных соединениях. Понятию «валентность» можно дать следующее определение:
(Численное значение валентности принято обозначать римскими цифрами, которые ставятся над знаками химических элементов.)
Ответьте на вопросы 1-3 (с. 32).
§12. Определение валентности элементов по формулам их соединений. Составление химических формул по валентности
Определение валентности элементов по формулам их соединений.
Зная формулы веществ, состоящих из двух химических элементов, и валентность одного из них, можно определить валентность другого элемента. Например, если дана формула оксида меди СuО, то валентность меди можно определить следующим образом. Валентность кислорода равна двум, а на один атом кислорода приходится один атом меди. Следовательно, валентность меди тоже равна двум.
При определении валентности элемента по формуле следует учитывать, что число единиц валентности всех атомов одного элемента должно быть равно числу единиц валентности всех атомов другого элемента.
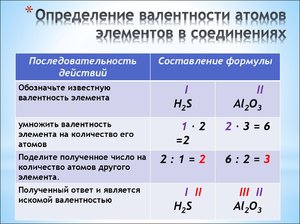
Итак, валентность элементов по формулам можно определить следующим образом:
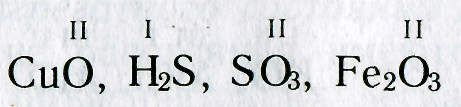
2. Находят и записывают общее число валентностей (наименьшее общее кратное) известного элемента:
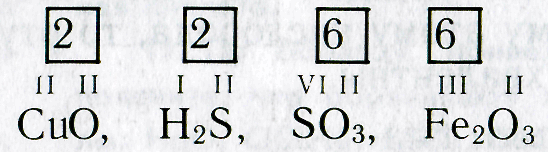
Составление химических формул по валентности. Чтобы составить химическую формулу, необходимо знать валентность элементов, образующих данное химическое соединение. Сведения о валентности некоторых элементов приведены в таблице 3.
Таблица 3. Валентность некоторых элементов в химических соединени
При составлении химических формул можно соблюдать следующий порядок действий:
1. Пишут рядом химические знаки элементов, которые входят в состав соединения:
2. Над знаками химических элементов проставляют валентность:
3. Определяют наименьшее общее кратное чисел, выражающих валентность обоих элементов: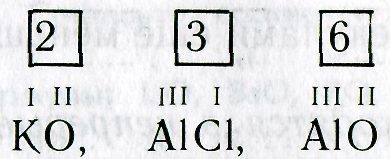
4. Делением наименьшего общего кратного на валентность соответствующего элемента находят индексы (индекс «1» не пишут):
Однако относительные молекулярные массы вычисляются как для веществ с молекулярным, так и для веществ с немолекулярным строением. Для последних понятия «молекула» и «относительная молекулярная масса» употребляют условно.
Основные положения атомно-молекулярного учения можно сформулировать так:
1. Существуют вещества с молекулярным и немолекулярным строением.
2. Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества и температуры. Наибольшие расстояния имеются между молекулами газов. Этим объясняется их легкая сжимаемость. Труднее сжимаются жидкости, где промежутки между молекулами значительно меньше. В твердых веществах промежутки между молекулами еще меньше, поэтому они почти не сжимаются.
3. Молекулы находятся в непрерывном движении. Скорость движения молекул зависит от температуры. С повышением температуры скорость движения молекул возрастает.
5. Молекулы состоят из атомов, которые, как и молекулы, находятся в непрерывном движении.
6. Атомы одного вида отличаются от атомов другого вида массой и свойствами.
7. При физических явлениях молекулы сохраняются, при химических, как правило, разрушаются.
9. У веществ с немолекулярным строением в узлах кристаллических решеток находятся атомы или другие ча c тицы (с. 14). Между этими частицами существуют сильные химические связи, для разрушения которых требуется много энергии. Поэтому вещества с немолекулярным строением имеют высокие температуры плавления.
Сущность химических реакций заключается в разрушении химических связей между атомами одних веществ и в перегруппировке атомов с образованием других веществ.
Ответьте на вопросы 8-12 (с. 33).
1. Что такое валентность химических эле ментов? Поясните это на конкретных примерах.
2. Почему валентность водорода принята за единицу?
3. В реакции железа с соляной кислотой один атом металла вытесняет два атома водорода. Как это можно объяснить, пользуясь понятием о валентности?
5. Даны химические символы элементов и указана их валентность. Составьте соответствующие химические формулы:
I II V IV I III VII II III II IV III I
LiO, ВаО, РО, SnO, КО, РН, MnO, FeO, BO, HS, NO, CrCI.
6. Пользуясь данными таблицы 3 (с. 30), составьте химические формулы соединений с кислородом следующих химических элементов: Zn, В, Be, Co, РЬ, Ni. Назовите их.
7. Составьте формулы оксидов: меди (I), железа (III), вольфрама (VI), железа (II), углерода (IV), серы (VI), олова (IV), марганца (VII).
8. Изложите сущность основных положений атомно-молекулярного учения.
9. Какие явления подтверждают: а) движение молекул; 6) наличие между молекулами промежутков?
10. Чем отличается движение молекул в газах, жидкостях, твердых веществах?
11. Чем отличаются по своим физическим свойствам твердые вещества с молекулярным и немолекулярным строением?
12. Как объяснить физические и химические явления с точки зрения атомно-молекулярного учения?
1. Вычислите относительные молекулярные массы: а) оксида железа (III); б) оксида фосфора (V); в) оксида марганца (VII).
2. Определите массовые доли элементов в оксиде меди (I) и в оксиде меди (II). Найденные массовые доли выразите в процентах.
1. Что такое валентность химических эле- рода. Как это можно объяснить, пользуясь ментов? Поясните это на конкретных примерах. понятием о валентности?
2. Почему валентность водорода принята 4. Определите валентность элементов по за единицу? формулам: HgO, K 2 S, B2O3, ZnO, МпОг, NiO,
один атом металла вытесняет два атома водо- 5. Даны химические символы элементов и
Для отдельных классов соединений, где преобладает какой-либо один тип химического взаимодействия, полезную информацию о способности атомов к образованию связей могут дать перечисленные ниже частные понятия (частные определения В.).
1. Определение понятия «валентность» и связь его с другими понятиями химии
Ковалентность равна числу неспаренных электронов атома, участвующих в образовании связи, и часто может принимать все значения от 1 до максимальной, которая для большого числа элементов совпадает с номером их группы в периодической системе Менделеева (подробно см. разделы 2 и 3).
Однако по своему определению ОЧ, в отличие от ковалентности и ионной В., имеющих чёткий физический смысл, носит в общем случае условный характер и, за исключением весьма ограниченного класса соединений с чисто ионной связью, не совпадает ни с эффективными зарядами атомов в соединениях, ни с фактическим количеством связей, которые атом образует. Кроме того, в ряде случаев, в частности, когда электроотрицательности двух разных связанных атомов близки и связь между ними имеет почти чисто ковалентный характер, возникает неопределённость, к какому из них следует целиком относить электронную пару (см. Окислительное число).
2. Эволюция понятия «валентность» и его роль в истории химии
Первый камень преткновения изучающих химию. Большой ошибкой является подход, когда учащийся не пытается понять валентность, ожидая, что знания об этом потом приложатся сами собой. Но этот подход неверный, так как без понимания этого мы упираемся в тупик неспособности составить даже простейшую формулу.
Что такое «валентность» элементов?
Обозначают валентность элемента всегда только римскими цифрами. Посмотреть ее значение для разных атомов можно в специальной таблице.
Какие бывают характеристики у валентности элементов?
Влияние валентности элементов в химических реакциях.
Даже того как ученые узнали, что атом — это не мельчайшая частица в мире, они уже оперировали этим понятием. Они понимали, что есть внутренний фактор, который влияет на протекание химической реакции различных веществ. Из-за того, что ученые по-разному видели строение молекулы, понятие «валентность элемента » пережило несколько метаморфоз.
Валентность вещества определяется количеством внешних электронов атома. Каким количеством электронов атом обладает, столько максимально соединений он способен совершить. Таким образом «валентность» подразумевает собою число электронных пар атомов.
Хотя электронная теория появилась намного позже, после «разделения» атома на более мелкие частицы, до этого ученые все равно вполне успешно определяли валентность в большинстве случаев. Удавалось им это благодаря химическому анализу веществ.
Это была тяжелая работа: прежде всего, требовалось определить массу элемента в чистом виде. Далее, с помощью химического анализа, ученые определяли каков состав соединения, и только потом могли высчитать, сколько атомов содержит в себе молекула вещества.
Этот метод все еще используется, но не является универсальным. Так удобно определять элемент в простом соединении веществ. Например, с одновалентным водородом, или двухвалентным кислородом.
Но уже при работе с кислотами метод не особо удачный. Нет, мы можем частично использовать его, например, при определении валентности соединений кислотных остатков.
Валентность элементов в формулах.
Как мы уже говорили выше, понятие «валентность элементов » связанно с электронной структурой атома. Но это не единственный вид связи, которые существуют в природе. Химики знакомы еще с ионными, кристаллическими и другими формами структуры вещества. Для таких структур валентность уже не столь актуальна, но вот работая с формулами молекулярных реакций, мы обязательно должны ее учитывать.
Для того, чтоб сделать формулу мы должны расставить все индексы, которые уравновешивают количество атомов, вступающие в реакцию. Только зная валентность веществ, мы можем правильно расставить индексы. И наоборот, зная молекулярную формулу и имея индексы, можно узнать валентность элементов, что входят в состав вещества.
Для произведения подобных расчетов важно помнить, что валентности обоих элементов, вступивших в реакцию, будут равны, а значит, для поиска необходимо найти наименьшее общее кратное.
Необычные способы определения валентности элементов.
Наглядность.
Спонсор размещения P&G Статьи по теме «Как определить валентность» Как доказать амфотерность гидроксидов Как вычислить валентность Как определить химическую формулу
Возьмите на заметку, что обозначается показатель валентности римскими цифрами и ставится над знаком элемента.
Обратите внимание: если формула двухэлементного вещества написана правильно, то,
при умножении числа атомов каждого элемента на его валентность, у всех элементов
должны получиться одинаковые произведения.
Заметьте, что в молекулах водородных соединений вычислить валентность очень просто.
Водород всегда одновалентен, а этот показатель у связанного с ним элемента будет равняться количеству атомов водорода в данной молекуле. К примеру, в CaH2 кальций будет двухвалентен.
Запомните главное правило определения валентности: произведение показателя валентности атома какого-либо элемента и количества его атомов в какой-либо молекуле всегда равно произведению показателя валентности атома второго элемента и количества его атомов в данной молекуле.
Рассмотрите пример с молекулой оксида серы SО2. Кислород во всех соединениях двухвалентен, поэтому, подставляя значения в пропорцию: Vкислорода х Кислорода = Vсеры х Ксеры, получаем: 2 х 2 = Vсеры х 2. От сюда Vсеры = 4/2 = 2. Таким образом, валентность серы в данной молекуле равна 2.
Другие новости по теме:
Химическая формула – это запись, сделанная с использованием общепринятых символов, которая характеризует состав молекулы какого-либо вещества. Например, формула всем известной серной кислоты – H2SO4. Легко можно увидеть, что каждая молекула серной кислоты содержит два атома водорода, четыре атома
Химия для каждого школьника начинается с таблицы Менделеева и фундаментальных законов. И уже только потом, уяснив для себя, что же изучает эта сложная наука, можно приступать к составлению химических формул. Для грамотной записи соединения нужно знать валентность атомов, составляющих его. Спонсор
Валентность – один из основных терминов, употребляемых в теории химического строения. Это понятие определяет способность атома образовывать химические связи и количественно представляет собой число связей, в которых он участвует. Спонсор размещения P&G Статьи по теме «Что такое валентность» Что
Со школы или даже раньше каждый знает, всё вокруг, включая и нас самих, состоит их атомов – наименьших и неделимых частиц. Благодаря способности атомов соединяться друг с другом, многообразие нашего мира огромно. Способность эта атомов химического элемента образовывать связи с другими атомами
Валентность химических элементов
Общая характеристика
Валентность представляет способность атомов создавать химические соединения, добавлять другие атомы. С давних времен известны исторические данные о молекулярной, атомной структуре веществ.
Необходимость и основные понятия
Определение в переводе характеризует силу, создание. Главное суждение введено до открытия строения атома. Природа химических соединений заключается в делении между собой пары частиц на валентные электроны.
Число обобществленных связей, которыми атом соединяется с другими элементами, называется валентностью. В учет не берется полярность связей, поэтому показатель не имеет знака и не равен 0. В химических сочетаниях атомные частицы находятся в числовом соотношении.
Соединения водорода H с разными микрочастицами:
Атом Cl (хлора) связан с одним А. водорода, О2 (кислорода) — с двумя, азота (N)-с тремя, а углерода — с 4 атомными частицами. В молекуле углекислого газа СО2 частица Н связана с двумя атомами кислорода.
А. соединяются по-разному с другими элементами. Такая способность выражается численной характеристикой.
Обозначение валентности:
Один атом водорода соединяется только с одной частью другого элемента, соответственно, валентность принимают за 1. Объясняя «химическим» языком, атомная частица водорода обладает единицей валентности (В), он одновалентен.
Образование химических связей атома любого элемента соответствует количеству соединившихся мелких частиц водорода. В молекуле хлороводорода валентность Cl равна 1, а в молекуле воды у атома кислорода — двум. В структурной составляющей метана В. углерода равна 4. Условно в химии обозначают единицы валентности римскими цифрами I-Х.
Историческая справка и взгляды ученых
Скудные знания о строении молекулярных и атомных частицах 19 века не позволяли объяснить причины, по которым атомы образуют связи с другими элементами. Валентность как основной принцип химии изучается до сих пор.
Ученый Э. Франкленд ввел терминологию «связь» в научные труды для характеристики взаимодействия атомов между собой. Специалист выяснил, что некоторые элементы образуют соединения с одними и теми же атомами. Азот прикрепляет три водородных частицы в молекуле аммиака.
Позже ученый выдвинул теорию о существовании конкретных чисел химической связи и назвал ее «соединительной силой». Труды Франклина стали значимым вкладом в структурную химию.
Мнения, научные работы доказаны в 1860 г. немецким деятелем Ф. Кекуле. По его мнению, углерод является из четырех основным, в самом простейшем его соединении частиц (метане) образуются связи с 4 атомами Н.
В Советском союзе информацию о строении веществ систематизировал А. Бутлеров. Последующее развитие связей получило введение периодической теории Д. Менделеева. Он подтвердил, что валентность Э. в соединениях и прочие свойства обусловлены занятым положением в периодической системе.
Главным преимуществом теории В. является возможность наглядного изображения молекулярного строения. Первые модели возникли в середине 19 века, а позже использовались структурные формулы в виде окружности с химическим знаком. Между обозначений атомов черточкой выделяется связь, а число линий соответствует В.
Основная классификация
Элементы распределяются с постоянной и переменной валентностью. Углерод соединяется с различными атомами кислорода, поэтому имеет переменную валентность. Многие элементы имеют неустойчивую величину.
| Валентность | |||
| Постоянная | Переменная | ||
| Элемент | В | Элемент | В |
| H (Водород) | I | I (Йод) | I |
| Li (Литий) | S (Сера) | II, IV, VI | |
| Na (Натрий) | N (Азот) | I-V | |
| K (Калий) | F | II, III | |
| F (Фтор) | Cu | I, II | |
| Al (Алюминий), B, Р | III, V | C, Si | II, IV |
| O (Кислород), Mg (Магний), Ca (Кальций), Ba (Барий), Zn (Цинк) | II | Cl, Br, I | I, III, V, VII |
Водород образует связь не с каждым элементом, а кислородные соединения имеются почти у всех. В таких сочетаниях атомы О2 проявляют двукратную валентность.
Ковалентная связь осуществляется из-за образования общих электронных пар. Когда между 2 атомными структурами (А) существует совместная электронная пара, она называется одинарной, при наличии двух — двойной, трех — тройной.
Валентность азота N в связи NH3 составляет III, поскольку один атом Н связан с тремя частицами N. Валентность углерода в метане (СН4), по тому же принципу будет 4 (IV).
Валентность хлора в молекуле хлороводорода равна единице, индекс не применяется. Одному атому H соответствует 1 атом Cl. Если образованная химическая связь углерода © в метане равна 4, валентность Н — всегда 1. Рядом с Н ставится индекс 4, а формула метана выглядит следующим образом: CH4.
Постоянной одной В. остается H, K, F. Двухвалентные — кислород, магний, кальций, цинк, а трехвалентные — алюминий. Валентность брома, железа, меди, хлора или прочих элементов модифицируется, когда они формируют различные соединения.
Йод представлен в таблице 53 по счету. Присутствие одного неспаренного электрона говорит о способности проявлять низшую В., равную единице в соединениях. Зная валентность, можно легко составить формулы соединений.
Определение по формуле
Если под рукой нет таблицы Менделеева, то существует возможность установления В. элемента с помощью несложных расчетов. Для примера выбирается формула оксида марганца — Mn2O7.
Кислород двухвалентный, а для определения марганца В. кислорода умножают на число атомов газа в сочетании 2*7, получается 14. Это число делится на количество мелких атомных частиц Mn:14/2 = 7. В полученном соединении валентность составляет VII.
Индексы в молекулярных веществах отображают число А., входящих в состав. Получив формулу вещества, в котором известна В. одного элемента, можно определить В. другого. В веществе, состоящем из молекул число В. обоих элементов равно. Используется минимальное общее кратное для определения неизвестной В.
Например, в образовании формулы связи оксида железа Fe2O3 участвуют пара атомов Fe с валентностью III и три атома O с двойной валентностью. Минимальным общим кратным будет 6.
Для правильной формулировки записи оксида фосфора учитывается В кислорода (II) и фосфора (V). Наименьшее общее кратное для Р и О получается десять. Обозначение записывается Р2О5.
Понимая и зная свойства элементов, проявляющих в разных сочетаниях, можно находить валентность по внешнему параметру соединений. Оксиды меди (купрум) имеют красный (Cu2O) и черный (CuО) цвет. Гидроксиды меди будут желтыми (CuОН) и синими (Cu (ОН)2).
Чтобы составить формулу бинарных соединений элементов, достаточно определить валентность. Если требуется записать формулу кислородного соединения хлора (ClO), в котором валентность Cl равна 7, соблюдают последовательность:
Записывают индексы возле знаков элементов. Получается Cl2O7.
Труды Менделеева
Согласно электронной теории, В. атома определяется из числа непарных электронов (Э)., участвующих в формировании пар с Э. других атомов. Понятие В. связано с созданием закона Менделеева.
Теория электронов
Атомы представляют положительную основу (ядро), вокруг которой расположены отрицательно заряженные электроны. Наружная оболочка последних бывает недостроенной, а завершенная структура устойчивее, она включает восемь электронов.
Создание связи за счет общих пар электронов приводит к благоприятному состоянию атомов.
Максимальная В. — это величина Э. во внешней оболочке атома. Химические связи составляют Э., находящиеся на наружной оболочке атома. Изучив таблицу Менделеева, можно определить, что положение веществ в периодической системе и его В. взаимосвязаны.
Валентность:
Основанием для образования соединений является прием электронов.
Виды электронов:
Когда атом отрицательно заряжен частицами без пары для взаимодействия, то они образуются в таком количестве, сколько имеется неспаренных электронов.
В молекулярной структуре водорода и серы H2S последнее вещество приобретает двойную валентность (-), потому что каждый атом участвует в образовании 2 электропар. Знак черточка или тире указывает на притяжение пары к более отрицательному элементу. У менее отрицательного к валентности добавляют знак плюс.
Распределение свойств
В периодической таблице указаны все 118 химических элементов (водород, литий, бор, натрий, магний, кальций, ванадий, уран и другие).
Химические и физические свойства каждого вещества похожи с предшествующим ему в таблице элементом. Закономерность проявляется у всех, кроме нескольких первых, потому что они не включают перед собой элементов, аналогичных по атомному объему.
Валентность металлов:
| Элемент | В |
| Серебро | I-III |
| Ртуть | I-II |
| Золото | I-III |
| Никель | I- IV |
| Мышьяк | -III, II, III, V |
| Свинец | II-IV |
| Кобальт | II-IV |
| Олово | II, IV |
В периодической таблице элементы классифицированы, упорядочены с учетом атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды называются периодами, а столбцы — группами. В самой первой таблице содержалось не более шестидесяти элементов, теперь продолжительность списка увеличили до 118 элементов. Систематизированы не только химические вещества, но и их свойства.
Достаточно ученому-химику взглянуть на таблицу, и он сможет ответить на разные экзаменационные, научные вопросы.
Говоря о степени окисления, предполагают, что атом в веществе ионной природы имеет заряд, и если валентность нейтральная, то уровень окисления будет нулевым, положительным или отрицательным. Узнать информацию можно из таблицы Менделеева.
Для атома одного и того же Э., в зависимости от элементов, с которыми он сформирует химическое соединение, В. и стадия окисления совпадают (Н2О, СН4) и различаются (Н2О2, HNO3). Само понятие валентности ученые-химики не используют по Менделеевской таблице.