Как пить биодрон
Как пить биодрон
Бондронат (таблетки) : инструкция по применению
Состав
1 таблетка, покрытая оболочкой, содержит: активное вещество: ибандроновая кислота 50 мг (в виде натрия ибандроната моногидрата 56.25 мг)
вспомогательные вещества: лактозы моногидрат, повидон (К 25), целлюлоза микрокристаллическая, кросповидон, кислота стеариновая, силикагель коллоидный безводный
оболочка: опадрай 00А28646 (гипромеллоза, титана диоксид (Е 171), тальк)
Описание
Фармакологическое действие
Ингибитор костной резорбции, азот-содержащий бисфосфонат. Оказывает специфическое селективное действие на костную ткань благодаря высокой аффинности к минеральным компонентам кости. Подавляет активность остеокластов, снижает частоту скелетных осложнений при злокачественных заболеваниях.
Ибандроновая кислота уменьшает остеокласт-ассоциированное высвобождение факторов роста опухоли, тормозит распространение и инвазию клеток опухоли, проявляет синергический эффект с таксанам in vitro. Ибандроновая кислота предотвращает костную деструкцию, вызванную блокадой функции половых желез, ретиноидами, опухолевыми процессами или введением экстрактов опухолевой ткани in vivo.
В дозах, значительно превышающих фармакологически эффективные, ибандроновая кислота не влияет на минерализацию костной ткани.
Ибандроновая кислота предотвращает развитие новых и снижает рост уже имеющихся костных метастазов, что приводит к снижению частоты скелетных осложнений, интенсивности болевого синдрома, потребности в проведении лучевой терапии и хирургических вмешательств по поводу метастатического процесса в костях, тем самым приводя к значительному улучшению качества жизни пациентов.
Ибандроновая кислота дозозависимо ингибирует опухолевый остеолиз, что определяется при помощи маркеров костной резорбции (пиридинолин и дезоксипиридинолин).
Фармакокинетика
Концентрация в плазме ибандроновой кислоты увеличивается пропорционально дозе введенного внутривенно (в дозе до 6 мг) или принятого внутрь препарата (в дозе до 100 мг).
Биодоступность ибандроновой кислоты снижается до 75% при ее приеме через 2 часа после еды, в связи с чем таблетки Бондроната рекомендуется принимать натощак с последующим приемом пищи не ранее чем через 30 мин.
Данных о том, что ибандроновая кислота метаболизируется нет.
40-50% количества препарата циркулирующего в крови проникает в костную ткань и накапливается в ней, оставшийся препарат выводится в неизмененном виде почками.
Невсосавшийся препарат после перорального введения выводится в неизмененном виде с калом.
Терминальный период полувыведения 10-60 ч. Концентрация препарата в крови снижается быстро и достигает 10% от максимальной через 3 ч после в/в введения и 8 ч после приема внутрь.
При в/в назначении ибандроновой кислоты с интервалом 4 недели в течение 48 недель у пациентов с метастатическим поражением костей системной кумуляции не отмечено. Общий клиренс ибандроновой кислоты 84-160 мл/мин. Почечный клиренс (60 мл/мин у здоровых женщин в менопаузе) обуславливает 50-60% общего клиренса и зависит от клиренса креатинина. Разница между общим и почечным клиренсом отражает захват вещества в костной ткани.
Фармакокинетика ибандроновой кислоты не зависит от пола. Так же не выявлено клинически значимых межрасовых различий распределения ибандроновой кислоты у лиц южно-европейской и азиатской расы. Относительно негроидной расы данных недостаточно.
Больные с нарушением функции почек
Экспозиция ибандроновой кислоты у больных с различными нарушениями функции почек зависит от клиренса креатинина (КК). После однократной в/в инъекции 6 мг ибандроновой кислоты (15-минутная инфузия) средняя АиС0-24 выгтте на 14% у пациентов с нарушением функции почек легкой степени тяжести (среднее значение КК=68.1 мл/мин) и на 86% у пациентов с нарушением функции почек средней степени тяжести (среднее значение КК=41.2 мл/мин) по сравнению с здоровыми добровольцами (среднее значение КК=120 мл/мин). Средняя Стах не возрастает у пациентов с нарушением функции почек легкой степени тяжести и увеличивается на 12% у пациентов с нарушением функции почек средней степени тяжести. У больных с тяжелым нарушением функции почек (КК 30 мл/мин) коррекции дозы при пероральном приеме не требуется. При в/в введении требуется изменение дозы и времени инфузии у пациентов с метастатическим поражением костей при раке молочной железы.
37% ибандроновой кислоты выводится из организма во время стандартной 4-часовой процедуры гемодиализа.
Больные с нарушением функций печени Данных о фармакокинетике ибандроновой кислоты у больных с нарушением функций печени нет. Печень не играет существенной роли в клиренсе ибандроновой кислоты, которая не метаболизируется, а выводится через почки или связывается в костной ткани. У больных с нарушением функции печени коррекции дозы не требуется. Кроме того, в терапевтических концентрациях ибандроновая кислота слабо связывается с белками плазмы крови (87%), поэтому, вероятно, что гипопротеинемия при тяжелых заболеваниях печени не приводит к клинически значимому повышению концентрации ибандроновой кислоты в крови. Пожшой возраст
Изученные фармакокинетические параметры не зависят от возраста. Следует учитывать возможное снижение функции почек у пожилых пациентов.
Данные о применении Бондроната у лиц моложе 18 лет отсутствуют.
Отчет о проведении клинических испытаний, переносимости и клинической эффективности, препарата Биоарон С у детей, страдающих часто рецидивирующими бактериальными и вирусными инфекциями верхних дыхательных путей
Московский научно-исследовательский институт педиатрии и детской хирургии Росздрава
Отделение аллергологии и клинической иммунологии
Руководитель отдела клинической аллергологии и иммунологии ФГУ «МНИИ педиатрии и детской хирургии Росздрава»,
д.м.н. А.Н.Пампура
Обоснование исследования.
Несмотря на большие достижения в области фармакотерапии частота заболевания респираторными острыми инфекциями у детей органов дыхания остается достаточно высокой. Особенно это касается так называемой группы часто болеющих детей (ЧБД). По данным российских авторов «часто болеющими» являются дети, перенесшие острые респираторные инфекции (ОРЗ) более 4-6 раз в год в зависимости от возраста. В России каждый 4-5 ребенок может быть отнесен к группе часто болеющих детей. На эту группу приходится более 60% всех заболеваний детского возраста.
Развитию острых инфекционно-воспалительных заболеваний дыхательных путей, нарушающих местные и общие защитные механизмы, способствуют различные причины, в том числе и нарушения в иммунной системе: угнетение клеточного иммунитета и локальной продукции секреторных иммуноглобулинов, повреждение слизистых и клеточных мембран, мукоцилиарного эпителия. Большое значение в тактике лечения длительного и часто болеющих детей в последние годы отводится иммунокоррекции.
В МНИИ педиатрии и детской хирургии Росздрава проведена оценка клинической эффективности и безопасности профилактического применения препарата Биоарон С и его влияния на ряд иммунологических показателей у детей, страдающих часто рецидивирующими бактериальными и вирусными инфекциями верхних дыхательных путей.
Цель исследования
Оценить клиническую эффективность и безопасность препарата Биоарон С в комплексной терапии детей, страдающих часто рецидивирующими бактериальными и вирусными инфекциями верхних дыхательных путей.
Задачи исследования
Общий дизайн исследования
Тип исследования: открытое не сравнительное исследование курсового применения препарата Биоарон С.
Дизайн: открытая оценка в одной группе детей с учетом исходного состояния.
Место проведения и участники исследования: отделение аллергологии и клинической иммунологии ФГУ «МНИИ педиатрии и детской хирургии Росздрава»
Число больных: в исследование было включено 71 ребенок в возрасте от 3 до 12 лет, окончили исследование 60 пациентов, выбыли – 11 детей.
Длительность наблюдения: 6 месяцев
Оценка состояния детей проводилась на 0, 1, 15, сутки от начала приема Биоарона С и через 6 месяцев.
Пациенты
В исследование было включено 71 больной в возрасте от 3 до 12 лет (средний возраст 7,7±0,38 лет), при этом 27 детей в возрасте от 3 до 6 лет и остальные 44 ребенка – от 6 до 12 лет, из них 28 девочек и 43 мальчика.
Больные были включены в исследование при наличии всех критериев включения и отсутствии любых критериев исключения.
Критерии включения:
Критерии исключения:
Процедуры исследования и методы оценки
Исследование проводилось в соответствии со следующим дизайном (табл.1).
Таблица 1
Дизайн исследования
| Период исследования | ||||
|---|---|---|---|---|
| 0 день | 1 день | 15 день | 6 мес. | |
| Включение больного в исследование (соответствие критериям исследования) | + | — | — | — |
| Подписание информированного согласия | + | — | — | — |
| Забор крови на иммунологические исследования* | + | — | + | — |
| Забор крови на биохимические исследования* | + | — | + | — |
| Начало лечебного периода | — | + | — | — |
| Окончание лечебного периода | — | — | + | — |
| Сбор сведений о переносимости | — | — | + | — |
| Сбор сведений о заболеваниях за 0,5 года | + | — | — | + |
* – забор крови производился в течение 3-х рабочих дней по окончании приема препарата.
Лабораторные и инструментальные методы исследования
выполнялись в двух точках (до лечения и на 15 день терапии Биоароном С)
Результаты проведенных исследований статистически обработаны с применением методов вариационной статистики, корреляционного анализа. Достоверность одноименных показателей вычисляли по формулам параметрической статистики с использованием критерия Стьюдента. Доверительный интервал для средних величин вычисляли с заданным уровнем достоверности 0,95.
Использованы стандартные пакеты статистических программ «Excel 7,0», «Биостат».
Способ применения и дозировка:
дети в возрасте 3-6 лет – 2 раза в день по 5. мл (1 чайная ложка) препарата; старше 6 лет – 3 раза в день по 5 мл (1 чайная ложка) препарата до еды в течение 14 дней.
Критериями оценки эффективности являлось сравнение суммарного количества длительности заболеваемости (с учетом длительности стационарного лечения и длительности антибактериальной терапии) через 6 мес. после применения Биоарона С с аналогичным календарным периодом предшествующего года.
Критерии оценки безопасности
Полученные результаты
В исследование было включено 71 ребенок, из них 11 детей выбыли из исследования (заболели ОРВИ на первой неделе терапии Биоароном С и отказались от дальнейшего участие в исследовании – 4 больных, отказался от повторного взятия крови без причин 1 ребенок, по причине появления аллергической реакции в виде эритемы – 4 ребенка, по причине появления тошноты и рвоты после приема препарата – 1 ребенок, появление диареи отмечено у 1 ребенка, страдающего целиакией).
Таким образом, исследование завершили 60 детей, средний возраст которых 7,9 ± 0,41 (21 ребенка в возрасте от 3 до 6 лет, и 39 детей в возрасте от 6 до 12 лет), из них 34 мальчика и 26 девочек.
Суммарное количество дней заболеваемости в течение 6 месяцев после приема препарата достоверно уменьшилось с 35,64±1,18 до 31,33±1,84 (р=0,045), по сравнению с аналогичным календарным периодом предшествующего года (Табл 2). Так же, отмечается уменьшение длительности стационарного лечения (с 2,28±0,6 до 1,12±0,45) и длительности антибактериальной терапии (с 9,42±1,0 до 6,91±0,88) после применения Биоарона С, хотя достоверности в отличие в этих показателей получено не было.
При изучении показателей клеточного иммунитета (табл. 3) отмечалось увеличение относительного и абсолютного количества Т-клеток (CD3+, CD4+,CD8), при этом достоверное увеличение выявлено относительного количества CD3+ CD4+, и абсолютного количества Т-клеток (CD4+, CD8).
Таблица 2
Влияние терапии Биоароном С на показатели длительности заболеваемости
| Показатель | До терапии | После терапии | t | Р |
|---|---|---|---|---|
| Количество дней болезни | 35,64±1,18 | 31,33±1,84 | 2,016 | 0,046 |
| Длительность стационарного лечения | 2,28±0,6 | 1,12±0,45 | 1,622 | 0,107 |
| Дни антибактериальной терапии | 9,42±1,0 | 6,91±0,88 | 1,884 | 0,062 |
Отмечено так же достоверное снижение относительного количества CD16+
Таблица 3
Влияние терапии Биоарон С на субпопуляционный состав Т-лимфоцитов
| Показатели | До начала терапии | На 15 день терапии | t | Р | Норма | |
|---|---|---|---|---|---|---|
| CD3+ | % | 70,1±0,98 | 73,2±0,8 | -2,45 | 0,016 | 55-80 |
| абсол | 2,1±0,1 | 2,4±0,1 | 1,92 | 0,056 | 0,8-2,2 | |
| CD4+ | % | 44,6±1,0 | 47,4±0,8 | -2,12 | 0,036 | 31-49 |
| абсол | 1,37±0,07 | 1,68±0,08 | -2,032 | 0,044 | 0,6-1,6 | |
| CD8+ | % | 25,4±0,6 | 26,4±0,7 | -1,155 | -0,250 | 19-37 |
| абсол | 0,76±0,03 | 0,86±0,04 | 2,118 | 0,036 | 0,3-0,8 | |
| CD16+ | % | 15,3±1,0 | 12,5±0,7 | 2,24 | 0,027 | 9-17 |
| абсол | 0,46±0.03 | 0,42±0,03 | 0,926 | 0,36 | 0,2-0,6 | |
При этом отмечена зависимость изменения показателей субпопуляционного состава Т лимфоцитов в зависимости от исходного уровня: так при сниженных исходных значениях, показатели имеют тенденцию к повышению, если количество клеток повышено или приближается к верхней границы нормы, то, как правило, отмечается снижение показателей. Так при исходных значениях CD3+ 50%, показатель достоверно снижается с 61,87±1,80 до 51,68±1,79 (табл. 11).
При исследовании фагоцитарного числа по отношению к фагоцитирующим нейтрофилам на 30 мин (количество микробных тел, поглощенных 1 нейтрофилом), отмечено, что при значениях показателя меньше 5 у.е. показатель достоверно увеличивается с 4,18±0,18 до 7,36±0,38. А при исходном значении 5 у.е и более, – достоверно уменьшается с 7,48±0,2 до 6.09±0,47 (табл. 11).
Таблица 10
Влияние терапии Биоарона С на фагоцитарную активность нейтрофилов
| Показатели | До начала терапии | На 14 день терапии | t | Р | Норма | ||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Фагоцитарный индекс на 30 мин (%) | 49,4±2,24 | 50,9±1,7 | -0,537 | 0,592 | 40-60 | ||||||||||||||||||||||||||||||||||
| Фагоцитарный индекс на 120 мин (%) | 53,9±2,2 | 52,4±1,9 | 0,521 | 0,603 | 40-60 | ||||||||||||||||||||||||||||||||||
| Фагоцитарное число по отношению к фагоцитирующим нейтрофилам на 30 мин (у.е) | 6,4±0,26 | 6,5±0,36 | -0,31 | 0,756 | 2,5-5 | ||||||||||||||||||||||||||||||||||
| Фагоцитарное число по отношению к фагоцитирующим нейтрофилам на 120 мин (у.е) | 1,37±0,07 | 1,68±0,08 | 3,235 | 0,002 | 2,5-5 | ||||||||||||||||||||||||||||||||||
| Фагоцитарное число по отношению к общему количеству нейтрофилов на 30 мин (у.е) | 3,36±0,25 | 3,63±0,26 | -0,749 | 0,456 | 2,5-5 | ||||||||||||||||||||||||||||||||||
| Фагоцитарное число по отношению к общему количеству нейтрофилов на 120 мин (у.е) | 4,28±0,27 | 3,69±0,25 | 1,603 | 0,112 | 2,5-5 | ||||||||||||||||||||||||||||||||||
| ИЗФ-1 (у.е) | 1,22±0,08 | 1,09±0,07 | 1,223 | 0,224 | 5 v.e | 7,48± 0,2 | 6,09±0,47 | 2,108 | 0,039 | ||||||||||||||||||||||||||||||
| ИЗФ-З (у.е) | 23 | 1 | 2,16±0,16 | 1,29±0,17 | 3,727 | 1 отмечено достоверное снижение этого показателя с 2,16±0,16 до 1,29±0,17 (табл. 11). ИЗФ-3 интегральный показатель, составляющий произведение индексов ИЗФ-1 и ИЗФ-2 и наиболее точно отражает переваривающую способность нейтрофилов. Таким образом, более детальное исследование фагоцитоза так же подтверждает иммуномодулирующее действие препарата Биоарон С. При исследовании показателей гуморального иммунитета отмечена тенденция к увеличению средних значений сывороточных IgA, IgM, IgG, (особенно выраженная для IgM) и снижение IgE, хотя достоверных различий выявлено не было (табл. 12). Полученные результаты свидетельствуют о существенном повышении уровня сывороточного общего IgE до начала терапии, что связано с тем, что большинство обследованных детей страдали аллергическими заболеваниями. Таблица 12
Следует отметить, что изменений показателей биохимического исследования крови (общего белка, АЛТ, ACT, мочевины, креатинина, глюкозы) за время терапии Биароном С выявлено не было. Выводы Обзор эффективных мазей от псориаза: какая самая безопасная Регулярная обработка мазью – один из обязательных методов лечения псориаза на руках, ногах, лице и других частях тела. Жирная текстура таких наружных средств позволяет активным компонентам долго сохраняться на коже, что делает их более эффективными, чем кремы и гели. В список мазей от псориаза входят два основных вида средств: Гормональные мази от псориазаВ качестве активных компонентов гормональных мазей выступают глюкокортикостероиды – гормоны, способные подавлять активность иммунной системы и уменьшать воспаление. Чаще всего в таких мазях присутствуют следующие компоненты: Единственным плюсом гормональных мазей считают быстрое появление результатов. Минусов же гораздо больше, и к ним относятся: Дерматологи не рекомендуют применение гормональных мазей при поражении более 20% кожного покрова. Также не стоит наносить их на участки чувствительной кожи: в области шеи, складок кожи, лица, места опрелостей. Без назначения врача такие препараты использовать нельзя, даже если они продаются без рецептов. Из-за бесконтрольного применения может нарушиться работа надпочечников, что поведет за собой серьезные проблемы и заболевания. Негормональные мази от псориазаВ меру эффективными и одновременно недорогими мазями от псориаза считают негормональные средства. К их преимуществам в сравнении с гормональными можно отнести: Но даже при всех плюсах назвать негормональные мази от псориаза действительно эффективными нельзя. В отличие от гормональных, они оказывают гораздо более слабое действие. Их эффект проявляется не так быстро, поэтому их назначают только при легких проявлениях псориаза. Еще их считают более безопасными для лечения псориаза у детей. Негормональные мази устраняют шелушение, отечность, зуд, снимают воспаление и раздражение. Кроме того, несмотря на более безопасный состав, применение таких средств не исключает развитие аллергической реакции, если у человека есть непереносимость того или иного компонента. В зависимости от оказываемого действие все негормональные мази делятся на несколько категорий: В качестве вспомогательных негормональных средств при псориазе используют увлажняющие мази. Но они лишь помогают устранить ощущение сухости и стянутости кожи. Особенности негормональных мазейСалициловая мази от псориаза – одна из самых недорогих, но нужно учитывать, что ее действия при таком серьезном заболевании часто недостаточно. Они показывают хорошие отшелушивающий, смягчающий и антисептический эффекты, но, как и у других негормональных мазей, они проявляются не менее чем через 2 недели, а иногда и позже. То же можно сказать про применение мази на основе солидола от псориаза. Кроме того, это очень специфические средства, которые имеют резкий запах. Он может оставаться на мебели и одежде, и его очень трудно отстирать. Среди перечисленных мазей нет тех, относительно применения которых проводились бы клинические испытания. Это говорит, что их эффективность подтверждается лишь опытом некоторых пользователей. Клинические же испытания проводились только относительно таких препаратов: Это говорит о том, что их применение действительно может принести пользу. Но у Пимекролимуса при бесконтрольном использовании есть риск присоединения инфекции, а Кальципотриол нельзя применять при поражении более 30% поверхности кожи, поскольку это может привести к гиперкальциемии. Единственным максимально безопасным средством остается пиритион цинка. Таким образом, отвечая на вопрос, какая мазь лучше от псориаза, можно сказать, что Цинокап. Но это не отменяет того, что ее эффект все равно слабее, чем у гормональных средств. Какую же мазь выбратьРешать, какой мазью лечить псориаз, должен только профессиональный дерматолог. Его задача – выбрать самый безопасный и одновременно эффективный препарат. В клинике «ПсорМак» уже более 25 лет практикуют лечение мазью против псориаза, изготавливаемой по авторской рецептуре. В составе нет гормональных компонентов, что обеспечивает средству следующие преимущества: Но наши специалисты понимают, что даже самая эффективная мазь для лечения псориаза должна подходить пациенту. Поэтому перед назначением мы обязательно проводим полную диагностику. Кроме того, в лечении псориаза важен комплексный подход. В связи с этим наши дерматологи разрабатывают для пациента индивидуальную диету, а при необходимости дают направление на иглорефлексотерапию и психотерапию. Если вы хотите добиться длительного рецидива и перестать ежедневно бороться с неприятными симптомами, запишитесь на консультацию в «ПсорМак», и мы подберем для вас индивидуальную схему лечения. Вся правда об адаптогенахСтресс, усталость, эмоциональная нестабильность и беспокойный сон — частые спутники человека. Еще бывает, что ходить по докторам нет времени, разбираться в себе нет желания. Подчас хочется универсальной таблетки, которая все исправит и вернет в строй. Часто взор в таком случае падает на адаптогены — средства, которые якобы помогают бороться со стрессом. Разбираемся, что это, эффективны ли они и можно ли их заменить. Что это такоеАдаптогены — это фармакологическая группа средств, которые якобы усиливают сопротивляемость стрессу. Кроме нее, производители и маркетологи заявляют о намного большем списке предполагаемых эффектов: повышение иммунитета, укрепление сна, эмоциональная стабилизация, уменьшение симптомов депрессии и тревоги, нормализация гормонального баланса. Некоторые даже пишут, что адаптогены защищают от радиации и снижают воздействие химических канцерогенов на организм. В результате адаптогены чаще всего покупают люди с неврологическими заболеваниями и психическими расстройствами. Но если говорить о базовой функции средств, то адаптогены помогают человеку приспособиться к стрессу. Они призваны сделать так, чтобы человек выдерживал нервно-психическое напряжение и эмоциональную нагрузку, например, если работа связана с повышенной концентрацией внимания, утомляемостью или риском эмоционального выгорания. Адаптогены, как правило, натурального происхождения: женьшень, элеутерококк, корни родиолы, корень ашваганды и так далее. Это растения, которые обработаны и приведены в лекарственную форму, например, настойку, экстракт или порошок. При этом важно разграничивать некоторые понятия: адаптогены — это не стимуляторы, не противотревожные и не антидепрессанты. Они не стимулируют центральную нервную систему и не вызывают возбуждение, то есть не показаны при астении — эмоциональном и физическом истощении, депрессии и тревожном расстройстве. Хоть и некоторые производители и заявляют, что адаптогены помогают при этих состояниях. В этом и заключается распространенная проблема неспецифических средств. Производители и реклама рассказывают, что это универсальная пилюля: защитит от вирусов, улучшит настроение и снизит тревогу. Тем самым они предвосхищают потребности людей, у которых нет желания посещать врачей, проходить диагностику и узнавать причину своего состояния. Принял курс таблеток — и должно все пройти.
Номинально они относятся к фармакологической группе общетонизирующих средств и адаптогенов. Но на деле — это комбинация биологически активных добавок (БАД) и иногда ноотропов, которые, как фармакологическая группа, не имеют доказательной базы и в научном мире славятся как «пустышки».
Адаптогены приобретаются практически в любой аптеке без рецепта и даже в магазинах. В общем, адаптогены — это скорее БАД, но не медикаментозное средство. Продолжение статьи Вы можете прочитать по ссылке на ФОРМА — блог СБЕР ЕАПТЕКИ. Состояния, вызванные приемом амиодарона, в практике кардиолога и эндокринологаВ клинической практике врачам разных специальностей нередко приходится сталкиваться с проблемой назначения препаратов, обладающих не только высокой эффективностью, но и большим спектром побочных действий, которые могут осложнять течение основного заболев В клинической практике врачам разных специальностей нередко приходится сталкиваться с проблемой назначения препаратов, обладающих не только высокой эффективностью, но и большим спектром побочных действий, которые могут осложнять течение основного заболевания. К таким препаратам относится амиодарон, занимающий ведущее место в лечении потенциально злокачественных и злокачественных форм желудочковых аритмий, но имеющий широкий спектр воздействия на щитовидную железу. Амиодарон — антиаритмический препарат III класса, был открыт Tondeur и Binon в 1960 г. и с тех пор широко используется в кардиологической практике. Частота его применения достигает 24,1% от общего числа назначений антиаритмических препаратов. В основном препарат используют для лечения злокачественных форм желудочковых и наджелудочковых аритмий, пароксизмальной суправентрикулярной тахикардии, фибрилляции предсердий, которые рефрактерны к терапии другими антиаритмическими препаратами и сопровождаются высоким риском внезапной сердечной смерти. Мета-анализ 13 многоцентровых исследований, посвященных первичной профилактике внезапной смерти у пациентов, перенесших инфаркт миокарда или имеющих хроническую недостаточность кровообращения, продемонстрировал способность амиодарона снижать показатели не только аритмической, но и общей летальности. Так как амиодарон не оказывает выраженного отрицательного инотропного действия на миокард, показано его применение при нарушениях сердечного ритма у больных с застойной сердечной недостаточностью. Он также является средством выбора при лечении и профилактике аритмий у больных с синдромом Вольффа-Паркинсона-Уайта. Помимо антиаритмического действия у ряда больных препарат оказывает влияние на функцию щитовидной железы, вызывая тиреотоксикоз или гипотиреоз. В течение ряда лет эти изменения являлись одной из причин отмены или отказа от применения амиодарона несмотря на то, что препарат назначался по жизненным показаниям. Продолжающиеся исследования в данном направлении позволили изменить взгляд на проблему и разработать новые подходы к диагностике и лечению указанных нарушений. Механизм действия амиодаронаПрепарат представляет собой йодированную жирорастворимую производную бензофурана, которая по структуре имеет близкое сходство с тироксином. Препарат состоит на 37,5% из йода, приблизительно 10% молекул подвергается дейодированию ежедневно. Высокое содержание йода в амиодароне считается одной из причин возникновения тиреоидной дисфункции. У пациентов, принимающих амиодарон, уровень неорганического йода в моче и плазме увеличивается в 40 раз. Препарат проникает во многие органы и ткани: в печень, легкие, щитовидную железу, миокард, но более всего накапливается в жировой ткани. Период полувыведения амиодарона составляет от 30 дней до 5 месяцев. Механизм воздействия амиодарона на щитовидную железуУстановлено, что у 1/3 пациентов в процессе лечения амиодароном наблюдается повышение уровня общего и свободного тироксина (Т4), реверсивного (неактивного) трийодтиронина (ТЗ), уменьшение уровня ТЗ. Это обусловлено подавлением активности 5-дейодиназы I типа, нарушающего конверсию Т4 в Т3 в периферических тканях, особенно в печени. Подавление активности 5-дейодиназы может сохраняться на протяжении нескольких месяцев и после отмены препарата. Кроме того, препарат снижает проникновение тиреоидных гормонов в клетки периферических тканей. В конечном итоге оба механизма способствуют развитию доброкачественной формы эутиреоидной гипертироксинемии, с повышенным уровнем общего и свободного Т4, рТЗ, нормальным или субнормальным ТЗ. Не-смотря на повышенный уровень св Т4 [14,7;23,2], у пациентов не отмечается признаков тиреотоксикоза (рис. 1).
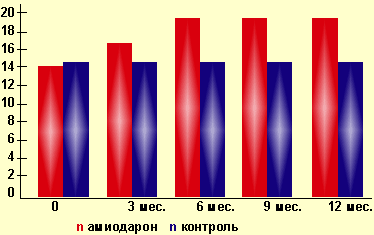
Эутиреоидная гипертироксинемия не требует медикаментозной коррекции, а диагноз тиреотоксикоза не должен основываться на одном только обнаружении повышенного уровня тироксина у больных, получающих амиодарон. По нашим данным, развитие эутиреоидной гипертироксинемии не приводит к утрате амиодароном антиаритмической эффективности и рецидивам предшествующих нарушений сердечного ритма. Пациенты должны оставаться под динамическим наблюдением с периодическим мониторированием функционального состояния щитовидной железы. В процессе лечения амиодароном у ряда больных может произойти изменение уровня ТТГ в сыворотке крови без клинических проявлений нарушения функции щитовидной железы. Повышение концентрации ТТГ у клинически эутиреоидных пациентов зависит как от дозы, так и от длительности приема препарата. Так, при ежедневном приеме 200–400 мг амиодарона уровень ТТГ обычно находится в пределах нормы. При более высокой дозе препарата увеличение концентрации ТТГ может произойти в первые месяцы приема, с последующим возвращением к норме (табл. 1). Амиодарон снижает чувствительность клеток, особенно кардиомиоцитов, к тиреоидным гормонам, приводя к «местному», тканевому гипотиреозу. Развитию этого состояния способствуют взаимодействие амиодарона с рецепторами тиреоидных гормонов, сокращение числа катехоламиновых рецепторов и снижение эффекта ТЗ на кардиомиоциты. На клеточном уровне амиодарон действует как антагонист тиреоидных гормонов. Наиболее активный метаболит амиодарона, диэтиламиодарон (ДЭА), действует как конкурентный ингибитор присоединения трийодтиронина к α-1-ТЗ-рецептору и как неконкурентный ингибитор β-1-ТЗ-рецептора. Действие ДЭА зависит от его концентрации в различных тканях. При низкой концентрации ДЭА может выступать как агонист действия ТЗ и только при больших концентрациях — как антагонист ТЗ. Известно, что α-1-ТЗ-рецепторы находятся в основном в сердечной и скелетной мускулатуре, тогда как в печени, почках и мозге преобладают β-1-ТЗ-рецепторы. Следовательно, при достаточной концентрации амиодарон действует как конкурентный ингибитор Т3, обусловливая развитие «местного» гипотиреоза в сердечной мышце. Кроме того, исследования последних лет показали, что амиодарон вызывает мутацию гена ядерного рецептора Т3. Снижение проникновения Т3 в кардиомиоциты оказывает антиаритмический эффект за счет изменения экспрессии генов ионных каналов и других функциональных белков. Амиодарон непосредственно влияет на ионные каналы, вне зависимости от его воздействия на тиреоидные гормоны. Экспериментально доказано, что амиодарон способен ингибировать Nа-К-АТФ-азу. Препарат блокирует несколько ионных токов на мембране кардиомиоцита: выход ионов К во время фаз реполяризации, а также вход ионов Na и Ca. Кроме вышеописанных эффектов амиодарон и его метаболит ДЭА оказывают цитотокическое действие на щитовидную железу. Экспериментальными исследованиями установлено, что амиодарон и его метаболит вызывают лизис клеток линии человеческих тиреоцитов, а также нетиреоидной ткани. Амиодарон оказывает самостоятельный, токсический эффект, усиливаемый содержанием йода в молекуле, при этом его активный метаболит ДЭА обладает большей цитотоксичностью и его интратиреоидная концентрация выше, чем у самого препарата. В литературе широко обсуждается вопрос о влиянии амиодарона на течение аутоиммунных процессов в щитовидной железе. Предполагается, что избыток йода, высвобождаемый из амиодарона, может приводить к индукции или манифестации аутоиммунных изменений в щитовидной железе. Классическими маркерами аутоиммунного процесса являются антитела к тиреоглобулину (ТГ) и пероксидазе (ТПО). У ряда пациентов антитела к пероксидазе регистрируются как на ранних этапах лечения, так и в течение 6 мес. после отмены препарата. По мнению ряда исследователей, этот феномен объясняется ранним токсическим эффектом амиодарона на щитовидную железу, приводящим к высвобождению аутоантигенов и последующему запуску иммунных реакций. С другой стороны, у большинства лиц, получающих амиодарон, не отмечается увеличения частоты встречаемости тиреоидных антител. Амиодарон-ассоциированная дисфункция щитовидной железыУ большинства больных, принимающих амиодарон, сохраняется эутиреоз. Тем не менее у некоторых пациентов могут развиться нарушения функции щитовидной железы. Возникновение гипотиреоза объясняется длительным блоком органификации йода и нарушением синтеза тиреоидных гормонов (эффект Вольфф-Чайкова). В развитие этого состояния вносит вклад и ингибирование тиреоидных рецепторов в тканях. По современным представлениям, в основе патогенеза другой дисфункции щитовидной железы — тиреотоксикоза, развивающегося на фоне приема амиодарона, — лежат 2 основных механизма, приводящих к формированию 2 вариантов амиодарон-ассоциированного тиреотоксикоза (АмАТ): Клинические особенности и лечение нарушений функции щитовидной железы на фоне приема амиодаронаАмиодарон-ассоциированный гипотиреоз. Распространенность гипотиреоза на фоне приема амиодарона варьирует от 6% в странах с низким потреблением йода до 13% с высоким потреблением йода. Наиболее часто гипотиреоз встречается у пожилых людей и женщин, которые наиболее подвержены развитию гипотиреоза (отношение полов 1,5:1). По данным нашего исследования, среди пациентов с амиодарон-ассоциированным гипотиреозом органическая патология щитовидной железы выявлена в 70,8% случаев (в основном аутоиммунный тиреоидит) (рис. 2).
В клинической картине отмечаются классические признаки гипотиреоза: утомляемость, сухость кожи, зябкость, запоры, сонливость, ухудшение внимания, отечный синдром, брадиаритмии и др. Субклинический вариант протекает бессимптомно, но возможно нарушение липидного обмена (повышение ЛПНП, коэффициентов обХс/ЛПВП, ЛПНП/ЛПВП и снижение ЛПВП), ухудшение памяти, депрессия. Диагностика этого состояния основана на определении сниженного уровня свободного Т4 и повышенного ТТГ (обычно > 10mU/l) или нормального уровня свободного Т4 при повышенном уровне ТТГ при субклиническом варианте течения. Уровень Т3 не является надежным индикатором, так как при гипотиреозе он может быть в пределах нормы или даже несколько повышен в результате компенсаторного дейодирования Т4 в биологически более активный Т3. Лечение амиодарон-ассоциированного гипотиреоза. С амиодарон-индуцированным гипотиреозом можно бороться 2 способами: либо отменить амиодарон, либо подобрать заместительную терапию тиреоидными гормонами. После отмены амиодарона эутиреоз обычно восстанавливается, но на это могут потребоваться месяцы в связи с длительным периодом выведения лекарства. Часто на практике отмена амиодарона невозможна, так как препарат применяется по жизненным показаниям, особенно для лечения тяжелых желудочковых тахиаритмий. В таких случаях лечение амиодароном продолжают. Пациентам назначается L-тироксин. Уровень ТТГ снижается обычно до верхней границы нормы. Рекомендуется начинать заместительную терапию тиреоидными гормонами с минимальных доз 12,5–25 мкг/сут с постепенным повышением ее под контролем ТТГ с интервалом в 4–6 нед. до достижения эффекта, не допуская при этом декомпенсации кардиальной патологии или развития аритмии. При субклиническом течении гипотиреоза вопрос о заместительной терапии решается индивидуально. Назначение L-тироксина может быть показано при сопутствующем нарушении липидного профиля, депрессии, повышении уровня ТТГ более чем на 10 МЕ/л, причем подбирается минимально эффективная доза для коррекции выявленных нарушений. Пациент должен оставаться под наблюдением с целью оценки динамики состояния на фоне лечения первые 6 нед., а затем каждые 3 мес. При отсутствии изменений в лабораторных показателях липидного спектра и клинической симптоматике препарат отменяют. Амиодарон-ассоциированный тиреотоксикоз. По статистике АмАТ развивается в 2–12 % случаях при постоянном приеме препарата. Некоторые исследования показали, что распространенность варьирует в зависимости от потребления йода с пищей. В популяции АмАТ превалирует в районах с низким потреблением йода (например, Центральная Европа) и редко встречается в районах, где пища насыщена йодом (например, Северная Америка, Великобритания). По нашим данным, среди пациентов с АмАТ, проживающих в районе легкого и умеренного йодного дефицита (Москва и Московская область), преобладали лица с измененной щитовидной железой (61%), в основном с узловыми зобами и аутоиммунным поражением щитовидной железы (рис. 3).
Частота тиреотоксикоза не зависит от суточной и кумулятивной дозы амиодарона. Необходимо отметить, что между началом приема препарата и развитием тиреотоксикоза может проходить достаточно долгое время (до 3 лет). Более того, описаны случаи возникновения этого состояния через несколько месяцев после отмены амиодарона. Клинические особенности АмАТ определяются тем, что это состояние преимущественно развивается у лиц пожилого возраста. Обычные симптомы тиреотоксикоза — зоб, похудание, потливость, тремор пальцев рук — могут быть выражены незначительно или вовсе отсутствовать. В клинической картине доминируют сердечно-сосудистые и психические расстройства. Серьезную опасность представляют именно кардиальные эффекты избытка тиреоидных гормонов, такие, как ухудшение течения сопутствующих форм аритмий, учащение приступов ИБС. Повышенная чувствительность к адренергической стимуляции при тиреотоксикозе может увеличивать частоту желудочковых аритмий, особенно у больных с предшествовавшей сердечной патологией. Токсическое действие тиреоидных гормонов на центральную нервную систему приводит к развитию тиреотоксической энцефалопатии, которая проявляется нервной возбудимостью, эмоциональной лабильностью, нарушением сна. Однако у больных пожилого возраста, как правило, доминируют противоположные признаки: психическая заторможенность, апатия, отсутствие аппетита, слабость, адинамия, депрессия, что может затруднять диагностику АмАТ. Дифференциальная диагностика АмАТ I и АмАТ II типовДля клинициста важно дифференцировать 2 формы АмАТ для выбора правильной тактики ведения пациентов. Как было сказано выше, АмАТ I типа развивается на фоне существующих или предшествующих заболеваний щитовидной железы. Помимо изменений гормонального спектра и определения повышенного титра антитиреоидных антител (в случаях манифестации диффузного токсического зоба), АмАТ I типа характеризуется нормальным или, гораздо реже, сниженным захватом радиофармпрепарата, при УЗИ отмечаются признаки узлового зоба или аутоиммунного зоба с нормальным или повышенным кровотоком. АмАТ II типа развивается на фоне интактной железы. Главная клиническая особенность этих форм — внезапное развитие и тяжесть тиреотоксикоза, в том числе развитие болевых форм, клинически похожих на подострый тиреоидит. При исследовании с радиоактивным йодом отмечается снижение накопления препарата в железе. В биоптате щитовидной железы, полученном при тонкоигольной биопсии или после хирургического вмешательства, отмечается большое количество коллоида, инфильтрация макрофагами, деструкция тиреоцитов. Часто наблюдается отсутствие или снижение кровотока в щитовидной железе, определяемое при УЗИ с доплерографией. Обсуждается роль повышенной концентрации ИЛ-6 как маркера этого состояния, однако в нашем исследовании мы не обнаружили существенных различий в уровне ИЛ-6 и косвенного показателя активности ИЛ-6 — С-реактивного белка у лиц с АмАТ I и II типов и пациентов с аутоиммунным тиреотоксикозом. Кроме этих 2 форм в практике клинициста могут встречаться смешанные варианты течения этого осложнения с чертами АмАТ I и II типов. У пациентов с деструктивным тиреотоксикозом из-за действия амиодарона позже может развиться гипотиреоз. Сводные данные об отличии двух форм представлены в таблице 2. Основным и наиболее ранним проявлением амиодарон-ассоциированного тиреотоксикоза в наших исследованиях стала потеря антиаритмической эффективности амиодарона во всех случаях. У пациентов с пароксизмами желудочковой тахикардии мерцательной аритмии отмечалось рецидивирование нарушений ритма сердца. У больных с желудочковой экстрасистолией по результатам суточного мониторирования ЭКГ наблюдалось увеличение общего количества парных желудочковых экстрасистол и пробежек желудочковой тахикардии на 61,7, 83,5 и 85% соответственно, по сравнению с показателями, регистрировавшимися до развития тиреотоксикоза. Лечение амиодарон-ассоциированного тиреотоксикоза. В отличие от гипотиреоза, который сравнительно легко лечится заместительной терапией тиреоидными гормонами, компенсация тиреотоксикоза сопряжена со многими трудностями и требует индивидуального подхода в каждом случае. У пациентов с легким тиреотоксикозом, исходно неизмененной щитовидной железой и небольшим зобом тиреотоксикоз устраняется после отмены препарата. Наоборот, у пациентов с предшествующими заболеваниями щитовидной железы тиреотоксикоз, как правило, не проходит без лечения даже спустя несколько месяцев после окончания терапии амиодароном. Отмена амиодарона возможна только в тех случаях, когда нарушения сердечного ритма не опасны для жизни и могут быть нивелированы альтернативными антиаритмическими препаратами. Для лечения тиреотоксикоза применяют тионамиды, пропилтиоурацил, высокие дозы глюкокортикоидов, плазмаферез, оперативное лечение. За рубежом используют конкурентный ингибитор захвата йода щитовидной железой — перхлорат калия. Для компенсации тиреотоксикоза требуются большие дозы антитиреоидных препаратов (например, метизола 40–60 мг или пропицила 300—600 мг) для ингибирования синтеза гормонов. Для нормализации уровня свободного Т4 может потребоваться 6–12 нед. и более. Длительная терапия высокими дозами тиреостатиков обычно необходима пациентам, которые продолжают получать амиодарон по жизненным показаниям. Некоторые исследователи предпочитают продолжать терапию поддерживающими дозами тиреостатиков, с тем чтобы сохранить полный или частичный блок синтеза тиреоидных гормонов в течение всего периода терапии амиодароном. В случае развития гипотиреоза к лечению добавляется L-тироксин. Одним из главных фактов патогенеза АмАТ II типа, особенно возникшего у лиц без предшествующих изменений щитовидной железы, служит развитие деструктивного тиреоидита и выход ранее синтезированных гормонов в кровоток. В такой ситуации предлагается использовать глюкокортикоиды. Преднизолон назначается в дозе 30–40 мг/сут. Курс лечения может продолжаться до 3 мес., так как описаны случаи возвращения симптомов тиреотоксикоза при попытке снизить дозу препарата. В случае развития гипотиреоза у пациентов, перенесших АмАТ II типа, к лечению добавляется L-тироксин. По показаниям к проводимой терапии добавляются пропранолол и другие симптоматические средства. При тяжелом течении амиодарон-ассоциированного тиреотоксикоза (обычно при сочетании 2 форм) используют комбинацию тионамида и глюкокортикоида. У некоторых пациентов комбинированная лекарственная терапия может быть неэффективной, что требует хирургического вмешательства. Оперативное лечение, как правило, проводится в случае невозможности достижения компенсации заболевания после длительного (около 6 мес.) курса медикаментозной терапии или при сочетании амиодарон-ассоциированного тиреотоксикоза с узловым зобом. Несмотря на риск тиреотоксического криза во время анестезии и хирургического вмешательства, в мире накоплен опыт лечения таких больных, показавший, что субтотальная резекция щитовидной железы позволяет быстро добиться ремиссии тиреотоксикоза и продолжить антиаритмическую терапию. При крайне тяжелом состоянии используют плазмаферез. Радиоактивный йод обычно не эффективен в лечении пациентов с АмАТ, так как большая концентрация йода предотвращает достаточное поглощение щитовидной железой радиоизотопа. Кроме того, это может привести к усилению тиреотоксикоза в результате высвобождения гормонов. Однако в районах с пограничным уровнем йодного дефицита пациенты с диффузным или узловым зобом, у которых наблюдается нормальное или повышенное поглощение радиоизотопа, несмотря на прием амиодарона, могут отвечать на терапию радиоактивным йодом. Как было отмечено выше, амиодарон назначается при тяжелых, жизнеугрожающих аритмиях, часто рефрактерных к другой терапии. Отмена препарата в такой ситуации может быть недопустима по жизненным показаниям. Поэтому в лечебной практике в случае невозможности прекращения приема антиаритмика компенсацию тиреотоксикоза проводят на фоне продолжающейся терапии амиодароном. Более того, поскольку препарат и его метаболит ДЭA вызывают развитие «местного гипотиреоза», это, как ни парадоксально, защищает сердце от действия избытка тиреоидных гормонов, поэтому отмена препарата может усилить токсическое действие тиреоидных гормонов на сердце. В литературе описаны случаи успешного ведения пациентов с тиреотоксикозом без отмены амиодарона, поэтому в каждом конкретном случае решение о смене антиаритмического препарата должно приниматься индивидуально, совместно кардиологом и эндокринологом. Ряд авторов предполагают, что даже в тех случаях, когда планируется отмена препарата, пациенты должны принимать амиодарон, пока тиреотоксикоз не будет полностью компенсирован. Мониторинг тиреоидной функцииВсем пациентам, которым планируется назначение амиодарона, необходимо провести исследование функционального состояния щитовидной железы и ее структуры. Это позволяет не только выявить наличие тиреоидной патологии, но и прогнозировать возможное развитие тиреотоксикоза или гипотиреоза после начала терапии. План обследования щитовидной железы до назначения препарата включает: определение ТТГ; определение свободного Т4 при измененном уровне ТТГ; УЗИ щитовидной железы; определение уровня антител к ТПО; сцинтиграфию щитовидной железы — при подозрении на автономию (снижение уровня ТТГ, наличие узлового/многоузлового зоба); пункционную биопсию щитовидной железы (при наличии узлов, подозрении на новообразование). Присутствие антител к ТПО увеличивает риск развития амиодарон-ассоциированного гипотиреоза у пациентов с аутоиммунным тиреоидитом, особенно во время первого года лечения. Повторное определение уровня свТ4, ТТГ можно повторить через 3 мес. от начала терапии, а затем через каждые 6 мес. При нормальных показателях мониторинг осуществляется по уровню ТТГ 1-2 раза в год, особенно у пациентов с измененной щитовидной железой. В случае наличия патологии щитовидной железы до лечения или развития ее на фоне приема препарата проводится лечение по вышеуказанным рекомендациям. Напомним, что появление рефрактерности к антиаритмической терапии может быть ранним признаком манифестации амиодарон-ассоциированного тиреотоксикоза. Амиодарон на сегодняшний день является наиболее эффективным и широко используемым препаратом для лечения и профилактики угрожающих жизни желудочковых нарушений сердечного ритма и различных других форм сердечных аритмий. Однако, как и любой фармакологический препарат, он может вызывать нежелательные эффекты со стороны различных органов и тканей, что осложняет его использование. Одним из самых распространенных таких эффектов является нарушение функционального состояния щитовидной железы, что обусловлено фармакологическими особенностями препарата — высоким содержанием йода в его молекуле. Среди пациентов старшей возрастной группы, получающих амиодарон, наиболее часто встречается субклинический гипотиреоз и тиреотоксикоз. Наличие сопутствующей патологии щитовидной железы является безусловным фактором риска нарушения ее функции. Развитие тиреотоксикоза может сопровождаться утратой антиаритмической активности амиодарона и приводить к рецидивированию нарушений ритма сердца. Ухудшение течения предшествующей аритмии, частичная утрата антиаритмической активности препарата должны насторожить кардиолога и направить его поиск на выяснение возможной эндокринной причины неэффективности лечения. Развитие субклинического гипотиреоза на фоне приема амиодарона протекает без утраты антиаритмической активности препарата, но может сопровождаться дислипидемией с повышением показателей общего холестерина и ЛПНП. В таких случаях проведение заместительной терапии L-тироксином позволяет улучшить показатели липидного спектра. Для предупреждения и прогнозирования возможных осложнений со стороны щитовидной железы пациенты, которым планируется лечение амиодароном, должны быть направлены к эндокринологу с целью уточнения функционального состояния щитовидной железы и наличия сопутствующей тиреоидной патологии. В дальнейшем на фоне приема препарата необходимо исследовать функцию щитовидной железы не реже 1 раза в 6 мес. и всегда при ухудшении течения аритмии согласно предложенному алгоритму. Выявление тиреотоксикоза является показанием к назначению тиреостатической терапии. При неэффективности монотерапии тиреостатиками к лечению добавляют глюкоамиотикоиды. Рекомендуется проводить лечение тиреотоксикоза в течение не менее 2 лет. В случаях, когда медикаментозное лечение невозможно, необходимо рассмотреть вопрос об оперативном лечении. В случае развития явного гипотиреоза назначается прием L-тироксина под контролем уровня ТТГ. У лиц старшей возрастной группы при субклиническом гипотиреозе рекомендуется проведение заместительной терапии L-тироксином, если уровень ТТГ выше 10 МЕ/л. Если уровень ТТГ не превышает 10 МЕ/л, относительным показанием к назначению L-тироксина с использованием минимально эффективных доз и хорошей переносимости препарата является наличие зоба и дислипидемии. В остальных случаях проводится динамическое наблюдение с определением ТТГ 1 раз в 6 мес. и УЗИ щитовидной железы 1 раз в год. В тех случаях, когда амиодарон назначается для первичной или вторичной профилактики фатальных желудочковых нарушений ритма сердца или когда отмена препарата невозможна по иным причинам, компенсацию тиреотоксикоза и заместительную терапию при гипотиреозе проводят на фоне продолжения приема амиодарона. Вопрос об отмене или продолжении лечения амиодароном должен решаться индивидуально для каждого пациента совместно кардиологом и эндокринологом. Клинический опыт показывает, что в большинстве случаев выбор делается в пользу продолжения лечения. Н. Ю. Свириденко, доктор медицинских наук Влияние БАД на иммунитетСуществуют ли пищевые добавки, укрепляющие иммунную систему или это не более, чем реклама? Стоит ли применять витамины, минералы или травяные добавки для поддержки иммунитета? Поговорим об этом подробнее. Критическая роль и сложные функции иммунной системы в здоровье и защите часто недооцениваются до тех пор, пока иммунная система работает и защищает организм от опасностей. Как армия солдат, иммунитет выполняет множество жизненно важных функций и использует все силы организма для защиты от повреждений, болезней и инфекционных агентов, включая бактерии, вирусы, грибки и паразиты. Как устроен иммунитет?Иммунная система также может распознавать, защищать и уничтожать аномальные клетки, полученные из собственных тканей хозяина. Есть два основных функциональных подразделения иммунной системы: Иммунная система действует, создавая барьер исключения, идентифицируя и устраняя болезнетворные микроорганизмы. Кроме того, она выявляет и устраняет неопасные источники антигенов, поддерживает память об иммунологических встречах. Иммунная система состоит из различных органов, клеток и белков. Кожа, роговица и слизистая дыхательной системы, желудочно-кишечного тракта и мочеполовых путей образуют физический барьер, который является первой линией защиты организма. Помимо нервной системы, иммунная система считается самой сложной и многогранной системой в организме человека. В ее сложную сеть входят различные клетки, распределенные по всему человеческому телу, которые перемещаются через лимфу и кровоток. В некоторых областях клетки классифицируются как первичные лимфоидные органы, где появляются и созревают иммунные клетки (костный мозг и тимус), и вторичные лимфоидные органы (лимфатические узлы, селезенка и лимфоидная ткань, ассоциированная с кишечником), где зрелые иммунные клетки взаимодействуют и отвечают на антигены. Важно, чтобы система работала!Однако, для того, чтобы иммунная система была эффективной, необходимо, чтобы она различала собственные и чужие клетки, организмы и вещества, и умела устранять вредные чужеродные сущности. При возникновении проблем в иммунной системе, могут возникнуть аутоиммунные заболевания, такие как: ревматоидный артрит, волчанка, рассеянный склероз и болезнь Грейвса. Эти состояния связаны с проблемами приобретенной реакции иммунной системы. При аутоиммунной реакции антитела и иммунные клетки по ошибке нацелены на собственные здоровые ткани организма, давая сигнал организму атаковать их. Людей с признаками аутоиммунных заболеваний, таких как: усталость, лихорадка и воспаление, всегда следует направлять к иммунологу Все больше людей обращаются в интернет за советом по использованию различных пищевых добавок, продаваемых для укрепления иммунной системы, особенно непосредственно перед началом или во время сезона простуды и гриппа. Факторы, которые могут нарушить иммунную системуИсследователи обнаружили определенные факторы, которые могут влиять на иммунную систему, такие как: плохое питание, хронический стресс, недостаток сна, определенные заболевания, а также использование определенных фармакологических агентов, таких как кортикостероиды и иммунодепрессанты, используемых для лечения аутоиммунных заболеваний, иммуноопосредованных болезней и у пациентов после трансплантации. Хроническая потеря сна связана не только с увеличением воспалительных маркеров, но и с иммунодефицитом. Кроме того, исследования показали, что процесс старения также может влиять на иммунную систему и что, по-видимому, существует корреляция между питанием и иммунитетом у пожилых людей. Это связано с тем, что люди старшего возраста склонны есть меньше, могут иметь меньшее разнообразие продуктов в своем рационе и теряют аппетит из-за приема определенных лекарств или заболеваний. Нужны ли добавки и БАДы?Исследователи постоянно изучают влияние диеты, физических упражнений, возраста, психологического стресса и других факторов на иммунный ответ, как у животных, так и у людей. Некоторые исследования показали, что недоедание с дефицитом цинка или селена, железа, меди, витаминов А, С, Е и В6 и фолиевой кислоты значительно влияет на реакцию иммунной системы. Кроме того, переедание, избыточный вес или ожирение также могут снизить иммунный ответ. Правильные пищевые привычки, такие как здоровое и сбалансированное питание, имеют решающее значение для укрепления иммунной системы, а предлагаемые основные питательные вещества, поддерживающие иммунное здоровье, включают витамины A, B6, C и E, а также фолиевую кислоту, цинк, селен и железо, использование пробиотиков и пребиотиков может повлиять на реакцию иммунной системы. Пищевые добавкиМногие из БАДов, продаваемых для общего улучшения иммунной системы, содержат 1 или несколько витаминов A, B6, C, D и E, а также цинк и селен. Некоторые содержат витамины, минералы и различные ингредиенты, такие как эхинацея, имбирь и другие растительные ингредиенты для повышения иммунитета, либо комбинацию витаминов C, B витамины и минералы. Другие продукты, продаваемые для поддержки иммунной системы, включают пребиотики и пробиотики, некоторые из которых содержат молозиво, богатое антителами, иммуноглобулины А и Е; и факторы роста, которые могут быть компонентами, обеспечивающими иммуномодулирующее действие. Существует также множество дополнительных продуктов, предназначенных для усиления иммунной системы, а также для предотвращения и лечения симптомов, наиболее часто связанных с вирусом простуды и гриппа, которые могут содержать один или несколько из следующих компонентов: эхинацея, бузина и цинк. Одним из наиболее важных шагов в поддержании общего состояния здоровья и укреплении иммунной системы является включение здорового образа жизни в повседневную жизнь. Добавки будут работать только в сочетании с правильным питанием и активностью, общим укреплением здоровья. Прежде чем рекомендовать использование любой из этих добавок, врач проверяет возможные противопоказания и взаимодействия лекарств или питательных веществ. Пациентам с заболеваниями или тем, кто принимает другие лекарства, следует обсудить использование этих добавок со своими врачами. Пациенты также должны быть предупреждены об опасности приема мегадоз витаминов и всегда читать этикетки, чтобы проверить дублирование препаратов, так как прием нескольких пищевых добавок иожет привести к отравлению. Медицинские мифы. Девять мифов о рассеянном склерозеПримечание Лахта Клиники. Ежегодно с 1 марта в мире проводится Месяц осведомленности о рассеянном склерозе (Multiple Sclerosis Awareness Month, причем многозначное слово «Awareness» в данном контексте можно понимать и как «бдительность», и как «узнавание», «осознание» и т.п.). На момент публикации данного материала очередная кампания подходит к концу, и мы считаем целесообразным дополнить статью «Рассеянный склероз», размещенную на нашем сайте, анализом некоторых ложных представлений об этом тяжелом заболевании. Рассеянный склероз (множественный склероз) – хроническое заболевание центральной нервной системы, при котором поражается как головной, так и спинной мозг. На сегодняшний день не существует способов обратить процесс или, тем более, обернуть его вспять, поэтому применяется эффективное паллиативное лечение, задачей которого является замедление развития болезни, смягчение ее многочисленных неврологических симптомов, отдаление сроков инвалидизации. По данным на 2016 год, как сообщал ведущий медицинский журнал мира The Lancet, рассеянный склерозом страдали на земном шаре 2.2 миллиона человек. Известно, что это иммуно-опосредованный процесс, и большинство экспертов относят его к аутоиммунным заболеваниям. С другой стороны, рассеянный склероз относится к рубрике демиелинизирующих заболеваний, поскольку разрушается защитная и электроизолирующая белковая (миелиновая) оболочка нервных волокон. Это приводит к нарушениям связей между центральной нервной системой и прочими системами организма. Поэтому клинические проявления рассеянного склероза могут обнаруживаться где угодно и, в частности, включать: — онемения, покалывания и другие парестезии; — проблемы со зрением; — мышечные спазмы и слабость; — тревожные и/или депрессивные расстройства; — боли различного характера; — нарушения речи и глотания, и т.д. В некоторых случаях симптоматика с течением времени медленно нарастает, что называют первичным прогрессирующим рассеянным склерозом. Другие пациенты переживают приступы, «атаки», обострения, в ходе которых имевшиеся проявления болезни усугубляются или появляются новые симптомы. Этот тип течения называют возвратно-ремиттирующим. Общее состояние некоторых пациентов с возвратно-ремиттирующей формой постепенно ухудшается, что определяется как вторичный прогрессирующий рассеянный склероз. К настоящему времени остается неясным, почему у одних людей это заболевание развивается, а у других нет. Предполагается, что патогенетическую роль могут играть средовые (экологические) и наследственные факторы. А поскольку механизмы развития неизвестны, то в отношении рассеянного склероза (и многих других этиопатогенетически неясных болезней) существует масса устойчивых мифов и заблуждений. В данной статье рассмотрим девять основных из них. Это именно миф. В действительности, как разъясняет Общество изучения рассеянного склероза, все наоборот: большинство пациентов обходятся без инвалидного кресла. По данным PubMed Central (база данных Институтов здравоохранения США. – прим. Лахта Клиники), через 15 лет от момента установления диагноза лишь 20% больных рассеянным склерозом вынуждены пользоваться креслом-каталкой, костылями или подпоркой для хоьбы. Этим медико-статистическим исследованием занималась, в частности, врач-невролог Лорен А. Ролак. В материалах Общества изучения рассеянного склероза отмечается: «Когда болезнь начинает ограничивать вашу подвижность, возможно, будет трудно решиться на использование палочки для ходьбы, специального скутера или кресла-каталки. Но когда вы начнете пользоваться чем-то из этих средств, то быстро убедитесь, – как убедились многие люди до вас, – насколько это просто и насколько это помогает сохранить свою независимость». И это – миф. Многие пациенты с рассеянным склерозом годами остаются незаменимыми членами своих рабочих коллективов и команд. Да, проблемы возможны, и некоторые люди могут столкнуться с необходимостью пересмотра дальнейших карьерных путей и планов. Однако это вовсе не является неизбежным для каждого. Сегодня «…люди с диагностированным рассеянным склерозом продолжают работать в течение длительного времени». Национальное общество изучения рассеянного склероза допускает, однако, что «некоторые заболевшие сразу решают оставить работу, услышав диагноз или пережив первое серьезное обострение; к такому решению человека нередко подталкивает семья либо лечащий врач». Вместе с тем, этот выбор во многих случаях оказывается слишком поспешным: решение нельзя принимать на высоте симптоматики. Существует масса вариантов паллиативной терапии, постоянно разрабатываются новые технологии, стратегии контроля болезни, а также ресурсы правовой защиты и общественной поддержки. В совокупности все это поможет вам сохранять за собой рабочее место как можно дольше. Действительно, привычная работа идет больным на пользу, что также было подтверждено специальными исследованиями: «Вдобавок к обеспечению финансовой безопасности, трудоустройство способно внести значительный вклад в физическое и психическое благополучие людей, страдающих рассеянным склерозом, поскольку является источником социального взаимодействия и поддержки, чувства идентичности, наличия целей и перспектив». Прим. Лахта Клиники. С 2019 года в Российской Федерации реализуется проект «Неограниченные возможности», задачей которого выступает обеспечение трудоустройства пациентов с рассеянным склерозом. Программу осуществляет Межрегиональное Московское общество рассеянного склероза при активном участии ряда общественных и коммерческих организаций. В действительности у большинства пациентов с рассеянным склерозом первые симптомы появились в возрасте от 20 до 40 лет. И хотя процесс может начаться на любом этапе жизни, случаи манифестации после 50 лет являются сравнительно редкими. Вместе с тем, авторы одного из исследований обращают внимание на то, что дифференцировать начало рассеянного склероза от других подобных заболеваний у людей пожилого возраста может быть очень непросто, поэтому такие случаи на самом деле могут оказаться гораздо более частым явлением, чем принято считать. Неправда. Физическая активность помогает контролировать симптомы, продлевая баланс и силу. Миф о том, что при рассеянном склерозе любые упражнения невозможны или противопоказаны, очень распространен. В базе PubMed есть публикации, авторы которых отмечают: некоторые больные с диагностированным рассеянным склерозом сворачивают всякую физическую активность, опасаясь, что она может спровоцировать усугубление симптоматики. На самом же деле: «Физические упражнения должны рассматриваться как безопасное и эффективное средство реабилитации больных рассеянным склерозом. Полученные доказательства свидетельствуют о том, что индивидуализированные и контролируемые врачом комплексы упражнений позволяют поддерживать и улучшать форму, функциональные возможности и качество жизни в целом, равно как и редуцировать те симптомы, которые при данном заболевании поддаются редукции». В прошлом году Национальное общество изучения рассеянного склероза в сотрудничестве с группой экспертов опубликовало подробные рекомендации для пациентов, касающиеся физической активности. Кроме прочего, в рекомендациях подчеркивается: «Работники здравоохранения должны разъяснять больным необходимость уделять [как минимум] 150 минут в неделю физическим упражнениям, и столько же – активному отдыху. […] Выходить на этот уровень следует постепенно, отталкиваясь от индивидуальных возможностей, предпочтений и безопасности пациента». Совершенно необходимо проконсультироваться с врачом, прежде чем приступать к новому образу жизни и осваивать системы упражнений. Согласно современным публикациям экспертов, лечение при рассеянном склерозе должно проводиться даже в тех случаях, когда болезнь протекает малосимптомно. На ранних этапах развития заболевания симптоматика и в самом деле может не причинять ощутимых проблем. Однако безотлагательное начало лечения под долгосрочным постоянным наблюдением врача способно замедлить прогрессирование симптомов. Этот эффект также был специально исследован, и в 2016 году были опубликованы данные, согласно которым «Имеются статистические ассоциации между ранним начало лечения и более благоприятным клиническим исходом». Еще одно распространенное заблуждение заключается в том, что рассеянный склероз может снижать фертильность и создавать проблемы с вынашиванием беременности. Это именно заблуждение. Как поясняют специалисты Multiple Sclerosis Trust, «беременность не должна связываться с высоким риском на том лишь основании, что у будущей матери выявлен рассеянный склероз. Если вы страдаете этим заболеванием, вероятность выкидыша или врожденных аномалий не отличается от среднестатистического уровня в общей популяции». Более того, при возвратно-ремиттирующем типе течения беременные пациентки переживают рецидивы и обострения реже, чем обычно. Риск обострения возвращается к исходному уровню лишь полгода спустя после родов. В 2019 году Association of British Neurologists опубликовала консенсусное руководство по ведению беременности у женщин с рассеянным склерозом, – на всем протяжении, начиная от консультирования на этапе планирования семьи и до послеродового сопровождения. Кроме прочего, авторы рекомендуют не прерывать поддерживающую медикаментозную терапию в связи с тем, что планируется деторождение в будущем. Наследственный фактор имеет определенное значение, однако рассеянный склероз не является собственно генетической болезнью и не передается напрямую, сколько-нибудь предсказуемым образом, от родителей к детям. Накопленные наблюдения показывают, что если у одного из гомозиготных близнецов начинается рассеянный склероз, риск развития той же болезни у второго близнеца варьирует в пределах 20-40%. Для гетерозиготных близнецов риск и того меньше: 3-5%. Иными словами, гены как-то вовлечены в развитие болезни, однако главный пусковой механизм все же не в них. Согласно актуальным данным Общества по изучению рассеянного склероза, при наличии этого заболевания у одного из родителей ребенок тоже заболевает в 1 случае из 67. Для детей со здоровыми обоими родителями аналогичный показатель составляет примерно 1:500. Таким образом, риск действительно выше, однако это никоим образом не является абсолютным противопоказанием. Да, жизнь в т.н. «ситуации хронического стресса» в некоторых случаях может утяжелять течение болезни. Правда и то, что люди с рассеянным склерозом более предрасположены к повышенной тревожности. Однако полностью исключить стрессы с тревогами невозможно. Специалисты рекомендуют искать более эффективные способы совладания и преодоления стрессов. В недавно опубликованной брошюре говорится о том, что «Стрессов нельзя, – и не нужно, – панически избегать. Другое дело, что хорошее овладение способами снижать интенсивность переживаний будет работать на нас, а не против». Похожий миф состоит в том, что стрессогенная жизнь может увеличить риск развития рассеянного склероза. До сих не получено никаких подтверждений этого. Этот вопрос также изучался специалистами. Рассеянный склероз – хроническое, пожизненное заболевание. Средняя продолжительность жизни у заболевших меньше примерно на 7 лет, чем популяционный показатель. Но сама по себе эта болезнь не является летальной. Более того, в выборках людей, заболевших много десятилетий назад, средняя продолжительность жизни меньше, чем в когортах заболевших в более поздние годы. Это говорит о том, что продолжительность жизни у больных рассеянным склерозом, в среднем, постепенно увеличивается. И она все меньше будет отличаться от среднестатистического уровня – по мере появления новых научных данных и разработки новых терапевтических стратегий. По материалам сайта Medical News Today Активное вещество – арабиноксилан. Таблетированная форма, ингредиенты: арабиноксилан (250 мг), микрокристаллическая целлюлоза (наполнитель), кукурузный крахмал (стабилизатор), какао-порошок (цвет), глицерин эфир жирных кислот (эмульгатор), декстрин (стабилизатор), трикальцийфосфат (агент против слеживания), диоксид кремния (агент против слеживания). Саше, ингредиенты: арабиноксилан (1000 мг), микрокристаллическая целлюлоза (наполнитель), декстрин (стабилизатор), кукурузный крахмал (стабилизатор), трикальцийфосфат (агент, предотвращающий слипание). Таблетки, содержащие по 250 мг арабиноксилана, упакованные в блистер, по 50 таблеток в упаковке. Порошок для приготовления оральной суспензии, упакованный в саше-пакеты, содержащие по 1000 мг арабиноксилана, по 30 /105 саше-пакетов в упаковке. ПОКАЗАНИЯ К ПРИМЕНЕНИЮ Основным показанием для применения является натуропатическое лечение больных с метастазирующими опухолями, прошедших медицинское лечение. Учитывая, что при приеме происходит активизация натуральных киллеров (NK-клеток), способных уничтожать клетки рака в соотношении 1:1, важно предварительно уменьшить опухолевую нагрузку при помощи хирургии, химиотерапии и/или лучевой терапии. Способен существенно снижать побочные эффекты химио- и лучевой терапии при одновременном применении, улучшая качество жизни пациентов (уменьшение тошноты и рвоты, диареи; профилактика выпадения волос; повышение аппетита, настроения, работоспособности; нормализация сна). Наиболее эффективен при лечении лейкемии и множественной миеломы, а также лимфомы, рака простаты, молочной железы и яичников. Применяемый в качестве средства для общего поддержания здоровья, помогает укрепить иммунную систему, увеличивая активность лейкоцитов. Положительное действие наблюдается также при разрушении энзимов печени вследствие гепатита (NK-клетки уничтожают клетки, пораженные вирусом гепатита) или под действием определенных токсических веществ (антиоксидантное действие), при хронической усталости после вирусных заболеваний (с возможной ликвидацией пораженных EBV или цитомегаловирусом клеток) и при ВИЧ-нфекции. При рецидивирующих вирусных инфекциях с межклеточной вирусной персистенцией типа Herpes simples, Herpes zoster, EBV можно попытаться провести 2-х месячный курс приема, если лечение другими препаратами не дает желаемых результатов. При аллергических реакциях сдерживает дегрануляцию тучных клеток, уменьшая симптомы аллергии. Ообладает способностью повышать толерантность к глюкозе, благоприятно влияя на течение диабета, хотя и не является заменителем инсулина. ДОЗИРОВКА И СПОСОБ ПРИЁМА Рекомендуемая ежедневная доза должна составлять 30-45 мг/кг/день (2-3 г в день), Максимальная эффективность при пониженной активности натуральных киллеров (NK-клеток) достигается обычно через 1-2 месяца, после чего можно снизить дозу до поддерживающей 15 мг/кг/день (1 г в день). Для общего поддержания здоровья рекомендуется доза не менее 500 мг в день. При диабете, а также при гепатитах В, С и других инфекциях рекомендуется принимать 1000 мг в день, а при онкологических заболеваниях и СПИДе — 3 г в день в течение месяца-двух с последующим переходом на 1 г в день. Биобран следует принимать всегда после еды, через 30 минут после приёма пищи, большие ежедневные дозы должны быть разделены на три порции и приниматься после завтрака, обеда и ужина. Порошок следует растворять в 100 мл воды или сока, таблетки следует запивать водой. Токсическое действие арабиноксилана, а также побочные действия при длительном приеме не зафиксированы. Иммуносупрессивная терапия, плохая усвояемость, целиакия, нетерпимость к арабинозе и ксилозе. Ввиду иммуномодулирующего действия применение при аутоиммунных заболеваниях требует осторожности. Препарат следует хранить в недоступном для детей месте при температуре не выше + 25°С. Желудочно-кишечный тракт (ЖКТ) выполняет не только пищеварительную, но и иммунную функцию, в частности, участвует в реализации защитных реакций организма против патогенных и условно-патогенных микроорганизмов. Около 80% всех иммунокомпетентных клеток организма локализовано именно в слизистой оболочке кишечника, и именно здесь действуют пробиотики. Однако следует быть внимательным, т.к. не все пробиотики одинаково полезны. Бион ® 3 объединяет 3 тщательно подобранных штамма лакто и бифидобактерий в единую эксклюзивную комбинацию “Tribion ® Harmonis” Оригинальная комбинация пробиотиков Витамины и минералы играют важную роль в метаболизме, влияют на функционирование органов, и, что немаловажно, являются важными факторами (особенно витамины А, D, E, C, B6, B12 и ФОЛИЕВАЯ КИСЛОТА и минералы Fe, Zn, Se), необходимыми для полноценной работы иммунной системы. Если организм не получает достаточного количества витаминов и минералов, то некоторые метаболические реакции замедляются (метаболизм углеводов, жиров и белков). Это приводит к нарушениям нормального функционирования органов и систем, а также к угнетению иммунитета и развитию инфекций. К сожалению, организм не способен синтезировать витамины (кроме витамина D) и минералы и нуждается в их поступлении извне. Создатели Бион ® 3 учли это и включили в состав комплекса все витамины и минералы, необходимые для полноценной работы иммунитета и нормального функционирования организма. % от суточной потребности Содержание в 1 таблетке Вит. С / Аскорбиновая кислота (в форме кальция аскорбата) Вит. РР / Никотинамид Вит. Е / а-токоферола ацетат Вит. В 5 / Пантотеновая кислота (в форме кальция пантотената) Вит. В 6 / Пиридоксина гидрохлорид Вит. В 2 / Рибофлавин Вит. В 1 / Тиамина нитрат Вит. А / Ретинол (в форме ретинола ацетата) Вит. D 3 / Холекальциферол Вит. В 12 / Цианокобаламин | 1,0 мкг | 33 % | |||||||||||||||||||||||||||||||
| Кальций (в форме трикальцийфосфата) | 90 мг | 9 % | |||||||||||||||||||||||||||||||||||||
| Магний (в форме магния оксида) | 45 мг | 10 % | |||||||||||||||||||||||||||||||||||||
| Железо (в форме железа сульфата) | 5 мг | 36 % | |||||||||||||||||||||||||||||||||||||
| Цинк (в форме цинка оксида) | 5 мг | 33 % | |||||||||||||||||||||||||||||||||||||
| Марганец (в форме марганца сульфата) | 1,2 мг | 60 % | |||||||||||||||||||||||||||||||||||||
| Йод (в форме калия йодида) | 100 мкг | 70 % | |||||||||||||||||||||||||||||||||||||
| Селен (в форме натрия селената) | 30 мкг | 40 % | |||||||||||||||||||||||||||||||||||||
| Хром (в форме хрома хлорида) | 25 мкг | 50 % | |||||||||||||||||||||||||||||||||||||
| Молибден (в форме натрия молибдата) | 25 мкг | 55 % | |||||||||||||||||||||||||||||||||||||
Вспомогательные компоненты:
калия хлорид, микрокристаллическая целлюлоза, инулин, глюкоза, диглицерид стеариновой кислоты, поливинилпирролидон, поливинилполипирролидон, магния стеарат, краситель железа оксид, кроскармеллоза, диоксид кремния, кукурузный крахмал, декстрин, гидроксипропилметил-целлюлоза, гидроксипропилцеллюлоза.
Область применения:
дополнительный источник витаминов, минеральных веществ и пробиотических микроорганизмов (бифидо- и лактобактерий).
Рекомендации по применению:
Взрослым и детям старше 14-ти лет по 1 таблетке в день во время еды, проглатывая целиком и запивая достаточным количеством воды. Продолжительность приема 1 месяц. При необходимости (особенно в зимний и весенний периоды) курс можно повторить.
При приеме антибиотиков рекомендуется принимать ежедневно по 1 таблетке Бион ® 3 через 2 часа после приема антибиотиков, не раскусывая и запивая достаточным количеством воды (1 стакан). Не превышать рекомендованную дозу.Начинать прием Бион ® 3 необходимо одновременно с началом приема антибиотиков. Беременным и женщинам, планирующим беременность, не следует превышать рекомендуемую дозу.
Противопоказания:
Условия хранения:
Условия реализации:
Через аптечную сеть и специализированные отделы торговой сети.
Форма выпуска:
Упаковка:
пластиковая баночка, содержащая 30 таблеток, или блистер, содержащий 10 таблеток.
Срок годности:
№ госрегистрации
RU.77.99.11.003.E.043698.10.11 от 14.10.2011
Производитель:
Продвижение продукта и прием претензий от потребителей осуществляется компанией
«Д-р Реддиc Лабораторис Лтд.», г. Москва, 115035, Овчинниковская наб., д. 20, стр.1.
Неудобная правда об адаптогенах
Иногда нам кажется, что наш организм не справляется с ежедневной нагрузкой и ему нужно что-то, что могло бы помочь, подстегнуть, придать сил. И тут на сцену выходят адаптогены, их можно купить в аптеках, заказать в Интернете, приготовить домашнее средство из растений на подоконнике. Но так ли это полезно и так ли это безопасно?
Под термином «адаптогены» мы понимаем широкую группу субстанций природного или синтетического происхождения, которой приписывают способность повышать неспецифическую сопротивляемость организма к различным вредным воздействиям. Это могут быть производные растительного или животного сырья, а также синтезированные в лабораториях соединения. Чаще всего они регистрируются как «биологически активные добавки», «supplements», то есть не являются лекарствами в классическом смысле.
Зачастую адаптогенный препарат в химическом смысле представляет собой сложную комбинацию различных веществ, которую непросто проанализировать и воспроизвести, поэтому эффект может разниться даже от партии к партии препарата и, соответственно, не всегда может быть предсказан. Кроме того, точное содержимое баночки иногда совсем неясно – формально разрешенные добавки могут содержать компоненты, не прошедшие процедуру одобрения.
Еще одна неочевидная «темная сторона» активного приема адаптогенов – иногда стремление к улучшению своего здоровья становится компонентом расстройства пищевого поведения, называемого орторексией. При этом озабоченность здоровым образом жизни становится приоритетом, вытесняющим все прочие интересы, а нарушение правил этого образа жизни рождает тревожность и чувство вины. Безусловно, пищевые добавки сами по себе не могут сподвигнуть человека к таким переменам в поведении, а вот их настойчивая реклама – вполне.
Пожалуй, этот вопрос не совсем корректен. Отсутствие доказанных эффектов не означает полного отсутствия эффектов вообще, это-то как раз и становится иной раз проблемой. Так, некоторые препараты на основе растительного сырья (например, зверобой и его препараты) могут влиять на метаболизм других лекарственных препаратов и повышать риск побочных эффектов (кровотечений, усиления токсических эффектов).
В то же время некоторые добавки могут оказаться небесполезны. Например, известный многим мелатонин продемонстрировал достоверный эффект в предотвращении и купировании джетлага, тревожности в пред- и постоперационном периоде, в то же время не было обнаружено достоверных подтверждений его полезности для терапии сезонной депрессии. Таким образом, вероятно, некоторые адаптогены могут иметь нужные эффекты и могут быть рекомендованы к приему (после проведения корректно спланированных исследований).
Безусловно, это ваше право и ваше решение. Однако, чтобы обезопасить себя, лучше помнить о нескольких важных моментах:
Следует помнить, что для некоторых групп людей прием адаптогенов может быть ограничен:
В целом прием адаптогенов до сих пор остается предметом горячей дискуссии среди врачей, пациентов, физиологов и психологов. Но если вы считаете что их употребление вам необходимо, постарайтесь подойти к их подбору максимально взвешенно и тщательно, а также внимательно следите за своим состоянием во время приема.
Вопросы эффективности и безопасности применения препаратов гормона роста в педиатрической практике
В настоящее время препараты гормона роста широко применяются в практике детского эндокринолога. Доказана эффективность гормона роста в лечении низкорослости при использовании препаратов с заместительной целью. Однако прогнозирование эффективности терапии
Currently, growth hormone preparations are widely used in practice of child’s endocrinologist. The efficiency of growth hormone in using its preparations with the purpose of substitution for treatment of stunting was proven. However, forecasting of the therapeutic efficiency remains the issue which requires detailed study.
Применение препаратов гормона роста (ГР) в терапевтических алгоритмах заболеваний, сопровождающихся нарушениями динамики ростовых показателей, сегодня обусловлено широкой доступностью несмотря на высокую стоимость. Рекомбинантный человеческий ГР, полученный биосинтетическим путем, используют в педиатрической практике как средство стимуляции роста, так и как метаболический регулятор нарушенных обменных процессов начиная с 1985 г. Вместе с тем препараты соматропина (МНН препаратов гормона роста) имеют определенные показания с доказанной эффективностью. Основным показанием к назначению соматропина является гипопитуитаризм. Именно лечение недостаточности ГР при гипопитуитаризме препаратами соматропина является патогенетически обоснованным и проводится с заместительной целью.
Применение ГР при других вариантах низкорослости возможно, но прогностически непредсказуемо. К настоящему времени имеются данные об эффективности лечения ГР детей с внутриутробной задержкой роста, семейной низкорослостью, синдромами Шерешевского–Тернера, Прадера–Вилли, Рассела–Сильвера, анемией Фанкони, гликогенозом, хронической почечной недостаточностью, скелетными дисплазиями, муковисцидозом [1].
С 2003 г. в США используют биосинтетический ГР для лечения детей с идиопатической низкорослостью. Возраст в начале терапии ГР и ответ на терапию ГР в первый год лечения являются основными факторами, определяющими конечный рост при идиопатической низкорослости. Предполагалось, что дети с хорошим ростовым ответом в первый год лечения ГР при идиопатической низкорослости скорее всего будут иметь хороший конечный рост при использовании даже низких доз ГР [2]. Однако результаты наблюдения показали, что индивидуальный эффект терапии остается сложным для предсказания. Большая вариабельность ауксиологических данных, возраст, показатели роста и костного возраста на момент начала терапии, скорость роста в первый год лечения определяют многофакторный анализ, сложный для прогнозирования.
Достаточно сложно прогнозировать ответ на лечение ГР также и при заместительной терапии. Оценка эффективности лечения ГР при соматотропной недостаточности по ауксиологическим параметрам показала, что ростовой ответ является переменным и различен в каждом конкретном случае [3]. Характерной особенностью терапии соматотропной недостаточности является то, что по данным наблюдений за терапией пациентов результат первого года лечения выше, чем в последующие годы. При этом отмечено, что единственным клинически значимым предиктором ответа роста на начало лечения в первый год является возраст начала терапии. Тогда как ни пик ГР при проведении стимуляционных тестов, ни пол, ни рост на момент начала терапии, индекс массы тела (ИМТ), костный возраст, доза ГР не влияют на скорость роста в первый год терапии. Более ранняя диагностика и лечение ГР позволяют достичь лучшего конечного роста в тяжелых случаях недостаточности ГР. Показано, что лучший ответ на лечение отмечался у детей с тяжелой степенью недостаточности ГР [4]. Но, по другим данным, конечный рост не имеет существенных различий у пациентов с тяжелым дефицитом ГР и пациентов с парциальным дефицитом ГР [5].
Рядом исследований было показано, что рост родителей является одним из показателей, который позволяет прогнозировать конечный рост у пациентов с дефицитом ГР, получающих заместительную терапию ГР. Было отмечено, что лечение ГР имеет лучшую эффективность у пациентов, в семьях которых не было родственников с низкорослостью [6].
Хотя лечение препаратами ГР не всегда сопровождается достижением генетически детерминированного роста, увеличение роста в первый год лечения в возрасте до начала полового развития коррелирует с общей прибавкой в росте при терапии. Это подтверждает важность начала лечения до начала пубертата [7].
В настоящее время ведется ряд исследований, с помощью которых подбирается необходимое сочетание лекарственных препаратов, комбинация с которыми ГР улучшит результаты лечения. Так, было показано, что одновременное назначение при врожденном дефиците ГР заместительной терапии ГР и агониста гонадолиберина с целью торможения инициации полового развития не имеет преимуществ перед назначением только ГР [8].
Ростовые эффекты ГР при соматотропной недостаточности у пациентов и с изолированным дефицитом ГР, и у пациентов с множественной недостаточностью гормонов гипофиза выражены с одинаковой степенью: 89% пациентов с изолированной недостаточностью ГР и 81% пациентов при множественном дефиците гормонов гипофиза достигают прогнозируемого роста. Причем бо?льшая прибавка в росте наблюдается в возрасте до начала пубертата [9].
Многолетний опыт лечения препаратами ГР показал, что лечение детей с низкорослостью с использованием дозы соматропина, рассчитанной на массу тела ребенка, сопровождается большой вариабельностью в ростовом ответе на терапию ГР. Вопрос, почему дети с недостаточностью ГР, терапия которых направлена на простое замещение недостающего ГР, имеют такие различные клинические исходы, до настоящего времени не решен.
Ведутся исследования, направленные на поиск фармакогеномных маркеров с прогностической значимостью чувствительности клеток к ГР.
Изучено изменение уровня инсулиноподобного фактора роста 1 (ИФР-1) после 1 месяца лечения ГР у детей с недостаточностью ГР и доказано, что имеется зависимость между полиморфизмом клеточного регулятора CDK4 и степенью изменения концентрации ИФР-1. Дальнейшее изучение взаимосвязи геномных маркеров и ранних изменений уровня ИФР-1 может позволить разработать стратегию быстрого индивидуального подбора дозы ГР при врожденной соматотропной недостаточности [10].
Также на конечный рост пациентов, получающих лечение ГР, оказывает влияние наличие или отсутствие полиморфизма SOCS2 (rs3782415). Полиморфизм, выявляемый в GHR, IGFBP3 и SOCS2 локусах, влияет на результаты роста пациентов с врожденной соматотропной недостаточностью, получающих ГР. Использование этих генетических маркеров может определить пациентов, генетически предрасположенных к менее результативному лечению [11].
Конечным результатом подобных исследований должно стать признание важности индивидуального дозирования ГР для каждого пациента на основе конкретных индивидуальных геномных характеристик. Это позволит значительно улучшить терапию, которая в течение долгих лет базируется на принципе «одна дозировка подходит всем».
Насколько терапевтическая эффективность соматропина сопоставима с его безопасностью — вопрос, требующий глубокого детального анализа, решение которого возможно путем накопления опыта применения ГР при лечении различных форм низкорослости.
Безопасность во время лечения и неблагоприятные эффекты лечения ГР тщательно отслеживаются и описываются у детей с дефицитом ГР (как с изолированной, так и с множественной недостаточностью гормонов аденогипофиза) и у детей с идиопатической низкорослостью [12]. Согласно имеющейся информации, полученной в основном из постмаркетинговых исследований, поддерживаемых производителями препаратов ГР, имеется низкая частота (менее 3% пролеченных детей) побочных эффектов и увеличение благоприятного профиля безопасности ГР. Тем не менее, полный спектр потенциальных побочных эффектов ГР не точно диагностируется при помощи постмаркетинговых исследований. Это связано с достаточно длительным сроком лечения, меняющимися в динамике характеристиками больного и невозможностью отследить нежелательные явления после окончания лечения пациента [13–15].
Редко возникающим нежелательным явлением при лечении ГР является внутричерепная гипертензия. Более высокий риск ее развития отмечен в группах больных с хронической почечной недостаточностью, синдромом Шерешевского–Тернера и с органическими причинами дефицита ГР. Внутричерепная гипертензия обычно развивается в начальном периоде лечения или при увеличении дозы препаратов соматропина, прекращается с окончанием терапии ГР. Показанием для проведения фундоскопии офтальмологом являются симптомы, указывающие на внутричерепную гипертензию, такие как сильная головная боль, двоение/нечеткое зрение и рвота. Лечение часто может быть возобновлено при более низких дозах ГР без возврата симптомов.
К осложнениям терапии соматропином относят изменения в костной системе — эпифизеолиз и сколиоз. Эпифизеолиз диагностируется с частотой 73 на 100 000 лет лечения и встречается реже у больных с изолированным дефицитом ГР и идиопатической низкорослостью по сравнению с теми пациентами, у которых дефицит ГР наблюдается вследствие внутричерепных новообразований, краниофарингеомы [16]. Средняя продолжительность от начала терапии ГР до появления эпифизеолиза колеблется от 0,4 до 2,5 лет. Рекомендовано регулярное наблюдение за появлением соответствующих симптомов, таких как боли в бедре и/или боли в колене, изменения в походке, в случае положительного результата — тщательное обследование и консультация ортопеда. Эпифизеолиз требует хирургического вмешательства на эпифизе бедренной кости.
Сколиоз прогрессирует во время лечения ГР из-за быстрого роста, а не является прямым побочным эффектом ГР. Наиболее часто сколиоз развивается при лечении синдромальных форм низкорослости (например, при синдроме Шерешевского–Тернера и синдроме Прадера–Вилли) [17]. У 0,2% детей с идиопатической низкорослостью или с изолированным дефицитом ГР, получавших ГР, отмечено прогрессирование сколиоза [18]. Регулярное обследование на предмет наличия или прогрессирования сколиоза рекомендуется всем пациентам, получающим препараты ГР.
Данные научных публикаций и собственный практический клинический опыт свидетельствуют о необходимости мониторинга показателей метаболизма глюкозы у пациентов, получающих ГР. Это связано с доказанным фактом наличия резистентности к инсулину при лечении препаратами соматропина. Заболеваемость сахарным диабетом (СД) 1-го типа не увеличивается при терапии ГР. Вместе с тем известно, что больные с синдромом Шерешевского–Тернера, Прадера–Вилли имеют высокий риск развития неиммунных форм сахарного диабета. Снижение чувствительности к инсулину и компенсаторное увеличение секреции инсулина с обеспечением эугликемии сопровождается нарушением толерантности к глюкозе и требует коррекции метаболических нарушений, а в ряде случаев отмены препаратов ГР [19]. Мониторинг потенциального развития сахарного диабета с тестированием крови на уровень глюкозы и/или HbA1c должен быть включен в алгоритм наблюдения за всеми пациентами, получающими препараты ГР.
Патофизиологические и эпидемиологические наблюдения позволяют выразить опасение, что ГР может увеличить риск развития злокачественной опухоли во время или после терапии. Известно, что реализация ростового эффекта ГР опосредована соматомединами, один из которых ИФР-1. ИФР-1 и ГР относятся к веществам с митогенной и антиапоптозной активностью, и их рецепторы обнаружены в опухолях. Состояния нарушенной и избыточной секреции/действия ГР ассоциированы со снижением и повышением риска злокачественности соответственно. Снижение ИФР-1 через ограничение калорийности индуцирует апоптоз и предотвращает или замедляет рост опухоли [20–22]. Некоторые немногочисленные эпидемиологические исследования соотносят увеличение ГР и уровни ИФР-1 с опухолями толстой кишки, молочной железы, щитовидной железы и раком предстательной железы у взрослых [23]. В целом данные литературы указывают на разрешающую/факультативную, а не причинную роль ГР в онкогенезе.
Заболеваемость впервые выявленными во время лечения лейкемией или злокачественными новообразованиями в целом после лечения у детей без сопутствующих факторов риска не увеличивается по сравнению с таковой в общей популяции. Несмотря на данные об отсутствии влияния ГР на появление второго новообразования у детей, в анамнезе которых была неоплазия [24, 25], пункт о повышенном риске развития второго новообразования у пациентов, получавших ГР, в настоящее время присутствует в инструкции по применению на всех препаратах ГР в США. Отсутствуют данные относительно эффектов ГР на риск развития неоплазии у больных с заболеваниями, которые сами отнесены в группу повышенного риска возникновения новообразований. Риск новообразований у пациентов, получающих лечение ГР, был рассмотрен Комитетом по лекарственным средствам и терапии Общества детских эндокринологов, и ключевой рекомендацией является необходимость продолжающегося наблюдения всех пациентов, получавших лечение ГР, и это имеет первостепенное значение [26].
Перед началом терапии ребенка препаратами гормона роста его родители должны быть информированы о неопределенности в отношении долгосрочной безопасности (о неблагоприятных эффектах после терапии в зрелом возрасте).
Долгосрочные исследования (в среднем 17 лет) по наблюдению 6928 детей с изолированной соматотропной недостаточностью идиопатической низкорослостью, или низким гестационным возрастом, которые начали лечение ГР в период между 1985 и 1996 гг., во Франции показали 30%-й рост общей смертности по сравнению с населением в целом [27]. Все виды смертности, связанной с раком, не были увеличены, но стандартизованные показатели смертности были повышены в группах больных с опухолями костной системы, больных с нарушениями в системе кровообращения и больных с кровоизлиянием в мозг. Применение дозы препаратов ГР более 50 мкг/кг/день не рекомендовано. Полученные из той же базы данные в недавнем исследовании показали значительно более высокий риск развития инсульта (особенно геморрагического инсульта) среди пациентов, получавших ГР в детстве [28]. В противоположность этому последующее наблюдение 2543 пациентов с изолированной соматотропной недостаточностью, идиопатической низкорослостью или низким гестационным возрастом из других европейских стран не выявили никакого эффекта воздействия ГР и/или дозы на смертность или частоту развития сердечно-сосудистых событий [29].
Таким образом, имеющиеся данные относительно безопасности терапии ГР для детей с различными формами низкорослости определяют необходимость формирования персонализированного алгоритма диспансерного наблюдения пациента и должны включать информирование родителей ребенка об имеющихся сегодня сведениях о нежелательных явлениях как во время лечения, так и в отдаленные периоды жизни.
Применение высоких доз препаратов гормона роста при синдромальных формах низкорослости должно иметь взвешенный подход к сопоставлению показателей эффективности и безопасности лечения. Увеличение дозы ГР определяет рост шансов, отдаленных метаболических или злокачественных рисков, не обнаруженных в ходе проведенных на сегодняшний день исследований. Изменение характеристик пациентов, этнических особенностей и рост уровня ожирения в детстве может увеличить риск развития СД 2-го типа у получающих ГР.
Определенные побочные эффекты препаратов ГР, связанные с ускоренным ростом (прогрессирование сколиоза и эпифизеолиз) и другими неизвестными механизмами (внутричерепная гипертензия), встречаются редко, однако требуют упреждающего разъяснения и тщательного контроля.
Кроме того, следует помнить об отдаленных последствиях гормонального лечения. Поскольку исследования населения, не получающего ГР, свидетельствуют о том, что высокие нормальные уровни свободного ИФР-1 (часто выявляемые у детей, получавших ГР) могут увеличить риски онкологических заболеваний, потенциальные связи между воздействием ГР и будущими рисками возникновения неоплазии требуют постоянного контроля. И, наконец, соответствующий уровень допустимого риска для новейшей и потенциально самой большой группы пациентов, получавших ГР, — практически здоровых, но низкорослых детей — еще предстоит определить [30].
Литературы
Е. Б. Башнина, доктор медицинских наук, профессор
О. С. Берсенева 1
ФГБОУ ВО СЗГМУ им. И. И. Мечникова МЗ РФ, Санкт-Петербург