Как победить аутоиммунное заболевание
Как победить аутоиммунное заболевание
Микробиом и аутоиммунные заболевания
АУТОИММУННЫЕ ЗАБОЛЕВАНИЯ И КИШЕЧНЫЙ МИКРОБИОМ
ВЗАИМОСВЯЗЬ АУТОИММУНИТЕТА С СОСТОЯНИЕМ КИШЕЧНОГО МИКРОБИОМА

Аутоиммунный процесс (аутоиммунитет) — это форма иммунного ответа, индуцированная аутоантигенами в условиях нормы и патологии.
В широком смысле понятие «аутоиммунные болезни» включает все расстройства, в этиологии и/или патогенезе которых в качестве первичных либо вторичных компонентов участвуют аутоантитела и/или аутосенсибилизированные лимфоциты.
В одних случаях нарушение толерантности является первичным и может быть причиной развития заболевания, в других, особенно при длительных хронических заболеваниях (например, хронический пиелонефрит, хронический простатит и др.), — вторичным и может быть следствием заболевания, замыкая «порочный круг» патогенеза. Нередко у одного больного развивается несколько аутоиммунных заболеваний, особенно это относится к аутоиммунным эндокринопатиям.
Среди заболеваний, которые относятся к данной группе недугов, следует отметить ревматоидный артрит, ряд аутоиммунных заболеваний щитовидной железы. Также аутоиммунным является механизм развития сахарного диабета первого типа, рассеянного склероза, системной красной волчанки. Существуют также некоторые синдромы, которые имеют аутоиммунную природу.
Рис. 1. Аутоиммунные заболевания
На сегодняшний день нет точных сведений и о механизме развития заболеваний такого типа. Согласно общему определению, возникновение аутоиммунных болезней провоцирует нарушение общих функции иммунной системы или же ее некоторых компонентов.
Таблица 1. Аутоиммунные заболевания: список наиболее часто встречающихся и основной патогенез их развития
Гематолог Пироговского Центра рассказал изданию «Москвич Mag» об эффективном лечении аутоиммунных болезней
Гематолог, д.м.н., профессор Денис Федоренко рассказал изданию «Москвич Mag» об эффективном лечении аутоиммунных заболеваний. Методика такого лечения была разработана в Пироговском Центре.
Денис Анатольевич перечислил возможные причины «поломок» иммунитета, вызывающих тяжелые заболевания — ревматоидный артрит, системную красную волчанку, болезнь Крона или рассеянный склероз. Врач порекомендовал не преувеличивать фактор риска вакцинации и в случае, если у родственников были аутоиммунные заболевания, исключать лишь необязательные прививки. В случае вакцинации детей, уточнил он, риск для ребенка от осложнений инфекционных болезней превышает риск развития аутоиммунных заболеваний в тысячи раз.
Гематолог Денис Федоренко: «Аутоиммунный сбой могут спровоцировать вакцинации и дистресс»
Аутоиммунные заболевания поражают, как правило, людей молодого возраста, иногда всего за несколько месяцев приводя к необратимой инвалидизации. Только в Москве от различных видов заболеваний иммунной системы страдают человек. Псориаз, мешающий адаптации в социуме, неспецифический язвенный колит с постоянным кровавым поносом, грозящий слепотой и полным параличом рассеянный склероз, системная красная волчанка и ревматоидный артрит — вот неполный перечень болезней, до недавнего времени считавшихся неизлечимыми.
В большинстве случаев стандартная терапия не приводит к стойкой ремиссии заболевания и оказывает лишь временный эффект. Но не так давно ситуация изменилась — в Пироговском центре научились эффективно лечить таких больных. Денис Федоренко, специалист по болезням крови, врач-гематолог отделения гематологии и химиотерапии Пироговского центра, участвовавший в разработке российской методики лечения системных аутоиммунных заболеваний сверхвысокими дозами химиотерапии с трансплантацией кроветворных стволовых клеток, рассказал «Москвич Mag» о причинах серьезных поломок иммунной системы, о том, чем опасна скрытая анемия и как ее распознать, почему популярная диета по группам крови — очередной миф и зачем хотя бы раз в год надо сдавать анализ крови.
Отечественные терапевты всегда отправляют пациентов делать анализ крови, клинический и биохимию. О чем говорит кровь?
Кровь продуцируется в костном мозге, это красно-бурое вещество можно увидеть на срезе костей или грудины. Именно в костном мозге находятся стволовые клетки, которые производят кровь (красные кровяные тельца, или эритроциты, переносящие кислород, и кровяные пластинки — тромбоциты), то есть клетки крови, отвечающие за свертываемость. Эти же стволовые клетки продуцируют иммунную систему, которая представлена в организме лейкоцитами и лимфоцитами, стражами организма и защитниками от инфекции. Но иногда эти клетки-защитники начинают нападать на собственные ткани и органы, и могут возникнуть различные аутоиммунные процессы.
Кровь — это ткань организма, такая же, как кожа или кости, но в отличие от других тканей она жидкая. Поэтому ее состояние показывает состояние всего организма в целом.
Какие самые распространенные аутоиммунные заболевания и в чем причина их возникновения?
При таких заболеваниях иммунная система, работающая по принципу «свой—чужой», в силу не до конца изученных причин дает сбой, и часть клеток начинает атаковать собственные ткани.
Хуже всего, что аутоиммунные заболевания поражают молодых людей и почти всегда приводят к полной инвалидизации, причем зачастую достаточно быстро. Если атаке подвергаются суставы, то развивается ревматоидный артрит, если кишечник — то язвенный колит или болезнь Крона, если кожа — псориаз, если щитовидная железа — аутоиммунный тиреоидит.
Одним из самых распространенных системных аутоиммунных заболеваний нервной ткани является рассеянный склероз, при котором иммунная система атакует миелиновую оболочку нервных волокон головного и спинного мозга, нарушая передачу импульсов от головного мозга к телу, что в итоге приводит к нарушениям двигательных и чувствительных функций.
Лечится рассеянный склероз достаточно сложно и, приобретая хроническое прогрессирующее течение, приводит к необратимой инвалидизации. Классическое лечение оказывает лишь незначительный эффект в виде снижения количества обострений или некоторого замедления прогрессирования заболевания. Остановить прогрессирование рассеянного склероза с помощью стандартного лечения невозможно.
Как-то странно в ХХI веке слышать о том, что есть множество неизлечимых заболеваний, вызванных сбоем иммунной системы, когда даже большинство видов рака научились лечить и успешно.
Действительно, мы успешно лечим еще недавно считавшийся неизлечимым рак крови: лейкемии, лимфомы, всего более сотни заболеваний крови. В эпоху таргетных препаратов, точечно действующих на молекулы или определенные зоны, до 90% раков крови излечимы полностью.
И с аутоиммунными болезнями тоже есть шанс на полное излечение. В Национальном медико-хирургическом центре им. Пирогова мы разработали новый метод, который позволяет использовать сверхвысокие дозы химиотерапии (в гораздо больших дозах, чем при стандартной химиотерапии), чтобы разрушить неправильный аутоиммунный процесс, а затем с помощью стволовых клеток пациента построить новый, здоровый иммунитет. На сегодняшний день мы — мировые лидеры в этой области, успешно лечим ревматоидный артрит, системную красную волчанку, болезнь Крона, рассеянный склероз и подобные ему состояния.
Это длительное лечение?
В стационаре пациент находится чуть больше месяца, причем десять дней в изоляции в закрытой палате, поскольку во время смены иммунитета необходимы условия, близкие к условиям в стерильной операционной. Лечение неприятное, у людей выпадают волосы, поднимается температура, может быть диарея. Но это ничто по сравнению с неизбежной инвалидизацией.
В чем причина возникновения аутоиммунного сбоя — гены, инфекции? И как можно защитить организм от самоуничтожения?
Причины сложно выделить, можно говорить лишь о провокациях (вакцинациях, дистрессе, инфекции, травмах), которые при общей наследственной предрасположенности могут вызвать болезнь. Но это не значит, что при наличии генетического фактора в семье дети обязательно заболеют. У нас наблюдались однояйцевые близнецы: один заболел, другой нет.
Для профилактики надо вести здоровый и активный образ жизни, правильно питаться, избегать излишних инсоляций и исключить интоксикации.
Если вакцинация может стать триггером, то, может, правы родители-антипрививочники?
Вакцинацию против детских болезней делать можно и нужно, риск для ребенка от осложнений инфекционных болезней превышает риск развития аутоиммунных заболеваний в тысячи раз. Но если у всех в роду были аутоиммунные заболевания, то стоит избегать лишних необоснованных вакцинаций.
До ХХ века главным лекарством от всех болезней считалось кровопускание, которое нередко действительно помогало. Это действительно эффективно?
Этот метод восходит к Средневековью. Самой частой причиной смерти считались сердечная недостаточность или отек легких. Сердечно-сосудистые заболевания и сейчас лидируют по летальности.
При этих состояниях сердце работает слабо, возникает скопление жидкости в легких, может сформироваться отек легких. И опытным путем врачи прошлого пришли к выводу, что если выпустить кровь, то нагрузка на сердце уменьшится. Таким образом, заболевание не лечилось, но происходило симптоматическое улучшение.
Анемия — самое распространенное заболевание крови в мире. Чем опасна эта болезнь?
Анемия, или, как в народе говорят, малокровие — это состояние, для которого характерно уменьшение количества красных кровяных телец — эритроцитов — и снижение содержания гемоглобина в единице объема крови. Причин анемии порядка полусотни, но самые частые — это кровотечения, как менструальные у женщин (достаточно терять по чайной ложке крови в месяц и не восполнять ее), так и желудочно-кишечные кровотечения.
На втором месте — дефицит некоторых элементов и витаминов, таких как железо или витамин B12, фолиевая кислота. Недостаток этих веществ может возникнуть во время беременности или лактации, кроме того, к анемии могут приводить онкология и многие хронические заболевания. Существуют даже наследственные формы анемий. Хроническая анемия чаще всего связана не с кровотечениями, а с потерей железа (снижению железа в организме может способствовать вегетарианство или диета), ответственного за выработку эритроцитов. Из-за нехватки железа костный мозг начинает меньше производить эритроцитов, и образуется хроническая анемия.
Кроме анемии нередко встречается латентный дефицит железа и (или) ферритина (отражает запасы железа в организме), причем эта скрытая форма может быть и при нормальном уровне гемоглобина и эритроцитов.
Опасно это состояние тем, что латентный дефицит железа рано или поздно переходит в железодефицитную анемию, когда уровень гемоглобина становится меньше 120 г/л крови у женщин и меньше 130 г/л у мужчин.
И эту анемию уже не вылечить никакими диетами, только лекарствами. Но если вовремя выявить латентный дефицит железа, то можно предотвратить возникновение хронической железодефицитной анемии.
Какие симптомы у анемии?
Люди с анемией устают сильнее, чувствуют себя слабее, у них сонливость, слабость, одышка или чувство нехватки воздуха, бледность кожных покровов, может быть ломкость волос и ногтей, сглаженный лакированный язык без сосочков, кровотечения, сердцебиения, головокружение.
В принципе, всем необходимо хотя бы раз в год сдавать анализ крови.
В косметологии сегодня очень популярен плазмолифтинг, когда косметолог берет кровь, прогоняет ее в центрифуге, чтобы отделить плазму от красных кровяных телец, и вводит ее под кожу. Считается, что таким образом оказывается мощный регенерирующий эффект на кожу. Действительно плазма обладает настолько волшебным потенциалом?
Кровь состоит из клеток крови и плазмы, в которой содержатся белки, жидкая часть. Я незнаком с этой методикой, скорее всего, это близко к инъекциям гиалуроновой кислоты.
В медицине плазма применяется для переливания при различных угрожающих для жизни состояниях в интенсивной терапии, при ожогах, чтобы помочь остановить кровотечение. На самом деле переливают все компоненты крови: если низкий уровень гемоглобина, то эритровзвесь, если низкий уровень тромбоцитов, то тромбоконцентрат. Цельную кровь, как раньше, сейчас не переливают, переливают только недостающие компоненты.
Хотя первая группа крови подходит всем, все же рекомендуется переливать от группы в группу. Должна быть полная совместимость между донором и реципиентом.
В американский натуропат Питер Д’Адамо разработал теорию питания по группам крови: первая группа принадлежит охотникам, значит, в их рационе должно доминировать мясо, вторая — земледельцам, соответственно, им стоит быть вегетарианцами, третья несет гены скотоводов, и этим людям показаны молочные продукты, а четвертая может с осторожностью есть все. Что вы как специалист по крови думаете на этот счет?
Это неправильный подход. В гематологии точно нет такой взаимосвязи.
Посмотрите на анатомию. Растительная пища переваривается очень медленно, и кишечник, например, коровы в раз длиннее ее тела. Мясо переваривается быстро, поэтому кишка хищника всего в раза длиннее.
У человека кишечник всего в 4 раза длиннее его туловища, и у нас есть и клыки, и жевательные зубы, соответственно, физиологически человеку свойственна разнообразная пища, как растительная, так и животная.
С какими мифами о крови вы сталкивались?
Связь группы крови и диеты, группы крови и заболеваний, даже брачные союзы по группе крови.
Аутоимунное заболевание
Иммунная система здорового человека толерантна к собственным тканям. Но иногда она начинает неадекватно на них реагировать – как на враждебные элементы. Ее мишенью могут стать абсолютно любые органы. Чаще всего встречаются аутоиммунные поражения щитовидной железы, желудка, суставов. В подобных случаях говорят об аутоиммунных заболеваниях (АИЗ). У пациентов может возникнуть длительная нетрудоспособность, а в ряде случаев – инвалидность. Несмотря на то, что науке известно уже более 80 разновидностей АИЗ, пока доподлинно не известно, почему они возникают.
Причины возникновения заболевания
В исследовательских кругах ведутся обсуждения причин появления АИЗ. Предполагается участие следующих факторов:
Дает сбой механизм рождения и отмирания аутореактивных Т- и В-лимфоцитов (готовых уничтожать клетки собственного организма).
Нарушаются гистогематические барьеры, защищающие ткани организма (глаз, мозга, половых желез, щитовидной железы) от агрессии собственной иммунной системы.Еще эти барьеры регулируют обменные процессы между тканями и кровью, обеспечивая постоянство состава и физико-химических свойств тканевой жидкости. Пострадать барьеры могут от воспалительного процесса.
Нарушены механизмы регуляции иммунного ответа.
Имеется генетическая предрасположенность. Причем она обусловливает не только наличие заболевания, но и орган-мишень иммунной системы. Как правило, для возникновения АИЗ должен мутировать не один ген, а сразу несколько.
Пациент перенес бактериальные и вирусные инфекции. Иногда патогенные белки похожи на белки организма, и ответ иммунной системы «на чужих» затрагивает «своих». К тому же, во время инфекционного процесса пробуждаются аутореактивные лимфоциты, процесс отмирания которых нарушился (первый фактор списка).
Беременность и клеточный химеризм на ее фоне: клетки плода для организма женщины наполовину чужеродны (содержат антигены супруга) и могут вызывать аутоиммунизацию. Подтверждением данной гипотезы является преобладание аутоиммунных заболеваний у женщин и пик заболеваемости в послеродовом периоде.
Справка! Аутоиммунные заболевания у женщин возникают в 2 раза чаще, чем у мужчин, что многие исследователи объясняют особенностями их гормонального статуса.
В целом исследователи сходятся на том, что для возникновения АИЗ, как правило, нужны две составляющие – генетическая предрасположенность и негативное влияние внешних факторов. Причем, к факторам относятся не только инфекции, но и злоупотребление табаком, химическими веществами, солнцем, перенесенные травмы.
Таким образом, баланс между ответом иммунной системы на «чужих» и толерантностью к «своим» — хрупкий и динамический процесс, регулирующийся хрупкими механизмами.
Что относится к аутоиммунным заболеваниям и как классифицируется
Список аутоиммунных заболеваний на сегодняшний день включает более 80 позиций. Их единой клинической классификации нет. Но тот факт, что одни поражают конкретный орган, другие – весь организм, позволяют говорить про деление:
На органоспецифические: рассеянный склероз, аутоиммунный тиреоидит (болезнь Хашимото), инсулинзависимый сахарный диабет (I тип), миастения, рассеянный склероз, болезнь Крона, неспецифический язвенный колит, аутоиммунный гепатит и так далее.
И органонеспецифические: системные васкулиты, ревматоидный артрит, системная красная волчанка, системный склероз, ревматическая полимиалгия, рецидивирующий полихондрит, острая ревматическая лихорадка.
Впрочем, и оно условно. У трети пациентов с псориазом развивается псориатический артрит, а это уже поражение всего организма.
Еще классифицировать патологии можно по органам-мишеням. Так, различают АИЗ:
желез внутренней секреции,
Симптомы и диагностика
Все АИЗ проявляются по-разному:
Проблемы со зрением и слухом, слабость рук и ног, недержание мочи может свидетельствовать о рассеянном склерозе, поражающем ЦНС.
Патологическая жажда, голод, чрезмерное выделение мочи, потеря веса сопровождают пациентов с диабетом I типа, поражающим поджелудочную железу.
Кожные аномалии (покраснения, зуд и шелушения), возникновение бляшек может говорить о псориазе.
Отечность конечностей, усталость, ощущение холода, проблемы с ЖКТ, обильные менструальные кровотечения отличают тиреоидит Хашимото.
Деформирующий артрит, появление кожных узелков, патологические изменения нервной системы и легких могут диагностировать при ревматоидном артрите.
Почечная недостаточность, поражение нервной системы, проблемы с кожей – маркеры системной красной волчанки.
Общими симптомами, которые должны насторожить, является субфебрилитет, слабость, повышенная утомляемость, одышка, чрезмерная потливость, снижение аппетита, болезненность суставов, патологическая потеря массы тела, патологии кожи, синдром Рейно (расстройство артериального кровообращения в сосудах конечностей под воздействием холода).
Диагностика начинается со сбора анамнеза, при котором врач уточняет наличие АИЗ у ближайших родственников, длительность имеющихся жалоб, наличие сопутствующей патологии, прием лекарственных препаратов, перенесенные накануне инфекционные заболевания (стрептококковые, герпесвирусные инфекции и др.).
Затем следует визуальный осмотр, позволяющий оценить состояние кожи, конечностей, лимфатических узлов (присутствует ли витилиго, сетчатое ливедо – древовидный рисунок на коже нижних конечностей, припухлость и ограничение движений в суставах, увеличение периферических лимфоузлов).
Для оценки изменений со стороны органов и систем, наиболее часто поражаемых при АИЗ, и системность этих поражений, врач назначает:
Инструментальные исследования: рентгенологию, УЗИ, эндоскопию. В ряде случаев (при болезни Крона, системной склеродермии) они имеют решающее диагностическое значение.
Лечение аутоиммунных заболеваний
На сегодняшний день основная задача врача при лечении аутоиммунных заболеваний – добиться снижения количества клеток-продуцентов аутоантител, а также лимфоцитов, обусловливающих иммунную агрессию.
Во избежание сильной аллергии снижается применение некоторых препаратов (антибиотиков и обезболивающих). При этом нельзя отказываться от заместительной терапии (приема инсулина и так далее).
К сожалению, лечение сводится к достижению ремиссии. Полностью избавиться от АИЗ нельзя.
Лечение аутоиммунных расстройств
Аутоиммунные заболевания (AD) можно определить как клинический синдром, вызванный активацией Т-клеток или В-клеток или того и другого, при отсутствии продолжающейся инфекции или другой видимой причины. Клинически они могут быть классифицированы как системные (например, системная красная волчанка) или органоспецифические (например, сахарный диабет I типа). Нерегулируемые самореактивные иммунные клетки повреждают ткань / орган-мишень за счет продукции ряда провоспалительных цитокинов, таких как фактор некроза опухоли (TNF-α), интерлейкины (IL), интерферон гамма (IFN-γ) и т. д., которые играют ключевую роль в его патогенезе аутоиммунных расстройств.
Несмотря на то, что традиционные схемы лечения, иммуностимуляторы и иммунодепрессанты, такие как циклоспорин и такролимус, которые применялись для лечения аутоиммунных заболеваний, были успешными, однако с появлением новых селективных целевых иммунотерапевтических средств произошла и сменилась революционная стратегия лечения аутоиммунных заболеваний.
Выбрав иммунные клетки в качестве мишени, исследователи разрабатывают новые биологические агенты в качестве терапевтического подхода к аутоиммунным заболеваниям. Эти виды иммунотерапии в широком смысле можно разделить на антигенно-специфические и неспецифические методы лечения. Ингибирование активации иммунных клеток и их путей наряду с запускающими факторами, включая цитокины и их рецепторы, считается неспецифической иммунотерапией, которая эффективно каталогизирована. Напротив, направление иммунотерапевтического лечения на устранение, толерантность и регуляцию эффекторных лимфоцитов, которые уклоняются от контроля и вносят вклад в патогенез аутоиммунных заболеваний, является антиген-специфической терапией. Однако, нельзя исключить возможность гиперчувствительности и обострения заболевания из-за введения родственного антигена в ранее сенсибилизированную среду.
CD 20, поверхностный антиген, экспрессируемый на В-клетке, играет ключевую роль в последней активации. Следовательно, предполагается, что CD 20 в качестве рассматриваемой мишени может быть полезным при лечении заболеваний, в значительной степени опосредованных В-клетками. Эффекторное действие, проявляемое анти-CD 20mAb, позволяет сгруппировать их в mAb типа 1, сильные активаторы комплемента, например ритуксимаб, в то время как тип 2 является сильными индукторами гомотипической адгезии и апоптоза, например офатумумаб. Хотя они успешно истощают зрелые В-клетки, их действие неэффективно на плазматические клетки и ранее продуцированные антитела.
Ритуксимаб, химерное мАт к CD 20 первого поколения, был одобрен для лечения ревматоидного артрита (RА). По мере того, как в литературе были получены обнадеживающие результаты исследований invitro и клинических испытаний, в ней также была установлена необходимость продвижения в направлении разработки более гуманизированных mAb. Ритуксимаб (RTX), химерное моноклональное антитело со специфической аффинностью к поверхностному антигену CD 20 на В-клетках, перехватывает две основные функции: развитие клеточного цикла и дифференцировку В-клеток. Будучи агентом, истощающим В-клетки, он считается полезным или даже лечебным, сдерживая дикую клику самовоспроизводящихся аутореактивных В-клеток при аутоиммунных расстройствах, хотя и охраняется определенными ограничениями. RTX как метод лечения приобрел значение при RА благодаря синовиальной активности B-клеток. От монотерапии до комбинированной терапии, от минимальной выборки до крупных исследований, применение в случаях, устойчивых к традиционному лечению, показало многообещающие результаты. Однако следует отметить, что механизм действия лекарственного средства может быть неэффективным, поскольку устранение патогенеза указанного аутоиммунного заболевания не регулируется одним только истощением В-клеток.
RTX считается относительно безопасным как при злокачественных, так и незлокачественных заболеваниях, хотя были зарегистрированы побочные эффекты, связанные с инфузией, инфекции, сывороточная болезнь, нейтропения и реакции на его химерный характер. CD22, молекула адгезии, ограниченная В-лимфоцитами, представляет собой мембранный рецептор, который в первую очередь активирует В-клетки и способствует взаимодействию с Т-клетками. Этот рецептор экспрессируется от стадии про B до стадии дифференцировки плазматических клеток. Этот мембранный рецептор был мишенью для анализа при аутоиммунных заболеваниях из-за его вклада в патогенез SLE ( системной красной волчанки).
Развитие менее иммуногенных анти-CD 20mAb второго поколения проложило путь для офатумумаба, окрелизумаба и велтузумаба.
Обинутузумаб, TRU-015, AME133V и Pro131921 представляют собой анти-CD 20mAb третьего поколения, обладающие улучшенными эффекторными функциями. Лучшая переносимость и мощный характер нового поколения хотя и выглядят многообещающе, но требуют определения руководящих принципов его применения и дозировки посредством контролируемых систематических клинических испытаний на аутоиммунных заболеваниях.
Терапия, направленная на TNF
Считается, что фактор некроза опухоли, плеотропный цитокин, важный провоспалительный медиатор, играет важную роль в аутоиммунных заболеваниях. С одной стороны, обнаружение TNF в синовиальных образцах пациентов с RA и, как следствие, снижение экспрессии провоспалительных цитокинов, таких как IL-1, IL-6, GM-CSF, наряду с подавлением индуцированного антигеном продукции IFN-γ на антителе против TNF введение в первый усиливает его иммунорегуляторную роль. Эти подтверждающие данные, основанные на фактических данных, привели к разработке биопрепаратов против TNF в качестве стратегии лечения аутоиммунных заболеваний. Инфликсимаб, этанерцепт, адалимумаб, голимумаб, цертолизумаб являются используемыми в настоящее время биологическими препаратами против TNF.
Инфликсимаб представляет собой рекомбинантное химерное антитело против TNF, которое блокирует связывание TNF со своими рецепторами и эффективно опосредует как CDC, так и ADCC. Этанерцепт, человеческий рекомбинантный белок, инактивирует TNF и лимфотоксин, тем самым препятствуя взаимодействию последнего со своими рецепторами. Это помогает пережить симптомы и замедлить прогрессирование заболеваний. Адалимумаб, полностью гуманизированные mAb IgG1, сравнительно хорошо переносятся из-за его минимальной иммуногенности по сравнению с инфликсимабом и его более длительного периода полувыведения.
Другим полностью гуманизированным mAb IgG1, обладающим большей аффинностью и специфичностью к человеческому TNF, способствующим эффективной нейтрализации TNF, является голимумаб. Цертолизумаб пегол, гуманизированное mAb, благодаря своей уникальной структуре и четкому механизму действия, способствует его более высокой эффективности по сравнению с другими ингибиторами TNF.
Таргетная терапия интерлейкином 6
IL 6, другой плейотропный цитокин, играет решающую роль в аутоиммунных заболеваниях. От секреции антител и иммуноглобулинов в В-клетках до дифференцировки CD4 + Т-гепер-клеток и CD8 + Т-клеток в Т-хелперы, продуцирующие IL-17 (Th 17) и активные цитотоксические клетки, соответственно, в Т-клетках, способствует его обоснованной роли в патогенезе. Кроме того, патогенная роль IL 6 продемонстрирована в многочисленных исследованиях на животных моделях с подавлением заболевания профилактическим или терапевтическим способом либо путем блокирования цитокина, либо путем введения антитела, что делает его мишенью для терапевтического вмешательства.
Таргетная терапия лимфоцитов Th 17
Таргетная терапия при аутоиммунных заболеваниях
Исследования выдвинули гипотезу, что уязвимые места, которые будут выявлены в механизме подавления T regs при аутоиммунных заболеваниях, когда T reg присутствуют в сбалансированном количестве, равны
1. Целевые аутореактивные CD4 + T эффекторные клетки памяти путем генерации толерогенных APC, что обеспечивает антиген-специфическую память. Т-клетки должны быть нацелены на реактивацию толерогенными APC.
2. Отношение к истощенным CD8 +Т-клетка к PD-1-PD-L1 опосредует гибель клеток под действием T reg, когда повышение экспрессии рецепторов IL2 с повышенной аффинностью (CD25) приводит к локальному истощению цитокинов.
3. Способность T reg ингибировать пролиферацию B-клеток и секрецию ими аутоантител при активации B-клетками.
Кроме того, исследователи обратились к ключевым моментам в предполагаемой ситуации, когда Treg несбалансированы при аутоиммунных заболеваниях: 1. Содействие формированию T reg через IL2 из-за их сродства к экспрессии, 2. Перенос адоптивных Treg-клеток путем восстановления иммунной системы до заболевания. начало может подавить начало болезни.
Однако, учитывая небольшую долю T reg в крови, трудности с их извлечением и выделением, поддержание его подавляющей функции является сложной задачей. Различные исследования были направлены на создание T regs как invitro, так и in vitro. Либо путем экспансии поликлональных T-регистров с помощью IL 2, рапамицина или аутоантигенных специфических T-reg с помощью антигена и дендритных клеток, антиген апоптоза приближается к достижению пула T-reg с его подавляющим действием. Следовательно, T-reg как мишень иммунотерапии могут быть адресованы либо путем достижения воспроизводимой популяции, либо путем ее активации, либо путем стимулирования ее образования, что позволяет им осуществлять свое подавляющее действие. Литература предполагает, что исследования проводятся как in vitro, так и in vitro для достижения первого.
Терапия дендритными клетками
Дендритные клетки (DC), они представляют собой антигенпрезентирующие клетки, которые представляют антиген Т-клеткам. Направление иммунного ответа, влияние на дифференцированные T reg, клетки Th 17, повышение толерантности, продуцирование воспалительных или супрессивных медиаторов делают их потенциальной мишенью для иммунотерапии. Толерогенные DC используются в исследованиях ранней фазы I для лечения RА, известных как Ревмавакс. Принцип, применяемый в этой форме терапии, аналогичен антигенспецифической терапии, когда нагруженные антигеном DC вводятся в Т-клетки во время презентации Ag с целью устранения Т-клеток. Эту процедуру необходимо анализировать на предмет различных факторов, таких как соответствующий антиген, путь, время и частота введения, а также отслеживать эффекты.
Иммунотерапия при аутоиммунных заболеваниях с оральными проявлениями
Пемфигус представляет собой группу угрожающих жизни пузырей эпидермальных и слизистых заболеваний, при которых аутоантитела, преимущественно представляющие собой Ig G4 и Ig G1, направлены к десмоглеину (Dsg) 1 и десмосомным компонентам клеточно-клеточных адгезионных комплексов. RTX оказался очень эффективным при пузырчатке. Он действует за счет неполного истощения В-клеток, снижения циркулирующих аутоантител к Dsg, модулируя как гуморальную, так и приобретенную иммунную функцию.
Современное лечение аутоиммунных заболеваний
Аутоиммунные заболевания представляют собой патологические состояния, характеризующиеся нарушением регуляции воспаления против аутоантигенов и поражающие 3-10% населения в целом.
Воспаление при аутоиммунных заболеваниях
Воспаление — это естественный процесс, посредством которого живые организмы восстанавливают поврежденные ткани и защищают их от инородных веществ. Однако нарушение регуляции иммунных реакций против собственных аутоантигенов приводит к потере иммунной толерантности и развитию аутоиммунных заболеваний. Хотя патофизиологические механизмы различаются для каждого аутоиммунного заболевания, несколько общих путей воспаления могут быть терапевтическими мишенями для иммунотерапии.
Аутоиммунные заболевания
Аутоиммунитет возникает из-за центральных и периферических дефектов контрольных точек толерантности и активации нетолерантных иммунных клеток. Аутоантигены могут быть индуцированы высвобождением аутоантигенов из иммунно-привилегированных участков, образованием нео-аутоантигенов и молекулярной мимикрией собственных белков с чужеродными веществами.
Клинические проявления аутоиммунитета могут быть разнообразными, начиная от бессимптомных состояний при наличии аутоантител и заканчивая молниеносными аутоиммунными заболеваниями, вызывающими угрожающее жизни поражение органов. Развитие аутоиммунного заболевания может быть спровоцировано факторами окружающей среды у генетически предрасположенных лиц. Триггеры окружающей среды, включая стресс, курение и инфекцию, вызывают провоспалительные функции врожденного иммунитета и способствуют патологическому ответу адаптивного иммунитета.
Наивные CD4 + Th-клетки дифференцируются в отдельные подмножества Т-клеток в зависимости от среды цитокинов. Т-клетки играют ключевую роль в патогенезе аутоиммунных заболеваний за счет распознавания аутоантигенов, продукции цитокинов и повышенной цитотоксичности. В последние десятилетия клетки Th17, продуцирующие IL-17 и FOXP3 + Treg, были выделены в качестве терапевтических мишеней для аутоиммунных заболеваний.
Лечение аутоиммунных заболеваний
Обычные методы лечения аутоиммунных заболеваний подавляют общую иммунную функцию, модулируя неконтролируемое воспаление. Однако эти терапевтические подходы не были полностью успешными в гетерогенных популяциях пациентов, и их эффективность достигается за счет побочных эффектов, особенно повышенного риска инфекции, обычно из-за неселективной иммуносупрессии.Чтобы преодолеть ограничения традиционных методов лечения, современные методы лечения направлены на более избирательное подавление воспалительных сигналов, вызывая при этом минимальное нарушение гомеостатических иммунных функций. Недавние достижения в понимании патогенеза заболеваний и новые методы производства лекарств привели к широкому использованию таргетной иммунотерапии для лечения аутоиммунных заболеваний. Кроме того, передовая молекулярная инженерия позволила появиться рекомбинантным белковым терапевтическим средствам, таким как mAb и слитые белки рецептор-Ab, которые нацелены на растворимые медиаторы или маркеры клеточной поверхности. Согласно отчету Global Pharmaceuticals Market Report, адалимумаб был самым продаваемым препаратом в мире в течение нескольких лет, за ним следуют другие таргетные иммунотерапевтические препараты, такие как пембролизумаб, ибрутиниб и устекинумаб.
За последние несколько десятилетий стандартом лечения аутоиммунных заболеваний стали биологические препараты и низкомолекулярные ингибиторы, нацеленные на воспалительные цитокины, иммунные клетки и внутриклеточные киназы. Новые методы лечения направлены на то, чтобы вызвать иммунную толерантность без ущерба для иммунной функции, используя передовые методы молекулярной инженерии.
Ингибирование цитокинов и лечение цитокинами
Ингибирование TNF, IL-6, IL-17 и IL-23 произвело революцию в лечении аутоиммунных заболеваний, таких как ревматоидный артрит, болезнь Бехтерева и псориаз. С тех пор, как в 1990-х годах селективная белковая терапия, нацеленная на ТNF, была впервые одобрена для лечения ревматоидного артрита (RА), таргетная иммунотерапия изменила правила игры в лечении аутоиммунных заболеваний.
TNFR1, конститутивно экспрессирующийся почти на всех ядерных клетках, в основном отвечает за воспалительную функцию TNF, тогда как TNFR2, который экспрессируется только на определенных типах клеток, таких как супрессорные клетки миелоидного происхождения, Treg-клетки и моноциты, связан с регуляторная функция TNF. Доступная в настоящее время терапия против TNF ингибирует как TNFR1, так и TNFR2. Из-за регулирующего аспекта TNF блокада TNF может парадоксальным образом индуцировать экспансию клеток Th1/Th17 и нарушение регуляции ответа IFN, что может объяснить неэффективность лечения, образование аутоантител и парадоксальный псориаз во время анти-TNF терапии. Поэтому более селективные методы лечения для ингибирования TNFR1 и усиления TNFR2 находятся в стадии изучения.
IL-23 взаимодействует с рецепторным комплексом, состоящим из IL-12Rβ1 (связывается с IL-12/IL-23p40) и IL-23R (связывается с IL-23p19), которые связаны с тирозинкиназой (TYK) 2 и JAK2 соответственно. Активация TYK2 и JAK2 приводит к фосфорилированию и ядерной транслокации STAT, преимущественно STAT3. Блокада передачи сигналов IL-23 может быть достигнута путем целенаправленного ингибирования IL-12/IL-23p40 или IL-23p19. В качестве mAb против IL-12/IL-23p40 устекинумаб блокирует как IL-12, так и IL-23, тогда как mAb против IL-23p19 (гуселкумаб, тилдракизумаб, рисанкизумаб и мирикизумаб) ингибируют только IL-23.
Внутриклеточные киназы, как мишени таргетированной иммунотерапии
Растворимые медиаторы из активированных иммунных клеток передают воспалительные сигналы, связываясь с родственными им рецепторами. При взаимодействии с воспалительными цитокинами рецепторы активируют семейство JAK, вызывая фосфорилирование, димеризацию и ядерную транслокацию STAT. Транскрипция генов с помощью STAT способствует пролиферации и дифференцировке клеток, а также выработке различных медиаторов воспаления, что еще больше усугубляет аутоиммунное воспаление. Недавно появившиеся низкомолекулярные ингибиторы киназы, нацеленные на семейство JAK. которые отвечают за передачу сигнала от множества рецепторов, вызвали большой интерес в области аутоиммунных и гематологических заболеваний. После успешного внедрения биологической терапии для лечения аутоиммунных заболеваний молекулярные мишени расширились до внутриклеточных киназ. Блокирование конвергентных сигналов низкомолекулярными ингибиторами киназы представляет большой интерес с точки зрения терапевтической эффективности и долгосрочной безопасности.
Виды аутоиммунных заболеваний
Человеческий костный мозг способствует выработке лимфоцитов. После проникновения в кровяное русло, они становятся незрелыми. К первому месту, где происходит их созревание, относится тимус, ко второму лимфатический узел. Локализацией тимуса является верхняя часть грудной клетки, а лимфатических узлов – шея, пах, подмышечная впадина. Т-лимфоцитами называются клетки после созревательного процесса в тимусе, а в-лимфоциты, созревшие в лимфатическом узле. Эти два вида лимфоцитов вырабатывают антитела, которые борются с чужеродными тканями и инфекциями. Реакция антитела направлена только на антиген, который ему соответствует. К примеру, у ребенка, который переболел свинкой, не будет вырабатываться иммунитет от кори.
Сутью вакцинации является знакомство иммунитета с определенного рода недугом. Ведение вакцины означает, что в организм проникает маленькая доза возбудителя, которая нужна для дальнейшего разрушительного действия антител на антигены. Однако встречаются ситуации, когда начинается атака лимфоцитов на ткани собственного организма. Так начинает развиваться аутоиммунные заболевания. Они встречаются приблизительно у 10 процентов населения мировых стран. Медицинская практика показывает, что редкие аутоиммунные заболевания поражают мужчин реже, чем женщин. Существует десять основных причин, вследствие которых наступает летальный исход. К таким причинам относится аутоиммунные и иммуннодефицитные заболевания.
В организме каждого человека есть иммунитет, который начинает свое развитие с момента рождения. В его состав входят специальные органы и клетки, защищающие от негативного микробного и вирусного воздействия. Иммунная система основана на механизме, способном различать собственную ткань от чужеродной. Различное повреждение провоцирует дисфункцию иммунитета, вследствие чего он перестает различать собственные клетки от чужих. Такое явление активирует производство аутоантител, ошибочно нападающих на здоровые клетки. В результате исчезает регуляторная работа т-лимфоцитов, появляются тяжелые аутоиммунные заболевания, которые поражают внутренние органы и системы организма.
Следует рассмотреть перечень аутоиммунных заболеваний. К первому типу относится расстройство, появляющееся, когда нарушается гистогематический барьер. Второй тип болезней появляется после того, как трансформируется ткань организма от физического, химического, вирусного воздействия. Происходит глубокие метаморфозные процессы в здоровых клетках, как результат – восприятие их чужими. Существуют случаи, когда происходит антигенная или экзоантигенная концентрация. Организм отреагирует повреждением клетки, на оболочке которой сохранился антигенный комплекс. Иногда контакт с вирусом провоцирует образование антигена, обладающего гибридным свойством. Это способно поразить центральную нервную систему.
В третью группу входят заболевания аутоиммунной системы, при которых происходит коалисценция ткани с экзоантигеном. В результате активизируется естественная реакция, направленная на пораженные участки. Четвертая группа включает недуги, причиной которых является генетическое отклонение или влияние неблагоприятного внешнего фактора. Это влечет стремительную мутацию клеток иммунитета, которая проявляется красной волчанкой.
Развитие заболевания аутоиммунного характера способно развиваться в любом возрасте. Несмотря на это, есть группа людей, у которых предрасположенность к аутоиммунным заболеваниям выше. А именно:
Почему появляются
Медицинские исследования выделяют внутренние и внешние причины, почему возникают аутоиммунные заболевания. Одной из внутренних причин, когда происходит агрессия и бесконтрольное размножение лимфоцитов, является генная мутация первого типа. При этом исчезает распознавание лимфоцитами здоровых клеток. Человек получает по наследству от близкого родственника такое иммунное расстройство. Учитывая мутационный процесс в конкретном органе или системе, может развиться тиреоидит, зоб.
К другой внутренней причине относится генная мутация второго типа, при которой происходит бесконтрольное размножение лимфоцитов-санитаров. В результате появляются иммунные и аутоиммунные заболевания, которые, в основном, передаются по наследству. Среди внешних причин аутоиммунного заболевания выделяют тяжелую затяжную инфекционную болезнь, после которой происходит неадекватное поведение иммунных клеток, а также негативное воздействие факторов окружающей среды (радиация, ультрафиолетовые лучи). Возникновение сбоя иммунитет происходит из-за хитрости клетки-возбудителя недуга. Они способны притвориться схожими на собственные, но патогенные клетки. В результате лимфоциты теряют возможность распознавать чужеродные организмы, и начинают бороться с обоими.
Появляются системные аутоиммунные заболевания, когда нарушается целостность гематобарьера, которые отделяют определенный орган или ткань от крови. Нормой считается отсутствие проникновения в кровоток клеточных антигенов. Это значит, что т-лимфоциты не вырабатывают к ним толерантность. К забарьерным относят клетки мозга, щитовидки, и клетки, которые вырабатывают инсулин. При наличии такого механизма развивается хронический аутоиммунный простатит. Это значит, что спермопродуцирующие клетки отделяются от крови при помощи гематотестикулярного барьера. Инфицирование, воспаление, травма могут стать причинами нарушения его целостности, в результате начинается аутоагрессия, направленная на ткани простаты.
Какие виды аутоиммунных болезней существуют
Говоря о классификации расстройств, выделяют три группы аутоиммунных заболеваний. К первой группе относятся органоспецифические патологии, характеризующиеся направлением антител и лимфоцитов на аутоантиген одного или нескольких органов. Сюда относится забарьерный антиген, к которому нет врожденной толерантности. Вторая группа включает органонеспецифические болезни, когда происходит взаимодействие аутоантител и лимфоцитов с аутоантигенами ткани или органа. Патологический процесс развивается, когда уже существует толерантность. Третья группа состоит из вышеперечисленных механизмов.
Если человек столкнулся с иммунным расстройством, он заинтересуется, какой врач занимается аутоиммунными заболеваниями. При органоспецифической аутоиммунной болезни необходимо обратиться к профильному врачу. При смешанном или системном недуге требуется квалифицированная помощь многих врачей. Это невролог, гематолог, ревматолог, эндокринолог, кардиолог, пульмонолог, дерматолог, нефролог.
Что относится к аутоиммунным заболеваниям системного типа
Появление красной волчанки связано с нарушением аутоиммунного процесса, когда привлечены все внутренние органы. Недуг поражает два-три человека из тысячи. Возникает красная волчанка, когда в организме образовываются аномальные антитела из-за влияния генетического фактора. Подтверждением является наличие взаимосвязи патологии с нехваткой наследственных компонентов иммунитета. Кроме этого, спровоцировать появление иммунного расстройства может токсическое вещество, вирус, бесконтрольное употребление медикаментозных средств.
Системное расстройство на протяжении длительного времени протекает без симптомов, проявляется кожным высыпанием, нарушается опорно-двигательная система. Однако в это время в организме нарастает интенсивность иммунного дисбаланса, который может стать причиной воспалительного процесса любого внутреннего органа. Красная волчанка характеризуется поражением соединительной ткани, присутствующей в органах и системах. В результате обнаруживаются кожные высыпания на лице и груди, кожа становится чувствительной к воздействию ультрафиолета (покраснение, сыпь, пятна). Распознавательным признаком служит появление на теле дисковидного элемента, у которого красная окантовка, бледная середина.
При таком аутоиммунном заболевании симптомы следующие:
Если возникает вопрос, как выявить аутоиммунное заболевание, следует применить комплексное обследование, которое включает клинический, лабораторный, иммунологический, и гистологический метод. Врач назначит сдать кровь на общий анализ, пройти электрокардиографию, рентген, узи брюшной полости, почек. При своевременно начатом лечении аутоиммунного заболевания, у пациента возрастают шансы избежать патологического изменения внутреннего органа или системы. Терапевтические мероприятия состоят из приема противовоспалительных и подавляющих иммунитет препаратов, а также кортикостероидов.
Воспалительная миопатия
Сюда относится группа болезней, которые вызваны мышечным воспалением и слабостью. Наличие полимиозита и дерматомиозита зачастую диагностируется у женщин. Воспалительная миопатия вызывает медленно прогрессирующую слабость тех мышц, которые задают движение двух сторон тела. Дерматомиозит характеризуется кожной сыпью, сопровождающуюся слабостью в мышцах. Человек устает после длительной ходьбы или пребывания в стоячем положении. Отмечаются частые спотыкания, падение, затруднение при глотании пищи или воды, вдыхании или выдыхании воздуха.
Наличие миастении
Это аутоиммунное заболевание, как диагностировать и лечить, подскажут в клинике Москвы. Характеризуется атакой иммунитета нервов и мышц, которые присутствуют во всем теле. У человека с миастенией двоится в глазах, трудно сфокусировать взгляд и опускать веки. Появляется затрудненное глотание, частая отрыжка, удушье. Кроме этого выделяют:
Поражение псориазом
При таком недуге происходит избыточное и быстрое появление новых кожных клеток, накопление которых обнаруживается на кожном покрове. Заболевший человек замечает появление плотных красных пятен, которые покрыты чешуйкой. К области, где присутствуют такие пятна, относится голова, локти, колени. Также появляется зуд и болезненные ощущения, негативно сказывающиеся на работоспособности, ухудшающие сон.
Псориаз может сопровождаться формой артрита, при которой поражаются суставы и фаланги пальцев верхних и нижних конечностей. При затрагивании позвоночника появляется боль в области спины. Человек может обратиться за лечением аутоиммунного заболевания в Москве.
При синдроме Шегрена
Список аутоиммунных заболеваний у человека пополняется синдромом Шегрена, который характеризуется атакой слезных и слюнных желез. При таком синдроме у пациента выделяют такие признаки:
Наличие склеродермии
Расстройство иммунитета, при котором появляется аномальное развитие соединительных тканей в кожном покрове и сосудах. Признаки склеродермии следующие:
Выявление ревматоидного артрита
При перечислении, что относится к аутоиммунным заболеваниям, следует выделить ревматоидный артрит, при котором воспаляются суставы и окружающая их ткань. Появиться может в любом возрасте. Исследования по излечению аутоиммунного заболевания такого типа заключаются в сдаче анализа крови на наличие ревматоидного фактора, и магнитном резонансе пораженного сустава.
Наличие сахарного диабета
При определении, какие бывают аутоиммунные заболевания, следует отнести сахарный диабет первого типа, при котором нарушается обмен углеводов и воды. В результате нарушается функционирование поджелудочной, которой вырабатывается инсулин. Он помогает перерабатывать сахар. Недуг можно приобрести или получить по наследству. Нехватка инсулина провоцирует возникновение гнойничковых поражений кожного покрова. Начинают крошиться зубы, появляется чувство грудной жабы, скачет артериальное давление, нарушается функционирование почек, нервной системы, резкое ухудшение зрительной функции.
Симптоматика имеет постепенный характер. Начало сахарного диабета сопровождается следующими признаками:
Наличие одного из вышеперечисленных симптомов служит поводом для сдачи крови на определение глюкозного показателя. Если отсутствует лечение аутоиммунного заболевания, появляются другие признаки:
Человека, который столкнулся с сахарным диабетом, интересует, можно ли избавиться от аутоиммунного заболевания такого вида, к какому врачу обратиться, сколько будет длиться лечение. После проведенного обследования, врачом назначаются препарат, который стимулирует работу поджелудочной, чтобы вырабатывалось больше инсулина. А также медикаменты, способные повысить клеточную восприимчивость к инсулину, ингибиторы и агонисты. Для избавления от сахарного диабета следует соблюдать диетическое питание, в котором мало углеводов, не заниматься самолечением, посещать спортзал для повышения двигательной активности. Бывают случаи, когда необходимо вводить инсулин, чтобы нормализовать уровень глюкозы.
Выявление саркоидоза
Относится к редкому хроническому воспалительному заболеванию, которое поражает четыре человека из ста тысяч. Происходит поражение легких. Редко встречается у детей и лиц преклонного возраста. Саркоидоз характеризуется затрудненным дыханием при физической нагрузке, резким понижением массы тела, потере аппетита, чрезмерной утомляемостью. Может присоединиться апатия, слабость в мышцах, приступы кашля. Признаками саркоидоза являются отхаркивание с примесью крови, одышка, болезненные ощущения в груди. При запущенной форме снижается дыхательная функция из-за воспалительного процесса в легких. Может наблюдаться нарушение в глазном яблоке, суставах, кожном покрове. При отсутствии лечения аутоиммунных заболеваний иммуноглобулинами повышается риск полной потере зрения.
Появиться саркоидоз может из-за контакта с бериллием или цирконием, сильной реакции организма на грибковое воздействие, сосновую пыльцу, атипические микробактерии, а также при генетической предрасположенности. Для определения патологии делается рентген и кожное тестирование Квейма Силцбаха. При возникновении вопроса, как лечить аутоиммунное заболевание такого типа, необходимо посетить квалифицированного врача. Он определяет возбудителя болезни, сколько длиться недуг, и выписывает медикаментозные препараты, употребление которых поможет избежать поражения жизненно важных органов. Без своевременного не начать терапию, прогноз на аутоиммунное заболевание такого вида не утешительный. Человек может ослепнуть и получить дыхательную недостаточность.
Какая существует профилактика аутоиммунных заболеваний
Чтобы понизить риск возникновения иммунной патологии, следует полностью долечивать вирусную инфекцию, острые респираторные заболевания. В рацион человека должны входить продукты питания, в состав которых входят витамины и микроэлементы. А также свежие овощи, фрукты, цельное зерно, обезжиренные молочные продукты, постный источник белка. Исключить насыщенные жиры, холестерин, соль, рафинированный сахар. Количество приемов пищи составляет два-четыре раза.
Минимизировать стрессовые ситуации, нервное перенапряжение, так как нарушения в центральной нервной системе способствуют увеличению чувствительности иммунной системы к негативному воздействию внешнего и внутреннего фактора. Начать медитировать, читать книги, выбрать хобби. Также, человек должен полноценно отдыхать. Плохой сон провоцирует сбой в гормональной выработке. Заниматься умеренными физическими нагрузками, йогой. Повышать нагрузки необходимо только после консультации с врачом. Соблюдая профилактические правила, человек уменьшит вероятность появления иммунного расстройства.
Спецагенты по борьбе с аутоиммунным воспалением: место моноклональных антител в современной ревматологии
Моноклональные антитела — новая надежда в лечении ревматических заболеваний.
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Вам когда-нибудь снились кошмары о том, как организм разъедает себя изнутри? А что если это становится реальностью? Именно процессы аутофагии лежат в основе развития ревматических заболеваний. В борьбе с аутоиммунным воспалением медицина слишком часто проигрывала. пока не появились они. Моноклональные антитела.
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Биомедицина сегодня и завтра» конкурса «био/мол/текст»-2017.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».
Основы нормального иммунитета и аутоиммунного процесса в доступной форме изложены на «Биомолекуле» в статье «Иммунитет: борьба с чужими и. своими» [1].
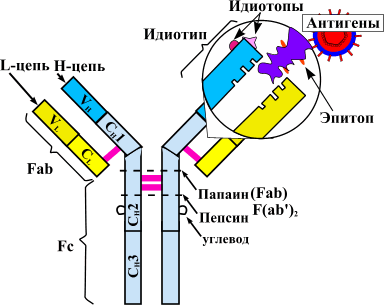
Рисунок 1. Схема строения антител. Антитела представляют собой белки-иммуноглобулины, имеющие две H-цепи (тяжелые) и две L-цепи (легкие). В каждой молекуле белка есть специфические Fab-фрагменты. Эти области отвечают за связывание с антигеном — «мишенью», на которую воздействует антитело. Структура Fab-фрагмента очень вариабельна, что позволяет ей подстраиваться под активные центры антигена — эпитопы. Между антителом и антигеном формируются химические связи (ионные, водородные, гидрофобные). Другой конец молекулы — Fc-фрагмент — отвечает за связывание образовавшихся иммунных комплексов с Fc-рецептором, расположенным на мембранах иммунных клеток (нейтрофилов, макрофагов, тучных клеток). Активация компонентов иммунитета запускает «реакцию уничтожения» по отношению к чужеродному антигену. Таким путем осуществляется антителозависимая цитотоксичность.
В 2017 году «Биомолекула» опубликовала спецпроект, посвященный аутоиммунным заболеваниям.
Несмотря на многолетний поиск новых путей фармакотерапии, современная медицина не может предложить способов лечения, непосредственно влияющих на причину возникновения аутоиммунитета. Врачи способны лишь замедлить прогрессирование патологии и снизить выраженность клиники — провести патогенетическое и симптоматическое лечение. Для этого разработана базисная терапия, которая применяется уже многие годы. Однако не всегда проверенные препараты работают так, как надо.
Почему необходимо искать новые способы лечения?
Для лечения аутоиммунных заболеваний используют широкий арсенал противоревматических лекарств. Классическая терапия включает нестероидные противовоспалительные средства, глюкокортикоиды, цитостатики. В зависимости от особенностей развития заболевания подбирают препараты из той или иной группы [4].
Лекарства, применяемые при ревматических болезнях
Разберемся, почему нужны новые лекарства. В качестве примера можно рассмотреть классическую терапию одного из самых распространенных аутоиммунных заболеваний — ревматоидного артрита [3]. Современные стратегии борьбы с этой патологией должны соответствовать концепции Treat to target — «лечение до достижения поставленной цели». Она направлена на ремиссию (исчезновение симптомов) заболевания или резкое снижение активности артрита [5], [6].
«Золотым стандартом» в терапии заболевания является метотрексат (рис. 2). Препарат входит в группу базисных противовоспалительных средств.
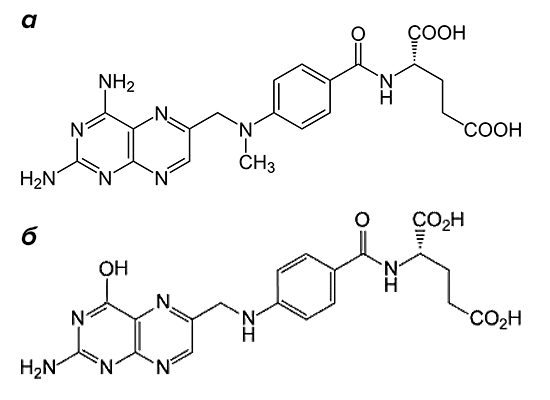
Рисунок 2. Структурные формулы метотрексата и фолиевой кислоты. Препарат (а) по строению похож на фолиевую кислоту (б). Он состоит из птеридиновых групп и парааминобензойной кислоты. Действующий компонент метотрексата отличается от структуры фолата отсутствием гидроксильной группы (–OH) и наличием дополнительного метильного радикала (–CH3).
По механизму действия метотрексат относится к антиметаболитам. Препараты этой группы тормозят физиологические реакции в организме, связываясь с ферментами и выключая их активность. Вещество, которое в норме участвует в реакции, уже не может попасть в биохимический круговорот из-за повышенной конкуренции с компонентами лекарства. Основной мишенью для действия метотрексата является фермент, расщепляющий фолиевую кислоту, — дигидрофолатредуктаза (ДГФ). Этот белок воздействует на поступающий в организм фолат, переводя его в активную форму. При этом образуется тетрагидрофолиевая кислота. Она участвуют в синтезе строительного материала для ДНК — пуриновых оснований и тимидилата.
Метотрексат вклинивается в цепочку реакций благодаря структурному сходству с молекулой фолиевой кислоты (рис. 2). Конкуренция за фермент приводит к тому, что содержание активного фолата в ткани значительно снижается. Нет строительного материала — нет и новых молекул ДНК, без которых клетки не могут размножаться. Повышенной чувствительностью к воздействию лекарства обладают те ткани, структурные элементы которых постоянно делятся. К ним относятся и компоненты костного мозга, из которых формируются будущие иммунные клетки.
Еще один важный момент в работе метотрексата связан с активностью его полиглутамированных метаболитов. Эти молекулы формируются после активации препарата непосредственно в клетках человеческого организма. Они ингибируют другие ферменты, которые взаимодействуют с фолиевой кислотой. В эту группу входят тимидилсинтетаза и АИКАР-трансамилаза. Активность производных метотрексата запускает процесс выработки аденозина. Он оказывает мощное противовоспалительное действие, благодаря чему снижается выраженность симптомов ревматоидного артрита [7].
Метотрексат удобно использовать — он легко дозируется и может назначаться длительными курсами. Кроме того, важное преимущество этого препарата — низкая цена, в сравнении с современными лекарствами импортных фармкомпаний [8]. Несмотря на все достоинства, лечение метотрексатом не всегда приводит к снижению активности заболевания. У многих пациентов использование препарата неэффективно даже в комбинации с другими классическими средствами [5]. Это подтверждается при анализе статистики. Исследования показали, что при проведении лечения метотрексатом и комбинациями базисных препаратов только половина пациентов достигла ремиссии [9], [10].
Несостоятельность классической терапии заставляет ученых искать новые способы лечения ревматоидного артрита. Стоит отметить, что, несмотря на новые разработки, борьбу с заболеванием все же начинают с назначения метотрексата и его аналогов. Дополнительные препараты используют только при высокой активности аутоиммунного процесса. У таких пациентов применение одного лекарства часто бывает неэффективно [7]. В зависимости от особенностей течения патологии подбирают подходящую схему терапии (рис. 3).
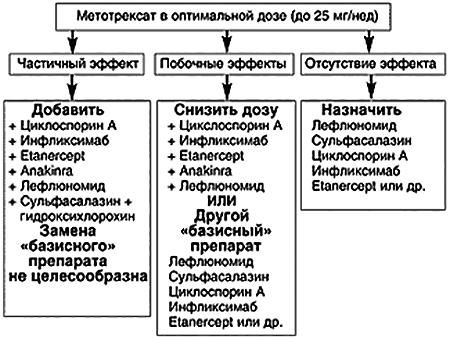
Рисунок 3. Тактика ведения пациента с ревматоидным артритом при неэффективности использования метотрексата.
Неэффективность препаратов базисной терапии встречается не только при ревматоидном артрите, но и при других заболеваниях аутоиммунного происхождения (системной красной волчанке, склеродермии, болезни Бехтерева). Это мотивирует специалистов-ревматологов разрабатывать другие лекарства и подбирать новые схемы терапии.
Генно-инженерные препараты: дополнение к базисной терапии
По-новому взглянуть на лечение аутоиммунных заболеваний позволила разработка терапевтических моноклональных антител [11]. Принципиально новый класс препаратов получен благодаря достижениям генной инженерии. Для понимания механизма действия этих лекарств стоит вспомнить о том, как работают иммунные клетки в норме и при патологии [1], [12].
Иммунная система — это сложный механизм, состоящий из множества «винтиков» — иммунных клеток. Каждая из них имеет свои функции и занимает определенное место в общей структуре защитной системы. В ответ на поступление «вражеского» агента (антигена) включаются компоненты врожденного иммунитета — неспецифические факторы защиты. Это нейтрофилы, эозинофилы и базофилы, которые первыми стоят на пути у вредного воздействия.
Винтики крутятся — активируются новые компоненты иммунной системы. В борьбу с патогеном вступают Т- и В-лимфоциты. Они включают более тонкие механизмы защиты — специфическую цитотоксичность. Вырабатываются антитела, ищут себе «жертву» Т-киллеры. Тонкая регуляция процесса с помощью цитокинов позволяет быстро достигнуть поставленной цели. Согласованное действие всех компонентов иммунитета приводит к выполнению программы — уничтожению патологического агента.
Во время подбора подходящих «деталей» для механизма — при селекции лимфоцитов — неизбежно возникают ошибки. Иммунная система производит аутореактивные клоны — клетки, которые специфичны к антигенам тканей организма. В норме они отсеиваются в «мастерских» — тимусе и лимфатических узлах. Те клоны лимфоцитов, которые не различают собственные и чужеродные антигены, сразу же уничтожаются еще до того, как они приступят к выполнению своей функции. Но что происходит, если «винтики» выпадают из машины иммунитета? Поломка возникает в специфической части механизма — в работе Т- и В-лимфоцитов. При нарушении процесса селекции аутореактивные клетки выходят в кровь. Они ищут своих «жертв» и находят их в нормальных элементах собственных тканей.
В зависимости от типа реакции отличается патофизиологический процесс, лежащий в основе аутоиммунной агрессии. Т-лимфоциты могут самостоятельно убивать клетки тела, а могут и работать «чужими руками» — активировать выработку аутоантител В-лимфоцитами. При поражении В-клеточного иммунитета аутофагия реализуется через систему комплемента, а также путем формирования цитотоксических иммунных комплексов [13], [14]. Подробнее о механизмах нормального и измененного иммунного ответа можно почитать на «Биомолекуле» [1], а также в статьях [15], [16].
При аутоиммунных заболеваниях можно подавлять сразу весь сложный механизм иммунитета, что и делают препараты классической терапии. Но это оставляет человека без защиты от вражеских агентов — бактериальных инфекций, вирусов и прочих патогенов. Поэтому предпочтительнее сохранить активность иммунной системы в целом, избавив человека от аутоагрессии определенных ее компонентов. Именно так работают новые препараты — моноклональные антитела.
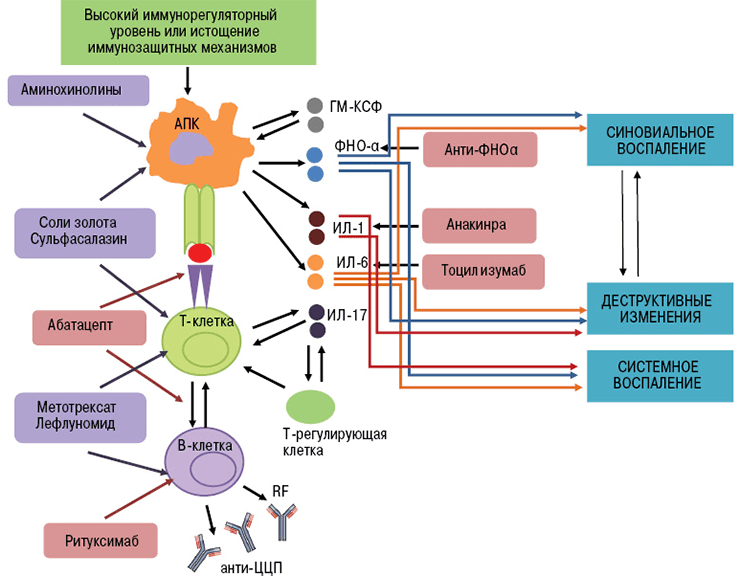
Биологические агенты воздействуют на отдельные «винтики» механизма иммунной защиты. Их мишенями могут быть цитокины и их рецепторы, мембранные молекулы лимфоцитов. В зависимости от точки приложения препарата моноклональные антитела делятся на группы (рис. 4):
Рисунок 4. Патофизиологические «жертвы» моноклональных антител — интерлейкины, ФНО, поверхностные белки лимфоцитов.
Ингибиторы ФНО
Ингибиторы фактора некроза опухолей — это первые моноклональные антитела, внедренные в ревматологическую практику. В эту группу входят инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
Фактор некроза опухолей (ФНО) — это провоспалительный цитокин (вещество, которое стимулирует развитие воспалительной реакции). В норме при его выделении происходит пролиферация клеток сосудов, активация макрофагов, лизис опухолевых агентов. Эти эффекты играют важную роль в защите организма от патогенов. Воспаление можно считать ответной реакцией на воздействие повреждающих факторов.
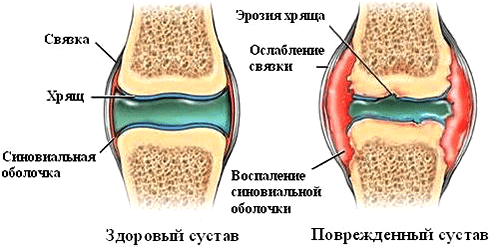
Однако влияние ФНО на суставы при ревматических заболеваниях нельзя назвать положительным. Так, при ревматоидном артрите цитокин стимулирует размножение синовиальных фибробластов — клеток оболочки сустава. Это приводит к формированию паннусов — разрастаний агрессивной ткани. С течением заболевания процесс воспаления и деструкции распространяется на суставный хрящ и подлежащие кости (рис. 5). Ткани сустава заполняются иммунными клетками — макрофагами, Т- и В-лимфоцитами, нейтрофилами. Эти механизмы лежат в основе развития хронического воспаления. Освежить знания о патогенезе ревматоидного артрита можно в статье «Ревматоидный артрит: изменить состав суставов» [3].
Рисунок 5. Патологические изменения в суставе при ревматоидном артрите. Аутоиммунный процесс вызывает появление эрозий, синовит (воспаление синовиальной оболочки), разрушение суставного хряща.
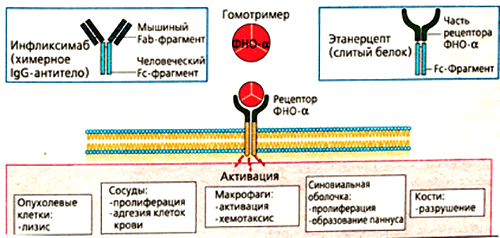
Одним из ингибиторов ФНО является препарат инфликсимаб. Он имеет «человеческую» и «мышиную» области. Примерно 25% всех аминокислот в составе моноклонального антитела получены из организма мышей. Это Fab-фрагмент — специфический участок, отвечающий за связывание с ФНО. Fc-фрагмент белка образуется из IgG1 — антитела человека.
Такое строение связано с механизмом получения препарата. Первоначально синтезируют антитело к фактору некроза опухолей в организме мыши. Полученный иммуноглобулин специфичен к ФНО и уже может его обезвреживать, но полностью чужеродные белки вводить в организм пациентов, конечно, нельзя. Это вызовет активную иммунную реакцию — выработку антител уже против терапевтических агентов. Поэтому домены мышиного иммуноглобулина заменяют сходными участками человеческих белков. Антитела, имеющие фрагменты разного происхождения, называются химерными. Фактически, они берут лучшие качества своих предшественников. Мышиная часть обеспечивает высокую чувствительность к ФНО, а человеческие фрагменты снижают иммуногенность — вероятность развития иммунного ответа.
Механизм действия инфликсимаба понятен из его строения. Fab-фрагмент молекулы связывает фактор некроза опухолей, образуя с ним устойчивый комплекс. Такое взаимодействие полностью блокирует активность цитокина, препятствуя его соединению с мембранными рецепторами p55 и p57. Инфликсимаб «обезвреживает» как растворимую, так и мембраноассоциированную формы ФНО (рис. 6). В клетках суставов снижается содержание и других провоспалительных факторов — ИЛ-1, ИЛ-6, монооксида азота.
Рисунок 6. Основные эффекты ФНО и блокирующие его моноклональные антитела (инфликсимаб и этанерцепт). Мишенями для моноклональных антител являются свободная и мембраноассоциированная формы фактора некроза опухолей. Лекарства препятствуют связыванию цитокина с рецептором, благодаря чему снижается активность ревматоидного артрита.
Немного другую структуру имеет еще один эффективный препарат из группы ингибиторов ФНО — этанерцепт. В его состав входит внеклеточная часть рецептора к фактору некроза опухолей. Она «подсоединяется» к человеческому IgG1. Гибридная молекула вступает в жесткую конкуренцию за свободный ФНО и обезвреживает его до того, как цитокин успевает связаться с рецепторами и запустить воспалительную реакцию. Дополнительное действие этанерцепта, которого нет у других ингибиторов ФНО, — это нейтрализация лимфотоксина. Это вещество тоже относится к провоспалительным цитокинам. Выработка лимфотоксина стимулирует пролиферативные процессы в суставах. Соответственно, блокировка его действия снижает активность воспаления при ревматологических заболеваниях [18].
Ингибиторы ФНО хорошо показали себя не только при лечении ревматоидного артрита, но и при других аутоиммунных патологиях. Например, у пациентов с болезнью Бехтерева широко используют новые препараты. Замедление прогрессирования патологии в этом случае очень важно, так как аутоагрессия направлена на суставные и костные образования позвоночника. С течением времени болезнь превращает позвоночный столб в «бамбуковую палку» — монолитное негнущееся образование. Анкилоз развивается постепенно, но неотвратимо. С каждым годом двигательные возможности больных становятся все более ограниченными. Применение биологических препаратов позволяет снизить активность воспаления в позвоночнике. Это замедляет процесс формирования анкилоза [19].
Блокаторы интерлейкиновых рецепторов
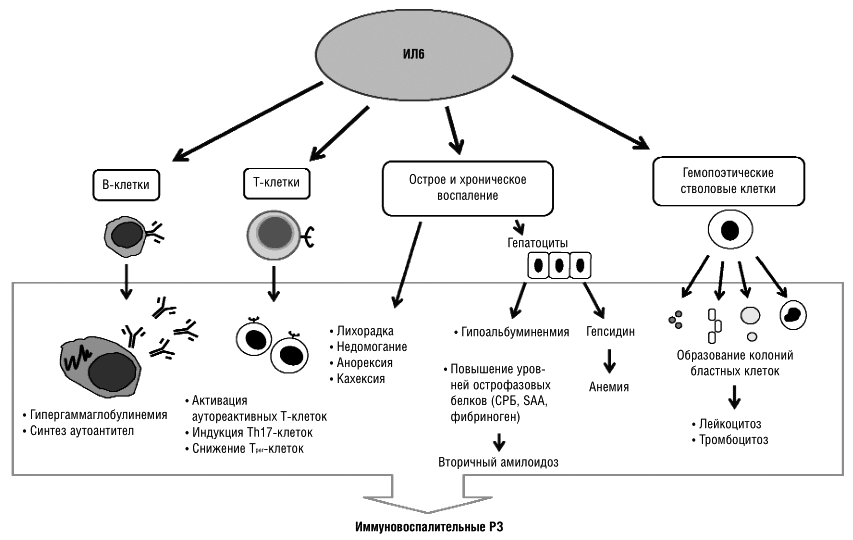
В развитии аутоиммунного воспаления важную роль играют интерлейкины, которые, как и ФНО, относятся к провоспалительным цитокинам (рис. 7). Основными представителями этой группы являются ИЛ-6, ИЛ-1, ИЛ-17. Функция интерлейкинов — это контроль процессов дифференцировки, пролиферации и гибели (апоптоза) иммунных клеток, который осуществляется через соответствующие гены-мишени [20].
Рисунок 7. Механизм действия интерлейкинов при аутоиммунном воспалении (на примере ИЛ-6). Цитокин влияет на T- и B-лимфоциты, гемопоэтические клетки, гепатоциты. Он стимулирует выработку аутоантител В-клетками, а также формирование аутореактивных Т-клонов, которые непосредственно участвуют в аутоиммунном процессе. Влияние на костный мозг заключается в стимуляции выработки новых клеток крови — повышается число лейкоцитов и тромбоцитов. Воспаление сопровождается ответной реакцией клеток печени, появлением характерных симптомов аутоиммунного заболевания.
Влияние интерлейкинов — один из «спусковых крючков» воспалительного процесса. Поэтому блокировка их активности улучшает состояние пациентов с аутоиммунными заболеваниями. Приостановить работу интерлейкинов можно, если связать их рецепторы — молекулы, передающие сигнал иммунным клеткам. На этом основан механизм действия моноклональных антител из группы ингибиторов интерлейкиновых рецепторов.
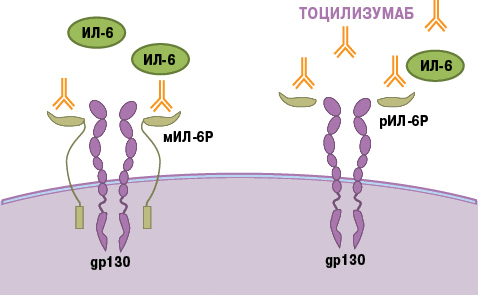
Тоцилизумаб — это препарат, который блокирует работу ИЛ-6. Рецептор этого вещества состоит из двух компонентов — мембранного ИЛ-6R (α-цепь) и гликопротеина g130 (β-цепь). Мембранная часть рецептора связывается с ИЛ-6, образуя устойчивый комплекс. Вместе они активируют компонент g130, вызывая изменение его структуры (гомодимеризацию). Образуется рецепторный комплекс из двух молекул g130, который в свою очередь активирует JAK1-киназу. Этот фермент запускает каскад реакций в клетке, который приводит к появлению биологического эффекта цитокина — развитию воспаления. В некоторых случаях ИЛ-6 связывает не мембранная, а растворимая форма α-цепи (рис. 8). Механизм действия рецептора при этом не меняется [21].
В основе работы тоцилизумаба лежит конкуретное ингибирование. Сигнальные молекулы активно связываются с моноклональным антителом. Вакантное место занято — интерлейкин не может образовать комплекс с рецептором, а значит, он не способен активировать процесс воспаления.
Рисунок 8. Механизм действия тоцилизумаба. Препарат связывает растворимые и мембранные рецепторы ИЛ-6, блокируя передачу сигналов.
Тоцилизумаб считается одним из самых безопасных препаратов, входящих в группу моноклональных антител. Это позволяет применять его при ювенильном идиопатическом артрите, который возникает в возрасте до 16 лет. Дети особенно остро реагируют на токсические воздействия, поэтому препараты, которые используют при их лечении, должны иметь минимальное число побочных реакций. Применение тоцилизумаба позволяет достигнуть необходимого эффекта лечения, не вызвав тяжелых осложнений.
Анти-B-клеточная терапия
Одними из главных элементов, участвующих в аутоиммунном воспалении, являются В-лимфоциты. Именно они вырабатывают аутоантитела, которые связываются со здоровыми клетками организма. Образовавшийся комплекс антитела и аутоантигена атакует система комплемента или цитотоксические лимфоциты. Этот процесс лежит в основе воспалительной реакции при таком ревматическом заболевании, как системная красная волчанка. Ей на «Биомолекуле» посвящена отдельная статья: «Системная красная волчанка: болезнь с тысячью лиц» [2].
Препараты из группы анти-B-клеточной терапии (ритуксимаб и белимумаб) блокируют активность В-лимфоцитов путем связывания их мембранных молекул CD20. Эти вещества есть только у определенных категорий В-клеток. Они специфичны для пре-В-лимфоцитов и зрелых В-лимфоцитов. CD20 нет у стволовых элементов и про-В-клеток, из которых будут образовываться новые лимфоцитарные элементы. Мембранные молекулы данного типа не содержатся и у плазматических клеток, которые вырабатывают иммуноглобулины [22].
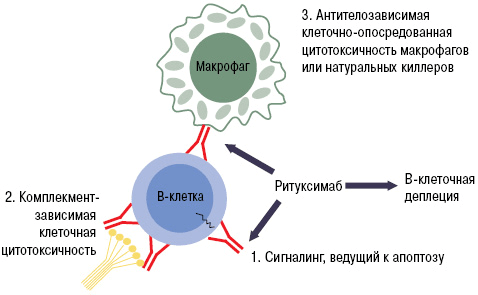
Благодаря этой особенности белок CD20 является идеальной «жертвой» для биологических препаратов. При «выключении» его активности не нарушается ни образование новых лимфоцитов, ни выработка нормальных антител. Одним из лекарств с таким механизмом действия является ритуксимаб. Моноклональное антитело связывается с молекулой CD20. Это приводит к запуску иммунологических реакций по отношению к B-лимфоцитам, которые обеспечивают разрушение (лизис) этих клеток (рис. 9).
Рисунок 9. Механизм работы ритуксимаба. Fab-фрагмент моноклонального антитела связывается с CD20 на поверхности B-лимфоцита. Это запускает лизис клетки, который может осуществляться несколькими путями: через систему комплемента, программу апоптоза или агрессию натуральных киллеров и макрофагов.
Анти-Т-клеточная терапия
Блокировка действия Т-лимфоцитов возможна благодаря особенностям их активации. Чтобы Т-лимфоцит вступил в аутоиммунный процесс и связался с антигеном, он должен получить два сигнала от антигенпрезентирующих клеток (АПК). Первый сигнал обеспечивает распознавание специфического аутоантигена Т-клеточными рецепторами. Второй сигнал — это неспецифический процесс связывания мембранных молекул CD80 и CD86 на поверхности АПК с рецептором CD28 лимфоцита. Сочетание этих взаимодействий вызывает активацию Т-клеток, которые в свою очередь стимулируют выработку провоспалительных цитокинов. Это и есть основной вклад Т-лимфоцитов в аутоиммунный процесс.
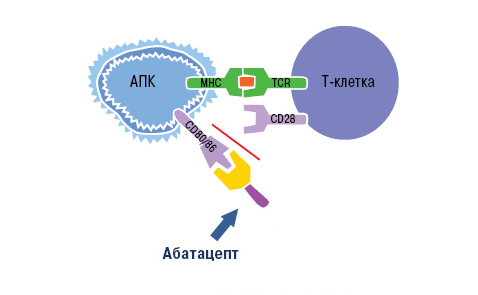
Знания о механизме активации Т-клеток использовали при разработке моноклональных антител. Основной представитель анти-Т-клеточных агентов — это абатацепт. Препарат представляет собой белок, состоящий из двух частей. Специфическая часть образована молекулой CTLA-4 (антиген 4 цитотоксических лимфоцитов). Неспецифическая область — это Fc-фрагмент человеческого иммуноглобулина G1 [23].
Воздействие абатацепта направлено как раз на неспецифический (костимулирующий) сигнал. Компонент CTLA-4 связывает белки CD80 и CD86 на поверхности антигенпрезентирующих клеток. Рецептор лимфоцита CD28 уже не может взаимодействовать с ними, из-за чего активация Т-клетки не завершается (рис. 10).
Рисунок 10. Механизм действия абатацепта. Абатацепт модулирует иммунный ответ через связывание с CD80/CD86 на антигенпрезентирующих клетках. Это препятствует связыванию CD80/CD86 с CD28 T-клеток, то есть активация Т-клеток отменяется через блокировку костимуляции.
Не всё так просто: возможные проблемы при использовании моноклональных антител
Препараты моноклональных антител уже довольно долго используют в ревматологической практике. Однако назначают их далеко не всем — не каждому первому и даже не каждому второму пациенту. Главным ограничением, с которым сталкиваются врачи и больные, является действительно «заоблачная» стоимость препаратов этой группы. Ревматические заболевания нельзя вылечить за неделю или месяц — они требуют многолетнего (или даже пожизненного) использования терапии. Поэтому при подборе лекарственного средства важна не только его эффективность, но и цена.
Например, одна пачка метотрексата стоит примерно 200 рублей. Цена упаковки инфликсимаба — около 43 тыс. рублей. Разница очевидна. За год лечения метотрексатом даже в максимальной дозировке пациент потратит на лекарство 1–2 тыс. рублей (в зависимости от фирмы-производителя, схемы лечения и стоимости препарата в местных аптеках). Цена годовой терапии инфликсимабом составляет примерно 700 тыс. рублей. Понятно, что самостоятельно обеспечить себя этим лекарством сможет только очень ограниченная группа пациентов.
Поэтому лечение ревматических заболеваний проводят по строгим алгоритмам. При выявлении патологии пациенту назначают базисный препарат. К примеру, при ревматоидном артрите основным лекарством, вероятнее всего, станет метотрексат. Добавлять моноклональные антитела к стандартной схеме лечения врачи будут только в исключительных случаях. В России их считают препаратами резерва — дополнительными средствами, которые стоит «оставить на потом», даже несмотря на высокую эффективность. Так, если выраженность симптомов не снижается долгое время (как минимум 6 месяцев!), к метотрексату могут добавить биологический препарат. Базисная терапия при этом не отменяется.
Если заболевание изначально имеет высокую активность, быстро прогрессирует и сопровождается внесуставными осложнениями, то больному сразу могут назначить комбинированное лечение базисными средствами и моноклональными антителами. Это связано с тем, что лучше всего биологические препараты работают именно в «остром периоде», когда выраженность симптомов максимальная. Кроме того, эффект от их использования наблюдается быстрее. Лечение инфликсимабом дает результаты уже через 2–4 недели, тогда как метотрексат «включается в работу» только через несколько месяцев.
Использование биологических препаратов допустимо в тех случаях, когда к базисным средствам у пациента развивается непереносимость. Больные испытывают тяжелое побочное воздействие лекарства, которое еще сильнее ухудшает их состояние. Применение препаратов с другим механизмом действия, в том числе и моноклональных антител, позволяет минимизировать побочные эффекты [18].
Назначение и реализация биологических препаратов контролируется государством. Многие средства из группы моноклональных антител (инфликсимаб, этанерцепт, тоцилизумаб, голимумаб) входят в «Перечень жизненно необходимых и важнейших лекарственных средств». В соответствии с ним формируется список лекарств, которые поступают в стационары по всей России. Конечно, биологические препараты сегодня есть далеко не в каждой больнице. Обычно их используют в региональных центрах или специализированных стационарах.
При неспособности обеспечить себя лекарствами пациенты получают инвалидность и проходят терапию за счет государства. Это право закреплено в действующей «Программе государственных гарантий оказания бесплатной медицинской помощи». Лечение биологическими препаратами предоставляется при ревматоидном артрите, болезни Бехтерева, СКВ, дерматополимиозите, ювенильном артрите и других заболеваниях. При этом врачи должны определить четкие показания к назначению того или иного средства. Получить дорогостоящее лечение довольно сложно — нужно пройти полное обследование, собрать документы. Однако предоставление государственной квоты для многих пациентов является последним шансом на полноценную жизнь.
Другая сложность, с которой можно столкнуться при использовании биологических препаратов, — это побочные реакции. Параллельно с накоплением данных об эффективности использования лекарств выявляют все новые нежелательные эффекты от их применения. Большая часть таких реакций связана с процессом иммуносупрессии. Подавляя активность иммунных клеток, моноклональные антитела снижают защитную функцию организма. В первую очередь страдают противоинфекционный и противоопухолевый иммунитеты [18], [24].
Парадоксально, но применение новых лекарств против аутоиммунитета может вызвать острые аутоиммунные реакции. Все биологические препараты представляют собой белковые молекулы, которые в той или иной степени чужеродны для организма. Поэтому при проникновении терапевтических агентов в тело больного иммунитет может распознать их как антигены. Появляется активный иммунный ответ — вырабатываются антитела уже против компонентов препарата.
Аутоиммунные синдромы, спровоцированные введением лекарства, обычно представлены васкулитами, СКВ, антифосфолипидным синдромом, псориазом [25]. Высокой иммуногенностью обладает инфликсимаб, в составе которого есть чужеродные мышиные фрагменты. Менее активно провоцируют иммунитет полностью «человеческие» препараты. Но даже при их применении есть высокий риск развития побочных аутоиммунных реакций. Чтобы устранить эти нарушения, необходимо скорректировать схему лечения больного. В нее включают дополнительные иммуносупрессоры, которые будут подавлять осложнения. Возможно, поэтому комбинации биологических препаратов с базисными лекарствами часто более эффективны, чем изолированная терапия, пусть даже и самыми новыми средствами [24].
Несмотря на все возможные сложности, моноклональные антитела прочно вошли в регистр лекарств, применяющихся в ревматологии. Перспектива использования биологических препаратов и их место в ревматологии будет зависеть от результатов многолетних исследований, которые еще предстоит провести. Но даже сейчас можно сказать, что разработка терапевтических моноклональных антител является важным шагом на пути к победе над аутоиммунным воспалением.
Аутоиммунные заболевания и препараты для их лечения
называется широкая группа заболеваний, которые объединяет то, что иммунная система организма начинает атаковать его собственные клетки и ткани. Поскольку иммунная система крайне сложна, то и сломаться в ней может любая её часть. Атаке может подвергнуться любая ткань организма, в настоящий момент насчитывается более восьмидесяти аутоиммунных заболеваний, ими страдают 5% населения. Мы поговорим об их классификации, подходах к лечению и перспективах.
Почему возникают аутоиммунные заболевания?
В норме иммунная система должна защищать организм от инфекций и других заболеваний. Для этого ей нужно уметь отличать вредоносные агенты (бактерии, паразиты, раковые клетки, заражённые вирусом клетки и т. п.) от безопасных — здоровых клеток своего организма, пыльцы, пищи, бактерий, которые живут в кишечнике и др. Однако нередки случаи, когда из-за какого-то дефекта иммунная система не может отличить своё от чужого. Точная причина таких сбоев до сих пор неизвестна. Но сейчас учёные уже в общих чертах разобрались, как иммунная система в здоровом организме обучается отличать антигены (молекулы, способные вызвать иммунный ответ) своего организма от чужих и что именно происходит при нарушении этих процессов.
Первые клетки иммунной системы, которые сталкиваются с «аномальными» агентами — это клетки врождённого иммунитета (дендритные и другие), которые постоянно находятся во всех тканях и поглощают любые подозрительные объекты. Затем эти клетки мигрируют в лимфоузлы и представляют фрагменты поглощённых белков на своей поверхности T-лимфоцитам — клеткам адаптивного (или приобретённого) иммунитета.
Врождённая иммунная система не способна к обучению и запоминанию, в отличие от адаптивного иммунитета, способного к обучению и формированию иммунологической памяти. Главные действующие лица адаптивного иммунитета — B- и T-лимфоциты. В здоровом организме существует довольно много таких клеток, они формируются в основном в эмбриональном периоде и способны связываться с широким спектром молекул. До встречи с конкретными возбудителями сила связывания недостаточно высока для возбуждения иммунного ответа, такие лимфоциты называются наивными.

Когда дендритная клетка встречается в лимфоузле с наивными T-лимфоцитами, те из них, которые проявляют сродство к чужеродному агенту, активируются, в них начинается процесс мутации генов, кодирующих рецептор для узнавания этих чужеродных агентов, и происходит отбор популяций T-лимфоцитов со всё большим сродством к ним (Рис. 1). Далее высокоспецифичные T-лимфоциты размножаются, помогают образованию антител против возбудителя и обе ветви иммунитета — врождённый и приобретённый — эффективно уничтожают возбудитель. Этот процесс занимает несколько дней, именно поэтому, например, грипп проходит не сразу, а только после стадии повышения температуры и воспаления. Воспаление играет важную роль в этом процессе: оно развивается под действием цитокинов (сигнальных белков), выделяемых всеми иммунными клетками, и характеризуется покраснением, болью, отёком воспалённого органа и температурой. «Нормальное» воспаление всегда должно завершаться, поэтому на его поздней стадии иммунные клетки вырабатывают противовоспалительные цитокины. Затем часть лимфоцитов преобразуются в клетки памяти, и таким образом организм приобретает иммунитет к данному возбудителю.
Почему же лимфоциты здорового человека не реагируют на собственные молекулы? Это обеспечивается механизмами центральной и периферической толерантности.
В эмбриональном периоде, когда образуются наивные лимфоциты, их специфичность (то есть то, против каких молекул они направлены) определяется путём случайных мутаций. Те лимфоциты, которые срабатывают против своих молекул, либо уничтожаются, либо становятся регуляторными клетками, призванными оберегать свои ткани от атаки иммунной системы. Это механизм центральной толерантности.
Существует также периферическая толерантность, которая контролирует те аутореактивные (специфичные против «своего») лимфоциты, которым удалось проскочить через сито центральной толерантности. Так, практически во всех органах имеются регуляторные T-клетки.
Толерантность в норме вырабатывается не только по отношению к антигенам собственного организма, но и по отношению к тем внешним агентам, на которые не должна возникать иммунная реакция: микрофлору, пищу, вдыхаемые частицы, плод в утробе матери. Особенно сложная задача у клеток иммунитета возникает в слизистых оболочках, там, где организм контактирует с внешней средой и где необходимо отличать патогенные микроорганизмы от неопасных и полезных симбиотических. В этих местах, особенно в кишечнике, выстроена многослойная система, определяющая, насколько велика опасность, исходящая от чужеродного агента.
Так почему же, несмотря на многочисленные системы защиты собственных белков от иммунной системы, лимфоциты иногда всё же выходят из-под контроля и начинают атаковать своё? Простого ответа на этот вопрос не существует. Аутоиммунные заболевания возникают, как правило, в результате сочетания генетических факторов и воздействия внешней среды. Наиболее понятная, но не единственная причина — инфекции. В некоторых случаях белки патогенов имеют сходство с какими-то белками организма, и когда иммунная система реагирует на инфекционный агент, реакция «перебрасывается» и на свои белки. К тому же, во время инфекций может произойти активация аутореактивных клеток, которые не были уничтожены в ходе развития толерантности, а находились в неактивном состоянии. Травмы, курение, некоторые химические вещества или облучение ультрафиолетом 1 также могут спровоцировать аутоиммунное заболевание, так как антигены, которые были раньше недоступны для иммунной системы, вследствие стрессового воздействия могут стать ей доступны. Женщины по не вполне понятным причинам страдают от аутоиммунных заболеваний более чем в два раза чаще мужчин.
Есть гипотеза, связывающая рост числа аутоиммунных заболеваний в XX веке с распространением гигиены и снижением количества паразитов в организме человека (так называемая гигиеническая гипотеза). Иммунная система в первый год жизни испытывает меньше контактов с чужеродными антигенами, что снижает её способность вырабатывать к ним толерантность. Более подробно эта гипотеза освещена в статье по ссылке.
Сейчас также много внимания уделяется роли микробиома в аутоиммунных заболеваниях. Если при таких расстройствах, как воспалительные заболевания кишечника, она очевидна, то механизмы влияния населяющих кишечник бактерий на мозг и другие отдалённые органы пока только начинают изучаться. Во всяком случае, до каких-то практических результатов здесь пока очень далеко.
Генетические факторы возникновения аутоиммунных заболеваний пока изучены недостаточно, можно говорить лишь о некоторых корреляциях. Как правило, аутоиммунные заболевания ассоциированы с мутациями не одного гена, а сразу многих. Чаще всего — это гены главного комплекса гистосовместимости (МНС), которые кодируют белки, отвечающие за взаимодействие антигенов с компонентами иммунной системы.
Таким образом, видно, что баланс между активацией иммунного ответа и толерантностью, — это тонкий динамический процесс, который регулируется множеством механизмов, и неудивительно, что они порой ломаются.
Классификация аутоиммунных заболеваний (АЗ)
Клинические проявления аутоиммунных заболеваний очень разные, и только в прошлом веке учёные и врачи пришли к выводу, что их объединяет что-то общее. С середины XX века, по мере развития инструментальных методов клеточной и молекулярной биологии, за различными проявлениями непохожих друг на друга заболеваний стали проступать общие черты — реакция иммунной системы на свои антигены и следующий за этим хронический воспалительный процесс.
АЗ можно разделить на орган-специфичные, те, которые поражают какой-то один орган или одну систему, и на системные, поражающие организм в целом. В таблице ниже приводятся некоторые аутоиммунные заболевания вместе с предполагаемыми антигенами и клиническими проявлениями.
| Заболевание | Основной орган | Аутоантигены | Клинические проявления |
|---|---|---|---|
| Орган-специфичные аутоиммунные заболевания | |||
| Рассеянный склероз | Центральная нервная система | Основный белок миелина, олигодендроцитарный белок миелина | Потеря зрения, слабость конечностей, нарушения слуха, недержание мочи |
| Болезнь Крона | Кишечник | Микробные антигены | Кровавый понос, брюшная боль |
| Язвенный колит | Толстый кишечник | Микробные антигены | Кровавый понос, брюшная боль |
| Диабет I типа | Поджелудочная железа | Белки островковых клеток, инсулин, декарбоксилаза глутаминовой кислоты | Патологическая жажда, голод, чрезмерное выделение мочи, потеря веса |
| Псориаз | Кожа | Кератин | Покраснение, шелушение кожи, зуд | Системные аутоиммунные заболевания |
| Синдром Шегрена | Слюнные и слёзные железы | Ядерные антигены (SSA, SSB) | Высыхание роговицы, полости рта, поражение лёгких и почек |
| Ревматоидный артрит | Суставы, лёгкие, иногда нервы | Определённые пептиды в суставах | Деформирующий артрит, кожные узелки, иногда — поражение лёгких и нервов |
| Системная красная волчанка | Почки, кожа, суставы, центральная нервная система | ДНК, гистоны, рибонуклеопротеины | Артрит, кожный зуд, почечная недостаточность, поражение нервов |
| Целиакия | Тонкий кишечник | Глютен 2 | Диарея, диспепсия, дистрофия |
Нередко бывает, что у человека развивается более одного аутоиммунного заболевания, так, у 33% пациентов с псориазом развивается псориатический артрит.
Ранее считалось, что астма и аллергические заболевания не относятся к аутоиммунным, так как в патогенезе астмы и аллергии главная роль принадлежит тучным клеткам и специальному виду антител — IgE (иммуноглобулин Е). Однако сейчас появилось много данных в пользу того, что аутоиммунные механизмы играют существенную роль в развитии этих болезней, в частности, у многих больных обнаруживают антитела против собственных белков и снижение количества регуляторных T-клеток, характерное для аутоиммунных заболеваний [1].
Тем не менее, далее мы не будем рассматривать астму и аллергии, хотя ряд подходов к лечению аутоиммунных заболеваний применим и к астме.
История подходов к лечению
Несмотря на то, что в основе всех аутоиммунных заболеваний лежат одни и те же процессы нарушения толерантности, человечество пока не научилось лечить все их единообразным способом. Поскольку поражаются разные органы, для каждого заболевания существуют свои подходы, хотя есть и пересечения. В большинстве случаев речь идёт не об излечении от заболевания, а о борьбе с симптомами или, в лучшем случае, замедлении ухудшения. Правда, у многих пациентов наступает стойкая длительная ремиссия, но заранее нельзя предсказать, поможет ли стандартная терапия данному пациенту или состояние будет со временем ухудшаться.
Неясно, почему препараты, которые очень хорошо работают при одних заболеваниях, не помогают при других, хотя, казалось бы, механизм действия должен обеспечивать эффективность. Для доказательства эффективности и безопасности всех новых лекарств требуются тщательно спланированные, длинные исследования на большом количестве пациентов, которые чаще всего заканчиваются неудачей.
Однако некоторые препараты всё же доказали свою эффективность: расскажем подробнее о некоторых из них. Мы не преследуем цель дать полный обзор нынешнего состояния или дать какие-то рекомендации пациентам, а хотим продемонстрировать то, как успехи фундаментальных наук привели к появлению лекарств, помогающих зачастую очень тяжёлым пациентам.
В XX веке, одновременно с изучением причин аутоиммунных болезней, начали применять подходы, основанные на снятии воспаления и иммуносупрессии. Они и сейчас представляют собой первые линии терапии 3 таких болезней, как ревматоидный артрит, болезнь Крона, язвенный колит, псориаз и другие.
Как правило, руководства по лечению аутоиммунных заболеваний предписывают начинать лечение с более лёгких препаратов — например, местных в случае псориаза, пероральных нестероидных противовоспалительных в случае других заболеваний. Если болезнь перестаёт прогрессировать или даже отступает, в более сильных средствах нет необходимости, а иногда препараты можно даже отменить. Однако некоторые больные не отвечают на первые линии терапии, и тогда требуются более сильные препараты: теперь это чаще всего инъекционные биопрепараты, которые обычно к тому же дороги. Эти лекарства прицельно воздействуют на отдельные элементы иммунной системы и подавляют именно те клетки, которые принимают активное участие в патогенезе. Конечно, высокая эффективность идёт рука об руку с нежелательными явлениями, поэтому врачи всегда взвешивают соотношение пользы и риска, прежде чем начать лечение такими сильными препаратами.
Особняком стоит лечение диабета I типа — здесь пациентам сразу требуются инъекции инсулина, без которого ткани не способны усваивать глюкозу. Другие терапевтические подходы также специфичны для диабета и направлены на снижение уровня глюкозы, поэтому далее диабет I типа мы не рассматриваем.
Исторически первыми препаратами, которые произвели революцию в лечении ряда аутоиммунных и воспалительных заболеваний, стали кортикостероиды — производные и аналоги стероидных гормонов надпочечников. Это всем известные преднизон, дексаметазон, бетаметазон и многие другие. С 1950-х годов они стали применяться для лечения таких заболеваний, как псориаз, ревматоидный артрит, язвенный колит, рассеянный склероз и др. Однако нежелательные явления при приёме кортикостероидов (а они влияют на множество систем организма, вызывая проблемы с сердцем, костями, метаболизмом и пр.) заставили искать более безопасные средства в случае лёгких форм заболеваний. Тем не менее стероиды применяются и сейчас у тяжёлых больных и в случае непереносимости более лёгких препаратов. Правда, и стероиды, и нестероидные противовоспалительные препараты (такие как аспирин и ибупрофен) не способны остановить прогрессию заболевания, а в основном помогают снять симптомы — воспаление и боль.
Основой терапии язвенного колита и болезни Крона (которые объединяют под общим названием «Воспалительные заболевания кишечника») стал месалазин (мезаламин, 5-аминосалициловая кислота, 5-ASA) — производное аспирина, также введённое в обращение в 1950-х годах. Это же действующее вещество образуется в организме из сульфасалазина, который применяется для лечения и воспалительных заболеваний кишечника, и ревматоидного артрита.

Ещё один важнейший препарат — метотрексат — был синтезирован в 1947 году, но сначала применялся только как противоопухолевое средство, и только с 1980-х годов начал использоваться при ревматоидном артрите, язвенном колите и псориазе. Как и в случае других лекарств, синтезированных до наступления эпохи таргетных препаратов (конец 1990-х годов), его механизм действия до конца неизвестен, но ясно, что он снижает активность T- и B-лимфоцитов и при этом подходит для длительного применения, так как относительно безопасен.

Новые препараты
Первым биологическим таргетным препаратом стало моноклональное антитело infliximab (Remicade), зарегистрированное в 1998 году. Оно вводится внутривенно и связывает TNF-alpha — один из основных воспалительных цитокинов. Infliximab удаляет TNF-alpha из кровотока, тем самым снижая воспаление и задерживая развитие болезни.
Вслед за infliximab на рынок вышли действующие похожим образом etanercept (Enbrel) и adalimumab (Humira). Эти три препарата в начале 2000-х годов были зарегистрированы по ряду аутоиммунных заболеваний — псориазу, ревматоидному артриту, воспалительным заболеваниям кишечника (кроме etanercept). Данные препараты в последнее десятилетие возглавили список лидеров по объёму продаж в мире — их суммарный объём продаж превышает 30 млрд долларов (или 3,6% всего мирового рецептурного рынка лекарств в 2018 году).
Конечно, у таких сильных препаратов есть и недостатки. Так как TNF-alpha — один из основных воспалительных цитокинов, он необходим для нормальной борьбы иммунной системы с инфекциями, поэтому его удаление из организма может снизить сопротивляемость организма инфекциям и злокачественным образованиям. Особенно опасны реактивация латентных инфекций, таких как туберкулёз, против которого организм становится практически беззащитен, и редкие случаи развития лимфом.
Вслед за ними стали доказывать свою эффективность и доходить до пациентов и другие таргетные препараты, как низкомолекулярные, так и биологические. Так, в случае ревматоидного артрита у части пациентов anti-TNF-препараты оказываются неэффективными, и тогда им назначают антитела против ещё одного воспалительного цитокина — интерлейкина-6 (IL-6), которые впервые вышли на рынок в 2008 году [3]. С 2012 года на рынке также есть низкомолекулярный пероральный (проще говоря, таблетка) ингибитор белка JAK. Это внутриклеточный фермент, участвующий в воспалительных сигнальных путях в клетках иммунной системы. Его подавление снижает производство воспалительных цитокинов и замедляет развитие заболевания [4].

А вот при воспалительных заболеваниях кишечника, помимо anti-TNF, используется несколько другой подход, не связанный с удалением цитокинов. При этих заболеваниях важную роль в развитии аутоиммунного воспаления играют T-клетки, которые мигрируют из кровеносных сосудов, снабжающих кишечник, в область поражения. Один из рецепторов, который использует для этого T-клетка — α4β7-интегрин, взаимодействующий с рецептором на поверхности эндотелиальной клетки (клетка стенки кровеносного сосуда) и затем проникающий в область контакта между двумя эндотелиальными клетками. Блокирование этого взаимодействия с помощью антитела vedolizumab (Entyvio) снижает количество T-клеток в тканях кишечника, что позволяет задержать прогрессию болезни. По похожему принципу действует антитело natalizumab (Tysabri), однако при воспалительных заболеваниях кишечника оно вызывало слишком много нежелательных явлений, поэтому применяется только при рассеянном склерозе, где профиль безопасности оказался более благоприятным.

Рассеянный склероз также стоит отдельно от других аутоиммунных заболеваний, так как здесь объектом атаки иммунной системы становится головной мозг — наиболее сложный орган, находящийся к тому же за гематоэнцефалическим барьером. Тем удивительнее, что для рассеянного склероза за последнее десятилетие было зарегистрировано много довольно эффективных препаратов. До 2010-х годов основными препаратами для терапии рассеянного склероза (РС) были бета-интерфероны и Копаксон. Бета-интерфероны применяются с 1993 года и до сих пор на первой линии лечения РС. Это природные цитокины, обладающие противовоспалительными свойствами, однако механизм их действия неясен. Они обладают умеренной эффективностью в плане снижения количества обострений рассеянного склероза, многие пациенты плохо их переносят, потому что они вызывают повышение температуры и другие симптомы, похожие на грипп.
Ещё более загадочный препарат — глатирамера ацетат (Копаксон), зарегистрированный в 1996 году. Это в каком-то смысле уникальное лекарство, потому что представляет собой полимер из четырёх аминокислот, идущих в случайном (!) порядке. Предполагаемый механизм действия таков: четыре аминокислоты — лизин, глутаминовая кислота, аланин и тирозин — наиболее часто встречаются в основном белке миелина (myelin basic protein, MBP), против которого у многих пациентов с РС развивается иммунный ответ. Каким-то образом введение Копаксона индуцирует появление вне ЦНС регуляторных T-клеток, мигрирующих в мозг и снижающих там иммунный ответ на MBP.
Помимо упомянутого выше Tysabri, это alemtuzumab (Lemtrada), который связывается с белком CD52 на поверхности T- и B-клеток, что приводит к их уничтожению. Затем происходит восстановление популяции лимфоцитов из предшественников, но по неизвестной причине новые лимфоциты оказываются уже не настолько агрессивными против своих белков в мозге, как до уничтожения, поэтому заболевание протекает легче. Примерно по тому же принципу действует антитело daclizumab (Zinbryta), уничтожающее только активированные T-клетки, связываясь с белком CD25 на их поверхности, и антитела против белка CD20, уничтожающие B-клетки.
Параллельно с антителами для лечения РС разрабатывались и малые молекулы с довольно оригинальным механизмом действия. Fingolimod (Gilenya) связывается с рецептором S1P1 на T-лимфоцитах и задерживает их выход из лимфоузлов. Таким образом, в крови становится меньше активных T-лимфоцитов, следовательно, они меньше попадают в ЦНС и их негативное воздействие снижается. Препарат оказался эффективнее интерферонов, однако в клинических исследованиях и после выхода на рынок отмечались случаи внезапной смерти, главным образом, из-за сердечно-сосудистых осложнений. Поэтому на первой линии лечения РС Gilenya, как правило, не применяется.
Перспективы
Несмотря на ряд препаратов с новыми механизмами действия, появившихся за последнее десятилетие, неудовлетворённая потребность в лечении аутоиммунных заболеваний по-прежнему велика. Излечивающих способов терапии нет, а имеющиеся средства хотя и способны замедлить ухудшение состояния, но помогают далеко не всем или плохо переносятся некоторыми пациентами.
Много надежд возлагалось и возлагается на так называемую передовую терапию: генные и клеточные технологии. Исследования в области различных популяций T-клеток привели к открытию регуляторных T-клеток, которые должны обеспечивать периферическую толерантность и снижать активность аутореактивных T-клеток. Однако ряд провалов в клинических исследованиях по введению таких клеток пациентам с рассеянным склерозом и диабетом I типа привёл к определённому скептицизму в этой области [5]. Тем не менее, разработки продолжаются и, возможно, успехи в умении манипулировать толерогенными клетками приведут к появлению работающих средств передовой терапии [6].
Единственная клеточная терапия, зарегистрированная при аутоиммунном заболевании, — стволовые клетки, полученные из жировой ткани здоровых доноров. Они используются по очень узкому показанию: у определённой подгруппы пациентов с болезнью Крона. Данный продукт, Alofisel (darvadstrocel), вышел на рынок в 2018 году и показал значимое увеличение доли пациентов с ремиссией в группе терапии (49,5%) по сравнению с группой плацебо (34,3%). Довольно высокий процент в плацебо-группе объясняется неравномерным течением заболевания с высокой частотой спонтанных ремиссий. Здесь играет роль множество факторов: например, в исследование пациенты включаются в момент обострения, а потом у многих из них активность болезни снижается. Играет роль также эффект включения в исследования, когда пациент начинает лучше следить за собой и выполнять все указания врачей. Неравномерное и очень гетерогенное течение аутоиммунных заболеваний — одна из проблем разработки лекарств против них: требуются долговременные наблюдения над большими группами пациентов, чтобы доказать, что лекарство действительно работает. Другая важная проблема — отсутствие достаточно качественных доклинических моделей аутоиммунных заболеваний, так как иммунная система человека (как и мозг) уникальна, то есть ни одно исследование на других видах животных не может предсказать всех эффектов у человека.
Потенциально излечивающая терапия, возможно, будет разработана для диабета I типа: уже сейчас в клинических исследованиях изучают трансплантированные бета-клетки островков Лангерганса поджелудочной железы (именно они поражаются при аутоиммунном процессе), защищённые от иммунной системы внешней капсулой [7].
Несмотря на то, что в клинических исследованиях сейчас находятся более 300 продуктов для лечения аутоиммунных заболеваний, по-настоящему новых и революционных на поздних стадиях исследований немного. В основном речь идёт о расширении показаний уже вышедших на рынок агентов (например, применение JAK-ингибиторов в псориазе), разработке более безопасных, удобных и дешёвых аналогов имеющихся препаратов.
Более интересные разработки связаны с воздействием на новые мишени иммунной системы с целью их «переучивания» в регуляторные или на генетическую модификацию T-лимфоцитов, но эти технологии пока находятся в самом начале исследований. Можно быть уверенными, что большинство таких разработок провалится, однако какая-то часть, возможно, доберётся до рынка и принесёт пользу пациентам.
Заключение
Мы выборочно рассмотрели несколько заболеваний и ряд продуктов, чтобы показать, насколько динамично развивается область терапии аутоиммунных заболеваний. Вместе с тем мы находимся только в самом начале понимания того, как работает иммунная система и тем более как её модулировать. Препараты разрабатываются почти вслепую, хотя, конечно, не совсем наугад, как это было до наступления 21 века.
Литература
Примечания
1 Имеется в виду прежде всего загар. Однако, хотя ультрафиолет (УФ) и является для некоторых заболеваний фактором риска, в случае других расстройств это скорее положительный фактор. В частности, следует помнить, что УФ стимулирует выработку витамина D, низкий уровень которого коррелирует с повышенным риском рассеянного склероза, системной красной волчанки и диабета I типа.
2 Целиакия стоит особняком, так как глютен — не аутоантиген, а белок, содержащийся в злаках, и поступает он с пищей. Однако иммунная реакция на него типична для аутоиммунных заболеваний. Вместе с тем болезнь проходит, если человек придерживается безглютеновой диеты.
3 Линиями терапии в медицине называются последовательные этапы применения все более «тяжёлых» (то есть более эффективных, но и менее безопасных) препаратов по мере того, как предыдущие этапы перестают работать.
4 Под таргетным понимается препарат, разработанный для воздействия на определённую мишень, известную заранее, и действующий преимущественно на неё.
5 Воспроизведённые препараты, имеющие то же действующее вещество, что и оригинальный препарат.