Как сделать изомер углеродного скелета
Как составлять изомеры
Одним из важнейших представлений в органической химии является – изомерия. Ее толк заключается в том, что существуют вещества, различающиеся пространственным расположение своих атом либо ядерных групп, при этом владеющих идентичной молекулярной массой и составом. В этом и заключается основная повод того что в природе отслеживается громадное многообразие органических веществ.
Вам понадобится
Инструкция
1. Вначале надобно составить формулу углеводородного скелета в неразветвленном виде, исходя из данных его молекулярной формулы.С – С – С – С – С – С
2. Пронумеровать все атомы углерода. 1 2 3 4 5 6 С – С – С – С – С – С
3. Зная о том, что углерод четырехвалентен, подставить атомы водорода углеродную цепь. 1 2 3 4 5 6 СН3 – СН2 – СН2 – СН2 – СН2 – СН3
4. Уменьшите углеродную цепочку на один атом, расположив его в виде бокового ответвления. Главно понимать, что боковые атомы цепочки углерода не могут стать боковыми ответвлениями. С – С – С – С – С С
5. Со стороны, к которой ближе боковое ответвление начните нумерацию цепочки, а после этого расставьте атомы водорода, соблюдая правила валентности. 1 2 3 4 5 СН3 – СН – СН2 – СН2 – СН3 СН3
7. Если для бокового ответвления огромнее нет вероятностей, уменьшите первоначальную цепочку углерода на один его атом, при этом расположив его как боковое ответвление. Не забывайте, что при одном атоме в углеродной цепочке находятся не огромнее 2-х ответвлений. С С – С – С – С С
8. Пронумеруйте новую цепь атом с того же края, к которому ближе ответвление. Добавьте атомы водорода, помня о четырехвалентности атома углерода. СН3 1 2 3 4 СН3 – С – СН2 – СН3 СН3
9. Проверяйте дальше дозволено ли расположить еще боковые ответвления к углеродной цепочке. Если дозволено составьте формулы изомеров. Если невозможно продолжайте сокращать цепочку атомов углерода, потихоньку на один атом, располагая его как боковое ответвление. Пронумеровав цепочку, продолжайте составлять формулы изомеров. Нумерация, в случае если боковые ответвления, находятся на идентичном расстоянии от краев цепи, будет начинаться с края, у которого огромнее боковых ответвлений. 1 2 3 4 СН3 – СН – СН – СН3 СН3 СН3
10. Продолжайте последовательность всех действий, пока будет иметься вероятность для расположения боковых ответвлений.
Совет 2: Виды изомерии органических веществ
В органической химии существует представление изомеров. Это молекулы с идентичным числом атомов всякого элемента, но отличающиеся конструкцией либо пространственным расположением. Существуют миллионы изомеров. Их принято разделять на группы: цепочечные, позиционные, функциональные, геометрические и оптические.
Цепочечные изомеры
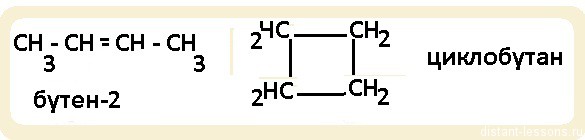
Цепочечные изомеры имеют молекулы с идентичной конструкцией, но отличаются составом углеродного «скелета» – основой, на которой помещены все атомы. Все органические молекулы скрепляются цепочками атомов углерода. И эта связь может быть организована по-различному: либо одной постоянной цепью, либо в виде цепочек с несколькими боковыми ответвлениями групп атомов углерода. Наименования изомеров отличаются между собой, дабы отразить это отличие. Ответвления от стержневой цепи зачастую могут быть представлены больше чем в одном варианте. Это приводит к огромному числу допустимых изомеров, потому что число атомов углерода в молекуле возрастает.
Позиционные изомеры
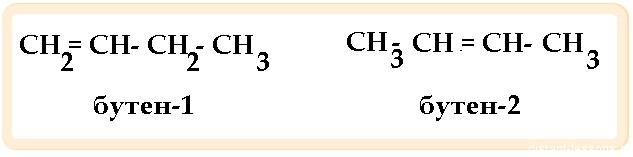
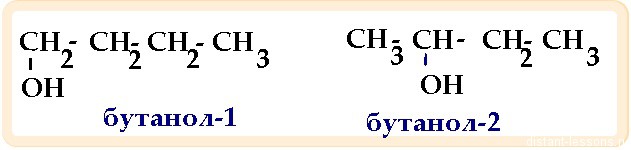
Позиционные изомеры различаются расположением «функциональной группы атомов» в молекуле. Такая группа в органической химии является частью молекулы, которая придает ей уникальные свойства. Существует уйма разных функциональных групп. Особенно распространенным из них даются наименования: углеводородные, галогенные, водородные и т.д.
Функциональные изомеры
У функциональных изомеров основная группа не меняет своего расположения, а изменяется формула вещества. Это допустимо путем перегруппировки атомов в молекуле и при их соединении друг с ином разными методами. Скажем, стандартная прямая цепочка алкана (содержащего только атомы углерода и водорода) может иметь функциональную группу, которая представляет собой циклоалкан. Это вещество является легко атомами углерода объединенными друг с ином таким образом, что они образуют кольцо. Разные изомеры могут существовать для одних и тех же функциональных групп.
Геометрические изомеры
Геометрическая изомерия, на самом деле, термин, тот, что «настойчиво не рекомендуется» Интернациональным союзом теоретической и прикладной химии. Тем не менее, обозначение «геометрическая изомерия» по-бывшему применяется во многих школьных и вузовских учебниках для обозначения такого класса веществ. Данный тип изомерии особенно зачастую включает двойные углеродные связи. Вращательное движение этих связей мощно ограничено, по сопоставлению с одинарными связями, которые могут вращаться вольно. Если в двойном типе связи две цепочки меняются местами, появляется изомер.
Оптические изомеры
Оптические изомеры получили такое наименование за счет могущества на них плоскополяризованного света. Они, как водится (но не неизменно), содержат хиральный центр. Это молекула углерода, состоящая из четырех разных атомов (либо групп атомов), прикрепленных к нему. Эти атомы либо группы могут быть расположены по-различному вокруг центральной части. Таким образом, молекула преломляет свет не потому что другие.
Важность изомерии
Изомеры одной и той же молекулы владеют разными свойствами. Эта специфика обширно используется в химии для приобретения новых химических соединений из теснее существующих.
Урок по химии: «Изомерия органических соединений»
Разделы: Химия
Цель урока: расширить представление о явлении изомерия. Рассмотреть все типы структурной и пространственной изомерии.
Оборудование: шаростержневые модели молекул.
Ход урока
Организационный момент.
Мы познакомились с номенклатурой органических соединений. Выполним проверку знаний.
Выполнение задания по карточкам (см. Приложение 1).
Проверка выполнения задания. Оценивание.
Изучение нового материала.
Учитель: Что называют явлением изомерия?
Ученик: Изомерия – это явление существования разных веществ с одинаковым качественным и количественным составом, т.е. одинаковой молекулярной формулой. [1]
Учитель: Явление изомерии было открыто Ю. Либихом и Ф. Вёлером в 1823г. Научное обоснование явлению изомерии было дано А. М. Бутлеровым в рамках теории строения. [2]
Учитель: Существует два вида изомерии: структурная и пространственная.
Структурную изомерию различают на:
Рассмотрим примеры изомерии (учащиеся конспектируют примеры в тетради).
1. Изомерия углеродного скелета.
2. Изомерия положения кратной связи.
3. Изомерия положения функциональной группы.
4. Межклассовая изомерия.
Пространственная изомерия подразделяется на:
Рассмотрим примеры изомерии (учащиеся конспектируют примеры в тетради).
1. Геометрическая изомерия.
Заместители могут располагаться либо по одну строну плоскости двойной связи (цис-изомер), либо по разные (транс-изомер).
2. Оптическая изомерия.
Явление изомерии возникает, если молекула несовместима со своим изображением в зеркале.
Оптическая изомерия а-аминопропионовой кислоты.
Домашнее задание.
Учебник «Химия-10». § 7, стр. 41 вопросы 3,4. Автор О. С. Габриелян.
Химия, Биология, подготовка к ГИА и ЕГЭ
Вопрос A13 ЕГЭ по химии —
Теория строения органических соединений: гомология и изомерия. Взаимное влияние атомов в молекулах. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
Темы, которые нужно знать:
Эти вопросы входят в анализ строения каждого класса веществ в органической химии, но в данном вопросе нам нужно свести все эти знания воедино. Давайте рассмотрим каждое определение, каждый пункт этого вопроса, исходя из знаний строения всех органических веществ.
Изомеры и гомологи
Не вдаваясь в сложные формулировки, давайте определим, что такое гомологи и изомеры.
Гомологи — относятся к одному классу веществ (например, алканы). Это значит, что у них:
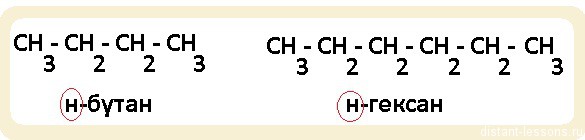
Обратите внимание, именно н-бутан и н-гексан будут относится к гомологам. Если мы возьмем н-алкан (линейная молекула) и разветвленный алкан, то, хотя у них будет одна и та же общая формула (СnH2n+2), по химическим свойствам они будут несколько различаться, т.к. разветвленное строение этих органических соединений будет оказывать влияние на направление протекания реакций.
Изомеры —химические соединения, одинаковые по составу и молекулярной массе, но различающиеся по строению и свойствам (химическим и физическим)
Виды изомерии:
Виды химической связи в органической химии
Т.к. органическая химия — это химия соединений углерода, то основным видом химической связи является ковалентная химическая связь.
Как и в неорганических соединениях, в органических вид химической связи определяют исходя из строения вещества.
Тип гибридизации атомов в органических соединениях
Как образуется гибридизация атомных орбиталей в молекуле мы подробно рассматривали при изучении каждого класса органических соединений, здесь мы рассмотрим практическое применение этих знаний.
На что нужно обратить внимание:
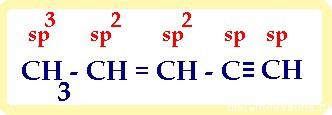
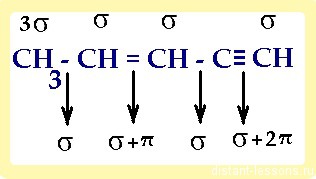
1) в молекуле, имеющей не только один вид связи, каждый атом имеет свой тип гибридизации :
итого: 10 сигма- и 3 π-связей
Давайте систематизируем все эти вопросы по классам углеводородов