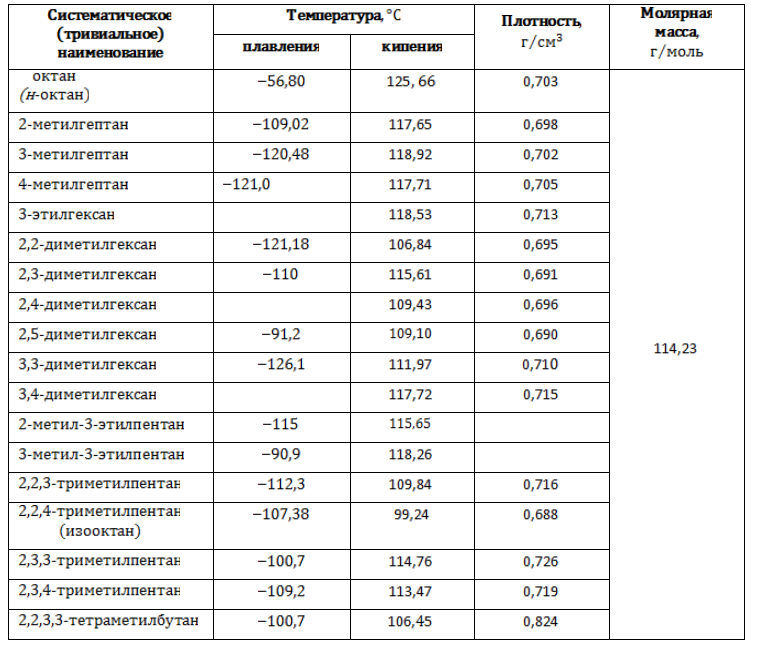
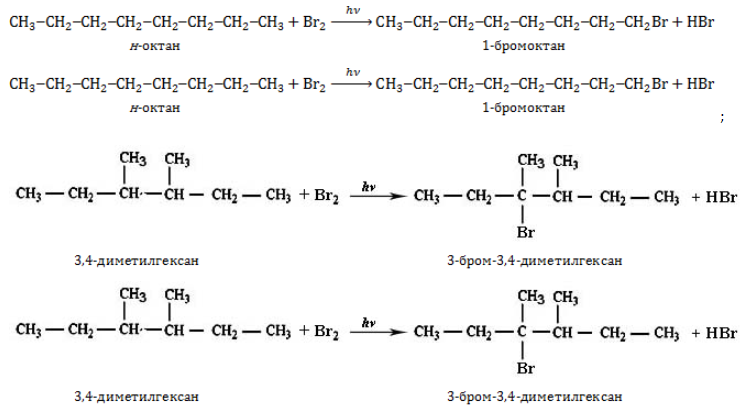
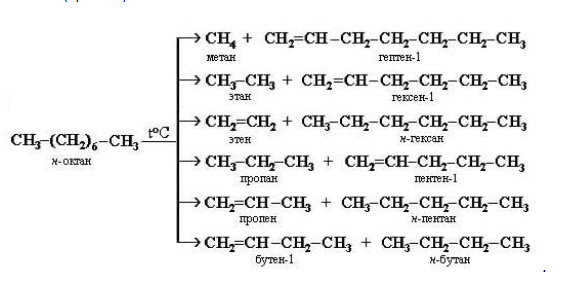
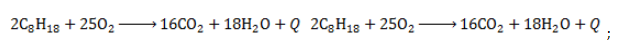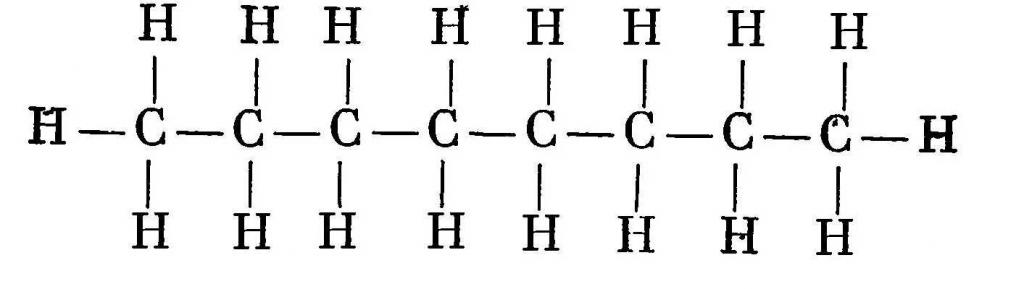Как сделать изомеры октана
Изомеры октана
Октан – восьмой член в гомологическом ряду алканов. Изомеры октана характеризуются структурным разнообразием, вследствие чего свойства этих веществ различны. Они, в свою очередь, определяют сферу применения того или иного изомера. Главным источником для получения октанов служит нефть и продукты ее переработки.
Формула и строение
Являясь типичными предельными углеводородами ациклического строения, октаны содержат наибольшее возможное количество атомов водорода. Построение углеродного скелета и удержание на нем водородных атомов осуществляется только за счет прочных одинарных 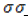
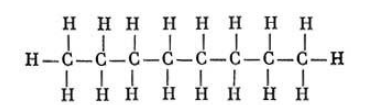
Состав октана выражается химической формулой С8H18. Простейшее строение молекулы октана представляет собой неразветвленную и не содержащую циклов цепь, так называемый нормальный, или н-октан. Она образована восемью углеродными атомами, валентности которых полностью насыщены.
Структурная формула октана:
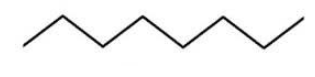
Строение молекулы можно также изобразить с помощью скелетной формулы, где символы водорода и углерода опускаются. Вершины и концы ломаной линии означают углеродные атомы:
Зигзагообразная форма линии точнее отражает молекулярную структуру углеводородов, так как углеродные атомы связываются между собой не линейно, а подчиняясь валентным углам, возникающим у атома в sp3-гибридизованном состоянии.
Поскольку вокруг 
Изомерия октана
У соединений состава С8H18 изомеры возникают не только вследствие вариантов ветвления цепочки. Октаны способны образовывать изомеры на основе оптических различий между структурно одинаковыми молекулами. Все изомеры октана являются насыщенными ациклическими углеводородами – кратные связи в них не появляются.
Структурная изомерия
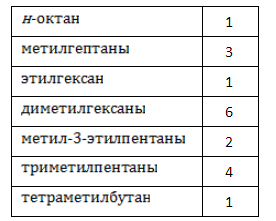
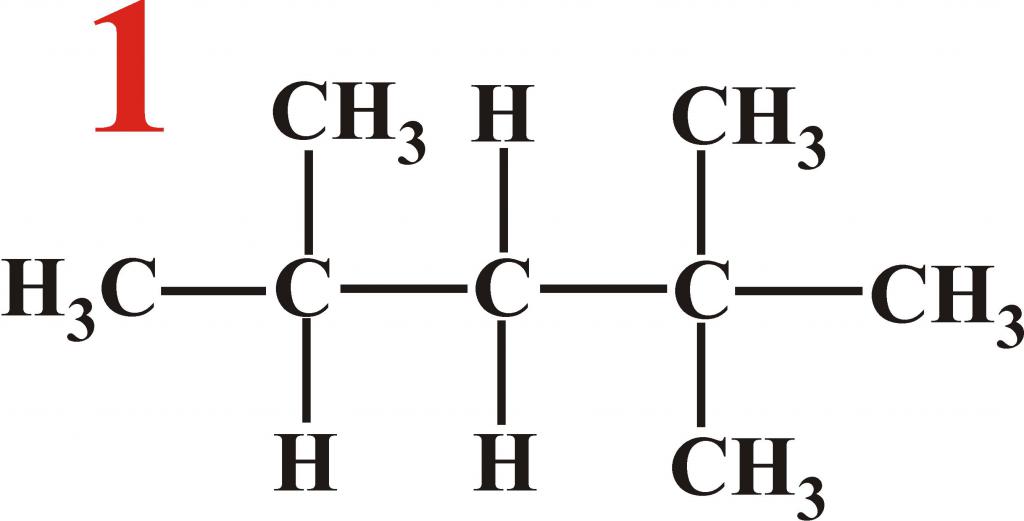
Алканы образуют структурные изомеры лишь по одному признаку – по порядку связывания атомов, формирующих углеродный скелет. Таких изомеров насчитывается 18, и их удобно разделить на группы по типу и количеству алкильных радикалов:
Оптическая изомерия
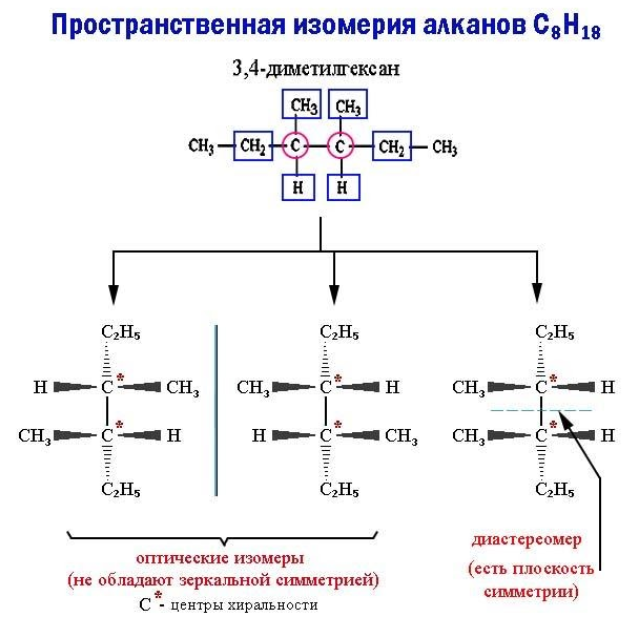
Пространственные изомеры данного типа, называемые также энантиомерами, при идентичной структуре не обладают зеркальной симметрией. Такие молекулы-энантиомеры представляют собой взаимные зеркальные отражения, которые не могут совпасть при вращении, – антиподы. Отсутствие зеркальной симметрии носит название хиральности (пример – правая и левая руки).
Хиральность возникает, если все четыре заместителя при каком-либо углеродном атоме оказываются разными. В этом случае в молекуле отсутствует плоскость симметрии. Как бы ни вращался этот атом (центр хиральности) вместе с радикалами, молекулу невозможно совместить с ее зеркальным отражением.
Если же молекула обладает плоскостью симметрии, она не является оптическим изомером. Возникает другой тип пространственной изомерии – диастереомерия.
Энантиомеры проявляют свои различия только в оптически активной среде. Так, являясь антиподами, они поворачивают в противоположных направлениях плоскость поляризации света. В химических взаимодействиях с хиральными соединениями (например, аминокислотами) оптические изомеры существенно различаются по реакционной способности.
Наименования и формулы изомеров октана

Физические свойства
Октаны – прозрачные жидкости без цвета, со слабо выраженным запахом. Появление боковых ветвей в молекулах изомерных форм прежде всего влияет на межмолекулярные связи, что приводит к изменению температур, при которых вещества совершают фазовые переходы.
Изомеры состава С8H18, подобно всем алканам, нерастворимы в воде, но растворяются в эфирах, бензоле и других органических растворителях.
Основные физические характеристики октанов приводятся в таблице.
Химические свойства
Изомерные октаны принадлежат к одному классу веществ – насыщенным ациклическим углеводородам. Поэтому в химических взаимодействиях они проявляют типичные для алканов свойства:
Получение октанов
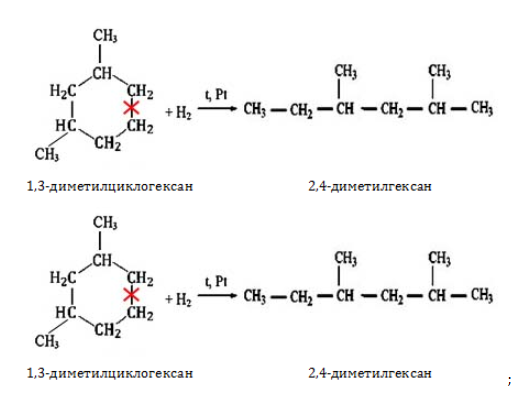
Для лабораторного синтеза октана и его изомеров применяются следующие методы:
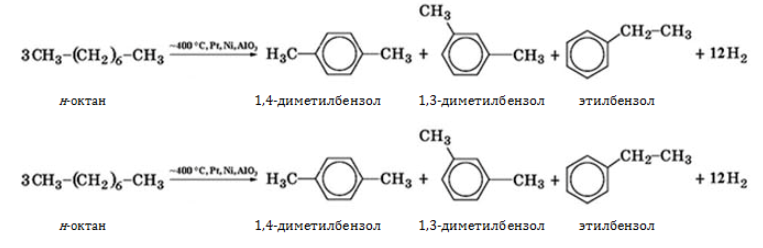
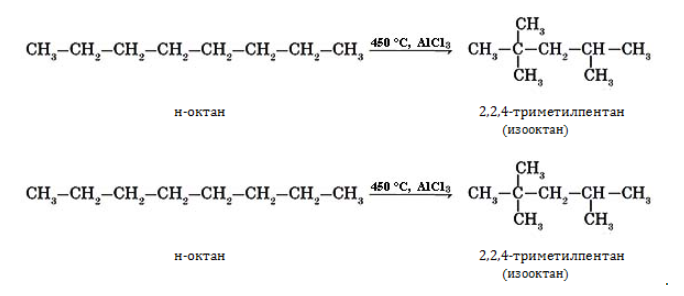
В промышленности октан и его изомеры получают в процессах бензиновой фракции нефти или в числе прочих углеводородов при синтезе по методу Фишера–Тропша:
Применение октанов
Как сырье или промежуточный продукт октан используется в органическом синтезе. С его помощью получают ароматические углеводороды бензольного ряда – этилбензол и ортоксилол – а также другие соединения. Октан также применяется в качестве растворителя. Как компонент топлива октан играет скорее отрицательную роль, так как понижает устойчивость горючего к детонации.
Изооктан благодаря разветвленной структуре молекулы не склонен к детонации, вследствие чего принят в качестве эталона для определения качества бензина. Изооктан входит в состав авиационного топлива. Как химическое сырье изооктан не находит применения. Сфера его использования ограничена топливной отраслью, в которой изооктан играет важную роль.
Что такое октан? Структурная формула и получение октана
Химия – это один из нелегких предметов, преподаваемых в школах. Сложность его заключается в том, что мало кто в повседневной жизни применяет химическую терминологию. Многие даже понятия не имеют, как можно получить или из чего состоит то или иное вещество.
На самом деле химия – это очень интересный увлекательный предмет. Благодаря знаниям, полученным на уроке, можно поэкспериментировать и получить интересные вещества.
В данной статье будет рассмотрено, что такое октан, структурная формула, получение вещества и его свойства.
Углеводородное соединение октан
Октаны являются частью алканового класса, образующего гомологический ряд. Они состоят из атомов водорода и углерода, являются насыщенными углеводородами.
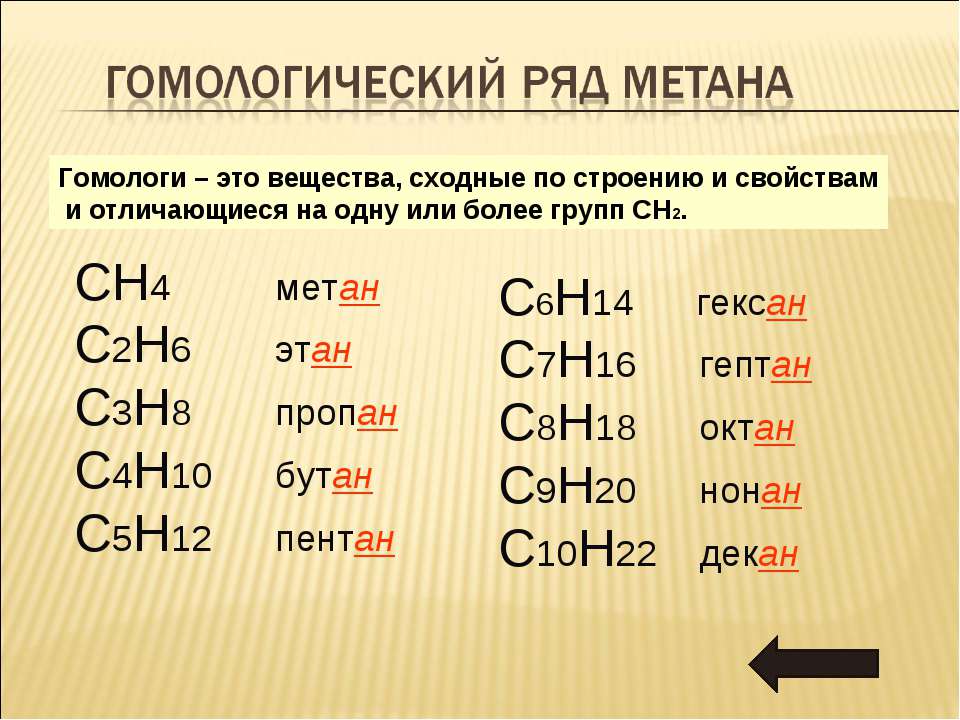
Гомологический ряд алканов начинается с метана (содержит один атом углерода и четыре атома водорода), далее идет этан (2 углерода, 5 водорода), пропан (3 и 8), бутан (4 и 10), пентан (5 и 12), гексан (6 и 14), гептан (7 и 16), октан (8 и 18) и так далее. Из этого можно понять, что октан состоит из восьми атомов углерода и 18 атомов водорода.
Структурная формула октана C8H18. Это вещество в виде жидкости без цвета, имеющее своеобразный запах. Получают его из нефти и бензина. При температуре 56,8 °С вещество плавится, а при 125,67 °С – кипит.
Октан используется в виде топлива для автомобилей, самолетов.
Алканы с атомами углерода больше трех имеют определенные изомеры. Рассмотрим, какие изомеры имеют октаны.
Структурные формулы изомеров октана
Изомеры – это такие вещества, которые имеют такой же состав, как сам алкан. Количество углеродов и водородов одинаковое, но разное строение и свойства. У октана 18 изомеров.
У каждого из них по восемь атомов углерода и восемнадцать атомов водорода. К ним можно отнести:
Структурный изомер октана – изооктан. Это бесцветная жидкость, пахнущая бензином. В воде она не растворяется. Применяется как добавка к бензину, повышающая его антидетонационные свойства.
Октан: способы получения и химические свойства
Октан C8H18 – это предельный углеводород, содержащий восемь атомов углерода в углеродной цепи. Бесцветная жидкость с характерным запахом, нерастворим в воде и не смешивается с ней.
Гомологический ряд октана
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Строение октана
В молекулах алканов встречаются химические связи C–H и С–С.
Связь C–H ковалентная слабополярная, связь С–С – ковалентная неполярная. Это одинарные σ-связи. Атомы углерода в алканах образуют по четыре σ-связи. Следовательно, гибридизация атомов углерода в молекулах алканов – sp 3 :
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109 о 28′ друг к другу:
Это соответствует тетраэдрическому строению.
| Например, в молекуле октана C8H18 атомы водорода располагаются в пространстве в вершинах тетраэдров, центрами которых являются атомы углерода. При этом углеродный скелет имеет зигзагообразное строение. |
Изомерия октана
Структурная изомерия
Для октана характерна структурная изомерия – изомерия углеродного скелета.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета отличаются строением углеродного скелета.