Как сделать ледяной кристалл
Thaumcraft 5/Ледяные кристаллы
Ледяные кристаллы (англ. Ice Crystal) — блок, добавляемый модификацией Thaumcraft 5; кристальное скопление, состоящее из ледяных кристаллов. Встречается в верхнем мире на глубине от 5 до 80 уровня. По умолчанию генерируется по 4-8 блоков в месторождении. Используется для получения ледяного кристалла путём разрушения блока.
Содержание
Получение [ править | править код ]
Натуральная генерация [ править | править код ]
Эти кристаллы встречаются в нижней половине мира, на высоте от 5 до 80 блоков. Ледяные кристаллы чаще всего встречаются в пещерах, хотя изредка могут быть обнаружены и на поверхности. В среднем, каждое месторождение содержит 4-8 кластеров ледяных кристаллов.
Наполнение [ править | править код ]
Ледяные кристаллы в виде кластера можно получить как предмет одним единственным способом — наполнением ледяного кристалла магией. Это можно сделать, изучив исследование «Фермер кристаллов».
Использование [ править | править код ]
Ледяной кристалл, добываемый из кластера, используется для крафта таумометра, а также для создания амулета вис, набалдашника: магический крюк и других полезных предметов.
Описание в Таумономиконе [ править | править код ]
Иногда появляется так много магической энергии, что она начинает конденсироваться на камнях в виде кристаллов. Пока есть избыток энергии кристаллы будут расти и даже распространяться.
Но когда Аура истощается, кристаллы испаряются опять же в виде энергии, восстанавливая Ауру. Таким образом, кристаллы представляют собой своеобразные батареи для вис. Но они никогда полностью не исчезают — как минимум один маленький кристалл всегда остаётся.
Кристаллы, растущие в заражённой зоне тоже могут заразиться.
Галерея [ править | править код ]
Ледяные кристаллы, найденные у подножия горы
Четыре способа сделать прозрачный лед дома
Искать среди 875 записей
Четыре способа сделать прозрачный лед дома
Казалось бы, нет ничего проще, чем приготовить лед дома. Но это не совсем так, ведь при заморозке у нас обычно получаются мутные кубики с пузырьками воздуха внутри. А в кафе и барах нам подают напитки с кристально чистым и прозрачным льдом. Дело в том, что процесс замерзания льда проходит постепенно от стенок формы к ее середине, выталкивая туда же воздух, который содержится в воде, и после замерзания мы получаем мутный оттенок льда (так выглядит замерзший воздух).
В чем же секрет получения такого льда и можно ли приготовить его в домашних условиях?
Ответ, однозначно, положительный. И сейчас мы откроем четыре секрета получения идеальных кубиков льда дома.
Способ первый: кипятим и замораживаем
Чтобы избавиться от лишнего воздуха в воде, просто прокипятите воду, предварительно пропустив ее через фильтр. Во время кипения вода избавляется от воздуха. После того как вы прокипятили воду, дайте ей остыть и повторите процедуру еще раз.
Когда вода остынет второй раз, ее можно наливать в форму. Через сутки в вашем распоряжении будет прекрасный прозрачный лед.
Способ второй: формы в форме
Хороший вариант для получения прозрачного льда – использование большого пластикового контейнера и водопроводная вода, пропущенная через фильтр.
В этот контейнер следует поместить формы с водой для кубиков льда, предварительно заполнив его водой на уровень, равный уровню воды в маленьких формочках. Таким образом лед будет появляться сверху вниз.
Через сутки останется достать формочки и сбить с них излишки льда, в которых останется лишний воздух. В результате мы получим прозрачный лед без особых усилий.
Способ третий: медленно, но верно
Воду предварительно следует профильтровать, а затем залить в формочки. Желательно обернуть их пищевой пленкой. Затем поместить формы на верхнюю полку морозильной камеры и оставить на 24 часа.
Прозрачный лед в результате вам обеспечен.
Способ четвертый: соль – лучший помощник
Через 24 часа вы получите прекрасный прозрачный лед.
Конечно, наилучший способ получения качественного льда – использование ледогенератора, однако эти агрегаты не из дешевых и не каждый человек захочет иметь дома такую конструкцию.
Выращиваем фиолетовый кристалл в домашних условиях
В этом обзоре мы расскажем о том, как самому вырастить красивый фиолетовый иммуно-кристалл.
Начнем с просмотра видеоролика от автора
Для выращивания фиолетового кристалла понадобится:
— алюмокалиевые квасцы;
— хромокалиевые квасцы;
— емкость;
— леска.

Для начала нужно сделать смесь квасцов. Для этого берем стакан и отвешиваем в него 100 гр. алюмокалиевых квасцов и 12 гр. хромокалиевых квасцов. Добавление вторых необходимо для получения фиолетового оттенка.

Далее наливаем в стакан 400 мл очень горячей воды и начинаем перемешивать, пока вся соль не растворится.
После этого оставляем стакан с раствором на 24 часа, чтобы на дне выпали кристаллы.
Спустя сутки сливаем раствор квасцов из стакана в другую емкость. На дне стакана будут образованы красивые маленькие кристаллы, сросшиеся между собой.
Расковыриваем массу с кристаллами и выкладываем их в тарелку.
Теперь выбираем из этой массы кристаллов самый красивый и большой. Этот кристалл будет служить затравкой, то есть именно его мы будем использовать для выращивания одного большого кристалла.
Раствор, который мы слили ранее из стакана, фильтруем.
Теперь подвязываем затравку на тонкую леску и подвешиваем в растворе квасцов на карандаш или палочку.
Теперь остается набраться терпения и ждать, пока вырастит кристалл.
Со временем вода из раствора будет испаряться и лишние квасцы будут формировать кристалл, который висит на леске.
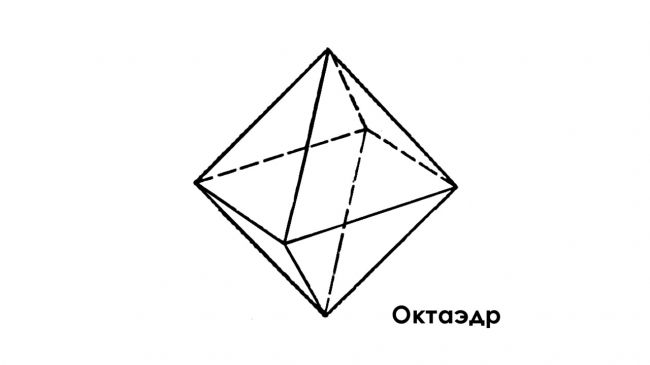
Спустя некоторое время кристалл будет обретать правильную геометрическую форму, обусловленную формой кристаллической решетки вещества. Для квасцов это восьмигранник или октаэдр.
Также во время роста кристаллов на дне стакана и на леске начнут расти лишние кристаллы, которые необходимо убирать.
Эти кристаллы можно сохранить, поскольку их в дальнейшем можно будет использовать для приготовления раствора и выращивания других кристаллов.
Также при выращивании иммуно-кристаллов следует избегать перепадов температур и загрязнения раствора.
Спустя два месяца можно получить кристалл, наподобие того, который получил автор идеи.
Готовый кристалл нужно вытащить из раствора, высушить салфеткой и покрыть слоем бесцветного лака, чтобы в будущем кристалл не выветривался и не терял своей красоты.

Выращивание кристаллов – очень увлекательное занятие, которое развивает терпение и разум.
Многообразие и загадки ледяных кристаллов. Что такое лед?
Поделиться
Значение льда в поддержании жизни на нашей планете трудно недооценить. Лёд оказывает большое влияние на условия обитания и жизнедеятельности растений и животных и на разные виды хозяйственной деятельности человека. Покрывая воду, лед из-за своей низкой плотности играет в природе роль плавучего экрана, защищающего реки и водоемы от дальнейшего замерзания и сохраняющего жизнь подводным обитателям. Природный лёд используется для хранения и охлаждения пищевых продуктов, биологических и медицинских препаратов, для чего он специально производится и заготавливается, а талую воду, приготовленную при плавлении льда, используют в народной медицине – для повышения обмена веществ и выведения шлаков из организма. Статья знакомит читателя с новыми малоизвестными свойствами и модификациями льда.
Лёд – кристаллическая форма воды, обладающая по последним данным четырнадцатью структурными модификациями. Среди них имеются и кристаллические (природный лед) и аморфные (кубический лед) и метастабильные модификации, различающиеся друг от друга взаимным расположением и физическими свойствами молекул воды, связанными водородными связями, формирующими кристаллическую решетку льда. Все они кроме привычного нам природного льда Ih, кристаллизующего в гексагональной решетке, образуются в условиях экзотических — при очень низких температурах сухого льда и жидкого азота и высоких давлениях в тысячи атмосфер, когда углы водородных связей в молекуле воды изменяются и образуются кристаллические системы, отличные от гексагональной. Такие условия напоминают космические и не встречаются на Земле.
Самое необычное свойство льда — это удивительное многообразие внешних проявлений. При одной и той же кристаллической структуре он может выглядеть совершенно по-разному, принимая форму прозрачных градин и сосулек, хлопьев пушистого снега, плотной блестящей корки льда или гигантских ледниковых масс. Лёд встречается в природе в виде материкового, плавающего и подземного льда, а также в виде снега и инея. Он распространён во всех областях обитания человека. Собираясь в больших количествах, снег и лед формируют особые структуры с принципиально иными, чем у отдельных кристаллов или снежинок, свойствами. Природный лед сформирован в основном льдом осадочно-метаморфического происхождения, образовавшимся из твердых атмосферных осадков в результате последующего уплотнения и перекристаллизации. Характерная особенность природного льда — зернистость и полосчатость. Зернистость обусловлена процессами рекристаллизации; каждое зерно ледникового льда представляет собой кристалл неправильной формы, тесно примыкающий к другим кристаллам в ледяной толще таким образом, что выступы одного кристалла плотно входят в углубления другого. Такой лед получил название поликристаллического. В нем каждый кристалл льда представляет собой слой тончайших листочков, налегающих друг на друга в базисной плоскости, перпендикулярной к направлению оптической оси кристалла.
Общие запасы льда на Земле составляют согласно расчетам около 30 млн. км 3 (табл. 1). Больше всего льда сосредоточено в Антарктиде, где толщина его слоя достигает 4 км. Также имеются данные о наличии льда на планетах Солнечной системы и в кометах. Лед имеет столь большое значение для климата нашей планеты и обитания на ней живых существ, что ученые обозначили для льда особую среду — криосферу, границы которой простираются высоко в атмосферу и глубоко в земную кору [2].
Табл. 1. Количество, распространение и время жизни льда.
Средняя концентрация, г/см 2
Скорость прироста массы, г/год
Среднее время жизни, год
Табл. 2. Некоторые физические свойства льда I.
Сильно уменьшается с понижением температуры
Теплота таяния, кал/г
Теплота парообразования, кал/г
Коэффициент термического расширения, 1/°C
Кажущаяся энергия активации 11 ккал/моль
Кажущаяся энергия активации 32 ккал/моль
Модуль упругости Юнга, дин/см 2
Сопротивление, МН/м 2 :
Динамическая вязкость, пуаз
Энергия активации при деформировании и механической релаксации, ккал/моль
Линейно растет на 0,0361 ккал/(моль· 0 C) от 0 до 273,16 К
В связи с широким распространением льда на Земле, отличие физических свойств льда (табл. 2) от свойств других веществ играет важную роль во многих природных процессах [4]. Лёд обладает многими другими полезными для поддержания жизни свойствами и аномалиями – аномалиями плотности, давления, объема, теплопроводности.Если бы не было водородных связей, сцепляющих молекулы воды в кристалл, лед плавился бы при –90 °С. Но этого не происходит из-за наличия водородных связей между молекулами воды. Вследствие меньшей, чем у воды, плотности лёд образует на поверхности воды плавучий покров, предохраняющий реки и водоёмы от донного замерзания, поскольку его теплопроводность намного меньше, чем воды. При этом наименьшая плотность и объем наблюдается при +3,98 °С (рис. 1). Дальнейшее охлаждение воды до 0 0 С постепенно приводит не к уменьшению, а к увеличению ее объема почти на 10%, когда вода превращается в лед. Такое поведение воды свидетельствует об одновременном существовании в воде двух равновесных фаз – жидкой и квазикристаллической по аналогии с квазикристаллами, кристаллическая решетка которых имеет не только периодическое строение, но и обладает осями симметрии разных порядков, существование которых ранее противоречило представлениям кристаллографов [5]. Эта теория, впервые выдвинутая известным отечественным физиком-теоретиком Я. И. Френкелем, основана на предположении, что часть молекул жидкости образует квазикристаллическую структуру, тогда как остальные молекулы являются «газоподобными», свободно движущимися по объему. Распределение молекул в малой окрестности любой фиксированной молекулы воды имеет определенную упорядоченность, несколько напоминающую кристаллическую, хотя и более рыхлую [6]. По этой причине структуру воды иногда называют квазикристаллической или кристаллоподобной, т. е. обладающей симметрией и наличием упорядоченность во взаимном расположении атомов или молекул.

Видимый свет льдом практически не поглощается, поскольку световые лучи проходят кристалл льда насквозь, но задерживает ультрафиолетовое излучение и большую часть инфракрасного излучения Солнца. В этих областях спектра лёд выглядит абсолютно чёрным, поскольку коэффициент поглощения света в этих областях спектра очень велик. В отличие от кристаллов льда, белый свет, падающий на снег, не поглощается, а многократно преломляется в ледяных кристаллах и отражается от их граней. Поэтому снег выглядит белым.
Вследствие очень высокой отражательной способности льда (0,45) и снега (до 0,95) покрытая ими площадь — в среднем за год около 72 млн. км 2 в высоких и средних широтах обоих полушарий — получает солнечного тепла на 65% меньше нормы и является мощным источником охлаждения земной поверхности, чем в значительной мере обусловлена современная широтная климатическая зональность. Летом в полярных областях солнечная радиация больше, чем в экваториальном поясе, но температура остаётся низкой, т. к. значительная часть поглощаемого тепла затрачивается на таяние льда, имеющего очень высокую теплоту таяния.
К другим необычным свойствам льда относят и генерацию электромагнитного излучения его растущими кристаллами [8]. Известно, что большинство растворенных в воде примесей не передаются льду, когда он начинает расти; они вымораживается. Поэтому даже на самой грязной луже пленка льда чистая и прозрачная. При этом примеси скапливаются на границе твердой и жидкой сред, в виде двух слоев электрических зарядов разного знака, которые вызывают значительную разность потенциалов. Заряженный слой примесей перемещается вместе с нижней границей молодого льда и излучает электромагнитные волны. Благодаря этому процесс кристаллизации можно наблюдать в деталях. Так, кристалл, растущий в длину в виде иголки, излучает иначе, чем покрывающийся боковыми отростками, а излучение растущих зерен отличается от того, что возникает, когда кристаллы трескаются. По форме, последовательности, частоте и амплитуде импульсов излучения можно определить, с какой скоростью замерзает лед и какая при этом формируется ледовая структура.
Но самое удивительное в структуре льда заключается в том, что молекулы воды при низких температурах и высоких давлениях внутри углеродных нанотрубок могут кристаллизоваться в форме двойной спирали, напоминающей молекулы ДНК. Это было доказано недавними компьютерными экспериментами американских учёных под руководством Сяо Чэн Цзэна из Университете штата Небраска (США). Чтобы вода сформировала спираль в моделируемом эксперименте она помещалась в нанотрубки диаметром от 1,35 до 1,90 нм под высоким давлением, варьирующимися от 10 до 40000 атмосфер и задавалась температура –23 °C [9]. Ожидалось увидеть, что вода во всех случаях образует тонкую трубчатую структуру. Однако, модель показала, что при диаметре нанотрубки в 1,35 нм и внешнем давлении 40000 атмосфер водородные связи в структуре льда искривились, что привело к образованию спирали с двойной стенкой – внутренней и внешней. Внутренняя стенка в этих условиях оказалась скрученной в четверо спиралью, а внешняя стенка состояла из четырёх двойных спиралей, похожих на молекулу ДНК (рис. 2). Данный факт может служить подтверждением связи структуры жизненно-важной молекулы ДНК со структурой самой воды и что вода служила матрицей для синтеза молекул ДНК.

Водородная связь имеет важное значение в химии межмолекулярных взаимодействий и обусловлена слабыми электростатическими силами и донорно-акцепторными взаимодействиями [13]. Она возникает при взаимодействии электронодефицитного электронами атома водорода одной молекулы воды с неподеленной электронной парой атома кислорода соседней молекулы воды (О-Н…О). Отличительной особенностью водородной связи является сравнительно низкая прочность; она в 5-10 раз слабее химической ковалентной связи [14]. По энергии водородная связь занимает промежуточное положение между химической связью и ван-дер-ваальсовыми взаимодействиями, удерживающими молекулы в твердой или жидкой фазе [15]. Каждая молекула воды в кристалле льда может одновременно образовывать четыре водородные связи с другими соседними молекулами под строго определенными углами, равными 109°47′, направленных к вершинам тетраэдра, которые не позволяют при замерзании воды создавать плотную структуру (рис. 3). В структурах льда I, Ic, VII и VIII этот тетраэдр правильный. В структурах льда II, III, V и VI тетраэдры заметно искажены [16]. В структурах льда VI, VII и VIII можно выделить две взаимоперекрещивающиеся системы водородных связей. Этот невидимый каркас из водородных связей располагает молекулы воды в виде сетчатой сетки, по структуре напоминающей шестигранные соты с полыми внутренними каналами. Если лед нагреть, сетчатая структура разрушается: молекулы воды начинают проваливаться в пустоты сетки, приводя к более плотной структуре жидкости, — этим объясняется, почему вода тяжелее льда.

Лед, который образуется при атмосферном давлении и плавится при 0 °С, — самое привычное, но всё же до конца не изученное вещество. Многое в его структуре и свойствах выглядит необычно. В узлах кристаллической решетки льда атомы кислорода тетраэдров молекул воды выстроены упорядоченно, образуя правильные шестиугольники, наподобие шестигранных пчелиных сот, а атомы водорода занимают самые разные положения на соединяющих атомы кислорода водородных связях (рис. 4). Поэтому возможны шесть эквивалентных ориентаций молекул воды относительно их соседей. Часть из них исключается, поскольку нахождение одновременно двух протонов на одной водородной связи маловероятно, но остаётся достаточная неопределённость в ориентации молекул воды. Такое поведение атомов нетипично, поскольку в твердом веществе все атомы подчиняются одному закону: либо они атомы расположены упорядоченно, и тогда это — кристалл, либо случайно, и тогда это — аморфное вещество. Такая необычная структура может реализоваться в большинстве модификаций льда — Ih, III, V, VI и VII (и по-видимому в Ic) (табл. 3), а в структуре льда II, VIII и IX молекулы воды ориентационно упорядочены. По выражению Дж. Бернала лёд кристалличен в отношении атомов кислорода и стеклообразен в отношении атомов водорода.
Табл. 3. Некоторые модификации льда и их физические параметры.
.png)
_(Thaumcraft_5).png)
.png)