Как убрать инсулинорезистентность
Как убрать инсулинорезистентность
Инсулинорезистентность: профилактика, питание и лечение
В статье мы расскажем:
Что такое инсулин и инсулинорезистентность
Инсулин — гормон белковой природы, секретируемый бета-клетками поджелудочной железы. Это своеобразный полицейский, осуществляющий строгий надзор за уровнем глюкозы в крови и при её повышении включающий разнообразные механизмы и способы возвращения к изначальной точке — то есть к физиологическим, оптимальным для функционирования органов значениям.
Инсулин, вопреки распространенному ошибочному пониманию, не транспортирует на себе глюкозу — он, в принципе, ничего и никого не переносит. Механизм его действия несколько иной: так, например, в жировой ткани и в мышцах он способствует перемещению специфического транспортера GLUT 4 из цитоплазмы (то есть внутренней среды, взвеси клетки, в которой «плавают» органеллы и ядро) в мембрану.
Итак, задача данного гормона — загнать непослушную глюкозу в клетку. Однако только этим она не ограничивается, учитывая, насколько свободно и легко этот моносахарид может вернуться обратно в кровь — именно поэтому он задействует различные пути её утилизации (в частности, синтез гликогена).
Впрочем, клетки и сами могут образовывать столь любимый и относительно легко метаболизируемый ими субстрат — за счет глюконеогенеза. Это биохимический процесс, заключающийся в синтезе глюкозы из различных НЕуглеводных компонентов, которыми могут быть кетокислоты и даже аминокислоты. Это несколько увеличивает спектр функций инсулина — ведь теперь ему, снизив концентрацию глюкозы в крови, необходимо предотвратить её повторное повышение — уже не по причине приема пищи, а из-за её внутриклеточной продукции.
Таким образом, данный гормон тормозит липолиз (процесс расщепления жира) и катаболизм (распад) белков, стимулируя наоборот захват аминокислот клетками, а также образование протеинов и липидов.
В основе всех действий инсулина, как, впрочем, и большинства биологически активных веществ лежит взаимодействие между ним и рецепторами клеток, что опосредует ряд сигнальных реакций. Вы не можете прийти в чужой дом без приглашения — так и он не может самовольно отправить глюкозу внутрь клетки.
В целом, процессы протекают размеренно и ровно — по меньшей мере до тех пор, пока рецепторы отвечают инсулину. Однако, чем чаще и дольше циркулирует он в крови, тем менее восприимчивы становятся они — наши клетки капризны, им попросту надоедает этот гормон с его однотипной, зазубренной на память схемой взаимодействия. Возникает такое патологическое состояние как ИНСУЛИНОРЕЗИСТЕНТНОСТЬ — когда поджелудочная железа свою работу по продукции гормонов выполняет ответственно и тщательно, но рецепторы попросту становятся резистентными. Теперь глюкоза попасть внутрь клетки не может.
Частое, дробное питание — на каждое поступление пищи (а точнее на белки и углеводы) выделяется клетками поджелудочной железы инсулин. И неважно, это будет конфета, яблоко или полноценный завтрак — ответ будет один: в виде секреции данного гормона.
Недостаточная физическая активность — умеренная нагрузка повышает чувствительность рецепторов к инсулину (и даже, по некоторым данным способствует синтезу новых!).
Избыточное потребление быстрых углеводов — да, и такие простые сахара, как глюкоза с фруктозой, и полисахариды (гликоген, крахмал и др) вызывают секрецию инсулина. Вот только разница заключается в том, что сложные углеводы повышают уровень сахара в крови медленно — и таким же плавным будет его последующий спад.
Полиморфизмы в генах. Конечно, генетика далеко не всегда занимает лидирующее место в списке причин заболеваний, но её роль, тем не менее, оспаривать не приходится. На сегодняшний день известны несколько генов, нарушения в которых («поломки» иными словами) могут приводить к ожирению и диабету — разумеется, в благоприятных при этом условиях (таких как отсутствие рациональной, правильно подобранной диеты, триггеры в виде стресса и хронических заболеваний, малоподвижный образ жизни).
Ген FTO (fat mass and obesity associated) влияет на метаболические процессы в целом путем экспрессии в ответственных за энергообмен структурах головного мозга специфического белкового соединения.
В многочисленных исследованиях полиморфизм данного гена ассоциировался с избыточной массой тела, увеличением окружности бедер и талии, а также общей величины жировой массы.
Ген KCNQ1 — кодирует органическое соединение, экспрессируемое также в клетках островков Лангерганса поджелудочной железы и участвует тем самым в контроле за секрецией инсулина. Его полиморфизм ассоциирован с повышенным риском развития сахарного диабета 2-ого типа.
Ген TCF7L2 — косвенно регулирует экспрессию глюкагон-подобного пептида 1 (с подобным инсулину действием) в клетках кишечника; он также отмечается в клетках сердца, нервной ткани мозга, сердце и в поджелудочной железе.
Гены IRS-1 и IRS-2 — мутации в них приводят к развитию инсулинорезистентности и гипофункции бета клеток поджелудочной железы.
Недосыпание и отсутствие нормальной гигиены сна. Гормоны голода и насыщения (лептин и грелин), соматотропный гормон (гормон роста, известный своим жиросжигающим эффектом), ТТГ (тиреотропный гормон), кортизол и мелатонин во многом привязаны к циклам “сон-бодрствование”.
Различные источники приводят, в среднем, такую неутешительную статистику: 35% и более взрослого населения всего мира спят менее 7 часов в день, а за последние десятилетия общая продолжительность сна сократилась, в целом, на 1.5-2 часа.
Интересно, что ограничение сна до 5.5 часов в течение 2х недель ассоциировалось со снижением уровня ТТГ и свободного тироксина — а гормонам щитовидной железы, как известно, отдается центральная роль в метаболизме.
Нарушения в цикле “сон-бодрствование” сопровождаются также снижением продукции жировой тканью лептина, воздействующего на центры насыщения в гипоталамусе (одной из ведущих структур головного мозга) и тем самым подавляющего аппетит — всё потому, что ночью его уровень возрастает на 30%. Есть статистические данные, которые отмечают, что люди, работающие посменно, более подвержены риску ожирения, заболеваний сердечно-сосудистой системы и сахарному диабету 2-го типа.
Хронический стресс — гормоны коры и мозгового вещества надпочечников, выделяемые при действии неблагоприятных, опасных факторов, стимулируют повышение уровня глюкозы в крови: ведь нужны силы, энергия, что убегать или сражаться. Так, например, кортизол отвечает за образование ключевых ферментов глюконеогенеза, уже упомянутого ранее; он также снижает чувствительность рецепторов к инсулину.
К инсулинорезистентности также могут приводить:
аномальная структура инсулина;
нарушение количества или снижение чувствительности рецепторов;
нарушение передачи внутриклеточного сигнала;
сбой в механизмах транспорта глюкозы.
Симптомы инсулинорезистентности
Постоянное ощущение голода и желание перекусить — с одной стороны, это опосредовано потерей рецепторами чувствительности к глюкозе — она просто НЕ МОЖЕТ зайти в клетки и остаётся в крови. С другой стороны, инсулинорезистентность, как правило, сопровождает ЛЕПТИНОРЕЗИСТЕНТНОСТЬ — в сущности, их механизмы похожи между собой.
Лептин — гормон белковой природы, кодируемый ob геном, регулирует пищевое поведение. Нарушение его функций связано с полиморфизмами данного гена, а также сбоями в его транспорте в нервную ткань мозга (то есть пересечением контрольной границы — гематоэнцефалического барьера), потерей чувствительности лептиновых рецепторов или неполадками в проведении от них внутриклеточных сигналов.
Впрочем, необходимо ответить, что мутации в ob гене встречаются крайне редко — как и изменения в структурах генов, кодирующих лептиновые рецепторы.
Гораздо более значимым фактором является нарушение транспортировки данного гормона через гематоэнцефалический барьер (преграду между циркулирующей по сосудам кровью и нервной тканью мозга, придающей последней определенную избирательность в плане проницаемости питательных веществ) — а возникает это при повышенном содержании (более 25-30 нг/мл) лептина в сыворотке крови — при подобных высоких концентрациях уровень лептина в спинномозговой жидкости, а также непосредственно в ткани мозга перестает возрастать.
К тому же отмечается, что постоянная циркуляция лептина приводит к уменьшению числа рецепторов к нему — в частности, в гипоталамусе. Это называется “лептин-индуцированной лептинорезистентностью”.
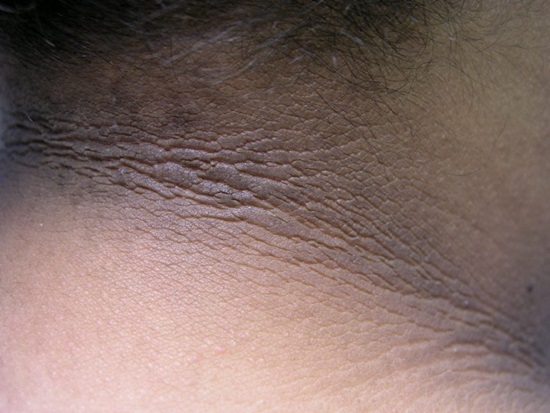
Acantosis nigricans или потемнение кожи в местах трения и складок (в области подмышечных впадин и паха, на сгибах локтевых суставов; “эффект грязной шеи”).
Акне, жирная кожа, избыточный рост волос по мужскому типу, ановуляция и бесплодие — всё это характерный букет гиперандрогении, встречаемый при синдроме поликистозных яичников (СПКЯ).
В патогенезе СПКЯ до сих пор центральное место занимает инсулиновая теория. В частности, показано, что инсулин снижает выработку в печени глобулина, связывающего половые гормоны (ГСПГ), тем самым повышая в крови фракцию свободных, АКТИВНЫХ андрогенов, стимулирующих, скажем, выработку кожного сала (что приводит к развитию угревой сыпи).
Кроме того, жировая ткань, избыток которой сопровождает, как правило, любое нарушение со стороны углеводного обмена, стимулирует повышение активности 17-бета-стероид-дегидрогеназы — фермента, катализирующего образование тестостерона.
Отечность — возникает из-за выведения калия и задержки в организме натрия, хвостом тянущего за собой молекулы воды.
Снижение текучести желчи вследствие повышения уровня липидов и холестерина — возрастает риск развития желчнокаменной болезни.
Повышение артериального давления — отчасти опосредовано задержкой натрия, приводящей, соответственно, и к задержке воды и, как следствие, — повышению объема циркулирующей крови; отчасти — потерей магния.
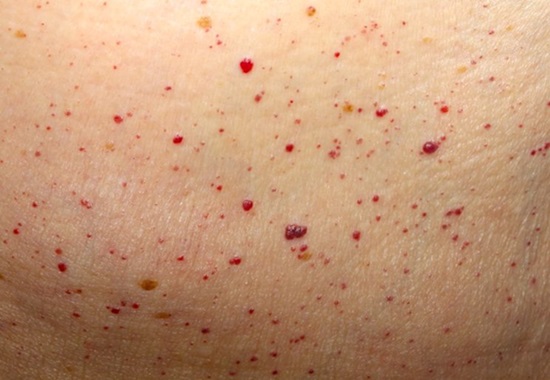
“Красные точки” или сосудистые ангиомы — еще одно яркое проявление нарушения чувствительности клеток к инсулину.
Появление папиллом вследствие избыточного деления эпителиальных клеток. Это и неудивительно, учитывая природу и биологическую роль инсулина — гормона синтеза (анаболизма). На нём, как на дрожжах растёт всё: от раковых клеток до мышц.
Синдром избыточного бактериального роста (СИБР) — патогенная микрофлора обожает глюкозу, и её повышенная концентрация в крови — идеальные условия для активного размножения и увеличения численности их колоний.
Признаки СИБРа достаточно неспецифичны и проявляются, как правило, следующими симптомами:
слабость, усталость, отсутствие сил;
урчание в животе.
Не менее активно растут и грибки — наблюдается кандидоз, проявления которого в значительной степени зависят от локализации патологического процесса (так, встречается кандидоз ротовой полости, кишечника, а также половых органов, сопровождающийся характерными творожистыми выделениями и сильным зудом).
Андрогенная алопеция или потеря волос в типичных мужских областях (затылок и виски) — как правило один из симптомов СПКЯ. Возникает за счёт стимуляции инсулином активности 5-альфа-редуктазы — фермента, катализирующего трансформацию тестостерона в метаболически гораздо более активный ДИГИДРОТЕСТОСТЕРОН.
Вспышки агрессии — из-за резкого падения концентраций глюкозы в крови.
Виды инсулинорезистентности
Физиологическая — возникает в период полового созревания, беременности, менопаузе, а также в условиях гипоксии, дефицита железа и малоподвижного образа жизни.
Патологическая — вызвана образом жизни и питания.
Кроме того, инсулинорезистентность может сопровождать многие эндокринные заболевания: тиреотоксикоз, гипотиреоз, синдром Кушинга (при котором наблюдается избыточное образование гипофизом АКТГ — адренокортикотропного гормона), феохромоцитома (опухоль надпочечников, автономно выделяющая адреналин и норадреналин). Она также сопровождает повышение концентрации мочевой кислоты (гиперурикемию), способную впоследствии привести к подагре, ревматоидный артрит, сердечную недостаточность, а также цирроз печени.
Диагностика инсулинорезистентности
Окружность талии более 80 см для женщин и более 90 см для мужчин.
Индекс массы тела >25.
Концентрация инсулина натощак > 6 ммоль/л.
Глюкоза натощак >5 ммоль/л.
Гликированный гемоглобин >6%.
Триглицериды >1.7 ммоль/л.
Липопротеины высокой плотности (ЛПВП) 3 ммоль/л.
Дополнительно рекомендуем проверить следующие показатели на наличие сопутствующих патологий:
Мочевую кислоту (повышенное потребление фруктозы часто ассоциировано с увеличением содержания мочевой кислоты и развитием подагры).
Гомоцистеин (при СПКЯ обычно наблюдается дефицит витаминов группы В, что приводит к повышению уровня гомоцистеина в сыворотке).
Кортизол в суточной моче.
Панель щитовидной железы: ТТГ, Т4 св., Т3 св., антитела к тиреопероксидазе и тиреоглобулину.
АЛТ, АСТ, щелочную фосфатазу, фракции билирубина.
Узи органов брюшной полости, молочных желез, а также надпочечников.
Осложнения и последствия инсулинорезистентности
Инсулинорезистентность — последняя, ключевая ступень в развитии сахарного диабета 2-го типа. Важно также понимать, что поджелудочная железа начинает компенсаторно начинает вырабатывать всё больше и больше инсулина — чтобы его лавинообразный поток хоть как-то да заставил глюкозу протиснуться внутрь клеток, пройти через их закрытые двери. Вот только её ресурсы и возможности далеко не бесконечны — со временем происходит и её истощение. И тогда пациентам приходится прибегнуть к инсулиновой игле.
При сахарном диабета, причем как 1-ого, так и 2-ого типов, отмечается снижение когнитивных функций, а риск деменции повышается аж на 50%!
Больные, как правило, страдают от микроциркуляторных нарушений, ожирения, дислипидемии и гипертонии.
Инсулинорезистентность и синдром поликистозных яичников (СПКЯ) — неразлучные спутники по жизни, взаимодополняющие друг друга в контексте развития метаболических нарушений. Статистика показывает: у больных сахарном диабетом 2-го типа СПКЯ встречается в 1.5-2 раза чаще, чем у женщин, не имеющих подобной патологии.
Интересно, что вирус гепатита С способен непосредственно влиять на запускаемый инсулином каскад сигнальных процессов — примечательно, что инсулинорезистентность была выявлена у 32.4% лиц, страдающих от хронического течения этого заболевания.
Питание при инсулинорезистентности
Необходим переход на 3х-разовый рацион. Исключение составляют пациенты с надпочечниковой недостаточностью, заболеваниями ЖКТ в стадии обострения и профессиональные спортсмены — им как раз и показаны перекусы с дробным питанием.
Высокожировая, умеренно белковая и низкоуглеводная диета, причем основу рациона должны составлять продукты с низким гликемическим индексом.
ГЛИКЕМИЧЕСКИЙ ИНДЕКС — показатель, отражающий насколько изменится концентрация глюкозы в крови после употребления того или иного продукта.
Необходимо исключить следующие продукты:
рафинированный сахар в чистом виде или в составе конфет, вафель, тортов;
овсяную, перловую, кукурузную и манную каши;
соусы (майонез, кетчуп) и магазинные заправки;
безалкогольные напитки (лимонады, пакетированные соки, мохито, газировку);
чипсы, сухарики, картошку фри и гамбургеры;
готовые блюда из кулинарии;
Рекомендуется рассмотреть палео-диету или другие низкоуглеводные протоколы. В частности, рацион должен содержать:
мясо — предпочтительно курицу или индейку (красное рекомендовано ограничить);
жирная морская рыба (можно и речную, но помните о необходимости тщательного осмотра мышечных волокон и длительного приготовления по причине высокой степени инвазии паразитическими червями);
орехи — за исключением арахиса (высокоаллергенный и заражен, как правило, плесенью) и кешью (содержит достаточно много углеводов в составе);
безглютеновые крупы: киноа, зеленая гречка, бурый рис;
печень трески и другие источники жиров;
в качестве подсластителей допустим в умеренных количествах эритрит.
Соблюдайте “голодные” промежутки не менее 4-5 часов — помните, что на любое поступление пищи поджелудочная железа будет выделять инсулин, чувствительность к которому и без того нарушена.
Лечение инсулинорезистентности
Медикаментозное — препаратом “Метформин” ( назначается строго врачом!). Как правило, показателями для его использования будет сахарный диабет 2-го типа и/или индекс массы тела более 35.
Биологически активными добавками (немедикаментозное) — условно можно поделить на две категории: направленное на восполнение дефицитов и на коррекцию углеводного обмена.



В целом, рекомендуем рассмотреть приём:
Берберина (500 мг 2-3 раза в день до еды, курс- 3-6 месяцев) — обладает желчегонным эффектом, снижает холестерин и нормализует липидный профиль.
Кроме того, исследования показали его защитную функцию в отношении сердечно-сосудистой системы — в частности, у крыс, страдающих от диабета, он предохранял клетки миокарда от апоптоза (само запрограммированной гибели).
Одна из важных функций инсулина — выработка оксида азота, приводящая к расширению просвета сосудов, усилению кровотока и, вследствие этого, повышению утилизации глюкозы в тканях-мишенях, — нарушена в условиях развития инсулинорезистентности и сахарного диабета 2-го типа. Однако, у животных лечение берберином усиливало этот инсулин-индуцированный вазорелаксантный эффект.
Магния (400-800 мг) — препятствует повышению артериального давления и появлению отеков, обладает аналгезивным эффектом.
Хрома (200 мкг/3 раза) — улучшает чувствительность клеточных рецепторов к инсулину, а также снижает тягу к сладкому.
Однако стоит учитывать, что неорганические формы этого металла достаточно токсичны и имеют низкую скорость всасывания. Именно поэтому в качестве биологических добавок обычно используются его органические соединения: хром пиколинат, никотинат хрома и малат хрома.
Миоинозитол — рекомендован при лечении СПКЯ. Улучшает качество половых клеток, нормализует чувствительность тканей к инсулину, предотвращает развитие внутриутробных пороков у плода. (Пропивать курсами, 3-4 гр/сутки).
Таурин (1000 мг 2 раза в день натощак) — снижает уровень инсулина в сыворотке, препятствует повышению артериального давления. Показан при проблемах с желчеоттоком.
Омега-3 полиненасыщенные жирный кислоты (ПНЖК) — эйкозапентаеновая и докозагексаеновая кислоты (EPA и DHA) — показали противовоспалительное, антитромботическое свойства, а также положительное воздействия на функции почек — особенно в контексте сопровождаемых диабет патологий с их стороны (включая нефропатию, поликистоз почек и другое). В частности, высокое потребление EPA и DHA было связано с более низкими рисками протеинурии (наличие белка в моче).
Ученые также отмечают: комбинированная терапия омега-3 ПНЖК и витамином Д3 хорошо переносилась и оказывала значительные благоприятные эффекты на функцию бета клеток, производящих инсулин, у пациентов с сахарным диабетом 1-го типа. Кроме того, добавления омега-3 ассоциировалось и с увеличением уровней циркулирующего в крови кальциферола.
Цинка (15-20 мг) — минерала, необходимого для нормальной функциональной активности многих антиоксидантных ферментов: супероксиддисмутазы и каталазы. Его дефицит приводит к окислению бета клеток поджелудочной железы и развитию оксидативного стресса, к которому они и без того склонны, учитывая большое количеств образуемых ими активных форм кислорода.
Исследование 82 000 американок опубликовало впечатляющие результаты: низкое потребление цинка ассоциировано с увеличением риска развития диабета на 17%.
Тягу к сладкому снижают:
Интервальное голодание при инсулинорезистентности
Интервальное голодание — режим питания, заключающийся в соблюдении определенных “голодных” промежутков, количество которых напрямую зависит от выбранной системы. Так, наибольшей популярностью пользуется именно 16/8 — то есть полный отказ от пищи в течение 16 часов (включающих также сон) и окно из 8 часов, в течение которого можно поесть (как правило, это два, реже — три приёма).
Об интервальном голодании сейчас говорят всё чаще и больше — но обычно в контексте аутофагии (то есть деградацией старых/ненужных/больных клеток и/или их компонентов). Однако немалую роль оно вносит в коррекцию метаболических нарушений.
У лабораторных крыс, придерживающихся дневного голодания и ограниченного по времени кормления, наблюдались следующие благоприятные эффекты:
снижение уровней лептина и инсулина;
уменьшение жировых отложений (особенно висцеральных);
повышенный уровень кетонов (и их использование в качестве источника энергии);
снижение частоты сердечных сокращений и, как следствие, артериального давления в состоянии покоя;
повышение тонуса Парасимпатической нервной системы;
сохранение мышечной массы.
Интервальное голодание на животных моделях замедляло развитие нейродегенеративных расстройств — в частности, болезней Альцгеймера, Паркинсона, Хантингтона.
Кроме того, такая система питания увеличивает устойчивость всего организма к стрессовым факторам и распространенным заболеваниям, возникающим в реалиях современного мира с его малоподвижным образом жизни.
Тем не менее, мы не рекомендуем без консультации специалиста по питанию придерживаться интервального голодания пациентам с хронической усталостью надпочечников, заболеваниями ЖКТ в состоянии обострения, нарушением желчеоттока, гипогликемией и тяжелыми физическими нагрузками.
Профилактика инсулинорезистентности
Достаточная физическая активность. Инсулинорезистентность, как и сахарный диабет 2-го типа, — заболевание образа жизни, что поддается коррекции — главное, комплексный подход.
Можно всю жизнь сидеть на “Метформине”, но, не поменяв пищевые привычки и не добавив умеренную физическую нагрузку, так и не увидеть улучшений в лабораторных и функциональных анализах.
Нет времени на 10 000 шагов в день? Начните с малого — Рим тоже не за сутки был построен. Выходите на несколько остановок раньше, чтобы неспешно пройтись на работу пешком; поднимайтесь по лестнице — забудьте о существовании слова “лифт”; выходите на вечерние прогулки с детьми, друзьями и родителями — еще и бонусом засыпать будете быстрее.
Придерживайтесь интервального голодания — самой простой системой, не требующей особых усилий станет 12/12. Так, скажем, если вы поужинаете в 7 вечера, то уже в 7 утра сможете позавтракать. Кроме того, такой режим позволит вам легко отказаться от перекусов и перейти на 3х-разовый рацион.
Любите смузи? Замените сладкие фрукты в них на ягоды, добавьте щедрый пучок зелени и горсть семечек — и наслаждайтесь зеленым коктейлем молодости и красоты.
Ограничьте продукты с высоким инсулиновым индексом (такие как красное мясо и творог) — они вызывают усиленную секрецию инсулина, хотя часто и не влияют на мгновенные подъёмы уровня сахара в крови.
Работайте со стрессоустойчивостью. Не можете полностью ограничить неблагоприятные факторы? Тогда поменяйте фокус зрения и своё отношение к ним!
Занимайтесь йогой, дыхательными практиками и пилатесом — повышение тонуса Парасимпатической системы — ключевой момент в работе с пищеварительной системой и её заболеваниями.
Материал основан на исследованиях:
Рекомендации для вас
Автономная некоммерческая организация нутрициологов и коучей по здоровью
109457, Россия, г. Москва, ул Жигулевская, д 1/24, корп 1, оф6, info@dietolognata.ru
2022 © ВСЕ ПРАВА ЗАЩИЩЕНЫ
Мы в социальных сетях
Настоящая Политика конфиденциальности персональных данных (далее — Политика конфиденциальности) действует в отношении всей информации, которую данный сайт, на котором размещен текст этой Политики конфиденциальности, может получить о Пользователе, а также любых программ и продуктов, размещенных на нем.
1. Определение терминов
1.1 В настоящей Политике конфиденциальности используются следующие термины:
1.1.1. «Администрация сайта» – уполномоченные сотрудники на управления сайтом, действующие от его имени, которые организуют и (или) осуществляет обработку персональных данных, а также определяет цели обработки персональных данных, состав персональных данных, подлежащих обработке, действия (операции), совершаемые с персональными данными.
1.1.2. «Персональные данные» — любая информация, относящаяся к прямо или косвенно определенному или определяемому физическому лицу (субъекту персональных данных).
1.1.3. «Обработка персональных данных» — любое действие (операция) или совокупность действий (операций), совершаемых с использованием средств автоматизации или без использования таких средств с персональными данными, включая сбор, запись, систематизацию, накопление, хранение, уточнение (обновление, изменение), извлечение, использование, передачу (распространение, предоставление, доступ), обезличивание, блокирование, удаление, уничтожение персональных данных.
1.1.4. «Конфиденциальность персональных данных» — обязательное для соблюдения Администрацией сайта требование не допускать их умышленного распространения без согласия субъекта персональных данных или наличия иного законного основания.
1.1.5. «Пользователь сайта (далее Пользователь)» – лицо, имеющее доступ к сайту, посредством сети Интернет и использующее данный сайт для своих целей.
1.1.6. «Cookies» — небольшой фрагмент данных, отправленный веб-сервером и хранимый на компьютере пользователя, который веб-клиент или веб-браузер каждый раз пересылает веб-серверу в HTTP-запросе при попытке открыть страницу соответствующего сайта.
1.1.7. «IP-адрес» — уникальный сетевой адрес узла в компьютерной сети, построенной по протоколу IP.
2. Общие положения
2.1. Использование Пользователем сайта означает согласие с настоящей Политикой конфиденциальности и условиями обработки персональных данных Пользователя.
2.2. В случае несогласия с условиями Политики конфиденциальности Пользователь должен прекратить использование сайта.
2.3.Настоящая Политика конфиденциальности применяется только к данному сайту. Администрация сайта не контролирует и не несет ответственность за сайты третьих лиц, на которые Пользователь может перейти по ссылкам, доступным на данном сайте.
2.4. Администрация сайта не проверяет достоверность персональных данных, предоставляемых Пользователем сайта.
3. Предмет политики конфиденциальности
3.1. Настоящая Политика конфиденциальности устанавливает обязательства Администрации сайта по умышленному неразглашению персональных данных, которые Пользователь предоставляет по разнообразным запросам Администрации сайта (например, при регистрации на сайте, оформлении заказа, подписки на уведомления и т.п).
3.2. Персональные данные, разрешённые к обработке в рамках настоящей Политики конфиденциальности, предоставляются Пользователем путём заполнения специальных форм на Сайте и обычно включают в себя следующую информацию:
3.2.1. Имя Пользователя;
3.2.2. Контактный телефон Пользователя;
3.2.3. Адрес электронной почты (e-mail);
3.3. Администрация сайта также принимает усилия по защите Персональных данных, которые автоматически передаются в процессе посещения страниц сайта: IP адрес; информация из cookies; информация о браузере (или иной программе, которая осуществляет доступ к сайту); время доступа; посещенные адреса страниц; реферер (адрес предыдущей страницы) и т.п.
3.3.1. Отключение cookies может повлечь невозможность доступа к сайту.
3.3.2. Сайт осуществляет сбор статистики об IP-адресах своих посетителей. Данная информация используется с целью выявления и решения технических проблем, для контроля корректности проводимых операций.
3.4. Любая иная персональная информация не оговоренная выше (история покупок, используемые браузеры и операционные системы и т.д.) не подлежит умышленному разглашению, за исключением случаев, предусмотренных в п.п. 5.2. и 5.3. настоящей Политики конфиденциальности.
4. Цели сбора персональной информации пользователя
4.1. Персональные данные Пользователя Администрация сайта может использовать в целях:
4.1.1. Установления с Пользователем обратной связи, включая направление уведомлений, запросов, касающихся использования сайта, оказания услуг, обработка запросов и заявок от Пользователя.
4.1.2. Подтверждения достоверности и полноты персональных данных, предоставленных Пользователем.
4.1.3. Уведомления Пользователя сайта о состоянии Заказа.
4.1.4. Предоставления Пользователю эффективной клиентской и технической поддержки при возникновении проблем связанных с использованием сайта.
5. Способы и сроки обработки персональной информации
5.1. Обработка персональных данных Пользователя осуществляется без ограничения срока, любым законным способом, в том числе в информационных системах персональных данных с использованием средств автоматизации или без использования таких средств.
5.2. Пользователь соглашается с тем, что Администрация сайта вправе передавать персональные данные третьим лицам, в частности, курьерским службам, организациями почтовой связи, операторам электросвязи, исключительно в целях выполнения заявок Пользователя.
5.3. Персональные данные Пользователя могут быть переданы уполномоченным органам государственной власти только по основаниям и в порядке, установленным действующим законодательством.
6. Обязательства сторон
6.1. Пользователь обязуется:
6.1.1. Предоставить корректную и правдивую информацию о персональных данных, необходимую для пользования сайтом.
6.1.2. Обновить или дополнить предоставленную информацию о персональных данных в случае изменения данной информации.
6.1.3. Принимать меры для защиты доступа к своим конфиденциальным данным, хранящимся на сайте.
6.2. Администрация сайта обязуется:
6.2.1. Использовать полученную информацию исключительно для целей, указанных в п. 4 настоящей Политики конфиденциальности.
6.2.2. Не разглашать персональных данных Пользователя, за исключением п.п. 5.2. и 5.3. настоящей Политики Конфиденциальности.
6.2.3. Осуществить блокирование персональных данных, относящихся к соответствующему Пользователю, с момента обращения или запроса Пользователя или его законного представителя либо уполномоченного органа по защите прав субъектов персональных данных на период проверки, в случае выявления неправомерных действий.
7. Ответственность сторон
7.1. Администрация сайта несёт ответственность за умышленное разглашение Персональных данных Пользователя в соответствии с действующим законодательством, за исключением случаев, предусмотренных п.п. 5.2., 5.3. и 7.2. настоящей Политики Конфиденциальности.
7.2. В случае утраты или разглашения Персональных данных Администрация сайта не несёт ответственность, если данная конфиденциальная информация:
7.2.1. Стала публичным достоянием до её утраты или разглашения.
7.2.2. Была получена от третьей стороны до момента её получения Администрацией сайта.
7.2.3. Была получена третьими лицами путем несанкционированного доступа к файлам сайта.
7.2.4. Была разглашена с согласия Пользователя.
7.3. Пользователь несет ответственность за правомерность, корректность и правдивость предоставленной Персональных данных в соответствии с действующим законодательством.
8. Разрешение споров
8.1. До обращения в суд с иском по спорам, возникающим из отношений между Пользователем сайта и Администрацией сайта, обязательным является предъявление претензии (письменного предложения о добровольном урегулировании спора).
8.3. При недостижении соглашения спор будет передан на рассмотрение в судебный орган в соответствии с действующим законодательством.
8.4. К настоящей Политике конфиденциальности и отношениям между Пользователем и Администрацией сайта применяется действующее законодательство.
9. Дополнительные условия
9.1. Администрация сайта вправе вносить изменения в настоящую Политику конфиденциальности без согласия Пользователя.
9.2. Новая Политика конфиденциальности вступает в силу с момента ее размещения на Сайте, если иное не предусмотрено новой редакцией Политики конфиденциальности.
Пути коррекции инсулинорезистентности и метаболического синдрома при СД 2 типа. Роль Сиофора
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Метаболический синдром является одной из наиболее приоритетных и социально значимых проблем медицины, к которой приковано внимание широкого круга специалистов: эндокринологов, кардиологов, терапевтов и др. Это связано с высокой распространенностью и прогрессированием данного синдрома во всех странах мира, в том числе и в России. Количество больных с метаболическим синдромом, по данным разных авторов, составляет 14–35% среди взрослого населения и растет даже среди детей и подростков, причем достоверно чаще встречается у мужчин, чем у женщин.
На протяжении всего ХХ века многие ученые обращали внимание на частое сочетание и взаимосвязь ряда заболеваний, таких как ожирение, нарушение углеводного и липидного обмена, распространенного атеросклероза, артериальной гипертензии, ишемической болезни сердца, приводящих к высокой смертности, но только американский ученый G. Reaven в своей Бантингской лекции в 1988 г., обобщив данные многочисленных клинических и научных наблюдений, предложил считать все эти нарушения не сочетанием различных заболеваний и факторов риска, а единой болезнью, которую он назвал «Синдромом Х» [1].
Согласно гипотезе G. Reaven, сочетание артериальной гипертонии, гипертриглицеридемии, низкого уровня холестерина липопротеидов высокой плотности и нарушения толерантности к глюкозе (вплоть до развития сахарного диабета) носит не случайный, а закономерный характер. В основе патогенеза метаболических нарушений, согласно теории G. Reaven, лежит инсулинорезистентность (снижение чувствительности к инсулину периферических тканей) и возникающая в ответ гиперинсулинемия, которая является самостоятельным фактором риска быстрого развития атеросклероза, а при истощении резервов инсулина – и сахарного диабета 2 типа.
По мере накопления новых научных данных выявлялось все больше симптомов и различных обменных нарушений, появлялись новые названия Синдрома Х: «Смертельный квартет» [Kaplan J., 1989], «Синдром Нового мира», «Синдром инсулинорезистентности» [Haffner S.,1992], «Смертельный секстет» [Enzi G., 1994], «Метаболический сосудистый синдром» [Hanefeld M., 1997] и др. В настоящее время наиболее часто используется термин «метаболический синдром».
Согласно резолюции Международной Федерации Диабета в состав метаболического синдрома входят следующие нарушения:
• абдоминальное/висцеральное ожирение;
• инсулинорезистентность/компенсаторная гиперинсулинемия;
• гипергликемия (нарушение толерантности к глюкозе и/или высокая гипергликемия натощак вплоть до развития сахарного диабета 2 типа);
• атерогенная дислипидемия (повышение в крови триглицеридов и липопротеидов низкой и очень низкой плотности при снижении холестерина липопротеидов высокой плотности);
• артериальная гипертония;
• нарушение системы гемостаза: гиперкоагуляция за счет увеличения концентрации фибриногена и снижения фибринолитической активности крови;
• гиперурикемия/подагра;
• хроническое субклиническое воспаление (увеличение уровня С–реактивного белка и других воспалительных цитокинов).
Не случайно абдоминальное ожирение поставлено на первое место. Жировая ткань является эндокринным органом, секретирующим значительное количество гормонов, которые напрямую или опосредованно влияют на инсулинорезистентность и скорость прогрессирования атеросклероза и сосудистых осложнений сахарного диабета.
Многочисленные научные исследования показали тесную связь абдоминального ожирения с инсулинорезистентностью [2] и другими гормональными и метаболическими нарушениями (в частности, гиперурикемией), которые являются факторами риска развития сахарного диабета 2 типа и атеросклеротических, сердечно–сосудистых и дисметаболических заболеваний, сочетание которых многократно ускоряет их развитие и прогрессирование, приводя к ухудшению качества жизни больных и высокой смертности. Более 75% пациентов с сахарным диабетом и метаболическим синдромом погибают от сердечно–сосудистых катастроф (инсульта, инфаркта, сердечной недостаточности, гангрены).
По данным литературы, при метаболическом синдроме развитие ишемической болезни сердца (ИБС) в 3–4 раза выше, смертность от ИБС – в 3 раза выше, от ишемического инсульта – в 2 раза выше, и все причины смерти в 2 раза выше, чем среди населения в целом [3].
Несмотря на то что теория развития метаболического синдрома в последние 10–15 лет претерпела определенные изменения, роль инсулинорезистентности как пускового механизма патогенеза метаболических нарушений и сахарного диабета остается неоспоримой.
Согласно классификации ВОЗ (1999 г.), к основным критериям метаболического синдрома относятся инсулинорезистентность и сахарный диабет 2 типа, а по классификации Ассоциации клинических эндокринологов [ACE, 2003 г.] эти состояния не разделяются, причем особое внимание уделяется уровню глюкозы натощак. Не менее важное значение, как показано в последние годы, имеет и уровень гликемии через 2 часа после еды, так как в состоянии постпрандиальной гипергликемии пациент с сахарным диабетом 2 типа находится более 13 часов в сутки. При наличии нарушений углеводного обмена распространенность метаболического синдрома значительно возрастает. Так, при нарушенной толерантности к глюкозе метаболический синдром имеется у 50%, а при сахарном диабете 2 типа – у 80% и более пациентов.
На рубеже тысячелетия распространенность сахарного диабета 2 типа приобрела характер «неинфекционной эпидемии». По данным ВОЗ, в настоящее время в мире насчитывается уже более 200 млн больных сахарным диабетом, а к 2025 г. их количество превысит 360 млн человек. Распространенность ранних нарушений углеводного обмена: нарушенной толерантности к глюкозе и нарушения гликемии натощак – в 2–3 раза выше. Второй, также быстро растущей «эпидемией» является ожирение.
Среди общего числа больных сахарным диабетом 85–90% составляют пациенты с сахарным диабетом 2 типа, который развивается обычно при генетической предрасположенности у лиц старше 40–60 лет с избыточной массой тела, ведущих малоподвижный образ жизни.
По определению ВОЗ, сахарный диабет – это группа обменных заболеваний, проявляющихся гипергликемией и возникающих в результате нарушения секреции инсулина, его действия или обоих этих факторов.
В основе патогенеза сахарного диабета 2 типа лежит снижение чувствительности периферических тканей к инсулину (инсулинорезистентность), постепенно прогрессирующее нарушение секреции инсулина и гиперпродукция глюкозы печенью.
Количество больных сахарным диабетом 2 типа увеличивается с возрастом и степенью развития ожирения. Так, у пациентов с ожирением 1 степени риск развития нарушений углеводного обмена и сахарного диабета 2 типа возрастает в 2–5 раз, при ожирении 2 степени – в 10 раз, а при ожирении 3 степени риск развития диабета возрастает в 30–40 раз.
Экономический прогресс, урбанизация жизни населения (компьютеры, автомобили, микроволновые печи, быстрая высококалорийная еда) способствуют развитию малоподвижного образа жизни, снижению физической активности и развитию ожирения, которое ведет к инсулинорезистентности.
Инсулинорезистентность – это снижение чувствительности к инсулину периферических тканей, прежде всего мышц, которые составляют основную массу организма человека. Работающие мышцы активно поглощают глюкозу, снижая ее уровень в плазме крови. Неработающие мышцы при малоподвижном образе жизни почти не поглощают глюкозу, и уровень сахара в крови повышается. При сахарном диабете 2 типа поглощение глюкозы периферическими тканями уменьшается примерно в два раза.
Инсулинорезистентность скелетных мышц у больных сахарным диабетом или ожирением связана с нарушением функции и уменьшением количества глюкозных транспортеров – ГЛЮТ–4, что было доказано при исследовании биоптатов мышц in vitro.
Функция транспортеров глюкозы увеличивается под влиянием инсулина и активной работы мышц, поэтому увеличение физической нагрузки при сахарном диабете 2 типа способствует снижению уровня глюкозы в крови за счет увеличения поглощения глюкозы мышцами.
При малоподвижном образе жизни для нормализации сахара крови требуется увеличение секреции инсулина. Гиперинсулинемия повышает аппетит и способствует развитию ожирения, а при высококалорийном питании, содержащем большое количество углеводов (в том числе сладостей), жиров, часто и алкоголя, ожирение прогрессирует крайне высокими темпами. Развивается порочный круг: чем меньше движений, тем больше ожирение; чем больше ожирение, тем труднее двигаться. При предрасположенности к развитию сахарного диабета 2 типа и инсулинорезистентности жир откладывается в основном в области живота: в сальнике и вокруг внутренних органов. Развивается абдоминальное/висцеральное/андроидное ожирение, при этом особенно сильно увеличивается объем талии. Если объем талии у мужчин >94 см, а у женщин >80 см, у них имеется висцеральный/андроидный тип ожирения и инсулинорезистентность. Объем талии и степень выраженности ожирения являются маркерами выраженности инсулинорезистентности.
Жировая ткань, являясь активным эндокринным органом, секретирует более 90 биологически активных веществ, среди которых адипокины, цитокины, ангиотензин, целый ряд гормонов: лептин, адипонектин и др. Лептин участвует в регуляции энергетического обмена, контроле гемопоэза, функции иммунной системы, ангиогенеза, количества жировой ткани. Уровень лептина в плазме крови пропорционален количеству жировой ткани [4]. Немаловажную роль в развитии инсулинорезистентности играет адипонектин, который рассматривается, как один из маркеров метаболического синдрома [5]. Он обратно пропорционален степени выраженности ожирения, ИМТ, тяжести метаболического синдрома, СД 2, инсулинорезистентности, дислипидемии, гиперинсулинеми натощак и сердечно–сосудистой патологии и, вероятно, играет защитную роль при этих состояниях. Уменьшение массы тела, особенно за счет абдоминального ожирения, приводит к повышению уровня адипонектина и снижению риска сердечно–сосудистой патологии.
Научные исследования последних лет показали, что жировая ткань играет немаловажную роль и в развитии механизмов воспаления, стимулируя синтез провоспалительных цитокинов, таких как ИЛ–6, ФНО–?, ИАП–1 [6], которые способствуют развитию инсулинорезистентности, причем одним из ключевых медиаторов ее развития является фактор некроза опухоли–? (ФНО–?). Так, повышение экспрессии гена ФНО–? в адипоцитах при ожирении и увеличение его секреции клетками жировой ткани сопровождалось пропорциональным увеличением степени выраженности инсулинорезистентности. На фоне лечения метформином больных сахарным диабетом и ожирением через 3 месяца наблюдалось достоверное снижение исходно повышенного ФНО–? с 47,75±2,98 до 24,34±3,15 пг/мл (р 7,9 ммоль/л (нормальный уровень – до 7,8 ммоль/л) приводит к развитию эффекта «глюкозотоксичности». Этим термином называется токсическое действие глюкозы, проявляющееся в гликозилировании белков различных органов и тканей организма, что неизбежно ведет к нарушению их функции, а при длительном повышении сахара крови – к развитию диабетических осложнений: поражению глаз (ретинопатии), повреждению нервов (полинейропатии), патологии почек (нефропатии), повреждению сосудов (атеросклерозу).
Особенностью клинического развития сахарного диабета 2 типа является длительное бессимптомное течение заболевания, что создает иллюзию мнимого благополучия. Отсутствие характерных симптомов диабета, хорошее самочувствие создает впечатление легкого заболевания, однако уже на самых ранних стадиях сахарного диабета 2 типа гипергликемия способствует прогрессирующему снижению секреции инсулина, поражению мелких и крупных сосудов, нарушению микроциркуляции, быстрому развитию атеросклероза, поражению нервной системы.
Длительное время пациенты не подозревают о своем заболевании, пока на первый план не выйдут тяжелые осложнения СД (нарушения зрения, инфаркт миокарда, инсульт, трофические язвы, гангрена, нарушение функции почек).
Преобладание неспецифических жалоб (слабость, утомляемость, головокружения, нарушения памяти и т.д.), наличие других болезней, частое отсутствие гипергликемии натощак и преобладание изолированной постпрандиальной гипергликемии у 50–70% больных, длительное отсутствие глюкозурии даже при плохой компенсации СД приводит к тому, что диагноз СД 2 типа, по данным международных исследований, «опаздывает» на 7–12 лет от начала заболевания.
Длительное «немое» течение диабета приводит к тому, что более 50% пациентов в момент постановки диагноза сахарного диабета 2 типа уже имеют различные осложнения [UKPDS, 10]:
Поражение крупных сосудов (макроангиопатии)
• Артериальную гипертонию – 39%
• Ишемическую болезнь сердца, ишемическую болезнь головного мозга, инсульт, поражение сосудов ног – 25–30%
• Инфаркт – 8%
Поражение мелких сосудов (микроангиопатии)
• Ретинопатию, снижение зрения – 55%
• Нефропатию, снижение функции почек (микроальбуминурию – 30%, протеинурию – 5–10%)
• Поражение нервов – нейропатию – 15%.
Многоцентровые проспективные клинические исследования – UKPDS, DECODE, Kumamoto Study, Helsinki Policemen study и др. [9,10] – убедительно показали значимость гипергликемии в развитии всех видов осложнений при СД 2 типа. Так, хроническая гипергликемия и повышение гликированного гемоглобина – НвА1с>7% (при норме 4–6%) повышает риск инфаркта миокарда в 4–5 раз. Гипергликемия через 2 часа после еды >10 ммоль/л увеличивает риск сердечно–сосудистой смертности в 2 и более раз, независимо от уровня гликемии натощак.
Диабетические осложнения возникают только тогда, когда сахарный диабет не компенсирован, и сахар крови длительное время остается повышенным. Раз возникнув, диабетические осложнения постепенно прогрессируют, существенно снижая качество жизни и сокращая ее продолжительность. Однако если диабет хорошо компенсирован, и сахар крови максимально приближается к нормальным показателям, то возникновение и развитие диабетических осложнений не только приостанавливается, но в ряде случаев даже подвергается обратному развитию.
В исследовании UKPDS было установлено, что снижение содержания глюкозы по возможности до уровня, близкого к нормальным показателям уменьшает риск развития диабетических осложнений и помогает предотвратить их прогрессирование.
Улучшение компенсации СД 2 и снижение НвА1с на 0,9% приводило к снижению частоты:
• всех заболеваний, связанных с диабетом – на 12%,
• микроангиопатий – на 25%,
• инфаркта миокарда – на 16%,
• удаления катаракты – на 24%,
• ретинопатии – на 21%,
• нефропатии – на 33%.
Лечение сахарного диабета 2 типа, учитывая сложный механизм его развития и разнородность этой группы больных, является сложной задачей. В настоящее время вылечить сахарный диабет невозможно, но можно хорошо управлять им и жить полноценной жизнью многие годы, сохраняя трудоспособность и хорошее самочувствие.
Главные цели лечения сахарного диабета 2 типа включают:
1. Достижение хорошего метаболического контроля (устранение симптомов гипергликемии натощак и после еды).
2. Предупреждение острых осложнений (гипогликемий) и декомпенсации диабета.
3. Предупреждение развития поздних сосудистых осложнений.
Начинать лечение необходимо с изменения образа жизни, которое включает диету (правильное питание), расширение физических нагрузок и уменьшение или устранение стрессовых ситуаций.
Успех лечения во многом зависит от того, насколько пациент вовлечен в программу терапии, от его знаний о своем заболевании, мотивации, поведения, обучения принципам самоконтроля, то есть от комплаентности пациента.
Диета. Поскольку 80–90% больных СД 2 типа имеют избыточную массу тела, а многие еще и пожилой возраст, повышенное артериальное давление, сопутствующие сердечно–сосудистые и другие заболевания, организации питания должно быть уделено особое внимание. Целью диеты является устранение постпрандиальной гипергликемии, гипергликемии натощак и снижение избыточной массы тела, так как ожирение способствует прогрессированию диабетических осложнений.
Вторым важным фактором лечения сахарного диабета 2 типа является расширение физической активности. Физические нагрузки не только положительно влияют на показатели гликемии, способствуя утилизации глюкозы мышцами, но и улучшают жировой обмен, благотворно влияют на сердечно–сосудистую систему, вызывают положительные эмоции и помогают противостоять стрессовым ситуациям, приводят к снижению инсулинорезистентности и гиперинсулинемии. Физические нагрузки должны быть индивидуализированы с учетом возраста больного, осложнений СД и сопутствующих заболеваний.
Пациентам с СД 2 типа достаточно 30–45 минут ежедневной ходьбы 2–3 раза в день. Поощряется систематическая физическая нагрузка, которая соответствует возможностям пациента, его желаниям и стилю жизни.
Диета и физические нагрузки – это два краеугольных камня, лежащих в основе лечения сахарного диабета 2 типа. Но, к сожалению, многие больные, особенно пожилого возраста, не всегда соблюдают диету и не в состоянии существенно расширить режим физических нагрузок из–за наличия заболеваний суставов, ишемической болезни сердца, тяжелой артериальной гипертонии, сердечно–легочной недостаточности.
На ранних стадиях нарушения углеводного обмена изменение образа жизни может быть достаточно эффективным и уменьшить риск развития сахарного диабета 2 типа на 58%. Однако на более поздних стадиях СД 2 типа, когда он чаще всего и выявляется, достичь приемлемых показателей НвА1с ( 0,05), за 6 месяцев – до 3,70±0,4 (p
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Метаболический синдром и инсулинорезистентность: взаимосвязь, причины, последствия
Комплекс обменных, гормональных и клинических нарушений в организме вследствие ожирения называется метаболическим синдромом. Иными словами, это не заболевание, как таковое, а состояние, в которое входят различные факторы риска. Они провоцируют развитие сердечно-сосудистых заболеваний, приводят к диабету, инсульту и прочим проблемам.
А что тогда такое инсулинорезистентность (ИР)? Нет, это не синоним метаболического синдрома, а его «спусковой крючок». Невосприимчивость организма к инсулину словно открывает двери вашего организма тому негативу, который способствует ожирению и развитию заболеваний.
То есть, при отсутствии метаболической реакции организма на инсулин, последний начинает скапливаться в плазме крови. Как говорится – со всеми вытекающими последствиями. И что самое опасное – точно установить у себя этот процесс в большинстве случаев очень трудно и только метаболические нарушения в организме могут об этом сказать.
Но как же сделать так, чтобы не нарушения стали признаком ИР, а определенные симптомы? Рекомендации довольно просты. О вероятной инсулинорезистентности вам сообщают следующие симптомы:
Иначе говоря, если вы генетически склонны к лишнему весу и/или артериальной гипертензии, то вы потенциальный член группы риска. Все просто – жировая ткань имеет очень высокую метаболическую активность, соответственно чувствительность тканей к инсулину падает на целых 40%, если оптимальная масса тела превышена на 35-40%.
Причины ожирения
Проблемы лишнего веса знакомы многим. Причины его появления можно поделить на 2 категории:
К внешним относятся:
В категорию внутренних причин входят:
Также важно отметить генетические факторы. Иными словами, это банальная наследственность.
Все вместе это формирует замкнутый порочный круг. Но его, при желании, вполне можно разорвать. А для этого достаточно для начала знать, как именно и отчего возникает резистентность к инсулину.
Откуда это появляется?
Скажи мне, что ты ешь и я скажу, кто ты. Вернее – «и я скажу, грозит ли тебе инсулинорезистентность». Поэтому первым делом пересмотрите свой рацион. Сахар, фруктоза, белый рис, макароны и многие другие блюда повышают уровень сахара в крови, который спустя полчаса (максимум) падает.
Далее организм словно спрашивает «что это было?» и пытается вернуть бодрость, подключая гормоны стресса – кортизол и адреналин. Они вырабатываются надпочечниками, но это, в свою очередь, быстро изнашивает их. В итоге упадок сил после приема «высокоэнергичной» пищи становятся все чаще и дольше. А там начинают страдать и другие железы, так как все взаимосвязано, плюс утрачиваются ресурсы в организме, нужные для выработки других важных гормонов – эстрогена, прогестерона, тестостерона и т.д.
Далее – при резистентности к инсулину мышцы и печень перестают реагировать на сахар, а поджелудочная железа начинает интенсивно производить инсулин. Результат известен – избыток инсулина является прямой дорогой к избыточному весу.
Подобная ситуация опасна для здоровья как мужчин, так и женщин, поэтому разделять пациентов с метаболическим синдромом по полу нет смысла. По статистике сегодня этот синдром у 1 из 4-х взрослых людей точно есть. Поэтому речь стоит вести не о степени опасности (с этим и так все ясно), а о том, как распознать метаболический синдром.
Как проводится диагностика метаболического синдрома?
Выделяют базовые диагностические критерии, говорящие о наличии резистентности к инсулину:
Перед диагностикой от пациентов требуется соблюдать следующие рекомендации:
Способы лечения
Что касается лечения, то наиболее эффективным и клинически обоснованным способом избавиться от инсулинорезистентности является уменьшение объемов жировой ткани с помощью простой нормализации массы тела, либо хирургическими способами. Также может назначаться прием препаратов, повышающих инсулиновую чувствительность, однако без коррекции избытка массы тела она будет малоэффективна.
Однако сброс веса сбросу рознь. При борьбе с метаболическим синдромом не нужно скидывать вес до «ультраидеальных» показателей любой ценой, то есть, уходить в иную крайность. Особенно это не стоит делать при артериальной гипертензии. И чтобы избежать печальных последствий, лучше сбрасывать вес по чуть-чуть. Оптимальные показатели – 2-4 кг за 1 месяц. Главное – в рационе не должно быть свыше 30% жиров (10% животных и 20% растительных), а количество углеводов должно быть около 50%. На получение белков должно приходиться 20% калорий в сутки.
Если рассматривать лечебные процедуры, то мы назовем следующие:
Миостимуляция
Процедура, при которой на мышцы, внутренние органы и нервную систему воздействуют путем импульсных токов называется миостимуляцией. Метод относится к аппаратной косметологии и позволяет сбросить лишний вес, а также способствует увеличению мышечной массы.
Электрические импульсы заставляют мышцы активнее сокращаться, за счет чего улучшается кровообращение, повышается отток лимфы, активизируются обменные процессы. Все это в совокупности заставляет исчезать жировые клетки.
Мы выполняем электромиостимуляцию с помощью аппарата «Транзион». Отметим, что с его помощью можно воздействовать на любые группы мышц, обходясь, тем самым, без длительного посещения спортзала для сгона лишних килограммов.
Прессотерапия
В нашей клинике прессотерапия является составной частью большой программы коррекции фигуры. Если кратко, то при этой процедуре на пациента надевается специальный многосекционный костюм, в каждый из отделов которого последовательно поступает сжатый воздух, формирующий давление. Показатели давления контролируется компьютером.
Сжатия тела позволяют очистить межклеточную жидкость, содержащую продукты жизнедеятельности клеток. Также прессотерапия способствует эффективному лимфодренажу.
Наряду с инъекциями препаратов, прессотерапия проводится на первом этапе программы, вместе с другими аппаратными процедурами – это Лимфоджей и ВГТ по проекции магистральных сосудов. Совместные процедуры позволяют избавить организм от лишней жидкости и нормализовать кровообращение в коже.
В завершение скажем, что если вы столкнулись с инсулинорезистентностью на относительно ранних этапах, то у вас есть все возможности, чтобы не пополнить ряды людей с метаболическим синдромом. И помимо своевременного обращения к врачу не забывайте и о таких мерах, как пересмотр рациона питания в сторону более низкоуглеводных блюд, физическая активность и восстановление натриево-калиевого баланса. Помните, все в ваших силах!
Роль инсулинорезистентности в развитии сахарного диабета и других состояний. Современные возможности коррекции
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Нарушению периферических эффектов инсулина — инсулинорезистентности (ИР) отводится важнейшая роль в развитии многих метаболических заболеваний, из которых наиболее значимыми традиционно являются сахарный диабет (СД) 2 типа и атеросклеротические дислипидемии, ассоциированные с развитием сердечно-сосудистых заболеваний (ССЗ). На рубеже 1990–2000-х гг. широко распространилось понятие метаболического синдрома. Сегодня считается, что говорить о метаболическом синдроме некорректно в связи с недостаточной доказательной базой, однако патофизиологическая роль ИР, механизмы ее развития и пути преодоления по-прежнему в фокусе научного интереса.
Снижение чувствительности рецепторов к инсулину ухудшает его эффекты, запуская порочный круг нарушений, включающих компенсаторную гиперсекрецию инсулина, дисфункцию β-клеток поджелудочной железы, ухудшение утилизации глюкозы тканями, метаболические и гемодинамические нарушения, последующее усиление ИР, органные повреждения и ССЗ. Ранняя терапия, направленная на улучшение чувствительности к инсулину, восстановление его эффектов, могла бы стать одним из эффективных методов первичной профилактики СД 2 типа и ССЗ. В статье рассмотрены механизмы формирования резистентности к инсулину, а также эндотелиальной дисфункции в условиях ИР, приводящие к кардиоваскулярным осложнениям, и новый подход к коррекции этих нарушений.
Ключевые слова: инсулинорезистентность, эндотелиальная дисфункция, сахарный диабет, гипогликемические средства в комбинациях.
Для цитирования: Демидова Т.Ю., Зенина С.Г. Роль инсулинорезистентности в развитии сахарного диабета и других состояний. Современные возможности коррекции. РМЖ. Медицинское обозрение. 2019;3(10(II)):116-122.
T.Yu. Demidova, S.G. Zenina
Pirogov Russian National Research Medical University, Moscow
Insulin resistance has long been considered to play a major role in the development of many metabolic disorders including type 2 diabetes and atherosclerotic dyslipidemia associated with cardiovascular disorders. In the late 1990s and early 2000s, the conception of metabolic syndrome has become popular, scientific societies have developed and applied its definitions. However, it is generally accepted now that the evidence base for metabolic syndrome is poor. Nevertheless, current researches still focus on the pathogenic role of insulin resistance, mecha-nisms of its development, and ways to improve insulin sensitivity.
Insulin resistance is of crucial importance for the development of obesity and type 2 diabetes. Reduced sensitivity of receptors to insulin impairs its effects and triggers a vicious circle of disturbances which involves compensatory oversecretion of insulin, pancreatic β-cell dysfunction, impaired tissue utilization of glucose, metabolic and hemodynamic disturbances, increased insulin resistance, organ damage, and cardiovascular disorders. Early treatment aimed to improve insulin sensitivity and recover its effects could become an effective primary prevention of type 2 diabetes and cardiovascular disorders. This paper discusses the mechanisms of the development of insulin resistance and endothelial dysfunction resulting in cardiovascular complications and a novel approach to overcome them.
Keywords: insulin resistance, endothelial dysfunction, diabetes, combinations of hypoglycemic agents.
For citation: Demidova T.Yu., Zenina S.G. Insulin resistance and its role in the development of diabetes and other conditions. Current modalities to improve insulin sensitivity. RMJ. Medical Review. 2019;10(II):116–122.
В статье рассмотрены механизмы формирования резистентности к инсулину, а также эндотелиальной дисфункции в условиях инсулинорезистентности, приводящие к кардиоваскулярным осложнениям, и новый подход к коррекции этих нарушений.
Введение
По данным Международной диабетической федерации, в 2017 г. количество больных сахарным диабетом (СД) в мире составляло 412 млн. К 2040 г. ожидается увеличение этого числа до 642 млн, что близко к численности населения Европы [1]. Судя по темпам роста числа больных и распространенности заболевания, СД 2 типа можно с полной уверенностью рассматривать как неинфекционную пандемию XXI века. Согласно современному определению, СД 2 типа — заболевание, которое развивается в силу либо преимущественной инсулинорезистентности (ИР) и относительной инсулиновой недостаточности, либо преимущественного нарушения секреции инсулина с ИР и проявляется нарушением углеводного обмена. Однако ИР чаще всего представляет собой наиболее ранний дефект, формирующийся еще на этапе избыточного веса и ожирения, которые у 90% больных сопутствуют СД 2 типа.
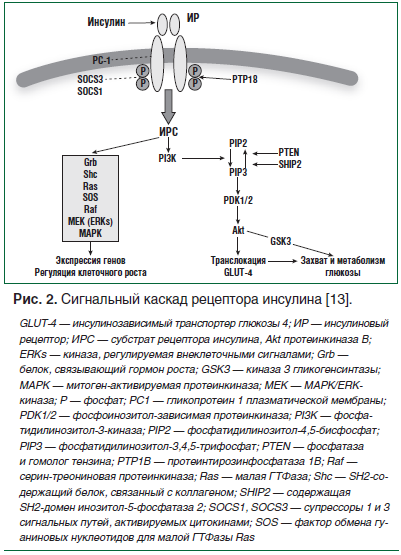
ИР — это нарушение биологического ответа на воздействие эндогенного или экзогенного инсулина тканей-мишеней — преимущественно печени, адипоцитов и скелетных мышц. К основным биологическим эффектам инсулина относят регуляцию всех видов метаболизма (углеводного, жирового, белкового) и митогенных процессов (роста, дифференцировки тканей, синтеза ДНК, транскрипции генов). ИР может развиваться в различных органах и тканях, вызывая глюкозотоксичность и повышая риск сосудистых заболеваний опосредованно, через повышение уровня липопротеинов очень низкой плотности и триглицеридов, стимулируя ускорение процессов гликозилирования белков и липидов (рис. 1) [2]. Инсулин также участвует в регуляции функций органов и тканей, которые не являются инсулинозависимыми, например эндотелия и сосудистой стенки. При гиперинсулинемии и ИР метаболические пути, регулируемые инсулином, и даже необязательно связанные с глюкозой, избыточно активируются. Например, в почках инсулин стимулирует повышенную реабсорбцию натрия. Системная гиперинсулинемия приводит к избыточной реабсорбции натрия, что способствует увеличению внутрисосудистого объема и повышению артериального давления. В яичниках клетки имеют рецепторы к инсулину, которые реагируют на минимальные изменения базальной концентрации инсулина. В условиях гиперинсулинемии эти рецепторы индуцируют выработку андрогенов, что приводит к гиперандрогении, клинически проявляющейся в гирсутизме, олигоменорее и поликистозности яичников. В печени, в то время как повышенная концентрация инсулина способствует глюконеогенезу, печеночные инсулинчувствительные механизмы липогенеза, не обладая резистентностью, гиперактивируются, что приводит к увеличению плотности липопротеидов. При ИР развивается дислипидемия — высокий уровень триглицеридов и липопротеинов низкой плотности и низкий уровень липопротеинов высокой плотности. Таким образом, нарушение активности инсулина способствует развитию атеросклероза.
При ИР под действием свободных жирных кислот (СЖК) повреждаются кардиомиоциты, что приводит к гипертрофии и ригидности сердечной мышцы (кардиомиопатия). В итоге повышается диастолическое давление, уменьшается ударный объем, нарушается диастолическое расслабление.
Таким образом, множественные проявления синдрома ИР являются результатом реакции на повышенные концентрации инсулина, которые индуцируются для поддержания нормального метаболизма глюкозы. ИР стоит рассматривать в совокупности с ожирением, нарушениями углеводного обмена, эндотелиальной дисфункцией, атеросклерозом, синдромом поликистозных яичников, липодистрофией, почечной и сердечной недостаточностью, поскольку все эти процессы патогенетически связаны. Поэтому современное понятие ИР не сводится к параметрам, характеризующим только метаболизм углеводов, а включает также изменения метаболизма жиров, белков, функции клеток эндотелия, экспрессии генов и др.
Эффекты инсулина в тканях-мишенях
Инсулин прямо или косвенно влияет на функцию практически всех тканей организма, вызывая большое разнообразие биологических реакций. Его метаболическое действие на печень, мышцы и жировую ткань является предметом глобальных исследований, поскольку эти ткани отвечают за обмен веществ в организме и запас энергии, а также выполняют важные функции в развитии резистентности к инсулину, ожирения и СД 2 типа. Инсулин является основным гормоном, ответственным за поступление, использование и хранение питательных веществ в клетках. Он влияет на углеводный обмен (увеличивает утилизацию глюкозы мышечной и жировой тканями, увеличивает синтез гликогена печенью и мышцами, повышает фосфорилирование глюкозы, уменьшает глюконеогенез и гликогенолиз), жировой обмен (повышает липогенез, увеличивает синтез жирных кислот, уменьшает липолиз), белковый обмен (увеличивает поглощение аминокислот, синтез белка и синтез нуклеиновых кислот) [3, 4]. Таким образом, основное действие инсулина на ткани — это активация процессов анаболизма и, соответственно, подавление процессов катаболизма.
В эндотелии инсулин выполняет специфические функции, в частности регулирует экспрессию молекул клеточной адгезии VCAM-1, VEGF, эндотелина-1, гемооксигеназы-1 [5]. Но одно из наиболее важных действий заключается в том, что этот гормон увеличивает экспрессию и активацию эндотелиального фермента синтазы оксида азота (eNOS), которая приводит к образованию оксида азота (NO) в эндотелии сосудов. NO в эндотелии диффундирует как в просвет, так и в клетки гладких мышц сосудов, где активирует фермент гуанилатциклазу и вызывает расслабление сосудов. Таким образом, усиление кровотока за счет действия инсулина вызывает увеличение использования глюкозы в тканях-мишенях [6].
Эндотелий может также регулировать транспорт инсулина в периферические ткани, в частности в скелетные мышцы, жировую ткань, центральную нервную систему и др. Инсулин может оказывать защитное (антиатерогенное) или повреждающее (проатерогенное) действие в зависимости от уровня и его активации различными чувствительными к инсулину путями [7].
Митогенный эффект инсулина реализуется через взаимодействие как с собственными рецепторами, так и с рецепторами инсулиноподобных факторов (ИФР). Митогенное действие инсулина заключается в активации пренил-трансфераз, в увеличении фарнезилированного белка р21RAS, экcпрессирующего онкоген ras, RHO, Rab и, как следствие, в увеличении клеточного ответа на ИФР-1, эпидермального фактора роста, фактора роста тромбоцитов, способности мутированного белка р21RAS инициировать клеточную пролиферацию и превращать нормальные клетки в злокачественные. Это приводит к накоплению молекулярных повреждений, развитию ожирения и атеросклероза, увеличению риска развития онкологии, старению организма в целом [8].
Инсулин может оказывать и нормализующее влияние на митогенез. Способствуя высвобождению ИФР-1 и многих других факторов роста и цитокинов, он стимулирует мобилизацию эндотелиальных прогениторных клеток (ЭПГ) из костного мозга или тканевых депо. ЭПГ обеспечивают регенерацию поврежденных или старых сосудов. Но в условиях длительной гиперинсулинемии, обусловленной ИР, количество ЭПГ снижается и репаративные процессы в поврежденном эндотелии протекают неполноценно, еще более усугубляя хронические дегенеративные состояния [9].
Молекулярные механизмы действия инсулина и формирования ИР
Инсулин представляет собой пептид из 51 аминокислоты, который вырабатывается и секретируется β-клетками островков поджелудочной железы. Его биологическое действие начинается, когда он связывается со своим рецептором, интегральным мембранным гликопротеином, который образован двумя α-субъединицами и двумя β-субъединицами. Субъединица α является полностью внеклеточной и связывается с внеклеточной областью β-субъединицы, а также с другой α-субъединицей через дисульфидные мостики. Каждая β-субъединица состоит из внеклеточного домена, трансмембранного домена и внутриклеточного домена тирозинкиназы, который активируется аутофосфорилированием [10].
Рецептор инсулина относится к семейству рецепторов с внутренней тирозинкиназной активностью. Связывание инсулина с α-субъединицей рецептора вызывает конформационные изменения, которые потенцируют его каталитическую активацию и аутофосфорилирование нескольких остатков тирозинкиназы, расположенных в цитозольной области β-субъединицы. Аутофосфорилированные остатки потом распознаются различными адаптерными белками, из которых IRS-1 и IRS-2 (члены семейства субстратов инсулина) являются двумя основными видами и наиболее распространенными посредниками на начальной стадии передачи сигнала инсулина. IRS действует как адаптерная молекула, которая организует образование молекулярных комплексов и запускает внутриклеточные сигнальные каскады [11].
Нарушение чувствительности к инсулину может развиваться на трех уровнях — дорецепторном, рецепторном и пострецепторном.
На дорецепторном уровне ИР обусловливает патологические изменения инсулина, секрецию клетками поджелудочной железы проинсулина вместо инсулина, блокаду нормального взаимодействия гормона со своим рецептором на поверхности клеток (например, при хронической почечной недостаточности). ИР, развивающаяся на дорецепторном уровне, часто бывает обусловлена мутациями кодирующего гена.
Рецепторный уровень ИР обусловлен уменьшением числа рецепторов на поверхности клетки или снижением их сродства к инсулину.
Но в большинстве случаев ИР бывает вызвана дефектами передачи инсулинового сигнала на пострецепторном уровне, эти дефекты обусловлены структурно-функциональными нарушениями со стороны белков, вовлеченных в детерминацию сигнальных процессов.
Основные метаболические эффекты инсулина, в т. ч. его стимулирующее влияние на поглощение глюкозы клетками-мишенями, реализуются при помощи сигнального пути фосфатидилинозитол-3-киназы (PI3K) и протеинкиназы В (Akt). Под действием PI3K из фосфатидилинозитол-4,5-бисфосфата (PIP2) образуется вторичный мессенджер — фосфатидилинозитол-3,4,5-трифосфат (PIP3), ответственный за последующую активацию PI3K/Akt пути. Влияние инсулина на захват глюкозы периферическими тканями через активацию PI3K/Akt пути осуществляется путем транслокации глюкозного транспортера GLUT-4 из цитозоля в плазматическую мембрану и дальнейшего трансмембранного переноса глюкозы в клетку. IRS-1 соединяется с PI3К и активирует ее, в результате чего происходит фосфорилирование и активация eNOS. В исследованиях блокаторы PI3К и Akt уменьшают инсулинстимулированную продукцию NO [12].
Атерогенные свойства инсулина связаны с его стимуляцией другой сигнальной системы — митогенактивированной протеинкиназы (МАРК). В результате активации этого пути происходит рост и пролиферация эндотелиальных клеток, усиливаются миграция в интиму, пролиферация гладкомышечных клеток и продукция коллагена, что способствует ускорению атеросклероза (рис. 2).
При ожирении, которое сопровождает СД 2 типа, адипоцитами синтезируется избыточное количество провоспалительных цитокинов (интерлейкина-6, фактора некроза опухоли), что приводит к хроническому воспалительному процессу, в результате которого нарушается путь передачи инсулинового сигнала и повреждаются функции митохондрий, тем самым нарушается гомеостаз глюкозы. При ожирении в кровоток поступает избыток СЖК. В результате их накопления и метаболизма в миоцитах образуются метаболиты: церамиды, диаглицерол или ацил-КоА, что ведет к нарушению передачи сигнала инсулина, и происходит селективное угнетение PI3К-сигнального пути, в то время как МАРК-сигнальный путь усиливается. Это обусловливает проатерогенный эффект инсулина в условиях ИР, который реализуется через ремоделирование стенки сосуда и способствует развитию сосудистых осложнений [14].
ИР и эндотелиальная дисфункция
Для эндотелия характерна базальная выработка вазодилататора — NO, образующегося из L-аргинина с участием eNOS. NO обладает антиатерогенными, антиоксидантными свойствами, регулирует многие функции эндотелия и является чувствительным индикатором повреждения [15]. При ИР страдают важнейшие функции эндотелия — усиливается выработка вазоконстрикторов и снижается синтез вазодилататоров, что приводит в конечном итоге к спазму артериальных сосудов и росту артериального давления. Причинами эндотелиальной дисфункции могут быть различные факторы, в т. ч. ИР, гипергликемия, гиперлипидемия, действие цитокинов, свободнорадикальное повреждение при накоплении продуктов перекисного окисления липидов. При ИР NO утрачивает свои антигипертензивные, антисклеротические и антитромботические защитные свойства.
Индуцированное СЖК нарушение работы PI3К-пути приводит к блокированию активности eNOS по аминокислотному остатку серина, понижению продукции NO, эндотелиальной дисфункции и сосудистому ремоделированию (утолщению комплекса интима-медиа). Это является важным предиктором сердечно-сосудистой патологии (рис. 3) [16]. Хроническая ИР стимулирует продукцию инсулина поджелудочной железой, способствуя прогрессированию дисфункции β-клеток, снижению уровня инсулина и повышению уровня глюкозы плазмы. Гипергликемия сокращает способность эндотелия к синтезу NO и влияет на функционирование сосудов через целый ряд механизмов, главным образом через гиперпродукцию активных форм кислорода (АФК) (см. рис. 3) [16]. Одна из первых мишеней гипергликемии — дыхательная цепь митохондрий, в которой происходит выработка избыточного количества супероксид-аниона (О2 – ). Дальнейшее повышение АФК и индуцируемой ими протеинкиназы С замыкает этот порочный круг. Активация протеинкиназы С глюкозой ведет к снижению выработки NO (см. рис. 3). Митохондриальные АФК далее активируют сигнальные каскады, вовлеченные в патогенез сердечно-сосудистых осложнений, включая поток полиолов, образование продуктов гликозилирования и рецепторов к ним, протеинкиназу С и гексозаминовый путь (см. рис. 3).
ИР и эндотелиальная дисфункция — это тесно ассоциированные состояния, приводящие к метаболическим и кардиоваскулярным заболеваниям. Прогрессирование ИР при СД идет параллельно с прогрессированием эндотелиальной дисфункции до атеросклероза.
ИР как основное патогенетическое звено в развитии СД 2 типа
Стоит ли рассматривать ИР в качестве обязательного патогенетического компонента при СД 2 типа, остается предметом большого научного интереса.
ИР встречается, кроме СД, при многих других заболеваниях и физиологических состояниях [17]:
физиологическая ИР (как следствие повышения секреции соматотропного гормона в пубертатном возрасте, при беременности, при богатой жирами диете, во время ночного сна);
метаболическая ИР (СД 2 типа, ожирение, декомпенсация СД 1 типа, избыточный прием алкоголя, инфекция, стресс);
эндокринная ИР (тиреотоксикоз, гипотиреоз, синдром Кушинга, акромегалия, синдром поликистозных яичников, феохромоцитома);
неэндокринная ИР (эссенциальная артериальная гипертензия, цирроз печени, ревматоидный артрит, травма, ожоги, сепсис, хирургические вмешательства).
Очевидно, что различные внешнесредовые факторы могут ускорять развитие ИР, например возраст, избыточная масса тела и висцеральное ожирение, избыток насыщенных жиров (СЖК) и легкоусвояемых углеводов в питании, физическая гиподинамия и саркопения, курение, прием некоторых лекарственных препаратов (бета-адреноблокаторы, глюкокортикостероиды, диуретики тиазидового ряда) и др.
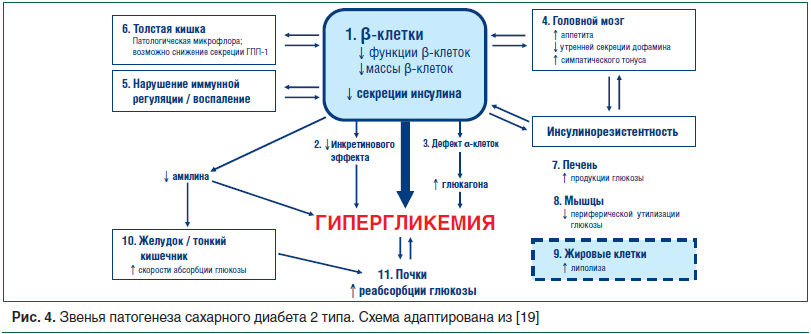
Имеется много подтверждений того, что роль ИР в развитии СД 2 типа остается ведущей у подавляющего числа пациентов и, по-видимому, нуждается в обязательной коррекции на любом этапе. Согласно современному представлению о патогенезе СД не менее
3 звеньев из 11 непосредственно связаны с ИР: нарушение утилизации глюкозы мышечной и жировой тканью, а также повышенная продукция глюкозы в печени
(рис. 4), что обеспечивает стойкое повышение уровней глюкозы крови в течение суток. Вместе с тем ИР ассоциирована с усиленным липолизом висцеральных адипоцитов, перегрузкой портальной системы СЖК и формированием локального воспаления в висцеральном жировом депо. Во многом из-за ИР формируются специфические для СД атерогенные сдвиги в липидном спектре, жировая инфильтрация печени, переключение на жировые источники энергообеспечения вместо углеводных, что нефизиологично в нормальной ситуации. Компенсаторная гиперинсулинемия со временем начинает снижаться, β-клеточная секреция постепенно истощается, диктуя потребность в многокомпонентной противодиабетической терапии, включая введение инсулина. В силу многочисленных патологических процессов, среди которых ИР играет не последнюю роль, при СД возрастает гиперглюкагонемия за счет гиперактивности панкреатических α-клеток. Повышается уровень провоспалительных цитокинов и интерлейкинов, что также ассоциируется с тканевой ИР и прогрессирующей гипергликемией. Высока вероятность того, что эндотелиальная дисфункция и изменения проницаемости сосудистых капилляров влияют на действие периферического инсулина [18].
Следует помнить, что прогрессирующая хроническая гипергликемия в силу феномена глюкозотоксичности усугубляет ИР и потерю чувствительности β-клеток к глюкозному стимулу, способствует образованию и накоплению конечных продуктов гликирования, усиливает провоспалительные процессы, замыкая порочный круг метаболических и органных нарушений.
Новый подход к коррекции ИР и эндотелиальной дисфункции
Важнейшая роль, которую играет ИР в развитии различных заболеваний, обусловливает необходимость коррекции данного состояния. Известно, что эффективным методом уменьшения ИР является коррекция массы тела, модификация питания и регулярная аэробная физическая активность. При снижении веса уменьшается масса висцеральных адипоцитов, нормализуются обменные процессы, включая уровни гликемии, липидов, СЖК, а также восстанавливается тирозинкиназная активность инсулиновых рецепторов. По-видимому, дефект тирозинкиназной активности развивается на фоне гипергликемии, нарушения внутриклеточного метаболизма глюкозы и гиперинсулинемии, которые регрессируют на фоне снижения веса.
Однако снизить массу тела и удержать полученный результат удается ничтожно малому количеству пациентов. Немедикаментозные подходы признаются самыми трудно выполнимыми и характеризуются низкой «выживаемостью» достигнутых результатов. Нарушения пищевого поведения, вредные алиментарные привычки, гиподинамия, стрессы, психологические проблемы остаются мощными классическими барьерами на пути такого метода коррекции. У пациентов с СД есть множество дополнительных проблем, связанных с гиперинсулинемической картиной, приемом сахароснижающих препаратов с высокими рисками гипогликемий, которые диктуют высокую потребность в медикаментозной поддержке на всех этапах лечения. Среди большого портфеля противодиабетической терапии лишь 2 класса препаратов непосредственно влияют на чувствительность тканей к инсулину — это бигуаниды и тиазолидиндионы.
Метформин, единственный представитель группы бигуанидов, остается самым часто используемым и признанным веществом для коррекции ИР, особенно у людей с СД и предиабетом. Метформин улучшает чувствительность тканей к инсулину за счет усиления инсулинстимулированного фосфорилирования тирозина инсулиновых рецепторов, увеличения их количества на мембранах клеток, повышения активности PI3К, а также уменьшения экспрессии ферментов глюконеогенеза и симпатической активности. Он устраняет ИР (преимущественно в печени), что проявляется снижением процессов гликогенолиза и глюконеогенеза. Он в меньшей степени влияет на ИР в мышечной и жировой ткани, поэтому не всегда достаточно эффективен даже в максимальной дозировке. Кроме того, желудочно-кишечные расстройства, часто вызываемые метформином, становятся причиной его отмены. При длительном применении метформина может развиться дефицит витамина В12. Противопоказаниями к его первичному назначению являются почечная (СКФ Литература
Только для зарегистрированных пользователей
Инсулинорезистентность: ее роль в патогенезе сахарного диабета 2 типа и возможности коррекции
Инсулинорезистентность — это состояние, сопровождающееся снижением чувствительности периферических тканей к биологическому действию инсулина и встречающееся не только при сахарном диабете (СД) 2 типа, но и при других заболеваниях, сопровождающихся наруше
Инсулинорезистентность — это состояние, сопровождающееся снижением чувствительности периферических тканей к биологическому действию инсулина и встречающееся не только при сахарном диабете (СД) 2 типа, но и при других заболеваниях, сопровождающихся нарушениями обмена веществ.
На чувствительность тканей к инсулину влияют различные факторы, в том числе возраст, наличие избыточной массы тела и особенно распределение жировой ткани, показатели артериального давления, наличие гипертензии, дислипидемии, общее физическое состояние и тренированность организма, курение, ишемическая болезнь сердца и, наконец, семейный анамнез по диабету.
Состояния, сопровождающиеся инсулиновой резистентностью
Физиологическая инсулинорезистентность: пубертат; беременность; ночной сон; диета, богатая жиром.
Метаболическая инсулинорезистентность: диабет 2 типа; декомпенсация диабета 1 типа; диабетический кетоацидоз; ожирение; выраженная недостаточность питания; гиперурикемия; инсулинвызванная гипогликемия; избыточный прием алкоголя.
Эндокринная инсулинорезистентность: тиреотоксикоз; гипотиреоз; синдром Кушинга; акромегалия; феохромоцитома.
Неэндокринная инсулинорезистентность: эссенциальная гипертензия; хроническая почечная недостаточность, цирроз печени; ревматоидный артрит; acanthosis nigricans, раковая кахексия; сердечная недостаточность; миотоническая дистрофия; травма, ожоги, сепсис, хирургические вмешательства.
Инсулинорезистентность встречается более чем в 25% случаев у практически здоровых лиц без ожирения, причем степень ее выраженности в этом случае сопоставима с показателями инсулинорезистентности у больных СД 2 типа.
Причины инсулинорезистентности при СД 2 типа гетерогенны. В ее развитии четко прослеживается наличие двух компонентов: генетического и приобретенного. Так, родственники первой степени родства с нарушенной и даже с нормальной толерантностью к глюкозе имеют выраженную инсулинорезистентность по сравнению с лицами контрольной группы. У монозиготных близнецов, имеющих СД 2 типа, инсулиновая резистентность также более выражена по сравнению с близнецами без диабета. Приобретенный компонент инсулинорезистентности проявляется уже в период манифестации диабета.
Несмотря на то что к инсулиновой резистентности имеется четкая генетическая предрасположенность, до сих пор не идентифицированы точные генетические нарушения, лежащие в основе ее развития. Это свидетельствует о полигенном характере инсулиновой резистентности. При генетическом обследовании больных, имеющих СД, дислипидемию, гипертензию, которые, как известно, являются компонентами синдрома инсулиновой резистентности, были идентифицированы несколько точечных мутаций в гене рецептора к лептину, в гене субстрата инсулинового рецептора-1 (СИР-1) и PPAR (peroxisome proliferator-activated receptor γ) (G. S. Barsh и соавт., 2000).
Механизмы развития инсулиновой резистентности при СД 2 типа также гетерогенны. Одной из причин появления вторичной инсулинорезистентности является глюкозотоксичность или глюкозовызванная инсулиновая резистентность, т. е. состояние длительной гипергликемии, приводящее к снижению биологического действия инсулина. При СД 1 типа инсулинорезистентность развивается как следствие плохого контроля сахарного диабета, а улучшение компенсации углеводного обмена у этих больных сопровождается выраженным повышением чувствительности к инсулину, что, в свою очередь, требует коррекции суточных доз инсулина, применяемых у больных после достижения хорошей компенсации диабета. Инсулинорезистентность у больных СД 1 типа в большей степени проявляется в мышечных тканях, носит обратимый характер и имеет прямую корреляцию с содержанием гликогемоглобина в крови. У больных СД 2 типа инсулинорезистентность больше зависит от наследственного компонента, и хотя степень ее выраженности также уменьшается при достижении компенсации углеводного обмена, но в значительно меньшей степени по сравнению с показателями, отмечающимися у пациентов с СД 1 типа.
Инсулинорезистентность сопровождается снижением инсулинстимулированного транспорта глюкозы в жировую и мышечную ткани, что было достаточно убедительно показано в исследованиях in vitro (культура фибробластов, преадипоцитов или интактных мышечных клеток). W. T. Garvey и соавт. (1988) первыми отметили синергетическое влияние инсулина и глюкозы в механизмах десенситизации глюкозотранспортной системы в культуре адипоцитов, что позволило им сформулировать новую концепцию инсулинорезистентности. Нарушение гена гликогенсинтазы и ее киназ сопровождается инсулиновой резистентностью. Синтез гликогена в мышцах представлен на рис. 1. Помимо этого, глюкозотоксичность способствует десенситизации β-клеток, что проявляется ухудшением их секреторной активности.
В ходе изучения состояния транспортной системы, осуществляющей поступление глюкозы в клетку, S. Marshall и соавт. (1992) выявили, что для десенситизации глюкозной транспортной системы в клетках жировой ткани, инкубированных при высоких концентрациях глюкозы и инсулина, необходим хотя бы в минимальных количествах обмен глюкозы/фосфатов и гексоз. При этом удалось установить, что инсулин осуществляет пермиссивную функцию в глюкозовызванной десентизации и этот эффект не зависит от комплексирования инсулина с рецептором.
Глюкоза, проникшая с помощью глюкозных транспортеров (в основном GLUT-4) внутрь клетки, благодаря участию фермента гексокиназы превращается в глюкозо-6-фосфат, который, в свою очередь, используется: а) для образования гликогена, б) в системе гликолиза (около 95–97%), в) в пентозофосфатном шунте и г) лишь 2–3% — в глюкозаминовом шунте. При гипергликемии, вследствие повышенного поступления глюкозы внутрь клетки, увеличивается включение углеродов глюкозы в фруктозо-6-фосфат или уменьшается доступ глюкозы в систему гликолиза и образования гликогена. Механизм, с помощью которого гипергликемия снижает скорость поступления глюкозы в клетку под влиянием инсулина, называется гексозаминовым шунтом. Увеличение внутриклеточного количества продуктов гексозаминового шунта (гексозфосфатов) по принципу обратной связи регулирует механизмы поглощения глюкозы клеткой, снижая его, что и наблюдается при инсулинрезистентных состояниях.
Свободные жирные кислоты (СЖК) оказывают ингибирующее влияние на окисление глюкозы (цикл Рэндла) и участвуют в поддержании и усилении состояния инсулинорезистентности (рис. 2). Однако, как показали исследования последних лет, неэстерифицированные жирные кислоты (НЭЖК) необходимы для нормальной глюкозостимулированной секреции инсулина. Эффективное и быстрое снижение НЭЖК в крови у здоровых и больных диабетом людей, в свою очередь, влияет на уменьшение базального уровня секреции инсулина (G. Boden, 1999).
В эксперименте на модели «ожирелых» диабетических крыс (Zucker diabetic fatty rat) было показано, что значительное повышение в плазме крови концентрации НЭЖК и триглицеридов в предиабетический период сочетается с резким увеличением содержания триглицеридов в островках поджелудочной железы. Это ингибирующее влияние повышенной концентрации липидов на функцию β-клеток поджелудочной железы получило название липотоксичности.
Механизмы развития инсулиновой резистентности при нарушении жирового обмена (повышение НЭЖК или СЖК) у больных СД 2 типа представлены на рис. 3.
Полученные в последние годы данные позволили внести некоторые коррективы в гипотезу о механизмах, участвующих в развитии инсулиновой резистентности под влиянием повышенного уровня СЖК в крови (рис. 2).
При СД 2 типа отмечаются как снижение количества и аффинности рецепторов к инсулину, так и нарушение инсулино-рецепторного взаимодействия, что сопровождается усилением клинических проявлений инсулинорезистентности и восстановлением этих показателей почти до нормы при снижении массы тела. Помимо рецепторных, имеется значительное число пострецепторных механизмов, участвующих как в генезе инсулинорезистентности, так и в процессах, приводящих к развитию диабета. Инициация передачи гормонального сигнала инсулина начинается с фосфорилирования β-субъединицы инсулинового рецептора, которое осуществляется при помощи тирозинкиназы. Это фосфорилирование, а затем и аутофосфорилирование рецептора инсулина необходимы для реализации последующих этапов пострецепторного действия инсулина, и в частности для активирования и транслокации глюкозных транспортеров (GLUT), наиболее важным из которых является GLUT-4. Экспрессия этого транспортера имеет место только в скелетных мышцах, мышцах сердца и жировой ткани. Гликозилирование, или уменьшение транслокации GLUT-4, сопровождается инсулиновой резистентностью.
Учитывая значимость инсулиновой резистентности в патогенезе сахарного диабета, становится понятна необходимость применения для лечения СД 2 типа препаратов, влияющих в первую очередь на снижение инсулиновой резистентности. Проводимые в течение последних почти 20 лет исследования по созданию таких препаратов завершились успехом, и в настоящее время в клинической практике появились лекарственные средства, объединенные по механизму их действия в группу сенситайзеров инсулина (глитазоны, или тиазолидиндионы).
Они усиливают действие инсулина в мышцах скелета, жировой ткани и в печени. К препаратам этой группы относятся роcиглитазон и пиоглитазон. Механим их действия заключается в способности взаимодействовать с определенным недавно идентифицированным классом ядерных рецепторов PPARγ, играющим основную роль в регуляции дифференцировки адипоцитов и обмена липидов. Оставаясь центральным регулятором адипогенеза, PPARγ осуществляет дифференцировку преадипоцитов в адипоциты. Эту координирующую роль он выполняет в тесной кооперации с другими факторами транскрипции (R. Walczak и P. Tontonoz, 2002). Модулируя инсулиновую чувствительность периферических тканей к инсулину, глитазоны участвуют также в регуляции эндокринной функции жировой ткани, изменяя секрецию соответствующих гормонов жировой ткани (ФНО-a, ингибитор 1 типа активатора плазминогена, адипонектин, лептин и др.), что влияет на снижение скорости развития сосудистых осложнений диабета, вплоть до возможности их обратного развития.
Клиническое применение тиазолидиндионов показывает, что одним из побочных эффектов указанных препаратов является увеличение у пациентов и без того высокой массы тела. Однако на основании специально проведенных исследований можно сделать вывод, что увеличение массы тела при применении этих лекарственных средств происходит за счет подкожного, а не висцерального депо жировой ткани, количество которого имеет статистически высокодостоверное влияние на степень выраженности инсулиновой резистентности и развития сердечно-сосудистых осложнений.
Доказано, что умеренное увеличение массы тела, наблюдаемое у больных СД 2 типа, находящихся на терапии глитазонами, происходит за счет подкожного жирового депо. Так, D. E. Kelley и соавт. (2002) установили, что на фоне приема роcиглитазона при умеренном увеличении массы тела отмечается уменьшение на 10% количества висцерального депо жира, что снижает риск развития сердечно-сосудистых заболеваний.
Тиазолидиндионы (сенситайзеры, или глитазоны) являются высокоаффинными агонистами PPARγ и повышают чувствительность тканей к инсулину, что сопровождалось снижением уровня глюкозы, липидов и инсулина в сыворотке крови как в экспериментах на животных с диабетом, так и у больных СД 2 типа.
Содержание PPARγ в жировой ткани в 10–100 раз выше, чем в других тканях-мишенях для инсулина (мышцы и печень). Под влиянием глитазонов четко отмечается увеличение экспрессии PPARγ, поэтому и в других (нежировых) тканях организма значительно снижается резистентность к инсулину. Имеются данные о непосредственном влиянии глитазонов и на другие гены, участвующие в гомеостазе углеводов в организме; так, глитазоны усиливают экспрессию гена GLUT-4, основного транспортера глюкозы в мышечной и жировой ткани. Агонисты PPARγ, в том числе роcиглитазон (авандиа) и пиоглитазон (актос), увеличивая дифференцировку адипоцитов в жировой ткани, изменяют соотношение мелких и крупных адипоцитов в сторону преобладания первых, которые, в свою очередь, имеют более высокую чувствительность к инсулину по сравнению с крупными адипоцитами.
Глитазоны, повышая чувствительность тканей к инсулину, способствуют усилению утилизации глюкозы периферическими тканями, что проявляется компенсацией углеводного обмена у больных СД 2 типа.
В США тиазолидиндионы в качестве антидиабетических препаратов применяются с 1997 г. и представлены тремя препаратами из этой группы — троглитазон (с 1997 г.), роcиглитазон и пиоглитазон (с мая и июля 1999 г. соответственно).
Троглитазон — первый препарат этой группы — синтезирован в 1983 г., обладает рядом свойств как тиазолидиндиона, так и витамина Е. С 1997 г. препарат применялся для лечения больных диабетом 2 типа в США, но вследствие гепатотоксичности с марта 2000 г., по решению Комиссии по лекарствам и питанию (FDA), в США троглитазон был изъят из списка лекарственных веществ, рекомендованных для применения в клинической практике.
Тщательный анализ всех случаев развития нарушения функции печени на фоне приема троглитазона показал, что более часто такие побочные явления развивались у тех больных, у которых до начала терапии отмечалось повышение активности аланинаминотрансферазы (АЛТ) в 3 раза выше верхней границы нормальных значений. В противопоказаниях к лечению глитазонами указано, что терапию можно проводить тем пациентам, у которых до начала лечения уровень АЛТ в сыворотке не превышает в 2, 5 раз верхнюю границу нормы. В период лечения глитазонами необходимо осуществлять мониторинг содержания АЛТ в сыворотке крови не реже 1 определения в квартал.
Клиническое применение пиоглитазона показало значительную его эффективность в терапии больных, страдающих СД 2 типа. В ходе многоцентрового двойного слепого плацебоконтролируемого исследования (M. Brockley и R. L. Schneider, 2000) удалось показать, что применение пиоглитазона в разовой дозе 15 и 30 мг в день в качестве монотерапии сопровождалось улучшением клинических проявлений у больных СД 2 типа и достоверным снижением у них уровней гликемии и гликогемоглобина.
В ходе другого двойного слепого исследования (S. Shaffer и соавт., 2000) изучалось влияние различных доз пиоглитазона (7,5; 15; 30 и 45 мг) на компенсацию СД 2 типа. Было установлено, что терапия пиоглитазоном хорошо переносится больными, а снижение уровня гликемии и НbА1с статистически достоверно и зависит от дозы препарата. Отмечались хорошая переносимость препарата и отсутствие каких-либо признаков гепатотоксичности.
Сравнительное изучение сахароснижающего действия пиоглитазона и акарбозы, проведенное B. Gora (2000) у 118 больных СД 2 типа, показало, что у пациентов, получающих пиоглитазон, уровень гликогемоглобина в крови снизился на 1,1%, уровень глюкозы в крови натощак — на 2,7 ммоль/л, инсулина — на 9 мкЕД/мл, тогда как у пациентов, получавших лечение акарбозой, перечисленные показатели уменьшились лишь на 0,3% и 1,2 ммоль/л соответственно, а содержание инсулина в крови даже повысилось на 1,5 мкЕД/мл. Одновременно отмечено снижение содержания триглицеридов и липопротеидов низкой плотности (ЛПНП) у больных, получавших лечение пиоглитазоном, тогда как при приеме акарбозы эти показатели оставались неизменными или даже были выше, чем до проводимой терапии.
Убедительные данные, полученные D. Einhorn и соавт. (2000), свидетельствуют о синергетическом влиянии пиоглитазона и метформина на состояние углеводного, липидного обмена. У 328 больных, получавших терапию пиоглитазона (30 мг) с метформином, наблюдалось статистически достоверное снижение HbA1c и гликемии натощак по сравнению с группой больных, получавших плацебо + метформин. В другом исследовании, проведенном этой же группой авторов (D. Einhorn и соавт., 2001), прослеживалось влияние лечения пиоглитазоном у 727 больных (монотерапия — 56 больных, пиоглитазон + препараты сульфонилмочевины — 236, пиоглитазон + инсулин — 313 и пиоглитазон + метформин — 154 больных) на протяжении 72 нед. Препарат хорошо переносился больными — за период наблюдения не отмечалось никаких нежелательных явлений.
Особый интерес представляет исследование P. C. Davidson и соавт. (2001), в ходе которого изучалось влияние пиоглитазона (45 мг) и роcиглитазона (8 мг) на течение диабета у больных, ранее получавших лечение троглитазоном. Если при приеме троглитазона у больных СД 2 типа содержание гликогемоглобина в крови снизилось с 8,1 до 7,5%, то под влиянием пиоглитазона у этих пациентов отмечалось дальнейшее его снижение — до 7,1%, причем максимального эффекта удавалось достичь через 6 мес. В группе больных, получавших роcиглитазон, уровень гликозилированного гемоглобина не изменился. Снижение триглицеридов и повышение холестерина липопротеидов высокой плотности (ЛПВП) в сыворотке крови было более выраженным у больных, получавших пиоглитазон, по сравнению с роcиглитазоном. Что касается общего холестерина и холестерина ЛПНП, то у больных, получавших пиоглитазон, отмечалось уменьшение этих показателей, тогда как у пациентов, находившихся на терапии роcиглитазоном, указанные показатели повысились. Однако у лиц, получавших пиоглитазон, за период лечения отмечена прибавка массы тела в среднем на 2,5 кг, тогда как у больных, применявших роcиглитазон, масса тела снизилась в среднем на 400 г.
Проведенные исследовании позволили установить новые аспекты действия агонистов PPARγ-рецепторов, что расширяет сферу применения препаратов этой группы при терапии сахарного диабета. Так, показано, что агонисты оказывают влияние на ангиогенез. Сосудистый эндотелиальный фактор роста (СЭФР, или VEGF) является ключевым регулятором внутриглазных ангиогенных заболеваний, к которым относятся диабетическая ретинопатия, возрастная дегенерация макулы и преждевременная ретинопатия. Как показали исследования T. Murata и соавт. (2001), тиазолидиндионы ингибируют интраокулярный ангиогенез.
На основании экспериментальных и клинических исследований можно сделать вывод, что пиоглитазон является новым эффективным сахароснижающим препаратом, который может использоваться как в качестве монотерапии, так и в сочетании с другими препаратами (пероральные сахароснижающие препараты, метформин, акарбоза, инсулин). Наряду с этим при лечении пиоглитазоном наблюдается тенденция к нормализации липидного обмена, и в первую очередь триглицеридов и холестерина ЛПВП. Препарат хорошо переносится и не обладает гепатотоксичностью. Он показан при СД 2 типа, который, как известно, сопровождается инсулинорезистентностью.
Росиглитазон, или авандиа, также относится к препаратам из группы тиазолидиндионов. В апреле 1999 г., после многолетних, многоцентровых и широкомасштабных клинических исследований, роcиглитазон был зарегистрирован в Мексике, в мае того же года — в США, в июле 2000 г. — в странах ЕС.
Росиглитазон быстро и практически полностью абсорбируется в желудочно-кишечном тракте, биодоступность препарата составляет в среднем — 99% (P. J. Cox и соавт., 2000). Прием пищи и рН желудочного сока не влияют на абсорбцию роcиглитазона в желудочно-кишечном тракте.
Росиглитазон является высокоселективным PPARγ-агонистом, его активность в 100 раз превышает таковую у троглитазона и в 30 раз — у пиоглитазона.
Исследования, проведенные в клеточной культуре на интактных мышиных 3Т3-L1 или адипоцитах человека (P. W. Young и соавт., 1998), показали, что у роcиглитазона аффинность к комплексированию с рецепторами выше, чем у пиоглитазона, тогда как у троглитазона аффинность к комплексированию с рецептором ниже, чем у тиоглитазона. Изучение степени выраженности сахароснижающего действия тиазолидиндионов in vivo показывает, что, исходя из их относительной сахароснижающей активности, препараты следует распределить следующим образом: роcиглитазон>пиоглитазон>троглитазон (J. Berger и соавт., 1996; P. W. Young и соавт., 1998).
Механизм действия роcиглитазона, как и других препаратов из этой группы, обусловлен его взаимодействием с PPARγ, который принадлежит к суперсемейству транскрипционных факторов рецепторов ядерных гормонов и экспрессируется в основном в белом жире, а у животных — в «буром» жире. Экспериментальные и клинические данные показывают, что основное действие тиазолидиндионов осуществляется в жировой ткани, где они оказывают стимулирующее влияние на дифференцировку адипоцитов. Однако имеется ряд убедительных свидетельств в пользу того, что этот класс препаратов обладает не только периферическим, но и центральным действием. Так, установлено, что роcиглитазон оказывает влияние на метаболизм глюкозы в печени (S. L. Grossman и J. Lessem, 1997) и мышцах.
Изучая влияние роcиглитазона на регуляцию экспрессии генов в адипоцитах человека, J. Rieusset и соавт. (1999) впервые продемонстрировали, что стимуляция PPARγ вызывает экспрессию мРНК субъединицы р85a фосфатидилинозитол-3-киназы, которая является одной из важных субъединиц рецептора к инсулину, участвующей в трансдукции биологического действия инсулина и влияющей на транспорт и внутриклеточный метаболизм глюкозы. Этот механизм в какой-то мере объясняет влияние тиазолидиндионов на повышение тканевой чувствительности к инсулину.
Дальнейшим подтверждением прямого влияния росиглитазона на секреторную активность β-клеток послужили исследования C. Yang и соавт. (2001), в ходе которых было показано, что роcиглитазон в дозе 0,045–4,5 мкгмоль/л стимулировал секрецию и высвобождение инсулина, статистически достоверно повышая как первую (на 80,7%), так и вторую фазу (на 52,4%) его секреции. Представляют интерес наблюдения L. Chao и соавт. (2000), которые показали, что у мышей с высокой гипергликемией, гиперлипидемией и инсулиновой резистентностью, но без жировой ткани, роcиглитазон восстанавливал нарушенный липидный обмен, тогда как показатели углеводного обмена и секреции инсулина оставались без изменений. Эти исследования являются свидетельством того, что от наличия жировой ткани в организме зависит проявление антидиабетических эффектов роcиглитазона, но не коррекция нарушений обмена липидов.
Роcиглитазон, как и другие препараты из группы тиазолидиндионов, способствует повышению массы тела и ИМТ, в основном за счет увеличения подкожно-жирового депо, при этом снижаются количество висцерального депо и степень выраженности печеночного стеатоза (гепатоза) и гепатомегалии (D. G. Carey и соавт., 2000). Однако это побочное действие роcиглитазона может быть сведено к минимуму или даже полностью нивелироваться при одновременном применении низкокалорийной диеты (B. C. Richard и соавт., 2002). Длительная терапия тиазолидиндионами в ряде случаев сопровождается увеличением объема циркулирующей плазмы при снижении концентрации гемоглобина в крови (результат разведения), при этом происходит задержка жидкости в организме, наблюдавшаяся как у здоровых добровольцев, получавших в течение 8 нед по 8 мг препарата в сут, так и у больных СД 2 типа (M. A. Kahn и соавт., 2002). По данным P. Dogterom и соавт. (1999), роcиглитазон не влияет на эритропоэз или на преждевременную деструкцию эритроцитов.
Применение роcиглитазона у больных СД 2 типа сопровождалось статистически достоверным снижением гликемии и уровня гликозилированного гемоглобина (Y. Miyazaki и соавт, 2001; J. J. Holan и соавт., 2000). Следует отметить, что снижение гликемии наступает лишь через 2–4 нед от начала терапии, а уменьшение гликозилированного гемоглобина — после 8-й нед лечения.
M. A. Khan и соавт. (2002) провели сравнительную оценку эффективности роcиглитазона (2–8 мг/сут) и пиоглитазона (15–45 мг/сут) у 60 больных СД 2 типа, которым до этого проводилось лечение троглитазоном. У больных обеих групп после 4 мес лечения уровень гликозилированного гемоглобина в крови остался на исходном уровне, но при этом у всех пациентов отмечалось увеличение массы тела почти на 2 кг.
У больных, получавших лечение пиоглитазоном, улучшился липидный профиль, тогда как в группе больных, леченных роcиглитазоном, — практически не изменился.
K. A. Virtanen и соавт. (2002) изучали влияние роcиглитазона и метформина на поглощение глюкозы жировой тканью у больных СД 2 типа. На фоне приема роcиглитазона отмечалось повышение инсулинстимулированного поглощения глюкозы в висцеральную жировую ткань, и особенно в подкожно-жировую ткань области бедер, что проявлялось улучшением чувствительности к инсулину. У больных, получавших метформин, отмечалось уменьшение количества подкожно-жировой клетчатки в области живота с повышением поглощения глюкозы в этой области.
Показано, что повышение СЖК в сыворотке крови больных СД 2 типа сопровождается более выраженной инсулиновой резистентностью и ухудшением течения диабета (G. Boden, 1999). Тиазолидиндионы, видимо, посредством повышения чувствительности периферических тканей к инсулину модифицируют липолиз, приводя к снижению уровня СЖК в сыворотке крови больных. Так, под влиянием 26-недельной терапии роcиглитазоном в дозе 4 или 8 мг в день, L. S. Phillips и соавт. (2001) отметили снижение СЖК на 7 и 19% от исходного уровня, тогда как у пациентов, получавших плацебо, выявлено повышение уровня СЖК на 4%. Более выраженное снижение уровня СЖК (на 14 и 23% соответственно) на фоне терапии авандиа наблюдалось в исследовании V. Fonseca и соавт. (2000).
Недостаточная функция β-клеточного аппарата подтверждается повышением уровня проинсулина в сыворотке крови и увеличением соотношения проинсулин/инсулин. Изменение этого состояния в сторону уменьшения отношения проинсулин/инсулин в сыворотке крови указывает на восстановление функциональной активности островкового аппарата поджелудочной железы. Изучая влияние роcиглитазона на функцию β-клеток у больных СД 2 типа, L. E. Porter и соавт. (2000) впервые отметили тенденцию к нормализации отношения проинсулин/инсулин и повышению уровня инсулина в сыворотке крови, тогда как у больных, получающих плацебо или глибурид, этот эффект отсутствовал. В дальнейшем это положительное влияние роcиглитазона было подтверждено F. Ovalle и D. S. H. Bell (2002). Представляет интерес тот факт, что другой широко использующийся препарат из группы тиазолидиндионов — актос, или пиоглитазон, не оказывает подобного влияния на функцию островкового аппарата поджелудочной железы (K. Kubo, 2002).
Помимо сахароснижающего действия, роcиглитазон достоверно уменьшает степень выраженности инсулинорезистентности, характерной для СД 2 типа. Назначение роcиглитазона повышает чувствительность тканей к инсулину, и этот эффект усиливается благодаря ограничениям в пищевом рационе (L. Pickavance и соавт., 1999). Применение роcиглитазона в дозе от 2 до 8 мг/сут в качестве монотерапии у больных СД 2 типа сопровождалось статистически достоверным снижением инсулинорезистентности, тогда как у пациентов, получавших глибенкламид (T. B. Leonard и соавт., 2001) или плацебо (J. Gerich и соавт., 2001), показатели инсулинорезистентности оставались без изменений. Уменьшение степени выраженности инсулиновой резистентности у больных СД 2 типа под влиянием терапии роcиглитазоном снижает на 9–27% риск развития сердечно-сосудистых заболеваний (T. B. Leonard и соавт., 2001).
Таким образом, тиазолидиндионы улучшают гликемический контроль диабета посредством изменения инсулинорезистентности и функциональной активности β-клеток; их эффективность является результатом первичного уменьшения гликогенолитического и глюконеогенного компонентов образования глюкозы в печени. Следовательно, тиазолидиндионы (актос и авандия) представляют собой новый класс сахароснижающих препаратов, обладающих патогенетическим влиянием на уменьшение степени выраженности инсулиновой резистентности при СД 2 типа, которая, в свою очередь, является одной из основных причин развития сахарного диабета.
По вопросам литературы обращайтесь в редакцию.
Е. М. Клебанова, кандидат медицинских наук
М. И. Балаболкин, доктор медицинских наук, профессор
В. М. Креминская, кандидат медицинских наук
ММА им И. М. Сеченова, Москва