как узнать геометрическую форму молекулы
Гибридизация электронных орбиталей и геометрия молекул
В 1930 г. Слейтером и Л. Полингом была развита теория образования ковалентной связи за счет перекрывания электронных орбиталей – метод валентных связей. В основе этого метода лежит метод гибридизации, который описывает образование молекул веществ за счет «смешивания» гибридных орбиталей («смешиваются» не электроны, а орбитали).
Определение типа гибридизации молекул с ковалентной связью
Определить тип гибридизации можно только для молекул с ковалентной связью типа АВn, где n больше или равно двум, А – центральный атом, В – лиганд. В гибридизацию вступают только валентные орбитали центрального атома.
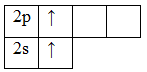
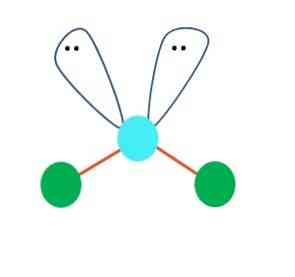
Определим тип гибридизации на примере молекулы BeH2.
Первоначально записываем электронные конфигурации центрального атома и лиганда, рисуем электронно-графические формулы.
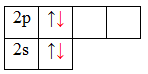
Атом бериллия (центральный атом) имеет вакантные 2p-орбитали, поэтому, чтобы принять по одному электрону от каждого атома водорода (лиганд) для образования молекулы BeH2 ему необходимо перейти в возбужденное состояние:
Образование молекулы BeH2 происходит за счет перекрывания валентных орбиталей атома Be
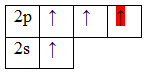
* красным цветом обозначены электроны водорода, черным – бериллия.
Тип гибридизации определяют по тому, какие орбитали перекрылись, т.о., молекула BeH2 находитс в sp – гибридизации.
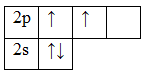
Помимо молекул состава ABn, методом валентных связей можно определить тип гибридизации молекул с кратными связями. Рассмотрим на примере молекулы этилена C2H4. В молекуле этилена кратная двойная связь, которая образована 
У атома углерода имеется еще одна вакантная p-орбиталь, следовательно, чтобы принять 4 атома водорода ему необходимо перейти в возбужденное состояние:
Определение геометрической структуры молекул
Геометрическую структуру молекул, а также катионов и анионов состава АВn можно с помощью метода Гиллеспи. В основе этого метода – валентные пары электронов. На геометрическую структуру оказывают влияние не только электроны, участвующие в образовании химической связи, но и неподеленные электронные пары. Каждую неподеленную пару электронов в методе Гиллеспи обозначают Е, центральный атом – А, лиганд – В.
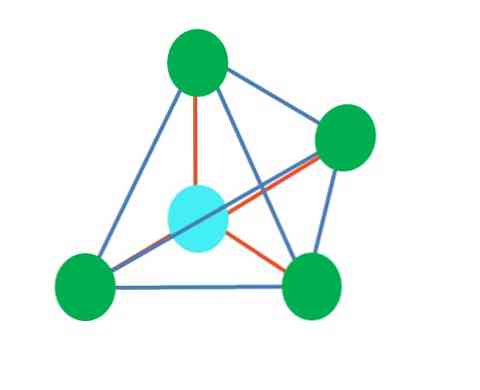
Если неподеленных электронных пар нет, то состав молекул может быть АВ2 (линейная структура молекулы), АВ3 (структура плоского треугольника), АВ4 (тетраэдрическая структура), АВ5 (структура тригональной бипирамиды) и АВ6 (октаэдрическая структура). От базисных структур могут быть получены производные, если вместо лиганда появляется неподеленная электронная пара. Например: АВ3Е (пирамидальная структура), АВ2Е2 (угловая структура молекулы).
Чтобы определить геометрическую структуру (строение ) молекулы необходимо определить состав частицы, для чего вычисляют количество неподеленных лектронных пар (НЕП):
НЕП = (общее число валентных электронов – число электронов, пошедших на образование связи с лигандами) / 2
На связь с H, Cl, Br, I, F уходит по 1-му электрону от А, на связь с O – по 2 электрона, а на связь с N – по 3 электрона от центрального атома.
Рассмотрим на примере молекулы BCl3. Центральный атом – B.
НЕП = (3-3)/2 = 0, следовательно неподеленных электронных пар нет и молекула имеет структуру АВ3 – плоский треугольник.
Подробно геометрическое строение молекул разного состава представлено в табл. 1.
Таблица 1. Пространственное строение молекул
Типы и примеры молекулярной геометрии
молекулярная геометрия или молекулярная структура пространственное распределение атомов вокруг центрального атома. Атомы представляют области, где существует высокая электронная плотность, и поэтому считаются электронными группами, независимо от того, какие связи образуют (одинарные, двойные или тройные)..
Эта концепция основана на комбинации и экспериментальных данных двух теорий: теории валентной связи (TEV) и отталкивания электронных пар валентной оболочки (VSPR). В то время как первый определяет связи и их углы, второй устанавливает геометрию и, следовательно, молекулярную структуру.
Какие геометрические формы могут принимать молекулы? Две предыдущие теории дают ответы. Согласно ВСЭПР, атомы и пары свободных электронов должны располагаться в пространстве таким образом, чтобы минимизировать электростатическое отталкивание между ними..
В треугольнике три зеленые точки ориентированы на расстоянии 120º. Этот угол, равный углу связи, позволяет атомам отталкивать друг друга как можно меньше. Следовательно, молекула с центральным атомом, присоединенным к трем другим, примет геометрию тригональной плоскости..
Тем не менее, VSCR предсказывает, что свободная пара электронов в центральном атоме будет искажать геометрию. Для случая тригональной плоскости эта пара будет отталкивать три зеленые точки, что приведет к геометрии тригональной пирамиды..
То же самое может случиться и с октаэдром изображения. В нем все атомы разделены максимально устойчиво.
Как заранее узнать молекулярную геометрию атома X?
Для этого необходимо также рассматривать пары свободных электронов как электронные группы. Они вместе с атомами будут определять то, что известно как электронная геометрия, который является неразлучным спутником молекулярной геометрии.
Из электронной геометрии и по обнаружению структурой Льюиса пар свободных электронов мы можем установить, какой будет молекулярная геометрия. Сумма всех молекулярных геометрий даст представление о глобальной структуре.
тип
Как видно из основного изображения, молекулярная геометрия зависит от того, сколько атомов окружает центральный атом. Однако, если пара электронов присутствует без разделения, она изменит геометрию, потому что она занимает много объема. Следовательно, он оказывает стерическое действие.
В соответствии с этим геометрия может представлять серию характерных форм для многих молекул. И именно здесь возникают различные типы молекулярной геометрии или молекулярной структуры.
Когда геометрия равна структуре? Оба обозначают одно и то же только в тех случаях, когда структура не имеет более одного типа геометрии; в противном случае необходимо учитывать все существующие типы, а структура должна иметь глобальное имя (линейное, разветвленное, глобулярное, плоское и т. д.)..
Геометрия особенно полезна для объяснения структуры твердого тела из его структурных единиц.
линейный
Все ковалентные связи являются направленными, поэтому связь A-B является линейной. Но будет ли молекула AB линейной?2? Если да, геометрия просто представлена как: B-A-B. Два атома B разделены углом 180 °, и согласно TEV, A должен иметь sp-гибридные орбитали.
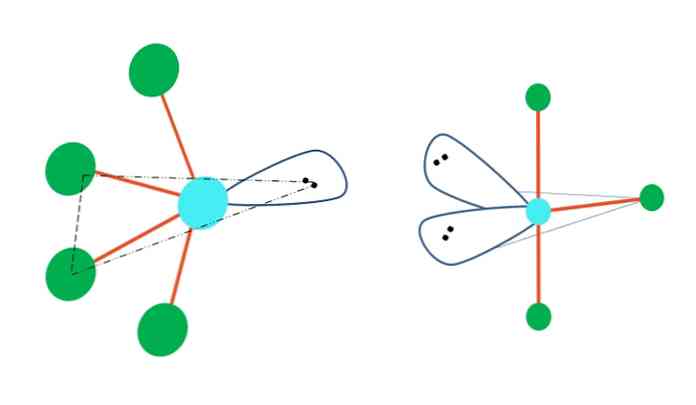
угловая
Можно предположить в первую очередь линейную геометрию для молекулы AB2; Тем не менее, важно нарисовать структуру Льюиса, прежде чем прийти к выводу. Рисуя структуру Льюиса, можно определить количество пар электронов без разделения (:) на атоме А.
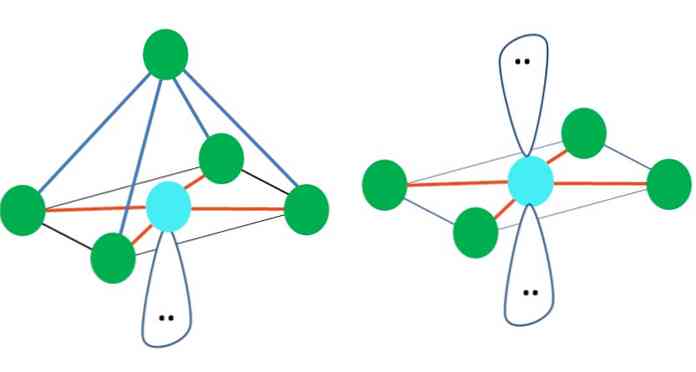
Когда это так, поверх электронных пар они толкают два атома B вниз, изменяя их углы. В результате линейная молекула B-A-B в конечном итоге становится V, бумерангом или угловой геометрией (верхнее изображение)
Молекула воды, H-O-H, является идеальным примером для этого типа геометрии. В атоме кислорода есть две пары электронов без разделения, которые ориентированы под приблизительным углом 109º.
Почему этот угол? Потому что электронная геометрия является тетраэдрической, которая имеет четыре вершины: две для атомов H и две для электронов. На изображении выше обратите внимание, что зеленые точки и две «доли с глазами» рисуют тетраэдр с голубоватой точкой в центре.
Если бы у О не было пар свободных электронов, вода образовала бы линейную молекулу, ее полярность уменьшилась бы, и океаны, моря, озера и т. Д., Вероятно, не существовали бы, как они известны.
четырехгранный
Верхнее изображение представляет тетраэдрическую геометрию. Для молекулы воды ее электронная геометрия является тетраэдрической, но, удаляя пары без электронов, можно заметить, что она превращается в угловую геометрию. Это также наблюдается просто путем устранения двух зеленых точек; остальные два нарисуют V с синей точкой.
Что, если вместо двух пар свободных электронов был только один? Тогда была бы тригональная плоскость (основное изображение). Однако, исключая электронную группу, стерический эффект, создаваемый парой свободных электронов, не исключается. Следовательно, он искажает треугольную плоскость в треугольную базовую пирамиду:
Хотя геометрическая геометрия тригональной и тетраэдрической пирамиды различна, электронная геометрия одинакова: тетраэдрическая. Таким образом, треугольная пирамида не считается электронной геометрией?
По этой причине всегда важно сначала определить электронную геометрию с помощью структур Льюиса, прежде чем определять молекулярную геометрию. Молекула аммиака, NH3, пример молекулярной геометрии тригональной пирамиды, но с тетраэдрической электронной геометрией.
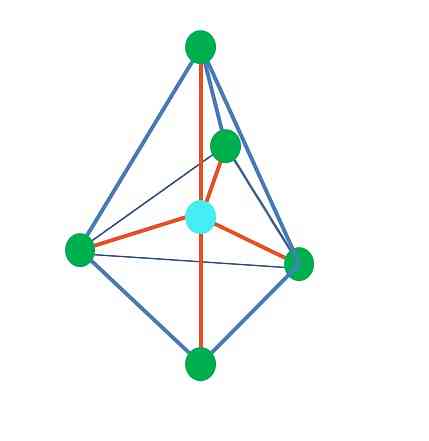
Тригональная бипирамида
Из тригональной дипирамидальной геометрии вокруг центрального атома пять электронных групп. На верхнем изображении вы видите пять зеленых точек; три в треугольном основании и два в осевых положениях, которые являются верхней и нижней вершинами пирамиды.
Какую гибридизацию имеет голубая точка? Для образования простых связей (оранжевого цвета) нужны пять гибридных орбиталей. Это достигается с помощью пяти sp орбиталей 3 d (произведение смеси орбиталей s, три p и a d).
Аксиальные и экваториальные позиции
В аксиальном положении пара электронов будет «давить» перпендикулярно (90º) на треугольном основании, в то время как если бы оно находилось в экваториальном положении, две оставшиеся электронные группы основания были бы на расстоянии 120º друг от друга и сжимали бы оба конца на 90º (вместо три, как с базой).
Поэтому центральный атом будет стремиться ориентировать свои безэлектронные пары в экваториальных положениях, чтобы генерировать более стабильные молекулярные геометрии.
Колеблющаяся и Т-образная форма
Если бы тригональная геометрия бипирамиды заменила один или несколько ее атомов безэлектронными парами, она также имела бы другую молекулярную геометрию.
Слева от верхнего изображения геометрия меняется на колеблющуюся форму. В ней свободная пара электронов толкает остальные четыре атома в одном направлении, складывая их связи влево. Обратите внимание, что эта пара и два атома лежат в одной треугольной плоскости исходной дипирамиды.
Итак, для молекулы типа AB5, он принимает треугольную геометрию бипирамиды. Тем не менее, AB4, с той же электронной геометрией, она примет колеблющуюся геометрию; и AB3, Т-образная геометрия. Во всех них А будет иметь (в основном) sp-гибридизацию 3 d.
Для определения геометрии молекулы необходимо нарисовать структуру Льюиса и, следовательно, ее электронную геометрию. Если это тригональная бипирамида, то свободные от электронов пары будут отбрасываться, но не их стерическое воздействие на остальные атомы. Таким образом, можно идеально различить три возможных молекулярных геометрии.
восьмигранный
Октаэдрическая молекулярная геометрия представлена справа от основного изображения. Этот тип геометрии соответствует соединениям AB6. AB4 они образуют квадратное основание, в то время как остальные два B расположены в осевом положении. Таким образом, образуются несколько равносторонних треугольников, которые являются гранями октаэдра.
Здесь, опять же, могут быть (как и во всех электронных геометриях) пары свободных электронов, и, следовательно, другие молекулярные геометрии происходят из этого факта. Например, АБ5 с восьмигранной электронной геометрией состоит из пирамиды с квадратным основанием и AB4 квадратной плоскости:
В случае октаэдрической электронной геометрии эти две молекулярные геометрии являются наиболее устойчивыми с точки зрения электростатического отталкивания. В квадратно-плоской геометрии две электронные пары расположены на расстоянии 180 °.
Другие молекулярные геометрии
Модифицируя основания упомянутых выше пирамид, можно получить некоторые более сложные молекулярные геометрии. Например, пятиугольная бипирамида основана на пятиугольнике, и соединения, которые ее образуют, имеют общую формулу AB7.
Как и другие молекулярные геометрии, замена атомов B на пары без электронов приведет к искажению геометрии к другим формам..
Кроме того, соединения AB8 они могут принимать такие геометрии, как квадратная антипризма. Некоторые геометрии могут быть очень сложными, особенно для формул AB7 вперед (до AB12).
примеров
Далее будет упомянут ряд соединений для каждой из основных молекулярных геометрий. В качестве упражнения вы могли бы нарисовать структуры Льюиса для всех примеров и подтвердить, что, учитывая электронную геометрию, вы получаете молекулярную геометрию, как указано ниже..
Линейная геометрия
-Хлорид бериллия, BeCl2 (Cl-Be-Cl)
-Углекислый газ, СО2 (O = C = O)
-Дибромид ртути, HgBr2 (Br-Hg-Br)
-Цианид водорода, HCN (H-N≡C)
Его углы должны быть 180º, и, следовательно, иметь sp-гибридизацию.
Угловая геометрия
—Вода
-Диоксид азота, НЕТ2
Тригональная плоскость
-Трифторид брома, BF3
-Алюминий трихлорид, AlCl3
-Анион карбонат, СО3 2-
четырехгранный
-Четыреххлористый углерод, CCl4
-Анион сульфат, СО4 2-
Треугольная пирамида
-Катион гидроний, ч3О +
Тригональная бипирамида
-Пентафторид фосфора, ПФ5
-Пентахлорид сурьмы, SbF5
колеблющийся
Тетрафторид серы, SF4
Форма Т
-Трихлорид йода, ICl3
-Хлористый трифторид, ClF3 (оба соединения известны как интергалогены)
восьмигранный
-Сера гексафторид, SF6
-Селен гексафторид, SeF6
Кульминацией молекулярной геометрии является то, что объясняет наблюдения химических или физических свойств вещества. Тем не менее, он ориентирован в соответствии с электронной геометрией, так что последний всегда должен быть определен до первого.
Геометрия молекул
Геометрия молекул
Российский университет дружбы народов, Москва
ВВедение
Определение пространственного расположения атомов в молекуле, то есть геометрии молекулы, представляет собой в настоящее время задачу, вполне разрешимую даже для достаточно сложной молекулы, путем решения соответствующей квантовохимической задачи.
Вместе с тем существуют приближенные подходы, которые могут быть использованы для анализа экспериментальных данных по геометрическим конфигурациям молекул.
К числу подобных подходов относятся:
— метод валентных связей
— метод трехцентровых связей
— метод отталкивания валентных электронных пар
метод валентных связей
Метод валентных связей наиболее известен и включает рассмотрение таких понятий как валентность, гибридизация атомных орбиталей, направленность ковалентных связей и т. д.
Согласно теории валентных связей химическая связь между двумя атомами А и В образуется с помощь общей пары электронов
А + В = А ¯ В ковалентная связь
А ¯ + В = А ¯ В донорно-акцепторная связь
Валентность характеризует способность атомов, образовывать химические связи, и равна числу химических связей образованных атомом. Согласно методу валентных связей валентность равна числу общих пар электронов, а в случае ковалентной связи валентность равна числу неспаренных электронов на внешнем уровне атомов в основном или возбужденных состояниях.
C 2s22p2 ¯ вал = II C=O
C* 2s12p3 вал = IV О=C=O
S 3s23p4 ¯ ¯ вал = II H-S-H
S* 3s23p33d1 ¯ вал = IV SO2
S** 3s13p33d2 вал = VI SO3
Гибридизация атомных орбиталей – это смешивание АО разных подуровней атома, электроны которых участвуют в образовании эквивалентных s-связей. Для определения типа гибридизации определяют число s-связей, образованных атомом.
 |
Расположение гибридных орбиталей
Три неспаренных электрона на гибридных орбиталях бора взаимодействуют с неспаренными р-электронами фтора с образованием трех ковалентных связей. В силу направленности ковалентных связей эти три связи располагаются под теми же углами 120о, что и гибридные орбитали, и молекула BF3 имеет плоское строение с углами 120о между связями.
Молекула СlF3. Атом хлора в основном состоянии имеет лишь один неспаренный электрон. Для объяснения существующей и равной трем валентности хлора предполагается переход этого атома в возбужденное состояние: Cl 3s23p5 ® Cl* 3s23p43d1, в котором имеются три неспаренных электрона. Поскольку в гибридизации участвуют АО, содержащие как по одному, так и по два электрона, то имеется пять dsp3-ГО, на которых находятся две неподеленные пары и три неспаренных электрона (рис.1.). Подобные гибридные орбитали имеют тригонально-бипирамидальное расположение. Из пяти возможных мест координации (двух аксиальных и трех экваториальных) более выгодными (с меньшим межлигандным отталкиванием) оказываются экваториальные положения. Именно два из них и занимаются неподеленными парами. А неспаренные электроны занимают оставшееся экваториальное положение и аксиальные положения. В силу направленности ковалентных связей расположение связей Cl – F аналогично расположению орбиталей с неспаренными электронами, а молекула ClF3 имеет Т-образное строение с углом между связями, близким к 90о.

Рис. 1. Геометрия молекулы ClF3 в методе валентных связей: расположение гибридных орбиталей; расположение связей и неподеленных пар; расположение связей.
Метод трехцентровых связей
Применение метода валентных связей к элементам VА – VIIIА групп периодической системы элементов требует возбуждения одного или нескольких электронов с орбитали р на орбиталь d. Энергия подобного возбуждения велика и, во всяком случае, больше энергии двух образующихся связей. Это означает, что такое возбуждение не может иметь место во время образования связи и что использование теории валентных связей для этих соединений не корректно. Так для р-элементов V – VIII групп периодической системы разница между энергиями ns—, np- и nd-орбиталями более 1000 кДж/моль. Это значит, что энергии ns-орбиталей малы, энергии nd—орбиталей велики, чтобы взаимодействовать с орбиталями других атомов. Поэтому только np—орбитали могут взаимодействовать с орбиталями других атомов. Однако число неспаренных np— электронов недостаточно для объяснения возможных валентностей и уменьшается к концу периода, в то время как высшая валентность увеличивается. Возникает вопрос, могут ли пары р-электронов образовывать связи? Положительный ответ на этот вопрос дает теория трехцентровых связей.
Рассмотрим трехатомную линейную молекулу MX2 с помощью метода МО. Атом М имеет р-орбиталь с двумя электронами. Каждый из двух атомов X имеет одну р-орбиталь, содержащую один электрон. Взаимодействие этих орбиталей приводит к системе из трех МО: s (связывающей), s0 (несвязывающей) и s* (антисвязывающей). Связывающие и антисвязывающие МО содержат вклады всех трех атомов, несвязывающие МО образованы АО только двух атомов лигандов (рис.2).
Рис. 2. Схема МО линейного трехцентрового фрагмента Х-М-Х.
Такая система устойчива, порядок связи равен 0,5(2-0) = 1 для трехцентровой связи, т. е. по 0,5 единиц на каждую двухцентровую связь. Подобная связь менее устойчива, чем двухцентровая ковалентная связь.
Видно, что перед образованием связи атом М имел два электрона, атомы Х имели по одному электрону. В образовавшейся системе АО атомов Х формируют целиком несвязывающую МО и участвуют в образовании связывающей МО, и на них находится существенно больше двух электронов. Таким образом, образование подобной трехцентровой связи сопровождается переносом электронной плотности с атома М на атом Х. Это может иметь место только при условии, если атомы Х будут существенно более электроотрицательными, чем атом М.
Можно сделать вывод. Электронная пара р-электронов способна к образованию связи с двумя электроотрицательными лигандами с образованием линейного трехцентрового фрагмента. Подобные связи называются трехцентровыми или гипервалентными I.
Квантовохимические расчеты показали, что в случае максимальной валентности р-элемента его s-электроны могут частично принимать участие в образовании связи и образовывать связи, называемые гипервалентные II и более прочные, чем в рассмотренном случае трехцентровых связей. Геометрическое расположение связей в этом случае определяется их взаимным отталкиванием.
Таким образом, в соединениях р-элементов могут быть три типа химических связей: ковалентные связи, трехцентровые связи (или гипервалентные I) и гипервалентные II связи.
Теория трехцентровых связей – это логическое продолжение теории валентных связей в случаях, когда возбуждения s®p или p®d маловероятны, а центральный атом имеет неподеленную пару р-электронов. В соединениях, образование которых не требует возбуждения электронов или для которых энергия подобного возбуждения мала, образуются только ковалентные связи и использование теории валентных связей оправдано и корректно.
Молекулы SF2, SF4, SF6.
Сера имеет два неспаренных р-электрона, неподеленную пару р-электронов и неподеленную пару s-электронов.
В молекуле SF2 обе образующиеся связи – ковалентные. В молекуле SF4 две связи – ковалентные и одна связь – трехцентровая, гипервалентная I. В молекуле SF6 валентность серы максимальна и все связи – гипервалентные II.
Молекула SF2 угловая из-за взаимодействия связывающих пар электронов с неподеленными парами электронов серы.
Молекула SF4 содержит линейный фрагмент F-S-F трехцентровой связи. Две ковалентные связи и неподеленная пара электронов серы лежат в плоскости перпендикулярной этому фрагменту с учетом их взаимного отталкивания (рис.3).
Молекула SF6 октаэдрическая, так как подобному расположению лигандов соответствует их минимальное отталкивание.
Атом хлора имеет один неспаренный электрон и две неподеленные пары р-электронов. Этот атом может образовать одну ковалентную и две трехцентровые связи.
В молекуле ClF имеется она ковалентная связь, в молекуле ClF3 – одна ковалентная и одна трехцентровая связи, а в молекуле ClF5 – одна ковалентная и две трехцентровые связи.
Поскольку каждой трехцентровой связи соответствует линейный фрагмент, то молекула ClF3 имеет Т-образную форму, молекула ClF5 – форму тетрагональной пирамиды (рис.3).
Атом ксенона не имеет неспаренных электронов и не может образовывать ковалентные связи. Однако ксенон имеет три неподеленные пары р-электронов и может образовывать до трех трехцентровых связей.
В молекуле XeF2 имеется одна гипервалентная I связь, в молекуле XeF4- две, а в молекуле XeF6- три таких же связи.
Вследствие взаимного расположения трехцентровых связей молекула XeF2 – линейная, молекула XeF4 – квадратная, а молекула XeF6 – октаэдрическая. Энергии образующихся связей невелики, они меньше, чем энергии ковалентных связей, однако молекулы устойчивы.
Рис. 3. Геометрия молекул SF4, SF6, ClF3, ClF5 в методе трехцентровых связей. Обозначения связей: ковалентные – черные толстые, гипервалентные I – серые, гипервалентные II – черные тонкие.
Теория трехцентровых связей объясняет, почему получены многочисленные соединения для ксенона, немногочисленные – для криптона, но соединения практически отсутствуют для аргона, неона и гелия (речь идет о нейтральных молекулах), почему большинство найденных соединений являются фторидами или оксидами. Согласно теории трехцентровых связей, необходимым условием образования подобных связей является большая разность электроотрицательностей центрального атома и лигандов. Подобная связь не образуется, если вместо ксенона брать менее электроположительный атом или вместо фтора или кислорода брать менее электроотрицательный атом.
метод отталкивания валентных электронных пар
Согласно этой теории молекулы или ионы, содержащие только простые связи, на валентном уровне центрального атома М могут иметь два типа электронных пар: связывающие пары связей М-Х и неподеленные пары электронов Е.
Эти связывающие и неподеленные пары электронов располагаются таким образом, чтобы их взаимное отталкивание было минимальным.
Это приводит к их определенному расположению в пространстве в зависимости от общего числа электронов (см. таблицу 1).
Учитывая общее число электронных пар атома М (n) и тип молекулы (например, МХ2Е – имеются две связывающие пары и одна неподеленная), можно установить геометрию молекул.
Таблица 1. Геометрия молекул в зависимости от числа электронных пар n и типа молекулы.
1. Неподеленная пара электронов имеет в области центрального атома больший объем, чем общая связывающая пара электронов. Отталкивание неподеленной пары электронов больше, чем отталкивание общей пары электронов.
2. Отталкивание двойной связи больше, чем отталкивание простой связи.
Это правило позволяет рассматривать геометрию молекул с кратными связями. Согласно этому правилу двойная связь занимает на периферии центрального атома одну позицию, имея отталкивание большее, чем отталкивание простых связей.
В молекуле этилена каждый атом углерода имеет четыре электрона. Два из них образуют двойную связь С=С, два других – две простых связи С-Н. Около углерода имеется три электронных облака, имеющих тригональное расположение. Поскольку отталкивание двойной связи больше, чем отталкивание простых связей, то угол между связями С-Н должен быть меньше 120о. Экспериментальное значение этого угла Н-С-Н равно 117,7о.
3. Отталкивание связывающей пары уменьшается с увеличением электроотрицательности лиганда.
С увеличением электроотрицательности лиганда электронная плотность связывающей общей пары электронов смещается в сторону лиганда и уменьшается в области центрального атома, поэтому отталкивание этой пары будет меньшим, чем отталкивание других общих пар электронов.
В случае молекулы NF3, имеющей ту же пирамидальную геометрию, что и молекула NH3, валентный угол должен быть меньше не только тетраэдрического угла 109,5о, из-за большего отталкивания неподеленных пар электронов по сравнению со связывающими парами, но и меньше значения 107,3о, наблюдаемого в молекуле NH3, поскольку отталкивание связи N-F меньше, чем отталкивание связи N-Н. Экспериментальное значение валентного угла в молекуле NF3 (102о) подтверждает предсказание теории.
Замещение атомов водорода на более электроотрицательные атомы в молекуле этилена СН2=СН2, угол НСН равен 117,7о, приводит к уменьшению валентного угла до 114о (угол ClCCl в молекуле CH2=CCl2) и 109о (угол FCF в молекуле CH2=CF2).
Молекула ClF3. Атом хлора имеет на последнем уровне семь электронов. Три из них образуют три общие пары простых связей Cl – F, а четыре другие образуют две неподеленные пары электронов. Тип молекулы MX3E2. Расположение пяти пар – тригонально-бипирамидальное. Положения этих пяти пар не эквивалентные. В аксиальном положении пара имеет три пары под углом 90о и одну под углом 180о. В экваториальном положении пара имеет две пары под углом 90о и две пары под углом 120о. С учетом большего отталкивания ближайших пар отталкивание минимально в экваториальных положениях. Именно эти выгодные положения и занимаются двумя неподеленными парами. Три связывающие пары занимают третье экваториальное положение и два аксиальных положения. Молекула ClF3 имеет Т-образную геометрию.
Из-за большего отталкивания неподеленных пар электронов по сравнению с общими парами электронов угол между аксиальной и экваториальной связями должен быть меньше 90о. Экспериментальное значение этого угла равно 87,5о (рис.4).
Молекула XeF4. Атом ксенона имеет на валентном уровне восемь электронов. Четыре из них образуют четыре связи, четыре других – две неподеленные пары электронов. Тип молекулы МХ4Е2. Расположение шести пар – октаэдрическое. Первая неподеленная пара может занимать любое из шести равноценных положений. Вторая неподеленная пара электронов должна занимать положение противоположное положению первой пары, чтобы минимизировать межэлектронное отталкивание. Молекула имеет квадратное расположение связей.
Молекула IOCl3. В молекуле IOCl3 атом иода имеет 7 электронов. Три из них образуют три простые связи, два – одну двойную связь и еще два – неподеленную пару. Расположение пяти электронных облаков – тригонально-бипирамидальное. Неподеленная пара и двойная связь, как имеющие наибольшее отталкивание, занимают два экваториальные положения. Три простые связи занимают оставшееся экваториальное положение и два аксиальных положения. Геометрия молекулы – искаженный тетраэдр.
Рис. 4. Геометрия молекул в методе Гиллеспи. Приведено расположение связей и неподеленных пар.
Заключение
Таким образом, для определения геометрии молекулы могут быть использованы различные методы. Так необычная Т-образная геометрия молекулы ClF3 может быть правильно предсказана с помощью метода валентных связей (предполагающего в данном случае возбуждение р-электрона на d-орбиталь), с помощью метода трехцентровых связей (указывающего на невозможность подобного возбуждения) и с помощью метода Гиллеспи (вообще не обсуждающего вопросы образования химической связи).
Очевидно, что эти методы не могут объяснить геометрию всех молекул, например, изменения геометрии в ряду: BeF2 – MgF2 – CaF2 (от линейной молекулы к нежесткой и к угловой). Однако, учитывая простоту этих моделей, следует скорее удивляться их успехам, нежели их неудачам.
1. Химическая связь. М.: Наука, 1973. 232 с.
3. Геометрия молекул. М.: Мир, 1975. 278 с.