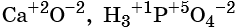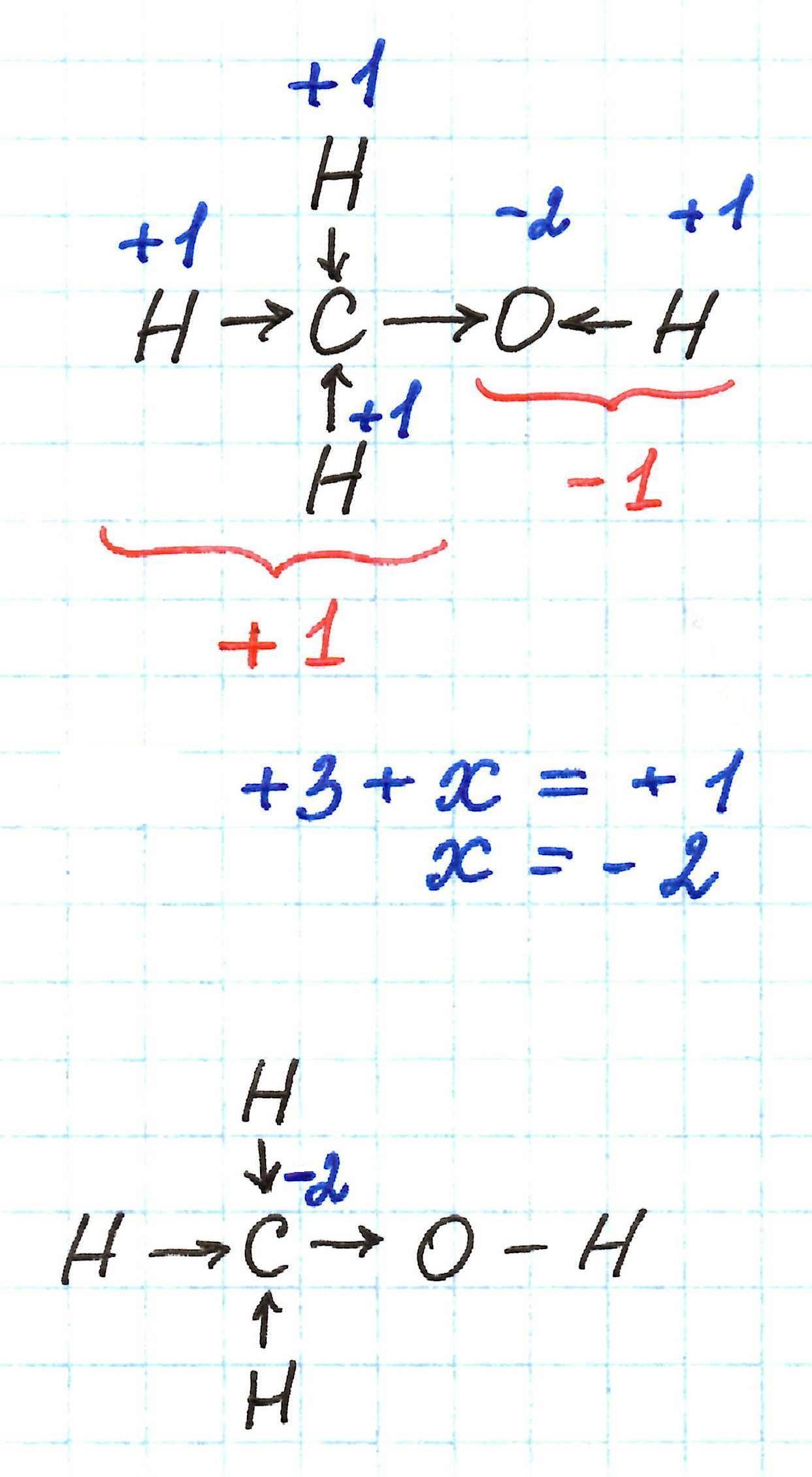Как узнать степень окисления
Как узнать степень окисления
Степени окисления элементов. Как найти степени окисления?
3) Высшая степень окисления элемента, как правило, совпадает с номером группы, в которой находится данный элемент (например, фосфор находится в V группе, высшая с. о. фосфора равна +5). Важные исключения: F, O.
4) Поиск степеней окисления остальных элементов основан на простом правиле:
Несколько простых примеров на определение степеней окисления
Что делать, если неизвестны степени окисления двух элементов
А можно ли определить степени окисления сразу нескольких элементов, пользуясь похожим уравнением? Если рассматривать данную задачу с точки зрения математики, ответ будет отрицательным. Линейное уравнение с двумя переменными не может иметь однозначного решения. Но ведь мы решаем не просто уравнение!
Вывод: если в молекуле содержится несколько атомов с неизвестными степенями окисления, попробуйте «разделить» молекулу на несколько частей.
Как расставлять степени окисления в органических соединениях
Не смешивайте понятия «валентность» и «степень окисления»!
Степень окисления часто путают с валентностью. Не совершайте подобной ошибки. Перечислю основные отличия:
Небольшой тест на тему «Степень окисления»
Потратьте несколько минут, проверьте, как вы усвоили эту тему. Вам необходимо ответить на пять несложных вопросов. Успехов!
Для желающих еще немного потренироваться рекомендую соответствующий тематический тест.
Степень окисления
Темы кодификатора ЕГЭ: Электроотрицательность. Степень окисления и валентность химических элементов.
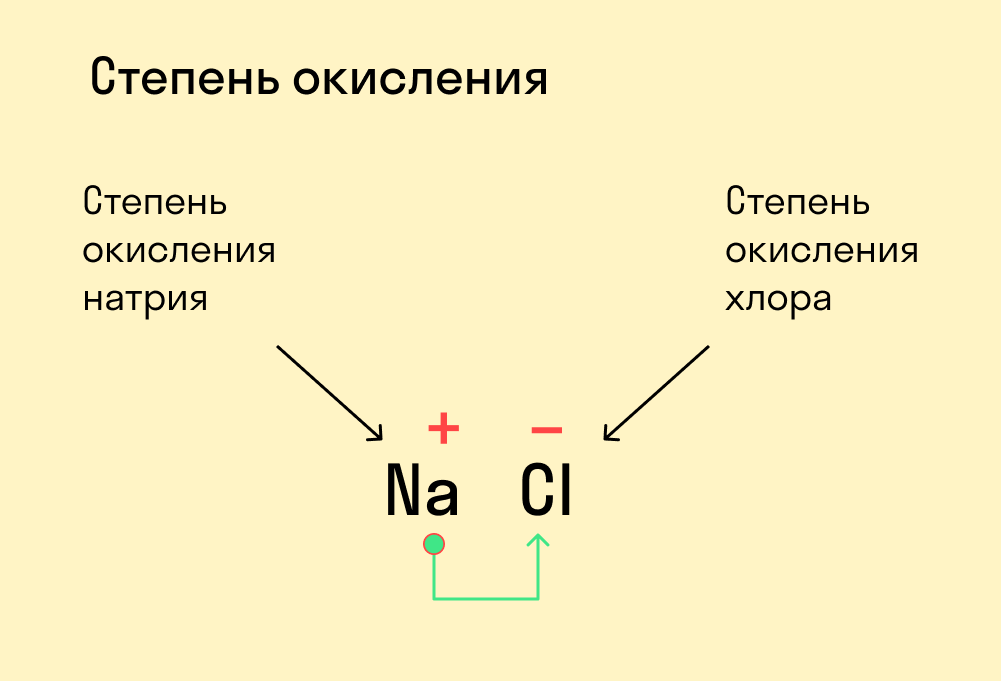
Степень окисления – это вспомогательный условный заряд атома элемента в соединении, вычисленный из предположения, что все соединения состоят из ионов (все полярные связи – ионные).
Что значит «условный заряд»? Мы просто-напросто договариваемся, что немного упростим ситуацию: будем считать любые полярные связи полностью ионными, и будем считать, что электрон полностью уходит или приходит от одного атома к другому, даже если на самом деле это не так. А уходит условно электрон от менее электроотрицательного атома к более электроотрицательному.
Наверняка, у вас возник вопрос — зачем же придумывать то, чего нет? Это не коварный замысел химиков, все просто: такая модель очень удобна. Представления о степени окисления элементов полезны при составлении классификации химических веществ, описании их свойств, составлении формул соединений и номенклатуры. Особенно часто степени окисления используются при работе с окислительно-восстановительными реакциями.
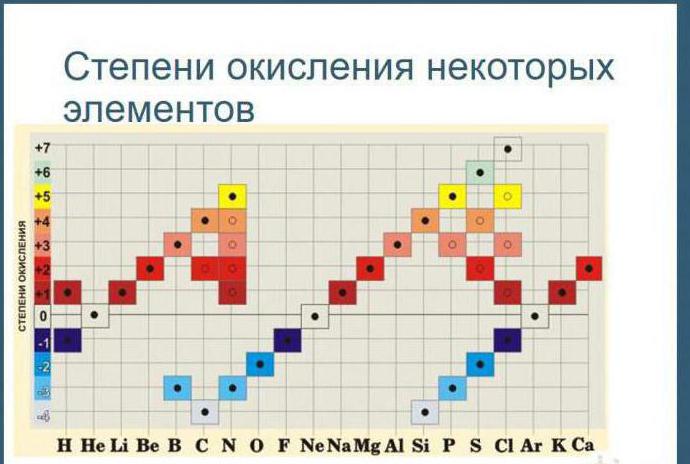
Степени окисления бывают высшие, низшие и промежуточные.
Высшая степень окисления равна номеру группы со знаком «плюс».
Низшая определяется, как номер группы минус 8.
И промежуточная степень окисления — это почти любое целое число в интервале от низшей степени окисления до высшей.
Для нахождения степеней окисления используют следующие правила :
Примеры :
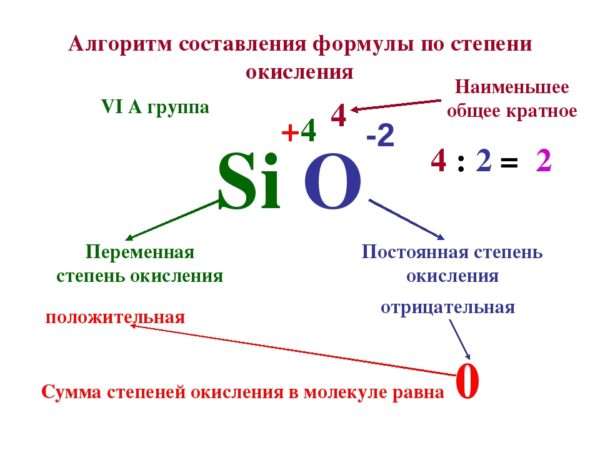
Задание: определите степени окисления элементов в молекуле дихромата калия: K2Cr2O7.
В бинарных соединениях более электроотрицательный элемент характеризуется отрицательной степенью окисления, менее электроотрицательный – положительной.
Обратите внимание, что понятие степени окисления – очень условно! Степень окисления не показывает реальный заряд атома и не имеет реального физического смысла. Это упрощенная модель, которая эффективно работает, когда нам необходимо, например, уравнять коэффициенты в уравнении химической реакции, или для алгоритмизации классификации веществ.
Степень окисления – это не валентность! Степень окисления и валентность во многих случаях не совпадают. Например, валентность водорода в простом веществе Н2 равна I, а степень окисления, согласно правилу 1, равна 0.
Это базовые правила, которые помогут Вам определить степень окисления атомов в соединениях в большинстве случаев.
В некоторых ситуациях вы можете столкнуться с трудностями при определении степени окисления атома. Рассмотрим некоторые из этих ситуаций, и разберем способы их разрешения:
Потренируемся определять степень окисления атомов в органических соединениях. Для этого необходимо нарисовать полную структурную формулу атома, и выделить атом углерода с его ближайшим окружением — атомами, с которыми он непосредственно соединен.
Полезные советы:
Тренировочный тест по теме «Степени окисления и валентность» 10 вопросов, при каждом прохождении новые.
Как определить степень окисления
wikiHow работает по принципу вики, а это значит, что многие наши статьи написаны несколькими авторами. При создании этой статьи над ее редактированием и улучшением работали, в том числе анонимно, 13 человек(а).
Количество просмотров этой статьи: 631 285.
В химии термины «окисление» и «восстановление» означает реакции, при которых атом или группа атомов теряют или, соответственно, приобретают электроны. Степень окисления — это приписываемая одному либо нескольким атомам численная величина, характеризующая количество перераспределяемых электронов и показывающая, каким образом эти электроны распределяются между атомами при реакции. Определение этой величины может быть как простой, так и довольно сложной процедурой, в зависимости от атомов и состоящих из них молекул. Более того, атомы некоторых элементов могут обладать несколькими степенями окисления. К счастью, для определения степени окисления существуют несложные однозначные правила, для уверенного пользования которыми достаточно знания основ химии и алгебры.
Степень окисления элемента
Что такое степень окисления
Для начала давайте вспомним, как проходят химические связи в молекуле вещества. Взаимодействуя между собой, атомы могут притягивать или отдавать электроны для образования общей электронной пары. Атом с более высокой электроотрицательностью (ЭО) притягивает электроны и приобретает отрицательный заряд, а атом с меньшей ЭО, напротив, отдает электроны и обретает положительный заряд.
Степень окисления — это условный заряд, который предположительно обретет атом после перемещения электронов. Он вычисляется из предположения, что все свободные электроны полностью перемещаются от одного атома к другому и все образованные связи — ионные.
Почему в определении степени окисления мы говорим об условном заряде? Потому что в реальности он может быть другим, а химические связи атома в соединении не обязательно будут ионными. Но мы предполагаем, что все именно так, чтобы немного упростить расчеты. Это помогает в составлении формул и классификаций.
Запомните:
Численно степень окисления равна количеству электронов, которые перешли от одного атома к другому.
У атома с меньшей ЭО, который отдает электроны, — положительная степень окисления.
У атома с большей ЭО, который притягивает электроны, — отрицательная степень окисления.
Простые вещества, такие как Cl2, O2 и т. д., имеют степень окисления, равную 0, поскольку смещения электронов в данном случае не происходит.
Как рассчитать степень окисления
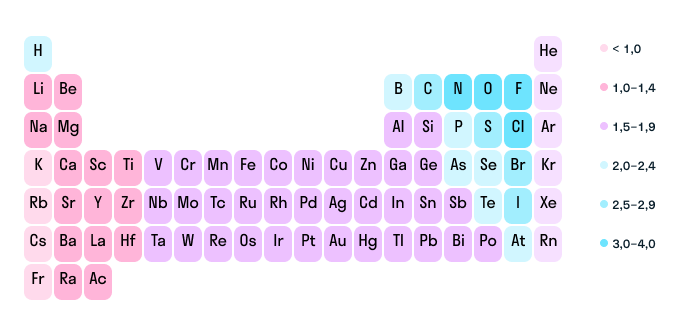
Как мы уже выяснили выше, определить степень окисления элемента (иначе говоря, окислительное число) помогает электроотрицательность. Значения ЭО легко узнать, пользуясь таблицей Менделеева или шкалой относительной электроотрицательности. Сравните, у какого химического элемента в соединении ЭО выше — этот элемент будет притягивать электроны и приобретет отрицательный заряд.
Шкала относительной электроотрицательности
Это правило поможет составить уравнение и посчитать степень окисления любого химического элемента в соединении, если известны данные по остальным элементам. Еще больше облегчат расчеты следующие закономерности:
у водорода в гидридах окислительное число −1, а во всех остальных веществах оно равно +1;
у кислорода степень окисления в оксидах равна −2, в пероксидах −1, в соединениях с фтором +2;
у неметаллов в соединениях с водородом и металлами окислительное число всегда отрицательное;
у металлов степень окисления всегда положительная.
Также есть элементы, которые во всех соединениях отдают или принимают одинаковое количество электронов, поэтому их окислительное число — постоянная величина.
Алгоритм действий
Итак, мы знаем основные закономерности. Давайте разберемся, как находить степени окисления на примерах. Предлагаем следующий алгоритм действий.
Посмотрите, является ли вещество элементарным. Если да — значит, оно находится в химически несвязанном состоянии и окислительное число равно 0. Это правило подходит как для веществ, образованных из отдельных атомов, так и для тех, что включают многоатомные молекулы одного и того же элемента.
Пример
Если это соединение, определите, состоит ли оно из ионов. В многоатомном ионе сумма всех степеней окисления равна его заряду. Узнайте эту сумму из таблицы растворимости и составьте уравнение с известными окислительными числами.
Пример
Допустим, нужно определить заряд азота в ионе аммония.
Согласно таблице растворимости заряд иона аммония NH4 + равен +1. Это значит, что сумма степеней окисления в этом соединении тоже будет равна +1.
Также известно, что водород всюду, кроме гидридов, имеет заряд +1. В данном случае есть 4 атома водорода, т. е. +1 × 4.
Составим формулу: х + (+1) × 4 = +1. Значит х = −3.
Если соединение — нейтральная молекула, составьте уравнение, учитывая, что все окислительные числа в сумме равны 0.
Пример
Допустим, нужно определить степень окисления серы в соединении Na2SO4.
Мы знаем, что у щелочного металла Na постоянное окислительное число +1. Кислород, согласно вышеизложенным правилам, в оксидах имеет заряд −2.
Составим уравнение: (+1) × 2 + х + (−2) × 4 = 0. Значит х = −6.
Как узнать степень окисления нескольких элементов
А как быть, если неизвестны окислительные числа двух и более элементов в соединении? В математике уравнения с двумя неизвестными не всегда имеют решение. Но в химии есть выход: можно разделить химическую формулу на несколько частей, которые имеют постоянные заряды.
Пример
Поскольку мы знаем окислительные числа водорода и кислорода, найти заряды азота и серы в каждом ионе не составит труда.
В ионе NH4 + формула для определения заряда азота будет следующей: х + (+1) × 4 = 1. Понятно, что х = −3, т. е. степень окисления азота −3.
В ионе SO4 2- формула для серы х + (−2) × 4 = −2. Следовательно, х = 6, т. е. заряд серы равен +6.
Как определить высшую и низшую степень окисления
Выделяют высшую (или максимально положительную) и низшую (максимально отрицательную) степени окисления. В диапазоне между ними располагаются окислительные числа, которые могут принадлежать данному химическому элементу в различных соединениях. Для четных групп характерны четные числа в диапазоне, а для нечетных групп — нечетные.
Высшая степень окисления совпадает с номером группы элемента (для элементов в главной подгруппе) в короткой форме периодической системы.
Низшая степень окисления равна числу, которое получится, если от номера группы элемента отнять 8.
Исключения: фтор, железо, кобальт, родий, подгруппа никеля, кислород, благородные газы (помимо ксенона).
Проиллюстрируем на примере, как найти высшую и низшую степень окисления.
Хлор (Cl), согласно короткой периодической таблице, принадлежит к группе VII. Значит, его максимальное окислительное число будет +7. Такой условный заряд элемент приобретает в оксиде хлора Cl2O7 и хлорной кислоте HClO4. Минимальное число получаем следующим образом: 7 − 8 = −1 (характерно для хлороводорода HCl).
По степени окисления можно понять, как поведет себя вещество в окислительно-восстановительных реакциях. Если в соединении главный действующий элемент имеет высшую степень окисления, оно является окислителем, а если он имеет низшую степень окисления — восстановителем.
Например, серная кислота является окислителем, поскольку у серы в данном случае заряд +6. А вот в сернистой кислоте у серы заряд всего +4, поэтому она может проявлять и окислительную способность, и восстановительную. В сероводороде заряд серы равен −2, и это минимальная степень окисления, а значит, данное вещество — восстановитель.
Как найти степень окисления в органическом соединении
В органической химии определять окислительные числа элементов немного сложнее, поскольку все органические вещества включают углерод, известный большим количеством неполярных связей. Если у нас всего один атом углерода, можно использовать стандартный способ.
Пример
Рассчитайте степень окисления углерода в метаноле H3C−OH.
Мы знаем, что водород Н имеет окислительное число +1, а у кислорода в данном случае оно равно −2. Составим уравнение:
х + (+1) × 4 + (+2) × 1 = 0
Но что делать, если атомов углерода больше? Придется анализировать структурную формулу, чтобы понять, какие химические связи есть между элементами и сколько электронов они теряют/приобретают в результате. Такой вариант нахождения окислительного числа называют графическим.
Графический метод
Нарисуйте структурную формулу соединения.
Изобразите стрелками химические связи и смещение атомов (все связи между атомами углерода С−С считайте неполярными).
Посчитайте, сколько стрелок ведет к атому (это «−») и сколько от него (это «+»), а затем суммируйте «+» и «−», чтобы узнать степень окисления.
Валентность и степень окисления: в чем разница?
Школьники, которые только начали изучать данные разделы химии, нередко путают степень окисления и валентность. Численно эти показатели могут совпадать (но далеко не всегда), а вот по смыслу они в корне различаются.
Между этими двумя понятиями есть следующие отличия:
валентность не имеет знака, в то время как у окислительного числа он есть («+» или «−»);
валентность равна нулю только в том случае, если атом не имеет связей с другими частицами, а степень окисления может быть равна нулю и при наличии таких связей;
вычисляя степень окисления, мы предполагаем, что в соединении ионные связи, хотя на самым деле это может быть не так, а валентность всегда имеет реальный смысл.
Поэтому отождествлять эти два понятия ни в коем случае не стоит. Более того, не нужно ориентироваться на валентность, пытаясь определить окислительное число.
Вопросы для самопроверки
Почему степень окисления называют формальным зарядом, условным?
Что отражает численная величина степени окисления?
Чему равна сумма всех окислительных чисел в ионе?
Как определить низшую степень окисления?
Как найти две неизвестных степени окисления в одном веществе?
Как определять степени окисления в органических веществах?
Как расставлять и как определить степень окисления элементов
В химических процессах главную роль играют атомы и молекулы, свойства которых определяют исход химических реакций. Одной из важных характеристик атома является окислительное число, которое упрощает метод учета переноса электронов в частице. Как определить степень окисления или формальный заряд частицы и какие правила необходимо знать для этого?
Определение

Термин окисление (оксидация) в химии означает реакцию, в ходе которой группа атомов или один из них теряют электроны или приобретают, в случае приобретения реакцию называют «восстановлением».
Степень окисления – это величина, которая измеряется количественно и характеризует перераспределяемые электроны в ходе реакции. Т.е. в процессе оксидации электроны в атоме уменьшаются или увеличиваются, перераспределяясь между другими взаимодействующими частицами, и уровень оксидации показывает, как именно они реорганизуются. Данное понятие тесно связано с электроотрицательностью частиц – их умением притягивать и отталкивать от себя свободные ионы.
Это интересно! Что такое алканы: строение и химические свойства
Определение уровня оксидации зависит от характеристик и свойств конкретного вещества, поэтому нельзя однозначно назвать процедуру вычисления легкой или сложной, но ее результаты помогают условно записать процессы окислительно-восстановительных реакций. Следует понимать, что полученный результат вычислений является результатом учета переноса электронов и не имеет физического смысла, а также не является истинным зарядом ядра.
Важно знать! Неорганическая химия часто использует термин валентности вместо степени окисления элементов, это не является ошибкой, но следует учитывать, что второе понятие более универсальное.
Понятия и правила вычислений движения электронов являются основой для классификации химических веществ (номенклатура), описания их свойств и составления формул связи. Но наиболее часто данное понятие используется для описания и работы с окислительно-восстановительными реакциями.
Правила определения степени окисления
Как узнать степень окисления? При работе с окислительно-восстановительными реакциями важно знать, что формальный заряд частицы всегда будет равен величине электрона, выраженного в числовом значении. Эта особенность связана с тем предположением, что электронные пары, образующие связь, всегда полностью смещаются в сторону более отрицательных частиц. Следует понимать, что речь идет об ионных связях, а в случае реакции при ковалентной связи электроны будут делиться поровну между одинаковыми частицами.
Окислительное число может иметь как положительные, так и отрицательные значения. Все дело в том, что в процессе реакции атом должен стать нейтральным, а для этого нужно либо присоединить к иону некое количество электронов, если он положительный, либо отнять их, если он отрицательный. Для обозначения данного понятия при записи формулы обычно прописывают над обозначением элемента арабскую цифру с соответствующим знаком. Например, 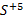
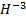
Следует знать, что формальный заряд металлов всегда будет положительным, а в большинстве 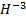
Запомнив эти особенности, достаточно просто будет определять окислительное число у элементов, независимо от сложности и количества уровней атомов.
Полезное видео: определение степени окисления
Как определить степень окисления
Периодическая таблица Менделеева содержит почти всю необходимую информацию для работы с химическими элементами. Например, школьники используют только ее для описания химических реакций. Так, чтобы определить максимальные положительные и отрицательные значения окислительного числа необходимо свериться с обозначением химического элемента в таблице:
Таким образом, достаточно просто узнать крайние границы формального заряда того или иного элемента. Такое действие можно совершить с помощью вычислений на основе таблицы Менделеева.
Важно знать! У одного элемента могут быть одновременно несколько различных показателей оксидации.
Различают два основных способа определения уровня оксидации, примеры которых представлены ниже. Первый из них – это способ, который требует знаний и умений применять законы химии. Как расставлять степени окисления с помощью этого способа?

Для этого необходимо:
Это интересно! Уроки химии: что это такое галогены
Этот способ весьма хорош, поскольку правильность решения всегда можно проверить, если сложить все уровни оксидации вместе.
Второй метод можно применять без знания химических законов:
Рассмотрим второй метод на примере вещества Na2SO4, в котором не определен атом серы S, известно лишь, что он отличен от нуля.
Это интересно! Уроки химии: катионы и анионы – что это такое
Чтобы найти, чему равны все степени окисления необходимо:
Таким образом, чтобы использовать второй метод, достаточно знать простые законы арифметики.
Таблица оксидации
Для простоты работы и вычисления показателей оксидации для каждого химического вещества используют специальные таблицы, где прописаны все данные.
Она выглядит следующим образом:
Полезное видео: учимся определять степень окисления по формулам
Вывод
Нахождение степени окисления для химического вещества – это простое действие, которое требует лишь внимательности и знания основных правил и исключений. Зная исключения и пользуясь специальными таблицами, это действие не будет занимать много времени.
Правила определения степени окисления
Понятие степень окисления
Для характеристики состояния элементов в соединениях введено понятие степени окисления.
Положительная степень окисления обозначает число электронов, которые смещаются от данного атома, а отрицательная – число электронов, которые смещаются к данному атому.
Из этого определения следует, что в соединениях с неполярными связями степень окисления элементов равна нулю. Примерами таких соединений могут служить молекулы, состоящие из одинаковых атомов (N2, H2, Cl2).
Степень окисления металлов в элементарном состоянии равна нулю, так как распределение электронной плотности в них равномерно.
При определении степени окисления элементов в соединениях с полярными ковалентными связями сравнивают значениях их электроотрицательностей. Поскольку при образовании химической связи электроны смещаются к атомам более электроотрицательных элементов, то последние имеют в соединениях отрицательную степень окисления.
Правила определения степени окисления
Чтобы определить степени окисления элементов, входящих в состав того или иного соединения, сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Так, например, в соединениях с неполярными связями степень окисления элементов равна нулю. Примерами таких соединений могут служить молекулы, состоящие из одинаковых атомов (N2, H2, Cl2).
Степень окисления металлов в элементарном состоянии равна нулю, так как распределение электронной плотности в них равномерно.
При определении степени окисления элементов в соединениях с полярными ковалентными связями сравнивают значениях их электроотрицательностей. Поскольку при образовании химической связи электроны смещаются к атомам более электроотрицательных элементов, то последние имеют в соединениях отрицательную степень окисления.
Фтор, характеризующийся наибольшим значением электроотрицательности, в соединениях всегда имеет постоянную отрицательную степень окисления (-1).
Для кислорода, также имеющего высокое значение электроотрицательности, характерна отрицательная степень окисления обычно (-2), в пероксидах (-1). Исключение составляет соединение состава OF2, в котором степень окисления кислорода равна (+2).
Щелочные и щелочноземельные элементы, для которых свойственно относительно невысокое значение электроотрицательности, всегда имеют положительную степень окисления, равную соответственно (+1) и (+2).
Большинство элементов могут проявлять разную степень окисления в соединениях. При определении их степени окисления пользуются правилом, согласно которому сумма степеней окисления элементов в электронейтральных молекулах равна нулю, а в сложных ионах – заряду этих ионов. В качестве примера рассчитаем степень окисления азота в соединениях состава KNO2 и HNO3. Степень окисления водорода и щелочных металлов в соединениях равна (+), а степень окисления кислорода – (-2). Соответственно степень окисления азота равна:
Что это такое
В химии описание различных окислительно-восстановительных процессов не обходится без степеней окисления – специальных условных величин, при помощи которых можно определить заряд атома какого-либо химического элемента.
Если представить степень окисления (не путайте с валентностью, так как во многих случаях они не совпадают) как запись в тетради, то мы увидим просто цифры со знаками ноль (0 – в простом веществе), плюс (+) или минус (-) над интересующим нас веществом. Как бы то ни было, они играют огромную роль в химии, а умение определять СО(степень окисления) – это необходимая база в изучении данного предмета, без которой дальнейшие действия смысла не имеют.
Мы используем СО, чтобы описать химические свойства вещества (или отдельного элемента), верного написания его международного названия (понятного для любой страны и нации вне зависимости от используемого языка) и формулы, а также для классификации по признакам.
Степень может быть трёх видов: высшая (для её определения требуется знать, в какой группе находится элемент), промежуточная и низшая (необходимо из числа 8 вычесть номер группы, в которой располагается элемент; естественно, цифра 8 берётся потому, что всего в периодической системе Д.Менделеева 8 групп). Подробно об определении степени окисления и правильном её расставлении будет сказано ниже.
Как определяется степень окисления: постоянная СО
Во-первых, СО может быть переменной или постоянной
Определение постоянной степени окисления не составляет большого труда, поэтому урок лучше начинать именно с неё: для этого необходимо только умение пользоваться ПС (периодической системой). Итак, существует ряд определённых правил:
На основе данных сведений расставляются степени окисления во множестве сложных веществ, описываются окислительно-восстановительные реакции и прочее, однако об этом позже.
Переменная СО
Некоторые химические элементы отличаются тем, что имеют не одну степень окисления и меняют её в зависимости от того, в какой формуле стоят. Согласно правилам сумма всех степеней также должна равняться нулю, но для её нахождения необходимо проделать некоторые вычисления. В письменном варианте это выглядит как просто алгебраическое уравнение, но со временем мы «набиваем руку», и не составляет труда составить и быстро выполнить весь алгоритм действий мысленно.
Разобраться на словах будет не так легко, и лучше сразу перейти к практике:
Дополнительные упражнения можно будет найти в конце, но прежде всего нам требуется определить, какие элементы имеют переменную степень окисления. В принципе, все элементы, не считая первых трёх групп, меняют свои степени. Наиболее ярким примером служат галогены (элементы VII группы, не считая фтора F), IV группа и благородные газы. Ниже вы увидите перечень некоторых металлов и неметаллов с переменной степенью:
Это лишь небольшое количество элементов. Чтобы научиться определять СО, требуется изучение и практика, однако это не значит, что нужно заучивать все постоянные и переменные СО наизусть: просто запомните, что последние встречаются значительно чаще. Зачастую немалую роль играет коэффициент и то, какое вещество представлено – к примеру, в сульфидах отрицательную степень принимает сера (S), в оксидах – кислород (O), в хлоридах – хлор (Cl). Следовательно, в этих солях положительную степень принимает другой элемент (и называется в данной ситуации восстановителем).
Решение задач на определение степени окисления
Теперь мы подошли к самому главному – практике. Попробуйте выполнить следующие задания сами, а затем посмотрите разборку решения и сверьте ответы:
Краткое заключение
Чтобы научиться определять степень окисления самостоятельно, вам нужно не только уметь составлять уравнения, но и основательно взяться за изучение свойств элементов различных групп, вспомнить уроки алгебры, составляя и решая уравнения с неизвестной переменной.
Не забывайте, что в правилах есть свои исключения и о них нельзя забывать: речь идёт об элементах с переменной СО. Также для решения многих задач и уравнений необходимо умение расставлять коэффициенты (и знать, с какой целью это делается).
Степень окисления для «чайников»
Степень окисления или окислительное число дает количественную характеристику состояния атома в соединении.
| Степень окисления — условный заряд атома в соединении, если предположить, что соединение состоит только из ионов |
Исходя из вышесказанного, в окислительно-восстановительных реакциях вычисляют неизвестную степень окисления элементов, исходя из двух моментов:
Составляем и решаем уравнение:
| Высшая степень окисления — наибольшее положительное ее значение |
Высшая степень окисления является очень важной количественной характеристикой элемента, чаще всего, она равна номеру группы элемента в Периодической таблице:
| Низшая степень окисления — наименьшее возможное ее значение для данного элемента |
Если элемент имеет три и более возможных степеней окисления, то все остальные степени окисления, лежащие между высшей и низшей, называются промежуточными или средними.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Степень окисления.
Степень окисления – это условный заряд атомов химического элемента в соединении, вычисленный из предположения, что все связи имеют ионный тип.
Степени окисления могут иметь положительное, отрицательное или нулевое значение, поэтому алгебраическая сумма степеней окисления элементов в молекуле с учётом числа их атомов равна 0, а в ионе – заряду иона.
1. Степени окисления металлов в соединениях всегда положительные.
2. Высшая степень окисления соответствует номеру группы периодической системы, где находится данный элемент (исключение составляют: Au +3 (I группа), Cu +2 (II), из VIII группы степень окисления +8 может быть только у осмия Os и рутения Ru.
3. Степени окисления неметаллов зависят от того, с каким атомом он соединён:
4. Высшую отрицательную степень окисления неметаллов можно определить вычитанием из 8 номера группы, в которой находится данный элемент, т.е. высшая положительная степень окисления равна числу электронов на внешнем слое, которое соответствует номеру группы.
5. Степени окисления простых веществ равны 0, независимо от того металл это или неметалл.
Элементы с неизменными степенями окисления.
Элемент
Характерная степень окисления
Что такое степень окисления, как определять и расставлять

Важное правило — правило расстановки, алгоритмы
Здесь много говорится о таких соединениях, как оксиды. Для начала, любой ученик должен выучить определение оксидов — это сложные соединения из двух элементов, в их составе находится кислород. К классу бинарных соединений оксиды относят по той причине, что в алгоритме кислород стоит вторым по очереди. При определении показателя важно знать правила расстановки и рассчитать алгоритм.
Это интересно: полярная и неполярная ковалентная связь — что это?
Алгоритмы для кислотных оксидов
Степени окисления — это численные выражения валентности элементов. К примеру, кислотные оксиды образованы по определённому алгоритму: сначала идут неметаллы или металлы (их валентность обычно от 4 до 7), а после идёт кислород, как и должно быть, вторым по порядку, его валентность равняется двум. Определяется она легко — по периодической таблице химических элементов Менделеева. Также важно знать то, что степень окисления элементов — это показатель, который предполагает либо положительное, либо отрицательное число.
Расстановка в кислотах, содержащих кислород
После проведения всех этих действий можно определить степень окисления и центрального элемента формулы. Выражение для её вычисления представляет собой формулу в виде уравнения. Например, для серной кислоты уравнение будет с одним неизвестным.
Основные термины в ОВР
ОВР — это восстановительно-окислительные реакции.
Как расставлять степень окисления в солях

Металл, который непосредственно образует соль, располагается в главной подгруппе, его степень будет равна номеру его группы, то есть всегда будет оставаться стабильным, положительным показателем.
1.3.2. Электроотрицательность. Степень окисления и валентность химических элементов.
Электроотрицательность
Электроотрицательность — способность атома какого-либо химического элемента в соединении оттягивать на себя электроны связанных с ним атомов других химических элементов.
Электроотрицательность, как и прочие свойства атомов химических элементов, изменяется с увеличением порядкового номера элемента периодически:
График выше демонстрирует периодичность изменения электроотрицательности элементов главных подгрупп в зависимости от порядкового номера элемента.
При движении вниз по подгруппе таблицы Менделеева электроотрицательность химических элементов уменьшается, при движении вправо по периоду возрастает.
Электроотрицательность отражает неметалличность элементов: чем выше значение электроотрицательности, тем более у элемента выражены неметаллические свойства.
Степень окисления
Степень окисления – условный заряд атома химического элемента в соединении, рассчитанный исходя из предположения, что все связи в его молекуле ионные, т.е. все связывающие электронные пары смещены к атомам с большей электроотрицательностью.
Как рассчитать степень окисления элемента в соединении?
1) Степень окисления химических элементов в простых веществах всегда равна нулю.
2) Существуют элементы, проявляющие в сложных веществах постоянную степень окисления:
Элементы, проявляющие постоянную СО
Значение постоянной СО этого элемента
IA группы — Li, Na, K, Rb, Cs, Fr
Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd
3) Существуют химические элементы, которые проявляют в подавляющем большинстве соединений постоянную степень окисления. К таким элементам относятся:
Элемент
Степень окисления практически во всех соединениях
Исключения
Фторид кислорода —
4) Алгебраическая сумма степеней окисления всех атомов в молекуле всегда равна нулю. Алгебраическая сумма степеней окисления всех атомов в ионе равна заряду иона.
5) Высшая (максимальная) степень окисления равна номеру группы. Исключения, которые не попадают под это правило, — элементы побочной подгруппы I группы, элементы побочной подгруппы VIII группы, а также кислород и фтор.
Химические элементы, номер группы которых не совпадает с их высшей степенью окисления (обязательные к запоминанию)
Химический элемент
Номер группы
Высшая степень окисления
6) Низшая степень окисления металлов всегда равна нулю, а низшая степень окисления неметаллов рассчитывается по формуле:
низшая степень окисления неметалла = №группы − 8
Отталкиваясь от представленных выше правил, можно установить степень окисления химического элемента в любом веществе.
Нахождение степеней окисления элементов в различных соединениях
Пример 1
Определите степени окисления всех элементов в серной кислоте.
Решение:
Запишем формулу серной кислоты:
Степень окисления водорода во всех сложных веществах +1 (кроме гидридов металлов).
Обозначим степень окисления серы как x:
Молекула серной кислоты, как и молекула любого вещества, в целом электронейтральна, т.к. сумма степеней окисления всех атомов в молекуле равна нулю. Схематически это можно изобразить следующим образом:
Т.е. мы получили следующее уравнение:
Таким образом, степень окисления серы в серной кислоте равна +6.
Пример 2
Определите степень окисления всех элементов в дихромате аммония.
Решение:
Запишем формулу дихромата аммония:
Как и в предыдущем случае, мы можем расставить степени окисления водорода и кислорода:
Однако мы видим, что неизвестны степени окисления сразу у двух химических элементов — азота и хрома. Поэтому найти степени окисления аналогично предыдущему примеру мы не можем (одно уравнение с двумя переменными не имеет единственного решения).
Мы знаем степени окисления водорода и кислорода. Зная, что сумма степеней окисления атомов всех элементов в ионе равна заряду, и обозначив степени окисления азота и хрома как x и y соответственно, мы можем записать:
Т.е. мы получаем два независимых уравнения:
Решая которые, находим x и y:
Как определять степени окисления элементов в органических веществах можно почитать здесь.
Валентность
Валентность атомов обозначается римскими цифрами: I, II, III и т.д.
Валентные возможности атома зависят от количества:
1) неспаренных электронов
2) неподеленных электронных пар на орбиталях валентных уровней
3) пустых электронных орбиталей валентного уровня
Валентные возможности атома водорода
Изобразим электронно-графическую формулу атома водорода:
Было сказано, что на валентные возможности могут влиять три фактора — наличие неспаренных электронов, наличие неподеленных электронных пар на внешнем уровне, а также наличие вакантных (пустых) орбиталей внешнего уровня. Мы видим на внешнем (и единственном) энергетическом уровне один неспаренный электрон. Исходя из этого, водород может точно иметь валентность, равную I. Однако на первом энергетическом уровне есть только один подуровень — s, т.е. атом водорода на внешнем уровне не имеет как неподеленных электронных пар, так и пустых орбиталей.
Таким образом, единственная валентность, которую может проявлять атом водорода, равна I.
Валентные возможности атома углерода
Рассмотрим электронное строение атома углерода. В основном состоянии электронная конфигурация его внешнего уровня выглядит следующим образом:
Т.е. в основном состоянии на внешнем энергетическом уровне невозбужденного атома углерода находится 2 неспаренных электрона. В таком состоянии он может проявлять валентность, равную II. Однако атом углерода очень легко переходит в возбужденное состояние при сообщении ему энергии, и электронная конфигурация внешнего слоя в этом случае принимает вид:
Несмотря на то что на процесс возбуждения атома углерода тратится некоторое количество энергии, траты с избытком компенсируются при образовании четырех ковалентных связей. По этой причине валентность IV намного более характерна для атома углерода. Так, например, валентность IV углерод имеет в молекулах углекислого газа, угольной кислоты и абсолютно всех органических веществ.
Помимо неспаренных электронов и неподеленных электронных пар на валентные возможности также влияет наличие вакантных ( ) орбиталей валентного уровня. Наличие таких орбиталей на заполняемом уровне приводит к тому, что атом может выполнять роль акцептора электронной пары, т.е. образовывать дополнительные ковалентные связи по донорно-акцепторному механизму. Так, например, вопреки ожиданиям, в молекуле угарного газа CO связь не двойная, а тройная, что наглядно показано на следующей иллюстрации:
Резюмируя информацию по валентным возможностям атома углерода:
1) Для углерода возможны валентности II, III, IV
2) Наиболее распространенная валентность углерода в соединениях IV
3) В молекуле угарного газа CO связь тройная (!), при этом одна из трех связей образована по донорно-акцепторному механизму
Валентные возможности атома азота
Запишем электронно-графическую формулу внешнего энергетического уровня атома азота:
Как видно из иллюстрации выше, атом азота в своем обычном состоянии имеет 3 неспаренных электрона, в связи с чем логично предположить о его способности проявлять валентность, равную III. Действительно, валентность, равная трём, наблюдается в молекулах аммиака (NH3), азотистой кислоты (HNO2), треххлористого азота (NCl3) и т.д.
Выше было сказано, что валентность атома химического элемента зависит не только от количества неспаренных электронов, но также и от наличия неподеленных электронных пар. Связано это с тем, что ковалентная химическая связь может образоваться не только, когда два атома предоставляют друг другу по одному электрону, но также и тогда, когда один атом, имеющий неподеленную пару электронов — донор( ) предоставляет ее другому атому с вакантной (
) орбиталью валентного уровня (акцептору). Т.е. для атома азота возможна также валентность IV за счет дополнительной ковалентной связи, образованной по донорно-акцепторному механизму. Так, например, четыре ковалентных связи, одна из которых образована по донорно-акцепторному механизму, наблюдается при образовании катиона аммония:
Несмотря на то что одна из ковалентных связей образуется по донорно-акцепторному механизму, все связи N-H в катионе аммония абсолютно идентичны и ничем друг от друга не отличаются.
Валентность, равную V, атом азота проявлять не способен. Связано это с тем, что для атома азота невозможен переход в возбужденное состояние, при котором происходит распаривание двух электронов с переходом одного из них на свободную орбиталь, наиболее близкую по уровню энергии. Атом азота не имеет d-подуровня, а переход на 3s-орбиталь энергетически настолько затратен, что затраты энергии не покрываются образованием новых связей. Многие могут задаться вопросом, а какая же тогда валентность у азота, например, в молекулах азотной кислоты HNO3 или оксида азота N2O5? Как ни странно, валентность там тоже IV, что видно из нижеследующих структурных формул:
em>Резюмируя информацию по валентным возможностям атома азота:
1) Для азота возможны валентности I, II, III и IV
2) Валентности V у азота не бывает!
3) В молекулах азотной кислоты и оксида азота N2O5 азот имеет валентность IV, а степень окисления +5 (!).
Валентные возможности фосфора
Изобразим электронно-графическую формулу внешнего энергетического уровня атома фосфора:
Как мы видим, строение внешнего слоя у атома фосфора в основном состоянии и атома азота одинаково, в связи с чем логично ожидать для атома фосфора так же, как и для атома азота, возможных валентностей, равных I, II, III и IV, что и наблюдается на практике.
Однако в отличие от азота, атом фосфора имеет на внешнем энергетическом уровне еще и d-подуровень с 5-ю вакантными орбиталями.
Таким образом, недоступная для азота валентность V для атома фосфора возможна. Так, например, валентность, равную пяти, атом фосфора имеет в молекулах таких соединений, как фосфорная кислота, галогениды фосфора (V), оксид фосфора (V) и т.д.
Валентные возможности атома кислорода
Электронно-графическая формула внешнего энергетического уровня атома кислорода имеет вид:
Мы видим на 2-м уровне два неспаренных электрона, в связи с чем для кислорода возможна валентность II. Следует отметить, что данная валентность атома кислорода наблюдается практически во всех соединениях. Выше при рассмотрении валентных возможностей атома углерода мы обсудили образование молекулы угарного газа. Связь в молекуле CO тройная, следовательно, кислород там трехвалентен (кислород — донор электронной пары).
Из-за того что атом кислорода не имеет на внешнем уровне d-подуровня, распаривание электронов s и p-орбиталей невозможно, из-за чего валентные возможности атома кислорода ограничены по сравнению с другими элементами его подгруппы, например, серой.
Таким образом, кислород практически всегда имеет валентность, равную II, однако в некоторых частицах он трехвалентен, в частности, в молекуле угарного газа C≡O. В случае, когда кислород имеет валентность III, одна из ковалентных связей образована по донорно-акцепторному механизму.
Валентные возможности атома серы
Внешний энергетический уровень атома серы в невозбужденном состоянии:
У атома серы, как и у атома кислорода, в обычном состоянии два неспаренных электрона, поэтому мы можем сделать вывод о том, что для серы возможна валентность, равная двум. И действительно, валентность II сера имеет, например, в молекуле сероводорода H2S.
Как мы видим, у атома серы на внешнем уровне появляется d-подуровень с вакантными орбиталями. По этой причине атом серы способен расширять свои валентные возможности в отличие от кислорода за счет перехода в возбужденные состояния. Так, при распаривании неподеленной электронной пары 3p-подуровня атом серы приобретает электронную конфигурацию внешнего уровня следующего вида:
В таком состоянии атом серы имеет 4 неспаренных электрона, что говорит нам о возможности проявления атомами серы валентности, равной IV. Действительно, валентность IV сера имеет в молекулах SO2, SF4, SOCl2 и т.д.
При распаривании второй неподеленной электронной пары, расположенной на 3s-подуровне, внешний энергетический уровень приобретает конфигурацию:
В таком состоянии уже становится возможным проявление валентности VI. Примером соединений с VI-валентной серой являются SO3, H2SO4, SO2Cl2 и т.д.
Аналогично можно рассмотреть валентные возможности остальных химических элементов.
Как расставлять и как определить степень окисления элементов
В химических процессах главную роль играют атомы и молекулы, свойства которых определяют исход химических реакций. Одной из важных характеристик атома является окислительное число, которое упрощает метод учета переноса электронов в частице. Как определить степень окисления или формальный заряд частицы и какие правила необходимо знать для этого?
Определение

Термин окисление (оксидация) в химии означает реакцию, в ходе которой группа атомов или один из них теряют электроны или приобретают, в случае приобретения реакцию называют «восстановлением».
Степень окисления – это величина, которая измеряется количественно и характеризует перераспределяемые электроны в ходе реакции. Т.е. в процессе оксидации электроны в атоме уменьшаются или увеличиваются, перераспределяясь между другими взаимодействующими частицами, и уровень оксидации показывает, как именно они реорганизуются. Данное понятие тесно связано с электроотрицательностью частиц – их умением притягивать и отталкивать от себя свободные ионы.
Это интересно! Что такое алканы: строение и химические свойства
Определение уровня оксидации зависит от характеристик и свойств конкретного вещества, поэтому нельзя однозначно назвать процедуру вычисления легкой или сложной, но ее результаты помогают условно записать процессы окислительно-восстановительных реакций. Следует понимать, что полученный результат вычислений является результатом учета переноса электронов и не имеет физического смысла, а также не является истинным зарядом ядра.
Важно знать! Неорганическая химия часто использует термин валентности вместо степени окисления элементов, это не является ошибкой, но следует учитывать, что второе понятие более универсальное.
Понятия и правила вычислений движения электронов являются основой для классификации химических веществ (номенклатура), описания их свойств и составления формул связи. Но наиболее часто данное понятие используется для описания и работы с окислительно-восстановительными реакциями.
Правила определения степени окисления
Как узнать степень окисления? При работе с окислительно-восстановительными реакциями важно знать, что формальный заряд частицы всегда будет равен величине электрона, выраженного в числовом значении. Эта особенность связана с тем предположением, что электронные пары, образующие связь, всегда полностью смещаются в сторону более отрицательных частиц. Следует понимать, что речь идет об ионных связях, а в случае реакции при ковалентной связи электроны будут делиться поровну между одинаковыми частицами.
Окислительное число может иметь как положительные, так и отрицательные значения. Все дело в том, что в процессе реакции атом должен стать нейтральным, а для этого нужно либо присоединить к иону некое количество электронов, если он положительный, либо отнять их, если он отрицательный. Для обозначения данного понятия при записи формулы обычно прописывают над обозначением элемента арабскую цифру с соответствующим знаком. Например, 

Следует знать, что формальный заряд металлов всегда будет положительным, а в большинстве 
Запомнив эти особенности, достаточно просто будет определять окислительное число у элементов, независимо от сложности и количества уровней атомов.
Полезное видео: определение степени окисления
Как определить степень окисления
Периодическая таблица Менделеева содержит почти всю необходимую информацию для работы с химическими элементами. Например, школьники используют только ее для описания химических реакций. Так, чтобы определить максимальные положительные и отрицательные значения окислительного числа необходимо свериться с обозначением химического элемента в таблице:
Таким образом, достаточно просто узнать крайние границы формального заряда того или иного элемента. Такое действие можно совершить с помощью вычислений на основе таблицы Менделеева.
Важно знать! У одного элемента могут быть одновременно несколько различных показателей оксидации.
Различают два основных способа определения уровня оксидации, примеры которых представлены ниже. Первый из них – это способ, который требует знаний и умений применять законы химии. Как расставлять степени окисления с помощью этого способа?
Для этого необходимо:
Это интересно! Уроки химии: что это такое галогены
Этот способ весьма хорош, поскольку правильность решения всегда можно проверить, если сложить все уровни оксидации вместе.
Второй метод можно применять без знания химических законов:
Рассмотрим второй метод на примере вещества Na2SO4, в котором не определен атом серы S, известно лишь, что он отличен от нуля.
Это интересно! Уроки химии: катионы и анионы – что это такое
Чтобы найти, чему равны все степени окисления необходимо:
Таким образом, чтобы использовать второй метод, достаточно знать простые законы арифметики.
Таблица оксидации
Для простоты работы и вычисления показателей оксидации для каждого химического вещества используют специальные таблицы, где прописаны все данные.
Она выглядит следующим образом:
Полезное видео: учимся определять степень окисления по формулам
Вывод
Нахождение степени окисления для химического вещества – это простое действие, которое требует лишь внимательности и знания основных правил и исключений. Зная исключения и пользуясь специальными таблицами, это действие не будет занимать много времени.
Как определить степень окисления: таблица Менделеева и алгоритм действий
Как определить степень окисления? Таблица Менделеева позволяет записывать данную количественную величину для любого химического элемента.
Определение
Для начала попробуем понять, что представляет собой данный термин. Степень окисления по таблице Менделеева представляет собой количество электронов, которые приняты либо отданы элементом в процессе химического взаимодействия. Она может принимать отрицательное и положительное значение.
Связь с таблицей
Как определяется степень окисления? Таблица Менделеева состоит из восьми групп, расположенных вертикально. В каждой из них есть две подгруппы: главная и побочная. Для того чтобы установить показатели для элементов, необходимо использовать определенные правила.
Инструкция
Как рассчитать степени окисления элементов? Таблица позволяет в полной мере справиться с подобной проблемой. Щелочные металлы, которые располагаются в первой группе (главной подгруппе), степень окисления проявляют в соединениях, она соответствует +, равна их высшей валентности. У металлов второй группы (подгруппы А) +2 степень окисления.
Для простых веществ, которые не вступали в химическое взаимодействие с другими веществами, определяемый показатель считается равным нулю.
Попробуем выявить основные действия, касающиеся расстановки в бинарных соединениях. Как поставить в них степень окисления? Таблица Менделеева помогает решить проблему.
Определим подобные показатели еще в одном бинарном соединении CuO. Так как медь располагается в побочной подгруппе (первой группе), следовательно, изучаемый показатель может проявлять разные значения. Поэтому для его определения необходимо сначала выявить показатель для кислорода.
Как еще используется химическая таблица? Степени окисления элементов в формулах, состоящих из трех элементов, также вычисляются по определенному алгоритму. Сначала расставляют эти показатели у первого и последнего элемента. Для первого этот показатель будет иметь положительное значение, соответствовать валентности. У крайнего элемента, в качестве которого выступает неметалл, данный показатель имеет отрицательное значение, он определяется в виде разности (от восьми отнимают номер группы). При вычислении степени окисления у центрального элемента используют математическое уравнение. При расчетах учитывают индексы, имеющиеся у каждого элемента. Сумма всех степеней окисления должна быть равна нулю.
Пример определения в серной кислоте
Заключение
При использовании правил можно расставлять коэффициенты в окислительно-восстановительных реакциях. Данный вопрос рассматривается в курсе химии девятого класса школьной программы. Кроме того, информация о степенях окисления позволяет выполнять задания ОГЭ и ЕГЭ.
Как определять степень окисления
Степень окисления равна нулю:
Последний пункт дает возможность определять неизвестную степень окисления элемента, если известны степени окисления других элементов в этом соединении:
Для определения степени окисления азота составляем и решаем уравнение:
Во многих случаях степень окисления численно равна валентности.
Как составлять уравнения окислительно-восстановительных реакций
Напомним, что окислительно-восстановительными реакциями называются химические реакции, протекающие с изменением степеней окисления элементов (всех или некоторых).
Уравнения окислительно-восстановительных реакций составляются при помощи метода электронного баланса, либо метода полуреакций.
Метод электронного баланса
Алгоритм составления уравнения окислительно-восстановительной реакции:
Приведем еще один пример составления уравнения окислительно-восстановительной реакции методом электронного баланса.
Рассмотрим пример окислительно-восстановительной реакции, в которой меняют свои степени окисления сразу три элемента.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Как определить степень окисления?
Как определить степень окисления химического элемента?
Степень окисления — это численная величина условного электрического заряда, образующегося на том или ином атоме химического элемента.
При определении степени окисления, как правило, предполагают, что общие пары полностью смещены в сторону атома более электроотрицательного элемента. На практике это бывает не всегда, а только в случае соединений с ионной решёткой.
Степень окисления сокращённо называется СО.
Записывается СО в виде числа из арабской цифры или цифр. Данное число пишется над символом соответствующего элемента. Перед числом СО ставится знак: плюс или минус.
Обратите внимание: именно впереди. Если плюс или минус стоИт после цифры — то это ужЕ не СО, а заряд иона.
Основные правила определения степени окисления таковы:
1) Степень окисления элемента в простом веществе равна нулю. Например: N2 (0), O2 (0).
2) Щелочные металлы в соединениях всегда имеют СО +1.
3) Щёлочно-земельные металлы в соединениях имеют СО +2.
4) Алюминий в соединениях почти всегда имеет СО +3.
5) Водород имеет СО, равную +1, при условии, если помимо водорода в рассматриваемом соединении имеется ещё хотя бы один неметалл.
Если же рассматривается соединение водорода с металлом (гидрид), например, NaH или KH, то знайте, что в данном случае у водорода СО равна –1.
6) Кислород в соединениях имеет СО, равную –2, с двумя исключениями:
а) в соединении со фтором OF2 кислород имеет СО, равную +2. Причина состоит в том, что фтор — более электроотрицательный элемент, и он перетягивает на себя электронную пару.
б) в перекисных соединениях (например, H2O2) кислород, как правило, имеет СО, равную –1. Причина состоит в том, что в перекисях имеется связь – O – O –.
7) Сумма СО всех атомов в молекуле равна нулю.
Данное правило позволяет находить СО у элементов, у которых мы её заранее не знаем.
Например, соединение K2SO3.
Согласно правилу номер 2, у калия СО равна +1 (так как калий — это щелочной металл).
Смотрим кислород. У нас не фторид и не перекись. А значит, у кислорода СО равна –2.
Какая же СО у серы?
Итак, у серы в соединении K2SO4 СО равна 6. Вернее, +6.
Это не гидрид, значит, у водорода СО равна +1 (см. правило номер 5).
У кислорода СО равна –2.
Нужно найти у азота.
Опять же, составляем уравнение:
Значит, мы определили, что у азота в азотной кислоте СО равна +5.
И помните, что очень опасно приравнивать валентность к степени окисления!
Например, у азота в HNO3 СО, как мы вычислили, равна +5. Однако валентность равна 4.
Углерод в органических соединениях имеет постоянную валентность 4. Но степень окисления углерода равна: в метане — –4, в этане — –3, а в пропане вообще дробная валентность: минус две целых две третьих. Есть также органические соединения, в которых углерод проявляет положительную СО, например, в муравьиной кислоте (HCOOH) у углерода СО равна +2. А в формальдегиде (HCOH) СО углерода равна нулю.
Таблица окисления химических элементов

Средняя оценка: 4.7
Всего получено оценок: 473.
Средняя оценка: 4.7
Всего получено оценок: 473.
Чтобы определить условный заряд атомов в окислительно-восстановительных реакциях, используют таблицу окисления химических элементов. В зависимости от свойств атома элемент может проявлять положительную или отрицательную степень окисления.
Что такое степень окисления
Условный заряд атомов элементов в сложных веществах называется степенью окисления. Значение заряда атомов записывается в окислительно-восстановительных реакциях, чтобы понять, какой элемент является восстановителем, а какой – окислителем.
Степень окисления взаимосвязана с электроотрицательностью, которая показывает возможность атомов принимать или отдавать электроны. Чем выше значение электроотрицательности, тем больше способность атома отнимать электроны в реакциях.
Степень окисления может иметь три значения:
Например, степени окисления в реакции натрия с хлором выглядят следующим образом:
В реакции металлов с неметаллами металл всегда является восстановителем, а неметалл – окислителем.
Как определить
Существует таблица, в которой указаны все возможные степени окисления элементов.
Название
Символ
Степень окисления
1, 0, +1, +3, +5, +7, редко +2 и +4
+2, +3, редко +4 и +6
-1, +1, +5, редко +3, +4
+3, +6, редко +2, +3, +5
+3, +4, +8, редко +2, +6, +7
-1, +1, +5, +7, редко +3, +4
+6, редко +2, +3, +4, +5
+3, +4, +6, +8, редко +2
+3, +4, +6, редко +1, +2
+2, +4, +6, редко +1, +3
+3, редко +3, +2, +4, +5
Или использовать на уроках этот вариант таблицы.

Кроме того, степени окисления химических элементов можно определить по периодической таблице Менделеева:
Второе правило не работает для щелочных и щелочноземельных металлов, которые всегда имеют одну положительную степень окисления, равную номеру группы. Исключения составляют магний и бериллий (+1, +2). Также постоянную степень окисления имеют:
Остальные металлы имеют непостоянную степень окисления. В большинстве реакций выступают в качестве восстановителя. В редких случаях могут быть окислителями с отрицательной степенью окисления.
Что мы узнали?
Из урока 8 класса узнали о степени окисления. Это условная величина, показывающая, сколько электронов может отдать или принять атом в ходе химической реакции. Значение связано с электроотрицательностью. Окислители принимают электроны и имеют отрицательную степень окисления, восстановители отдают электроны и проявляют положительную степень окисления. Большинство металлов – восстановители с постоянной или переменной степенью окисления. Неметаллы могут проявлять свойства окислителя и восстановителя в зависимости от вещества, с которым реагируют.
Таблица степени окисления химических элементов
Понятие степень окисления химических элементов
Она принимает как положительные, так и отрицательные значения. Чтобы указать степень окисления элемента в соединении нужно поставить сверху над его символом арабскую цифру с соответствующим знаком («+» или «-»).
Следует помнить, что степень окисления — величина, не имеющая физического смысла, так как не отражает реальный заряд атома. Однако это понятие весьма широко используется в химии.
Таблица степени окисления химических элементов
Максимальную положительную и минимальную отрицательную степень окисления можно определить с помощью Периодической таблицы Д.И. Менделеева. Они равны номеру группы, в которой расположен элемент, и разнице между значением «высшей» степени окисления и числом 8, соответственно.
Если рассматривать химические соединения более конкретно, то в веществах с неполярными связями степень окисления элементов равна нулю (N2, H2, Cl2).
Степень окисления металлов в элементарном состоянии равна нулю, так как распределение электронной плотности в них равномерно.
При определении степени окисления элементов в соединениях с полярными ковалентными связями сравнивают значениях их электроотрицательностей. Поскольку при образовании химической связи электроны смещаются к атомам более электроотрицательных элементов, то последние имеют в соединениях отрицательную степень окисления.
Существуют элементы, для которых характерно только одно значение степени окисления (фтор, металлы IA и IIA групп и т.д.). Фтор, характеризующийся наибольшим значением электроотрицательности, в соединениях всегда имеет постоянную отрицательную степень окисления (-1).
Щелочные и щелочноземельные элементы, для которых свойственно относительно невысокое значение электроотрицательности, всегда имеют положительную степень окисления, равную соответственно (+1) и (+2).
Однако, имеются и такие химические элементы, для которых характерны несколько значений степени окисления (сера – (-2), 0, (+2), (+4), (+6) и др.).
Для того, чтобы легче было запомнить сколько и какие степени окисления характерны для конкретного химического элемента используют таблицы степеней окисления химических элементов, которые выглядят следующим образом:
Валентность химических элементов. Степень окисления химических элементов
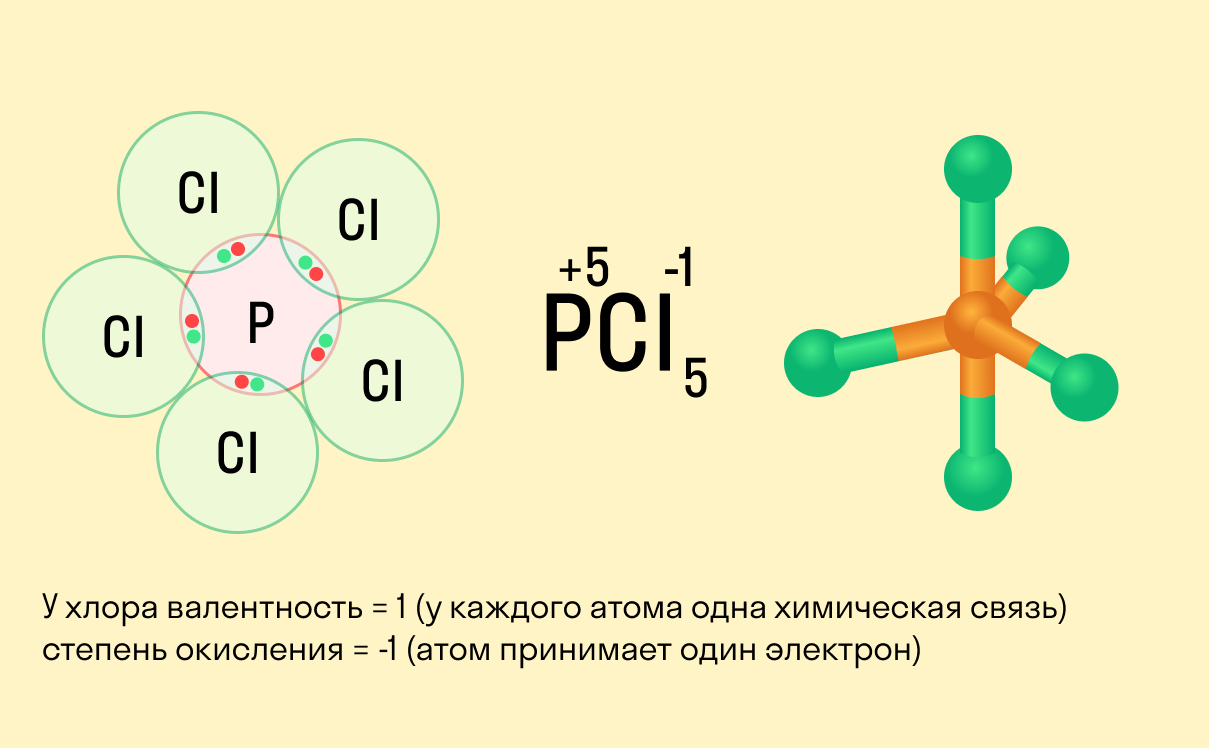
Валентность является сложным понятием. Этот термин претерпел значительную трансформацию одновременно с развитием теории химической связи. Первоначально валентностью называли способность атома присоединять или замещать определённое число других атомов или атомных групп с образованием химической связи.
Количественной мерой валентности атома элемента считали число атомов водорода или кислорода (данные элементы считали соответственно одно- и двухвалентными), которые элемент присоединяет, образуя гидрид формулы ЭHx или оксид формулы ЭnOm.
Так, валентность атома азота в молекуле аммиака NH3 равна трём, а атома серы в молекуле H2S равна двум, поскольку валентность атома водорода равна одному.
В соединениях Na2O, BaO, Al2O3, SiO2 валентности натрия, бария и кремния соответственно равны 1, 2, 3 и 4.
Понятие о валентности было введено в химию до того, как стало известно строение атома, а именно в 1853 году английским химиком Франклендом. В настоящее время установлено, что валентность элемента тесно связана с числом внешних электронов атомов, поскольку электроны внутренних оболочек атомов не участвуют в образовании химических связей.
В электронной теории ковалентной связи считают, что валентность атома определяется числом его неспаренных электронов в основном или возбуждённом состоянии, участвующих в образовании общих электронных пар с электронами других атомов.
Для некоторых элементов валентность является величиной постоянной. Так, натрий или калий во всех соединениях одновалентны, кальций, магний и цинк — двухвалентны, алюминий — трёхвалентен и т. д. Но большинство химических элементов проявляют переменную валентность, которая зависит от природы элемента — партнёра и условий протекания процесса. Так, железо может образовывать с хлором два соединения — FeCl2 и FeCl3, в которых валентность железа равна соответственно 2 и 3.
Степень окисления — понятие, характеризующее состояние элемента в химическом соединении и его поведение в окислительно-восстановительных реакциях; численно степень окисления равна формальному заряду, который можно приписать элементу, исходя из предположения, что все электроны каждой его связи перешли к более электроотрицательному атому.
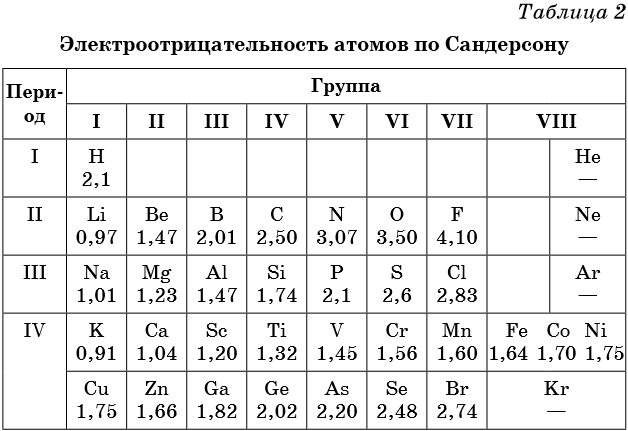
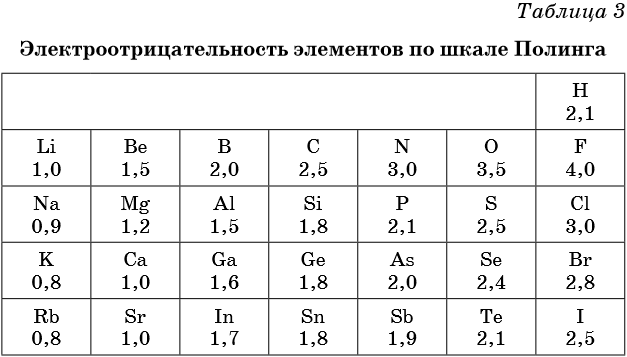
Электроотрицательность — мера способности атома к приобретению отрицательного заряда при образовании химической связи или способность атома в молекуле притягивать к себе валентные электроны, участвующие в образовании химической связи. Электроотрицательность не является абсолютной величиной и рассчитывается различными методами. Поэтому приводимые в разных учебниках и справочниках значения электроотрицательности могут отличаться.
В таблице 2 приведена электроотрицательность некоторых химических элементов по шкале Сандерсона, а в таблице 3 — электроотрицательность элементов по шкале Полинга.
Значение электроотрицательности приведено под символом соответствующего элемента. Чем больше численное значение электроотрицательности атома, тем более электроотрицательным является элемент. Наиболее электроотрицательным является атом фтора, наименее электроотрицательным — атом рубидия. В молекуле, образованной атомами двух разных химических элементов, формальный отрицательный заряд будет у атома, численное значение электроотрицательности у которого будет выше. Так, в молекуле диоксида серы SO2 электроотрицательность атома серы равна 2,5, а значение электроотрицательности атома кислорода больше — 3,5. Следовательно, отрицательный заряд будет на атоме кислорода, а положительный — на атоме серы.
В молекуле аммиака NH3 значение электроотрицательности атома азота равно 3,0, а водорода — 2,1. Поэтому отрицательный заряд будет у атома азота, а положительный — у атома водорода.
Следует чётко знать общие тенденции изменения электроотрицательности. Поскольку атом любого химического элемента стремится приобрести устойчивую конфигурацию внешнего электронного слоя — октетную оболочку инертного газа, то электроотрицательность элементов в периоде увеличивается, а в группе электроотрицательность в общем случае уменьшается с увеличением атомного номера элемента. Поэтому, например, сера более электроотрицательна по сравнению с фосфором и кремнием, а углерод более электроотрицателен по сравнению с кремнием.
При составлении формул соединений, состоящих из двух неметаллов, более электроотрицательный из них всегда ставят правее: PCl3, NO2. Из этого правила есть некоторые исторически сложившиеся исключения, например NH3, PH3 и т.д.
Степень окисления обычно обозначают арабской цифрой (со знаком перед цифрой), расположенной над символом элемента, например:
Для определения степени окисления атомов в химических соединениях руководствуются следующими правилами:
Проиллюстрируем вышеприведённые правила несколькими примерами.
Пример 1. Определить степень окисления элементов в оксидах калия K2O, селена SeO3 и железа Fe3O4.
Оксид калия K2O. Алгебраическая сумма степеней окисления атомов в молекуле равна нулю. Степень окисления кислорода в оксидах равна –2. Обозначим степень окисления калия в его оксиде за n, тогда 2n + (–2) = 0 или 2n = 2, отсюда n = +1, т. е. степень окисления калия равна +1.
Оксид селена SeO3. Молекула SeO3 электронейтральна. Суммарный отрицательный заряд трёх атомов кислорода составляет –2 × 3 = –6. Следовательно, чтобы уравнять этот отрицательный заряд до ноля, степень окисления селена должна быть равна +6.
Молекула Fe3O4 электронейтральна. Суммарный отрицательный заряд четырёх атомов кислорода составляет –2 × 4 = –8. Чтобы уравнять этот отрицательный заряд, суммарный положительный заряд на трёх атомах железа должен быть равен +8. Следовательно, на одном атоме железа должен быть заряд 8/3 = +8/3.
Следует подчеркнуть, что степень окисления элемента в соединении может быть дробным числом. Такие дробные степени окисления не имеют смысла при объяснении связи в химическом соединении, но могут быть использованы для составления уравнений окислительно-восстановительных реакций.
Пример 2. Определить степень окисления элементов в соединениях NaClO3, K2Cr2O7.
Молекула NaClO3 электронейтральна. Степень окисления натрия равна +1, степень окисления кислорода равна –2. Обозначим степень окисления хлора за n, тогда +1 + n + 3 × (–2) = 0, или +1 + n – 6 = 0, или n – 5 = 0, отсюда n = +5. Таким образом, степень окисления хлора равна +5.
Молекула K2Cr2O7 электронейтральна. Степень окисления калия равна +1, степень окисления кислорода равна –2. Обозначим степень окисления хрома за n, тогда 2 × 1 + 2n + 7 × (–2) = 0, или +2 + 2n – 14 = 0, или 2n – 12 = 0, 2n = 12, отсюда n = +6. Таким образом, степень окисления хрома равна +6.
Следует помнить, что степень окисления иногда не равна валентности данного элемента.
Например, степени окисления атома азота в молекуле аммиака NH3 или в молекуле гидразина N2H4 равны –3 и –2 соответственно, тогда как валентность азота в этих соединениях равна трём.
Максимальная положительная степень окисления для элементов главных подгрупп, как правило, равна номеру группы (исключения: кислород, фтор и некоторые другие элементы).
Максимальная отрицательная степень окисления равна 8 — номер группы.
Тренировочные задания
1. В каком соединении степень окисления фосфора равна +5?
2. В каком соединении степень окисления фосфора равна –3?
3. В каком соединении степень окисления азота равна +4?
4. В каком соединении степень окисления азота равна –2?
5. В каком соединении степень окисления серы равна +2?
6. В каком соединении степень окисления серы равна +6?
7. В веществах, формулы которых CrBr2, K2Cr2O7, Na2CrO4, степень окисления хрома соответственно равна
1) +2, +3, +6
2) +3, +6, +6
3) +2, +6, +5
4) +2, +6, +6
8. Минимальная отрицательная степень окисления химического элемента, как правило, равна
1) номеру периода
2) порядковому номеру химического элемента
3) числу электронов, недостающих до завершения внешнего электронного слоя
4) общему числу электронов в элементе
9. Максимальная положительная степень окисления химических элементов, расположенных в главных подгруппах, как правило, равна
1) номеру периода
2) порядковому номеру химического элемента
3) номеру группы
4) общему числу электронов в элементе
10. Фосфор проявляет максимальную положительную степень окисления в соединении
11. Фосфор проявляет минимальную степень окисления в соединении
12. Атомы азота в нитрите аммония, находящиеся в составе катиона и аниона, проявляют степени окисления соответственно
13. Валентность и степень окисления кислорода в перекиси водорода соответственно равны
1) II, –2
2) II, –1
3) I, +4
4) III, –2
14. Валентность и степень окисления серы в пирите FeS2 соответственно равны
1) IV, +5
2) II, –1
3) II, +6
4) III, +4
15. Валентность и степень окисления атома азота в бромиде аммония соответственно равны
1) IV, –3
2) III, +3
3) IV, –2
4) III, +4
16. Атом углерода проявляет отрицательную степень окисления в соединении с
1) кислородом
2) натрием
3) фтором
4) хлором
17. Постоянную степень окисления в своих соединениях проявляет
1) стронций
2) железо
3) сера
4) хлор
18. Степень окисления +3 в своих соединениях могут проявлять
1) хлор и фтор
2) фосфор и хлор
3) углерод и сера
4) кислород и водород
19. Степень окисления +4 в своих соединениях могут проявлять
1) углерод и водород
2) углерод и фосфор
3) углерод и кальций
4) азот и сера
20. Степень окисления, равную номеру группы, в своих соединениях проявляет
1) хлор
2) железо
3) кислород
4) фтор
КАК ОПРЕДЕЛИТЬ СТЕПЕНЬ ОКИСЛЕНИЯ В ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ И КАК РАССТАВЛЯТЬ КОЭФФИЦИЕНТЫ В ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЯХ С ОРГАНИЧЕСКИМИ ВЕЩЕСТВАМИ
Как определить степень окисления в органических соединениях? Чем отличается определение степени окисления в органических соединениях от определения степени окисления в неорганических? Как составить уравнение окислительно-восстановительной реакции, в которой участвуют соединения углерода, и правильно расставить коэффициенты?
Обо всем этом в данной статье подробно и по порядку.
Проблема, как определить степень окисления в органических соединениях, вытекает из школьного курса химии. Определенное (но не достаточное) внимание уделяется этому вопросу на примере неорганических веществ. Об органических же веществах в этой связи речь практически не идет.
Тем не менее, об окислении соединений углерода в курсе органической химии (10 класс) говорится достаточно часто. 33 задание в ЕГЭ по химии практически всегда подразумевает хотя бы одну ОВР с участием органического вещества и необходимость не только составить схему реакции, но и расставить коэффициенты.
Придя в колледж или университет, изучая курс органической химии на более серьезном уровне, студент сталкивается все с той же проблемой: как определить степень окисления в органических соединениях. Подразумевается, что бывший выпускник школы получил эти знания в школьном курсе химии, поэтому нет надобности останавливаться на данном вопросе в профессиональном образовании.
Налицо потеря взаимосвязи и преемственности разных ступеней образования: среднего основного и профессионального (СПО и ВПО).
Итак, разберемся по порядку как определить степень окисления в органических соединениях.
Что такое электроотрицательность, степень окисления и ковалентная связь
Для того чтобы правильно определить степень окисления в органическом соединении, необходимо четко и ясно усвоить три основных понятия: собственно само понятие степень окисления, электроотрицательность и ковалентная связь.
Остановимся на них кратко, так как их рассмотрение не является основной целью данной статьи.
Что такое электроотрицательность
Понятие электроотрицательности (ЭО) впервые было введено американским химиком Л.Полингом в 1932 г.
Кстати, ЭО – это еще одна относительная величина в химии. Ее правильнее называть относительной электроотрицательностью (ОЭО). Абсолютные значения ЭО очень не удобны в расчетах, поэтому их вычисляют относительно значения ЭО лития Li. Относительные величины не имеют единиц измерения.
Были получены вполне приемлемые для расчетов и анализа числа, которые сведены в удобную таблицу, в общих чертах похожую на периодическую систему химических элементов.
Способность атомов химических элементов притягивать к себе электроны других атомов в процессе образования химической связи называется электроотрицательностью .
Почему нейтральные атомы притягиваются
Раз атомы притягивают к себе электроны, то закономерно возникает следующий вопрос. Если атом, по определению, – это электронейтральная частица, то как он может вообще к себе что-то притягивать, в частности электроны – отрицательно заряженные частицы?
Вообще этот вопрос можно бы переадресовать ученым, специалистам, занимающимся проблемами квантовой механики (один из разделов современной физики).
А мы же лишь крайне упрощенно поясним, почему такое может быть.
Необходимо вспомнить, что силовые линии электрического поля положительного заряда (а им является ядро атома) всегда заканчиваются на отрицательном заряде (электроны атома).
У атомов большинства химических элементов внешний уровень не завершен. То есть в нем есть своеобразная «дырка», сквозь которую выходят силовые линии ядра. Выходят они за пределы атома и заканчиваются на электронах другого атома. В подобной ситуации, несмотря на свою общую электронейтральность, атом ведет себя как положительная частица.
Примерно так это выглядит
При всем при этом атомы полностью не «слипаются». Это не возможно, так как положительно заряженные ядра атомов будут отталкиваться. Но поскольку расстояние между ядром одного атома и электронами другого меньше расстояния между ядрами, то можно утверждать, что силы притяжения все-таки преобладают над силами отталкивания.
Для чего необходимо понятие относительной электроотрицательности
Знание и понимание понятия ОЭО дает возможность определить тип химической связи между атомами. Для этого необходимо найти разность ОЭО двух элементов, атомы которых и образуют связь.
Если разность электроотрицательностей менее 0,5, то связь считается ковалентной неполярной. При разности от 0,5 до 1,6 – связь ковалентная полярная. Если более 2,0 – ионная. А если разность в промежутке от 1,6 до 2,0, то в присутствии металла связь считается ионной, при его отсутствии – ковалентной полярной.
Что такое ковалентная связь
Почему мы говорим здесь о ковалентной связи? Потому, что большинство органических соединений – ковалентные. А это очень важно при определении с.о. углерода в них.
Если коротко, то
ковалентная связь – связь между атомами элементов, возникающая за счет обобществления электронов, т.е. образования общих электронных пар.
Если связь образована между атомами с одинаковой ОЭО, то связь будет считаться ковалентной неполярной. Это потому, что между атомами не происходит перераспределения электронной плотности. Иными словами обобществленная электронная пара не смещается к какому-либо атому.
Такая ситуация возможна, если в образовании связи участвуют атомы одного и того же химического элемента-неметалла:
Но есть и редкие исключения. Молекула фосфина PH3 характеризуется ковалентной неполярной связью, так как относительные электроотрицательности водорода и фосфора равны: ОЭО(Н)=2,1 и ОЭО(Р)=2,1.
Если же связь образована элементами-неметаллами с разной ОЭО, то она считается ковалентной полярной. Происходит перераспределение электронной плотности между атомами, т.е. общая электронная пара смещается к атому с большей ОЭО. И чем сильнее будет разность в электроотрицательностях атомов элементов, тем полярнее будет и связь.
Что такое степень окисления и какие значения она может принимать
Степень окисления (с.о.) – важнейшее понятие в теории окислительно-восстановительных процессов. И это условная величина.
Известно, что при образовании ковалентной связи электроны общей электронной пары смещаются к атому более электроотрицательного элемента. Но лишь смещаются, а не полностью переходят к нему!
Классифицировать с.о. можно по разным признакам. Один из них – это постоянство для одного и того же химического элемента.
Согласно данному признаку, существуют элементы, проявляющие во всех без исключения сложных веществах одну и ту же ( постоянную ) степень окисления. Например:

А вот теперь самое интересное! Мы прекрасно знаем, что химический элемент углерод проявляет две степени окисления: +2 (в соединении СО) и +4 (СО2, например).
Более того, находясь в составе сложного органического соединения, углерод может иметь и нулевую степень окисления! Уж это совсем не вяжется с устоявшимися представлениями, выработанными на основе знаний о неорганических веществах. Для них мы знаем, что с.о. равная нулю возможна у атомов элементов в составе простых веществ (О3, P4, H2, N2 и т.д.)
Подведем некоторый итог.
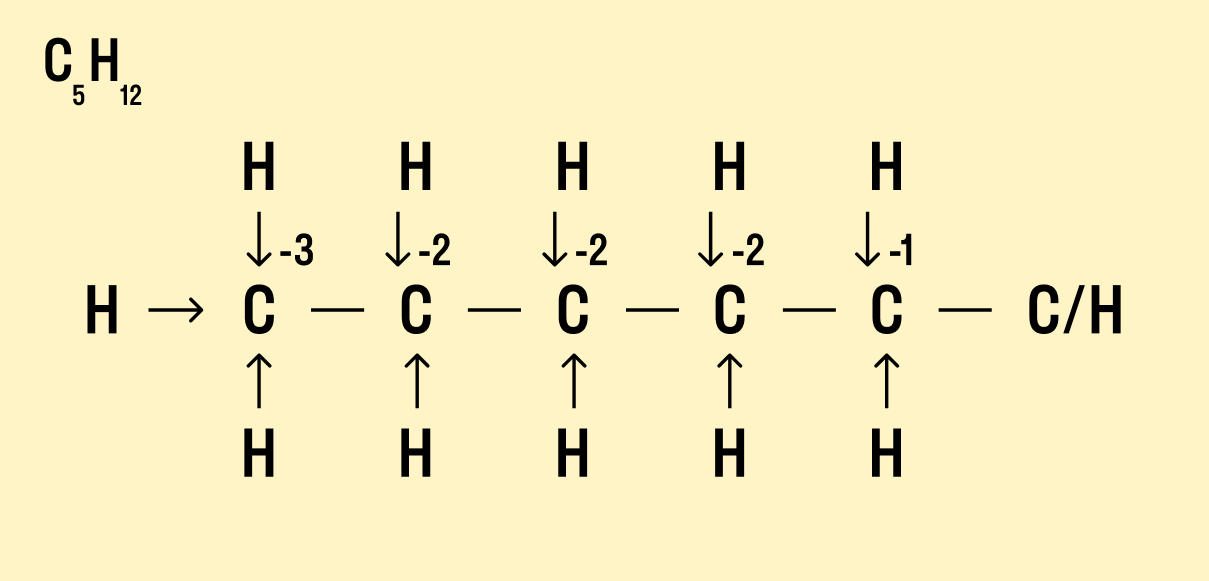
В органических соединениях:
2) с.о. углерода может быть равна 0;
3) валентность углерода постоянна, равна IV и не всегда совпадает по значению со степенью окисления.
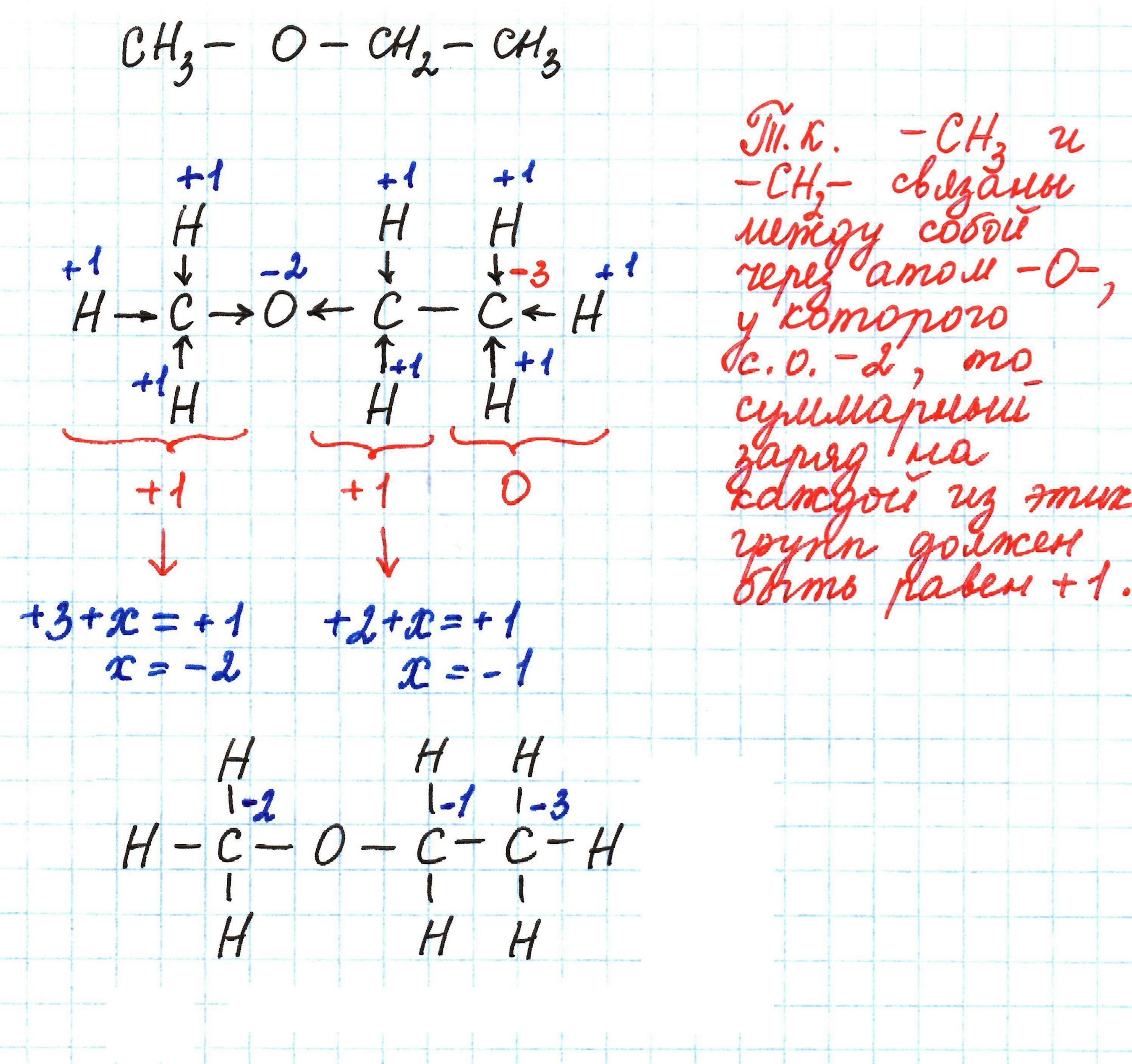
Как определить степень окисления в органических соединениях: примеры
Методы, которыми мы пользуемся для определения с.о. в неорганических веществах, применимы к органическим лишь в очень редких случаях.
Особенности определения с.о. в органических веществах
Определить степень окисления в органических веществах можно разными способами. Разберем самый простой и удобный, на наш взгляд. Именно для этого мы вспомнили, что такое относительная электроотрицательность, ковалентная связь и ее виды.
Вернемся к ранее упомянутому пропану С3Н8 и рассмотрим, какие виды ковалентной связи присутствуют в его молекуле.
1) запишем полную структурную формулу вещества и пронумеруем атомы углерода;
2) определим, какие связи в молекуле будут ковалентными полярными и ковалентными неполярными;
Но даже и такой вполне удобный способ определения с.о. не всегда бывает справедлив. Все дело во влиянии атомов кислорода на распределение зарядов в молекуле.
Молекулу метанола можно рассматривать как связанные между собой метильную –СН3 и гидроксильную –ОН группы. В таком случае суммарные заряды каждой из них в итоге должны дать ноль, так как молекула в целом электронейтральна.
Ясно, что подобная ситуация будет возникать всегда в тех случаях, когда атом углерода связан с гидроксильной –ОН группой, образуя первичный спирт.
Приведем другие примеры.
Метилэтиловый эфир – последовательно связанные друг с другом метильная группа –СН3, атом кислорода О, гомологическая разность –СН2– и еще одна метильная группа –СН3.
Приведенные примеры позволяют сделать общие выводы о том, как определить степень окисления в органических соединениях.
2) Каждая ковалентная полярная связь, электронная плотность которой смещается ОТ атома углерода (С→О, С→N и т.д.), добавляет в его значение с.о. +1.
! При этом не следует забывать о влиянии более электроотрицательных атомов на распределение электронной плотности (а, значит, и зарядов), что приводит в некоторых случаях к несоблюдению указанных общих выводов.
Как расставить коэффициенты в окислительно-восстановительных реакциях с органическими веществами
Итак, начнем с самых простых окислительно-восстановительных реакций, в которых реагентами выступают органические соединения. Для определения степени окисления углерода будем использовать выше описанный метод. В каждом конкретном примере на этом останавливаться уже не будем.
Пример 1. СН4 + О2 → СО2 + Н2О
При расстановке коэффициентов в данном случае лучше воспользоваться методом электронного баланса:
1) определим с.о. элементов;
2) составим схемы полуреакций с элементами, изменяющими свою с.о.;
3) используя данные по числу отданных и принятых электронов в полуреакциях, найдем наименьшее общее кратное и определим множители для каждой из полуреакций;
4) просуммируем полуреакции с учетом найденных множителей (коэффициентов);
5) перенесем коэффициенты в схему реакции, поставив их перед соответствующими веществами;
6) подберем коэффициенты для всех остальных химических элементов;
7) помним, что баланс количества атомов кислорода проверяем в последнюю очередь. Обычно, если число атомов кислорода слева (до стрелки) и справа (после стрелки) сходится, то это означает, что реакция составлена правильно и все остальные коэффициенты верны.
Пример 2. С3Н8 + О2 → СО2 + Н2О
В данном случае также удобнее использовать метод электронного баланса.
Пример 3. Н2C2O4 + KMnO4 → СО2 + K2CO3 + MnO2 + Н2О
Для расстановки коэффициентов вновь воспользуемся методом электронного баланса.
Пример 4. CH3OH + K2Cr2O7 + H2SO4 → HCOOH + Cr2(SO4)3 + K2SO4 + Н2О
В данном случае метанол и дихромат калия реагируют в кислой среде. Для расстановки коэффициентов можно воспользоваться любым из методов. Еще раз применим метод электронного баланса.
Пример 5. C6H12O6 + KMnO4 + H2SO4 → CO2 + MnSO4 + K2SO4 + Н2О
Расставим коэффициенты тремя разными способами.
Способ 2. Расставим коэффициенты методом электронного баланса, используя все три с.о. углерода.
Способ 3. Поскольку реакция между глюкозой и перманганатом калия проходит в кислой среде (в H2SO4), расставим коэффициенты ионно-электронным методом (полуреакций):
1) молекулярные вещества (а к ним относится и глюкоза) на ионы не диссоциируют, поэтому в схемах полуреакций записываются в исходном виде;
2) количество недостающих кислорода и водорода в полуреакциях компенсируем, дописывая по необходимости молекулы воды H2O или ионы водорода Н + ;
3) считаем слева и справа в каждой полуреакции суммарный заряд (он создается ионами, образовавшимися при диссоциации реагирующих веществ, и ионами водорода Н + );
4) разницу зарядов компенсируем отдаваемыми или принимаемыми электронами;
5) так же, как и в методе электронного баланса, находим наименьшее общее кратное, определяем множители для каждой из полуреакций;
6) просуммируем полуреакции с учетом найденных множителей (коэффициентов);
7) перенесем коэффициенты в схему реакции, поставив их перед соответствующими веществами;
8) подберем коэффициенты для всех остальных химических элементов;
9) помним, что баланс количества атомов кислорода проверяем в последнюю очередь.
Пример 6. C3H4 + KMnO4 + H2SO4 → CH3COOH + CO2 + MnSO4 + K2SO4 + Н2О
Такое разнообразие степеней окисления одного элемента затрудняет применение метода электронного баланса. Поэтому лучше воспользоваться методом полуреакций.
Действие окислителей на органические вещества
В зависимости от строения и состава органических веществ (разветвленность углеродного скелета, наличие функциональных групп и их количество), а также от условий процесса (избыток или недостаток окислителя, его концентрация, рН раствора, нагревание или охлаждение) окисление происходит по-разному.
Так, например, при окислении алкена раствором KMnO4 в мягких условиях (без нагревания и в нейтральной или слабощелочной среде) образуется двухатомный спирт. А при окислении алкена раствором KMnO4 в жестких условиях (с нагреванием и в кислой или сильнощелочной среде) молекула по двойной связи разрушается, и образуются совершенно иные продукты. Это могут быть и карбоновая кислота, и ее соль и СО2.
Знание действия окислителей на органические вещества тех или иных классов поможет верно определить продукты окислительно-восстановительной реакции и правильно расставить в них коэффициенты.
Итак, ответ на вопрос: «Как определить степень окисления в органических веществах», – позволяет правильно составить схему реакции с участием органических веществ и подобрать наиболее оптимальный метод расстановки коэффициентов.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
или на Одноклассниках

Ваше мнение для нас важно!