какая орбиталь имеет сферическую форму
Тест по теме
«СТРОЕНИЕ АТОМА»
ВАРИАНТ 1
1. Определите элемент со схемой распределения электронов в атоме 2, 8, 4:
а) Mg; б) Si; в) Cl; г) S.
2. Максимальное число электронов на третьем энергетическом уровне:

3. Орбитали, имеющие сферическую форму, называют:
4. Максимальное число электронов на р-орбиталях:
5. Укажите химический элемент, атомы которого имеют электронную формулу
а) Na; б) P; в) Al; г) Ar.
6. Сколько орбиталей в атоме водорода, на которых находятся электроны?
7. Атом какого химического элемента содержит три протона?
8. Атом какого химического элемента имеет заряд ядра +22?
9. Число нейтронов в атоме марганца равно:
а) 25; б) 29; в) 30; г) 55.
10. Количество неспаренных электронов в атоме серы равно:
ВАРИАНТ 2
1. Определите элемент со схемой распределения электронов в атоме 2, 8, 8:
а) Na; б) P; в) Al; г) Ar.
2. Максимальное число электронов на четвертом энергетическом уровне:
а) 14; б) 32; в) 26; г) 18.
3. Орбитали, имеющие гантелеобразную форму, называют:
4. Максимальное число электронов на s-орбиталях:
5. Укажите химический элемент, атомы которого имеют электронную формулу
а) Mg; б) P; в) Cl; г) Si.
6. Сколько орбиталей в атоме гелия, на которых находятся электроны?
7. Атом какого химического элемента содержит десять электронов?
8. Атом какого химического элемента имеет заряд ядра +35?
а) Ni; б) Pt; в) Br; г) Te.
9. Число нейтронов в атоме цинка равно:
а) 65; б) 22; в) 30; г) 35.
10. Количество неспаренных электронов в атоме хлора равно:
1.1.1. Строение электронных оболочек атомов элементов первых четырех периодов. Электронная конфигурация атома. Основное и возбужденное состояние атомов.
Химия — наука о веществах, их свойствах и превращениях.
Химическими веществами называют то, из чего состоит окружающий нас мир.
Свойства каждого химического вещества делятся на два типа: это химические, которые характеризуют его способность образовывать другие вещества, и физические, которые объективно наблюдаются и могут быть рассмотрены в отрыве от химических превращений. Так, например, физическими свойствами вещества являются его агрегатное состояние (твердое, жидкое или газообразное), теплопроводность, теплоемкость, растворимость в различных средах (вода, спирт и др.), плотность, цвет, вкус и т.д.
Превращения одних химических веществ в другие вещества называют химическими явлениями или химическими реакциями. Следует отметить, что существуют также и физические явления, которые, очевидно, сопровождаются изменением каких-либо физических свойств вещества без его превращения в другие вещества. К физическим явлениям, например, относятся плавление льда, замерзание или испарение воды и др.
О том, что в ходе какого-либо процесса имеет место химическое явление, можно сделать вывод, наблюдая характерные признаки химических реакций, такие как изменение цвета, образование осадка, выделение газа, выделение теплоты и (или) света.
Так, например, вывод о протекании химических реакций можно сделать, наблюдая:
— образование осадка при кипячении воды, называемого в быту накипью;
— выделение тепла и света при горении костра;
— изменение цвета среза свежего яблока на воздухе;
— образование газовых пузырьков при брожении теста и т.д.
Мельчайшие частицы вещества, которые в процессе химических реакций практически не претерпевают изменений, а лишь по-новому соединяются между собой, называются атомами.
Сама идея о существовании таких единиц материи возникла еще в древней Греции в умах античных философов, что собственно и объясняет происхождение термина «атом», поскольку «атомос» в буквальном переводе с греческого означает «неделимый».
Тем не менее, вопреки идее древнегреческих философов, атомы не являются абсолютным минимумом материи, т.е. сами имеют сложное строение.
Что касается качественного устройства атома, то у каждого атома все протоны и нейтроны сосредоточены в так называемом ядре, вокруг которого электроны образуют электронную оболочку.
Поскольку фундаментальным свойством атома является его электронейтральность, а заряд одного электрона равен заряду одного протона, из этого можно сделать вывод о том, что количество электронов в любом атоме равно количеству протонов.
Так, например, в таблице ниже представлен возможный состав атомов:
Вид атомов с одинаковым зарядом ядер, т.е. с одинаковым числом протонов в их ядрах, называют химическим элементом. Таким образом, из таблицы выше можно сделать вывод о том, что атом1 и атом2 относятся в одному химическому элементу, а атом3 и атом4 — к другому химическому элементу.
Как можно заметить из представленной выше таблицы, атомы одного химического элемента могут отличаться количеством нейтронов в ядрах.
Атомы, относящиеся к одному химическому элементу, но имеющие разное количество нейтронов и, как следствие массу, называют изотопами.
Так, например, химический элемент водород имеет три изотопа – 1 Н, 2 Н и 3 Н. Индексы 1, 2 и 3 сверху от символа Н означают суммарное количество нейтронов и протонов. Т.е. зная, что водород – это химический элемент, который характеризуется тем, что в ядрах его атомов находится по одному протону, можно сделать вывод о том, что в изотопе 1 Н вообще нет нейтронов (1-1=0), в изотопе 2 Н – 1 нейтрон (2-1=1) и в изотопе 3 Н – два нейтрона (3-1=2). Поскольку, как уже было сказано, нейтрон и протон имеют одинаковые массы, а масса электрона по сравнению с ними пренебрежимо мала, это значит, что изотоп 2 Н практически в два раза тяжелее изотопа 1 Н, а изотоп 3 Н — и вовсе в три раза. В связи с таким большим разбросом масс изотопов водорода изотопам 2 Н и 3 Н даже были присвоены отдельные индивидуальные названия и символы, что не характерно больше ни для одного другого химического элемента. Изотопу 2 Н дали название дейтерий и присвоили символ D, а изотопу 3 Н дали название тритий и присвоили символ Т.
Если принять массу протона и нейтрона за единицу, а массой электрона пренебречь, фактически верхний левый индекс помимо суммарного количества протонов и нейтронов в атоме можно считать его массой, в связи с чем этот индекс называют массовым числом и обозначают символом А. Поскольку за заряд ядра любого атома отвечают протоны, а заряд каждого протона условно считается равным +1, количество протонов в ядре называют зарядовым числом (Z). Обозначив количество нейтронов в атоме буквой N, математически взаимосвязь между массовым числом, зарядовым числом и количеством нейтронов можно выразить как:
Согласно современным представлениям, электрон имеет двойственную (корпускулярно-волновую) природу. Он обладает свойствами как частицы, так и волны. Подобно частице, электрон имеет массу и заряд, но в то же время поток электронов, подобно волне, характеризуется способностью к дифракции.
Для описания состояния электрона в атоме используют представления квантовой механики, согласно которым электрон не имеет определенной траектории движения и может находиться в любой точке пространства, но с разной вероятностью.
Область пространства вокруг ядра, где наиболее вероятно нахождение электрона, называется атомной орбиталью.
Атомная орбиталь может обладать различной формой, размером и ориентацией. Также атомную орбиталь называют электронным облаком.
Графически одну атомную орбиталь принято обозначать в виде квадратной ячейки:
Квантовая механика имеет крайне сложный математический аппарат, поэтому в рамках школьного курса химии рассматриваются только лишь следствия квантово-механической теории.
Согласно этим следствиям, любую атомную орбиталь и находящийся на ней электрон полностью характеризуют 4 квантовых числа.
Орбитали с l = 0 называют s-орбиталями. s-Орбитали имеют сферическую форму и не обладают направленностью в пространстве:
Орбитали с l = 1 называются p-орбиталями. Данные орбитали обладают формой трехмерной восьмерки, т.е. формой, полученной вращением восьмерки вокруг оси симметрии, и внешне напоминают гантель:
Орбитали с l = 2 называются d-орбиталями, а с l = 3 – f-орбиталями. Их строение намного более сложное.
Так, например, p-орбитали, т.е. орбитали с орбитальным квантовым числом l = 1, имеющие форму «трехмерной восьмерки», соответствуют трем значениям магнитного квантового числа (-1, 0, +1), что, в свою очередь, соответствует трем перпендикулярным друг другу направлениям в пространстве.
Совокупность всех орбиталей в атоме, имеющих одно и то же значение главного квантового числа, называют энергетическим уровнем или электронной оболочкой. Любой произвольный энергетический уровень с некоторым номером n состоит из n 2 орбиталей.
Множество орбиталей с одинаковыми значениями главного квантового числа и орбитального квантового числа представляет собой энергетический подуровень.
Каждый энергетический уровень, которому соответствует главное квантовое число n, содержит n подуровней. В свою очередь, каждый энергетический подуровень с орбитальным квантовым числом l, состоит из (2l+1) орбиталей. Таким образом, s-подуровень состоит из одной s-орбитали, p-подуровень – трех p-орбиталей, d-подуровень – пяти d-орбиталей, а f-подуровень — из семи f-орбиталей. Поскольку, как уже было сказано, одна атомная орбиталь часто обозначается одной квадратной ячейкой, то s-, p-, d- и f-подуровни можно графически изобразить следующим образом:
Каждой орбитали соответствует индивидуальный строго определенный набор трех квантовых чисел n, l и ml.
Распределение электронов по орбиталям называют электронной конфигурацией.
Заполнение атомных орбиталей электронами происходит в соответствии с тремя условиями:
Цифрами нормального размера слева от символа подуровня показан номер энергетического уровня, а верхними индексами справа от символа подуровня показано количество электронов на соответствующем подуровне.
Ниже приведены электронные формул первых 36 элементов периодической системы Д.И. Менделеева.
| период | № элемента | символ | название | электронная формула |
| I | 1 | H | водород | 1s 1 |
| 2 | He | гелий | 1s 2 | |
| II | 3 | Li | литий | 1s 2 2s 1 |
| 4 | Be | бериллий | 1s 2 2s 2 | |
| 5 | B | бор | 1s 2 2s 2 2p 1 | |
| 6 | C | углерод | 1s 2 2s 2 2p 2 | |
| 7 | N | азот | 1s 2 2s 2 2p 3 | |
| 8 | O | кислород | 1s 2 2s 2 2p 4 | |
| 9 | F | фтор | 1s 2 2s 2 2p 5 | |
| 10 | Ne | неон | 1s 2 2s 2 2p 6 | |
| III | 11 | Na | натрий | 1s 2 2s 2 2p 6 3s 1 |
| 12 | Mg | магний | 1s 2 2s 2 2p 6 3s 2 | |
| 13 | Al | алюминий | 1s 2 2s 2 2p 6 3s 2 3p 1 | |
| 14 | Si | кремний | 1s 2 2s 2 2p 6 3s 2 3p 2 | |
| 15 | P | фосфор | 1s 2 2s 2 2p 6 3s 2 3p 3 | |
| 16 | S | сера | 1s 2 2s 2 2p 6 3s 2 3p 4 | |
| 17 | Cl | хлор | 1s 2 2s 2 2p 6 3s 2 3p 5 | |
| 18 | Ar | аргон | 1s 2 2s 2 2p 6 3s 2 3p 6 | |
| IV | 19 | K | калий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 |
| 20 | Ca | кальций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 | |
| 21 | Sc | скандий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1 | |
| 22 | Ti | титан | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 2 | |
| 23 | V | ванадий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 3 | |
| 24 | Cr | хром | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5 здесь наблюдается проскок одного электрона с s на d подуровень | |
| 25 | Mn | марганец | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5 | |
| 26 | Fe | железо | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6 | |
| 27 | Co | кобальт | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 7 | |
| 28 | Ni | никель | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 8 | |
| 29 | Cu | медь | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 10 здесь наблюдается проскок одного электрона с s на d подуровень | |
| 30 | Zn | цинк | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 | |
| 31 | Ga | галлий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 1 | |
| 32 | Ge | германий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 2 | |
| 33 | As | мышьяк | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 3 | |
| 34 | Se | селен | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 4 | |
| 35 | Br | бром | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 5 | |
| 36 | Kr | криптон | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 |
Как уже было сказано, в основном своем состоянии электроны в атомных орбиталях расположены согласно принципу наименьшей энергии. Тем не менее, при наличии пустых p-орбиталей в основном состоянии атома, нередко, при сообщении ему избыточной энергии атом можно перевести в так называемое возбужденное состояние. Так, например, атом бора в основном своем состоянии имеет электронную конфигурацию и энергетическую диаграмму следующего вида:
5B = 1s 2 2s 2 2p 1
А в возбужденном состоянии (*), т.е. при сообщении некоторой энергии атому бора, его электронная конфигурация и энергетическая диаграмма будут выглядеть так:
5B* = 1s 2 2s 1 2p 2
В зависимости от того, какой подуровень в атоме заполняется последним, химические элементы делят на s, p, d или f.
Нахождение s, p, d и f-элементов в таблице Д.И. Менделеева:
Электронные конфигурации простых ионов
Ионами называют частицы, имеющие либо положительный, либо отрицательный заряд. Ионы бывают простые и сложные. Простые ионы образованы одним химическим элементом, сложные – двумя или более элементами.
Рассмотрим детальнее простые ионы. Откуда у них может возникнуть заряд? Вспомним тот факт, что любой атом является электронейтральной частицей вследствие того, что количество отрицательно заряженных электронов в его оболочках равно количеству положительно заряженных протонов в его ядре.
Если мы «удалим» у атома часть электронов, то получим часть некомпенсированных положительных зарядов. При удалении части электронов у атома получим катион, при присоединении одного или нескольких электронов к атому получим анион.
Мы поняли, как записать электронно-графическую (или обычную электронную) формулу иона, зная точное его обозначение. Однако, для того чтобы успешно сдать ЕГЭ, нам нужно уметь самим определять заряды ионов, которые склонны образовывать те или иные химические элементы. Причем уметь определять заряд наиболее устойчивых ионов мы обязаны только для элементов главных подгрупп.
Все очень просто, если учитывать, что атомы элементов главных подгрупп «хотят» получить электронную конфигурацию, как у ближайшего к ним по номеру в таблице атома благородного газа.
Химия. 10 класс
§ 1. Строение атома. Состояние электрона в атоме. Атомная орбиталь
Строение атома. Состояние электрона в атоме. Атомная орбиталь
В центре атома находится положительно заряженное ядро. Заряд ядра равен атомному номеру элемента в периодической системе. Вокруг ядра движутся отрицательно заряженные электроны, образуя электронную оболочку. Положительный заряд ядра компенсируется отрицательным зарядом электронов, поэтому атом электронейтрален.
Например, атом водорода состоит из ядра, заряд которого равен 1+, и одного электрона. Заряд ядра атома гелия равен 2+, поэтому в атоме гелия два электрона (рис.1.2).
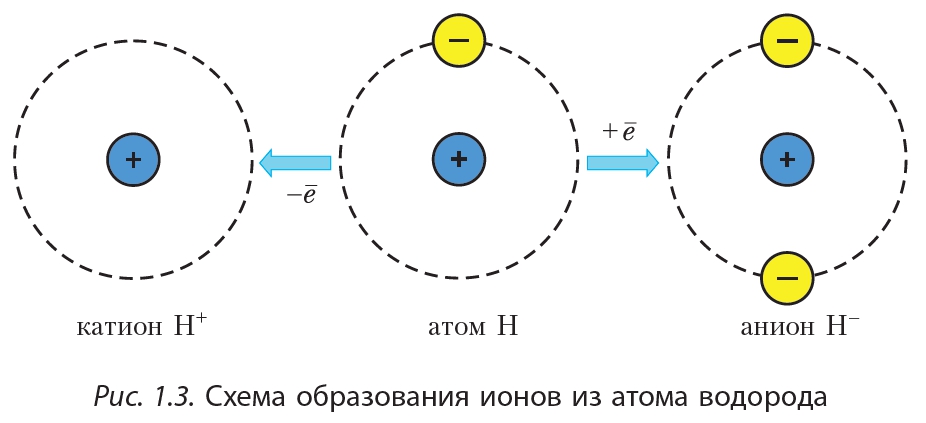
Если атом отдаёт электрон, то образуется положительно заряженный ион – катион. Если атом присоединяет электрон, то образуется отрицательно заряженный ион – анион (рис.1.3).
Глядя на рисунки 1.2 и 1.3, можно ошибочно предположить, что электроны вращаются вокруг атомного ядра подобно тому, как планеты вращаются вокруг солнца. В действительности траекторию движения электрона в атоме определить невозможно. Каждый электрон образует вокруг ядра облако отрицательного заряда определённой формы и размера – электронное облако. Например, единственный электрон в атоме водорода образует облако сферической формы (рис. 1.4).
Глядя на рисунки 1.2 и 1.3, можно ошибочно предположить, что электроны вращаются вокруг атомного ядра подобно тому, как планеты вращаются вокруг солнца. В действительности траекторию движения электрона в атоме определить невозможно. Каждый электрон образует вокруг ядра облако отрицательного заряда определённой формы и размера – электронное облако. Например, единственный электрон в атоме водорода образует облако сферической формы (рис. 1.4).
Чтобы лучше представить электронное облако, проведём мысленный эксперимент. Допустим, у нас есть возможность фотографировать атом водорода в различные моменты времени, тогда на фотографиях мы будем видеть электрон в различных положениях относительно ядра (рис. 1.5).
Если сделать много таких снимков и наложить фотографии друг на друга, по густоте точек мы увидим, насколько часто электрон оказывается в данной области пространства.
Из рисунка 1.5 видно, что электрон в атоме водорода чаще всего находится в непосредственной близости от ядра, по мере удаления от ядра вероятность обнаружить электрон резко снижается.
У электрона есть ещё одна особенность. В атоме водорода электрон может иметь не любые, а только определённые значения энергии. Эти значения энергии электрона в атоме водорода называются энергетическими уровнями. Энергетические уровни обозначаются номерами.
На рисунке 1.6 показаны энергетические уровни атома водорода.
Электрон может переходить с одного энергетического уровня на другой. При переходе с первого уровня на второй он поглощает порцию энергии, равную Е2 – Е1, при обратном переходе он излучает такую же порцию энергии.
Теперь мы можем уточнить понятие орбиталь, которое было введено в курсе химии 8-го класса. Мы уже знаем, что электрон в атоме может находиться только в определённых состояниях. Каждому состоянию соответствует определённое значение энергии и определённая форма электронного облака. Электронное состояние называется орбиталью.
| Атомная орбиталь – состояние электрона в атоме, характеризующееся определёнными значением энергии, формой и пространственной ориентацией электронного облака. |
Электронное облако не имеет чётких границ, поэтому при изображении формы орбитали приводят не всё электронное облако, а лишь ту область пространства, внутри которой вероятность обнаружить электрон достаточно большая.
Орбитали могут иметь различную форму. Орбитали сферической формы называются s-орбиталями:
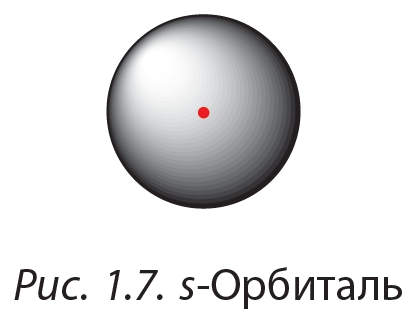
В атомах имеются также d- и f-орбитали ещё более сложной формы, с ними можно ознакомиться, перейдя по ссылке в QR-коде.
Атом состоит из положительно заряженного ядра и отрицательно заряженных электронов.
Каждый электрон в атоме находится в состоянии с определённой энергией (занимает определённую атомную орбиталь).
Орбиталь характеризуется энергией и формой электронного облака.
Скрытая от нас красота
Каждому свое красиво.
Цицерон
Кто такие «мы» и что от нас скрывают? Речь пойдет о химиках, впрочем, это касается всех. В нашем путешествии потребуется путеводитель, или карта местности, чтобы быстрее достичь скрытой цели. Такой путеводитель у химика всегда под рукой – это таблица Менделеева. Дальнейший рассказ станет гораздо интереснее, если эта таблица будет у вас под руками.
Представьте себе, что вы познакомились с интересным человеком, от которого постоянно узнаете необычные и занимательные сведения. Сначала будет вполне достаточно получать интересную информацию, но постепенно вас заинтересует и сам этот человек. Захочется узнать его вкусы, взгляды, привязанности, как он живет.
В нашей статье информацию предоставляют электроны. Именно они (в первую очередь валентные электроны) определяют поведение веществ, образованных химическими элементами, бесконечное разнообразие их химических превращений. Рассмотрим, в каких условиях живут электроны. Нельзя сказать, что архитектуру их жилища от нас кто-то скрывает, но истинная картина мало кому знакома.
Природа – превосходный дизайнер
Напомним, что область пространства, которую занимает электрон в атоме или молекуле, называют орбиталью. Привычным и даже популярным стало не только само понятие орбиталей, но и их внешний облик, который иногда можно увидеть на обложках книг. Например, на обложке одного из школьных учебников химии изображена схема молекулы воды, похожий сюжет – схема молекулы метана (рис. 1).
Рис. 1.
Популярность и изящество орбиталей
Обе конструкции очень привлекательны. Расположенные внутри тетраэдра орбитали, напоминающие удлиненные надувные шары, соприкасаются с орбиталями-сферами.
В молекуле метана – орбитали молекулярные, мы же сосредоточим внимание на более простых объектах – атомных орбиталях. Где же располагаются электроны в изолированных атомах, не связанных химическими связями? Полюбовавшись показанными картинками, отложим в сторону эмоции и внесем грустную ноту – истинные молекулярные орбитали в метане внешне довольно заметно отличаются от того, что изображено на большинстве картинок. О том, почему такое произошло, поговорим несколько позже.
Каковы они на самом деле?
Итак, электрон движется в атоме вокруг ядра не по фиксированной линии – орбите, а занимает некоторую область пространства. Ранее использовали термин «орбита», но постепенно пришли к мысли, что орбита (от лат. orbita – колея) – это линия в пространстве. Например, по земной орбите движется наша планета вокруг Солнца. Область нахождения электрона – не линия, а некая объемная часть пространства, поэтому стали применять термин «орбиталь». Своеобразие понятия «орбиталь» состоит в том, что эта часть пространства не имеет четких границ, она размыта. Например, электрон в атоме водорода (рис. 2а) может с определенной вероятностью оказаться либо весьма близко к ядру, либо на значительном удалении (точки, обозначающие случайное местонахождение электрона, в некоторой определенной области располагаются гуще).
Существует область пространства, где нахождение электрона наиболее вероятно. В целях наглядности орбиталь ограничивают поверхностью, очерчивающей область пространства, где вероятность появления электрона наибольшая, иначе говоря, где электронная плотность максимальна (рис. 2б). Итак, орбиталь следует воспринимать как некое объемное тело, внутри которого электрон находится с вероятностью 95%.
Рис. 2.
Случайное положение электрона
в районе атомного ядра (а)
и способ изображения той области,
где находится электрон (б)
У атома водорода орбиталь электрона имеет сферическую (шаровую) форму, следовательно, электронная плотность в направлении каждой оси трехмерных координат одинакова (рис. 3). Это так называемая s-орбиталь.
К настоящему моменту описано пять типов орбиталей: s, p, d, f и g. Названия первых трех сложились исторически, далее был выбран алфавитный принцип, таким образом, никакого скрытого смысла эти буквы не несут. Орбитали существуют независимо от того, находятся на них электроны (занятые орбитали) или отсутствуют (вакантные орбитали). Интересно, что атом каждого элемента, начиная с водорода и заканчивая последним полученным на сегодня элементом, имеет полный набор всех орбиталей на всех энергетических уровнях, а их заполнение электронами происходит по мере увеличения порядкового номера элемента, т.е. заряда ядра атома.
















 Все это, а также различные, более серьезные беседы, которые помогут развить фантазию, раскрепостить воображение, научат находить нестандартные решения задач, приведены в книге М.М. Левицкого «О химии серьезно и с улыбкой» (эту книгу можно заказать в издательстве «Академкнига» через агентство «Почта-Сервис»: 125413, г. Москва, а/я 5, тел. (495) 453-60-13, e-mail: agentstvops@list.ru). Из нее вы узнаете, что в химии можно с помощью цепочек рассуждений обнаружить неизвестные ранее соединения или предсказать структуры новых молекул.
Все это, а также различные, более серьезные беседы, которые помогут развить фантазию, раскрепостить воображение, научат находить нестандартные решения задач, приведены в книге М.М. Левицкого «О химии серьезно и с улыбкой» (эту книгу можно заказать в издательстве «Академкнига» через агентство «Почта-Сервис»: 125413, г. Москва, а/я 5, тел. (495) 453-60-13, e-mail: agentstvops@list.ru). Из нее вы узнаете, что в химии можно с помощью цепочек рассуждений обнаружить неизвестные ранее соединения или предсказать структуры новых молекул.