какая таутомерная форма глюкозы обладает данными свойствами
Таутомерия моносахаридов в растворах
Упоминавшееся уже явление мутаротации получило почти исчерпывающее объяснение. Установлено, что твердые кристаллические моносахариды представляют собой шестичленные циклические структуры — пиранозы. В зависимости от условий кристаллизации можно получить чистую α-пиранозу или чистую β-пиранозу. При растворении же любой из этих однородных форм в растворе постепенно устанавливается равновесие между различными стереоизомерами (α- и β-пиранозами, α- и β-фуранозами), причем величина удельного вращения изменяется от величины, свойственной раствору того или иного чистого изомера, вплоть до некоторой промежуточной.
Процесс мутаротации сильно ускоряется в присутствии щелочей.
Равновесный раствор обладает постоянным удельным вращением (при данных температурных условиях, составе растворителя и пр.).
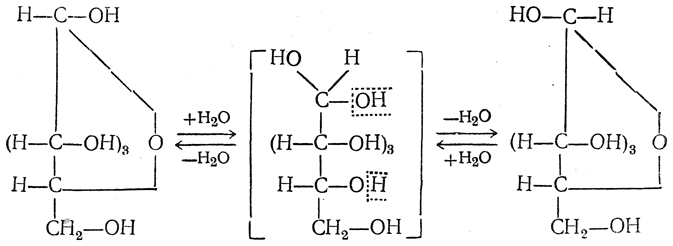
Объяснение возможности взаимного превращения α- и β-форм сначала искали в промежуточном образовании гидратной формы моносахарида:
Однако дальнейшее изучение явления мутаротации растворов самих моносахаридов и некоторых их производных в неводных растворителях привело к заключению, что промежуточной формой при мутаротации может являться не только гидратная форма, но также нециклическая форма со свободной альдегидной или кетонной группой, часто называемая оксо-формой.
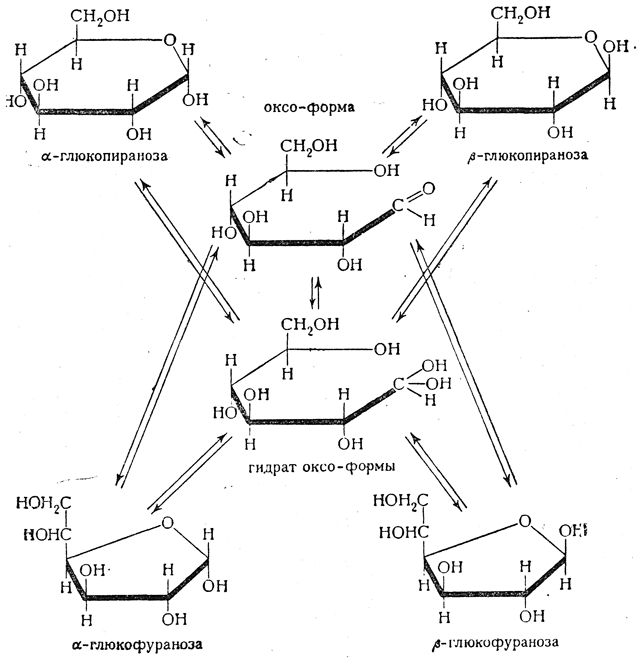
По-видимому, в зависимости от условий (в частности, температурных) промежуточной формой при взаимных превращениях α- и β-форм (как пираноз, так и фураноз) может быть оксо-форма или ее гидрат. Сложную систему динамического равновесия в водном растворе глюкозы следует, вероятно, представлять таким образом:
Отсутствие некоторых альдегидных реакций у моносахаридов объясняется тем, что оксо-формы содержатся в водных растворах лишь в ничтожных количествах, а преобладают циклические формы.
Позднее было выяснено, что альдегидную реакцию с фуксинсернистой кислотой, не идущую в обычных условиях, удается провести с реактивом, приготовленным особым способом (без избытка сернистой кислоты), причем оказалось возможным даже фотоколориметрически сравнивать содержание альдегидной формы в растворах различных моносахаридов.
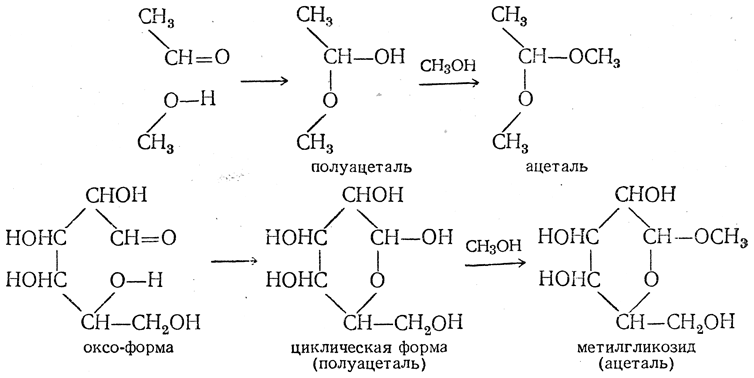
Свойства гликозидов, казавшиеся весьма своеобразными, также получили теперь естественное объяснение. Если циклические формы моносахаридов являются полуацеталями, то гликозиды являются циклическими ацеталями, что видно из следующего сопоставления:
Полуацетальный гидроксил, возникший из кислорода карбонильной группы (альдегидной или кетонной), должен, конечно, резко отличаться от прочих спиртовых гидроксилов, что и наблюдается в действительности. Этот гидроксил, отличающийся своей реакционной способностью, участвует в образовании гликозидов, почему его часто называют гликозидным гидроксилом.
Естественно, что гликозиды должны быть сходны с ацеталями: как и ацетали, они легко гидролизуются кислотами и обычно стойки по отношению к щелочам.
Оксо-формы моносахаридов не были получены в свободном состоянии Однако оказалось возможным получить некоторые их производные со свободной альдегидной группой (производные аль-формы), например:
Эти вещества обладают большой реакционной способностью, в частности дают в обычных условиях окрашивание с фуксинсернистой кислотой и образуют кристаллические бисульфитные соединения.
Многочисленные исследования растворов моносахаридов химическими и физическими методами приводят к заключению, что в растворах альдоз содержание оксо-форм ничтожно, т. е. альдозы в растворах мало дециклизованы. При этом содержание оксо-форм в растворах альдопентоз С5Н10О5 гораздо больше, чем в растворах альдогексоз C6H12O6. Глюкоза в растворах является, по-видимому, наименее дециклизованным моносахаридом из альдогексоз: содержание оксо-формы в ее растворе равно 0,024%. Содержание оксо-формы в растворе рибозы 8,5%. Кетозы дециклизованы в растворах в гораздо большей степени, чем альдозы.
Степень дециклизации, зависящая от стойкости циклических форм, обусловливается, по-видимому, всей конфигурацией данного моносахарида. В настоящее время известно несколько «факторов нестабильности». Эти вопросы будут рассмотрены в томе II при изложении данных о конформациях моносахаридов. Уже давно было обращено внимание на то, что in vitro (лат. — в стекле) сахара обладают значительной стойкостью, тогда как в организмах — in vivo (лат. — в живом) чрезвычайно быстро идут как процессы расщепления моносахаридов (брожение, окисление), так и синтетические процессы (например, образование крахмала, гликогена). Когда Э. Фишер получил γ-метилглюкозид и оказалось, что он гидролизуется разбавленными кислотами почти в 100 раз. быстрее, чем обычные α— и β-глюкозиды, возникла идея, что в организмах глюкоза при нормальных условиях переходит в особую «активную» форму. Такую неизвестную активную форму стали называть γ-сахаром, не связывая сначала с этим названием какого-либо представления о структуре. В дальнейшем, когда у γ-глюкозидов было доказано наличие пятичленного кольца, γ-сахарами стали называть фуранозы. Однако впоследствии оказалось, что наибольшей реакционной способностью обладают не фуранозы, а оксо-формы. Кроме того, было обнаружено, что при углеводном обмене в организмах простые сахара, прежде чем расщепиться, как правило, превращаются в фосфорнокислые эфиры.
По-видимому, «активирование» сахаров и заключается в их фосфорилировании, способствующем дециклизации молекул моносахарида (Б. Н. Степаненко).
2.2.3 Таутомерия моносахаридов в растворах
Различают два вида изомерии моносахаридов в растворах:
кольчато-цепную или оксо-окси-таутомерию.
Кето-енольная таутомерия моносахаридов. Происходит при действии щелочей и состоит в переходе карбонильной формы (альдегидной или кетонной) в енольную форму (точнее ендиольную) с двумя ОН-группами при атомах углерода, связанных двойной связью, т.е. в образовании ендиола общего для эпимерных моносахаридов. Благодаря кето-енольной таутомерии, эпимерные моносахариды могут превращаться друг в друга. Например, в щелочной среде фруктоза претерпевает таутомерное превращение в глюкозу, которая и реагирует с фелинговой жидкостью:
Кольчато-цепная (оксо-окси-) таутомерия моносахаридов. Заключается в существовании кольчатых (циклических) форм и цепной (т.е. с открытой углеродной цепью) формы моносахарида, находящихся в растворе в динамическом равновесии. Обычно циклические формы моносахаридов преобладают над открытой цепной формой.
2.2.4 Мутаротация
2.3 Способы получения моносахаридов
а. Основным способом получения моносахаридов, имеющим практическое значения, является гидролизди- и полисахароидов, который происходит под действием кислот или ферментов, водные растворы щелочей не способствуют гидролизу :
б. Синтетические способы получения моносахаридов
Альдольная конденсация формальдегида — первый синтез сахаров был произведен еще А. М. Бутлеровым, который в качестве катализатора альдольной конденсации использовал гидроксид кальция:
2.4 Физические свойства моносахаридов
Моносахариды являются твердыми кристаллическими веществами. Все они гигроскопичны, хорошо растворимы в воде, легко образуют сиропы. Растворимость моноз в спирте низкая, в эфире они практически нерастворимы. Растворы моносахаридов имеют нейтральную реакцию по лакмусу и обычно обладают сладким вкусом. Сладость разных моноз различна. Например, фруктоза приблизительно в три раза слаще глюкозы. Растворы моносахаридов обладают оптической активностью, для них характерно явление мутаротации.
Лекция № 17. Углеводы
Моносахариды – мономеры, из остатков
которых состоят углеводы более сложного строения.
Олигосахариды – олигомеры, содержащие от
2 до 10 моносахаридных остатков.
Полисахариды – полимеры, включающие до
нескольких тысяч моносахаридных звеньев.
1.1. Строение и
классификация
По химическому строению различают:
В зависимости от длины углеродной цепи моносахариды
делятся на триозы, тетрозы, пентозы, гексозы и т.д. Обычно моносахариды
классифицируют с учетом сразу двух этих признаков, например:
В природе встречаются производные моносахаридов,
содержащие аминогруппу (аминосахара), карбоксильную группу (сиаловые
кислоты, аскорбиновая кислота), а также атом Н вместо одной или нескольких
групп ОН (дезоксисахара ).
Все моносахариды (кроме дигидроксиацетона) содержат хиральные атомы углерода
и имеют стереоизомеры. Простейшая альдоза, глицериновый альдегид, содержит один хиральный атом С и существует в виде двух оптических изомеров
– D и L:
По мере увеличения длины цепи количество
стереоизомеров у альдогексоз растет. В соответствии с числом хиральных центров
существует 4 стереоизомерных альдотетрозы, 8 альдопентоз, 16 альдогексоз и т.д.
В зависимости от конфигурации наиболее удаленного от карбонильной группы
хирального атома С все моносахариды делят на два стереохимических ряда –
D-моносахариды и L-моносахариды:
Подавляющее большинство природных моносахаридов
принадлежит к D-ряду.
Родоначальником ряда D-альдоз является
D-глицериновый альдегид. Остальные D-альдозы могут быть построены на основе
D-глицеральдегида путем последовательной вставки фрагмента СНОН сразу после
карбонильной группы. Стереоизомерные альдозы имеют тривиальные названия.
Эпимеры – это диастереомеры, которые
отличаются по конфигурации только одного хирального центра.
Например, D-рибоза и D-арабиноза являются эпимерами, так как отличаются
конфигурацией только хирального атома углерода в положении 2. D-глюкоза имеет
несколько эпимеров: D- маннозу по С-2, D-аллозу по С-3, D-галактозу по С-4,
L-иодозу по С-5.
Каждая из D-альдоз имеет энантиомер, относящийся к L-ряду, который может быть
построен аналогично D-ряду на основе L-глицеральдегида. Энантиомером D-глюкозы
является L-глюкоза, D-маннозы – L-манноза и т.д.
Ряд D-кетоз может быть построен на основе
простейшей кетозы – дигидроксиацетона. Названия кетоз образуются из названий
соответствующих альдоз путем введения суффикса “ул”. Для некоторых кетоз
утвердились тривиальные названия.
Дигидроксиацетон не содержит хирального атома С
и не имеет стереоизомеров. Остальные кетозы являются хиральными
соединениями.
В природе широко распространены гексозы
(D-глюкоза, D-галактоза, D-манноза, D-фруктоза) и пентозы (D-рибоза, D-ксилоза,
D-арабиноза). Среди производных моносахаридов наиболее распространенными
являются аминосахара D-глюкозамин и D-галактозамин и дезоксисахар
2-дезокси-D-рибоза.
Известно, что альдегиды способны присоединять спирты с образованием
полуацеталей:
Карбонильная и гидроксильная группы
моносахаридов взаимодействуют внутримолекулярно с образованием циклического
полуацеталя:
При этом возникает новый хиральный центр –
бывший карбонильный, а теперь аномерный атом углерода. Наиболее устойчивы
циклические полуацетали, содержащие шестичленный (пиранозный) или
пятичленный (фуранозный) циклы. Они образуются при взаимодействии
альдегидной группы с гидроксильной группой в положении 5 или 4 моносахарида
соответственно. На рисунке представлена схема образования циклических форм
D-глюкозы:
Аномеры – это эпимеры, которые различаются по
конфигурации аномерного атома углерода.
Циклические формы моносахаридов изображают с
помощью формул Хеуорса. Молекулу представляют в виде плоского цикла,
перпендикулярного плоскости рисунка. Заместители, находившиеся в формуле Фишера
слева, располагают над плоскостью цикла, справа – под плоскостью. Для
определения положения группы СН 2 ОН в формуле Фишера предварительно делают две
перестановки.
Растворение кристаллического моносахарида
сопровождается постепенным таутомерным превращением, которое заканчивается
установлением таутомерного равновесия. Каждая таутомерная форма оптически
активна и имеет свою величину удельного вращения. Поэтому за таутомерным
превращением можно следить по изменению удельного вращения раствора, которое
заканчивается с установлением равновесия. Явление изменения удельного вращения
свежеприготовленного раствора моносахарида называют мутаротацией. Явление
мутаротации – одно из доказательств существования цикло-оксо-таутомерии у
моносахаридов.
Заместители у каждого атома цикла могут
находиться в аксиальном (а) или экваториальном (е) положениях. Аксиальные связи расположены параллельно оси симметрии цикла и направлены
попеременно вверх и вниз. Экваториальные связи ориентированы под углом
109 0 к оси симметрии цикла также
попеременно вверх и вниз. При инверсии цикла экваториальные связи становятся
аксиальными и наоборот.
При введении в циклогексан заместителей две
конформации кресла становятся энергетически неравноценными. Меньшей энергией,
как правило, обладает та конформация, в которой объемистые заместители занимают
экваториальное положение. Например, для циклогексанола наиболее выгодной
является конформация с экваториальным положением ОН группы:
Основой строения пиранозных форм моносахаридов
является тетрагидропиран, для которого возможны две энергетически
неравноценные конформации кресла.
Химические свойства моносахаридов определяются
наличием карбонильной группы (в ациклической форме), полуацетального гидроксила
(в циклических формах) и спиртовых ОН групп.
Восстановление альдоз приводит к “уравниванию”
функциональных групп на концах цепи. В результате из некоторых альдоз (эритрозы,
рибозы, ксилозы, аллозы, галактозы) образуются оптически неактивные
мезо-соединения, например:
Разные альдозы при восстановлении могут дать
один и тот же спирт.
Такая конфигурационная взаимосвязь между
глицитами использовалась для установления стереохимической конфигурации
моносахаридов.
При восстановлении кетоз из карбонильной группы
возникает новый хиральный центр и образуется смесь неравных количеств
диастереомерных спиртов (эпимеров по С-2).
Эта реакция доказывает, что D-фруктоза,
D-глюкоза и D-манноза имеют одинаковые конфигурации хиральных центров С-2, С-3,
и С-4.
Вследствие своей полифункциональности альдозы
окисляются по-разному при действии различных окислителей. При этом может быть
окислена карбонильная группа, оба конца углеродной цепи или расщеплена связь
С-С.
Получение гликоновых кислот
При мягком окислении альдоз, например, под
действием бромной воды, затрагивается только карбонильная группа и образуются гликоновые кислоты, которые очень легко образуют пяти- и шестичленные
лактоны.
Кетозы в этих условиях не окисляются и могут
быть таким образом выделены из смесей с альдозами..
Альдозы и кетозы дают реакции, характерные
только для соединений, содержащих альдегидную группу: они восстанавливают в
щелочной среде катионы металлов Ag + (Ag(NH3)2OH – реактив
Толенса ) и Cu 2+ (комплекс
Cu 2+ с тартрат-ионом – реактив
Фелинга). При этом гликоновые кислоты образуются в незначительном
количестве, так как в щелочной среде протекает деградация углеродного скелета
моносахаридов.
Альдоза +
Ag(NH3)2 + —-> гликоновая кислота + Ag
+ продукты деструктивного окисления
Альдоза +
Cu 2+ —-> гликоновая кислота +
Cu2O + продукты деструктивного окисления
Сахара, способные восстанавливать реактивы
Толенса и Фелинга, называют восстанавливающими. Кетозы проявляют
восстанавливающие свойства за счет изомеризации в щелочной среде в альдозы,
которые и взаимодействуют далее с окислителем. Процесс превращения кетозы в
альдозу происходит в результате енолизации. Образующийся из кетозы енол является
общим для нее и 2-х альдоз (эпимеров по С-2). Так, в слабощелочном растворе в
равновесии с D-фруктозой находятся ендиол, D-глюкоза и D-манноза.
Взаимопревращения в щелочном растворе между
альдозами, эпимерами по С-2, называют эпимеризацией.
Получение гликаровых кислот
При образовании гликаровых кислот, как и в
случае глицитов, происходит “уравнивание” функциональных групп на концах цепи и
из некоторых альдоз образуются мезо-соединения.
Окисление кетоз азотной кислотой протекает с
расщеплением С-С связей.
В лабораторных условиях они могут быть получены
только многостадийным синтезом, так как окисление спиртовой группы в присутствии
альдегидной требует предварительной защиты последней. Гликуроновые кислоты
входят в состав полисахаридов (пектиновые вещества, гепарин). Важная
биологическая роль D-глюкуроновой кислоты состоит в том, что многие токсичные
вещества выводятся из организма с мочой в виде растворимых глюкуронидов.
Циклические формы моносахаридов содержат несколько групп ОН, одна из которых
– гликозидный (полуацетальный) гидроксил, отличается повышенной
склонностью к реакциям нуклеофильного замещения.
Известно, что в присутствии кислотных катализаторов полуацетали реагируют со
спиртами. При этом происходит нуклеофильное замещение полуацетального гидроксила
и образуются полные ацетали.
Аналогично реагирует гликозидный гидроксил в
альдозах и кетозах. Спиртовые ОН группы при этом не затрагиваются. Продукты
замещения гликозидного гидроксила называют гликозидами ( гликопиранозидами или гликофуранозидами в
зависимости от размера цикла). Например, при пропускании через раствор D-глюкозы
в метаноле газообразного HCl образуется смесь метилглюкозидов, соответствующих
разным таутомерным формам D-глюкозы (двум пиранозным и двум фуранозным). В
условиях термодинамического контроля в реакционной смеси преобладают более
стабильные метилпиранозиды.
Как полные ацетали гликозиды гидролизуются в
условиях кислотного катализа и устойчивы в разбавленных растворах щелочей.
Механизм кислотного гидролиза включает протонирование гликозидного кислорода,
расщепление гликозидной С-О связи с образованием гликозил-катиона, который затем
атакуется молекулой воды.
Молекулу гликозида рассматривают как состоящую
из двух частей – сахарной части и агликона :
В качестве агликона в природных гликозидах могут
выступать спирты, фенолы, стероиды, сами моносахариды. Перечисленные агликоны
связаны с сахарной частью через атом кислорода, поэтому такие гликозиды называют О-гликозидами. В природе широко распространены N-гликозиды, в
которых агликонами являются азотистые основания. К ним относятся нуклеозиды – структурные единицы нуклеиновых кислот.
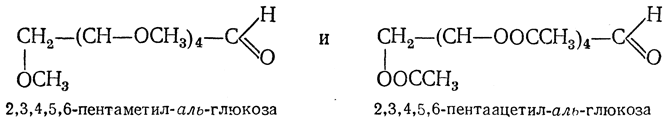
Получение простых эфиров
Метиловые эфиры по спиртовым группам ОН получают
действием на моносахариды диметилсульфата в водном растворе щелочи или
метилиодида в присутствии оксида серебра. Эти методы являются модификациями
синтеза Вильямсона. При этом в реакцию вступает и гликозидный гидроксил. Простые
эфиры по спиртовым группа устойчивы к гидролизу, в то время как гликозидная
связь легко расщепляется в кислой среде.
Приведенная последовательность реакций
(метилирование, затем гидролиз) используется для определения размера цикла в
моносахаридах. Неметилированной остается группа ОН, которая участвовала в
образовании циклического полуацеталя.
Получение сложных эфиров
Гидроксильные группы моносахаридов легко
этерифицируются действием ангидриридов и хлорангидридов карбоновых кислот. Чаще
всего используют ацетилирование уксусным ангидридом в присутствии кислотного
(H 2SO4, ZnCl2 ) или основного (пиридин, СH 3 COONa) катализатора.
Для удаления ацетильных групп используют
переэтерификацию действием метилата натрия в метаноле.
Получение производных по карбонильной
группе. Образование озазонов
Моносахариды вступают во многие реакции нуклеофильного присоединения по
карбонильной группе, характерные для альдегидов и кетонов: присоединяют HCN,
NH2 OH, фенилгидразин. При действии
избытка фенилгидразина образуются озазоны.
Эпимеры по С-2, например, D-глюкоза и D-манноза,
дают один и тот же озазон, что используется для установления стереохимической
конфигурации моносахаридов. Кетозы также образуют озазоны. D-фруктоза дает такой
же озазон, что и D-глюкоза.
Озазоны – желтые кристаллические вещества,
используются для идентификации сахаров.
Дисахариды состоят из двух моносахаридных остатков, связанных гликозидной
связью. Их можно рассматривать как О-гликозиды, в которых агликоном является
остаток моносахарида.
Возможно два варианта образования гликозидной связи:
1) за счет гликозидного гидроксила одного моносахарида и спиртового
гидроксила другого моносахарида;
2) за счет гликозидных гидроксилов обоих моносахаридов.
Дисахарид, образованный первым способом, содержит свободный гликозидный
гидроксил, сохраняет способность к цикло-оксо-таутомерии и обладает восстанавливающими свойствами.
Различие между мальтозой и целлобиозой состоит в
конфигурации гликозидной связи, что отражается на их конформационном строении.
Гликозидная связь в мальтозе имеет аксиальное, в целлобиозе – экваториальное
положение. Конформационное строение этих дисахаридов служит первопричиной
линейного строения макромолекул целлюлозы и спиралеобразного строения амилозы
(крахмал), структурными элементами которых они являются.
Сахароза содержится в
сахарном тростнике, сахарной свекле, соках растений и плодах. Она состоит из
остатков D-глюкозы и D-фруктозы, которые связаны за счет гликозидных
гидроксилов. В составе сахарозы D-глюкоза находится в пиранозной, а D-фруктоза –
в фуранозной форме. Сахароза – невосстанавливающий дисахарид.
Последовательность реакций – окисление,
метилирование, гидролиз, позволяет установить строение дисахарида.
Окисление дает возможность определить, остаток
какого моносахарида находится на восстанавливающем конце. Метилирование и
гидролиз дают информацию о положении гликозидной связи и размерах цикла
моносахаридных звеньев. Конфигурация гликозидной связи ( a или b ) может быть определена с
помощью ферментативного гидролиза.
Крахмал – полисахарид
растительного происхождения. Его основная биологическая функция – запасное
вещество растений. Крахмал представляет собой смесь двух полисахаридов – амилозы (10-20%) и амилопектина (80-90%)
Цепь амилозы включает от 200 до 1000
моносахаридных единиц. Вследствие аксиального положения гликозидной связи
макромолекула амилозы свернута в спираль.
Крахмал набухает и растворяется в воде, образуя
вязкие растворы (гели). Химические свойства крахмала аналогичны свойствам моно-
и дисахаридов. Крахмал гидролизуется под действием кислот (но не щелочей) и
фермента амилазы. Конечным продуктом гидролиза крахмала является
D-глюкоза.
| крахмал | декстрины | мальтоза | D-глюкоза |
За счет спиралеобразной конформации амилоза
способна образовывать соединения включения с молекулярным иодом. Комплексы
крахмала с иодом имеют интенсивную синюю окраску. Реакция используется как
качественная на иод и крахмал.
Макромолекулы целлюлозы образуют волокна. В
отличие от крахмала целлюлоза в воде не набухает и не растворяется. Для перевода
целлюлозы в растворимую форму необходима её химическая модификация.
Среди других гомополисахаридов стоит отметить
следующие.