какой фермент в цитоплазме клетки фосфорилирует гликогенфосфорилазу и переводит ее в активную форму
| Поиск | |
|---|---|
| ЧВК | статьи |
| PubMed | статьи |
| NCBI | белки |
СОДЕРЖАНИЕ
Механизм
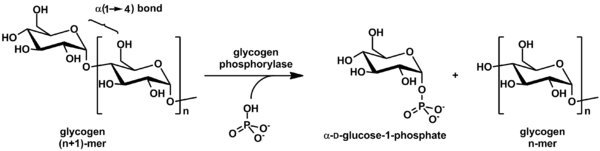
Гликогенфосфорилаза расщепляет гликоген на субъединицы глюкозы (см. Также рисунок ниже):
(α-1,4-гликогеновая цепь) n + Pi ⇌ (α-1,4-гликогенная цепь) n-1 + α-D-глюкозо-1-фосфат.
Существует также альтернативный предложенный механизм с участием положительно заряженного кислорода в конформации полукресла.
Состав
Мономер гликогенфосфорилазы представляет собой большой белок, состоящий из 842 аминокислот с массой 97,434 кДа в мышечных клетках. Хотя фермент может существовать в виде неактивного мономера или тетрамера, он биологически активен как димер из двух идентичных субъединиц.
У млекопитающих основные изоферменты гликогенфосфорилазы находятся в мышцах, печени и головном мозге. Тип мозга преобладает во взрослом мозге и эмбриональных тканях, тогда как печень и мышечный тип преобладают в печени и скелетных мышцах взрослых, соответственно.
Димер гликогенфосфорилазы имеет много областей биологического значения, включая каталитические сайты, сайты связывания гликогена, аллостерические сайты и обратимо фосфорилированный остаток серина. Во-первых, каталитические центры относительно скрыты, на расстоянии 15 Å от поверхности белка и от границы раздела субъединиц. Это отсутствие легкого доступа каталитического сайта к поверхности является значительным, поскольку оно делает активность белка очень чувствительной к регуляции, поскольку небольшие аллостерические эффекты могут значительно увеличить относительный доступ гликогена к сайту.
Возможно, наиболее важным регуляторным сайтом является Ser14, сайт обратимого фосфорилирования, очень близко расположенный к границе раздела субъединиц. Структурное изменение, связанное с фосфорилированием и с превращением фосфорилазы b в фосфорилазу a, представляет собой расположение первоначально неупорядоченных остатков с 10 по 22 в α-спирали. Это изменение увеличивает активность фосфорилазы до 25% даже в отсутствие AMP и дополнительно усиливает активацию AMP.
Аллостерический сайт связывания AMP на мышечных изоформах гликогенфосфорилазы находится близко к границе раздела субъединиц, как и Ser14. Связывание AMP на этом сайте, соответствующее изменению из состояния T фермента в состояние R, приводит к небольшим изменениям третичной структуры на границе раздела субъединиц, что приводит к большим изменениям в четвертичной структуре. Связывание AMP поворачивает башни-спирали (остатки 262-278) двух субъединиц на 50 ° относительно друг друга за счет большей организации и межсубъединичных взаимодействий. Это вращение башенных спиралей приводит к повороту двух субъединиц на 10 ° относительно друг друга и, что более важно, нарушает остатки 282-286 (петля 280s), которые блокируют доступ к каталитическому сайту в Т-состоянии, но не в состояние R.
Клиническое значение
| фосфорилаза, гликоген; мышца (синдром Макардла, болезнь накопления гликогена V типа) | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Условное обозначение | PYGM | ||||||
| Ген NCBI | 5837 | ||||||
| HGNC | 9726 | ||||||
| OMIM | 608455 | ||||||
| RefSeq | NM_005609 | ||||||
| UniProt | P11217 | ||||||
| Прочие данные | |||||||
| Номер ЕС | 2.4.1.1 | ||||||
| Locus | Chr. 11 кв. 12 -кв. 13,2 | ||||||
| |||||||
| фосфорилаза, гликоген; печень (болезнь Херса, болезнь накопления гликогена VI типа) | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Условное обозначение | PYGL | ||||||
| Ген NCBI | 5836 | ||||||
| HGNC | 9725 | ||||||
| OMIM | 232700 | ||||||
| RefSeq | NM_002863 | ||||||
| UniProt | P06737 | ||||||
| Прочие данные | |||||||
| Номер ЕС | 2.4.1.1 | ||||||
| Locus | Chr. 14 q11.2-24.3 | ||||||
| |||||||
| фосфорилаза, гликоген; головной мозг | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Условное обозначение | PYGB | ||||||
| Ген NCBI | 5834 | ||||||
| HGNC | 9723 | ||||||
| OMIM | 138550 | ||||||
| RefSeq | NM_002862 | ||||||
| UniProt | P11216 | ||||||
| Прочие данные | |||||||
| Номер ЕС | 2.4.1.1 | ||||||
| Locus | Chr. 20 п.11.2-п11.1 | ||||||
| |||||||
Мутации в мышечной изоформе гликогенфосфорилазы (PYGM) связаны с болезнью накопления гликогена типа V (GSD V, болезнь Макардла). На сегодняшний день идентифицировано более 65 мутаций в гене PYGM, которые приводят к болезни Макардла. Симптомы болезни Макардла включают мышечную слабость, миалгию и недостаток выносливости, все из-за низкого уровня глюкозы в мышечной ткани.
Регулирование
В печени глюкагон также активирует другой GPCR, который запускает другой каскад, что приводит к активации фосфолипазы C (PLC). PLC косвенно вызывает высвобождение кальция из эндоплазматической сети гепатоцитов в цитозоль. Повышенная доступность кальция связывается с субъединицей кальмодулина и активирует киназу гликогенфосфорилазы. Киназа гликогенфосфорилазы активирует гликогенфосфорилазу таким же образом, как упоминалось ранее.
Гликогенфосфорилаза b не всегда неактивна в мышцах, так как она может аллостерически активироваться AMP. Повышение концентрации АМФ во время физических упражнений сигнализирует о потребности в энергии. АМФ активирует гликогенфосфорилазу b, изменяя ее конформацию с напряженной на расслабленную. Эта расслабленная форма имеет такие же ферментативные свойства, что и фосфорилированный фермент. Увеличение концентрации АТФ препятствует этой активации, вытесняя АМФ из сайта связывания нуклеотидов, что указывает на наличие достаточных запасов энергии.
Историческое значение
Регуляция активности гликогенфосфорилазы и глигогенсинтазы
Действие этих гормонов в конечном счете сводится к изменению скорости реакций, катализируемых ключевыми ферментами метаболических путей обмена гликогена – гликогенсинтазой и гликогенфосфорилазой, активность которых регулируется аллостерически и фосфорилированием/ десфорилированием.
Гликогенфосфорилаза существует в 2 формах:
Взаимопревращения 2 форм гликогенфосфорилазы обеспечиваются действием ферментов киназы фосфорилазы и фосфопротеинфосфатазы (фермент, структурно связанный с молекулами гликогена). В свою очередь, активность киназы фосфорилазы и фосфопротеинфосфатазы также регулируется путём фосфорилирования и дефосфорилирования.
Активация фосфопротеинфосфатазы происходит в результате реакции фосфорилирования, катализируемой специфической протеинкиназой, которая, в свою очередь, активируется инсулином посредством каскада реакций с участием других белков и ферментов. Активируемая инсулином протеинкиназа фосфорилирует и тем самым активирует фосфопротеинфосфатазу. Активная фосфопротеинфосфатаза дефосфорилирует и, следовательно, инактивирует киназу фосфорилазы и гликогенфосфорилазу.
Активность гликогенсинтазы также изменяется в результате фосфорилирования и дефосфорилирования. Однако есть существенные различия в регуляции гликогенфосфорилазы и гликогенсинтазы:
фосфорилирование гликогенсинтазы катализирует ПК А и вызывает её инактивацию;
дефосфорилирование гликогенсинтазы под действием фосфопротеинфосфатазы, наоборот, её активирует.
Регуляция метаболизма гликогена в печени
Таким образом, в печени ускоряется синтез гликогена и тормозится его распад.
При голодании снижение уровня глюкозы в крови является сигналом для синтеза и секреции α-клетками поджелудочной железы глюкагона. Гормон передает сигнал в клетки через аденилатциклазную систему. Это приводит к активации проттеинкиназы А, которая фосфорилирует гликогенсинтазу и киназу фосфорилазы. В результате фосфорилирования гликогенсинтаза инактивируется и синтез гликогена тормозится, а киназа фосфорилазы становится активной и фосфорилирует гликогенфосфорилазу, которая становится активной. Активная гликогенфосфорилаза ускоряет мобилизацию гликогена в печени.
При интенсивной физическеой работе и стрессе в крови повышается концентрация адреналина. В печени есть два типа мембранных рецепторов адреналина. Эффект адреналина в печени обусловлен фосфорилированием и активацией гликогенфосфорилазы. Адреналин имеет сходный с глюкагоном механизм действия. Но возможно включение и другой эффекторной системы передачи сигнала в клетку печени.
Регуляция синтеза и распада гликогена в печени адреналином и Са 2+ .
В период пищеварения преобладает влияние инсулина, так как инсулин-глюкагоновый индекс в этом случае повышается. В целом инсулин влияет на обмен гликогена противоположно глюкагону. Инсулин снижает концентрацию глюкозы в крови в период пищеварения, действуя на метаболизм печени следующим образом:
активирует фосфопротеинфосфатазу гранул гликогена, которая дефосфорилирует гликогенсинтазу и таким образом её активирует. Кроме того, фосфопротеинфосфатаза дефосфорилирует и, следовательно, инактивирует киназу фосфорилазы и гликогенфосфорилазу;
индуцирует синтез глюкокиназы, тем самым ускоряя фосфорилирование глюкозы в клетке.
Гликогенфосфорилаза
| Поиск | |
|---|---|
| ЧВК | статьи |
| PubMed | статьи |
| NCBI | белки |
Содержание
Механизм [ править ]
Гликогенфосфорилаза расщепляет гликоген на субъединицы глюкозы (см. Также рисунок ниже):
(α-1,4-гликогеновая цепь) n + Pi ⇌ (α-1,4-гликогенная цепь) n-1 + α-D-глюкозо-1-фосфат. [2]
Существует также альтернативный предложенный механизм с участием положительно заряженного кислорода в конформации полукресла. [3]
Структура [ править ]
Мономер гликогенфосфорилазы представляет собой большой белок, состоящий из 842 аминокислот с массой 97,434 кДа в мышечных клетках. Хотя фермент может существовать как неактивный мономер или тетрамер, он биологически активен как димер из двух идентичных субъединиц. [4]
У млекопитающих основные изоферменты гликогенфосфорилазы находятся в мышцах, печени и головном мозге. Тип мозга преобладает во взрослом мозге и эмбриональных тканях, тогда как печень и мышечный тип преобладают в печени и скелетных мышцах взрослых, соответственно. [5]
Димер гликогенфосфорилазы имеет много областей биологического значения, включая каталитические сайты, сайты связывания гликогена, аллостерические сайты и обратимо фосфорилированный остаток серина. Во-первых, каталитические центры относительно скрыты, на расстоянии 15 Å от поверхности белка и от границы раздела субъединиц. [6] Отсутствие легкого доступа каталитического сайта к поверхности имеет большое значение, поскольку оно делает активность белка очень чувствительной к регулированию, поскольку небольшие аллостерические эффекты могут значительно увеличить относительный доступ гликогена к сайту.
Возможно, наиболее важным регуляторным сайтом является Ser14, сайт обратимого фосфорилирования, очень близко расположенный к границе раздела субъединиц. Структурное изменение, связанное с фосфорилированием и превращением фосфорилазы b в фосфорилазу a, представляет собой расположение первоначально неупорядоченных остатков с 10 по 22 в α-спирали. Это изменение увеличивает активность фосфорилазы до 25% даже в отсутствие AMP и дополнительно усиливает активацию AMP. [7]
Аллостерический сайт связывания AMP на мышечных изоформах гликогенфосфорилазы находится близко к границе раздела субъединиц, как и Ser14. Связывание AMP на этом сайте, соответствующее изменению из состояния T фермента в состояние R, приводит к небольшим изменениям в третичной структуре на границе раздела субъединиц, что приводит к большим изменениям в четвертичной структуре. [8] Связывание АМФ поворачивает башни-спирали (остатки 262-278) двух субъединиц на 50 ° относительно друг друга за счет большей организации и межсубъединичных взаимодействий. Это вращение башенных спиралей приводит к повороту двух субъединиц на 10 ° относительно друг друга и, что более важно, нарушает остатки 282-286 (петля 280s), которые блокируют доступ к каталитическому сайту в Т-состоянии, но не в состояние R. [6]
Клиническое значение [ править ]
| фосфорилаза, гликоген; мышцы (синдром Макардла, болезнь накопления гликогена V типа) | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Символ | PYGM | ||||||
| Ген NCBI | 5837 | ||||||
| HGNC | 9726 | ||||||
| OMIM | 608455 | ||||||
| RefSeq | NM_005609 | ||||||
| UniProt | P11217 | ||||||
| Прочие данные | |||||||
| Номер ЕС | 2.4.1.1 | ||||||
| Locus | Chr. 11 кв. 12 -кв. 13,2 | ||||||
| |||||||
| фосфорилаза, гликоген; печень (болезнь Херса, болезнь накопления гликогена VI типа) | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Символ | PYGL | ||||||
| Ген NCBI | 5836 | ||||||
| HGNC | 9725 | ||||||
| OMIM | 232700 | ||||||
| RefSeq | NM_002863 | ||||||
| UniProt | P06737 | ||||||
| Прочие данные | |||||||
| Номер ЕС | 2.4.1.1 | ||||||
| Locus | Chr. 14 q11.2-24.3 | ||||||
| |||||||
| фосфорилаза, гликоген; мозг | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Символ | PYGB | ||||||
| Ген NCBI | 5834 | ||||||
| HGNC | 9723 | ||||||
| OMIM | 138550 | ||||||
| RefSeq | NM_002862 | ||||||
| UniProt | P11216 | ||||||
| Прочие данные | |||||||
| Номер ЕС | 2.4.1.1 | ||||||
| Locus | Chr. 20 п.11.2-п11.1 | ||||||
| |||||||
Мутации в мышечной изоформе гликогенфосфорилазы (PYGM) связаны с болезнью накопления гликогена V типа (GSD V, болезнь МакАрдла). На сегодняшний день идентифицировано более 65 мутаций в гене PYGM, которые приводят к болезни Макардла. [15] [16] Симптомы болезни Макардла включают мышечную слабость, миалгию и недостаток выносливости, все из-за низкого уровня глюкозы в мышечной ткани. [17]
Регламент [ править ]
В печени глюкагон также активирует другой GPCR, который запускает другой каскад, что приводит к активации фосфолипазы C (PLC). PLC косвенно вызывает высвобождение кальция из эндоплазматического ретикулума гепатоцитов в цитозоль. Повышенная доступность кальция связывается с субъединицей кальмодулина и активирует киназу гликогенфосфорилазы. Киназа гликогенфосфорилазы активирует гликогенфосфорилазу таким же образом, как упоминалось ранее.
Гликогенфосфорилаза b не всегда неактивна в мышцах, поскольку она может аллостерически активироваться AMP. Повышение концентрации АМФ во время физических упражнений сигнализирует о потребности в энергии. АМФ активирует гликогенфосфорилазу b, изменяя ее конформацию с напряженной на расслабленную. Эта расслабленная форма имеет такие же ферментативные свойства, что и фосфорилированный фермент. Повышение концентрации АТФ препятствует этой активации, вытесняя АМФ из сайта связывания нуклеотидов, что указывает на наличие достаточных запасов энергии.