кардиальные механизмы компенсации сердечной деятельности
4. Срочные и долговременные интракардиальные механизмы компенсации сердечной деятельности. Гипертрофия миокарда, особенности гипертрофированного сердца, механизмы декомпенсации.
Интракардиальные механизмы компенсации сердечной деятельности:
Условно выделяют 4 (четыре) кардиальных механизма сердечной деятельности при СН.
1. Гетерометрический механизм компенсации Франка-Старлинга:
Если степень растяжения мышечных волокон превышает допустимые границы, то сила сокращения снижается.
При допустимых перегрузках линейные размеры сердца увеличиваются не более, чем на 15-20%. Такое расширение полостей называется тоногенной дилатацией и сопровождается увеличением УО.
Дистрофические изменения в миокарде ведут к расширению полостей без увеличения УО. Это – миогенная дилатация (признак декомпенсации).
2. Изометрический механизм компенсации: При перегрузке давлением- Увеличение времени взаимодействия актина и миозина- Увеличение давления и напряжения мышечного волокна в конце диастолы
Гетерометрический механизм энергетически более выгоден, чем изометрический. Поэтому клапанная недостаточность протекает более благоприятно, чем стеноз.
3. Тахикардия: возникает в ситуациях:
= Увеличение давления в полых венах.
= Увеличение давления в правом предсердии и растяжение его.
= Изменение нервных влияний.
= Изменение гуморальных экстракардиальных влияний.
Тахикардия – энергетически невыгодный механизм компенсации. Причины: = Повышение потребности миокарда в кислороде.
= Укорочение диастолы → уменьшение периода отдыха миокарда.
= Укорочение диастолы → желудочек не успевает заполниться кровью.
= Неполное заполнение кровью желудочков делает невозможным реализацию гетерометрического механизма компенсации.
= Менее полноценная систолы.
4. Усиление симпатоадреналовых влияний на миокард: включается при снижении УО и значительно усиливает силу сокращений миокарда
Гипертрофия – это увеличение объема и массы миокарда. Возникает при реализации кардиальных механизмов компенсации. Кардиальные механизмы компенсации увеличивают интенсивность работы миокарда на фоне повышенного синтеза белков и нуклеиновых кислот. Поэтому объем и масса миокарда увеличивается.
Биологическая значимость и особенности компенсированной гипертрофии:
При повышенной нагрузке орган выполняет необходимую работу за счет возросшей массы.
Гипертрофированный миокард имеет морфофункциональные особенности, в которых заложены возможности и предпосылки для дальнейшей декомпенсации:
= Рост нервных волокон отстает от скорости увеличения массы кардиомиоцитов → в условиях повышенной нагрузки возможен дефицит нервных влияний на миокард.
= Рост артерий и капилляров отстает от роста кардиомиоцитов.
= Уменьшение клеточной поверхности на единицу массы клетки → ионный дисбаланс.
= Рост митохондрий отстает от роста кардиомиоцитов → дефицит энергии.
= нарушение кардиомиоцитарных пластических процессов вследствие вышеперечисленных причин.
Аварийная стадия – сразу после повышения нагрузки. Характерено:
Повышенный синтез белков и утолщение мышечных волокон.
Мобилизация гликогена и исчезновение его глыбок из цитоплазмы кардиомиоцитов.
Уменьшение содержания креатинфосфата.
Дисбаланс ионов (K ↓, Na ↑).
Стадия завершившейся гипертрофии – масса и объем миокарда увеличены. Миокард полностью справляется с обычной и повышенной нагрузкой. Потребление О2 и образование энергии сбалансировано. Нарушения гемодинамики нормализованы.
Но если повышенная нагрузка на сердце действует длительное время или появилось дополнительное повреждение миокарда, то гипертрофия переходит в 3-ю стадию.
Стадия постепенного истощения и прогрессирующего кардиосклероза.
а) рост н/волокон отстаёт от скорости увеличения массы кардиомиоцитов
б) рост артерий и капилляров отстаёт от роста кардиомиоцитов
в) уменьшение клеточной поверхности на единицу массы клетки и ионный дисбаланс
г) рост митохондрий отстаёт от роста кардиомиоцитов дефицит Е
д) нарушение кардиомиоцитарных пластических процессов вследствие вышеперечисленных причин.
Механизм декомпенсации гипертрофированного миокарда:
Дистрофия миокарда и уменьшение силы сокращений-Миогенная дилатация-Переполнение вен кровью и увеличение остаточного систолического объёма-Рост давления в правом предсердии и устьях полых вен-Действие на синаптический узел-Тахикардия (рефлекс Бейн – Бриджа)-Тахикардия+ миогенная дилатация-Декомпенсация гипертрофированного миокарда
Экстракардиальные механизмы компенсации при СН и НК:
а) рефлекс Китаева – при недостаточности левого соr запускается: при увеличении давления в лёгочных венах при застое крови в м/кр.
Рост давления в м/к-Спазм артериол м/кр-Уменьшение притока крови к левому сердцу-Уменьшение нагрузки
Увеличение давления в устьях полых вен
Увеличение ЧСС увеличение ЧД расширение периф. артериол б/круга
Механизмы компенсации сердечной недостаточности
Интракардиальные (миокардиальные): срочные и долговременные.
Экстракардиальные.
в ответ на кратковременную перегрузку объемом – гетерометрический механизм компенсации (закон Франка-Старлинга). Повышение сократимости миокарда при его растяжении притекающей кровью.
в ответ на кратковременную перегрузку давлением – гомеометрический механизм компенсации (феномен Анрепа). Происходит при неизменной длине миоцитов. Такой механизм называют гомеометрическим, поскольку он реализуется без значительного изменения длины мышечных волокон, за счет увеличения изометрического напряжения. Энергетически более затратный, чем гетерометрический механизм компенсации.
тахикардия является результатом рефлекторной реакции, возникающей при повышении давления в устьях полых вен и в правом предсердии (рефлекс Бейнбриджа).
Повышение сократимости сердца в результате активации симпатико-адреналовых влияний (положительный инотропный эффект). Характеризуется увеличением частоты и силы сокращений. Несмотря на то, что тахикардия поддерживает до известных пределов минутный объем сердца, она содержит в себе и слабую сторону. Так, при тахикардии уменьшается продолжительность общей диастолы сердца и диастолы желудочков, что отражается на восстановлении энергетических резервов сердца.
Долговременные механизмы компенсации СН
Ремоделирование миокарда – это структурно-геометрические изменения и прогрессирующее нарушение функции миокарда в ответ на длительную повреждающую перегрузку или потерю части функционирующего миокарда (Е. Браунвальд). Термин «ремоделирование сердца» введен в литературу N.Sharp в конце 70-х гг. XX-го века для обозначения структурных и геометрических изменений сердца после острого инфаркта миокарда (ИМ).
Варианты ремоделирования сердца:
дилатация полостей сердца;
изменение типа геометрии желудочков;
Гипертрофия миокарда. Длительная нагрузка на сердечную мышцу сопровождается увеличением нагрузки на единицу мышечной массы, повышением интенсивности функционирования ее структур (ИФС). В ответ на это активируется генетический аппарат мышечных и соединительно-тканных клеток. Усиливается синтез белков, что ведет к быстрому увеличению объема мышечного волокна, его гипертрофии. При этом наблюдается увеличение объема каждого сердечного мышечного волокна, общее же число волокон остается неизменным. Гипертрофия миокарда ведет к снижению нагрузки на единицу мышечной массы до нормального уровня, нормализации ИФС.
Гипертрофия миокарда – явление приспособительное, направленное на выполнение повышенной нагрузки без существенного увеличения нагрузки на единицу мышечной массы миокарда.
Различают физиологическую (рабочую) и патологическую гипертрофию мышцы сердца. Физиологическая гипертрофия возникает в результате усиленной работы в течение длительного времени при условии хорошего питания. При этом масса сердца увеличивается пропорционально развитию скелетной мускулатуры (например, гипертрофия сердца у спортсменов). Коэффициент полезного действия у гипертрофированного сердца увеличен. Патологическая гипертрофия возникает при различных процессах в самом сердце или сосудах, когда создаются затруднения к опорожнению полостей сердца или условия, способствующие увеличению систолического объема, то есть ведущие к перегрузке миокарда. При этом масса сердца увеличивается независимо от развития скелетной мускулатуры.
Функциональные и обменные особенности миокарда при гипертрофии:
1. нарушение регуляции гипертрофированного сердца в связи с отставанием роста нервных окончаний от увеличения массы кардиомиоцитов,
2. снижение сосудистого обеспечения миокарда в результате отставания роста артериол и капилляров от увеличения размеров и массы мышечных клеток, т.е. развития относительной коронарной недостаточности,
3. большое увеличение объема клеток миокарда в сравнении с их поверхностью. Учитывая, что в сарколеме локализованы ферменты транспорта катионов, субстратов метаболизма, рецепторные белки, эти измменения обусловливают развитие ионного дисбаланса, нарушение метаболизма кардиомиоцитов, ухудшение снабжения кислородом и другими питательными веществами,
4. снижение уровня энергообеспечения клеток миокарда в результате отставания возрастания массы митохондрий по сравнению с массой миофибрилл,
5. нарушение пластических процессов в кардиомиоцитах в результате отставания роста массы ядра от роста массы цитоплазмы, относительного снижения числа митохондрий, уменьшения поверхности клеток, объема микроциркуляторного русла и дефицита энергии и субстратов, необходимых для биосинтеза структур.
Стадии развития компенсаторной гиперфункции сердца (по Ф.З. Меерсону).
1. Аварийная стадия – развивается непосредственно после увеличения нагрузки, характеризуется сочетанием патологических изменений в миокарде (исчезновение гликогена, сниж. креатинина, сниж. К, увел. Na, мобил. гликолиза, увел. лактата) с мобилизацией резервов миокарда и организма м целом.
2. Стадия завершившейся гипертрофии и относительной устойчивой гиперфункции – процесс гиперфункции завершен, ув. массы сердца (100-120%), ИФС в норме, патол. изменений в миокарде нет, потребность кислорода и образ. АТФ в норме, нормализация гемодинамических показателей.
3. Стадия постепенного истощения и прогрессирующего кардиосклероза – глубокие обменные и структурные изменения в миокарде, часть мышечных волокон гибнет и замещается соединительной тканью, увел. ИФС, нарушается регуляторный аппарат сердца. Прогрессирующее истощение компенсаторных резервов приводит к возникновению хронической недостаточности сердца, а в дальнейшем – к недостаточности кровообращения.
Дилатация – расширение полостей пораженного сердца является следствием гипердиастолы, возникающей при возвращении крови, например, в левый желудочек из аорты (при недостаточности полулунных клапанов аорты). В дальнейшем наступает расстройство коронарного кровообращения в связи с продолжающимся переполнением кровью полостей сердца и увеличением растяжения волокон миокарда (компенсирует минутный объем сердца). В результате этих процессов расширение полостей сердца (тоногенная дилатация) может в дальнейшем перейти в состояние миогенной дилатации.
Дилатация сердца тоногенная (d. cordis tonogena; син.: Д. сердца активная, Д. сердца компенсаторная, Д. сердца концентрическая) — Д. с., обусловленная повышением внутриполостного давления при отсутствии первичных патологических изменений миокарда; при Д. с. т. наблюдается равномерная гипертрофия миокарда.
Дилатация сердца миогенная (d. cordis myogena; син.: Д. сердца застойная, Д. сердца пассивная, Д. сердца эксцентрическая) — Д. с., обусловленная патологическими изменениями миокарда и снижением его сократительной функции.
Дилатация сердца и тахикардия являются грозными симптомами начинающейся декомпенсации сердечной деятельности.
Механизмы компенсации гемодинамических нарушений при хронической сердечной недостаточности
Основным звеном патогенеза ХСН является, как известно, постепенно нарастающее снижение сократительной функции миокарда и падение сердечного выброса. Происходящее при этом уменьшение притока крови к органам и тканям вызывает гипоксию последних, которая первоначально может компенсироваться усиленной тканевой утилизацией кислорода, стимуляцией эритропоэза и т.д. Однако этого оказывается недостаточно для нормального кислородного обеспечения органов и тканей, и нарастающая гипоксия становится пусковым механизмом компенсаторных изменений гемодинамики.
Экстракардиальные механизмы компенсации функции сердца. В отличие от острой сердечной недостаточности роль рефлекторных механизмов экстренной регуляции насосной функции сердца при ХСН сравнительно невелика, поскольку нарушения гемодинамики развиваются постепенно на протяжении нескольких лет. Более или менее определенно можно говорить о рефлексе Бейнбриджа, который «включается» уже на стадии достаточно выраженной гиперволемии.
Однако ведущую роль в генезе долговременной компенсации и декомпенсации нарушенной сердечной функции играют не рефлекторные, а нейрогуморальные механизмы, важнейшим из которых является активация симпатоадреналовой (САС) и ренин-ангиотензин-альдостероновой систем. Говоря об активации САС у пациентов с ХСН, нельзя не указать, что у большинства из них уровень катехоламинов в крови и моче находится в пределах нормы. Этим ХСН отличается от ОСН.
Интракардиальные механизмы компенсации функции сердца. К ним относятся компенсаторная гиперфункция и гипертрофия сердца. Эти механизмы являются неотъемлемыми компонентами большинства приспособительных реакций сердечно-сосудистой системы здорового организма, но в условиях патологии могут превратиться в звено патогенеза ХСН.
Компенсаторная гиперфункция сердца (КГС). КГС выступает как важный фактор компенсации при пороках сердца, артериальной гипертензии, анемии, гипертонии малого круга и других заболеваниях. В отличие от физиологической гиперфункции она является длительной и, что существенно, непрерывной. Несмотря на непрерывность, КГС может сохраняться в течение многих лет без явных признаков декомпенсации насосной функции сердца.
Увеличение внешней работы сердца, связанное с подъемом давления в аорте (изометрическая гиперфункция), приводит к более выраженному возрастанию потребности миокарда в кислороде, чем перегрузка миокарда, вызванная повышением объема циркулирующей крови (изотоническая гиперфункция). Иными словами, для осуществления работы в условиях нагрузки давлением мышца сердца использует гораздо больше энергии, чем для выполнения той же работы, связанной с нагрузкой объемом, а следовательно, при стойкой артериальной гипертензии гипертрофия сердца развивается быстрее, чем при увеличении ОЦК. Например, при физической работе, высотной гипоксии, всех видах клапанной недостаточности, артерио-венозных фистулах, анемии гиперфункция миокарда обеспечивается за счет увеличения минутного объема сердца. При этом систолическое напряжение миокарда и давление в желудочках возрастают незначительно и гипертрофия развивается медленно. В то же время при гипертонической болезни, гипертензии малого круга, стенозах клапанных отверстий развитие гиперфункции связано с повышением напряжения миокарда при незначительно измененной амплитуде сокращений. В этом случае гипертрофия прогрессирует достаточно быстро.
Вторая стадия завершившейся гипертрофии характеризуется нормальной ИФС миокарда и, соответственно, нормальным уровнем энергообразования и синтеза нуклеиновых кислот и белков в ткани сердечной мышцы. При этом потребление кислорода на единицу массы миокарда остается в границах нормы, а потребление кислорода сердечной мышцей в целом увеличено пропорционально возрастанию массы сердца. Увеличение массы миокарда в условиях ХСН происходит за счет активации синтеза нуклеиновых кислот и белков. Пусковой механизм этой активации изучен недостаточно. Считается, что определяющую роль здесь играет усиление трофического влияния симпатоадреналовой системы. Эта стадия процесса совпадает с длительным периодом клинической компенсации. Содержание АТФ и гликогена в кардиомиоцитах также находится при этом в пределах нормы. Подобные обстоятельства придают относительную устойчивость гиперфункции, но вместе с тем не предотвращают исподволь развивающихся в данной стадии нарушений обмена и структуры миокарда. Наиболее ранними признаками таких нарушений являются значительное увеличение концентрации лактата в миокарде, а также умеренно выраженный кардиосклероз.
Механизм декомпенсации гипертрофированного миокарда включает следующие звенья:
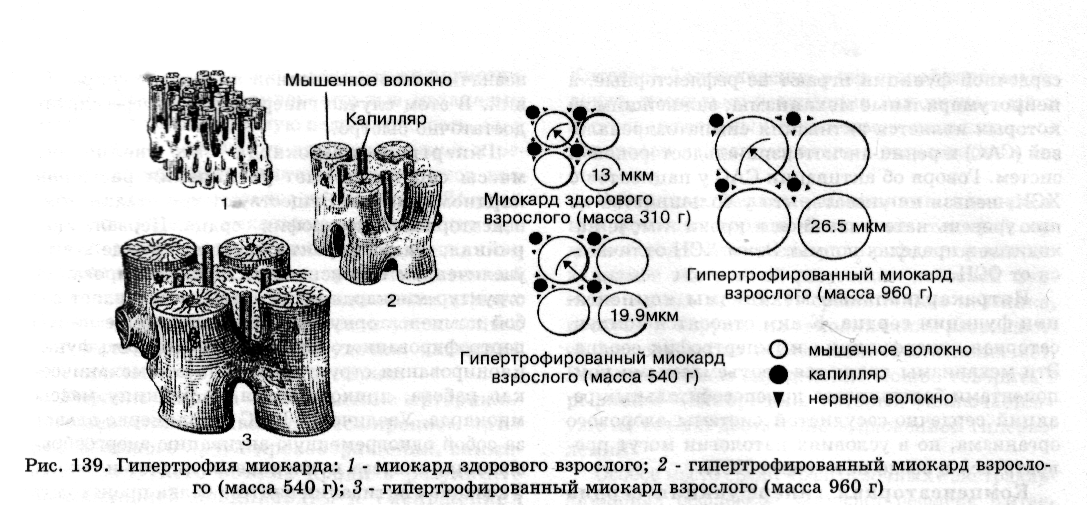
1. Процесс гипертрофии не распространяется на коронарные сосуды, поэтому число капилляров на единицу объема миокарда в гипертрофированном сердце уменьшается (рис. 139). Следовательно, кровоснабжение гипертрофированной сердечной мышцы оказывается недостаточным для выполнения механической работы.
2. Вследствие увеличения объема гипертрофированных мышечных волокон уменьшается удельная поверхность клеток, в связи с этимухудшаются условия для поступления в клетки питательных веществ и выделения из кардиомиоцитов продуктов метаболизма.
4. Проводящая система сердца и вегетативные нервные волокна, иннервирующие миокард, не подвергаются гипертрофии, что также способствует возникновению дисфункции гипертрофированного сердца.
5. Активируется апоптоз отдельных кардиомиоцитов, что способствует постепенному замещению мышечных волокон соединительной тканью (кардиосклероз).
В конечном итоге гипертрофия утрачивает приспособительное значение и перестает быть полезной для организма. Ослабление сократительной способности гипертрофированного сердца происходит тем скорее, чем сильнее выражены гипертрофия и морфологические изменения в миокарде.
Вегетативная дисфункция сердца
Вегетативная дисфункция сердца является частью симптомокомплекса, называемого соматоформной дисфункцией вегетативной нервной системы. Так как ВНС обеспечивает стабильность работы практически всех внутренних органов, то и симптомы расстройства ее чрезвычайно разнообразны.
Симптомы вегетативной дисфункции сердца
Симптоматику вегетативной дисфункции выявить достаточно просто, однако для окончательного установления диагноза врачу нужно точно ответить на следующие вопросы: являются ли данные симптомы признаком самостоятельной болезни или же проявлением другого, соматического, неврологического, психического заболевания? Могут ли они означать наличие патологии ССС (сердечно-сосудистой системы): гипертония, ИБС, клапанные пороки, воспаление миокарда?
При установке диагноза вегетативной дисфункции учитывают:
Выделяют основные и дополнительные диагностические признаки вегетативной дисфункции. Достоверным можно считать диагноз при наличии двух и больше основных и 2-х дополнительных признаков.
Основные признаки:
Дополнительные признаки:
Также есть признаки, наличие которых со стопроцентной вероятностью исключает диагноз вегетативной дисфункции. Выявляются они при осмотре и дополнительном обследовании. Это отеки ног, влажные хрипы в легких, аускультативные шумы в диастолу, увеличение сердца (гипертрофия, дилатация), изменения на ЭКГ (блокада левой ножки п.Гиса, АВ-блокада II-III степени, очаговые изменения, смещение сегмента ST, нарушения ритма кроме единичной экстрасистолии), изменения в анализах крови.
Причины ВСД
В основе заболевания — нарушение нейрогуморальной регуляции вегетативной нервной системы, отвечающей за стабильность и слаженность деятельности всех внутренних органов и организма в целом. Это отдел нервной системы, не подчиняющийся сознанию и управлению волей человека.
Диагностика и лечение вегетативной дисфункции сердца
Вегетативная дисфункция является диагнозом исключения. После того как будет исключен ряд сердечно-сосудистых заболеваний благодаря лабораторным, инструментальным методам (ЭКГ, ЭхоКГ, Холтер-ЭКГ и др.) следует проводить дифдиагностику с нервно-психическими заболеваниями и только в последнюю очередь думать о вегетатике.
Лечение же непосредственно расстройства вегетативной нервной системы следует начинать с оздоровления образа жизни: регулярные физические нагрузки, спорт (приоритетно плавание), исключение вредных привычек, полноценный ночной сон, оптимальное питание, нормализация массы тела, закаливание.
Из медикаментов используются адаптогены, дневные транквилизаторы, ноотропы, сосудистые препараты, антиоксиданты, витамины.
К кому обратиться?
В случае преобладания кардиальной симптоматики для правильной диагностики и при необходимости лечения нужна консультация врача-кардиолога. Лечение вегетативных расстройств является компетенцией неврологов и психиатров.
5.Экстракардиальные механизмы компенсации сердечной недостаточности. Эффекты и патогенетическая оценка включения экстракардиальных механизмов компенсации.
Происходит активация нескольких нейроэндокринных систем, важнейшими из которых являются:
симпатико-адреналовая система (САС) и ее эффекторы (адреналин и норадреналин);
ренин-ангиотензин-альдостероновая система (РААС) (почки — надпочечники);
тканевые ренин-ангиотензиновые системы (РАС);
предсердный натрийуретический пептид;
эндотелиальная дисфункция и др.
увеличение ЧСС (стимуляция b1-адренергических рецепторов) и, соответственно, МО (поскольку МО = УО х ЧСС);
повышение сократимости миокарда (стимуляция b1- и a1-рецепторов);
системная вазоконстрикция и повышение ОПСС и АД (стимуляция a1-рецепторов);
повышение тонуса вен (стимуляция a1-рецепторов), что сопровождается увеличением венозного возврата крови к сердцу и увеличением преднагрузки;
стимуляция развития компенсаторной гипертрофии миокарда;
активирование РААС (почечно-надпочечниковой) в результате стимуляции b1-адренергических рецепторов юкстагломерулярных клеток и тканевых РАС за счет дисфункции эндотелия.
На начальных этапах повышение активности САС способствует увеличению сократимости миокарда, притока крови к сердцу, величины преднагрузки и давления наполнения желудочков, что в конечном итоге приводит к сохранению в течение определенного времени достаточного сердечного выброса. Однако длительная гиперактивация САС у больных хронической СН может иметь многочисленные негативные последствия, способствуя:
1. Значительному увеличению преднагрузки и постнагрузки (за счет чрезмерной вазоконстрикции, активации РААС и задержки натрия и воды в организме).
2. Повышению потребности миокарда в кислороде (в результате положительного инотропного эффекта активации САС).
3. Уменьшению плотности b-адренергических рецепторов на кардиомиоцитах, что со временем приводит к ослаблению инотропного эффекта катехоламинов (высокая концентрация катехоламинов в крови уже не сопровождается адекватным увеличением сократимости миокарда).
4. Прямому кардиотоксическому эффекту катехоламинов (некоронарогенные некрозы, дистрофические изменения миокарда).
5. Развитию фатальных желудочковых нарушений ритма (желудочковой тахикардии и фибрилляции желудочков) и т.д.
Гиперактивация симпатико-адреналовой системы
Один из наиболее ранних компенсаторных факторов при дисфункции сердца. Особенно важной оказывается в случаях развития острой СН. Эффекты реализуются прежде всего через a- и b-адренергические рецепторы клеточных мембран различных органов и тканей.
Гиперактивация ренин-ангиотензин-альдостероновой системы
Имеет значение не только почечно-надпочечниковая РААС, но и локальные тканевые.
Активация почечной ренин-ангиотензиновой системы сопровождается выделением клетками ЮГА почек ренина, расщепляющего ангиотензиноген с образованием пептида — ангиотензина I (АI). Последний под действием АПФ трансформируется в ангиотензин II, который является основным и наиболее мощным эффектором РААС. Воздействие АII на АТ2-рецепторы клубочковой зоны коркового вещества надпочечников приводит к образованию альдостерона, основным эффектом которого является задержка в организме натрия и воды, что способствует увеличению ОЦК.
В целом активация РААС сопровождается следующими эффектами:
выраженной вазоконстрикцией, повышением АД;
задержкой в организме натрия и воды и увеличением ОЦК;
повышением сократимости миокарда (положительное инотропное действие);
инициированием развития гипертрофии и ремоделирования сердца;
активацией образования соединительной ткани (коллагена) в миокарде;
повышением чувствительности миокарда к токсическому влиянию катехоламинов.
Активация РААС при острой СН и на начальных этапах развития хронической СН имеет компенсаторное значение и направлена на поддержание нормального уровня АД, ОЦК, перфузионного давления в почках, увеличение пред- и постнагрузки, увеличение сократимости миокарда. Однако в результате длительной гиперактивации РААС развивается ряд отрицательных эффектов:
1. увеличение ОПСС и снижение перфузии органов и тканей;
2. чрезмерное увеличение постнагрузки на сердце;
3. значительная задержка жидкости в организме, что способствует формированию отечного синдрома и повышению преднагрузки;
4. инициация процессов ремоделирования сердца и сосудов, в том числе гипертрофии миокарда и гиперплазии гладкомышечных клеток;
5. стимуляция синтеза коллагена и развитие фиброза сердечной мышцы;
6. развитие некроза кардиомиоцитов и прогрессирующее повреждение миокарда с формированием миогенной дилатации желудочков;
7. повышение чувствительности сердечной мышцы к катехоламинам, что сопровождается возрастанием риска возникновения фатальных желудочковых аритмий у больных СН.
Антидиуретический гормон (АДГ), секретируемый задней долей гипофиза, участвует в регуляции проницаемости для воды дистальных отделов канальцев почек и собирательных трубок. Например, при недостатке в организме воды и дегидратации тканей происходит уменьшение объема циркулирующей крови (ОЦК) и увеличение осмотического давления крови (ОДК). В результате раздражения осмо- и волюморецепторов усиливается секреция АДГ задней долей гипофиза. Под влиянием АДГ повышается проницаемость для воды дистальных отделов канальцев и собирательных трубок, и, соответственно, усиливается факультативная реабсорбция воды в этих отделах. В итоге выделяется мало мочи с высоким содержанием осмотически активных веществ и высокой удельной плотностью мочи.
Наоборот, при избытке воды в организме и гипергидратации тканей в результате увеличения ОЦК и уменьшения ОДК происходит раздражение осмо- и волюморецепторов, и секреция АДГ резко снижается или даже прекращается. В результате реабсорбция воды в дистальных отделах канальцев и собирательных трубках снижается, тогда как Na+ продолжает реабсорбироваться в этих отделах. Поэтому выделяется много мочи с низкой концентрацией осмотически активных веществ и низкой удельной плотностью.
Нарушение функционирования этого механизма при сердечной недостаточности может способствовать задержке воды в организме и формированию отечного синдрома. Чем меньше сердечный выброс, тем больше раздражение осмо- и волюморецепторов, что приводит к увеличению секреции АДГ и, соответственно, задержке жидкости.
Предсердный натрийуретический пептид
Предсердный натрийуретический пептид (ПНУП) является своеобразным антагонистом вазоконстрикторных систем организма (САС, РААС, АДГ и других). Он продуцируется миоцитами предсердий и выделяется в кровоток при их растяжении. ПНУП вызывает вазодилатирующий, натрийуретический и диуретический эффекты, угнетает секрецию ренина и альдостерона.
Секреция ПНУП — это один из наиболее ранних компенсаторных механизмов, препятствующих чрезмерной вазоконстрикции, задержке Nа+ и воды в организме, а также увеличению пред- и постнагрузки.
Активность ПНУП быстро усиливается по мере прогрессирования СН. Однако, несмотря на высокий уровень циркулирующего ПНУП, степень его положительных эффектов при хронической СН заметно снижается, что связано, вероятно, с уменьшением чувствительности рецепторов и увеличением расщепления пептида. Поэтому максимальный уровень циркулирующего ПНУП ассоциируется с неблагоприятным течением хронической СН.
Нарушения эндотелиальной функции
Дисфункция эндотелия, возникающая под действием различных повреждающих факторов (гипоксии, чрезмерной концентрации катехоламинов, ангиотензина II, серотонина, высокого уровня АД, ускорения кровотока и т.д.), характеризуется преобладанием вазоконстрикторных эндотелийзависимых влияний и закономерно сопровождается повышением тонуса сосудистой стенки, ускорением агрегации тромбоцитов и процессов пристеночного тромбообразования.
К числу важнейших эндотелийзависимых вазоконстрикторных субстанций, повышающих сосудистый тонус, агрегацию тромбоцитов и свертываемость крови, относятся эндотелин-1 (ЭТ1), тромбоксан А2, простагландин PGH2, ангиотензин II (АII) и др. Они оказывают существенное влияние на сосудистый тонус и сократимость миокарда, величину преднагрузки и постнагрузки, агрегацию тромбоцитов и т.д.. Кроме того, эндотелин-1 способствует образованию коллагена в сердечной мышце и развитию кардиофиброза. Существенную роль вазоконстрикторные субстанции играют в процессе пристеночного тромбообразования
Одним из ведущих патогенетических механизмов формирования и прогрессирования сердечной недостаточности является гиперактивация нейрогормональных систем организма — САС, РААС, АДГ, ПНУП и др., а также дисфункция эндотелия.
2. На начальных этапах развития заболевания активация этих систем носит адаптационный характер и направлена на сохранение достаточного сердечного выброса, системного АД и перфузии органов и тканей. Этот эффект реализуется благодаря:
повышению сердечного выброса за счет гиперфункции с последующей гипертрофией;
увеличению постнагрузки (вазоконстрикция);
увеличению преднагрузки и ОЦК (физиологическая задержка натрия и воды) и др.
3. Длительная чрезмерная активация нейрогормональных систем приводит к:
избыточной задержке натрия и воды в организме (отечный синдром);
резкому увеличению ОПСС (нарушение перфузии органов и тканей);
чрезмерному возрастанию пред- и постнагрузки, что ведет к снижению функции сердца;
стимулированию синтеза коллагена и развитию кардиофиброза;
развитию некрозов кардиомиоцитов, прогрессирующему повреждению сердечной мышцы и формированию миогенной дилатации сердца.