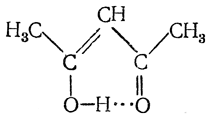
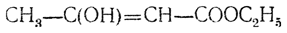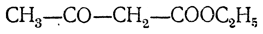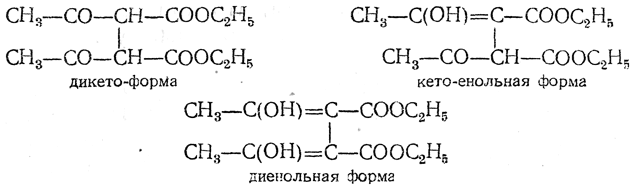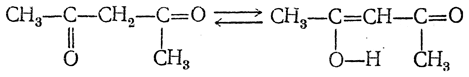кето форма ацетоуксусной кислоты
Кето-енольная таутомерия β – дикарбонильных соединений (ацетилацетон, ацетоуксусный эфир, щавелевоуксусная кислота). Реакции кетонной и енольной форм ацетоуксусного эфира.
Кето-енольная таутомерия. Таутомерия присуща различным классам веществ, чаще гетерофункциональным соединениям. Таутомерия — способность химических соединений существовать в виде двух иди нескольких, находящихся в равновесии, структурных изомеров.
В большинстве случаев таутомерные превращения сопровождаются переносом протона от одного атома к другому, поэтому такие виды таутомерии объединяются общим понятием прототропной таутомерии. Одной из разновидностей прототропной таутомерии является кето-енольная таутомерия, сущность которой состоит в переносе протона от α-СН-кислотного центра карбонильного соединения к атому кислорода карбонильной группы как основному центру:
Кето-енольная таутомерия свойственна β-оксокислотам и их сложным эфирам, а также 1,3-дикетонам и соединениям других классов, содержащим карбонильную группу. Енольная форма термодинамически менее выгодна, чем кетонная. Показано, что енолизация является эндотермическим процессом. Однако в 1,3-дикарбонильных соединениях енольная форма стабилизирована за счет образования внутримолекулярных водородных связей, а также за счет сопряжения.
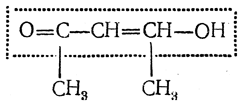
Ниже приведены таутомерные формы одного из важнейших 1,3-дикарбонильных соединений — ацетоуксусного эфира:
Положение равновесия таутомеров зависит от строения карбонильного соединения. Алифатические альдегиды и кетоны, у которых в углеводородных радикалах отсутствуют электроноакцепторные заместители, существуют практически только в оксоформе (кетонной). Заметные количества енольной формы в равновесной смеси появляются тогда, когда СН-кислотность карбонильного соединения усиливается за счет дополнительной электроноакцепторной группы, например, у ацетона содержание енольной формы низкое, а у ацетилацетона она преобладает в равновесной смеси.
При наличии в β-положении объемных заместителей устойчивость енольной формы понижается, так как объемные группы препятствуют образованию внутримолекулярной водородной связи. Так, содержание енольной формы снижается в ряду: ацетоуксусный эфир — метил ацетоуксусный эфир — этил ацетоуксусный эфир.
Влияние на состояние кето-енольного равновесия оказывает и растворитель: полярные растворители стабилизируют кетонную форму, неполярные — енольную. Считают, что енольная форма за счет внутримолекулярной водородной связи менее полярна и хуже сольватируется полярными растворителями.
Таутомерные превращения дикарбонильных соединений протекают с довольно низкой скоростью, что позволило выделить таутомеры некоторых веществ в индивидуальном виде. При низких температурах кетонная форма устойчива и не подвергается енолизации в течение довольно долгого времени. При пропускании сухого хлороводорода через суспензию натриевого енолята ацетоуксусного эфира в диметиловом эфире была выделена чистая енольная форма:
Существование двух таутомерных форм проявляется в химических свойствах β-оксоэфиров. Ацетоуксусный эфир может вступать в реакции как в кетонной, так и в енольной форме. Как кетон он способен присоединять циановодородную кислоту и гидросульфит натрия, а в реакции с этиленгликолем образовывать циклический ацеталь:
В реакциях с такими нуклеофилами, как гидразин и его производные или гидроксиламин, ацетоуксусный эфир образует пятичленные гетероциклические соединения.
В енольной форме ацетоуксусный эфир при взаимодействии с хлоридом фосфора(V) превращается в эфир галогенозамещенной α,β-ненасыщенной кислоты:
Качественной пробой для обнаружения енольной формы ацетоуксусного эфира служит реакция с хлоридом железа(Ш), приводящая к появлению вишневого окрашивания реакционной смеси (качественная реакция).
Для количественного определения содержания енольной формы в равновесной смеси применяют титрование бромом (качественная реакция). Бромирование двойной связи протекает значительно быстрее, чем енолизация карбонильного соединения, поэтому при быстром проведении титрования удается довольно точно установить содержание енольной формы:
Продукт бромирования отщепляет бромоводород, превращаясь в производное кетонной формы. Таким образом, с помощью усовершенствованных методик титрования можно определить содержание енольной формы практически во всем диапазоне концентраций.
Кето-енольная таутомерия
Строение ацетоуксусного эфира было предметом спора среди химиков в течение многих десятилетий. На основании ряда химических реакций разные исследователи предлагали для него одну из следующих двух формул строения:
1) строение оксикротонового эфира
предложенное Гейтером, открывшим это соединение;
впервые предложенное Франкландом и Дюппа, открывшими ряд синтетических реакций, идущих при помощи этого эфира. В многочисленных исследованных реакциях ацетоуксусный эфир реагирует иногда так, как если бы он обладал строением эфира кетокислоты, а иногда в согласии с енольной формулой (как оксикротоновый эфир). Это — один из типичнейших примеров явления таутомерии, или десмотропии. Именно на этом примере особенно хорошо исследованы характерные взаимные отношения веществ, содержащих карбонильную группу >СН—СО—, к веществам, содержащим гидроксил у этиленовой связи >С=С(ОН)—, или енолам. Эти отношения носят название кето-енольной таутомерии.
Как мы видели раньше, для простейших альдегидов и кетонов и соответствующих ненасыщенных спиртов еще не наблюдаются явления настоящей таутомерии, так как простейшие енолы этого рода, подобные виниловому спирту, крайне неустойчивы, быстро и нацело превращаются в соединения с карбонильной группой, т. е. в альдегиды и кетоны. Устойчивы лишь производные таких енолов.
В более сложных молекулах превращение этих двух форм друг в друга иногда идет настолько медленно, что оказалось возможным проследить уже при обычных температурах ход этого превращения, а при низких температурах удалось выделить оба вещества в чистом виде.
Наиболее характерные отношения таутомерии наблюдаются при наличии в молекуле по крайней мере двух карбонильных групп, находящихся друг по отношению к другу в β-положении. Таковы ацетилацетон, малоновый эфир, ацетоуксусный эфир и пр.
Наличие в жидком ацетоуксусном эфире двух веществ может быть доказано следующим образом:
1. Как нам известно, многие физические характеристики вещества могут быть вычислены, если известна формула его строения. Особенно точно может быть вычислена молекулярная рефракция. Исследование плотности, молекулярной рефракции и других физических свойств показало, что величины этих констант для обыкновенного ацетоуксусного эфира лежат между теми, которые теоретически вычисляются для обеих форм. Зная величины этих констант для чистых веществ (на основании вычисления), можно было определить, в каких относительных количествах находятся обе формы. Изменение физических свойств свежеперегнанного ацетоуксусного эфира можно объяснить тем, что при комнатной температуре равновесие между обеими формами устанавливается сравнительно медленно.
2. Так как с хлорным железом интенсивное фиолетовое окрашивание дают только енолы, то по интенсивности окраски можно судить о большем или меньшем содержании енольной формы в таутомерной смеси. Количественное определение содержания енольной формы этим путем сделалось возможным лишь после выделения ее в чистом виде.
3. Как нашел К. Мейер, лишь енольная форма, подобно другим этиленовым соединениям, присоединяет бром; кето-форма реагирует с ним очень медленно. Таким образом, содержание енольной формы можно определить по количеству брома, присоединяющегося к смеси.
Содержание енольной формы может быть определено также методом Чугаева-Церевитинова. Ввиду сильного енолизирующего действия магнийорганических соединений на обычные кетоны более удобным оказалось применение цинкдиметила или цинкиодметила.
4. Наконец, Кнорру (1911) удалось, растворяя ацетоуксусный эфир в петролейном эфире и охлаждая раствор жидким воздухом, выделить из раствора кристаллическое вещество с т. пл. —39° С, оказавшееся чистой кето-формой, т. е. собственно ацетоуксусным эфиром. Свежеприготовленное вещество не давало реакции с хлорным железом, не присоединяло брома и обладало физическими свойствами, точно отвечающими кето-форме. При стоянии расплавленный чистый ацетоуксусный эфир медленно превращается в обыкновенный ацетоуксусный эфир.
Енольную форму, т. е. оксикротоновый эфир, Кнорру удалось получить, разлагая соляной кислотой при сильном охлаждении натрийацетоуксусный эфир, являющийся производным исключительно енольной формы. Полученный таким образом оксикротоновый эфир не представлял собой вполне индивидуального вещества, вероятно, потому, что здесь одновременно получались оба возможных (цис- и транс-) стереоизомера.
В отличие от кето-формы енольная форма моментально растворяется в щелочах, присоединяет теоретическое количество брома, дает интенсивную окраску с хлорным железом и т. п.
В обыкновенном ацетоуксусном эфире после установления равновесия содержится более 90% кето-формы и лишь несколько процентов енольной формы.
Разрешению вопроса о таутомерных формах ацетоуксусного эфира предшествовало разрешение его для ряда более сложных случаев кето-енольной таутомерии, как, например, для диацетилянтарного эфира, для которого были найдены три следующие таутомерные формы:
Здесь, как и в большинстве аналогичных случаев, возможно существование ряда стереоизомерных форм.
Для диацетилянтарного эфира и для многих других соединений таутомерные формы существуют при обычной температуре в твердом виде. Кроме того, в некоторых случаях таутомерное превращение различных форм друг в друга идет гораздо медленнее, чем у ацетоуксусного эфира. Эти обстоятельства чрезвычайно облегчили получение в чистом виде отдельных форм и изучение их взаимных превращений.
Исследования показали, что в большинстве случаев температура сравнительно мало влияет на положение равновесия. Однако в свежеперегнанном ацетоуксусном эфире часто находится много енольной формы. Это явление получило объяснение, когда было показано, что щелочь из стекла оказывает сильное каталитическое влияние на взаимные превращения двух форм. Именно поэтому при медленной перегонке из стеклянной колбы можно почти нацело превратить обыкновенный ацетоуксусный эфир в более низкокипящую енольную форму Наоборот, при проведении перегонки из кварцевой посуды, не оказывающей каталитического влияния на это превращение, в первых порциях отгоняется весь енол, а затем уже перегоняется чистый ацетоуксусный эфир,
Кроме того, оказалось, что на положение равновесия довольно сильно влияют растворители. Электролитически диссоциирующие растворители благоприятствуют образованию кетонной формы («кетизируют»), а неполярные растворители благоприятствуют образованию енольной формы («енолизируют»). Это видно из следующих данных о содержании енольной формы ацетоуксусного эфира в разных растворителях (вычислены по присоединению брома при 18° С к растворенному ацетоуксусному эфиру после установления равновесия между обеими формами):
Выше уже указывалось, что енольная группировка примерно на 22 ккал/моль энергетически менее выгодна, чем таутомерная ей группировка с карбонильной группой. Однако если двойная связь енольной группировки образует с имеющимися в молекуле другими двойными связями (>С=С >С=O) сопряженную систему, то может оказаться, что затрата энергии на енолизацию полностью или частично будет компенсироваться уменьшением энергии за счет образования системы сопряженных связей. Например, в случае ацетилацетона
енольная форма реально существует, причем дополнительная стабилизация енола может достигаться вследствие возникновения, водородной связи
так как здесь расстояния О—Н∙∙∙О в точности отвечают соответствующим расстояниям в «димерах» карбоновых кислот.
Здесь следует обратить внимание на то, что енольная форма содержит группировку, являющуюся винилогом карбоксильной группы:
Поэтому можно было бы ожидать у оксикротонового эфира проявления кислотных свойств. На самом деле они очень слабы. Это объясняется связыванием атома водорода водородной связью, затрудняющей его протонизацию. Наоборот, сходные соединения, у которых водородная связь между гидроксильным атомом водорода и карбонильной группой невозможна по пространственным причинам, ведут себя, как карбоновые кислоты (см., например, димедон).
34.Понятие о кетокислотах на примере ацетоуксусной кислоты. Ацетоуксусный эфир, кето-енольная таутомерия. Кетонное расщепление ацетоуксусного эфира.
Ацетоуксусная кислота (формула СН3·CO·СН2СООН) — органическая кетокислота; промежуточный продукт обменажирных кислотиаминокислот. Ацетоуксусная кислота — органическое соединение из группы β-кетокислот.
Ацетоуксусная кислота реагирует с галогенами(хлоромилибромом), которые разлагают её до соответствующегогалогеноводорода,углекислого газаи галоидацетона (хлор- или бромацетона):
Реакции кетонного расщепления ацетоуксусного эфира
35.Гетерофункциональные производные бензольного ряда как лекарственные средства. Салициловая кислота и ее производные (ацетилсалициловая кислота, фенилсалицилат, метилсалицилат).
Среди монофункциональных производных бензола особое место занимает производное с карбоксильной группой — бензойная кислота͵ применяемая в медицине в виде натриевой соли (натрия бензоат) как отхаркивающее средство.
Бензойная кислота в свободном виде встречается в некоторых смолах и бальзамах, а также клюкве, бруснике, но чаще содержится в связанном виде. Как гетерофункциональное соединение п- аминофенол образует производные по каждой функциональной группе в отдельности и одновременно по двум функциональным группам. п-Аминофенол ядовит. Интерес для медицины представляют его производные – парацетамол, фенацетин, оказывающие анальгетическое (обезболивающее) и жаропонижающее действие.
Парацетамол является N-ацетильным производным п-аминофенола. Фенацетин получается при ацетилировании этилового эфира п-аминофенола, называемого фенетидином.
Эфиры ароматических аминокислот обладают общим свойством – способностью в какой-либо степени вызывать местную анестезию, ᴛ.ᴇ. потерю чувствительности. Особенно заметно это свойство выражено у пара- производных. В медицине используют анестезин и новокаин. Новокаин применяют в виде соли (гидрохлорида), что связано с крайне важно стью повышения его растворимости в воде.
п-Аминобензойная кислота является фактором роста микроорганизмов и участвует в синтезе фолиевой кислоты, при недостатке или отсутствии которой микроорганизмы погибают. Название кислоты связано с выделением ее из листьев шпината (от лат. folium – лист). Фолиевая кислота играет важную роль в метаболизме нуклеиновых кислот и белков; в организме человека не синтезируется.
Фолиевая кислота (витамин В) включает три структурных фрагмента — ядро птеридина, п-аминобензойную и L-глутаминовую кислоты. Обе функциональные группы п- аминобензойной кислоты участвуют в образовании связей с двумя другими компонентами.
Салициловая кислота относится к группе гидроксибензойных кислот. Как о-гидроксибензойная кислота она легко декарбоксилируется при нагревании с образованием фенола.
Салициловая кислота растворима в воде, дает интенсивное окрашивание с хлоридом железа(III) (качественное обнаружение фенольной гидроксильной группы). Она оказывает антиспазматическое, жаропонижающее и антигрибковое действие, но как сильная кислота (рКа 2,98) вызывает раздражение пищеварительного тракта и в связи с этим применяется только наружно. Внутрь применяют ее производные – соли или эфиры. Салициловая кислота способна образовывать производные по любой функциональной группе. Практическое значение имеют салицилат натрия, сложные эфиры по СООН-группе (метилсалицилат, фенилсалицилат (салол)) и ОН-группе – ацетилсалициловая кислота (аспирин). Перечисленные производные (кроме салола) оказывают анальгетическое, жаропонижающее и противовоспалительное действие. Метилсалицилат из-за раздражающего действия используется наружно в составе мазей. Салол применяется как дезинфицирующее средство при кишечных заболеваниях и примечателен тем, что в кислой среде желудка не гидролизуется, а распадается только в кишечнике, в связи с этим используется также в качестве материала для защитных оболочек некоторых лекарственных средств, которые не стабильны в кислой среде желудка.
Из других производных салициловой кислоты большое значение имеет п- аминосалициловая кислота (ПАСК) как противотуберкулезное средство. ПАСК является антагонистом п-аминобензойной кислоты, крайне важно й для нормальной жизнедеятельности микроорганизмов. Другие изомеры таким действием не обладают. м-Аминосалициловая кислота является высокотоксичным веществом.
Антисептическое средство, расщепляясь в щелочном содержимом кишечника, высвобождает салициловую кислоту и фенол. Салициловая кислота оказывает жаропонижающее и противовоспалительное действие, фенол активен в отношении патогенной микрофлоры кишечника.Оказывает некоторое уроантисептическое действие.По сравнению с современными противомикробными ЛС фенилсалицилат менее активен, но малотоксичен, не раздражает слизистую оболочку желудка, не вызывает дисбактериоза и др.осложнений противомикробной терапии.
метилсалицилат представляет собой жидкость, обладающую противовоспалительным, обезболивающим, раздражающим и отвлекающим действием. Препарат назначают при ревматизме, радикулите, артрите, экссудативном плеврите.
Синдром гиперкетонемии у детей и подростков: патогенез, причины, диагностика
В статье представлены современные данные о физиологии энергетического обмена и роли в нем кетоновых тел. Рассмотрены основные причины избыточного образования кетонов, методы диагностики, подходы к лечению.
The article presents modern data on the physiology of energy metabolism and the role of ketone bodies in it. The main causes of excessive ketone formation, diagnostic methods, approaches to treatment are considered.
Часть 1
Кетоновые тела (ацетоновые тела) — группа органических соединений, являющихся промежуточными продуктами обмена углеводов, жиров, белков. Кетокислоты — это продукт метаболизма ацетил-коэнзима А (ацетил-КоА), который при дефиците пищи образуется либо из собственных белков, либо из жира. К кетоновым телам относятся β-оксимасляная кислота (β-оксибутират), ацетоуксусная кислота (ацетоацетат) и ацетон.
Физиология энергетического обмена
Кетоновые тела синтезируются в основном в митохондриях печеночных клеток из ацетил-КоА, который объединяет несколько ключевых метаболических процессов клетки. Главная функция ацетил-КоА — доставлять атомы углерода с ацетил-группой в цикл трикарбоновых кислот (ЦТК, цикл Кребса), чтобы те были окислены с выделением энергии. Содержание ацетил-КоА определяет направление клеточного метаболизма в данный момент: будет ли происходить синтез и накопление гликогена, жира и синтез белков или, наоборот, будут расходоваться ранее накопленные энергозапасы в организме.
Образование кетоновых тел является физиологическим процессом и необходимой частью энергетического обмена. В процессе этого обмена происходит «сгорание» и взаимотрансформация углеводов, белков, жиров и других энергосубстратов с образованием энергии, которая либо превращается в тепло, либо аккумулируется в виде аденозинтрифосфата (АТФ).
В условиях дефицита энергии в организме воссоздание энергетических запасов возможно за счет активации глюконеогенеза или синтеза кетоновых тел (кетогенез).
Кетоновые тела играют важную роль в поддержании энергетического баланса организма, а активация кетогенеза является более целесообразной и оптимальной для организма в этих условиях. Кетоновые тела не только сохраняют структурные белки организма, угнетая секрецию и действие глюкагона — мощного стимулятора глюконеогенеза, но и по механизму обратной связи регулируют и ограничивают интенсивность кетогенеза [1].
Глюконеогенез — это метаболический путь биосинтеза глюкозы из не углеводных предшественников, активный в печени, почках, тонком кишечнике. Когда запасы гликогена в организме исчерпываются, печень переходит на синтез его путем глюконеогенеза. Субстратами глюконеогенеза являются: пировиноградная кислота (пируват), молочная кислота (лактат), глицерол, глюкогенные аминокислоты, жирные кислоты.
Трансформация пировиноградной кислоты возможна двумя путями — аэробным или анаэробным. Гликолиз, или путь Эмбдема–Мейергофа, — основной путь утилизации глюкозы в клетках. Одна молекула глюкозы превращается при этом в две молекулы пировиноградной кислоты. Превращение пирувата в ацетил-КоА происходит при участии набора ферментов, структурно объединенных в пируватдегидрогиназный комплекс (ПДК).
При аэробных условиях пируват проникает в митохондрии. Образованный ацетил-КоА в цикле Кребса окисляется до СО2 и Н2О. Основная часть глюкозы расходуется на синтез АТФ в процессе окислительного фосфорилирования.
Если содержание кислорода недостаточно, как это может быть в скелетных мышцах при интенсивной физической нагрузке или в тканях, где нет или очень мало митохондрий (эритроциты, белые мышцы, клетки сетчатки глаза, мозгового слоя коры надпочечников), гликолиз является конечным энергетическим процессом, в результате которого пируват преобразуется в лактат, а последний в продукт анаэробного гликолиза. Он образуется при любых состояниях организма в эритроцитах и работающих мышцах. Избыток лактата поступает в печень, где из него вновь синтезируется глюкоза (глюконеогенез). Таким образом, лактат используется в глюконеогенезе постоянно.
При мышечной работе глюкоза в миоците используется не только на энергетические нужды, но и на обеспечение постоянного притока оксалоацетата в ЦТК. При этом с увеличением продолжительности нагрузки «энергетическая» роль глюкозы снижается [2].
Ацетил-КоА является ключевым метаболитом липидного обмена. Он образуется при β-окислении жирных кислот в митохондриях печени. В матриксе митохондрий печеночных клеток происходит окисление жирных кислот в цикле Кноппа–Линена. Ключевым участником этого процесса является L-карнитин, который транспортирует длинноцепочечные жирные кислоты в митохондрии через внутреннюю мембрану последних. Этот процесс является инсулинозависимым. В норме цитрат образуется путем конденсации оксалоацетата и ацетил-КоА с участием фермента цитрат-синтетазы.
Аминокислоты (лейцин, тирозин, фенилаланин), образующиеся в результате распада мышечных белков, включаются в глюконеогенез при длительном голодании или продолжительной мышечной работе. В процессе катаболизма они превращаются в ацетоацетат и могут использоваться в синтезе кетоновых тел.
Включение лактата, глицерола и аминокислот в глюконеогенез зависит от физиологического состояния организма. При окислении одной молекулы β-оксибутирата образуется СО2 и Н2О и обеспечивается синтез 27 молекул АТФ.
Биологическая роль кетоновых тел
Кетоновые тела играют важную роль в поддержании энергетического баланса. Образовавшиеся ацетоновые тела поступают из гепатоцитов в кровь и разносятся к клеткам различных органов. Ацетоновые тела в норме достаточно хорошо утилизируются клетками периферических тканей, в особенности это касается скелетных мышц и миокарда, которые значительную часть нужной им энергии получают за счет окисления ацетоновых тел. Основным путем активации ацетоацетата в клетках является путь с участием тиафоразы. В гепатоцитах нет этого фермента. Именно поэтому образовавшийся в гепатоцитах ацетоацетат в них не активируется и не окисляется, тем самым создаются условия для «экспорта» ацетоацетата из гепатоцитов в кровь.
У здоровых при усилении липолиза увеличивается скорость утилизации кетоновых тел, которые являются важными источниками энергии при мышечной работе, голодании. Скелетные мышцы и почки используют кетоновые тела даже при их низкой концентрации в крови. Лишь клетки центральной нервной системы в обычных условиях практически не утилизируют ацетоновые тела [3].
Кетоновые тела это часть метаболического регулярного механизма для предотвращения излишней мобилизации жирных кислот и сдерживания протеолиза, что сберегает структурные белки организма. В норме кетоновые тела стимулируют выход инсулина из поджелудочной железы, что угнетает липолиз и таким образом ограничивает доставку липидов в печень и соответственно кетогенез. Во время голодания кетоновые тела являются одним из основных источников энергии для мозга [4]. В норме процессы синтеза и использования кетоновых тел уравновешены. Концентрация кетоновых тел в крови и в тканях обычно очень низка, поэтому содержание кетоновых кислот в плазме крови в норме присутствует в крайне низких количествах и составляет 0,1–0,3 ммоль (0,03–0,2 ммоль/л по ацетону).
Наличие кетоновых тел в моче всегда указывает на развитие патологического состояния в организме. Кетоновые тела удаляются с мочой в различных количествах: ацетон — 3–4%, ацетоуксусная кислота — 30–40%, β-гидроксимасляная — 60–70%.
Лабораторные тесты, выявляющие кетонурию, основаны на реакциях с ацетоацетатом и ацетоном, так как они не реагируют с β-оксибутиратом. Для качественного определения содержания кетоновых тел в моче используют цветные пробы Ланге, Легаля, Лестраде, Герхарда. Количество ацетоацетата в анализе мочи измеряют в плюсах (от одного + до четырех ++++). Присутствие +++ соответствует повышению уровня кетоновых тел в 400 раз, ++++ — в 600 раз. Физиологический кетоз может выявляться при голодании, тяжелой мышечной работе, у новорожденных [5].
Причины избыточного кетоза
Возникающая в патологических условиях гиперкетонемия связана с диссоциацией кетогенеза в печени и утилизацией кетоновых тел в других органах, то есть либо скорость синтеза кетоновых тел в печени превышает скорость их утилизации периферическими тканями организма, либо нарушена утилизации их как источника энергии в других органах.
Повышение содержания кетоновых тел в организме прежде всего вызывается дефицитом углеводов для обеспечения организма энергией, перегрузкой белками и жирами на фоне недостатка легкоперевариваемых углеводов в рационе, истощением организма, ожирением, нарушением эндокринной регуляции (сахарный диабет, тиреотоксикоз и др.), отравлением, травмами черепа и т. д. [4].
Интенсивное образование кетоновых тел происходит также при наличии дефицита оксалоацетата, так как последний является основным регулятором ЦТК. Обычно в клетке имеется баланс между образованием ацетил-КоА (из глюкозы, жирных кислот или аминокислот) и количеством оксалоацетата. Источником оксалоацетата является глюкоза (синтез из пирувата), поступление из фруктовых кислот самого цикла (яблочной, лимонной), образование из аспарагиновой кислоты. При недостаточном количестве оксалоацетата в плазме крови, наблюдаемом при патологических состояниях, концентрация кетоновых тел может значительно повышаться. Не успевая окисляться и представляя собой достаточно сильные органические кислоты, они вызывают развитие метаболического кетоацидоза.
Стимуляция кетогенеза при дефиците пищи, стрессе, длительной рвоте является компенсаторным процессом, в ходе которого восполняется энергетический дефицит за счет кетокислот.
Гиперкетонемия со сдвигом рН в кислую сторону может наблюдаться при угнетении цикла Кребса, в котором происходит «сгорание» кетоновых тел.
Скорость образования кетоновых тел зависит и от скорости окисления жирных кислот в печени, а процесс окисления ускоряется при усилении липолиза (распада жира) в жировой ткани. Интенсивное образование кетокислот происходит также при приеме с пищей так называемых кетогенных аминокислот (лейцина, тирозина, фенилаланина, изолейцина), некоторых белков и большого количества жиров [5].
При умеренном кетозе в крови циркулируют главным образом ацетоацетат и β-оксибутират. Ацетон образуется только при высоких концентрациях кетоновых тел и преимущественно удаляется через легкие.
Однако в экстремальных условиях из кетоновых тел с помощью глюконеогенеза может синтезироваться глюкоза, служащая источником энергии для работы центральной нервной системы.
Ацетоновые тела, накапливаясь в крови и тканях, оказывают ингибирующее действие на липолиз, в особенности это касается расщепления триглицеридов в адипоцитах. Снижение уровня липолиза в клетках жировой ткани приводит к уменьшению притока высших жирных кислот в гепатоциты и к снижению скорости образования ацетоновых тел и, следовательно, снижению их содержания в крови.
При дефиците энергии в результате изменения гормонального статуса и действия внутриклеточных механизмов регуляции нарастает скорость мобилизации жиров и усиливается глюконеогенез из аминокислот и глицерина. Липолиз активируется глюкагоном, адреналином. Длительная стимуляция кетогенеза или нарушение процессов кетолизиса приводят к изменению буферной емкости крови, а при содержании в чрезмерно высоких концентрациях кетоновых тел крови возникает угрожающий жизни декомпенсированный кетоацидоз.
Такая картина характерна при тяжелом течении сахарного диабета 1-го типа, гипогликемии, длительном голодании, стрессах различной этиологии, заболеваниях печени, тяжелой и длительной мышечной работе [6].
Кетоновые тела являются водорастворимыми кислотами, поэтому, в отличие от жирных кислот, они могут проходить через гематоэнцефалический барьер и служат, наряду с глюкозой, источником энергии для нервной ткани, особенно после 3–5 дней голодания, когда концентрация кетоновых тел в крови существенно увеличивается.
Сахарный диабет
Сахарный диабет 1-го типа является самой частой причиной кетоза и кетоацидоза. Ведущую роль в патогенезе кетоацидоза играет абсолютная инсулиновая недостаточность, приводящая к снижению утилизации глюкозы инсулинзависимыми тканями и, соответственно, гипергликемии и тяжелому энергетическому голоду в них. Инсулин влияет на все виды обмена. Дефицит инсулина при сахарном диабете является причиной резкого повышения в крови уровня всех контринсулярных гормонов (глюкагона, кортизола, катехоламинов, тироксина и др.). Они стимулируют мобилизацию липидов из жировых депо и доставку жирных кислот к органам, что является адаптивным механизмом, поставляющим альтернативный субстрат окисления в условиях снижения утилизации глюкозы клетками. Снижается активность липопротеинлипазы (ЛП-липазы) адипоцитов, поэтому свободные жирные кислоты не поступают в жировую ткань. Начинает преобладать эффект глюкагона, стимулирующий кетогенез в печени и гормончувствительную триацилглицерол-липазу (ТАГ-липазу) в адипоцитах.
При сахарном диабете в избыточном количестве начинает образовываться продукт β-окисления жирных кислот — ацетил-КоА. Однако способность цикла Кребса утилизировать данный продукт существенно снижена, так как β-окисление свободных жирных кислот в митохондриях зависит от их транспорта через мембрану митохондрий. А этот процесс является инсулинозависимым.
Если он затруднен, то жирные кислоты быстро превращаются в ацил-КоА, из которого образуется ацетил-КоА. Цикл Кребса и ресинтез жирных кислот не в состоянии полностью использовать избыточно образующийся ацетил-КоА, тем более что цитратный цикл тормозится этим избытком. В норме цитрат образуется путем конденсации оксалоацетата и ацетил-КоА с участием фермента цитрат-синтетазы. Активность последней при декомпенсации диабета снижена, в частности, из-за ингибирующего влияния АТФ, образующейся в избытке при окислении жирных кислот.
Уменьшено и образование оксалоацетата, так как в результате усиленного окисления свободных жирных кислот и повышенного глюконеогенеза увеличивается соотношение NADH/NAD+. Это ведет к недостаточному образованию цитрата и накоплению ацетил-КоА.
Этому процессу способствует увеличение содержания в печени карнитина (особенно в условиях активации эффектов глюкагона). Карнитин стимулирует транспорт жирных кислот в митохондрии клеток печени, где они подвергаются β-окислению, значительно ускоряя кетогенез.
В результате избыток ацетил-КоА становится источником образования больших количеств кетоновых тел: β-оксимасляной, ацетоуксусной кислот и ацетона.
У больных сахарным диабетом 1-го типа нарушается белковый обмен, который характеризуется преобладанием процессов катаболизма в результате активации процесса глюконеогенеза из глюкогенных аминокислот и снижения проницаемости клеточных мембран для аминокислот, что приводит к недостатку в тканях свободных аминокислот и нарушению процесса синтеза белка [6].
Гипоксия тканей вызывает активацию анаэробного гликолиза и повышение содержания лактата, который не может быть утилизирован в результате дефицита лактатдегидрогеназы на фоне дефицита инсулина. Это усугубляет нарушение кислотно-щелочного баланса организма и приводит к возникновению лактоацидоза.
Активное нарастание содержания кетоновых тел при декомпенсации сахарного диабета связано не только с усиленной продукцией, но со сниженной периферической утилизацией. При избыточном накоплении кетоновых тел буферная способность крови быстро истощается, что приводит к развитию декомпенсированного метаболического кетоацидоза. Кетоновые тела начинают выделяться с мочой в виде натриевых солей, а ацетон — также и в составе выдыхаемого воздуха.
Следствием увеличения концентрации ацетоацетата является ускорение образования ацетона, который обладает токсическим свойством. Он растворяется в липидных компонентах клеточных мембран и дезорганизует их. Страдают все ткани организма, а больше всего — клетки нервной ткани. Нарушается работа многих ферментативных систем. Это может проявляться потерей сознания [7].
При сахарном диабете 2-го типа сохраняется минимальная продукция инсулина, что объясняет редкость развития липолиза и состояния кетоацидоза и кетоацидотической комы при нарастании гипергликемии.
Гипогликемия и гипогликемические состояния
Кетотическая гипогликемия является самой частой причиной низкой концентрации глюкозы в крови. Стимуляция кетогенеза в условиях синдрома гипогликемии связана с активацией процессов липолиза при тяжелом энергетическом голоде. По мере истощения запасов гликогена в печени повышается содержание глюкагона, адреналина, норадреналина, кортизола, гормона роста, которые стимулируют глюконеогенез [8, 9].
Из жировой ткани интенсивно метаболизируются жирные кислоты для обеспечения источника энергии для мышечной деятельности и доступной глюкозы для центральной нервной системы. Жирные кислоты окисляются в печени с образованием кетоновых тел — ацетоацетата и β-оксибутирата.
Гипогликемии при дефиците ферментов
Нарушения обмена гликогена, связанные с его патологическим депонированием, проявляются гликогеновыми болезнями. Это группа наследственных нарушений, в основе которых лежит снижение или отсутствие активности ферментов, катализирующих реакции синтеза (агликогенозы) или распада гликогена (гликогенозы).
Дефект фермента глюкозо-6-фосфатазы (болезнь Гирке). Первичное нарушение при болезни Гирке (гликогеноз 1-го типа) происходит на генетическом уровне. Оно состоит в полной или почти полной неспособности клеток продуцировать глюкозо-6-фосфатазу, обеспечивающую отщепление свободной глюкозы от глюкозо-6-фосфата. В результате этого гликогенолиз прерывается на уровне глюкозо-6-фосфата и дальше не идет. Дефосфорилирование с участием глюкозо-6-фосфатазы является ключевой реакцией не только гликогенолиза, но и глюконеогенеза, который, таким образом, при болезни Гирке также прерывается на уровне глюкозо-6-фосфата.
Возникновение устойчивой гипогликемии, которая в реальных условиях неизбежна из-за непоступления в кровь глюкозы как конечного продукта гликогенолиза и глюконеогенеза, в свою очередь приводит к постоянной повышенной секреции глюкагона как стимулятора гликогенолиза. Глюкагон, однако, в условиях прерывания этого процесса способен лишь без пользы для организма непрерывно стимулировать его начальные стадии.
Психическое и соматическое развитие, а также биохимический статус (повышение уровня триглицеридов, холестерина, гиперурикемия, гипофосфатемия) у этих больных резко нарушены. Содержание глюкозы в плазме натощак постоянно снижено, в связи с чем даже при кратковременном голодании развиваются гипогликемические судороги, кетонурия и метаболический ацидоз. Последний обусловлен не только гиперкетонемией, но и повышенным накоплением и образованием в крови пирувата и лактата, что является результатом нарушенного глюконеогенеза. Характерными чертами заболевания являются: олигофрения, задержка роста, ожирение, остеопороз, большой живот (следствие увеличения печени и почек), ксантоматоз, липемия сетчатки, геморрагический диатез.
Диагноз основывается на данных клинической картины, сниженного содержания глюкозы и повышенной концентрации липидов и лактата в крови. Уровень глюкозы в плазме практически не меняется после введения глюкагона. Однако содержание лактата в крови после его введения возрастает. Биопсия печени, специальные гистохимические методы подтверждают недостаточность соответствующих ферментов [10].
Некоторые гипоталамо-гипофизарные синдромы могут сопровождаться гипогликемией: синдром Лоренса–Муна–Бидля–Борде, синдром Дебре–Мари, синдром Пехкранца–Бабинского (адипозогенитальная дистрофия).
Синдром Лоренса–Муна–Бидля–Борде характеризуется ожирением, гипогонадизмом, умственной отсталостью, дегенерацией сетчатки, полидактилией, глубокими дегенеративными изменениями гипоталамо-гипофизарной системы.
Синдром Дебре–Мари — заболевание обусловлено гиперфункцией задней доли гипофиза и гипофункцией аденогипофиза. Проявляется в раннем детском возрасте. Больные инфантильны, низкорослы, с избыточной массой. В клинической картине типично нарушение водного обмена с олигурией и олигодипсией, плотность мочи высокая. Психическое развитие не нарушено.
Синдром Пехкранца–Бабинского — причиной заболевания считают органические и воспалительные изменения гипоталамуса, которые ведут к ожирению, аномалиям развития скелета и гипоплазии половых органов.
Ожирение
Бурное нарастание ожирения во всех возрастных группах людей в большей степени связано с изменением образа жизни: снижение двигательной активности (компьютеризация, автомобилизация, урбанизация), изменения характера питания (переедание) и т. д. Избыточное поступление энергии или снижение ее затраты приводит к увеличению массы тела и развитию ожирения.
Жировая ткань обладает высокой метаболической активностью. В ней непрерывно совершаются интенсивные процессы обмена веществ, такие как синтез и гидролиз липидов, синтез жирных кислот, в том числе из углеводов, их этерификация в триглицериды или нейтральный жир, депонирование и расщепление их с образованием жирных кислот, использование последних для энергетических целей.
Ожирение приводит к значительным метаболическим и обменным нарушениям. Они характеризуются гиперинсулинизмом и нарушением толерантности к глюкозе; инсулинорезистентностью, вызываемой нарушением инсулинорецепторных взаимоотношений; увеличением содержания свободных жирных кислот в крови, склонностью к кетогенезу при голодании и к гипертриглицеридемии. При ожирении понижается активность липолитических ферментов в жировой ткани: липазы триглицеридов, что приводит к их накоплению, и липопротеинлипазы. Расщепление липопротеидов снижается. Гипертрофированные адипоциты слабее, чем гиперплазированные, реагируют на адреналин, норадреналин и другие липолитические вещества [11].
Важным проявлением нарушения межуточного обмена при ожирении является кетоз, связанный с повышенным липолизом, избыточным поступлением свободных жирных кислот в печень. Скорость реакции в ЦТК снижена, так как оксалоацетат используется для глюконеогенеза. В результате скорость образования ацетил-КоА превышает способность ЦТК окислять его. Ацетил-КоА используется для синтеза кетоновых тел. Из-за избытка кетоновых тел нарушается их утилизация.
Этому способствует наблюдающаяся гипогликемия, гиперлипидемия, кетонемия при применении длительной гипокалорийной диеты. А сопутствующий дефицит углеводов тормозит использование ацетил-КоА в цикле Кребса. При дефиците углеводов в организме возникает недостаток энергии в клетках. Усиливается липолиз [12].
Избыток неэстерифицированных жирных кислот, поступающих в печень, вызывает развитие жировой инфильтрации в ней, что нарушает окисление и выведение липопротеидов из печени, обуславливая накопление кетоновых тел. Для эффективного использования продуктов распада жира необходимы продукты углеводного обмена — жиры «сгорают» в пламени углеводов.
Окончание статьи читайте в следующем номере.
ФГБОУ ВО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва