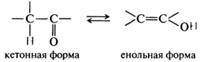
кетонная форма щавелевоуксусной кислоты
ЩАВЕЛЕВО-УКСУСНАЯ КИСЛОТА
Щавелево-уксусная кислота — дикарбоновая кислота, HOOC-C(OH) = CH—COOH. Щавелево-уксусная кислота является исходным веществом важнейшего метаболического цикла — цикла трикарбоновых кислот (см. Три-карбоновых кислот цикл). Недостаток щавелево-уксусной кислоты нарушает нормальное течение этого цикла и вызывает серьезные расстройства обмена веществ и энергии (см.). Щавелево-уксусная кислота является веществом, связывающим между собой углеводный обмен (см.) и обмен аминокислот (схем.), кроме того, она принимает участие в процессах трансаминирования (см.).
В природе щавелево-уксусная кислота существует в виде двух таутомерных форм (см. Таутомерия) — енольной и кетонной (HOOC—CO—CH2—COOH, кетоянтарная кислота) и в виде циси транс-изомеров (см. Изомерия). Транс-изомер щавелево-уксусная кислота называют также оксифумаровой кислотой (см. Фумаровая кислота), транс-изомер — оксималеиновой кислотой. Соли и эфиры щавелево-уксусная кислота называют оксалоацетатами.
Молекулярный вес (масса) щавелево-уксусной кислоты равен 132,07. Цис-изомер представляет собой бесцветные кристаллы с t°пл 152°, растворимые в воде, спирте, ацетоне, этилацетате, нерастворимые в бензоле и хлороформе. Транс-изомер — бесцветные кристаллы с t°пл 184°, при нагревании до 50° он переходит в транс-изомер. В кислых растворах щавелево-уксусная кислота декарбоксилируется (см. Декарбоксилирование). Количественно щавелево-уксусная кислота определяют колориметрически (см. Колориметрия) в виде 2,4-динитрофенилгидразона или манометрически по объему диоксида углерода (см. Ангидрид угольной кислоты), выделившегося при декарбоксилировании щавелево-уксусной кислоты. В организме животных и человека щавелево-уксусная кислота синтезируется из пировиноградной кислоты (см.) и диоксида углерода CO2 или образуется из аспарагиновой кислоты (см.) в процессе трансаминирования.
При недостатке щавелево-уксусной кислоты в печени накапливаются ацетильные группы, не способные к окислению, которые начинают быстро превращаться в кетоновые тела (см.). Их избыточное образование ведет к развитию метаболического ацидоза (см.) и другим патологическим состояниям. Кетоз, обычно сопутствующий нарушению баланса между окислением жиров (см.) и катаболизмом углеводов (см.), возникает во всех случаях относительной нехватки щавелево-уксусной кислоты по сравнению с КоА, когда ацетил-КоА не может полностью вступить в реакцию конденсации с оксалоацетатом (то есть в первую реакцию цикла трикарбоновых кислот). Такой недостаток щавелево-уксусной кислоты может создаться в условиях необходимости метаболизирования в печени больших количеств этилового спирта, при голодании (см.) или сахарном диабете (см. Диабет сахарный).
Библиогр.: Березов Т. Т. и Коровкин Б. Ф. Биологическая химия, с. 203, 512, М., 1982; Крю Ж. Биохимия Медицинские и биологические аспекты, пер. с франц., с. 372, М., 1979.
Кето-енольная таутомерия β – дикарбонильных соединений (ацетилацетон, ацетоуксусный эфир, щавелевоуксусная кислота). Реакции кетонной и енольной форм ацетоуксусного эфира.
Кето-енольная таутомерия. Таутомерия присуща различным классам веществ, чаще гетерофункциональным соединениям. Таутомерия — способность химических соединений существовать в виде двух иди нескольких, находящихся в равновесии, структурных изомеров.
В большинстве случаев таутомерные превращения сопровождаются переносом протона от одного атома к другому, поэтому такие виды таутомерии объединяются общим понятием прототропной таутомерии. Одной из разновидностей прототропной таутомерии является кето-енольная таутомерия, сущность которой состоит в переносе протона от α-СН-кислотного центра карбонильного соединения к атому кислорода карбонильной группы как основному центру:
Кето-енольная таутомерия свойственна β-оксокислотам и их сложным эфирам, а также 1,3-дикетонам и соединениям других классов, содержащим карбонильную группу. Енольная форма термодинамически менее выгодна, чем кетонная. Показано, что енолизация является эндотермическим процессом. Однако в 1,3-дикарбонильных соединениях енольная форма стабилизирована за счет образования внутримолекулярных водородных связей, а также за счет сопряжения.
Ниже приведены таутомерные формы одного из важнейших 1,3-дикарбонильных соединений — ацетоуксусного эфира:
Положение равновесия таутомеров зависит от строения карбонильного соединения. Алифатические альдегиды и кетоны, у которых в углеводородных радикалах отсутствуют электроноакцепторные заместители, существуют практически только в оксоформе (кетонной). Заметные количества енольной формы в равновесной смеси появляются тогда, когда СН-кислотность карбонильного соединения усиливается за счет дополнительной электроноакцепторной группы, например, у ацетона содержание енольной формы низкое, а у ацетилацетона она преобладает в равновесной смеси.
При наличии в β-положении объемных заместителей устойчивость енольной формы понижается, так как объемные группы препятствуют образованию внутримолекулярной водородной связи. Так, содержание енольной формы снижается в ряду: ацетоуксусный эфир — метил ацетоуксусный эфир — этил ацетоуксусный эфир.
Влияние на состояние кето-енольного равновесия оказывает и растворитель: полярные растворители стабилизируют кетонную форму, неполярные — енольную. Считают, что енольная форма за счет внутримолекулярной водородной связи менее полярна и хуже сольватируется полярными растворителями.
Таутомерные превращения дикарбонильных соединений протекают с довольно низкой скоростью, что позволило выделить таутомеры некоторых веществ в индивидуальном виде. При низких температурах кетонная форма устойчива и не подвергается енолизации в течение довольно долгого времени. При пропускании сухого хлороводорода через суспензию натриевого енолята ацетоуксусного эфира в диметиловом эфире была выделена чистая енольная форма:
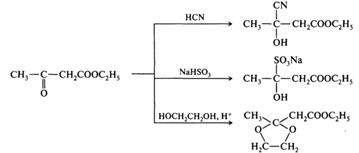
Существование двух таутомерных форм проявляется в химических свойствах β-оксоэфиров. Ацетоуксусный эфир может вступать в реакции как в кетонной, так и в енольной форме. Как кетон он способен присоединять циановодородную кислоту и гидросульфит натрия, а в реакции с этиленгликолем образовывать циклический ацеталь:
В реакциях с такими нуклеофилами, как гидразин и его производные или гидроксиламин, ацетоуксусный эфир образует пятичленные гетероциклические соединения.
В енольной форме ацетоуксусный эфир при взаимодействии с хлоридом фосфора(V) превращается в эфир галогенозамещенной α,β-ненасыщенной кислоты:
Качественной пробой для обнаружения енольной формы ацетоуксусного эфира служит реакция с хлоридом железа(Ш), приводящая к появлению вишневого окрашивания реакционной смеси (качественная реакция).
Для количественного определения содержания енольной формы в равновесной смеси применяют титрование бромом (качественная реакция). Бромирование двойной связи протекает значительно быстрее, чем енолизация карбонильного соединения, поэтому при быстром проведении титрования удается довольно точно установить содержание енольной формы:
Продукт бромирования отщепляет бромоводород, превращаясь в производное кетонной формы. Таким образом, с помощью усовершенствованных методик титрования можно определить содержание енольной формы практически во всем диапазоне концентраций.
Оксалоацетат
Оксалоацетат, щавелевоуксусная кислота (HO2C-C(O)-CH2-CO2H) — это четырехуглеродная двухосновная оксикислота. Существует в виде таутомера HO2C-C(OH)=CH-CO2H. [1]
Содержание
Получение
Эфиры
Диэтилоксалоацетат (диэтиловый эфир щевелевоуксусной кислоты, щавелевоуксусный эфир) — может быть получен конденсацией этилацетата с диэтилоксалатом в присутствии металлического натрия или этилата натрия. [2] [3] Применяется в органическом синтезе.
Биологическая роль
Оксалоацетат является промежуточным соединением в цикле Кребса и глюконеогенезе. Оксалоацетат образуется при окислении малата, катализируемого малатдегидрогеназой. Оксалоацетат взаимодействует с ацетил-КоА, образуя цитрат, при участии фермента цитратсинтазы. [1]
Также оксалоацетат образуется в мезофилле растений, путем конденсации углекислого газа с фосфоенолпируватом, катализируемой фосфоенолпируват карбоксикиназой. Оксалоацетат образуется из пирувата в анаплеротической реакции. [4]
Из щавелевоуксусной кислоты и ацетил кофермента А по типу альдольной конденсации происходит биосинтез лимонной кислоты.
Примечания
Полезное
Смотреть что такое «Оксалоацетат» в других словарях:
ОКСАЛОАЦЕТАТДЕКАРБОКСИЛАЗА — (оксалоацетат карбоксилаза), фермент класса лиаз, катализирующий декар боксилирование щавелевоуксусной к ты (оксалоацетата) с образованием пировиноградной к ты (пирувата): НООСС(О)СН 2 СООН СН 3 С(О)СООН + СО 2 Молекула О. из бактерий Klebsiella… … Химическая энциклопедия
Цикл трикарбоновых кислот — Цик … Википедия
ТРИКАРБОНОВЫХ КИСЛОТ ЦИКЛ — (цикл Кребса), цик лич. последовательность ферментативных р ций (схема 1; назв. неионизир. форм к т см. в ст. Обмен веществ), в к рых осуществляются превращения ди и трикарбоновых к т, образующихся как промежут. продукты в организме животных, в… … Химическая энциклопедия
Аспарагин — Аспарагин … Википедия
Кребса цикл — Цикл трикарбоновых кислот (цикл Кребса, цитратный цикл) центральная часть общего пути катаболизма, циклический биохимический аэробный процесс, в ходе которого происходит превращение двух и трёхуглеродных соединений, образующихся как промежуточные … Википедия
Лимоннокислый цикл — Цикл трикарбоновых кислот (цикл Кребса, цитратный цикл) центральная часть общего пути катаболизма, циклический биохимический аэробный процесс, в ходе которого происходит превращение двух и трёхуглеродных соединений, образующихся как промежуточные … Википедия
ЦТК — Цикл трикарбоновых кислот (цикл Кребса, цитратный цикл) центральная часть общего пути катаболизма, циклический биохимический аэробный процесс, в ходе которого происходит превращение двух и трёхуглеродных соединений, образующихся как промежуточные … Википедия
Цикл Кребса — Цикл трикарбоновых кислот (цикл Кребса, цитратный цикл) центральная часть общего пути катаболизма, циклический биохимический аэробный процесс, в ходе которого происходит превращение двух и трёхуглеродных соединений, образующихся как промежуточные … Википедия
Цикл лимонной кислоты — Цикл трикарбоновых кислот (цикл Кребса, цитратный цикл) центральная часть общего пути катаболизма, циклический биохимический аэробный процесс, в ходе которого происходит превращение двух и трёхуглеродных соединений, образующихся как промежуточные … Википедия
Цитратный цикл — Цикл трикарбоновых кислот (цикл Кребса, цитратный цикл) центральная часть общего пути катаболизма, циклический биохимический аэробный процесс, в ходе которого происходит превращение двух и трёхуглеродных соединений, образующихся как промежуточные … Википедия
Электронное и пространственное строение пептидной группы.
63 кДж/моль). Таким образом, электронное строение предопределяет достаточно жесткую плоскую структуру пептидной группы. α-Углеродные атомы аминокислотных остатков располагаются в плоскости пептидной группы по разные стороны от связи С–N, т. е. в более выгодном транс-положении: боковые радикалы R аминокислотных остатков в этом случае будут наиболее удалены друг от друга в пространстве.
Первичная структура пептидов и белков — это аминокислотная последовательность, т. е. порядок чередования α-аминокислотных остатков. Для высокомолекулярных полипептидов и белков наряду с первичной структурой характерны более высокие уровни организации, которые принято называть вторичной, третичной и четвертичной структурами.
Пространственная структура белков способна нарушаться под влиянием ряда факторов — повышенной температуры, изменения рН среды, облучения ультрафиолетовым светом или рентгеновскими лучами, механическом воздействии (например, сильном перемешивании растворов), действии химических агентов (мочевины, хлорида гуанидиния, меркаптоэтанола, додецилсульфата натрия, солей). Разрушение природной, нативной макроструктуры белков называется денатурацией.
При денатурации разрушаются, как правило, нековалентные взаимодействия, стабилизирующие структуру белка. Первичная структура при денатурации сохраняется.
У денатурированных белков снижается растворимость, а главное — исчезает биологическая активность. Денатурация может быть обратимой или необратимой. При обратимой денатурации, удалив диализом денатурирующие агенты, можно вновь получить активный (ренатурированный) белок.
56. Оксокислоты: номенклатура, классификация; химические свойства как гетерофункциональных соединений; специфические реакции. Представители: глиоксиловая, пировиноградная, ацетоуксусная, щавелевоуксусная,a-оксоглутаровая.
Оксокарбоновыми кислотами (оксокислотами) называются, соединения, молекулы которых содержат наряду с карбоксильной группой оксогруппу, т. е, это альдегидо- или кетонокислоты. Оксокислоты могут содержать одну, две или более карбоксильных групп. По взаимному расположению функциональных групп различают α-, β-, γ-оксокарбоновые кислоты; существуют также оксокислоты и с иным расположением функциональных групп.
Многие оксокислоты являются важными метаболитами, участвующими в обмене веществ. Биологическая роль α-оксокислот заключается также в том, что они являются интермедиатами в биосинтезе α-аминокислот в живых организмах.
В названиях альдегидо- и кетонокислот наличие карбонильной группы обозначают префиксом оксо-. Для некоторых оксокислот укоренились тривиальные названия (пировиноградная, левулиновая); для оксокислот, участвующих в биохимических циклах в живых организмах, используются традиционно сложившиеся в биохимической литературе названия — ацетоуксусная, щавелевоуксусная, кетоглутаровая и др.:
Оксокислоты проявляют многие свойства, характерные как для карбоновых кислот, так и для альдегидов и кетонов. Оксокислоты образуют производные по карбоксильной группе — соли, сложные эфиры, амиды и т.д., по оксогруппе — оксимы, гидразоны, гидроксинитрилы и т. д.
Химические свойства оксокислот существенно зависят от взаимного расположения функциональных групп. Обе группы оказывают друг на друга определенное влияние. В частности, при близком их расположении наблюдается взаимное усиление электрофильных свойств атомов углерода карбонильной и карбоксильной групп и, как следствие, усиление их реакционной способности при взаимодействии с нуклеофилами.
Кислотные свойства оксокарбоновых кислот снижаются по мере удаления оксогруппы от карбоксильной группы.В этом случае наблюдается четкая закономерность (как, например, и для галогенозамещенных кислот): по мере удаления электроноакцепторной оксогруппы от карбоксильной группы кислотные свойства оксокислоты снижаются вследствие затухания отрицательного индуктивного эффекта.
α-Оксокислоты, у которых карбонильная группа находится в непосредственном соседстве с электроноакцепторной карбоксильной группой, легко вступают в реакции нуклеофильного присоединения. Например, некоторые α-оксокислоты легко присоединяют воду и образуют устойчивые гидратные формы:
Под действием разбавленных минеральных кислот α-оксокислоты подвергаются декарбоксилированию; нагревание с концентрированной серной кислотой приводит к декарбонилированию, т. е. отщеплению оксида углерода(II):
Эфиры α-оксокислот присоединяют магнийорганические соединения селективно по кетонной группе; здесь проявляется большая активность в реакциях с нуклеофилами кетонной группы, чем сложноэфирной:
Некоторые а-оксокислоты из-за наличия в молекуле СН-кислотного центра вступают в реакции конденсации типа альдольной. Например, пировиноградная кислота превращается при длительном стоянии в соответствующий альдоль, который затем отщепляет воду, образуя лактон:
β-Оксокислоты среди оксокислот имеют наибольшее практическое значение. Специфика их химических свойств обусловлена наличием сильного СН-кислотного центра, возникновение которого связано с β-расположением функциональных групп. Именно в ряду βр-оксокислот наиболее ярко проявляется один из видов динамической изомерии — кето-енольная таутомерия.
Декарбоксилирование. β-Оксокислоты легко подвергаются декарбоксилированию, что обусловлено образованием шестизвенного переходного состояния с низкой энергией. Ацетоуксусная кислота при нагревании декарбоксилируется с образованием ацетона:
Специфическим свойством γ- и δ-оксокислот является их способность к другому виду таутомерии — кольчато-цепной таутомерии. Возникновение этого вида таутомерии обусловлено тем, что гидроксильная группа как нуклеофил обратимо присоединяется к кетонной группе:
Открытая (ациклическая) форма γ- и δ- оксокислот находится в равновесии с соответствующим гидроксилактоном — соединением, которое, с одной стороны, можно рассматривать как циклический полуацеталь, а с другой — как сложный эфир. Кольчато-цепная таутомерия более известна для моносахаридов.
Гидроксилактоны при нагревании или в присутствии водоотнимающих средств отщепляют воду и превращаются в ненасыщенные лактоны. При этом образуются два изомера, отличающихся положением двойной связи:
Преимущественное образование изомерного β-ангеликолактона объясняется наличием π,π-сопряженной системы.
Ароматические γ-оксокислоты, вступают во внутримолекулярную реакцию ацилирования по Фриделю—Крафтсу с образованием нового шестичленного цикла. Эта реакция представляет собой важный в синтетическом отношении способ получения соединений с конденсированными бензольными кольцами. Например, так получают в промышленности антрахинон:
Представители.
Глиоксиловая кислота (глиоксалевая кислота) — СНО-СООН — единственная возможная α-альдегидокислота. Глиоксиловая кислота часто содержится в недозрелых фруктах. Она образует серебряное зеркало с аммиачным серебром, образует оксим и др.. При восстановлении она дает гликолевую кислоту, при окислении — щавелевую кислоту.
Пировиноградная кислота— СН3-СО-СООН — органическая кетокислота. Пируваты — важные химические соединения в биохимии. Они являются конечным продуктом метаболизма глюкозы в процессе гликолиза. Пировиноградная кислота является «точкой пересечения» многих метаболических путей. Пируват может быть превращён обратно в глюкозу в процессе глюконеогенеза, или в жирные кислоты или энергию через ацетил-КоА, в аминокислоту аланин, или в этанол. Таким образом пируват объединяет несколько ключевых метаболических процессов клетки и является универсальной «метаболической валютой» живой клетки.
Ацетоуксусная кислота (3-оксобутановая кислота) — CH3-C(O)-CH2-COOH — одноосновная, первый представитель β-кетокислот, участвует в обмене веществ. Является неустойчивым соединением. Большое количество ацетоуксусной кислоты используют для получения ацетоуксусного эфира (этилацетоацетата). Является метаболитом окисления жирных кислот, характерное увеличение ацетоуксусной кислоты в плазме крови наблюдается при весьма серьёзных патологических процессах, так она накапливается в организме у больных сахарным диабетом (относится к кетоновым телам).
Щавелевоуксусная кислота (оксалоацетат)— HООC-C(O)-CH2-CООH — это четырехуглеродная двухосновная кетокислота. Существует в виде таутомера HООC-C(OH)=CH-CООH. Оксалоацетат является промежуточным соединением в цикле Кребса и глюконеогенезе. Из щавелевоуксусной кислоты и ацетил кофермента А по типу альдольной конденсации происходит биосинтез лимонной кислоты.
α-Кетоглутаровая кислота (a—оксоглутаровая) — НООС-(СН2)2-СО-СООН— одно из двух кетоновых производных глутаровой кислоты. Анион α-кетоглутаровой кислоты, α-кетоглутарат (оксоглутарат) — важное биологическое соединение.
57. Кето-енольная таутомерия β – дикарбонильных соединений (ацетилацетон, ацетоуксусный эфир, щавелевоуксусная кислота). Реакции кетонной и енольной форм ацетоуксусного эфира.
Кето-енольная таутомерия. Таутомерия присуща различным классам веществ, чаще гетерофункциональным соединениям. Таутомерия — способность химических соединений существовать в виде двух иди нескольких, находящихся в равновесии, структурных изомеров.
В большинстве случаев таутомерные превращения сопровождаются переносом протона от одного атома к другому, поэтому такие виды таутомерии объединяются общим понятием прототропной таутомерии. Одной из разновидностей прототропной таутомерии является кето-енольная таутомерия, сущность которой состоит в переносе протона от α-СН-кислотного центра карбонильного соединения к атому кислорода карбонильной группы как основному центру:
Кето-енольная таутомерия свойственна β-оксокислотам и их сложным эфирам, а также 1,3-дикетонам и соединениям других классов, содержащим карбонильную группу. Енольная форма термодинамически менее выгодна, чем кетонная. Показано, что енолизация является эндотермическим процессом. Однако в 1,3-дикарбонильных соединениях енольная форма стабилизирована за счет образования внутримолекулярных водородных связей, а также за счет сопряжения.
Ниже приведены таутомерные формы одного из важнейших 1,3-дикарбонильных соединений — ацетоуксусного эфира:
Положение равновесия таутомеров зависит от строения карбонильного соединения. Алифатические альдегиды и кетоны, у которых в углеводородных радикалах отсутствуют электроноакцепторные заместители, существуют практически только в оксоформе (кетонной). Заметные количества енольной формы в равновесной смеси появляются тогда, когда СН-кислотность карбонильного соединения усиливается за счет дополнительной электроноакцепторной группы, например, у ацетона содержание енольной формы низкое, а у ацетилацетона она преобладает в равновесной смеси.
При наличии в β-положении объемных заместителей устойчивость енольной формы понижается, так как объемные группы препятствуют образованию внутримолекулярной водородной связи. Так, содержание енольной формы снижается в ряду: ацетоуксусный эфир — метил ацетоуксусный эфир — этил ацетоуксусный эфир.
Влияние на состояние кето-енольного равновесия оказывает и растворитель: полярные растворители стабилизируют кетонную форму, неполярные — енольную. Считают, что енольная форма за счет внутримолекулярной водородной связи менее полярна и хуже сольватируется полярными растворителями.
Таутомерные превращения дикарбонильных соединений протекают с довольно низкой скоростью, что позволило выделить таутомеры некоторых веществ в индивидуальном виде. При низких температурах кетонная форма устойчива и не подвергается енолизации в течение довольно долгого времени. При пропускании сухого хлороводорода через суспензию натриевого енолята ацетоуксусного эфира в диметиловом эфире была выделена чистая енольная форма:
Существование двух таутомерных форм проявляется в химических свойствах β-оксоэфиров. Ацетоуксусный эфир может вступать в реакции как в кетонной, так и в енольной форме. Как кетон он способен присоединять циановодородную кислоту и гидросульфит натрия, а в реакции с этиленгликолем образовывать циклический ацеталь:
В реакциях с такими нуклеофилами, как гидразин и его производные или гидроксиламин, ацетоуксусный эфир образует пятичленные гетероциклические соединения.
В енольной форме ацетоуксусный эфир при взаимодействии с хлоридом фосфора(V) превращается в эфир галогенозамещенной α,β-ненасыщенной кислоты:
Качественной пробой для обнаружения енольной формы ацетоуксусного эфира служит реакция с хлоридом железа(Ш), приводящая к появлению вишневого окрашивания реакционной смеси (качественная реакция).
Для количественного определения содержания енольной формы в равновесной смеси применяют титрование бромом (качественная реакция). Бромирование двойной связи протекает значительно быстрее, чем енолизация карбонильного соединения, поэтому при быстром проведении титрования удается довольно точно установить содержание енольной формы:
Продукт бромирования отщепляет бромоводород, превращаясь в производное кетонной формы. Таким образом, с помощью усовершенствованных методик титрования можно определить содержание енольной формы практически во всем диапазоне концентраций.