классификация кристаллических решеток по отношению к операциям симметрии
Савельев И.В. Курс общей физики, том I

Загрузить всю книгу 
Титульный лист
Главная редакция физико-математической литературы
Механика, колебания и волны,
КУРС ОБЩЕЙ ФИЗИКИ, ТОМ I
Главная цель книги — познакомить студентов прежде всего с основными идеями и методами физики. Особое внимание обращено на разъяснение смысли физических законов и на сознательное применение их. Несмотря на сравнительно небольшой объем, книга представляет собой серьезное руководство, обеспечивающее подготовку, достаточную для успешного усвоения в дальнейшем теоретической физики и других физических дисциплин.
Предисловие к четвертому изданию
При подготовке к настоящему изданию книга была значительно переработана. Написаны заново (полностью или частично) параграфы 7, 17, 18, 22, 27, 33, 36, 37, 40, 43, 68, 88. Существенные добавления или изменения сделаны в параграфах 2, 11, 81, 89, 104, 113.
Ранее, при подготовке ко второму и третьему изданиям были написаны заново параграфы 14, 73, 75. Существенные изменения или добавления были внесены в параграфы 109, 114, 133, 143.
Таким образом, по сравнению с первым изданием облик первого тома заметно изменился. Эти изменения отражают методический опыт, накопленный автором последние десять лет преподавания обшей физики в Московском инженерно-физическом институте.
Ноябрь 1969 г. И. Савельев
Из предисловия к четвертому изданию
Предлагаемая вниманию читателей книга представляет собой первый том учебного пособия по курсу общей физики для втузов. Автор в течение ряда лет преподавал общую физику в Московском инженерно-физическом институте. Естественно поэтому, что пособие он писал имея в виду прежде всего студентов инженерно-физических специальностей втузов.
При написании книги автор стремился познакомить учащихся с основными идеями и методами физической науки, научить их физически мыслить. Поэтому книга не является по своему характеру энциклопедичной, содержание в основном посвящено тому, чтобы разъяснить смысл физических законов и научить сознательно применять их. Не осведомленности читателя по максимально широкому кругу вопросов, а глубоких знаний фундаментальным основам физической пауки — вот что стремился добиться автор.
Физические типы кристаллических решеток



Классификация кристаллов
Кристаллическая решетка может обладать различными видами симметрии. Под симметрией кристаллической решетки понимается свойство решетки совпадать с самой собой при некоторых пространственных перемещениях.
Всякая решетка прежде всего обладает трансляционной симметрией, т. е. совпадает сама с собой при перемещении (трансляции) на величину периода идентичности[1]. Из других видов симметрии отметим симметрию по отношению к поворотам вокруг некоторых осей, а также к зеркальному отражению относительно определенных плоскостей.
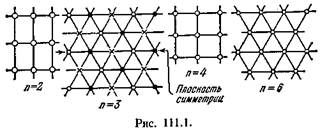
Если решетка совпадает сама с собой при повороте вокруг некоторой оси на угол 2л/n (следовательно, за один полный поворот вокруг оси решетка совпадает сама с собой п раз), то эта ось называется осью симметрии n-го порядка. Можно показать что, кроме тривиальной оси 1-го порядка, возможны только оси симметрии 2-го, 3-го, 4-го и 6-го порядков. Примеры структур, обладающих такими осями симметрии, показаны схематически на рис. 111.1 (белыми кружками, черными кружками и крестиками обозначены атомы разных сортов).
Плоскости, при зеркальном отражении от которых решетка совпадает сама с собой, называются плоскостями симметрии. Пример плоскости симметрии также дан на рис. 111.1.
Различные виды симметрии называются элементами симметрии кристаллической решетки. Кроме осей и плоскостей, возможны другие элементы симметрии, в рассмотрение которых мы, однако, входить не станем.
Кристаллическая решетка, как правило, обладает одновременно несколькими видами симметрии. Однако не всякое сочетание элементов симметрии оказывается возможным. Как показал выдающийся русский ученый Е. С. Федоров, возможны 230 комбинаций элементов симметрии, получившие название пространственных групп. Эти 230 пространственных групп разбиваются по признакам симметрии на 32 класса. Наконец, по форме элементарной ячейки все кристаллы делятся на семь кристаллографических систем (или сингоний), каждая из которых включает в себя несколько классов симметрии.
1. Триклинная система. Для нее характерно, что 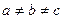
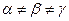
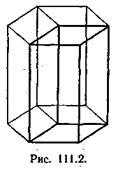
2. Моноклинная система. Два угла — прямые, третий (в качестве которого принято выбирать угол b) отличен от прямого. Следовательно, 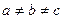
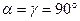
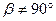
3. Ромбическая система. Все углы — прямые, все ребра — разные: 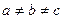
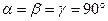
4. Тетрагональная система. Все углы — прямые, два ребра — одинаковые: 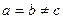
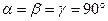
5. Ромбоэдрическая (или тригональная) система. Все ребра — одинаковые, все углы также одинаковые и отличные от прямого: 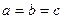
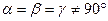
6. Гексагональная система. Ребра и углы между ними удовлетворяют условиям: 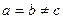
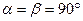
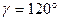
7. Кубическая система. Все ребра — одинаковые, все углы — прямые: a=b=c;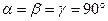
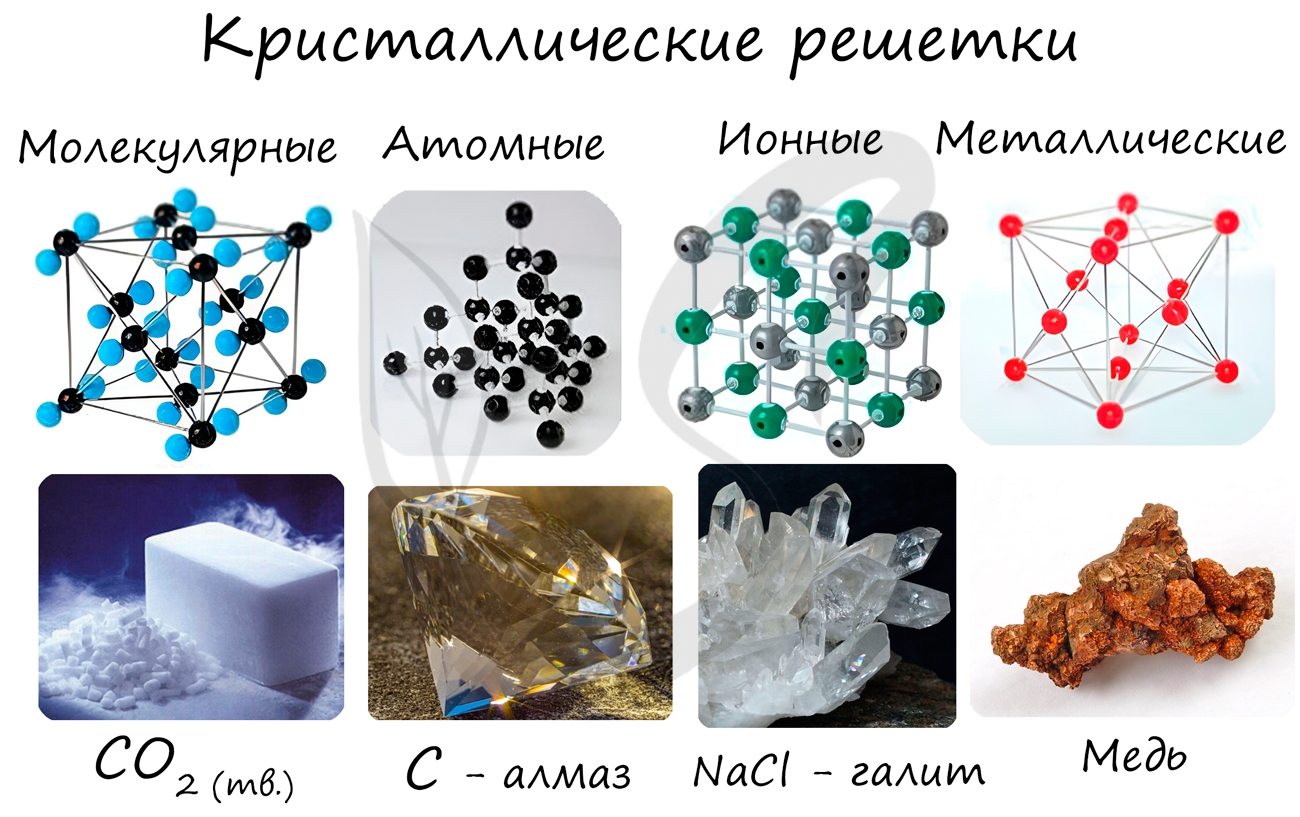
В зависимости от природы частиц, помещающихся в узлах кристаллической решетки, и от характера сил взаимодействия между частицами различают четыре типа кристаллических решеток и соответственно четыре типа кристаллов: ионные, атомные, металлические и молекулярные.
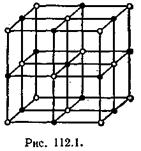
Типичным примером ионной решетки может служить изображенная на рис. 112.1 решетка каменной соли (NaCl). Эта решетка принадлежит к кубической системе. Белыми кружками изображены несущие положительный заряд ионы натрия, черными кружками — отрицательные ионы хлора. Как видно из рисунка, ближайшими соседями иона данного знака будут ионы противоположного знака. В газообразном состоянии NaCl состоит из молекул, в которых объединяются попарно ионы натрия с ионами хлора. Образующая молекулу группировка из иона Na и иона Сl утрачивает в кристалле обособленное существование. Ионный кристалл состоит не из молекул, а из ионов. Весь кристалл в целом можно рассматривать как одну гигантскую молекулу.
2. Атомные кристаллы. В узлах кристаллической решетки помещаются нейтральные атомы. Связь, объединяющая в кристалле (а также и в молекуле) нейтральные атомы, называется гомеополярной (или ковалентной). Силы взаимодействия при гомеополярной связи имеют также электрический (но не кулоновский) характер. Объяснение этих сил может быть дано только на основе квантовой механики.
Гомеополярная связь осуществляется электронными парами. Это означает, что в обеспечении связи между двумя атомами участвует по одному электрону от каждого атома. По этой причине гомеополярная связь имеет направленный характер. При гетерополярной связи каждый ион воздействует на все достаточно близкие к нему ионы. При гомеополярной связи воздействие направлено на тот атом, с которым у данного атома имеется совместная электронная пара. Гомеополярная связь может осуществляться только валентными, т. е. наименее связанными с атомом, электронами. Поскольку каждый электрон может обеспечить связь только с одним атомом, число связей, в которых может участвовать данный атом (число соседей, с которыми он может быть связан), равно его валентности.
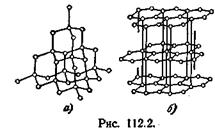
Такую же решетку, как у алмаза (решетку типа алмаза), имеют типичные полупроводники — германий (Ge) и кремний (Si). Для этой решетки характерно то, что каждый атом окружен четырьмя равноотстоящими от него соседями, расположенными в вершинах правильного тетраэдра. Каждый из четырех валентных электронов входит в электронную пару, связывающую данный атом с одним из соседей.
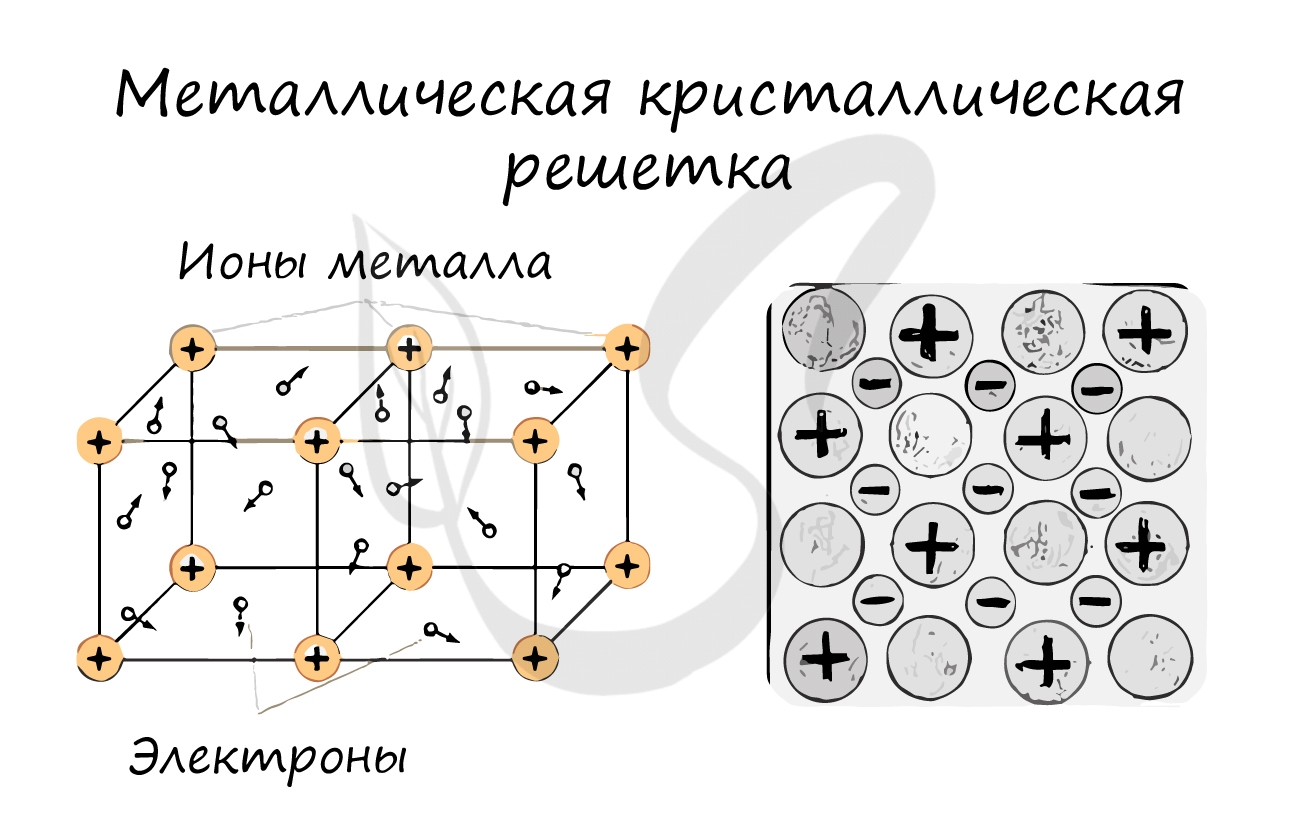
3. Металлические кристаллы. Во всех узлах кристаллической решетки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа, движутся электроны, отщепившиеся от атомов при образовании ионов. Эти электроны играют роль «цемента», удерживая вместе положительные ионы; в противном случае решетка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решетки и не могут ее покинуть.
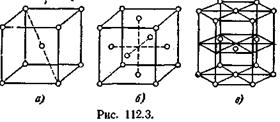
Большинство металлов имеет решетки одного из трех типов: кубическую объемно-центрированную (рис. 112.3, а), кубическую гранецентрированную (рис. 112.3, б) и так называемую плотную гексагональную (рис. 112.3, в). Последняя представляет собой гексагональную решетку с отношением с/а, равным 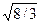
4. Молекулярные кристаллы. В узлах кристаллической решетки помещаются определенным образом ориентированные молекулы. Силы связи между молекулами в кристалле имеют ту же природу, что и силы притяжения между молекулами, приводящие к отклонению газов от идеальности. По этой причине их называют ван-дер-ваальсовскими силами. Молекулярные решетки образуют, например, следующие вещества: Н2, N2, О2, СО2, Н2О. Таким образом, обычный лед, а также так называемый сухой лед (твердая углекислота) представляют собой молекулярные кристаллы.
Кристаллическая решётка
Кристалли́ческая решётка — вспомогательный геометрический образ, вводимый для анализа строения кристалла. Решётка имеет сходство с канвой или сеткой, что даёт основание называть точки решётки узлами. Решёткой является совокупность точек, которые возникают из отдельной произвольно выбранной точки кристалла под действием группы трансляции. Это расположение замечательно тем, что относительно каждой точки все остальные расположены совершенно одинаково. Применение к решётке в целом любой из присущих ей трансляций приводит к её параллельному переносу и совмещению. Для удобства анализа обычно точки решётки совмещают с центрами каких-либо атомов из числа входящих в кристалл, либо с элементами симметрии.
Содержание
Общая характеристика
В зависимости от пространственной симметрии, все кристаллические решётки подразделяются на семь кристаллических систем. По форме элементарной ячейки они могут быть разбиты на шесть сингоний. Все возможные сочетания имеющихся в кристаллической решётке поворотных осей симметрии и зеркальных плоскостей симметрии приводят к делению кристаллов на 32 класса симметрии, а с учётом винтовых осей симметрии и скользящих плоскостей симметрии на 230 пространственных групп.
Помимо основных трансляций, на которых строится элементарная ячейка, в кристаллической решётке могут присутствовать дополнительные трансляции, называемые решётками Браве. В трёхмерных решётках бывают гранецентрированная (F), объёмноцентрированная (I), базоцентрированная (A, B или C), примитивная (P) и ромбоэдрическая (R) решётки Браве. Примитивная система трансляций состоит из множества векторов (a, b, c), во все остальные входят одна или несколько дополнительных трансляций. Так, в объёмноцентрированную систему трансляций Браве входит четыре вектора (a, b, c, ½(a+b+c)), в гранецентрированную — шесть (a, b, c, ½(a+b), ½(b+c), ½(a+c)). Базоцентрированные системы трансляций содержат по четыре вектора: A включает вектора (a, b, c, ½(b+c)), B — вектора (a, b, c, ½(a+c)), а C — (a, b, c, ½(a+b)), центрируя одну из граней элементарного объёма. В системе трансляций Браве R дополнительные трансляции возникают только при выборе гексагональной элементарной ячейки и в этом случае в систему трансляций R входят вектора (a, b, c, 1 /3(a+b+c), — 1 /3(a+b+c)).
Кристаллические решетки
Кристаллической решеткой называют пространственное расположение атомов или ионов в кристалле. Точки кристаллической решетки, в которых расположены атомы или ионы, называют узлами кристаллической решетки.
Кристаллические решетки подразделяют на молекулярные, атомные, ионные и металлические.
Очень важно не перепутать вид химической связи и кристаллической решетки. Помните, что кристаллические решетки отражают пространственное расположение атомов.
Молекулярная кристаллическая решетка
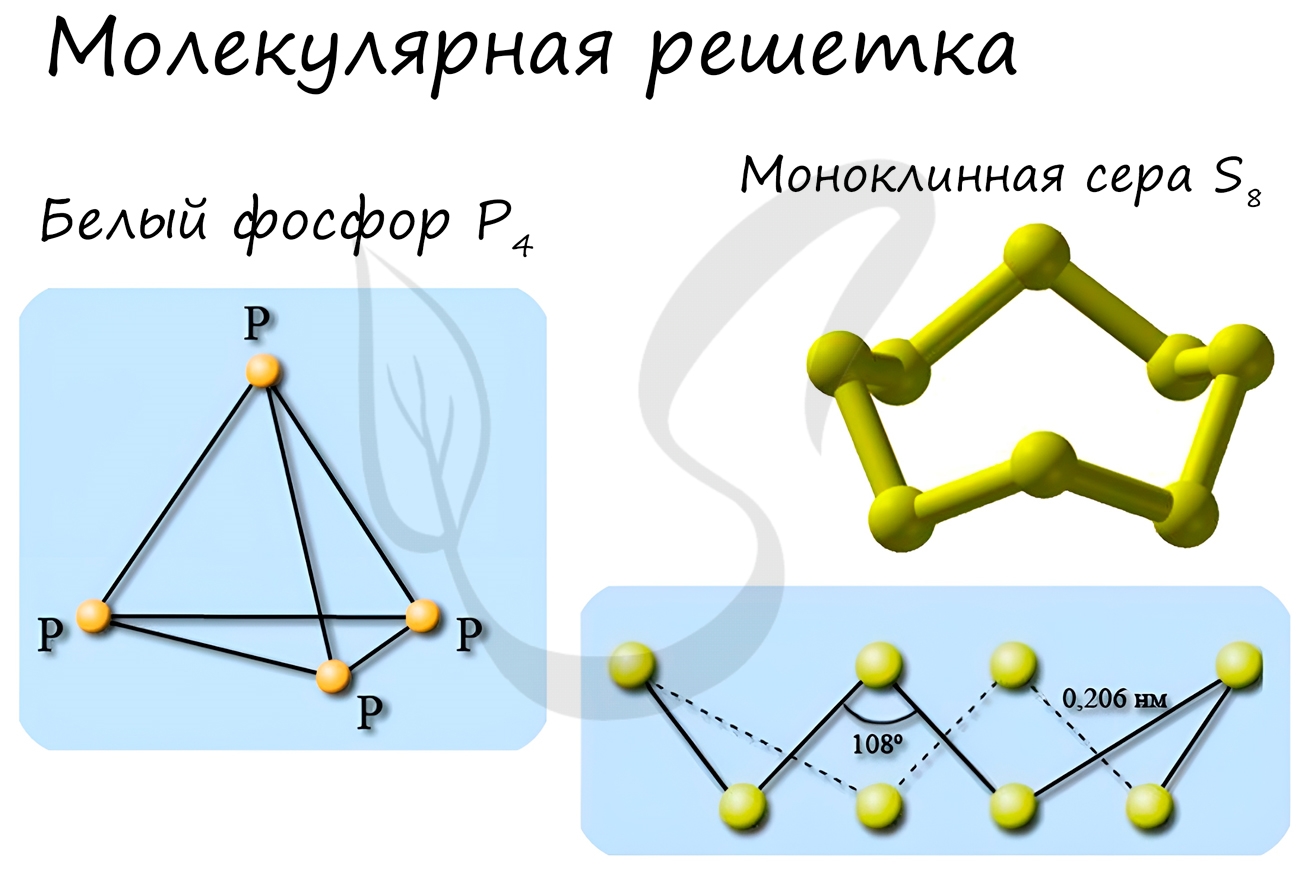
В узлах молекулярной решетки расположены молекулы. При обычных условиях молекулярную решетку имеют большинство газов и жидкостей. Связи чаще всего ковалентные полярные или неполярные.
Классическим примером вещества с молекулярной решеткой является вода, так что ассоциируйте свойства этих веществ с водой. Вещества с молекулярной решеткой непрочные, имеют небольшую твердость, летучие, легкоплавкие, способны к возгонке, для них характерны небольшие температуры кипения.
Примеры: NH3, H2O, Cl2, CO2, N2, Br2, H2, I2. Особо хочется отметить белый фосфор, ромбическую, пластическую и моноклинную серу, фуллерен. Эти аллотропные модификации мы подробно изучили в статье, посвященной классификации веществ.
Ионная кристаллическая решетка
В узлах ионной решетки находятся атомы, связанные ионной связью. Этот тип решетки характерен для веществ, обладающих ионной связь: соли, оксиды и гидроксиды металлов.
Металлическая кристаллическая решетка
В узлах металлической решетки находятся атомы металла. Этот тип решетки характерен для веществ, образованных металлической связью.
Ассоциируйте свойства этих веществ с медью. Они обладают характерным металлическим блеском, ковкие и пластичные, хорошо проводят электрический ток и тепло, имеют высокие температуры плавления и кипения.
Примеры: Cu, Fe, Zn, Al, Cr, Mn.
Атомная кристаллическая решетка
В узлах атомной решетки находятся атомы, связанные ковалентной полярной или неполярной связью.
Ассоциируйте эти вещества с песком. Они очень твердые, очень тугоплавкие (высокая температура плавления), нелетучие, прочные, нерастворимы в воде.
Примеры: SiO2, B, Ge, SiC, Al2O3. Особенно хочется выделить: алмаз и графит (C), красный и черный фосфор (P).
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Классификация кристаллических решеток
Кристалли́ческая решётка — пространственное периодическое расположение атомов или ионов в кристалле. Для описания кристаллической решётки достаточно знать расположение частиц в элементарной ячейке кристалла, повторением которой образуется вся кристаллическая решётка.
Содержание
Общая характеристика
Существует огромное количество кристаллических структур. Их объединяет главное свойство кристаллического состояния вещества — закономерное положение атомов в кристаллической решётке. Одно и то же вещество может кристаллизоваться в разных кристаллических решётках и обладать весьма различными свойствами (классический пример графит — алмаз). В случае простых веществ это явление называется аллотропией, в общем случае любых химических соединенй — полиморфизмом. В то же время, разные вещества могут образовывать однотипные, или изоморфные, решётки, как, например, решётки многих металлов: меди, алюминия, серебра, золота. Иногда происходит замещение атомов в кристаллической решётке на атомы другого химического элемента с образованием твёрдого раствора.
В зависимости от пространственной симметрии, все кристаллические решётки подразделяются на семь кристаллических систем. По форме элементарной ячейки они могут быть разбиты на шесть сингоний. Все возможные сочетания имеющихся в кристаллической решётке поворотных осей симметрии и зеркальных плоскостей симметрии приводят к делению кристаллов на 32 класса симметрии, а с учётом винтовых осей симметрии и скользящих плоскостей симметрии на 230 пространственных групп.
Помимо основных трансляций, на которых строится элементарная ячейка, в кристаллической решётке могут присутствовать дополнительные трансляции, называемые решётками Браве. В трёхмерных решётках бывают гранецентрированная (F), объёмноцентрированная (I), базоцентрированная (A, B или C), примитивная (P) и ромбоэдрическая (трансляций состоит из множества векторов (a, b, c), во все остальные входят одна или несколько дополнительных трансляций. Так, в объёмноцентрированную систему трансляций Браве входит четыре вектора (a, b, c, ½(a+b+c)), в гранецентрированную — шесть (a, b, c, ½(a+b), ½(b+c), ½(a+c)). Базоцентрированные системы трансляций содержат по четыре вектора: A включает вектора (a, b, c, ½(b+c)), B — вектора (a, b, c, ½(a+c)), а C — (a, b, c, ½(a+b)), центрируя одну из граней элементарного объёма. В системе трансляций Браве R дополнительные трансляции возникают только при выборе гексагональной элементарной ячейки и в этом случае в систему трансляций R входят вектора (a, b, c, 1 /3(a+b+c), — 1 /3(a+b+c)).