клеточная структура содержащая генетический материал в форме днк называется
Урок по биологии на тему «Особенности строения прокариотической клетки»
Разделы: Биология
Цель: продолжить формирование эволюционных представлений о развитии органического мира и его делении на прокариотические и эукариотические организмы; сформировать знания о клетках прокариот.
Оборудование: раздаточный материал по теме: «Особенности строения прокариотической клетки», рисунки учебника.
Ход урока
I. Повторение и проверка знаний изученного материала.
1. Устный опрос. Строение и функции ядра.
2. Письменная работа по вариантам. Вопросы записаны на доске.
II. Изучение нового материала.
— Какие выделяют уровни клеточной организации?
— Какие клетки называют прокариотическими?
— Какие организмы относятся к прокариотическим?
Прокариотические организмы сохраняют черты глубочайшей древности: они очень просто устроены.
Бактерии представляют собой типичные прокариотические клетки. Они живут повсюду: в воде, в почве, в пищевых продуктах. Бактерии представляют собой примитивные формы жизни, и можно предположить, что они относятся к тому типу живых существ, которые появились на самых ранних этапах развития жизни на Земле.
По-видимому, первоначально бактерии жили в морях; от них, вероятно, и произошли современные микроорганизмы. Человек познакомился с миром бактерий сравнительно недавно, лишь после того, как научились изготовлять линзы, дающие достаточно сильное увеличение. Развитие техники в последующие века позволило подробно изучить бактерии и другие прокариотические организмы.
Размеры бактерий колеблются в широких пределах: от 1 до 10-15 мкм.
— Рассмотрите рисунки, изображающие бактерии. Какую форму они могут иметь?
Бактерии могут жить или только в аэробных, или только в анаэробных условиях, или и в тех и других. Необходимую энергию они получают в процессе дыхания, брожения или фотосинтеза.
— Какие особенности строения бактерий можно выделить?
Основные особенности строения бактерий – отсутствие ядра, ограниченного оболочкой. Наследственная информация бактерий заключается в одной хромосоме. Бактериальная хромосома, состоящая из одной молекулы ДНК, имеет форму кольца и погружена в цитоплазму. Бактериальная клетка окружена мембраной, отделяющей цитоплазму от клеточной стенки. В цитоплазме мембран мало. В ней находятся рибосомы, осуществляющие синтез белков. Бактерии размножаются делением надвое. Иногда размножению предшествует половой процесс, сущность которого заключается в возникновении новых комбинаций генов в бактериальной хромосоме. Многим бактериям свойственно спорообразование. Споры возникают, когда ощущается недостаток в питательных веществах или когда в среде в избытке накапливаются продукты обмена. Процессы жизнедеятельности внутри спор практически прекращаются. Споры бактерий в сухом состоянии очень устойчивы. В таком состоянии они сохраняют жизнеспособность многие сотни и даже тысячи лет, выдерживая резкие колебания температуры. Попадая в благоприятные условия, споры преобразуются в активную бактериальную клетку.
Записать особенности строения бактерий в тетрадь.
Выступление учащегося с докладом по теме «Роль бактерий в природе и жизни человека». Остальные учащиеся составляют краткое резюме.
— Почему при одних болезнях в школе объявляется карантин, а при других – нет? Какие правила профилактики инфекционных заболеваний вы знаете?
III. Закрепление и обобщение изученного материала.
На каждой столе лежит материал с заданиями.
— Выберите верные утверждения.
— На партах находятся смешанные комплексы рисунков органоидов, хромосом, ядер и поверхностных аппаратов клеток. Сложите модель прокариотической клетки. (Один учащийся составляет модель у доски. Обсуждение полученных результатов.) Составьте рассказ о прокариотической клетке, по очереди называя одну из особенностей её строения и жизнедеятельности.
IV. Домашнее задание.
Особенности строения прокариотической клетки.
Из чего состоит ДНК человека
Дезоксирибонуклеиновая кислота, или ДНК, – это своеобразный программный код, который определяет то, каким образом будет развиваться, функционировать и размножаться организм. Именно эта молекула – объект генетических исследований, которые с высокой точностью помогают в решении ряда сложных проблем при установлении родства, диагностике наследственных заболеваний.
Структура построения ДНК
Структура ДНК состоит из шести меньших молекул – пятиуглеродного сахара, называемого дезоксирибозой, молекулы фосфата и четырех различных азотистых оснований (аденин, тимин, цитозин и гуанин). Модель структуры ДНК называется двойной спиралью, потому что две ее длинные цепи закручиваются, как витая лестница. Вертикальные элементы этой лестницы изготовлены из чередующихся молекул сахара и фосфата. Ступеньки лестницы состоят из двух оснований, соединенных двумя или тремя слабыми водородными связями.
Основной строительный блок ДНК называется нуклеотид. Нуклеотид состоит из одной молекулы сахара, одной молекулы фосфата и одного из четырех оснований. Пуриновые основания (аденин и гуанин) имеют двойную кольцевую структуру, в то время как пиримидиновые основания (тимин и цитозин) имеют только одно кольцо.
Нуклеотиды ДНК выстраиваются так, что молекулы сахара и фосфата образуют два длинных остова – их можно сравнить с поручнями лестницы. Чтобы сделать ступеньки этой лестницы, два основания соединяются между молекулами сахара на двух поручнях. Молекулы фосфата не имеют между собой никаких «перепонок». Молекула аденина сочетается только с тимином. Цитозин создает пары только с гуанином. Они могут соединяться в любом порядке на ступенях, давая четыре возможных комбинации оснований – A-T или T-A и C-G или G-C.
И именно эта цепочка пар оснований составляет код, управляющий тем, как выглядит любой организм на нашей планете, в том числе человек. Молекула ДНК выполняет ряд важнейших функций, среди которых:
ДНК хранит информацию, необходимую для построения и контроля клетки. Передача этой информации от материнских к дочерним клеткам называется вертикальной передачей генов и происходит в процессе репликации ДНК. ДНК реплицируется, когда клетка делает дубликат копии своей ДНК, только после этого клетка делится, что приводит к правильному распределению одной копии ДНК на каждую полученную клетку. ДНК также может быть ферментативно расщеплена и использована в качестве источника нуклеозидов и нуклеотидов для клетки. В отличие от других макромолекул, ДНК не выполняет структурную роль в клетках.
Весь набор информации, закодированной в ДНК организма называется его геномом. Он содержит информацию обо всех белках, синтезируемых организмом. Это инструкции примерно для 30 тысяч различных белков. Количество данных, которые содержит геном, просто поражает: к примеру, типичная клетка человеческого организма вмещает в себя 2 метра дезоксирибонуклеиновой кислоты. Если записать последовательность нуклеотидов в четырехбуквенном нуклеотидном коде, то это займет четверть страницы текста. А если полностью расшифровать геном человека, это займет тысячи страниц.
Как открыли ДНК?
Гены содержат биологическую информацию, которая должна передаваться без изменений от одного поколения к следующему. Она передается каждый раз, когда происходит деление клетки. Отсюда вытекают два основных биологических вопроса: как можно передать информацию в химической форме и как скопировать ее без изменений? Открытие структуры ДНК стало очередной вехой в биологии двадцатого века, поскольку это предложило ответы на оба вопроса, что позволило решить на молекулярном уровне проблему наследственности.
Существует распространенное заблуждение, что Джеймс Уотсон и Фрэнсис Крик обнаружили ДНК в 1950-х гг. На самом деле ДНК была открыта за десятилетия до них. Следуя работе предшествовавших им пионеров, Джеймс и Фрэнсис смогли прийти к своему новаторскому заключению о том, из чего состоит ДНК, в 1953 году. Но история открытия ДНК начинается в 1800-х годах. Вот несколько интересных фактов из этой истории.
Молекула, теперь известная как ДНК, была впервые идентифицирована в 1860-х годах швейцарским химиком по имени Иоганн Фридрих Мишер. Иоганн решил исследовать ключевые компоненты лейкоцитов – фрагментов иммунной системы нашего организма. Основным источником этих клеток были бинты, собранные в ближайшей медицинской клинике.
Иоганн провел эксперименты с использованием солевых растворов, чтобы лучше понять, из чего состоят лейкоциты. Он заметил, что при добавлении кислоты в раствор клеток от раствора выделяется некое вещество. Это вещество затем снова растворяется при добавлении щелочи. Исследуя это вещество, он понял, что оно обладает неожиданными свойствами, отличными от других белков, с которыми он был знаком. Иоганн назвал эту загадочную субстанцию «нуклеином», потому что считал, что она произошла из клеточного ядра. Затем он приступил к поиску способов извлечь его в чистом виде.
Иоганн был убежден в важности нуклеина и подошел очень близко к раскрытию его роли, хотя ему были доступны только простые инструменты и методы. Он долго колебался, прежде чем опубликовал свои результаты в 1874 году. В результате прошло много десятилетий, прежде чем открытие Иоганна Фридриха Мишера было справедливо оценено научным сообществом.
В течение многих лет ученые продолжали верить, что белки – это молекулы, в которых содержится весь наш генетический материал. Они полагали, что нуклеин не был достаточно сложным, чтобы содержать всю информацию, необходимую для создания генома. Как один тип молекулы мог объяснить все изменения, наблюдаемые в пределах вида?
Альбрехт Коссель был немецким биохимиком, который добился большого прогресса в понимании основных строительных блоков нуклеина. В 1881 году Альбрехт идентифицировал нуклеин как нуклеиновую кислоту и дал ей ее нынешнее химическое название – дезоксирибонуклеиновая кислота (ДНК). Он также выделил пять нуклеотидов основания, которые являются строительными блоками ДНК и РНК: аденин (A), цитозин (C), гуанин (G), тимин (T) и урацил (U). Эта работа была вознаграждена в 1910 году Нобелевской премией по физиологии и медицине.
В начале 1900-х годов снова возрос интерес к работа Грегора Менделя. Новые исследования пытались доказать или опровергнуть его теории о том, как физические характеристики наследуются от одного поколения к другому.
В середине девятнадцатого века анатом Вальтер Флемминг из Германии обнаружил волокнистую структуру в ядре клеток. Он назвал эту структуру «хроматином», но на самом деле он открыл то, что мы теперь называем хромосомами. Наблюдая за этим хроматином, Вальтер обнаружил, что хромосомы отделяются во время клеточного деления, также известного как митоз.
Хромосомная теория наследования была разработана главным образом Уолтером Саттоном и Теодором Бовери. Сначала они представили идею о том, что генетический материал, передаваемый от родителя к ребенку, находится внутри хромосом. Их работа помогла объяснить наследственные паттерны, которые Грегор Мендель наблюдал более века назад.
Интересно, что Уолтер Саттон и Теодор Бовери фактически работали независимо в начале 1900-х годов. Уолтер изучал хромосомы кузнечика, а Теодор изучал эмбрионы круглого червя. Тем не менее, их работы объединилась в идеальный союз вместе с выводами нескольких других ученых, сформировав хромосомную теорию наследования.
Что можно узнать по молекуле ДНК
Состав ДНК человека позволяет проводить сложные генетические исследования. Внутри ДНК закодированы такие разнообразные черты, как цвет глаз и волос человека, его рост, телосложение и многое-многое другое. Хотя ДНК каждого организма уникальна, вся ДНК состоит из одинаковых молекул азота. Так каким же образом ДНК одного организма отличается от другого? Это определяется порядком, в котором расположены эти более мелкие молекулы. В свою очередь, эта схема расположения в конечном итоге определяет уникальные характеристики каждого организма. Благодаря этому генетики могут изучать последовательности ДНК людей, чтобы определить:
Для того, чтобы провести любое из таких исследований, достаточно сдать мазок из полости рта или кровь (для пренатальной диагностики), хотя подходят и любые другие частички тела, если нет возможности получить стандартный мазок. Сроки и стоимость ДНК-анализа зависят от его сложности, типа предоставленных биологических материалов, количества участников исследования.
Знакомые незнакомцы: внехромосомные кольцевые ДНК
Знакомые незнакомцы: внехромосомные кольцевые ДНК
3D-модель внехромосомной кольцевой ДНК
Автор
Редактор
В истории молекулярной биологии многие открытия сначала опережают время, а потом долгие годы остаются незаслуженно забытыми, пока накопившиеся в области геномики и других «-омик» данные не приведут к их повторному «переоткрытию». Так случилось и с внехромосомной кольцевой ДНК, которая описана у большинства эукариот, а у человека известна с 60-х годов прошлого века. В последнее время этот ранее неизученный пул нуклеиновых кислот привлек внимание ученых, поскольку выяснилось, насколько весомым является их вклад в патогенез онкологических заболеваний. Позволит ли внехромосомная кольцевая ДНК собрать опухолевый пазл в единую картину? Только ли для опухолей характерно ее присутствие? О некоторых аспектах биологии внехромосомных кольцевых ДНК мы и поговорим в этом обзоре.
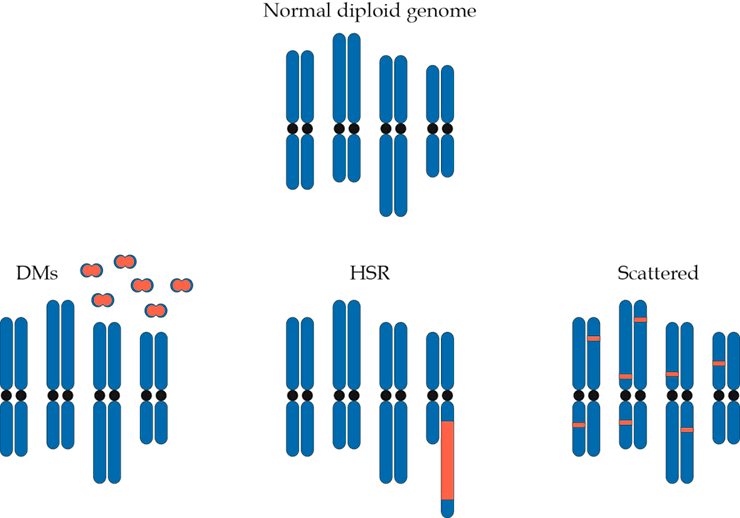
Рисунок 1. Цитогенетический препарат клетки нейробластомы с присутствующими на нем 16-ю двойными минихромосомами. Опубликовано в журнале Lancet, 1965 год.
Кольцевые ДНК описаны у вирусов, прокариот, низших эукариот (дрожжей, простейших и грибов), а также у некоторых высших растений. У млекопитающих, в том числе у человека, кольцевые ДНК присутствуют в составе митохондриального генома. Весь остальной геном, как считалось, в норме представлен линейными хромосомами и только в опухолях были описаны крупные внехромосомные кольцевые ДНК, которые удавалось наблюдать, изучая образцы новообразований в световом микроскопе (рис. 1).
Эти структуры получили название double minutes (от лат. minutus — маленький, мелкий) — двойные минихромосомы [1]. От обычных хромосом они отличаются не только кольцевой формой и размером, но и тем, что не имеют центромеры.
Впоследствии предложили методы, позволяющие отделить пул кольцевых ДНК от основной массы ДНК с помощью центрифугирования в градиенте плотности хлорида цезия или специфических экзонуклеаз и двумерного гель-электрофореза. Но, как и в случае с кольцевыми РНК (о которых «Биомолекула» писала в [2]), только в последнее время, с развитием технологии секвенирования нового поколения и разработкой биоинформатических подходов для поиска кольцевых молекул, удалось изучить всё их многообразие, ограничивающееся далеко не только двойными минихромосомами.
Четкой номенклатуры внехромосомных кольцевых ДНК, или вкДНК (extrachromosomal circular DNA, eccDNA), пока нет, но сегодня известно о существовании их вариантов размерами от сотен пар нуклеотидов (например, микроДНК, состоящей из 200–400 п.н.) до нескольких миллионов. Внехромосомная кольцевая ДНК может содержать повторяющиеся участки (как, скажем, теломерная или рибосомная ДНК) или состоять из уникальных, неповторяющихся последовательностей. Кольцевая ДНК упакована не столь плотно, как в хромосомах, что играет важную регуляторную роль, так как облегчает доступ к хроматину и способствует транскрипции определенных генов [3].
Точное число всех внехромосомных кольцевых ДНК, присутствующих в клетках, подсчитать достаточно сложно: методы секвенирования для количественного учета не годятся, а флуоресцентная гибридизация in situ (FISH), позволяющая локализовать в клетках любые последовательности ДНК, характеризуется высоким уровнем «шума». Малый размер и отсутствие четких морфологических «опознавательных знаков» вкДНК еще более затрудняют их идентификацию при FISH.
Совсем недавно на базе нейронной сети U-Net, широко применяющейся при анализе и обработке биомедицинских изображений, была создана программа ecSeg, позволяющая подсчитывать количество внехромосомных кольцевых ДНК в образцах различных клеточных линий [4]. Программа работает с изображениями, получаемыми камерой флуоресцентного микроскопа с метафазных пластинок, окрашенных DAPI (ДНК-связывающимся флуорофором). Проанализировав сорок различных опухолевых клеточных линий человека, создатели программы обнаружили, что некоторые из них (например, клеточная линия рака молочной железы HCC1569) содержат более 100 различных внехромосомных кольцевых ДНК в каждой клетке. Причем вариабельность вкДНК внутри одной и той же клеточной линии обеспечивается уже при их содержании в каждой клетке в количестве всего 10 единиц (и более). Это говорит о той важной роли, которую играет количество вкДНК в повышении неоднородности клеточной популяции.
Умножай и властвуй
Но вернемся к самым известным представителям внехромосомных кольцевых ДНК — двойным минихромосомам. Предполагается, что их появлению в клетке предшествует амплификация (многократное увеличение числа копий) определенных генов. В дальнейшем амплифицированные участки «вырезаются» из хромосомы и закольцовываются. Так, двойные минихромосомы клеток нейробластом (злокачественных опухолей симпатической нервной системы) содержат амплифицированный ген MYCN. Экстрахромосомная амплификация KRAS наблюдается в аденокарциномах пищевода, пищеводно-желудочного перехода и желудка, а также в некоторых случаях колоректального рака. Внехромосомная амплификация гена циклина D1 описана при раке мочевого пузыря [5]. Как правило, каждая кольцевая минихромосома состоит из амплифицированных копий только одного онкогена, хотя есть и исключения: так, описаны внехромосомные кольцевые ДНК с одновременной амплификацией генов EGFR и CDK4 [6]. Средний размер ампликона (участка ДНК, являющегося результатом амплификации) составляет 1,26 миллиона пар нуклеотидов [3], поэтому неудивительно, что двойные минихромосомы достаточно крупны (хоть это и звучит как каламбур).
В дальнейшем кольцевые структуры, несущие амплифицированный онкоген, могут встраиваться в хромосому, причем в произвольно выбранной позиции. В этом случае они формируют на хромосоме гомогенно окрашенные участки (ГОУ; в англоязычной литературе — homogenous staining regions, HSR), представляющие собой цитогенетическое проявление амплификации (рис. 2).
Рисунок 2. Двойные минихромосомы могут приводить к появлению ГОУ при встраивании в один и тот же участок на хромосоме или распределяться случайным образом, встраиваясь в разные участки разных хромосом
Отсутствие центромер приводит к тому, что в процессе митоза двойные минихромосомы, в отличие от обычной хромосомной ДНК, распределяются между дочерними клетками случайным образом. Поскольку амплификация онкогенов придает опухолевой клетке преимущество в скорости роста по сравнению с соседями, те из них, что содержат большее количество внехромосомных кольцевых ДНК, приобретают пролиферативное преимущество и проходят, таким образом, положительный отбор в ходе эволюции опухоли [7].
Рассматривая прогрессию опухоли через призму дарвиновской эволюции, можно объяснить и альтернативный вариант — полное исчезновение двойных минихромосом из клетки. Например, при таргетном лечении трастузумабом рака молочной железы (РМЖ) с амплификацией гена Her2/neu примерно у одной трети больных возникает рецидив [8]. Механизмов развития резистентности к таргетной терапии существует много, но один из вариантов заключается в активации работы сигнальных каскадов, перекрывающихся с сигнальным путем Her2/neu, с помощью компенсирующей амплификации генов PIK3CA и c-Met [8], [9]. Так, при лечении трастузумабом метастатического РМЖ с амплификацией Her2/neu в 27,7% случаев обнаруживается и амплификация гена рецептора тирозинкиназы c-Met [10]. Амплификация с-Met берет на себя функцию драйверной, а кольцевые минихромосомы, несущие амплифицированный ген Her2/neu, становятся балластом: они элиминируются из клетки.
На примере появления резистентных к трастузумабу клеток и прогрессии РМЖ, несмотря на лечение, хорошо видно, почему ингибирование только одной молекулярной мишени может оказаться терапевтически неэффективным. Стратегическим направлением клинических исследований сейчас становится воздействие сразу на несколько мишеней (double-hit-лечение). Так, по сравнению с обычной таргетной терапией при немелкоклеточном раке легкого с мутациями гена EGFR, использование комбинированной терапии бевацузимабом и эрлотинибом увеличивает время до прогрессирования заболевания и общую выживаемость больных [11]. Комбинация различных препаратов используется и при лечении меланомы c мутацией в гене BRAF [12]. К сожалению, ни в одном из исследований не описана какая-либо комбинация препаратов, которая бы привела к полному излечению пациентов. Во всех случаях неизбежно развивается резистентность, правда, в более поздние сроки по сравнению с монотерапией.
Пассажир садится за руль
Гены, которые подвергаются амплификации, находятся, как правило, в начале сигнальных каскадов, регулирующих важнейшие клеточные процессы, такие как рост клеток и поддержание целостности и функциональной дееспособности генома. Эти гены являются драйверами процесса канцерогенеза, то есть играют решающую роль в развитии опухоли. Учитывая, что процесс образования кольцевых структур может быть опосредован репарацией двухцепочечных разрывов с помощью негомологичного соединения концов линейной ДНК (non-homologous end joining, NHEJ) — процесса неточного и потенциально ведущего к накоплению мутаций, — можно ожидать, что мутационная нагрузка на вкДНК окажется выше, чем на остальные части опухолевого генома. И действительно, оказалось, что амплификация с образованием внехромосомной кольцевой ДНК может сопровождаться вторичными мутациями, которые изначально не влияют на рост опухоли (за что и получили название «мутации-“пассажиры”»), но способны выступать как потенциальные драйверы опухолевой прогрессии при изменении условий внешней среды, например, если опухоль подвергнется лечению.
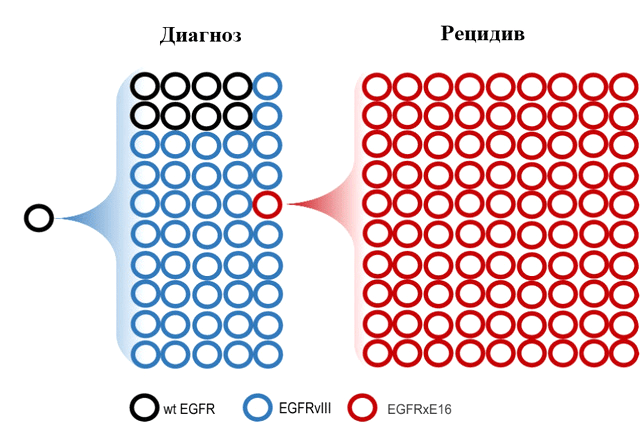
Ярким примером того, как мутации-«пассажиры» на внехромосомных кольцевых ДНК, накапливаемые «про запас», обеспечивают дополнительный механизм адаптации опухоли в новых условиях существования, является возникновение резистентности к лечению ингибиторами тирозинкиназы в глиобластомах (злокачественных опухолях головного мозга) с делецией 16 экзона в РНК-транскрипте гена EGFR (EGFRxE16) (рис. 3) [13].
Рисунок 3. Молекулярный профиль внехромосомных кольцевых ДНК опухоли в момент постановки диагноза и после обнаружения рецидива. В каждой из кольцевых минихромосом возможно возникновение дополнительных мутаций (обозначены кружками различных оттенков). вкДНК, несущие ген EGFR дикого типа (wtEGFR), отмечены черными кружками. Кольцевые минихромосомы с мутацией EGFRvIII — синего цвета, с мутацией EGFRxE16 — красного. Объяснения см. в тексте.
В клетках глиобластом возможны несколько различных мутаций гена EGFR. В случае мутации EGFRvIII, которая возникает в результате делеции экзонов 2–7 гена EGFR, опухоль, как и при наличии EGFR «дикого типа», остается чувствительной к терапии ингибиторами тирозинкиназы EGFR, такими как эрлотиниб и др. Напротив, опухоли, содержащие кольцевые минихромосомы с мутацией EGFRxE16, приобретают резистентность к проводимой терапии. Находясь в небольшом количестве клеток опухоли в момент постановки диагноза, с каждым поколением клеток кольцевые минихромосомы с мутацией EGFRxE16 накапливаются и дают начало новому опухолевому клону, преуспевшему в изменившихся условиях окружающей среды больше остальных. Отбор наиболее приспособленных — движущая сила эволюции, и здесь эволюция внутри опухоли поразительно напоминает классическую дарвиновскую эволюцию, предопределяя то обстоятельство, что возникающий через некоторое время рецидив будет представлен именно клоном с мутацией EGFRxE16 на внехромосомной кольцевой ДНК. Другой путь эволюции глиобластом — потеря двойных микрохромосом с мутантным EGFR, что тоже повышает устойчивость к лекарственным препаратам, усиливает злокачественный потенциал опухолевой популяции и объясняет плохой прогноз при данном заболевании [14].
Под окружающей средой в данном случае мы понимаем спектр экспрессии генов и белков, мутации и эпигенетические изменения, уже имеющиеся в этой клетке, опухолевое микроокружение и внешние факторы, такие как препараты, используемые для лечения. В этом конкретном случае изменение окружающей среды — это воздействие на опухоль лекарственным препаратом эрлотиниб.
Когда замкнутость дает преимущества
Возникновение амплификаций и вторичных по отношению к ним точечных мутаций за пределами хромосом имеет глубокий биологический смысл. Так опухоли получают возможность «экспериментировать» с новыми функциями, не нарушая свою жизнедеятельность. К тому же, с помощью амплификаций и других мутаций кольцевой внехромосомной ДНК формируется генетическая гетерогенность (разнородность) опухоли, а процесс ее эволюции идет гораздо быстрее, чем если бы эти процессы происходили исключительно в хромосомах. Это было показано Кристен Тёрнер и ее соавторами с помощью методов математического моделирования [15]. Они обнаружили, что внехромосомная амплификация позволяет достичь более высокого уровня экспрессии онкогена благодаря неравному распределению кольцевой ДНК между дочерними клетками во время митоза. Как и было предсказано моделью, в опухолях, где отмечалось присутствие вкДНК, содержание онкогенов EGFR (включая EGFRvIII) и MYC было значительно более высоким по сравнению с теми, которые не задействовали механизм внехромосомной амплификации. Авторы исследования также пришли к выводу, что если онкоген амплифицируется интрахромосомно, гетерогенность опухоли остается на сравнительно низком уровне.
Существование гетерогенности в опухоли может иметь большое клиническое значение, так как оказывает влияние на развитие заболевания и во многом определяет ответ на лечение [15], [16]. Представим себе опухолевые клетки с полностью идентичным геномом за исключением качественного и количественного спектра внехромосомных кольцевых ДНК. Уже только за их счет опухоль обеспечивает себе огромное разнообразие генотипических и фенотипических вариантов, и высока вероятность, что хотя бы один из них преуспеет больше остальных при изменении условий окружающей среды. Если учесть, что в реальных условиях in vivo опухоль является внутренне гетерогенной за счет генных мутаций и эпигенетических изменений, а также за счет влияния внешних факторов (таких как микроокружение опухоли), то вкДНК делает процесс опухолевой эволюции еще более сложным, приводя к прогрессии заболевания и неудачам в лечении.
На что способна кольцевая ДНК?
Важное открытие последних лет состоит в том, что в неопухолевых клетках также присутствуют внехромосомные кольцевые ДНК. Так, в 2018 году сразу две исследовательские группы продемонстрировали существование вкДНК в здоровых тканях человека [17], [18].
Молекулы кольцевой ДНК, обнаруженные в нормальных клетках, сильно различаются по размеру и генному составу. Часть из этих внехромосомных структур очень мала (менее 25 т.п.н.), другие же достигают 1 миллиона пар нуклеотидов, что сравнимо с двойными минихромосомами опухолей. Надо особо подчеркнуть, что сравнимы внехромосомные кольцевые ДНК опухолевой и нормальной тканей могут быть только по размеру, но не по структуре — в норме амплификации генов на внехромосомной ДНК не происходит.
В составе «нормальной» вкДНК обнаруживаются целые гены и их отдельные участки, межгенные промежутки, повторяющиеся последовательности, ретровирусы, ретротранспозоны, длинные терминальные повторы (LTR) и т.д. Ученые предполагают, что это продукты удаленной из хромосом поврежденной ДНК, которая не сразу элиминируется из клетки, а продолжает существовать в нестабильной кольцевой форме. Был даже предложен новый термин «циркулóм», обозначающий совокупность дополнительных внехромосомных кольцевых молекул ДНК [17]. Интересно, что хромосомы, содержащие наибольшее количество генов, являются и источником самого большого количества внехромосомных кольцевых ДНК [18].
Какую роль может играть эта ДНК в нормальной, неопухолевой клетке? Для ответа на этот вопрос ученым может пригодиться CRISPR/Cas — самая нашумевшая технология последних лет, о которой «Биомолекула» неоднократно писала [19–22].
Технология CRISPR сделала возможным эндогенный биогенез внехромосомной кольцевой ДНК в культуре клеток. Эксперименты были проведены на человеческих клетках почки эмбриона (HEK293T) и фибробластах молочной железы человека (HMF). Но принцип метода универсален и подходит для любых клеточных культур: нужны лишь два различных рибопротеиновых комплекса CRISPR/Cas9, вносящие в ДНК одной и той же хромосомы два двухцепочечных разрыва, а далее дело за клеточной системой репарации NHEJ, превращающей вырезанный кусок в кольцо. С помощью этой технологии была продемонстрирована гипотетическая ранее транскрипционная активность внехромосомной кольцевой ДНК [23]. Показано, что с вкДНК транскрибируются не только мРНК, но и малые некодирующие РНК — микроРНК и короткие интерферирующие РНК, которые могут подавлять экспрессию генов в клетках на уровне трансляции посредством РНК-интерференции [24]. Интересно, что эти линейные молекулы РНК содержат соединительные последовательности, характерные в то же время и для кольцевой РНК, что может привести к потенциальным ошибкам при биоинформатическом анализе данных секвенирования [25]. Поэтому при работе с кольцевой РНК необходимо подтверждать данные РНК-секвенирования (полученные методами «сухой» биологии) с помощью РНК-азы R, нозерн-блоттинга или электрофоретически. Сами же химерные линейные РНК, содержащие соединительные последовательности, характерные для бэксплайсинга (от англ. backsplicing — процесс сплайсинга с последующим соединением концов вырезанного транскрипта «голова к хвосту»), следует рассматривать как еще один тип молекул РНК, которые, возможно, выполняют в организме те же функции, что и кольцевые РНК, и потому заслуживают прицельного изучения.
Транскрипционной регуляцией экспрессии генов функции внехромосомной кольцевой ДНК не ограничиваются. Подобно экзосомам, она может выполнять роль переносчиков генетической информации от клетки к клетке. Межклеточные взаимодействия — это универсальный по своей природе биологический механизм, который лежит в основе существования всех многоклеточных. Процессы межклеточной коммуникации с особым вниманием изучают онкологи, так как, к сожалению, опухоли используют те же самые механизмы коммуникации, что и здоровые клетки. Уже накоплены данные о том, что вкДНК может репрограммировать микроокружение опухоли, участвовать в формировании преметастатических ниш, супрессивно модулировать иммунные клетки, тем самым определяя развитие опухолевого процесса и прогноз заболевания [3], [15–17].
О cGAS-пути иммунного ответа «Биомолекула» писала в статье «Почему прячут ДНК от Стинга?» [26].
Перспективы использования внехромосомной кольцевой ДНК в медицине
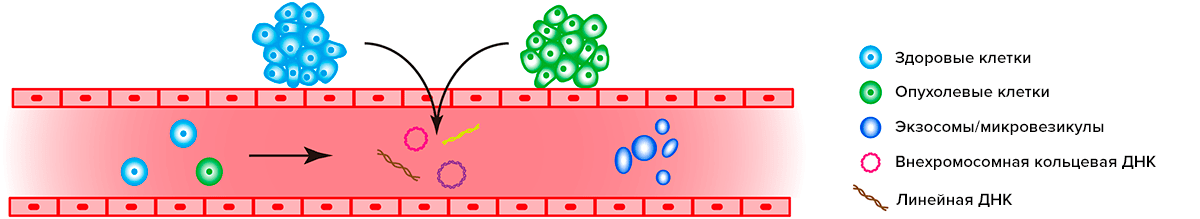
Внехромосомная кольцевая ДНК, подобно линейным «осколкам» хромосом, может попадать не только в цитоплазму, но и в кровяное русло. Опухоли участвуют в этом процессе не менее активно, чем здоровые ткани (рис. 4).
Рисунок 4. Источником ДНК для жидкостной биопсии могут быть линейные «осколки» хромосом и внехромосомная кольцевая ДНК, а также экзосомы, циркулирующие опухолевые клетки и клетки нормальных тканей, попадающие в кровяное русло
Количество внехромосомной кольцевой ДНК в крови не всегда коррелирует с размерами опухоли, но также зависит и от ее пролиферативной активности, васкуляризации, скорости деградации и других факторов. К тому же, необходимо помнить, что источником внехромосомной кольцевой ДНК в крови служат не только опухолевые, но и нормальные клетки. Но поскольку вкДНК опухолей обычно больше по размеру, это создает потенциальную возможность использования жидкостной биопсии для определения их динамики при хирургическом и лекарственном лечении злокачественных новообразований различной локализации [27]. Перспективным подходом является и оценка риска рецидива заболевания на основе выявляемых методом жидкостной биопсии закономерностей изменения численности внехромосомных кольцевых ДНК. Однако техническая сложность анализа минимальных различий размера вкДНК из здоровых и опухолевых клеток, необходимость минимизации ложно-положительных результатов и создания крайне чувствительного теста делают клиническое применение внехромосомной кольцевой ДНК опухолей как биомаркера для жидкостной биопсии делом отдаленного будущего. По крайней мере, эксперты американского общества клинической онкологии (ASCO) и коллегии американских патологов (CAP) по этому вопросу настроены скептически [28].
Более реальным выглядит создание лекарственного препарата, прицельно разрушающего внехромосомные кольцевые ДНК в опухолевых клетках и таким образом оказывающего терапевтическое воздействие. Так, уже появилось сообщение о том, что двуцепочечные разрывы, вносимые в структуру вкДНК с помощью CRISPR/Cas9, приводят к их агрегации, включению в состав микроядра и элиминации из клетки [29].
Заключение
Становится очевидным, что внехромосомные кольцевые ДНК играют важную роль в нормальных клетках и клетках опухолей. Будучи широко распространенными практически у всех эукариот, кольцевые ДНК участвуют в транскрипционной регуляции уровня экспрессии различных генов, процессах иммунного ответа, межклеточном взаимодействии и выполняют другие важные функции.
В опухолях же двойные минихромосомы можно рассматривать как резервуар для накопления различных амплификаций и точечных мутаций, причем все эти изменения, что немаловажно, являются обратимыми. Кольцевая ДНК обеспечивает высокую скорость накопления мутаций, которой не удается достичь в линейных хромосомах. И при этом клетка в любой момент может повернуть процесс вспять — если выяснится, что мутация несет потенциальный вред опухоли, вкДНК, ее содержащая, элиминируется из клетки. В конечном итоге именно внехромосомная кольцевая ДНК придает злокачественным новообразованиям пластичность, что делает лечение опухолей такой сложной задачей.