клиническими формами пренатальной гипотрофии являются
Публикации в СМИ
Гипотрофия пренатальная
Гипотрофия — вид дистрофии, хроническое нарушение питания и трофики тканей, характеризующееся относительным снижением массы тела ребёнка по отношению к его длине, нарушающее правильное развитие и функции отдельных органов и систем. По времени возникновения различают пренатальную, постнатальную и смешанную гипотрофии. Частота. В 3–5% случаев к педиатру обращаются по поводу недостаточной прибавки массы тела.
Этиология. Гипотрофия — полиэтиологичный синдром; может сопровождать различные заболевания.
• Экзогенные причины •• Алиментарная (недокорм, перекорм, дисбаланс поступления питательных веществ) •• Инфекционная (острые инфекции, сепсис) •• Токсическая (отравления, ожоги, применение цитостатиков) •• Социальные факторы (дефект воспитания, низкий социальный уровень семьи и т.п.).
• Эндогенные причины •• Эндокринные и нейроэндокринные расстройства — аномалии вилочковой железы, гипотиреоз, адреногенитальный синдром, гипофизарный нанизм •• Пороки развития органов •• Наследственные энзимопатии ••• Нарушение всасывания в кишечнике (целиакия, недостаточность дисахаридаз, синдром мальабсорбции) ••• Нарушение расщепления пищевых веществ (муковисцидоз) •• Первичные нарушения обмена веществ (белковый, углеводный, жировой виды обмена).
Генетические аспекты. Гипотрофия — проявление многих генетических заболеваний; например, гипотрофией сопровождаются почти все хромосомные болезни, десятки менделирующих синдромов, особенно синдромы нарушенного всасывания (муковисцидоз, целиакия, лактазная недостаточность и др.).
Клиническая картина.
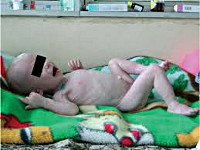
• Степени гипотрофий •• Гипотрофия I степени ••• Дефицит массы тела — 10–20% ••• Состояние ребёнка удовлетворительное ••• При осмотре — незначительное снижение количества подкожной жировой клетчатки на животе •• Гипотрофия II степени ••• Дефицит массы тела — 20–30%, возможно отставание в росте на 2–4 см ••• Общее состояние страдает незначительно ••• Лабильность нервной системы (возбуждение, апатия, вялость, снижение эмоционального тонуса) ••• Бледность, сухость и шелушение кожных покровов, снижение эластичности кожи и тургора мягких тканей ••• Подкожная жировая клетчатка сохранена только на лице ••• Признаки нарушения микроциркуляции (мраморность кожи, снижение температуры тела) ••• Диспептические расстройства (тошнота, рвота, запоры) ••• Возможно нарушение дыхания (тахипноэ), сердечной деятельности (приглушённость сердечных тонов, артериальная гипотензия, склонность к тахикардии) ••• Возможна задержка в психомоторном развитии ••• Часто выявляют анемию •• Гипотрофия III степени ••• Дефицит массы тела — более 30%, выраженная задержка развития ••• Общее состояние тяжёлое, вялость, слабость, анорексия, утрата приобретённых навыков ••• Кожа сухая, бледная, с сероватым оттенком, свисает складками ••• Полное отсутствие подкожной жировой клетчатки, атрофия мышц ••• Возможны признаки обезвоживания — сухость слизистых оболочек, западение большого родничка, поверхностное дыхание, артериальная гипотензия, приглушение сердечных тонов, нарушение терморегуляции, выраженная жажда ••• Лицо Вольтера (треугольной формы) ••• Дефицит роста достигает 4–6 см.
• Пренатальная гипотрофия. В эту группу гипотрофий можно включить задержку внутриутробного развития. По тяжести внутриутробного гипоксического поражения головного мозга и клинических проявлений различают следующие формы •• Невропатическая — характеризуется незначительным снижением массы тела, нарушением аппетита и сна ребёнка •• Нейродистрофическая — снижение массы и длины тела, отставание в психомоторном развитии, стойкая анорексия •• Нейроэндокринная — нарушение эндокринной регуляции психомоторного развития, функционального состояния органов •• Энцефалопатическая — грубое отставание в физическом и психическом развитии, выраженный неврологический дефицит, гипоплазия костной системы, полигиповитаминоз.
Диагностика • Анамнез жизни (акушерский и постнатальный) — течение беременности, токсикозы, заболевания матери; течение родов, длительность безводного промежутка, применение акушерских пособий; ежемесячная прибавка массы тела ребёнка, перенесённые заболевания в раннем неонатальном периоде • Социальный анамнез (жилищно-бытовые условия, социально-экономическое состояние семьи) • Наследственный анамнез — обменные, эндокринные заболевания, энзимопатии у членов семьи • Осмотр — антропометрические данные, состояние кожи и подкожной клетчатки, физикальные данные • Дефицит массы тела (в процентах) определяют по следующей формуле.
Лабораторные исследования • ОАК — гипохромная анемия, увеличение Ht вследствие повышения вязкости крови, увеличение СОЭ, возможны лейкопения, тромбоцитопения • Общий и биохимический анализы мочи • Биохимический анализ крови • Исследование КЩР, содержания электролитов (калий, кальций, натрий) • Иммунограмма (при инфекционных процессах) • Копрограмма • Кал на дисбактериоз • Эндокринный профиль (по показаниям) — исследование функций щитовидной железы, надпочечников, определение концентрации глюкозы в крови • Исследование хлоридов пота при подозрении на муковисцидоз • Бактериологическое и вирусологическое исследования при подозрении на внутриутробные инфекции и при инфекционных процессах • Консультации невропатолога, эндокринолога, окулиста.
Препараты, влияющие на результаты. Применение антибиотиков вызывает или усугубляет дисбактериоз кишечника, опосредовано влияя на кишечное всасывание.
Специальные методы исследования • Рентгенологическое исследование органов грудной клетки для исключения специфического лёгочного процесса (при муковисцидозе, туберкулёзе) • Рентгенография кистей рук для определения костного возраста • Рентгенография костей черепа (состояние «турецкого седла») • ЭКГ для исключения ВПС.
ЛЕЧЕНИЕ
Режим • Амбулаторный при I и II степенях с удовлетворительной переносимостью пищевых нагрузок • Госпитализация обязательна в следующих ситуациях •• Возраст до 1 года •• Наличие сопутствующей патологии внутренних органов и/или инфекционных заболеваний •• II стадия гипотрофии с низкой толерантностью к пищевым нагрузкам •• III стадия гипотрофии • Лечебная гимнастика и массаж.
Лечебное питание
• Первая фаза — адаптационный период. Цель — определение и повышение толерантности ребёнка к пищевым продуктам •• Восстановление водно-солевого обмена •• Пищевые нагрузки уменьшены по сравнению с нормой ••• До 2/3 необходимого объёма пищи при гипотрофии I степени ••• До 1/2–1/3 необходимого объёма пищи при гипотрофии II–III степеней ••• Или 100 мл грудного молока на 1 кг фактической массы тела при I–II степенях •• Парентеральное питание при II степени составляет 1/3 получаемого объёма пищи; при III степени — от 1/2 до 2/3 в зависимости от тяжести состояния ребёнка. Состав вводимой жидкости — коллоиды и кристаллоиды в соотношении 1:1.
• 2-я фаза — репарационный период. Цель — восстановление всех видов обмена, переход к полному кишечному питанию. Расчёт рациона проводят по энергетическим затратам — 150–180 ккал/кг фактической массы в зависимости от степени тяжести гипотрофии. Постепенное введение всех пищевых и витаминных добавок в возрастных пропорциях.
• 3-я фаза — усиленное питание. Цель — восстановление поступления питательных веществ в пересчёте на долженствующую по возрасту массу тела.
Лекарственная терапия • Широко применяют применяются аскорбиновую кислоту, тиамин, пиридоксин, цианокобаламин, ретинол, витамин E, фолиевую кислоту, кальция пантотенат. Ферментные препараты: панкреатин, панзинорм форте, панкреатин+жёлчи компоненты+гемицеллюлаза • Для повышения аппетита и стимуляции анаболических процессов — маточное молочко (новорождённым — по 2,5 мг, детям старше 1 мес — по 5 мг в виде свечей 3 р/сут в течение 7–15 дней; противопоказан при болезни Аддисона и идиосинкразии к препарату), горечи, оротовая кислота, калиевая соль (по 10 мг/кг/сут в 2–3 приёма в течение 3–5 нед), карнитина хлорид (по 4–10 капель 20% р-ра 3 р/сут), кальция глицерофосфат по 0,05–0,2 г 2–3 р/сут • Анаболические стероиды (под контролем костного возраста) — нандролон, метандиенон • Препараты парентерального питания+левокарнитин • При сопутствующем аллергическом процессе — антигистаминные препараты • При дисбактериозе кишечника — колибактерин, бификол, лактобактерин, бифидумбактерин • При пренатальной дистрофии — седативные средства, церебролизин, глутаминовая кислота • Гормональные препараты (тиреоидин, инсулин) — при необходимости • Лечение сопутствующей патологии и инфекционных осложнений.
Течение и прогноз. При своевременном и рациональном лечении, включающем питание и медикаментозную терапию, прогноз благоприятный. Осложняют течение гипотрофии отсутствие ухода за ребёнком в асоциальных семьях, сопутствующая патология и инфекционные заболевания. В случае пренатальной гипотрофии прогноз зависит от степени гипоксического поражения головного мозга.
Профилактика • Укрепление здоровья женщин до и во время беременности.• Рациональное вскармливание и сбалансированное питание • Организация правильного режима • Тщательный уход за ребёнком • Физическое воспитание и закаливание • Контроль за прибавкой массы тела • Проведение расчётов питания и своевременная его коррекция.
Примечание. В последние годы пренатальную гипотрофию рассматривают как проявление задержки внутриутробного развития (ЗВУР), то есть как гипотрофический вариант ЗВУР.
Сокращение. ЗВУР — задержка внутриутробного развития.
МКБ-10 • P05 Замедленный рост и недостаточность питания плода • P07 Расстройства, связанные с укорочением срока беременности и малой массой тела при рождении, не классифицированные в других рубриках
Гипотрофия у детей
Гипотрофия у детей – хроническое нарушение питания, сопровождающееся недостаточным приростом массы тела ребенка по отношению к его росту и возрасту. Гипотрофия у детей выражается отставанием ребенка в весе, задержкой в росте, отставанием в психомоторном развитии, недоразвитием подкожно-жирового слоя, снижением тургора кожных покровов. Диагностика гипотрофии у детей основывается на данных осмотра и анализа антропометрических показателей физического развития ребенка. Лечение гипотрофии у детей предусматривает изменение режима, рациона и калорийности питания ребенка и кормящей матери; при необходимости – парентеральную коррекцию метаболических нарушений.
Общие сведения
Гипотрофия у детей – дефицит массы тела, обусловленный нарушением усвоения или недостаточным поступлением питательных веществ в организм ребенка. В педиатрии гипотрофия, паратрофия и гипостатура рассматриваются как самостоятельные виды хронического расстройства питания у детей – дистрофии. Гипотрофия является наиболее распространенным и значимым вариантом дистрофии, которому особенно подвержены дети первых 3-х лет жизни. Распространенность гипотрофии у детей в различных странах мира, в зависимости от уровня их социально-экономического развития, колеблется от 2-7 до 30 %.
О гипотрофии у ребенка говорят при отставании массы тела более чем на 10% по сравнению с возрастной нормой. Гипотрофия у детей сопровождается серьезными нарушениями обменных процессов, снижением иммунитета, отставанием психомоторного и речевого развития.
Причины гипотрофии у детей
К хроническому расстройству питания могут приводить различные факторы, действующие в пренатальном или постнатальном периоде.
Внутриутробная гипотрофия у детей связана с неблагоприятными условиями, нарушающими нормальное развитие плода. В пренатальном периоде к гипотрофии плода и новорожденного могут приводить патология беременности (токсикоз, гестоз, фетоплацентарная недостаточность, преждевременные роды), соматические заболевания беременной (сахарный диабет, нефропатии, пиелонефрит, пороки сердца, гипертония и др.), нервные стрессы, вредные привычки, недостаточное питание женщины, производственные и экологические вредности, внутриутробное инфицирование и гипоксия плода.
Внеутробная гипотрофия у детей раннего возраста может быть обусловлена эндогенными и экзогенными причинами. К причинам эндогенного порядка относятся хромосомные аномалии и врожденные пороки развития, ферментопатии (целиакия, дисахаридазная лактазная недостаточность, синдром мальабсорбции и др.), состояния иммунодефицита, аномалии конституции (диатезы).
Экзогенные факторы, приводящие к гипотрофии у детей, делятся на алиментарные, инфекционные и социальные. Алиментарные влияния связаны с белково-энергетическим дефицитом вследствие недостаточного или несбалансированного питания. Гипотрофия у ребенка может являться следствием постоянного недокармливания, связанного с затруднением сосания при неправильной форме сосков у матери (плоские или втянутые соски), гипогалактией, недостаточным количеством молочной смеси, обильным срыгиванием, качественно неполноценным питанием (дефицитом микроэлементов), плохим питанием кормящей матери и пр. К этой же группе причин следует отнести заболевания самого новорожденного, не позволяющие ему активно сосать и получать необходимое количество пищи: расщелины губы и неба (заячья губа, волчья пасть), врожденные пороки сердца, родовые травмы, перинатальные энцефалопатии, пилоростеноз, ДЦП, алкогольный синдром плода и пр.
К развитию приобретенной гипотрофии склонны дети, болеющие частыми ОРВИ, кишечными инфекциями, пневмонией, туберкулезом и др. Важная роль в возникновении гипотрофии у детей принадлежит неблагоприятным санитарно-гигиеническим условиям – плохому уходу за ребенком, недостаточному пребыванию на свежем воздухе, редким купаниям, недостаточному сну.
Классификация гипотрофии у детей
Таким образом, по времени возникновения различают внутриутробную (пренатальную, врожденную), постнатальную (приобретенную) и смешанную гипотрофию у детей. В основе развития врожденной гипотрофии лежит нарушение маточно-плацентарного кровообращения, гипоксия плода и, как следствие, нарушение трофических процессов, приводящих к задержке внутриутробного развития. В патогенезе приобретенной гипотрофии у детей ведущая роль принадлежит белково-энергетическому дефициту вследствие недостаточного питания, нарушения процессов переваривания пищи или всасывания питательных веществ. При этом энергетические затраты растущего организма не компенсируются пищей, поступающей извне. При смешанной форме гипотрофии у детей к неблагоприятным факторам, действовавшим во внутриутробном периоде, после рождения присоединяются алиментарные, инфекционные или социальные воздействия.
По выраженности дефицита массы тела у детей различают гипотрофию I (легкой), II (средней) и III (тяжелой) степени. О гипотрофии I степени говорят при отставании ребенка в весе на 10-20% от возрастной нормы при нормальном росте. Гипотрофия II степени у детей характеризуется снижением веса на 20-30% и отставанием роста на 2-3 см. При гипотрофии III степени дефицит массы тела превышает 30 % от долженствующей по возрасту, имеется значительное отставание в росте.
В течении гипотрофии у детей выделяют начальный период, этапы прогрессирования, стабилизации и реконвалесценции.
Симптомы гипотрофии у детей
При гипотрофии I степени состояние детей удовлетворительное; нервно-психическое развитие соответствует возрасту; может иметь место умеренное снижение аппетита. При внимательном осмотре обнаруживается бледность кожных покровов, снижение тургора тканей, истончение толщины подкожно-жирового слоя на животе.
Гипотрофия III степени у детей характеризуется резким истощением: подкожно-жировой слой атрофируется на всем туловище и на лице. Ребенок вял, адинамичен; практически не реагирует на раздражители (звук, свет, боль); резко отстает в росте и нервно-психическом развитии. Кожные покровы бледно-серого цвета, слизистые оболочки сухие и бледные; мышца атрофичны, тургор тканей полностью утрачен. Истощение и обезвоживание приводят к западению глазных яблок и родничка, заострению черт лица, образованию трещин в углах рта, нарушению терморегуляции. Дети склонны к срыгиванию, рвоте, поносам, урежению мочеиспускания. У детей с гипотрофией III степени часто отмечаются конъюнктивиты, кандидозный стоматит (молочница), глоссит, алопеция, ателектазы в легких, застойные пневмонии, рахит, анемии. В терминальной стадии гипотрофии у детей развивается гипотермия, брадикардия, гипогликемия.
Диагностика гипотрофии у детей
Внутриутробная гипотрофия плода, как правило, выявляется при УЗИ-скрининге беременных. В процессе акушерского УЗИ определяются размеры головки, длина и предполагаемая масса плода. При задержке внутриутробного развития плода акушер-гинеколог направляет беременную в стационар для уточнения причин гипотрофии.
У новорожденных детей наличие гипотрофии может выявляться неонатологом сразу после рождения. Приобретенная гипотрофия обнаруживается педиатром в процессе динамического наблюдения ребенка и контроля основных антропометрических показателей. Антропометрия у детей включает оценку параметров физического развития: длины, массы, окружности головы, груди, плеча, живота, бедра, толщины кожно-жировых складок.
При выявлении гипотрофии проводится углубленное обследование детей для уточнения возможных причин ее развития. С этой целью организуются консультации детских специалистов (детского невролога, детского кардиолога, детского гастроэнтеролога, инфекциониста, генетика) и диагностические исследования (УЗИ брюшной полости, ЭКГ, ЭхоКГ, ЭЭГ, исследование копрограммы и кала на дисбактериоз, биохимическое исследование крови и пр.).
Лечение гипотрофии у детей
Лечение постнатальной гипотрофии I степени у детей проводится амбулаторно, гипотрофии II и III степени — в условиях стационара. Основные мероприятия включают устранение причин нарушения питания, диетотерапию, организацию правильного ухода, коррекцию метаболических нарушений.
Диетотерапия при гипотрофии у детей реализуется в 2 этапа: уточнение переносимости пищи (от 3-4 до 10-12 дней) и постепенное увеличение объема и калорийности пищи до физиологической возрастной нормы. Реализация диетотерапии при гипотрофии у детей базируется на дробном частом кормлении ребенка, еженедельном расчете пищевой нагрузки, регулярном контроле и коррекции лечения. Кормлением детей с ослабленным сосательным или глотательным рефлексами проводится через зонд.
Медикаментозная терапия при гипотрофии у детей включает назначение ферментов, витаминов, адаптогенов, анаболических гормонов. При гипотрофии тяжелой степени детям производится внутривенное введение белковых гидролизатов, глюкозы, солевых растворов, витаминов. При гипотрофии у детей полезны массаж с элементами ЛФК, УФО.
Прогноз и профилактика гипотрофии у детей
При своевременном лечении гипотрофии I и II степени прогноз для жизни детей благоприятный; при гипотрофии III степени смертность достигает 30-50%. Для предупреждения прогрессирования гипотрофии и возможных осложнений, дети должны еженедельно осматриваться педиатром с проведением антропометрии и коррекции питания.
Профилактика пренатальной гипотрофии плода должна включать соблюдение режима дня и питания будущей мамы, коррекцию патологии беременности, исключение воздействия на плод различных неблагоприятных факторов. После рождения ребенка важное значение приобретает качество питания кормящей матери, своевременное введение прикормов, контроль динамики нарастания массы тела ребенка, организация рационального ухода за новорожденным, устранение сопутствующих заболеваний у детей.
Нарушения питания у детей раннего возраста
Последние десятилетия в Российской Федерации, как и во всем мире, увеличивается количество детей с нарушениями нутритивного статуса. При этом основные усилия исследователей направлены на изучение проблемы, связанной с избыточной массой тела и ожирением.
Последние десятилетия в Российской Федерации, как и во всем мире, увеличивается количество детей с нарушениями нутритивного статуса. При этом основные усилия исследователей направлены на изучение проблемы, связанной с избыточной массой тела и ожирением. Прослеживается взаимосвязь между повышенным потреблением белка, сопровождающимся ускоренной прибавкой в массе тела у детей на первом году жизни, и развитием в дальнейшем метаболического синдрома. Значительно меньше внимания уделяется детям с отставанием в физическом развитии. В то же время характер гипотрофии во многих странах изменился. Как правило, она возникает не в результате алиментарного фактора — недостаточного питания здорового ребенка, а вследствие тяжелых, часто хронических, заболеваний, приводящих к повышению потребностей в пищевых веществах или нарушению усвоения нутриентов [1–3].
Существует несколько терминов, обозначающих недостаточное физическое развитие детей. В нашей стране принят и традиционно используется термин «гипотрофия», под которым понимают хроническое расстройство питания, характеризующееся дефицитом массы тела по отношению к росту и возрасту ребенка. Это состояние преимущественно наблюдается у детей раннего возраста в связи с высокими темпами роста и активностью обменных процессов, требующих достаточного поступления пищевых веществ и энергии. Патогенез гипотрофии определяется вызвавшим ее заболеванием, но во всех случаях он включает постепенно углубляющиеся нарушения обмена веществ с истощением запасов жиров и углеводов, усилением катаболизма белка и снижением его синтеза. Возникает дефицит многих эссенциальных микроэлементов, ответственных за реализацию иммунных функций, оптимальный рост, развитие мозга. Поэтому длительно текущей гипотрофии часто сопутствует отставание в психомоторном развитии, задержка речевых и когнитивных навыков и функций, высокая инфекционная заболеваемость вследствие снижения иммунитета, что в свою очередь усугубляет расстройство питания [3–5].
Однако при определении понятия «гипотрофия» не учитывается возможная задержка роста (длины тела), характеризующая наиболее тяжелые проявления нутритивной недостаточности.
В 1961 году Объединенным комитетом экспертов ФАО/ВОЗ по вопросам питания был предложен термин «белково энергетическая недостаточность» (БЭН), как обобщающий для обозначения таких заболеваний, как маразм и квашиоркор. БЭН — это алиментарно-зависимое состояние, вызванное достаточным по длительности и/или интенсивности преимущественно белковым и/или энергетическим голоданием, проявляющееся дефицитом массы тела и/или роста и комплексным нарушением гомеостаза организма в виде изменения основных метаболических процессов, водно-электролитного дисбаланса, изменения состава тела, нарушения нервной регуляции, эндокринного дисбаланса, угнетения иммунной системы, дисфункции желудочно-кишечного тракта (ЖКТ) и других органов и систем. То есть предполагался выраженный дефицит поступления пищевых веществ. При этом не учитывались недостаточное усвоение или повышенные потребности больных детей, а также дефицит микронутриентов.
Таким образом, оба используемых термина имеют определенные недостатки. Наиболее общим, на наш взгляд, объединяющим для обозначения подобных состояний может быть термин «нарушение нутритивного статуса», которое приводит к нарушению физического и, во многих случаях, умственного развития (дефицит белка, железа, длинноцепочечных полиненасыщенных жирных кислот и др.).
Причины нарушения нутритивного статуса (гипотрофии, БЭН)
К нарушениям физического развития могут привести как экзогенные, так и эндогенные факторы [6–9]. Экзогенные причины — это недостаточное поступление пищевых веществ вследствие недоедания (дефицитное питание) или затруднения при приеме пищи (в результате неврологических нарушений, аномалий развития или травм челюстно-лицевого аппарата). К эндогенным факторам относятся:
Отечественные педиатры преимущественно дифференцируют гипотрофию по времени возникновения и по дефициту массы тела (табл. 1). Различают пренатальную (врожденную) и постнатальную (развившуюся после рождения) гипотрофию. В основе пренатальных гипотрофий лежат нарушения внутриутробного развития плода вследствие недостаточности плацентарного кровообращения, воздействия инфекционных, наследственных и конституциональных особенностей матери, а также неблагоприятных социально-экономических, производственных и экологических факторов. Существует также термин «задержка внутриутробного развития» (ЗВУР). У новорожденных детей со ЗВУР отмечается дефицит массы тела, превышающий 2 сигма-отклонения. ЗВУР подразделяется на гипотрофический, гипопластический, диспластический типы. При постнатальных проявлениях в зависимости от дефицита массы тела выделяют гипотрофию 1 й, 2 й и 3 й степени.
Зарубежные авторы пользуются классификацией, предложенной Waterlow J. C. с последующими модификациями (табл. 2). Выделяют две основные формы БЭН: острую, проявляющуюся преимущественной потерей массы тела и ее дефицитом по отношению к долженствующей массе тела по росту, и хроническую, проявляющуюся не только дефицитом массы тела, но и существенной задержкой роста. Обе формы имеют три степени тяжести: легкую, среднетяжелую и тяжелую.
Использование различных терминов вносит путаницу и затрудняет статистические подсчеты. Поэтому в процессе обсуждения необходимо придти к единому мнению по поводу терминологии и классификации данных состояний. В этой статье мы будем преимущественно использовать общепринятый в нашей стране термин — «гипотрофия».
Изменения метаболизма при нарушениях нутритивного статуса
В процессе развития гипотрофии постепенно изменяются все виды обмена. На первых этапах истощаются депо гликогена и жира. При сохраняющемся выраженном дефиците пищевых веществ происходит распад белка, преимущественно в мышечной ткани. Снижается уровень короткоживущих белков крови (транстиретина, трансферрина, церулоплазмина и др.), затем уменьшается концентрация альбумина и общего белка. Нарушения метаболизма белка приводят к снижению иммунитета в связи с изменением синтеза иммуноглобулинов, а также антиоксидантной активности, сопровождающейся повреждением клеточных мембран, уменьшению секреции транспортных белков, внутриклеточному дефициту энергии и нарушению транспорта микронутриентов. Снижается активность ферментов и секреция инсулина, а также инсулиноподобного фактора роста, падает инсулинорезистентность, нарушается синтез фибриногена и факторов свертывания крови.
Ограниченное поступление белка при гипотрофии I и II степени приводит к усилению его распада и повышению реутилизации аминокислот. Аминокислоты активно используются для синтеза крайне необходимых транспортных, иммунных, острофазных и некоторых других белков, а также расходуются на энергетические нужды. При гипотрофии III степени распад белка замедляется. Умеренное замедление этого процесса, а также реутилизации аминокислот происходит при маразме, возникающем при недостаточности белка и энергии. Развитие квашиоркора, для которого характерен выраженный дефицит белка при удовлетворительном поступлении углеводов, приводящий к возникновению отеков, сопровождается практически полным прекращением распада белка, что в совокупности со снижением активности реутилизации аминокислот приводит к резкому падению их концентрации (в том числе цистеина — предшественника глутатиона) и выраженному нарушению синтезирующей функции печени. Возникающий при этом окислительный стресс приводит к разрушению целостности клеток. Поэтому смертность при квашиоркоре существенно выше, чем при маразме. Причины различных изменений метаболизма белка при данных заболеваниях остаются не установленными [10].
При развитии гипотрофии энергетический обмен меняется с преимущественно углеводного на липидный. Повышается распад жира (гипотрофия I–II степени). Неэстерифицированные жирные кислоты используются как источник энергии. Увеличивается биосинтез из холестерина жирных кислот, необходимых для поддержания функционирования пищеварительной системы, и кортикостероидов, регулирующих процессы адаптации. При тяжелых нарушениях у детей с гипотрофией III степени организм переходит на режим максимальной экономии энергии. В результате процесс распада жиров существенно замедляется, ухудшается усвоение неэстерифицированных жирных кислот, снижается концентрация фосфолипидов и неэстерифицированного холестерина в крови, что приводит к нарушению строения и функционирования клеточных мембран, уменьшению концентрации кортикостероидов и жирных кислот [11]. Развивается дефицит эссенциальных жирных кислот. Изменения, происходящие в мембранах клеток в совокупности с постепенно развивающейся декомпенсацией антиоксидантной системы и снижением липопротеин-липазной активности, приводят к снижению ассимиляции триглицеридов в тканях. Возникает перегрузка печени триглицеридами, нарушается ее функционирование. Поэтому при гипотрофии III степени на первом этапе лечения содержание жира в рационах ограничивается, также как и использование при парентеральном питании жировых эмульсий.
Недостаточное питание и возникающий при этом стресс приводят к резкому повышению выработки кортизола, что в условиях сниженного синтеза инсулина увеличивает соотношение кортизол/инсулин. Это приводит к усилению процессов катаболизма, которые усугубляются при снижении выработки инсулиноподобного фактора роста и трийодтиронина. В условиях катаболической направленности обменных процессов энергия (глюкоза) направляется преимущественно к мозгу, нарушается инсулинозависимый рост тканей, снижается масса тела и замедляется линейный рост.
Изменения, происходящие при гипотрофии, не могут не коснуться пищеварительной системы. Возникает атрофия слизистой оболочки кишечника, что сопровождается снижением ферментативной активности и выработки соляной кислоты, затрудняются процессы переваривания и усвоения пищи. Нарушается моторика ЖКТ, страдает местный иммунитет. Все эти изменения приводят к дисбактериозу кишечника, который дополнительно усугубляет процесс пищеварения.
Диагностика
Для выявления наличия у детей нарушений нутритивного статуса используют клинические и лабораторные методы. Необходимы сбор анамнеза и клинический осмотр с оценкой специфических симптомов гипотрофии и гиповитаминоза. Применяется антропометрия с расчетом Z-score, измеряется толщина кожно-жировых складок. Соматометрические методы являются ключевым способом оценки нутритивного статуса ребенка. При этом необходимо наличие таблиц сравнения массо-ростовых и возрастных показателей и/или карты центильного распределения показателей веса и роста.
В 2006 году Всемирная Организация Здравоохранения предложила «Стандартные Карты Роста» детей всех возрастных групп для использования в широкой педиатрической практике. В этих картах представлено распределение детей по массовозрастным, ростовозрастным, массоростовым показателям, а также по величине индекса массы тела.
При оценке состояния физического развития ребенка наиболее информативна комплексная оценка массы тела и роста в зависимости от возраста. Сочетанный дефицит массы и длины тела развивается не только при длительном дефиците питания, но и в случаях тяжелых хронических заболеваний ребенка.
В эпидемиологических исследованиях распространенности гипотрофии у детей используют показатель Z-score, который представляет собой отклонение значений индивидуального показателя (масса тела, рост) от среднего значения для данной популяции, деленное на стандартное отклонение среднего значения.
Биохимические методы оценки нарушений нутритивного статуса включают определение содержания альбумина и короткоживущих белков (транстиретин, ретинолсвязывающий белок, трансферрин и др.). Их концентрации при гипотрофии снижаются. Еще одним индикатором нарушения белкового метаболизма является альфа1 антитрипсин — ингибитор протеолитических ферментов, уровень которого при распаде белка повышается.
Иммунные маркеры гипотрофии — это абсолютная лимфопения, снижение соотношения CD4+/CD8+, задержка тестов гиперчувствительности (показатели клеточного иммунитета), а также снижение уровня иммуноглобулинов, характеризующих состояние гуморального иммунитета. Эти показатели лишь частично отражают тяжесть гипотрофии и степень восстановления нутритивного статуса, но имеют важное прогностическое значение.
Диетическая коррекция гипотрофии
Несмотря на то, что основные подходы к диетотерапии гипотрофии разработаны достаточно давно — в 50–70 е годы, до настоящего времени окончательно не определена степень пищевой, в том числе белковой, нагрузки у детей с различной степенью гипотрофии, остается спорной и длительность ее использования, особенно у детей с тяжелыми хроническими заболеваниями.
Экспериментальные работы и исследования с участием детей, проведенные за последние годы, изменили наши представления об оптимальном питании. Предполагаемая взаимосвязь между усиленным питанием на первом году жизни (избыточное потребление белка) и развитием в дальнейшем метаболического синдрома находит все больше подтверждений.
Нарушения питания в критические периоды, к которым относится весь период внутриутробного развития, а также первые месяцы жизни ребенка, приводят к стойким изменениям метаболизма, которые повышают риск развития метаболического синдрома, остеопороза, аллергических заболеваний.
Еще в 1980–1990 гг. Barker D. J. впервые определил взаимосвязь между низким весом при рождении и повышенным риском развития сердечно-сосудистых заболеваний, сахарного диабета 2 го типа, а также метаболического синдрома. Существует предположение, что причиной его возникновения является усиленное питание маловесных детей, в том числе детей с внутриутробной гипотрофией. Это действительно возможно при длительном избыточном питании детей, особенно после первого года, когда формируются основы пищевого поведения, сохраняющиеся в течение всей жизни. Но, с другой стороны, при длительном дефиците питания происходят изменения обмена веществ, направленные на максимальное сохранение энергии, и результатом является снижение скорости роста и тощей массы тела, при увеличении жировой составляющей (абдоминальный жир). То есть как недостаточное, так и избыточное питание может привести к развитию метаболического синдрома. Однако при дефиците нутриентов, помимо этого, еще снижается интеллект, а также развиваются остеопения, анемия и другие дефицитные состояния, имеющие отдаленные негативные последствия [3–5, 12]. Нерациональное питание и низкая физическая активность в последующие годы увеличивает риск возникновения метаболического синдрома.
Как показывают исследования, проведенные Sawaya A. L., количественная и качественная оптимизация питания детей с задержкой физического развития, возникшей в результате недостаточного питания, позволяет вернуться к нормальным прибавкам в массе и длине тела, способствует нормализации состава тела, плотности костной ткани и метаболизма инсулина у детей любого возраста. Однако у детей до двух лет этот процесс протекает быстрее [13].
Лечение детей с гипотрофией заключается в проведении диетотерапии, медикаментозной коррекции и своевременном оказании психосоциальной помощи.
Для выбора тактики диетологического лечения необходимо:
Затем проводится коррекция качественного и количественного состава рациона с учетом физиологических потребностей ребенка, его функциональных возможностей и специфики патологии.
На наш взгляд, принципиальные различия в подходах к проведению диетотерапии существуют при гипотрофии I–II и гипотрофии III степени. Это обусловлено различиями в течении обменных процессов, функционировании пищеварительной системы и характере выявленных гормональных нарушений. Кроме того, традиционные принципы ведения детей с гипотрофией I и II степени схожи и отличаются лишь расчетами первоначального поступления пищевых веществ. При гипотрофии I степени количество нутриентов рассчитывается на долженствующую массу тела, а при гипотрофии II степени — на фактическую с постепенным переходом на долженствующую. В то же время большинство детей с гипотрофией II степени (как правило, это дети с различной патологией) уже получают усиленное питание, рассчитанное на долженствующую массу тела. В такой ситуации ограничение питания нецелесообразно, первая фаза расчетов опускается, и питание назначается так же, как и детям с гипотрофией I степени.
Гипотрофия I степени развивается под влиянием недостаточного питания, а также различных соматических и инфекционных заболеваний. В первом случае необходимо наладить общий режим, уход за ребенком, устранить дефекты вскармливания. Предпочтение при назначении питания следует отдавать грудному молоку, а при смешанном и искусственном вскармливании — адаптированным молочным смесям, обогащенным про- и пребиотиками, благоприятно влияющими на процессы пищеварения и нормализацию состава микрофлоры кишечника, нуклеотидами, которые способствуют оптимальному росту и функционированию органов ЖКТ, улучшают всасывание пищевых веществ и оптимизируют созревание иммунной системы ребенка, а также длинноцепочечными полиненасыщенными жирными кислотами (ДПНЖК), оказывающими влияние на ростозависимую экспрессию генов, рост клеток и активность мембранозависимых процессов. Возможно использование кисломолочных смесей в количестве не более 1/2 от общего объема кормления [14]. Неадаптированные кисломолочные продукты (кефир, йогурт и т. п.) не должны назначаться детям ранее 8–9 месячного возраста. Для повышения энергетической ценности рациона и увеличения квоты белка необходимо своевременное введение прикорма (каши, овощное пюре с мясом и растительным маслом, творог).
При гипотрофии, развившейся на фоне соматической или инфекционной патологии, основной продукт питания (грудное молоко и лечебная смесь) назначается с учетом характера основного заболевания (мальабсорбция, повышенные потребности и др.).
При гипотрофии I степени расчеты и коррекция питания проводятся на долженствующую массу тела, которая складывается из массы тела при рождении и суммы нормальных ее прибавок за прожитый период (табл. 3). Однако ряд заболеваний требует повышения энергетической ценности рациона (бронхолегочная дисплазия, целиакия, муковисцидоз и др.).
Гипотрофия II степени преимущественно развивается при тяжелой врожденной или приобретенной патологии, недостаточное питание становится его причиной значительно реже. Диетическая коррекция алиментарной гипотрофии II степени условно подразделяется на три периода: адаптационный период (определение толерантности к пище), репарационный период (промежуточный) и период усиленного питания.
В периоде адаптации (продолжительность 2–5 дней) расчет питания проводится на фактическую массу тела (табл. 3). Число кормлений увеличивается на 1–2 в сутки с соответствующим снижением объема каждого кормления, при необходимости дополнительно вводится жидкость (5% раствор глюкозы или солевые растворы для оральной регидратации). В этот период предпочтительно использование грудного молока, при его недостатке или отсутствии — адаптированных детских молочных смесей, обогащенных пробиотиками, олигосахаридами и нуклеотидами. Возможно использование смесей с более высоким содержанием белка, например, специализированных молочных смесей для недоношенных и маловесных детей. При выявлении нарушений расщепления/всасывания пищевых ингредиентов целесообразно использование лечебных продуктов (например, низколактозных смесей при лактазной недостаточности, смесей с повышенной квотой среднецепочечных триглицеридов при мальабсорбции жиров). При отсутствии эффекта следует назначать смеси на основе высокогидролизованного молочного белка со среднецепочечными триглицеридами [3, 14].
В дальнейшем, при нормальной переносимости, начинается период репарации, когда объем питания постепенно (в течение 5–7 дней) увеличивается, при этом расчет нутриентов проводят на долженствующую массу тела. Сначала повышают углеводную и белковую составляющие рациона и лишь в последнюю очередь — жировую. Это становится возможным при введении прикорма. Первыми целесообразно назначать безмолочные каши промышленного производства, которые разводятся грудным молоком или смесью, которую получает ребенок, затем вводят мясное пюре, творог, желток. В этот период рекомендуется назначать ферментные препараты, поливитаминные комплексы и средства, положительно влияющие на обменные процессы (Элькар, Оротат калия, Корилип, Лимонтар, Глицин и др.).
Далее следует период усиленного питания, в течение которого ребенок получает высококалорийное питание (130–145 ккал/кг/сут) в комплексе с лекарственными препаратами, улучшающими переваривание и усвоение пищи. В случаях, когда гипотрофия II степени обусловлена тяжелым течением хронического заболевания и ребенок на момент обращения к врачу уже получает высококалорийную диету, проводится ревизия рациона. На фоне медикаментозного лечения основного заболевания и использования препаратов, способствующих улучшению переваривания и усвоения нутриентов и средств, положительно влияющих на обменные процессы, назначаются специализированные продукты с повышенным содержанием легкоусвояемого белка и содержащие среднецепочечные триглицериды.
Постепенно, с 4 месячного возраста, вводятся продукты прикорма, преимущество следует отдавать кашам промышленного производства, для разведения которых используются указанные смеси. Особое внимание уделяется достаточному содержанию в рационах питания мясного пюре, растительных масел.
Гипотрофия III степени, как и гипотрофия II степени, как правило, возникает при тяжелых соматических и инфекционных заболеваниях. При этом резко нарушаются все виды обмена, состояние ребенка, как правило, бывает очень тяжелым, поэтому такие дети нуждаются в проведении интенсивной терапии, использовании парентерального питания и энтерального, что требует стационарного лечения. Парентеральное питание начального периода должно быть обоснованным, сбалансированным и максимально кратковременным из-за опасности развития тяжелых осложнений. В первые дни используются аминокислотные препараты и растворы глюкозы, затем добавляются жировые эмульсии.
Параллельно проводится парентеральная коррекция дегидратации, нарушений кислотно-основного состояния (КОС) (как правило, ацидоза) и электролитных нарушений. Наиболее оправданным видом энтерального питания при тяжелых формах гипотрофии является длительное зондовое питание, которое заключается в непрерывном медленном поступлении питательных веществ в ЖКТ (желудок, двенадцатиперстную кишку, тощую кишку — капельно, оптимально — с помощью инфузионного насоса). Постоянное (или с небольшими интервалами) медленное введение специализированных продуктов абсолютно оправдано, так как энерготраты на переваривание и усвоение питательных веществ в этих условиях гораздо ниже, чем при порционном введении.
При таком способе кормления улучшается полостное пищеварение, постепенно повышается всасывающая способность кишки и нормализуется моторика верхних отделов ЖКТ. Для энтерального питания у детей раннего возраста должны использоваться специализированные продукты. Наиболее оправданным является применение смесей на основе высокогидролизованного молочного белка, не содержащих лактозу, обогащенных среднецепочечными триглицеридами (Альфаре, Нутрилон Пепти ТСЦ, Нутрилак Пептиди СЦТ, Прегестимил) [14].
Они обеспечивают максимальное усвоение питательных веществ в условиях значительного угнетения переваривающей и всасывающей способности пищеварительного тракта. Предпочтительно наличие в лечебном продукте и ДПНЖК, особенно докозагексаеновой кислоты (ДГК), способствующей снижению активности воспалительного процесса, связанного с основным заболеванием, и адекватному иммунному ответу. В Научном центре здоровья детей РАМН накоплен большой положительный опыт по использованию специализированной лечебной смеси Альфаре, обогащенной ДГК, в питании тяжелобольных детей с нарушениями нутритивного статуса.
Энергетическая ценность продуктов на основе высокогидролизованного молочного белка колеблется в пределах 0,66–0,72 ккал/мл, что при введении одного литра обеспечит ребенку 650–720 ккал/сут. При необходимости в первые дни лечебная смесь может разводиться в концентрации 5–7 г сухого порошка на 100 мл воды (5–7% раствор). Далее постепенно доводят концентрацию смеси до 13,5% (физиологической), а при хорошей переносимости — до 15%. Недостающие калории, нутриенты и электролиты в период применения смеси в низкой концентрации компенсируются за счет парентерального питания.
Длительность периода постоянного энтерального зондового питания варьирует от нескольких дней до нескольких недель в зависимости от выраженности нарушений толерантности к пище (анорексии, рвоты, диареи). В течение этого периода адаптации постепенно повышается калорийность рациона до 120 ккал на кг фактической массы и осуществляется медленный переход на порционное введение питательной смеси — 10 раз, а затем 7–8 раз в течение дня с сохранением и равномерным распределением достигнутого объема. С этой целью при переходе на дробное питание можно вначале оставлять постоянную инфузию на ночное время до того момента, когда порционное питание по калорийности не превысит 75% дневной нормы потребления.
В репарационный период осуществляется коррекция белкового, углеводного и затем жирового компонентов питания, расчет нутриентов производится на долженствующую массу тела, что приводит к повышению энергетической ценности рациона (табл. 3). В питание ребенка постепенно вводятся высококалорийные продукты прикорма, возможно введение адаптированных кисломолочных смесей. При хорошей переносимости назначенного рациона на этапе усиленного питания калорийность увеличивается до 130–145 ккал/кг/сут на долженствующую массу тела, с повышенным содержанием нутриентов, но не более: белка — 5 г/кг/сут, жира — 6,5 г/кг/сут, углеводов — 14–16 г/кг/сут. Средняя длительность этапа усиленного питания составляет 1,5–2 месяца. Основным показателем адекватности диетотерапии служит прибавка массы тела. Оптимальной считается прибавка, если она превышает 10 г/кг/сут, средней — 5–10 г/кг/сут и низкой — менее 5 г/кг/сут. В настоящее время причиной развития гипотрофии III степени у детей, как правило, является тяжелая хроническая соматическая патология, а не недостаточное питание, поэтому своевременная диагностика и лечение причинно-значимого заболевания являются основополагающим фактором профилактики и лечения данного состояния.
Медикаментозная терапия при гипотрофии III степени
Помимо медикаментозной (парентеральной) коррекции обезвоживания и электролитных нарушений, в остром периоде необходимо помнить о необходимости проведения своевременной диагностики возможной надпочечниковой недостаточности. Начиная с периода репарации, целесообразна заместительная ферментотерапия препаратами поджелудочной железы. Предпочтение отдается микрокапсулированным препаратам. При дисбактериозе кишечника, проведении антибактериальной терапии назначаются биопрепараты. Применение анаболических средств осуществляется с осторожностью, так как в условиях дефицита питательных веществ их использование может вызвать глубокие нарушения белкового и других видов обмена, угнетение ферментов пристеночного пищеварения. Показано применение витаминотерапии со стимулирующей и заместительной целью. На первых этапах лечения целесообразно парентеральное введение витаминных препаратов. Лечение рахита, железодефицитной анемии проводится начиная с периода репарации. Показания к проведению стимулирующей и иммунотерапии определяются индивидуально. В периоды адаптации и репарации следует отдавать предпочтение пассивной иммунотерапии (иммуноглобулины). В период реконвалесценции могут назначаться неспецифические иммуностимуляторы.
Литература
*НЦЗД РАМН, **РГМУ, Москва