Метаболиты что это
Метаболиты что это
МЕТАБОЛИТЫ
Метаболиты (греч. metabole перемена, превращение) — вещества, подвергающиеся химическим превращениям в организме в процессе промежуточного обмена веществ (метаболизма).
За счет действия разного рода регуляторных механизмов динамические концентрации Метаболитов в здоровом организме поддерживаются на постоянном уровне, характерном для каждого Метаболита. Средние величины этих концентраций (с указанием пределов колебаний) служат одной из характеристик нормы. При патологических состояниях концентрации Метаболитов изменяются, причем эти изменения часто бывают специфичными для той или иной болезни. На этом основаны многие биохимические методы лабораторной диагностики болезней.
Многие Метаболиты поступают в организм извне в составе пищи и являются предшественниками других М., образующихся в организме. Вещества в живой клетке последовательно превращаются сначала в один М., из к-рого образуется другой, и т. д. Такие последовательности превращений называют метаболическими путями. Напр., метаболический путь распада глюкозы до молочной кислоты включает такую последовательность М.: глюкоза —> глюкозо-6-фосфат —> фруктозо-6-фосфат —> фруктозо-1,6-дифосфат —> фосфоглицериновый альдегид 1,3-дифосфоглицериновая к-та —> фосфоенолпировиноградная к-та —> Пировиноградная к-та —> молочная к-та. Каждый метаболит образуется из своего предшественника в результате действия специфического фермента и, в свою очередь, служит субстратом для другого фермента (см. Ферменты). На этом основано избирательное прерывание метаболических цепей с помощью антиметаболитов (см.) — структурных аналогов метаболитов, к-рые используются в качестве лекарственных средств, а также в экспериментальных исследованиях.
В процессе метаболизма образуются М., являющиеся структурно-функциональными компонентами клетки, напр. такие, как коферменты, гормоны и другие регуляторные вещества, белки, нуклеиновые к-ты, структурные полисахариды и т. д. Следует, однако, отметить, что термин «метаболиты» к высокомолекулярным веществам применяют редко. М. могут превращаться в конечные продукты обмена веществ (конечные М.), выводимые из организма. Основными конечными М. для многих животных и человека являются углекислота (CO2), вода, мочевина (у рептилий и птиц вместо мочевины образуется мочевая к-та). Ряд конечных М., в т. ч. М. чужеродных соединений, выводится в форме глюкуронидов, сульфатов, продуктов микросомного окисления.
Клетки разных видов животных имеют как сходство, так и различия по составу Метаболитов. Напр., аминокислоты, нуклеотиды, многие коферменты и др. являются универсальными для всех форм жизни. Напротив, М., являющиеся предшественниками незаменимых пищевых факторов человека — витаминов, незаменимых аминокислот, незаменимых жирных к-т и т. п., отсутствуют в организме человека, но имеются у многих микроорганизмов, растений и нек-рых животных, способных синтезировать эти вещества,
Метаболиты
Метаболиты бывают первичными, вторичными, промежуточными (подвергающимися дальнейшим биотрансформациям) и конечными, не подвергающимися дальнейшей биотрансформации и выделяемыми из организма с мочой, калом, потом, выдыхаемым воздухом и др.
Связанные понятия
Эстеразы — ферменты, катализирующие в клетках гидролитическое расщепление сложных эфиров (англ. esters) на спирты и кислоты при участии молекул воды (гидролиз).
Альдегиддегидрогеназы — группа ферментов, катализирующих окисление альдегидов. Играют важную роль в выведении алкоголя из организма.
Холинэстеразы — группа ферментов из класса гидролаз карбоновых кислот, субстратами которых являются сложные эфиры холина с уксусной, пропионовой или масляной кислотами. Одной из важных качественных реакций на фермент является — ингибирование алкалоидом эзерином в концентрации 10−5 — 10−8М.
Упоминания в литературе
Связанные понятия (продолжение)
Пролекарство — это химически модифицированная форма лекарственного средства (эфир, соль, соль эфира и т. д.), которая в биосредах в результате метаболических процессов превращается в само лекарственное средство.
Ферментативный ингибитор — вещество, замедляющее протекание ферментативной реакции. Различают обратимые и необратимые ингибиторы (см. ниже).
Метаболиты
Метаболиты бывают первичными, вторичными, промежуточными (подвергающимися дальнейшим биотрансформациям) и конечными, не подвергающимися дальнейшей биотрансформации и экскретируемыми из организма с мочой, калом, потом, выдыхаемым воздухом и др.
Первичные метаболиты
Первичными метаболитами называют молекулы, присутствующие во всех клетках организма и необходимые для жизнедеятельности. Они делятся на четыре категории:
Пример: глюкоза — первичный метаболит, основной и наиболее универсальный источник энергии в организме человека и животных.
Вторичные метаболиты
Вторичные метаболиты — молекулы, встречающиеся не во всех клетках и не у всех видов живых организмов.
См. также
Полезное
Смотреть что такое «Метаболиты» в других словарях:
МЕТАБОЛИТЫ — промежуточные продукты обмена веществ в живых клетках. Многие из них оказывают регулирующее влияние на биохимические и физиологические процессы в организме … Большой Энциклопедический словарь
МЕТАБОЛИТЫ — МЕТАБОЛИТЫ, химические вещества, задействованные в метаболических процессах в клетках организмов. Эти вещества принимают участие в различных биологических обменах энергией, необходимых для роста организма, поддержания его жизнедеятельности и для… … Научно-технический энциклопедический словарь
метаболиты — вещества, образующиеся в клетке в процессе метаболизма. (Источник: «Микробиология: словарь терминов», Фирсов Н.Н., М: Дрофа, 2006 г.) … Словарь микробиологии
МЕТАБОЛИТЫ — см. Гормоны среды. Экологический энциклопедический словарь. Кишинев: Главная редакция Молдавской советской энциклопедии. И.И. Дедю. 1989 … Экологический словарь
метаболиты — – промежуточные продукты метаболитического пути или цикла … Краткий словарь биохимических терминов
метаболиты — промежуточные продукты обмена веществ в живых клетках. Многие из них оказывают регулирующее влияние на биохимические и физиологические процессы в организме. * * * МЕТАБОЛИТЫ МЕТАБОЛИТЫ, промежуточные продукты обмена веществ в живых клетках.… … Энциклопедический словарь
метаболиты — metabolitai statusas T sritis chemija apibrėžtis Organizmo medžiagų apykaitos produktai. atitikmenys: angl. metabolites rus. метаболиты … Chemijos terminų aiškinamasis žodynas
метаболиты — metabolitai statusas T sritis augalininkystė apibrėžtis Medžiagų apykaitos produktai, susidarantys ląstelėse, audiniuose bei organuose. atitikmenys: angl. metabolites rus. метаболиты … Žemės ūkio augalų selekcijos ir sėklininkystės terminų žodynas
метаболиты вторичные — соединения, часто сложного состава, не являющиеся основными промежуточными соединениями метаболизма клетки, образуются в его тупиковых ветвях. М. в. растений являются, напр., алкалоиды. Микроорганизмы образуют М. в., как правило, в период… … Словарь микробиологии
Основные закономерности метаболических процессов в организме человека. Часть 1.
Метаболизм – обмен веществ и энергии — представляет собой по классическим определениям, с одной стороны, обмен веществами и энергией между организмом и окружающей средой, а, с другой стороны, совокупность процессов превращения веществ и трансформации энергии, происходящих непосредственно в самих живых организмах. Как известно, обмен веществ и энергии является основой жизнедеятельности организмов и принадлежит к числу важнейших специфических признаков живой материи. В обмене веществ, контролируемом многоуровневыми регуляторными системами, участвует множество ферментных каскадов, обеспечивающих совокупность химических реакций, упорядоченных во времени и пространстве. Данные биохимические реакции, детерминированные генетически, протекают последовательно в строго определенных участках клеток, что, в свою очередь обеспечивается принципом компартментации клетки. В конечном итоге в процессе обмена поступившие в организм вещества превращаются в собственные специфические вещества тканей и в конечные продукты, выводящиеся из организма. В процессе любых биохимических трансформаций освобождается и поглощается энергия.
Клеточный метаболизм выполняет четыре основные специфические функции, а именно: извлечение энергии из окружающей среды и преобразование ее в энергию макроэргических (высокоэнергетических) химических соединений в количестве, достаточном для обеспечения всех энергетических потребностей клетки; образование из экзогенных веществ промежуточных соединений, являющихся предшественниками высокомолекулярных компонентов клетки; синтез из этих предшественников белков, нуклеиновых кислот, углеводов, липидов и других клеточных компонентов; синтез и разрушение специальных биомолекул, образование и распад которых связаны с выполнением специфических функций данной клетки.
Поскольку первоначальные представления об обмене веществ возникли в связи с изучением процессов обмена между организмом и внешней средой и лишь впоследствии эти представления расширились до понимания путей трансформации веществ и энергии внутри организма, до настоящего времени принято выделять соответственно внешний, или общий, обмен веществ и внутренний или промежуточный, обмен веществ. В свою очередь как во внутреннем, так и во внешнем обмене веществ различают структурный (пластический) и энергетический обмен. Под структурным обменом понимают взаимные превращения различных высоко- и низкомолекулярных соединений в организме, а также их перенос (транспорт) внутри организма и между организмом и внешней средой. Под энергетическим обменом понимают высвобождение энергии химических связей молекул, образующейся в ходе реакций и ее превращение в тепло (большая часть), а также использование энергии на синтез новых молекул, активный транспорт, мышечную работу (меньшая часть). В процессе обмена веществ часть конечных продуктов химических реакций выводится во внешнюю среду, другая часть используется организмом. В этом случае конечные продукты органического обмена накапливаются или расходуются в зависимости от условий существования организма, называясь запасными или резервными веществами.
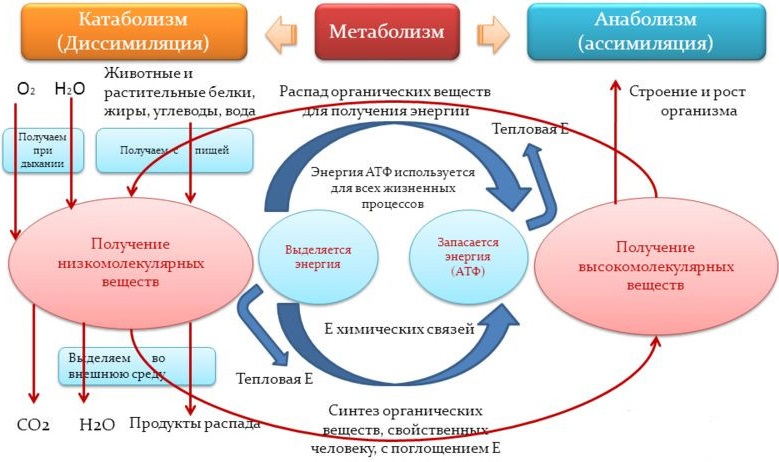
Как указывалось выше совокупность химических превращений веществ, которые происходят непосредственно в организме, начиная с момента их поступления в кровь и до момента выделения конечных продуктов обмена из организма, называют промежуточным обменом (промежуточным метаболизмом). Промежуточный обмен может быть разделен на два процесса: катаболизм (диссимиляция) и анаболизм (ассимиляция). Катаболизмом называют ферментативное расщепление крупных органических молекул, осуществляемое у всех высших организмов, как правило, окислительным путем. Катаболизм сопровождается освобождением энергии, заключенной в химических связях органических молекул, и резервированием ее в форме энергии фосфатных связей молекулы аденозинтрифосфорной кислоты (АТФ). Анаболизм, напротив, представляет собой ферментативный синтез крупномолекулярных клеточных компонентов, таких, как полисахариды, нуклеиновые кислоты, белки, липиды, а также некоторых их биосинтетических предшественников из более простых соединений. Анаболические процессы происходят с потреблением энергии. Процессы катаболизма и анаболизма происходят в клетках одновременно, неразрывно связаны друг с другом и являются обязательными компонентами одного общего процесса — метаболизма, в котором превращения веществ теснейшим образом переплетены с превращениями энергии. Катаболические и анаболические реакции различаются, как правило, локализацией в клетке. Например, окисление жирных кислот до углекислого газа и воды осуществляется с помощью набора митохондриальных ферментов, тогда как синтез жирных кислот катализирует другая система ферментов, находящихся в цитозоле. Именно благодаря разной локализации катаболические и анаболические процессы в клетке могут протекать одновременно. При этом все превращения органических веществ, процессы синтеза и распада взаимосвязаны, координированы и регулируются нейрогормональными механизмами, придающими химическим процессам нужное направление. В организме человека не существует самостоятельного обмена белков, жиров, углеводов и нуклеиновых кислот. Все превращения объединены в целостный процесс метаболизма, допускающий также взаимопревращения между отдельными классами органических веществ. Подобные взаимопревращения диктуются физиологическими потребностями организма, а также целесообразностью замены одних классов органических веществ другими в условиях блокирования какого-либо процесса при патологии.
На второй стадии катаболизма продуктами химических реакций становятся еще более простые молекулы, унифицированные для углеводного, белкового и липидного обмена. по своему типу (гликолиз, катаболизм аминокислот, β-окисление жирных кислот соответственно). Принципиальным является то, что на второй стадии катаболизма образуются продукты, которые являются общими для обмена исходно разных групп веществ. Эти продукты представляют собой ключевые химические соединения, соединяющие разные пути метаболизма. К таким соединениям относятся, например, пируват (пировиноградная кислота), образующийся при распаде углеводов, липидов и многих аминокислот, ацетил-КоА, объединяющий катаболизм жирных кислот, углеводов и аминокислот, a-кетоглутаровая кислота, оксалоацетат (щавелевоуксусная кислота), фумарат (фумаровая кислота) и сукцинат (янтарная кислота), образующиеся при трансформации аминокислот. Продукты, полученные на второй стадии катаболизма, вступают в третью стадию, которая известна как цикл трикарбоновых кислот (терминальное окисление, цикл лимонной кислоты, цикл Кребса). На третьем этапе ацетил-КоА и некоторые другие метаболиты, например α-кетоглутарат, оксалоацетат, подвергаются окислению в цикле ди- и трикарбоновых кислот Кребса. Окисление сопровождается образованием восстановленных форм НАДН + Н+ и ФАДН2. Именно в ходе второй и третьей стадий катаболизма освобождается и аккумулируется в виде АТФ практически вся энергия химических связей подвергнутых диссимиляции веществ. При этом осуществляется перенос электронов от восстановленных нуклеотидов на кислород через дыхательную цепь, сопровождающийся образованием конечного продукта – молекулы воды. Транспорт электронов в дыхательной цепи сопряжен с синтезом АТФ в процессе окислительного фосфорилирования.
В процессе обмена веществ постоянно происходит превращение энергии: потенциальная энергия сложных органических соединений, поступивших с пищей, превращается в тепловую, механическую и электрическую. Энергия расходуется не только на поддержание температуры тела и выполнение работы, но и на воссоздание структурных элементов клеток, обеспечение их жизнедеятельности, роста и развития организма. Тем не менее, только часть получаемой при окислении белков, жиров и углеводов энергии используется для синтеза АТФ, другая, значительно большая, превращается в теплоту. Так, при окислении углеводов 22, 7% энергии химических связей глюкозы в процессе окисления используется на синтез АТФ, а 77, 3% в виде тепла рассеивается в тканях. Аккумулированная в АТФ энергия используемая в дальнейшем для механической работы, химических, транспортных, электрических процессов в конечном счете тоже превращается в теплоту. Следовательно, количество тепла, образовавшегося в организме, становится мерой суммарной энергии химических связей, подвергшихся биологическому окислению. Поэтому вся энергия, образовавшаяся в организме, может быть выражена в единицах тепла — калориях или джоулях.
Общий баланс энергии организма определяют на основании калорийности вводимых пищевых веществ и количества выделенного тепла, которое может быть измерено или рассчитано. При этом надо учитывать, что величина калорийности, получаемая при лабораторной калориметрии, может отличаться от величины физиологической калорической ценности, поскольку некоторые вещества в организме не сгорают полностью, а образуют конечные продукты обмена, способные к дальнейшему окислению. В первую очередь это относится к белкам, азот которых выделяется из организма главным образом в виде мочевины, сохраняющей некоторый потенциальный запас калорий. Очевидно, что калорическая ценность, дыхательный коэффициент и величина теплообразования для разных веществ различны. Физиологическая калорическая ценность (в ккал/г) составляет для углеводов — 4, 1; липидов — 9, 3; белков — 4, 1; величина теплообразования (в ккал на 1 литр потребленного кислорода) для углеводов составляет 5, 05; липидов — 4, 69; белков — 4, 49.
Процесс анаболизма по аналогии с катаболическими процессами также проходит три стадии. При этом исходными веществами для анаболических процессов служат продукты второй стадии и промежуточные соединения третьей стадии катаболизма. Таким образом вторая и третья стадии катаболизма являются в то же время первой, исходной стадией анаболизма и химические реакции, протекающие в данном месте и в данное время, выполняют по сути двойную функцию. С одной стороны, они являются основой завершающего этапа катаболизма, а с другой — служат инициацией для анаболических процессов, поставляя вещества-предшественники для последующих стадий ассимиляции. Подобным образом, например, начинается синтез белка. Исходными реакциями этого процесса можно считать образование некоторых a-кетокислот. На следующей, второй стадии в ходе реакций аминирования или трансаминирования эти кетокислоты превращаются в аминокислоты, которые на третьей стадии анаболизма объединяются в полипептидные цепи. В результате ряда последовательных реакций происходит также синтез нуклеиновых кислот, липидов и полисахаридов. Тем не менее следует подчеркнуть, что пути анаболизма не являются простым обращением процессов катаболизма. Это связано прежде всего с энергетическими особенностями химических реакций. Некоторые реакции катаболизма практически необратимы, поскольку их протеканию в обратном направлении препятствуют непреодолимые энергетические барьеры. Поэтому в ходе эволюции были выработаны другие, специфические для анаболизма реакции, где синтез олиго- и полимерных соединений сопряжен с затратой энергии макроэргических соединений, прежде всего – АТФ.
Основные функции продуктов метаболизма в организме человека
Роль метаболитов для организма человека
Метаболизм или обмен веществ – это один из важнейших процессов, протекающих в организме живых существ. Его нарушение может привести к ряду проблем, таких как ожирение. Кроме того, неправильный обмен веществ нередко приводит к проявлению аллергических реакций, может стать причиной атопического дерматита у детей и так далее.
Важную роль в описанном процессе играют метаболиты. Собственно, именно благодаря этим веществам обмен веществ и становится возможным. Они бывают:
Метаболиты последней категории в дальнейшем уже не участвуют ни в каких процессах и выводятся из организма вместе с продуктами жизнедеятельности, а именно с мочой, калом, потом и так далее.
Первичные метаболиты
Вещества именно этой группы имеют наибольшее значение, поскольку встречаются во всех без исключения клетках организма и необходимы для нормальной жизнедеятельности. Выделяют четыре категории первичных метаболитов:
Вещества первой категории встречаются в природе чаще любых других биологических молекул. Среди наиболее важных их функций можно выделить транспортировку и хранение необходимой организму энергии. Великолепно справляются с данной задачей гликоген и крахмал. Кроме того, некоторые углеводы, в частности хитин у животных или целлюлоза у растений, выполняют еще и структурную функцию.
Огромное значение для метаболизма имеют белки. Набор задач, которые они выполняют, крайне широк. Одни из них являются катализаторами, то есть ускоряют химические реакции, протекающие в организме. Другие выполняют механическую функцию, кажем, формируя цитоскилет. Плюс к этому, белки отвечают за регуляцию клеточного цикла, иммунных реакций, а также за передачу сигналов через мембраны. Именно поэтому так важно употреблять в пищу достаточное количество белковой пищи, главным образом, мяса. Это поможет вам, кроме всего прочего, бороться с рядом заболеваний, к примеру, вызванных бактерией proteus.
Липиды являются наиболее эффективными источниками энергии в организме. Это объясняется тем, что в них содержится большое количество остатков жирных кислот, которые, в свою очередь, характеризуются крайне низким уровнем окисления. Также липиды выполняют функцию теплоизоляции. Именно поэтому у большинства теплокровных животных основное количество жировой ткани сосредоточено непосредственно под кожными покровами. Фосфолипиды, такие как, холестерин, воск и прочие выполняют структурную функцию, принимая непосредственное участие в построении клеточных мембран и некоторых наружных органов растений.
Из нуклеотидов состоят такие полимерные молекулы, как ДНК и РНК. Основная их функция – это хранение и последующая реализация генетической информации. Нарушения в этих молекулах может привести к очень серьезным заболеваниям и даже мутациям организма. Некоторые вирусы, например, ВИЧ, имеют в своем строении РНК-содержащий геном и благодаря этому могут создавать собственную матрицу ДНК.
В завершение можно сделать, что метаболиты выполняют ряд важнейших функций в жизнедеятельности любого живого организма, в том числе и человека.
Метаболиты что это
Неблагоприятная экология, стрессы, всевозможные житейские и служебные неурядицы пагубно сказываются на здоровье. Первое, что приходит на ум: «Чем лечиться?» Увы, многие лекарства либо мало эффективны, либо эффективны настолько, что поражают не только цель, но и соседние здоровые ткани и органы. Последствия такой «химической атаки» не всегда предсказуемы. Но есть и другой способ борьбы с заболеваниями. Препараты метаболитной терапии качественно отличаются от искусственно синтезированных соединений и не вызывают побочных эффектов. Чем же обусловлено столь благоприятное действие?
Метаболизм – слово многим незнакомое. В переводе с греческого – перемена, превращение. Чаще всего, говоря о метаболизме, подразумевают обмен веществ в организме в целом. В более узком (научном) понимании этот термин означает внутриклеточный обмен – превращения биологически активных соединений с момента их поступления в клетку до образования конечных продуктов. Какие же из этих веществ наиболее важны для организма?
В качестве основных химических соединений, которые присутствуют в живых клетках и участвуют в метаболизме, можно выделить аминокислоты, витамины, сахара, карбоновые кислоты, и др. Они выступают в качестве основных «кирпичиков», из которых собраны живые организмы. Их можно также назвать естественными метаболитами, т.е. такими метаболитами, которые присутствуют в организме и необходимы для работы клеток. Следует заметить, что абсолютно все лекарства в организме тоже рассматриваются как метаболиты, однако если они не являются веществами, присутствующими в клетке в нормальных условиях, то они называются ксенобиотиками («чужеродные вещества»). Примечательно, что большинство естественных метаболитов имеют не одну, а несколько функций в организме. Например, аминокислоты являются компонентами биологических полимеров – белков. В то же время некоторые из них играют роль нейромедиаторов – биологических веществ, обеспечивающих передачу нервного импульса с одной клетки на другую, необходимых для нормальной работы нервной системы, а также могут выступать в качестве «топлива» для энергетических станций клеток.
Если изобразить метаболизм в виде карты, аминокислоты будут находиться в самом ее центре, принимая участие в большом количестве реакций. В ходе этих реакций они способны превращаться в другие метаболиты, или, говоря научным языком, являться предшественниками при синтезе соединений, необходимых для нормального функционирования организма.
Поэтому рациональный метод лечения и профилактики многих заболеваний – предоставить клетке право «самой решать», какие молекулы синтезировать, обеспечив её «строительным материалом», необходимым в данном случае, при данной патологии.
Традиционные таблетки – дополнительная нагрузка на биохимические процессы в организме. В большинстве случаев они лишь усугубляют ситуацию на уровне клеток. И только препараты-метаболиты, в состав которых входят естественные соединения, позволяют клетке привести в действие собственные механизмы репарации (способности исправлять повреждения), подкорректировать на молекулярном уровне внутренние «поломки», приостановить или затормозить развитие заболеваний. При этом практически отсутствуют побочные явления, не наблюдается осложнений и синдрома отмены!
Именно такие препараты по праву называют лекарствами здорового человека.
Метаболиты что это
Метаболизм; обмен веществ.
Синонимы английские
Metabolism; metabolic balance.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Процесс обмена веществ, или метаболизма, представляет собой ряд биохимических и молекулярных реакций и взаимодействий, необходимых для нормального функционирования организма. Различают углеводный, белковый, жировой (липидный) обмены веществ, обмен гормонов и биологически активных веществ, а также обмен микроэлементов. В норме обмен веществ в организме человека сбалансирован и обеспечивает стабильное функционирование систем и органов. Метаболизм включает как процессы распада веществ (катаболизм), так и процессы синтеза (анаболизм). При патологическом изменении процессов метаболизма отмечаются нарушения на молекулярном, клеточном, тканевом уровнях с дальнейшей дисфункцией органов и организма в целом. Для оценки показателей обмена веществ, функционирования систем и органов используется определение спектра лабораторных диагностических параметров.
Печень является одним из жизненно важных органов организма человека и играет большую роль в поддержании различных видов обмена веществ. Это центральный орган, где проходят процессы синтеза, распада и превращения углеводов, жиров, аминокислот, расщепление потенциально токсичных соединений, образующихся в ходе обмена веществ. Аланинаминотрансфераза (АЛТ) и аспартатаминотрансфераза (АСТ) – это ферменты, относящиеся к группе аминотрансфераз. Фермент АЛТ обнаруживается в цитоплазме гепатоцитов, почках, в незначительном количестве в клетках сердца, скелетных мышцах и эритроцитах. Фермент АСТ главным образом содержится в кардиомиоцитах, в меньшем количестве – в печени (в цитоплазме и митохондриях гепатоцитов), скелетных мышцах, головном мозге и почках. У здоровых пациентов уровни АЛТ и АСТ в крови сравнительно низки. При поражении печени, мышц и других тканей может отмечаться нарастание уровня данных показателей. Выявление уровня данных ферментов в сыворотке крови позволяет оценить выраженность цитолитического синдрома при диагностике и мониторинге заболеваний печени. Гамма-глютамилтранспептидаза (ГГТП) – это фермент, который обнаруживают в желчных канальцах и эпителиальных клетках, выстилающих желчный проток. Он является катализатором переноса аминокислот из плазмы крови в клетки, а также их реабсорбции из желчи в кровь. В кровеносном русле она не содержится, только в клетках, при разрушении которых их содержимое попадает в кровь. Щелочная фосфатаза – это фермент, который находится в эпителиоцитах желчных протоков, в гепатоцитах, остеобластах, слизистой оболочке кишечника, в легких и почках. Повышение уровней представленных ферментов может свидетельствовать о патологических процессах печени и желчевыводящих путей. Их определение важно при холестазе, циррозе и онкологических процессах печени, при токсическом воздействии на печень.
Билирубин является продуктом распада гемоглобина и других гемсодержащих белков в печени, селезенке и клетках ретикулоэндотелиальной системы. В сыворотке крови он представлен в виде двух фракций: прямого и непрямого, составляющих общий билирубин. Выявление билирубина используется для диагностики и мониторинга желтух различной этиологии, для выявления заболеваний печени, обтурации внутри- и внепеченочных протоков, холестаза.
Лактатдегидрогеназа (ЛДГ) – это внутриклеточный фермент, который катализирует окисление молочной кислоты в пируват и содержится практически во всех клетках организма. Он наиболее активен в скелетной мускулатуре, сердечной мышце, почках, печени и эритроцитах. Является маркером повреждения тканей и разрушения клеток и используется в диагностике большого количества заболеваний. Креатинкиназа – фермент, который катализирует фосфорилирование креатина и его дефосфорилирование с образованием молекулы АТФ. Его наибольшая активность отмечается в скелетных мышцах и миокарде, меньшая – в клетках головного мозга, гладких мышцах, плаценте и других. Определение фермента является важным при цитолитических процессах при заболеваниях миокарда, скелетных мышц, при инсульте и др.
Фермент амилаза в основном секретируется клетками слюнных желез и поджелудочной железы. Он участвует в гидролитическом расщеплении полисахаридов. Липаза – это фермент, участвующий в гидролизе триглицеридов и входящий в состав секрета поджелудочной железы. Выявление данных показателей используется для диагностики патологических процессов, затрагивающих поджелудочную железу, заболевания слюнных желез и протоков, а также другие компоненты пищеварительной системы.
Почки являются главными органами мочевыделительной системы и играют важную роль в поддержании постоянства метаболизма в организме человека. Для оценки функционального состояния почек, в частности оценки сохранности процессов клубочковой фильтрации, используется определение уровней мочевины и креатинина в сыворотке крови, а также оценка скорости клубочковой фильтрации. Креатинин – это продукт неферментативного распада креатина и креатина фосфата, образующийся в мышцах. Мочевина – один из основных продуктов белкового метаболизма, содержащий азот. В норме данные метаболиты выводятся из организма человека с мочой. При их повышенном содержании можно судить о наличии патологических процессов почек, нарушающих нормальное функционирование почечного фильтра, проявляющихся как увеличением их выведения, так и избыточным накоплением. Косвенным параметром, отображающим функционирование почек, является уровень мочевой кислоты в сыворотке крови. Избыточное её накопление может свидетельствовать о снижении функционирования почечного фильтра, а также увеличении клеточной гибели в организме.
Жировой обмен веществ базируется на выявлении определенных компонентов, их количестве и соотношении в норме и патологии. Холестерол (холестерин) – это многоатомный циклический спирт, жизненно важный компонент органов и тканей человеческого организма. Он участвует в образовании мембран клеток, является исходным субстратом для синтеза половых гормонов, глюкокортикоидных гормонов, которые участвуют в росте, развитии организма и реализации функции воспроизведения. Из него образуются желчные кислоты, которые входят в состав желчи, витамин D. Холестерол нерастворим в воде, поэтому транспортируется в крови в составе липопротеинов, представляющих собой комплекс холестерол + аполипопротеин). Триглицериды являются основным источником энергии для организма, нерастворимы в воде и переносятся в крови с белком в виде комплекса, который называется липопротеином. Известно несколько типов липопротеинов, различающихся пропорциями входящих в их состав компонентов: липопротеины очень низкой плотности (ЛПОНП), липопротеины низкой плотности (ЛПНП), липопротеины высокой плотности (ЛПВП). Выявление общего холестерола и фракций липопротеинов используется для оценки риска развития атеросклероза, сердечно-сосудистых заболеваний, диагностики нарушений липидного обмена, метаболического синдрома.
Глюкоза является моносахаридом, который является основным энергетическим субстратом большинства тканей организма человека. Определение концентрации глюкозы играет основную роль в оценке углеводного обмена. Уровень глюкозы важен при диагностике гипер- и гипогликемии, нарушении толерантности к глюкозе, диагностике и мониторинге течения сахарного диабета, в комплексной диагностике метаболического синдрома.
Общее содержание белка в сыворотке крови отражает состояние белкового обмена. Белки сыворотки крови имеют разные размеры, заряд молекулы и относятся к альбуминам или глобулинам. Отклонение уровня общего белка от нормы может быть вызвано рядом физиологических состояний (непатологического характера) или являться симптомом различных заболеваний.
С-реактивный белок – это гликопротеин, вырабатываемый печенью и относящийся к белкам острой фазы воспаления. Он участвует в активации каскада воспалительных реакций на поверхности эндотелия сосудов, связывании и модификации липидов низкой плотности (ЛПНП), то есть способствует развитию атеросклероза. Повышенный уровень С-реактивного белка позволяет прогнозировать риск возникновения сердечно-сосудистой патологии (гипертонической болезни, инфаркта миокарда, инсульта, внезапной сердечной смерти), сахарного диабета 2-го типа и облитерирующего атеросклероза периферических сосудов.
Оценить состояние водно-электролитного обмена позволяет определение концентрации основных электролитов. К ним относятся калий (K), натрий (Na), кальций (Сa), железо (Fe). Они участвуют в поддержании водно-солевого баланса и кислотно-щелочного равновесия, работе сердечно-сосудистой, мышечной, нервной систем. Калий является основным внутриклеточным катионом. Натрий в большей концентрации, около 96 %, содержится во внеклеточной жидкости и крови. Данные микроэлементы участвуют в поддержании заряда мембран клеток, механизмах возбуждения мышечных и нервных волокон. Кальций относится к числу важнейших минералов организма человека. Около 99 % ионизированного кальция сосредоточено в костях и лишь менее 1 % циркулирует в крови. Он необходим для нормального сокращения сердечной мышцы, поперечно-полосатых мышц, для передачи нервного импульса, является компонентом свертывающей системы крови, каркаса костной ткани и зубов. Железо является микроэлементом, входящим в состав гемоглобина, миоглобина, некоторых ферментов и других белков, которые участвуют в обеспечении тканей и органов кислородом.
Клинический анализ крови позволяет оценить качественный и количественный состав крови по основным показателям: содержание эритроцитов и их специфических показателей, лейкоцитов и их разновидностей в абсолютном и процентном соотношении (лейкоцитарная формула), тромбоцитов.
Тиреотропный гормон (ТТГ) вырабатывается гипофизом и регулирует выработку гормонов щитовидной железы (тироксина и трийодтиронина) по «системе обратной связи», которая позволяет поддерживать стабильную концентрацию этих гормонов в крови. Гормоны щитовидной железы являются основными регуляторами расхода энергии в организме, и поддержание их концентрации на необходимом уровне крайне важно для нормальной деятельности практически всех органов и систем.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Причины повышения и понижения индивидуальны для каждого исследуемого показателя в комплексе. Рекомендуется оценивать полученные результаты как изолированно, так и совместно по исследуемым системам, органам при подозрении на ту или иную патологию.
Что может влиять на результат?
99 Лабораторное обследование при метаболическом синдроме
47 Развернутое лабораторное обследование почек
296 Лабораторное обследование функции печени
Кто назначает исследование?
Терапевт, врач общей практики, кардиолог, эндокринолог, гастроэнтеролог, нефролог, уролог, педиатр, хирург, гематолог.
Метаболический синдром: симптомы и диагностика нарушений обмена веществ
Метаболический синдром (МС) – это комплекс патологий, которые увеличивают риск возникновения сердечно-сосудистых заболеваний, инсульта и инфаркта.
Симптомы метаболического синдрома
По сути, метаболический синдром не является самостоятельным заболеванием. Это группа симптомов, которые часто встречаются вместе и увеличивают риск других – еще более тяжелых – нарушений.
Тревожные тенденции
Еще недавно метаболическим синдромом страдали преимущественно пожилые люди (старше 60 лет). Картина существенно изменилась за последние 20 лет. Динамика показала, что эта проблема молодеет и становится актуальной для более юного населения. В ряде стран доля взрослого населения, страдающая от этих симптомов, достигает 25%.
У метаболического синдрома есть еще одно название – «синдром нового мира». Дело в том, что преимущественно от ожирения и связанных с ним патологий страдают люди, ведущие малоподвижный образ жизни (а это касается преобладающего числа жителей больших городов), употребляющие большое количество быстрых углеводов и трансжиров. В результате во всем мире наблюдается всплеск сердечно-сосудистых заболеваний и диабета.
Метаболический синдром затрагивает как развитые страны (где высокотехнологичное производство избавило население от необходимости много двигаться), так и развивающиеся (большому проценту населения которых приходится экономить на продуктах питания и потреблять больше быстрых углеводов – макарон, хлеба, картофеля, кукурузы).
Есть и другая тенденция последних лет. От метаболического синдрома стали страдать женщины репродуктивного возраста. С чем это связано, до конца неясно. Предположительно, могут негативно влиять оральные контрацептивы.
Только представьте: за последние 20 лет число людей с метаболическим синдромом в мире выросло более чем на 100 млн – то есть на треть.
Особенно остро стоит проблема детского ожирения, а с ним и детского МС. Ученые связывают рост детского ожирения с частым отказом от грудного вскармливания. Грудное вскармливание исключает раннее введение прикорма, которое может привести к нездоровому увеличению веса. Потребление белка и общего количества энергии выше у детей, вскармливаемых смесями, что приводит к увеличению массы тела у младенцев. Также кормление смесью несколько увеличивает уровень инсулина, что в свою очередь способствует отложению жира и раннему развитию жировых клеток (адипоцитов).
Таким образом, быстрая прибавка в весе в младенческом возрасте связана с ожирением в детстве. Грудное вскармливание может помочь «запрограммировать» человека на поддержание здорового веса во взрослом возрасте.
В чем причины?
Метаболический синдром имеет наследственную предрасположенность, которая, однако, в большей степени тоже объясняется внешними факторами. Люди, выросшие в одной семье, с большей вероятностью будут иметь схожие пищевые привычки и одинаковое отношение к спорту. Если на родительском столе бывает огромное количество быстрых углеводов и жиров и мало – овощей, зелени и фруктов, у ребенка с детства закладываются нездоровые отношения с едой. Так же и со спортом: ребенок с большей вероятностью будет активным, если у него активные родители.
Факторы риска
Осложнения
Диагностика метаболического синдрома
Диагностика МС состоит из визуального осмотра у врача и лабораторных и инструментальных исследований. В первую очередь врач оценивает абдоминальное ожирение. Но одного лишнего веса для постановки диагноза недостаточно. Оцениваются и другие симптомы и результаты анализов. Также важно обнаружить причину ожирения. Лишний вес может быть следствием эндокринных нарушений, гормональных сбоев или иных патологий.
Другой важный критерий при постановке диагноза – артериальное давление. При метаболическом синдроме оно обычно повышено.
ЭКГ – требуется, чтобы проверить работу сердца и вовремя обнаружить патологии, если заболевание уже запущенно.
Ангиография. Сложное исследование, которое позволяет оценить состояние сосудов. Проводится только по назначению врача.
Диагностика метаболического синдрома – непростая комплексная задача, которая осложняется разнообразием форм заболевания, его причинами и способами коррекции. Также это состояние опасно тем, что долгие годы человек не ощущает себя больным. Самочувствие начинает страдать, когда появляются значительные отклонения в работе организма и развиваются осложнения. Ни один человек не может ощутить повышенный уровень глюкозы в крови или нарушение обмена холестерина. О себе дают знать только уже очень серьезные проблемы, вызванные этими нарушениями, – например, гнойное воспаление пальцев ног или сердечный приступ.
Международная классификация болезней не выделяет метаболический синдром как отдельное заболевание, это целый комплекс заболеваний.
Ни один диагноз нельзя поставить самостоятельно, но любое отклонение в результатах исследований – повод не откладывать поход к врачу.
Лечение
В более запущенных формах может потребоваться применение препаратов, снижающих инсулинорезистентность, и лечащих артериальную гипертонию.
Основная информация о метаболизме
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Многие считают, что их многочисленные неуспешные попытки похудеть связаны с плохим метаболизмом, а не с неправильным подходом к снижению веса. Именно на этом заблуждении наживаются недобросовестные предприниматели, продавая за большие деньги «волшебные» пилюли для ускорения обмена веществ.
Внимание! Следует понимать, что ни одной таблетке, экзотическому фрукту или чудо чаю не под силу по-настоящему запустить жиросжигающие процессы.
В этой статье будут опровергнуты основные мифы о метаболизме и приведены проверенные рекомендации по его ускорению.
Что такое метаболизм?
Метаболизм – это группа сложных процессов в организме, превращающих калории из пищи в полезную для жизнедеятельности человека энергию. Он зависит от:
На скорость усвоения пищи действуют разные факторы. Например, находясь в стрессовом состоянии, организм начинает вырабатывать кортизол, замедляющий пищеварительные процессы, и стимулирует запасание жировых отложений.
Внимание! Под метаболизмом подразумевают разные процессы – от переваривания сытного завтрака до дыхания во время сна, когда тело без участия мозга транспортирует кислород в органы.
Следует понимать, что у метаболизма нет скорости, а значит его классификации на медленный, нормальный и быстрый также не существует. Это обуславливается тем, что его скорость невозможно измерить. Но даже если бы это и было возможным, нет никаких эквивалентных единиц измерения, которыми можно было бы эту скорость описать.
Плохой обмен веществ: последствия и симптомы
Скорость усвоения пищи зависит от совокупности факторов, воздействующих на человека за определенный промежуток времени. То есть то, каким будет метаболизм – «быстрым» или «медленным», – зависит от образа жизни и реакции организма на окружающие раздражители.
Иногда даже неправильное трактование грамотных рекомендаций приводит к тому, что все меры похудения в конечном итоге не дают никакого практического результата. Например, человек, обстоятельно взявшийся за свой лишний вес, резко сокращает рацион до сильного дефицита калорий, употребляет большое количество ананасов ежедневно (они содержат ферменты, расщепляющие жир) и каждый день интенсивно тренируется в зале. В лучшем случае стрелка на весах не сдвинется, в худшем – покажет несколько лишних кг.
Это объясняется просто. Такими кардинальными мерами организм загоняется в стрессовое состояние. Мозг подает сигналы о том, что энергетические запасы иссякают, так как при серьезных физических нагрузках пропала энергия, которая поступала с пищей. Единственный вариант при этом – интенсивное запасание новых жировых отложений, чтобы спасти организм от энергетического голода.
Как ускорить метаболизм?
Единственный эффективный вариант ускорения метаболизма заключается в комбинации активных тренировок (кардио + силовых), увеличения калорийности меню (в среднем до 15%) и соблюдения рациона, соответствующего нормам БЖУ (белков, жиров и углеводов). При таком режиме организм войдет в эффективный темп усвоения пищи и научится откладывать излишки энергии в мышцы, а не в жировые ткани.
Есть четыре правила, придерживаясь которых, можно нормализовать обмен веществ:
Внимание! Чтобы улучшить метаболизм, необходимо правильно и регулярно питаться, а также уделять достаточно времени силовым и кардио тренировкам. А вот резкое ограничение рациона и различные диеты приведут к нарушению обменных процессов и набору веса.
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Что такое метаболический синдром? Причины возникновения, диагностику и методы лечения разберем в статье доктора Чернышева Андрея Владимировича, кардиолога со стажем в 33 года.
Определение болезни. Причины заболевания
Метаболический синдром (синдром Reaven) представляет собой симптомокомплекс, сочетающий в себе абдоминальное ожирение, инсулинорезистентность, гипергликемию (повышенное содержание глюкозы в крови), дислипидемию и артериальную гипертензию. Все эти нарушения связаны в одну патогенетическую цепь. Кроме того, такой синдром часто сочетается с гиперурикемией (избытком мочевой кислоты в крови), нарушением гемостаза (свёртываемости крови), субклиническим воспалением, синдромом обструктивного апноэ-гипопноэ сна (остановкой дыхания во сне). [4]
Метаболический синдром – хроническое, распространённое (до 35% в российской популяции), полиэтиологическое заболевание (возникающее по многим причинам), в котором главная роль принадлежит поведенческим факторам (гиподинамия, нерациональное питание, стресс). Имеет значение также наследственная предрасположенность к артериальной гипертензии, атеросклероззависимым заболеваниям и сахарному диабету второго типа. [5]
Практикующим врачам важно выделять группу риска метаболического синдрома. К данной группе относятся пациенты с начальными признаками заболевания и его осложнениями: артериальная гипертензия, углеводные изменения, ожирение и повышенное питание, ишемическая болезнь сердца, атеросклеротические заболевания периферических и мозговых артерий, нарушение пуринового обмена, жировая болезнь печени; синдром поликистозных яичников; постменопаузальный период у женщин и эректильная дисфункция у мужчин; гиподинамия, злоупотребление алкоголем, табакокурение, наследственная отягощенность по сердечно-сосудистым и обменным заболеваниям. [3] [7]
Симптомы метаболического синдрома
Клинические проявления метаболического синдрома соответствуют симптомам его составляющих:
Если изменения составляющих синдрома Reaven носят субклинический характер (что встречается довольно часто), то и течение заболевания носит асимптомный характер.
Патогенез метаболического синдрома
Инсулинорезистентность — первопричина развития метаболического синдрома. Представляет собой нарушение утилизации глюкозы в органах-мишенях (поперечнополосатой мускулатуре, липоцитах и печени), связанное с дисфункцией инсулина. Инсулинорезистентность уменьшает усвоение и поступление в клетки скелетной мускулатуры глюкозы; стимулирует липолиз и гликогенолиз, что приводит к липидным и углеводным патологическим изменениям. Кроме того, инсулинорезистентность усиливает секрецию инсулина, в результате чего возникает компенсаторная гиперинсулинемия и активация эндокринных систем (симпатоадреналовой, ренин-ангиотензин-альдостероновой) с формированием артериальной гипертензии, дальнейшим нарушением метаболических процессов, гиперкоагуляции, субклинического воспаления, дисфункции эндотелия и атерогенеза. Эти изменения, в свою очередь, способствуют усилению инсулинорезистентности, стимулируя патогенетический «порочный круг».
Классификация и стадии развития метаболического синдрома
Чёткой классификации и стадийности метаболического синдрома не существует. Его деление некоторыми авторами на полный, включающий все составляющие синдрома, и неполный представляется необоснованным. Несмотря на это, выраженность симптомов, количество компонентов синдрома Reaven и наличие осложнений оказывают влияние на стратификацию риска и выбор тактики лечения у конкретного пациента. Для этого следует учитывать:
В зависимости от индекса массы тела (ИМТ), который рассчитывается делением веса (кг) на рост (м 2 ), классифицируются следующие типы массы тела (МТ):
Второй тип ожирения является более патогенным в плане риска возникновения сердечно-сосудистых заболеваний и сахарного диабета. Это связано с ожирением внутренних органов, в том числе печени (висцеральное ожирение, неалкогольная жировая болезнь печени), снижением сатурации крови кислородом из-за перехода дыхания на грудной, поверхностный тип и эндокринной активностью висцеральной жировой ткани с патологическим изменением выработки адипокинов (лептин, грелин, адипонектин). Выявлена чёткая корреляция между увеличением абдоминальной жировой ткани и индекса массы тела с риском сопутствующих заболеваний. Считается, что риски начинают нарастать при увеличении окружности талии (ОТ) >80 см у женщин и 94 см у мужчин, а при ОТ >88 см и 102 см соответственно риск возрастает значительно.
Центральным патологическим звеном метаболического синдрома является изменение углеводного обмена. Концентрацию глюкозы оценивают в капиллярной крови (норма 1
жен. >1,2
Осложнения метаболического синдрома
Диагностика метаболического синдрома
Для диагностики метаболического синдрома необходимо выявить у пациента основной признак — абдоминальное ожирение по измерению ОТ (>80 см у женщин и >94 см у мужчин) и хотя бы два дополнительных критерия, которые включают в себя:
В клинических условиях нужно дифференцировать метаболический синдром от механического сочетания факторов риска, например артериальной гипертензии, избыточной массы тела без признаков абдоминального ожирения и повышения уровня ОХ крови, что встречается довольно часто (до 30%). В сомнительных случаях рекомендовано дополнительное определение инсулинорезистентности по следующим методикам:
Лечение метаболического синдрома
Лечение метаболического синдрома следует разделить на немедикаментозное и медикаментозное.
Медикаментозное лечение метаболического синдрома, в зависимости от наличия тех или иных его компонентов, может включать гиполипидемические, антигипертензивные препараты, медикаменты для снижения инсулинорезистентности, постпрандиальной гипергликемии и веса.
Основными препаратами, которые используют при лечении артериальной гипертензии у больных синдромом Reaven и сахарным диабетом, являются ингибиторы ангиотензинпревращающего фермента, сартаны и агонисты имидазолиновых рецепторов. Однако для достижения целевого уровня артериального давления часто необходимо сочетание различных классов медикаментов, таких как пролонгированных блокаторов медленных кальциевых каналов, высокоселективных бета-адреноблокаторов и тиазидоподобных диуретиков (индапамид) в сочетании с медикаментами первой линии. [10]
При неэффективности монотерапии статинами целесообразно присоединение эзетрола в дозе 10 мг/сут, который препятствует всасыванию ОХ в кишечнике и может усиливать снижение ХС-ЛПНП на 15-20%.
Фибраты — ещё один класс липидснижающих препаратов. Они расщепляют богатые триглицеридами жировые частицы, снижают синтез свободных жирных кислот и повышают ХС-ЛПВП путём увеличения распада ЛНП. Это приводит к значительному уменьшению триглицеридов (до 50%), ХС-ЛПНП (до 20%) и увеличению ХС-ЛПВП (до 30%). Фибраты также имеют плейотропные эффекты: снижают концентрацию мочевой кислоты, фибриногена и улучшают инсулиночувствительность, однако их положительное влияние на прогноз пациентов не доказано. Наиболее эффективный и безопасный препарат этой группы — фенофибрат 145 мг/сут.
Для снижения инсулинорезистентности препаратом выбора является метформин, который обладает доказанным положительным эффектом на тканевую инсулинорезистентность через усиление поглощения глюкозы тканями-мишенями. Метформин уменьшает скорость всасывания углеводов в тонкой кишке, оказывает периферическое анорексигенное действие, уменьшает продукцию глюкозы печенью, улучшает транспорт глюкозы внутри клеток. Положительное воздействие метформина (1500-3000 мг/сутки) на конечные точки обусловлено снижением инсулинорезистентности, системными метаболическими эффектами (снижение веса, липидных нарушений, факторов свёртываемости крови и т.д.). [9]
При наличии у пациента с синдромом Reaven сахарного диабета второго типа могут применяться современные классы сахароснижающих препаратов, такие как аналог глюкагоноподобного пептида-1, ингибитор дипептидилпептидазы-4 и ингибитор натрийзависимого переносчика глюкозы второго типа. Представитель последнего класса эмпаглифлозин (Джардинс) в исследовании EMPA-REG OUTCOME (2016 год) снизил сердечно-сосудистую смертность у больных сахарным диабетом второго типа на 36%.
Медикаментозная коррекция морбидного ожирения показана, если немедикаментозное лечение не приводит к снижению массы тела более чем на 5% от исходного. Препараты для лечения ожирения делятся на аноретики центрального действия (сибутрамин), и средства, воздействующие на желудочно-кишечный тракт, например орлистат (Ксеникал).
Препарат для снижения аппетита сибутрамин в меньшей степени воздействует на дофаминовые и холинергические процессы, но уменьшает потребление жиров и углеводов, что приводит к похудению и улучшает жировой и углеводный метаболизм. Артериальное давление и частота сердечных сокращений при этом повышается только на 5%.
Орлистат является ингибитором желудочной и панкреатической липаз, вследствие чего треть пищевых триглицеридов не всасывается и снижается их концентрация в крови, что приводит к уменьшению калоража пищи и веса. Кроме того, снижается артериальное давление, уровень глюкозы и инсулинорезистентности.
В медицинской практике лечение метаболического синдрома зависит от наличия и выраженности его компонентов. В таблице ниже показана тактика подбора терапии при вариантах синдрома Reaven, которые встречаются наиболее часто.
Красноречивые метаболиты
Примелькавшееся выражение «болезнь легче предупредить, чем лечить» наполняется новым смыслом, когда человек, обратившийся к врачу с запущенной болезнью, вынужден тратить средства, время и нервы на лечение. Задача раннего обнаружения и диагностики заболеваний появилась одновременно с самой медициной. Однако долгое время основными инструментами анализа для врачей были их органы восприятия, а параметрами служили цвет и запах выделяемых жидкостей и общее состояние больного. Сегодня на помощь медицине приходит наука. В данном случае речь идет о метаболомике, занимающейся изучением небольших молекул, являющихся результатом различных биохимических процессов в организме, в том числе патологических
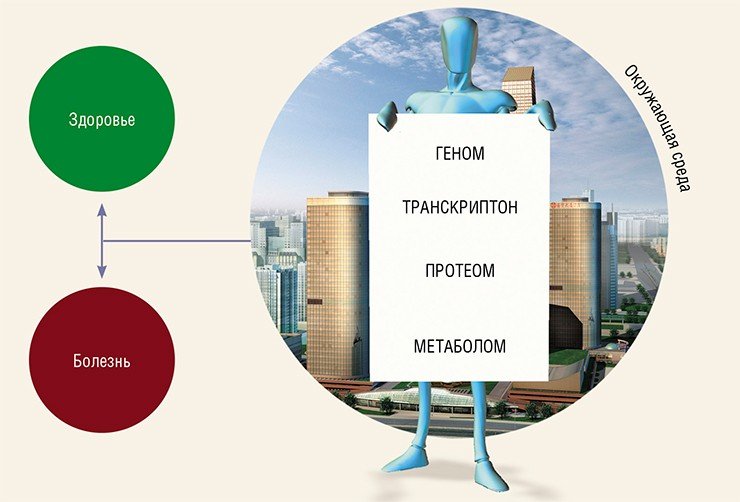
Метаболомика – область биологии, изучающая так называемый метаболом, т. е. всю совокупность относительно небольших молекул-метаболитов, функционирующих в живом организме. Очевидно, что состав такого метаболома тесно связан с геномом и протеомом организма, с составом поступающей пищи, а также с условиями окружающей среды.
Метаболомика органично встраивается в иерархию наук, изучающих геном и гены живых организмов, синтез и распределение транскриптов (молекул РНК), белки и их взаимодействия в живых организмах.
Однако спускаясь вниз по этой иерархической лестнице, мы приходим к парадоксальному открытию: если в связке геном–транскриптом–протеом наблюдается увеличение количества молекул различной структуры, то метаболом (набор всех метаболитов) оценивается гораздо меньшим числом составных частей. Например, если геном человека состоит примерно из 28 тыс. генов, протеом – более чем из 1 млн белков, то метаболом содержит примерно 2400 метаболитов.
Генетика – образ жизни – среда
Почему же количество метаболитов, образующихся в результате биохимических реакций, намного меньше, чем число молекул, ответственных за протекание этих реакций?
Во-первых, метаболиты – это молекулы небольшого размера, уже претерпевшие каскад биохимических превращений, и потому сами по себе достаточно устойчивы к дальнейшим преобразованиям.
Во-вторых, в человеческом геноме, при всех его различиях у разных людей, закодированы одни и те же или очень схожие биохимические процессы, необходимые для жизнедеятельности. Поэтому индивидуальные особенности строения ферментов или других важных составляющих биохимических процессов не должны оказывать существенного влияния на конечные метаболиты, но лишь при том условии, что речь идет о норме. В противном случае такое влияние может приводить к серьезным патологиям или даже нежизнеспособности организма.
При знакомстве с объектами новой науки возникает закономерный вопрос: если число метаболитов относительно невелико, как же их можно использовать для выявления патологий? Ведь если предположить, что каждый метаболит может служить биомаркером, то в этом случае можно идентифицировать не более двух с половиной тысяч болезней, хотя реально их много больше. И это при том, что маркерами могут служить далеко не все метаболиты.
Более того, выделение, идентификация и даже количественное определение отдельных метаболитов, как правило, не позволяют однозначно судить о наличии или отсутствии того или иного заболевания. Но это затруднение преодолимо – метаболиты следует рассматривать не по отдельности, а в комплексе и следить за изменением в составе всего комплекса. При таком подходе любые отклонения от нормы могут служить биомаркерами болезней или неблагоприятных изменений в организме пациента.
Кроме генетической предрасположенности к определенным заболеваниям на здоровье человека влияют его образ жизни, в том числе диета, и окружающая среда. Поэтому последние факторы имеют огромное влияние на текущий уровень метаболитов. При этом в течение жизни их роль возрастает, поскольку со временем они оказывают воздействие уже на всю цепочку биохимических преобразований в организме.
В связи с этим главной целью метаболомики является поиск и характеризация значимых различий в составе метаболитов между здоровым и любым патологическим состоянием человека, вызванных именно заболеванием.
Для успешного использования различий в составе метаболитов в качестве биомаркеров нужно решить еще одну важнейшую проблему, связанную со статистической достоверностью таких отклонений. Ведь изменения, достаточные для детектирования заболевания у одного пациента, могут быть недостаточными для определения патологии у другого.
Возможна и обратная ситуация: благодаря индивидуальным особенностям состава метаболитов здоровый человек может быть, наоборот, признан больным. Цель метаболомики как раз и состоит в том, чтобы разработать подходы, применение которых корректно не только по отношению к определенному индивидууму, но и для группы, популяции и даже всего вида в целом. Рациональное решение этой проблемы – анализ всего набора метаболитов, но сама по себе эта задача достаточно сложная.
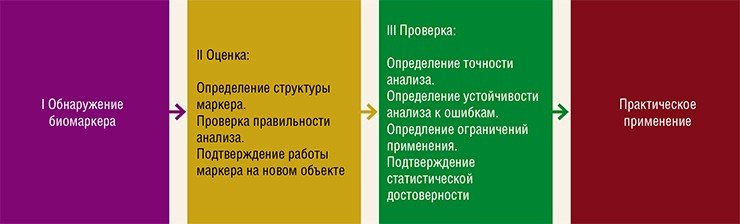
По ступеням анализа
Пациенты, у которых патологические изменения в составе метаболитов детектируются легко и однозначно, обычно являются тяжелобольными и имеют значительные нарушения в обмене веществ.
Большинство же нарушений не так явны. Они обусловлены косвенными эффектами патологического процесса или попытками организма компенсировать изменения в обмене веществ, вызываемые первоначальной патологией. В связи с этим поиск биомаркера какого-либо заболевания, как правило, длительный и многоступенчатый процесс.
Оборудование и протоколы для определения метаболитов, используемые в подобных исследованиях, должны отвечать ряду требований. Ведь анализируемые метаболиты могут, например, очень сильно различаться по своим физическим свойствам, таким как масса, гидрофобность и т. п.
Не менее сложной является и задача извлечения, идентификации и количественного определения всех метаболитов в биологическом образце. Поскольку результаты должны быть воспроизводимыми даже в том случае, когда сам исследователь еще не знает, ни что это за соединение, ни что оно вообще присутствует в образце. Поэтому, как правило, используется комбинация различных методов выделения и анализа.
Другая существенная проблема в анализе метаболитов – широкий диапазон их концентраций в биологических жидкостях и тканях. Например, концентрация аминокислот в крови составляет от 50 до 500 микромолей, а в спинно-мозговой жидкости она в 100 раз меньше. Впечатляет и сам диапазон концентраций у отдельных метаболитов: от нано- до миллимолярных (т. е. в 1000 раз больше)!
Существенно упростить методику анализа метаболитов как биомаркеров заболевания позволяет использование масс-спектрометрического оборудования. Особый интерес представляет тандемный масс-спектрометр с электро-спрей системой ввода образца в анализатор (ES-MS/MS), с помощью которого можно провести анализ в течение нескольких минут.
Детекция небольших, но достоверных изменений состава метаболитов этим методом позволяет определять болезни на самых ранних стадиях, что особенно важно при неонатальном скрининге – обследовании новорожденных детей для выявления наиболее распространенных врожденных и наследственных заболеваний. Метаболомика находит применение при разработке анализов индивидуальной восприимчивости к лекарственным средствам, например, варфарину, при определении уровня проканцерогенов – полиароматических углеводородов и т. д.
Безусловно, разработка и внедрение метаболомных методов анализа в первую очередь происходит для наиболее распространенных заболеваний. К сожалению, пока еще рано говорить, что в распоряжении врачей имеются полностью «готовые» методы анализа метаболитов, прошедших испытание временем и применением в клинике. Поэтому развитие метаболомики как науки, нацеленной на практическое применение в медицине, является актуальной задачей во всем мире.
Разработкой и оптимизацией методов анализа метаболитов занимаются в России. В новосибирском Академгородке на базе Института химической биологии и фундаментальной медицины СО РАН совместно с Центром новых медицинских технологий и Институтом экологии человека СО РАН (Кемерово) проводятся исследования, позволяющие упростить анализ и увеличить точность определения врожденных и наследственных заболеваний.
Область возможного применения анализа метаболитов и использования их в качестве биомаркеров практически не ограничена. Развитие метаболомики как науки и успешное внедрение анализа метаболитов в практическую медицину в будущем позволит последней эффективно работать в направлении профилактики заболеваний. Теперь основные усилия по защите здоровья пациентов сосредоточились в рамках совместной работы науки и медицины — тандеме, основанном на инструментальной базе самого высочайшего уровня.
Hollywood K., Brison D.R., Goodacre R. Metabolomics: current technologies and future trends // Proteomics. 2006. N 6(17). P. 4716—4723.
Ellis D.I., Dunn W.B., Griffin J.L. et al. Review etabolic fingerprinting as a diagnostic tool // Pharmacogenomics. 2007. N 8. P. 1243—1266.
Koulman A., Lane G. A., Harrison S. J., Volmer D. A. From differentiating metabolites to biomarkers // Anal. Bioanal. Chem. 2009. N 394. P. 663—670.
Микробиомные исследования с применением знаний метаболомики
Микробиом и метаболом
Микробиомные исследования с применением знаний метаболомики
СОДЕРЖАНИЕ:
Кратко о метаболомике и метаболоме
Метаболом представляет собой полный набор низкомолекулярных метаболитов (таких как промежуточные продукты обмена веществ, гормоны и другие сигнальные молекулы и вторичные метаболиты), которые могут быть найдены как в биологическом образце, так и в единичном организме. В человеческом теле по данным 2007 г. найдены около 2500 метаболитов, 1200 лекарств и 3500 компонентов пищи, которые в настоящее время каталогизированы (и постоянно пополняются) в доступной базе метаболома человека ( www.hmdb.c a ).
Комплексный взгляд на Метагеномы и Метаболомы кишечных заболеваний
Резюме. В последнее время метагеномика и метаболомика являются двумя наиболее быстро развивающимися “омическими” технологиями. Метагеномика стремится охарактеризовать состав микробных сообществ, их функционирование и динамично развивающиеся взаимоотношения с занимаемыми ими средами обитания, в то время как метаболомика изучает уникальные химические конечные точки (метаболиты), которые оставляют после себя специфические клеточные процессы. Значительный прогресс в технологии секвенирования ДНК и масс-спектрометрии позволил провести всесторонний сбор информации о микробиоме кишечника и его метаболоме с целью оценки влияния микробиоты кишечника на физиологию хозяина на уровне целостных систем. Наша кишечная микробиота, состоящая из прокариотических клеток вместе с их метаболитами, создает уникальную кишечную экосистему вместе с эукариотическими клетками-хозяевами. В этом обзоре мы рассмотрим детальную взаимосвязь между микробиотой кишечника и ее метаболитами в отношении здоровья хозяина и патогенезом различных кишечных заболеваний, таких как воспалительные заболевания кишечника и колоректальный рак. Также будут обсуждаться терапевтические вмешательства, такие как введение пробиотиков и пребиотиков, а также трансплантация фекальной микробиоты. Мы хотели бы продвигать этот уникальный общебиологический подход к включению информации о метагеномах и метаболомах, поскольку мы считаем, что это может помочь нам в большей степени понять сложное взаимодействие между кишечной микробиотой и метаболизмом хозяина. Эта новая интеграция информации о микробиоме, метатранскриптоме и метаболоме поможет нам улучшить целостное понимание сложного суперорганизма млекопитающих, тем самым позволив нам получить новые и беспрецедентные идеи для обеспечения захватывающих новых терапевтических подходов для оптимального здоровья кишечника.
1. Кишечная микробиота
Микробиота кишечника относится ко всем микроорганизмам, населяющим желудочно-кишечный тракт. У млекопитающих в кишечной микробиоте преобладают Actinobacteria, Bacteroidetes, Firmicutes и Proteobacteria, и, как сообщается, эти типы играют важную роль в формировании метаболизма и физиологии хозяина [1]. Общее количество бактерий, населяющих кишечник, составляет около 100 триллионов клеток, что примерно в три раза превышает общее количество клеток в организме человека [2]. Таким образом, кишечная микробиота часто считается функциональным и измеримым органом, состоящим из прокариотических клеток с эукариотическими клетками-хозяевами, сливающимися вместе для создания уникальной кишечной экосистемы [3]. В соответствии с диетическим образом жизни и состоянием питания хозяина, кишечные микробиоты различаются по составу вдоль пищеварительного тракта и эволюционируют внутри и между индивидуумами с течением времени [4]. Только в последние годы мы начали понимать системное влияние кишечной микробиоты на весь метаболический репертуар организма. В дополнение к очевидной роли кишечной микробиоты в пищеварении, она играет роль не только в поддержании оптимального здоровья хозяина, но и в этиопатогенезе различных метаболических заболеваний, таких как ожирение [5,6,7], диабет [1,8, 9]; кишечные заболевания, такие как воспалительные заболевания кишечника (ВЗК) [10], колоректальный рак (CRC) [11]; и такие заболевания, как аллергия [12], рассеянный склероз [13], хроническое заболевание почек [9], атеросклероз [14,15] и аутизм [16].
2. Что такое метаболомика?
Технологические достижения позволили провести комплексную оценку тысяч генов (геномика), транскриптов (транскриптомика), белков (протеомика), метаболитов (метаболомика) и кишечной микробиоты (метагеномика) с помощью высокопроизводительных методов и аналитических инструментов [17]. Быстрый прогресс в технологиях секвенирования ДНК и масс-спектрометрии (МС) в последние годы позволил провести обширный сбор данных о кишечном микробиоме и метаболоме для всесторонней оценки влияния кишечной микробиоты на здоровье человека [18]. Поскольку целостное понимание метаболизма органов и систем жизненно важно для поддержания здоровья и состояния питания [19], это привело к значительному прогрессу в технологиях метагенома и метаболома, что позволило нам лучше понять роль кишечной микробиоты в влиянии на общее состояние здоровья хозяина.
Ядерный магнитный резонанс (ЯМР) и масс-спектрометрия (МС) являются двумя наиболее широко используемыми метаболомно-аналитическими методами широкого спектра действия для идентификации биомаркеров заболевания. Используя эти подходы, мы можем точно идентифицировать и иметь четкое представление о метаболитах, продуцируемых микробиотой и клетками-хозяевами в образцах фекалий, крови, тканей и мочи [20]. Эти инструменты позволяют ученым понять степень воздействия обработок на метаболический профиль хозяина путем одновременного анализа присутствия и количества тысяч метаболитов.
3. Использование Метаболомики для понимания микробиоты кишечника
В настоящее время оценка метаболического профиля обычно используется для прямого сравнения метаболизма кишечной микробиоты и возможных метаболических исходов в организме хозяина. В докладе, исследующем системное влияние введения пробиотиков или пребиотиков или комбинации того и другого у первоначально свободных от микробов мышей, колонизированных комбинацией микробов, представляющих собой кишечную микробиоту человеческого младенца [21], было обнаружено, что пробиотическое / пребиотическое вмешательство значительно изменяет относительный состав сообщества кишечной микробиоты, приводя к системным изменениям в метаболических профилях различных тканей. В группах, получавших пребиотики, наблюдалось увеличение доли Bifidobacterium breve, Bifidobacterium longum и Bacteroides distasonis; снижение доли Escherichia coli и Clostridium perfringens; а также модуляция липидного обмена за счет снижения концентрации глюкозы и печеночных триглицеридов в плазме крови [21]. В другом докладе Wikoff et al. (2009), влияние микробиоты кишечника на хозяина оценивали у безмикробных и условно выращенных мышей путем сравнения профилей метаболома плазмы. Было много метаболитов, которые были обнаружены только у условно выращенных мышей, а не у мышей без микробов. Кроме того, концентрации более чем одной десятой всех метаболитов различались более чем на 50% при сравнении условно выращенных мышей и мышей без микробов [22].
4. Взаимосвязь между кишечной экосистемой, колоректальным раком и воспалительным заболеванием кишечника.
Как мы уже сообщали ранее, интеграция между активностью микробиома кишечника и нашими генами отражает общий метаболизм человека на системном уровне [23]. Наш желудочно-кишечный тракт обеспечивает питательные вещества для клеток и тканей через систему кровообращения, а также метаболиты, происходящие из кишечной микробиоты. Это тонкое взаимодействие между метаболитами, происходящими из кишечной микробиоты, самой микробиотой кишечника и иммунной системой хозяина передается через широкий спектр сигнальных путей, которые простираются за пределы иммунной системы. Прямые химические взаимодействия между кишечной микробиотой и хозяином и иммунно-опосредованные сигнальные механизмы влияют на различные органы, такие как кишечник, печень, скелетная мускулатура и мозг, и эти сложные взаимосвязи взаимно объединяются, чтобы достичь кульминации в ряде метаболических осей хозяин-микроб. В пределах этих осей метаболические реакции могут регулироваться кишечными микробными геномами, что приводит к выработке холина, фенолов, желчных кислот и короткоцепочечных жирных кислот (SCFAs) как кишечным микробиомом, так и геномом хозяина, которые необходимы для здоровья хозяина [23] (рис. 1). В этом обзоре мы обсудим взаимосвязь между метаболизмом кишечной микробиоты и защитными и вредными метаболитами в патогенезе колоректального рака (CRC) и ВЗК. Кроме того, мы также кратко обсудим терапевтические вмешательства, такие как введение пробиотика или пребиотика и трансплантация фекальной микробиоты (FMT).
Рисунок 1. Наша сложная кишечная экосистема включает четыре бактериальных типа: Firmicutes, Bacteroidetes, Actinobacteria и Proteobacteria, которые доминируют в кишечной микробиоте у млекопитающих, и, как сообщалось, характеризуют роль метаболизма и физиологии хозяина. В зависимости от пищевого образа жизни хозяина кишечная микробиота и ее метаболиты, такие как N-нитрозосоединения (NOCs), аммиак, полиамин, таурин, желчные кислоты, сероводород и короткоцепочечные жирные кислоты (SCFAs), в значительной степени вовлечены в этиопатогенез метаболических заболеваний, кишечных заболеваний и внекишечных заболеваний, тем самым играя жизненно важную роль в здоровье хозяина.
5. Колоректальный рак
CRC занимает третье место в мире по смертности от рака. Механизм патогенеза CRC известен как последовательность аденома-карцинома [24], где генетические изменения приводят к переходу от нормальной слизистой оболочки к предраковым поражениям, а затем к колоректальным аденомам и фульминантным CRC в течение многих лет [25]. Хотя некоторые причины CRC являются наследственными, большинство случаев CRC можно отнести к диете и образу жизни [26]. Однако недавнее исследование показало, что прогрессирование рака, связанное с питанием, связано со значительными сдвигами в кишечных микробных сообществах в результате взаимодействия хозяина и окружающей среды независимо от ожирения, и что онкогенез может передаваться среди генетически предрасположенных людей [27]. Кроме того, люди с ВЗК имеют повышенную частоту CRC, и это известно как колит-ассоциированный рак [28,29]. Также сообщалось, что само воспаление изменяет физиологию хозяина, тем самым способствуя раку, как это видно на мышиной модели CRC, ассоциированной с колитом, где колит изменяет микробный состав и индуцирует приращение генотоксических микроорганизмов [30]. Хотя существует много сообщений, в которых рассматривается потенциальная роль определенных штаммов патогенных бактерий в продвижении CRC посредством провоспалительных взаимодействий с клетками-хозяевами [25,29,31], становится все более очевидным, что совокупная активность кишечной микробиоты и их продукты метаболизма значительно влияют на патогенез и защиту от CRC [25,27,29,31,32].
См. дополнительно :
6. Воспалительное заболевание кишечника
ВЗК представляет собой группу изнурительных воспалительных заболеваний, поражающих желудочно-кишечный тракт. Два основных типа включают болезнь Крона (БК) и язвенный колит (ЯК). Ни один из них не смертелен; однако у больных пациентов наблюдается большое разнообразие симптомов, связанных с воспалением кишечника, от боли в животе, лихорадки, рвоты, диареи, ректального кровотечения и анемии до потери веса. Симптомы обычно устраняются с помощью противовоспалительных стероидов или иммунодепрессантов для уменьшения воспаления. Диетические или жизненные вмешательства также используются, чтобы попытаться устранить триггеры окружающей среды. В тяжелых случаях ВЗК требуется операция по удалению поврежденных участков кишечника [33]. Распространенность ВЗК в настоящее время самая высокая в Европе и Северной Америке [10]. Глобальная распространенность ВЗК растет, при этом наблюдается быстрый рост заболеваемости по мере того, как все больше стран переходят на «западный» образ жизни [34]. Показатели заболеваемости также возрастают у молодых людей, что увеличивает нагрузку на ресурсы здравоохранения (особенно в связи с тем, что раннее ВЗК связано с более высоким риском развития CRC) [35]. Общегеномное исследование ассоциации в 2008 году сообщило о 30 значительных генах восприимчивости и локусах для частоты возникновения БК и патогенеза [36]. Оценка последовательности 16S рРНК желудочно-кишечного содержимого у пациентов с БК и ЯК выявила аномальный состав микробиоты кишечника, характеризующийся истощением комменсальных Firmicutes и Bacteroidetes [37] и снижением количества Faecalibacterium prausnitzii, основного члена Firmicutes, который, как сообщалось, также ассоциирован с БК [38]. Хотя были многочисленные сообщения об уменьшении разнообразия кишечных микробных популяций, которые наблюдаются у пациентов с БК и ЯК [23,37,38], недавний отчет показал, что существуют аномальные кишечные виромы, где наблюдается значительное расширение бактериофагов Caudovirales у пациентов с ВЗК. Интересно, что виромы пациентов с БК и ЯК были специфичны для заболевания и когорты, а разнообразие кишечного кишечника не было вторичным по отношению к изменениям в кишечном микробном сообществе. Эти данные подтверждают модель, в которой изменения в вироме могут способствовать воспалению кишечника и бактериальному дисбиозу, что позволяет предположить, являются ли изменения бактериального микробиома при ВЗК вторичными по отношению к изменениям в появлении бактериофагов или введении бактериофагов после вмешательств в образ жизни [39]. В целом, ВЗК представляет собой серьезное бремя для здоровья в мире, которое вызывает растущую обеспокоенность.
См. дополнительно:
7. Микробный метаболизм в кишечнике
Как правило, анаэробное микробное сообщество кишечника ферментирует непереваренные пищевые компоненты, которые достигают толстого кишечника в большой спектр метаболитов. Это иллюстрирует как удивительную биохимическую емкость кишечной микробиоты, так и большое разнообразие доступных субстратов [40]. Основные продукты ферментации у здоровых людей включают газы и органические кислоты, главным образом три короткоцепочечные жирные кислоты (SCFAs): ацетат, пропионат и бутират. Эти SCFAs часто имеют соотношение 3: 1: 1 и имеют общую концентрацию 50–150 мМ в толстой кишке [41]. Неперевариваемые углеводы, включающие некрахмальные полисахариды (структурные полисахариды клеточных стенок растений), резистентный крахмал и некоторые растворимые олигосахариды (фруктоолигосахариды), обычно являются первичными субстратами для микробного брожения [42].
Метаболизм кишечной микробиоты также может включать анаэробное дыхание, в котором в качестве акцепторов электронов выступают нитрат, сульфат и некоторые органические соединения [43]. Факультативные анаэробы, такие как Proteobacteria, могут использовать доступный кислород в качестве акцептора электронов, что увеличивает их рекуперацию энергии из субстратов по сравнению с большинством облигатных анаэробов, за исключением Bacteroides spp. и Faecalibacterium prausnitzii. Бактерии Bacteroides spp. имеют цитохромы, в то время как F. prausnitzii зависят от внеклеточного переноса электронов через флавины и тиолы [44,45]. Кишечные микробы, которые используют водород и формиат, включая ацетогенные бактерии (например, Blautia hydroydrophica), метаногенные археи (Methanobrevibacter smithii) и сульфатредуцирующие бактерии (например, Desulfovibrio spp.), играют жизненно важную роль в анаэробном метаболизме через межвидовые взаимодействия перекрестного питания [46]. Относительный вклад ацетогенеза, метаногенеза и восстановления сульфатов метаногенными археями зависит от численности этих бактерий и изменения времени прохождения кишечника [47].
8. Защитные и вредные метаболиты
В этом обзоре микробные метаболиты кишечника и ферментативная активность будут разделены на разделы в зависимости от того, предполагается ли, что они являются защитными или оказывают неблагоприятное воздействие на здоровье кишечника, воспаление и канцерогенез.
9. Влияние SCFA на клетки-хозяева
Внеклеточные SCFAs участвуют в нескольких важных взаимодействиях с поверхностно-экспонированными рецепторами клеток-хозяев: G-белок-связанным рецептором 41 (GPR41), GPR43 и GPR109A [48,61,62]. GPR43 распознает все три основных SCFAs. Сродство к GPR41 находится в следующем порядке: пропионат> бутират >> ацетат. С другой стороны, GPR109A взаимодействует только с бутиратом [62]. Противовоспалительная бутират-управляемая передача сигналов, которая включает GPR109A, способствует дифференцировке Treg-клеток и IL-10-продуцирующих T-клеток, блокируя активацию ядерного фактора-kB (NF-kB), а также индуцируя апоптоз через механизм, независимый от ингибирования HDAC [62,63]. Ацетат и пропионат связываются с GPR43, тем самым оказывая противовоспалительное действие посредством модулирования клеток Treg [52,64]. Таким образом, противоопухолевые эффекты пропионата и бутирата, которые связаны с высоким потреблением клетчатки, могут быть опосредованы через подавляющие опухоль гены GPR43 и GPR109A [65]. Другие сообщения об антиканцерогенных эффектах бутирата включают ингибирование пролиферации и селективную индукцию апоптоза клеток CRC [49,51,66,67]. Эффект подавления рака еще полностью не выяснен; однако ингибирование HDAC может быть фактором, приводящим к изменениям регуляции транскрипции [50]. Сообщалось, что в результате ингибирования HDAC бутират и, в меньшей степени, пропионат активируют сигнальный путь AP-1 в эпителиальных клеточных линиях, которые играют жизненно важную роль в контроле клеточной пролиферации и апоптоза [68]. Несмотря на сообщения о противораковых свойствах бутирата, в последние годы исследование с использованием мышиной модели CRC показало, что низкие концентрации бутирата могут способствовать патогенезу CRC путем стимуляции роста эпителиальных клеток толстой кишки [27].
10. Вредные метаболиты: продукты белковой ферментации.
Большое количество потребляемого белка приводит к увеличению ферментации белка, получаемого из рациона, в толстой кишке, где могут наблюдаться повышенные концентрации продуктов, происходящих из аминокислот, таких как жирные кислоты с разветвленной цепью и фенилуксусная кислота [69,70,71]. Подмножество кишечной микробиоты, включая несколько субстратов бактероидов (Bacteroides spp.) и некоторых фирмикутов (Firmicutes), ферментирует аминокислоты с целью получения потенциально биологически активных соединений, таких как фенилуксусная кислота, фенолы, индолы и п-крезол [72]. Некоторые азотистые соединения, в частности N-нитрозосоединения (NOCs), обладают способностью стимулировать патогенез рака и оказывать канцерогенное действие посредством алкилирования ДНК, что может привести к мутациям. Потребление диетических NOCs положительно коррелирует с заболеваемостью CRC у европейцев [73]; тем не менее, NOCs также могут образовываться эндогенно посредством кислотного нитрозирования в желудке и нитрозирования аминов, полученных в результате микробной ферментации белка в толстой кишке [74]. Повышенные концентрации фекальных NOCs наблюдались у людей, которые потребляют высокобелковые диеты в контролируемых исследованиях диетического вмешательства [70]. Нитроредуктазы и нитратредуктазы, которые кодируются протеобактериями (Proteobacteria), также способствуют реакциям нитрозирования. Сообщалось, что аммиак, продукт ферментации белка, является потенциальным канцерогенным агентом, поскольку относительно низкие концентрации вызывают увеличение повреждения слизистой оболочки и аденокарциномы толстой кишки на мышиной модели [71,74]. Полиамины, такие как путресцин, спермидин и спермин, участвуют в широком спектре важнейших физиологических функций, таких как поддержание структурной целостности мембран, регуляция и трансляция генов [75,76]. Основные вышеупомянутые полиамины вырабатываются из аргинина в тканях хозяина, но синтез полиаминов также может происходить в кишечной микробиоте [77,78,79]. Сообщается, что высокий уровень полиаминов токсичен и связан с множеством заболеваний, включая рак. Окислительный стресс, вызванный катаболизмом полиаминов, считается фактором, способствующим токсичности [76]. Некоторые кишечные бактерии, такие как Bacteroides fragilis, усиливают выработку полиамина клетками-хозяевами, помимо того, что вносят непосредственный вклад в пул полиаминов путем синтеза таких соединений. Некоторые патогены, такие как Shigella flexneri, Streptococcus pneumonia, Salmonella enterica subsp и Helicobacter pylori, используют полиамины для повышения своей вирулентности [75].
11. Вредные метаболиты: метаболизм желчных кислот
12. Вредные метаболиты: сероводород
В кишечнике сероводород вырабатывается путем снижения содержания сульфата в рационе и метаболизма таких соединений, как серосодержащие аминокислоты [85] и таурин [88]. Сульфатредуцирующие бактерии, связанные с Desulfovibrio spp., хотя обнаруживаются в небольшом количестве у большинства особей, способны использовать лактат в качестве субстрата для роста и в то же время образуют сульфид [88]. Сульфид токсичен для колоноцитов и ингибирует окисление бутирата, тем самым приводя к разрушению барьера колоноцитов, способствуя патогенезу ЯК [89]. Он также может повредить ДНК в нетрансформированных клеточных линиях человека в концентрациях, аналогично обнаруженных в просвете толстой кишки (0,25–2 мМ) [89], и предполагается, что активные формы кислорода участвуют в этой генотоксичности [90].
13. Терапевтические вмешательства при заболеваниях кишечника
13.1. Пробиотические вмешательства
Пробиотики определяются как «живые микроорганизмы» и при назначении в соответствующих количествах оказывают благотворное влияние на здоровье хозяина [91]. Сообщалось, что определенные бактериальные штаммы играют защитную роль против ВЗК, конкурируя с патогенными микробами или непосредственно предотвращая колонизацию в кишечнике, а также благодаря их противовоспалительным свойствам [92].
Непатогенная кишечная палочка, E. coli Nissle 1917, является наиболее изученным одноштаммовым пробиотиком. Сообщалось, что он так же эффективен и безопасен, как и мезалазин, в поддержании ремиссии у пациентов с ЯК [93]. Кроме того, ректальное введение E. coli Nissle 1917, как сообщается, было значительно более эффективным, чем плацебо, в индуцировании ремиссии у дистальных пациентов с легкой и умеренной активностью ЯК [94]. Lactobacillus rhamnosus GG также сравнивали с мезалазином для поддержания ремиссии ЯК. Хотя аналогичные частоты рецидивов после 6–12 месяцев лечения наблюдались при обоих методах лечения, у L. rhamnosus GG было получено значительно более длительное время без рецидивов [95]. L. rhamnosus GG также использовали в качестве дополнения к традиционной терапии для поддержания индукции и ремиссии БК. Однако никаких существенных положительных эффектов по сравнению с плацебо не наблюдалось. В исследовании на животных, когда ферментированное молоко, содержащее B. lactis, L. lactis, S. thermophilus и L. bulgaricus, вводили колитическим мышам, наблюдалось улучшение воспаления. Также наблюдалось увеличение количества бактерий, продуцирующих бутират, и сопутствующее уменьшение штаммов энтеробактерий Klebsiella pneumoniae и Proteus mirabilis, способных вызывать воспаление толстой кишки [96]. Когда мышей, ассоциированных с микробиотой человека, лечили пробиотиками Lactobacillus paracasei или Lactobacillus rhamnosus и двумя галактозил-олигосахаридными пребиотиками, количество Bifidobacterium longum и Bifidobacterium breve увеличивалось, тогда как количество Clostridium perfringens было снижено. Это ремоделирование состава кишечной микробиоты привело к изменениям в различных метаболических путях хозяина, таких как глюконеогенез, липидный профиль и метаболизм аминокислот [97]. Конъюгированная линолевая кислота является естественным изомером линолевой кислоты, обнаруженным в мясе и молочных продуктах жвачных животных [98], и, как сообщалось, защищает от канцерогенеза толстой кишки, атеросклероза и ожирения у мышей [99,100]. В недавнем исследовании, где Bifidobacterium longum BB536 (BB536) вводили гнотобиотическим мышам, содержащим 15 штаммов преобладающей кишечной микробиоты человека, было отмечено, что в группе BB536 наблюдалось значительное увеличение фекальных уровней предшественника биотина-пимелата, бутирата и биотина. Увеличение концентрации биотина можно объяснить изменениями в метаболизме, связанными с синтезом биотина Bacteroides caccae у мышей. Доля бутират-продуцирующей микробиоты, Eubacterium rectale, была значительно выше в группе BB536, чем в группе без него [101].
13.2. Пребиотические вмешательства
Пребиотики представляют собой неперевариваемые соединения, которые придают специфические изменения в составе и активности микробиоты кишечника, тем самым оказывая благотворное влияние на здоровье хозяина [97]. Проросшие пищевые продукты из ячменя (GBF), которые часто изучаются при поддержании ВЗК, являются пребиотиками, богатыми глютамином и гемицеллюлозой [102]. Диетическое вмешательство GBF привело к увеличению продукции SCFAs на мышиной модели и снижению дефекации, а также уменьшению повреждения толстой кишки и фекальной крови [102,103]. В небольших клинических исследованиях с умеренно активными пациентами с ЯК применение GBF в качестве дополнения к традиционной терапии также показало значительное улучшение показателей клинической активности. У этих пациентов также сообщалось об увеличении содержания фекального бутирата [104]. Кроме того, при использовании диетических вмешательствах у пациентов с неактивным ЯК для поддержания ремиссии, у пациентов, подвергшихся GBF, частота рецидивов была значительно ниже, чем у пациентов, получавших только традиционную терапию, что сопровождалось очевидным снижением сывороточных провоспалительных цитокинов IL-6 и IL-8 [105]. В недавнем плацебо-контролируемом клиническом испытании с активными или спокойными субъектами с БК легкой и средней степени тяжести вмешательство инулина, обогащенного олигофруктозой, в течение четырех недель было эффективным для снижения активности заболевания и изменения состава микробиоты кишечника путем увеличения числа штаммов B. longum. [106]. Существует множество модельных исследований на животных с использованием пребиотических кормовых добавок, которые показали значительное влияние на профилактику и лечение CRC. Питание длинноцепочечными фруктанами типа инулина усиливает бифидогенные эффекты, снижает рН, модулирует иммунитет и снижает количество индуцированных азоксиметаном ( АОМ ) предопухолевых аберрантных криптовых очагов толстой кишки ( ACF ), а также опухолей тонкого кишечника и толстой кишки в модели CRC мышей [107]. Вмешательство ксилолигосахаридов и фруктоолигосахаридов ингибировало ACF толстой кишки у крыс, получавших диметилгиразин, снижая рН слепой кишки и уровень триглицеридов в сыворотке крови. Это вмешательство также привело к увеличению общей массы слепой кишки, увеличению популяции бифидобактерий и значительному снижению ACF толстой кишки [108].
13.3. Трансплантация фекальной микробиоты ( FMT)
Рисунок 2. Дисбактериозные воспалительные заболевания кишечника и колоректальный рак и соответствующие терапевтические вмешательства. Дисбактериоз относится к дисбалансу между миротворческими бактериями и патобионтами, что приводит к кишечным заболеваниям, таким как воспалительные заболевания кишечника и колоректальный рак. Некоторые бактериальные метаболиты могут вызывать прямое повреждение ДНК или способствовать воспалению. Патобионты также оказывают провоспалительное действие. Кроме того, потеря барьерной функции приведет к увеличению бактериальной транслокации, что приведет к дальнейшему развитию провоспалительных путей, что приведет к онкогенезу. Сообщалось, что прием пробиотиков и / или пребиотиков и трансплантация фекальной микробиоты восстанавливают симбиоз.
14. Выводы
Исследования, которые мы рассмотрели здесь, подчеркивают, что патогенез кишечных заболеваний, таких как ВЗК и CRC, зависит не только от конкретных патогенов, но и от метаболического выхода кишечной микробиоты. Тем не менее, мы все еще начинаем всесторонне понимать взаимосвязь между защитными и вредными метаболитами, их пути разложения в кишечнике вследствие кишечной микробиоты и последующее воздействие на здоровье хозяина. Поэтому, в свете этого, мы решительно выступаем за интеграцию метагеномной и метаболомной информации, поскольку считаем, что это ценная методология, которая позволила бы нам глубже понять эту сложную взаимосвязь между кишечной микробиотой и метаболическим потоком хозяина. Кроме того, интеграция информации, полученной из микробиомных, метатранскриптомных и метаболомных платформ, также приведет к улучшению всестороннего понимания сложного суперорганизма млекопитающих. Огромное количество ценных данных, полученных на основе этого мульти-омического понимания метаболических взаимодействий между образом жизни, питательными интервенциями и экосистемой кишечника, обеспечит интригующие новые терапевтические возможности не только в профилактике и поддержании ремиссии CRC и ВЗК, но и в внесении жизненно важного вклада в поддержание и продвижение оптимального здоровья хозяина для повышения качества жизни каждого человека.
Литература к подразделу II →
Применение Метаболомики к пробиотическим и пребиотическим вмешательствам в клинических исследованиях на людях
1. Вступление
В начале 1990-х годов, с развитием методов секвенирования нуклеиновых кислот, интерес к микробиому вновь возрос. Новые методы, включающие анализ рибосомных малых субъединиц РНК-генов, например 16S-рибосомный анализ генов, быстро нашли свое применение в изучении кишечной среды. Вычислительные методы позволили определить микробное сообщество с беспрецедентным уровнем детализации. Однако, помимо состава, следует признать, что значительная часть воздействия бактериального сообщества на хозяина передается через производимые им метаболиты. Микробы производят или трансформируют широкий спектр циркулирующих химических веществ, включая аминокислоты, жирные кислоты, желчные кислоты, гормоны и витамины [4,5].
Связь между составом микробного сообщества и метаболической активностью является косвенной и, как было показано, сильно зависит от функциональной избыточности и метаболической пластичности [6,7,8]. Функциональная избыточность указывает на то, что некоторые виды могут быть взаимозаменяемы, выполняя при этом сходные функции. Таким образом, различия в микробных сообществах могут не приводить к различиям в функциях. Метаболическая пластичность отражает способность данного сообщества адаптироваться к изменениям окружающей среды путем корректировки метаболического функционирования. Для того чтобы лучше понять, каким образом пробиотические и пребиотические вмешательства влияют на хозяина, анализ микробного сообщества должен также сопровождаться анализом функции этих сообществ путем изучения метаболома.
Конечная цель многих исследований в области пробиотиков и пребиотиков состоит в том, чтобы помочь в разработке более эффективных и персонализированных вмешательств для улучшения здоровья человека. К сожалению, изысканный уровень контроля, доступный в исследованиях на животных, включая строго контролируемые диеты и окружающую среду, строго определенные графики дозирования пробиотиков и пребиотиков, а также возможность инвазивного отбора проб у человека отсутствуют (недоступны). Целью данного обзора является оценка современного состояния науки при анализе воздействия пробиотиков и пребиотиков в контексте клинических испытаний на людях. Эти исследования будут оценены, чтобы понять проблемы в дизайне исследования, аналитических подходах и интерпретации. Кроме того, в центре внимания будут только те исследования, в которых использовался метаболомический подход, основанный на открытиях, для более полного изучения воздействия пребиотиков и пробиотиков на здоровье человека.
Исследования, которые соответствовали целевым критериям, были найдены в PubMed с использованием строки поиска (микробиом ИЛИ микробиота) И (метаболомика или «профилирование метаболита» или «метаболическое профилирование») или (пробиотики или пребиотики). Тщательный обзор позволил получить 15 исследований, в которых сообщалось о результатах какой-либо формы клинических испытаний на людях и которые включали метаболомический подход, основанный на открытиях. Было обнаружено, что эти исследования сосредоточены на пяти основных областях здоровья, и результаты этих исследований будут описаны ниже. Детали каждого из этих исследований представлены в таблице 1.
Таблица 1. Описание клинических исследований пробиотических и пребиотических вмешательств на людях, которые включали использование основанного на открытиях метаболомического анализа.
2. Воздействие на здоровых людей
Один из основных вопросов, касающихся пребиотических и пробиотических вмешательств, заключается в том, насколько они могут влиять на сообщество и функцию здоровой кишки. Исследование Vandeputte et al. изучали эффекты фруктанов инулинового типа в рандомизированном двойном слепом плацебо-контролируемом перекрестном исследовании [14]. В этом исследовании 44 здоровых добровольца прошли двухнедельную фазу запуска, после чего последовало четырехнедельное вмешательство, двухнедельное вымывание и затем кроссовер.
Пребиотическое вмешательство состояло из ежедневного потребления инулина, полученного из цикория. Анализ микробного сообщества проводили с использованием секвенирования гена 16S рДНК. Результаты показали, что были значительные изменения в микробиоте с потреблением инулина. В частности, наблюдалось увеличение числа бифидобактерий (Bifidobacteria) и анаэростипов (Anaerostipes), а также уменьшение билофилии (Bilophilia). Увеличение количества бифидобактерий было ожидаемо, поскольку пребиотическая концепция фактически возникла из наблюдения селективной стимуляции бифидобактерий инулиновой ферментацией [1]. Метаболомический анализ использовал платформу ГХ-МС (газовая хроматография масс-спктрометрия) и был разработан, чтобы сосредоточиться только на летучих органических соединениях в соответствии с методом De Preter et al. [15]. Это давало значительно ограниченную картину фекального метаболома, оставляя практически без внимания все полярные соединения, включая важные органические кислоты, такие как лактат, сукцинат и формиат. Перекрестный анализ выявил один метаболит, додеканол, который увеличивался с потреблением инулина. Додеканол может иметь диетическое происхождение [16], но он также может быть результатом измененного пищеварения липидов в кишечнике [17].
Хотя анализы цитотоксичности и генотоксичности фекальной воды не выявили статистически значимой разницы между пребиотическим вмешательством и плацебо, PLS-DA показал, что профили метаболитов были сгруппированы в зависимости от степени цитотоксичности или генотоксичности образцов. Анализ показал, что кислоты, спирты и сложные эфиры ассоциированы с большей цитотоксичностью, в то время как циклоалканы и набор терпенов, включая α-пинен, α- и β-фелландрен, лимонен, 3-карен и камфен, ассоциированы с низкой токсичностью. Терпены являются вторичными метаболитами, продуцируемыми растениями, и, как было показано, обладают антиоксидантным и антимикробным действием [20]. Другим интересным метаболическим открытием было снижение изовалериановой кислоты с помощью WBEs. Эта жирная кислота с разветвленной цепью является маркером ферментации белка, который предполагает, что WBEs может изменить структуру ферментации толстой кишки, чтобы быть более сахаролитической, а не протеолитической.
В процессе старения наблюдались изменения в иммунной системе, и недавние исследования показали, что микробиота и микробный метаболом могут влиять на определенные иммунологические функции [21]. В исследовании Vulevic et al., Пребиотическое вмешательство с использованием смеси галактоолигосахаридов (GOS) было дано когорте пожилых пациентов для наблюдения за влиянием на кишечную микробиоту, фекальный метаболизм и иммунологические функции [22]. В исследовании приняли участие сорок здоровых пациентов в возрасте от 65 до 80 лет в рандомизированном двойном слепом плацебо-контролируемом перекрестном исследовании. Дизайн исследования включал десятинедельные вмешательства, разделенные четырехнедельным вымыванием. Было обнаружено, что вмешательство GOS оказывает иммуномодулирующее действие, включая изменения в NK-клетках и некоторых цитокинах, включая увеличение IL-10 и снижение IL-1β. Основные изменения в микробиоте оценивались с помощью флуоресцентной гибридизации in situ. Основное изменение включало увеличение количества бифидобактерий и бактероидов. Метаболомический анализ был проведен с использованием 1 Н ЯМР и показал, что повышенные уровни бифидобактерий коррелируют с повышением фекальных концентраций лактата, глутамата, орнитина и капроновой кислоты. Поскольку лактат является продуктом метаболизма бифидобактерий, этот результат поддерживает пребиотическое моделирование этой бактерии. Изменения в глутамате и орнитине, вероятно, связаны с изменениями в диете. Диетические записи не указывали на какие-либо различия в потреблении белка между группами лечения, но при корреляции уровней бифидобактерий с потреблением белка у всех испытуемых уровни потребления белка были выше у тех, у кого уровень бифидобактерий был выше. Данные метаболомики в этом исследовании подтвердили использование пребиотиков для изменения как уровня, так и функции бифидобактерий, а также продемонстрировали, как метаболомический анализ может дать дополнительную информацию о влиянии диетических моделей в исследовании.
3. Избыточный Вес / Ожирение
Первые ассоциации между микробиотой кишечника и ожирением были зарегистрированы Turnbaugh et al. в исследованиях с использованием фекальных трансплантатов от тучных людей к мышам без микробов [12]. При имплантации «тучной микробиоты» у мышей наблюдалось значительно большее увеличение жировых отложений, чем при имплантации «худой микробиоты». Учитывая Глобальное бремя ожирения для здоровья, существует большой интерес к поиску способов манипулирования микробиотой кишечника в качестве лечения ожирения. Поисковые параметры обнаружили два исследования, в которых пребиотики или пробиотики оценивались в исследованиях ожирения у человека с использованием метаболомики.
В исследовании женщин, страдающих ожирением, влияние фруктанов типа инулина (ITFs) было изучено для оценки влияния на микробный состав кишечника и системный метаболизм [23]. В этом двойном слепом плацебо-контролируемом вмешательстве участвовали 30 женщин с ожирением, ежедневно получавших добавки ITF в течение трех месяцев. 1 Н ЯМР анализ мочи и сыворотки выявил несколько интересных корреляций между изменениями метаболитов и кишечных бактерий. Уровни Propionibacterium и Bacteroides vulgatus были снижены при лечении пребиотиками и коррелировали с пониженными уровнями фосфатидилхолина и лактата в плазме. Уровни этих бактерий и метаболитов также, по-видимому, связаны с пониженным ожирением. Повышение уровня Collinsella, рода Actinobacteria, наблюдалось в группе пребиотиков и коррелировало с уровнями мочевого гиппурата. В отличие от большинства исследований, в которых основное внимание уделялось фекальным метаболомам, в этом исследовании были изучены моча и сыворотка, и было обнаружено несколько новых корреляций между кишечной микробиотой и уровнями системного метаболита.
Hibbert et al. сообщили об исследовании, включающем как пробиотические, так и пребиотические вмешательства в рандомизированном двойном слепом плацебо-контролируемом исследовании 134 взрослых с избыточной массой тела [24]. Это исследование включало четыре группы лечения (1) плацебо (микрокристаллическая целлюлоза) (2) лечение пребиотиком Litesse Ultra® полидекстроза (LU), (3) Bifidobacterium animalis subsp. Lactis 420® (B420) и (4) LU + B420 с продолжительностью вмешательства 6 месяцев. Фекальный метаболом анализировали с помощью 1 Н ЯМР, а сывороточные желчные кислоты измеряли с использованием UPLC/MS/MS, как описано Han et al. [25]. Результаты показали, что кишечная микробиота была модифицирована для всех групп, при этом вмешательство LU показало более сильный эффект, чем один B420. Численность семейства Christensenellaceae была значительно повышена в группах, получавших только LU и в комбинации с B420. Эти уровни также были положительно коррелированы с фекальными жирными кислотами с разветвленной цепью (BCFAs), изомасляной кислотой, изовалериановой кислотой, 2-метилмасляной кислотой и 3-метил-2-оксовалератом и желчными кислотами плазмы, литохолевой кислотой и гиодезоксихолевой кислотой. BCFAs обычно генерируются путем микробной ферментации непереваренных белков в толстой кишке, но было показано, что эти метаболиты могут быть получены в результате потребления полидекстрозы [26]. Недавнее исследование показало, что BCFAs влияют на метаболизм липидов и глюкозы в адипоцитах человека, ингибируя липогенез de novo [27]. В этом исследовании объединенные результаты анализа микробного сообщества и метаболомики дают новое понимание того, как эти вмешательства могут влиять на энергетический обмен хозяина.
Дополнительно см.:
4. Здоровье младенцев и детей
Было показано, что на состав микробиоты кишечника младенца существенное влияние оказывают диетические факторы [28,29]. Были показаны четкие различия в траектории развития микробного сообщества между грудными и искусственно вскармливаемыми младенцами [30,31]. Исследование, проведенное Bazanella et al. было разработано для оценки влияния вмешательства с добавлением пробиотической формулы на состав и функцию кишечника младенца в течение первого года жизни [32]. В этом рандомизированном двойном слепом плацебо-контролируемом клиническом исследовании новорожденным давали стандартную сывороточную смесь с добавлением Bifidobacterium bifidum, Bifidobacterium breve, Bifidobacterium longum и Bifidobacterium longum subspeces infantus или контрольную смесь без добавок. Контрольные группы, находившиеся на грудном вскармливании, также были включены в анализ. Когорта состояла из 49 младенцев в контрольной группе и 48 младенцев в интервенции. Разнообразие и состав фекальной микробиоты определяли с помощью секвенирования 16S рРНК, а фекальный метаболом был проанализирован методом UPLC/MS (ультраэффективной жидкостной хроматографии/масс-спектрометрии). Младенцы в группе вмешательства показали снижение количества бактероидов (Bacteroides) и блаутии (Blautia), а также изменения в липидах и неизвестных метаболитах в течение одного месяца. В течение оставшегося периода исследования состав микробиоты и метаболома сходились. Достоверные различия наблюдались между детьми на грудном вскармливании и детьми, получавшими искусственное вскармливание, причем основные различающиеся метаболиты относились к стероидным липидам, глицерофосфолипидам и жирным кислотам. Целенаправленный анализ короткоцепочечных жирных кислот также может отличить грудных детей от детей, получающих искусственное вскармливание, при этом грудные дети имеют более низкие пропорции пропионата, бутирата, валерата и изовалерата (соли или эфиры изовалериановой кислоты), в то время как дети, получающие искусственное вскармливание, имеют более высокие количества пировиноградной кислоты и молочной кислоты.
Рецидивирующие инфекции дыхательных путей (RRIs) являются частым явлением у детей дошкольного возраста. Пидотимод (Pidotimod) является иммуностимулятором, который используется для лечения RRI у детей. Недавнее исследование метаболомики детей с RRI, принимающих Pidotimod, показало, что препарат может частично восстанавливать метаболические изменения, вызванные RRI, но некоторые метаболиты, полученные из микробиоты, оставались измененными [36]. В последующем исследовании, проведенном Santamaria et al., было проведено рандомизированное двойное слепое плацебо-контролируемое исследование, чтобы определить, могут ли пидотимод и / или пробиотик с бифидобактериями снижать заболеваемость RRIs и изменять профиль метаболизма мочи у детей дошкольного возраста. [37]. Когорта детей в возрасте 3–6 лет была случайным образом распределена по четырем группам, где субъекты получали лечение в течение первых 10 дней каждого месяца в течение четырех месяцев. Первичной клинической конечной точкой было количество дней без симптомов. У детей, получавших пидотимод с пробиотиком или без него, было значительно больше дней без симптомов. Метаболические профили были измерены у 25 пациентов с использованием UPLC / MS. Никаких существенных различий в метаболических профилях не наблюдалось между группой, принимавшей плацебо и пробиотики, но было обнаружено большое отличие между плацебо и пидотимодом, как с пробиотиком, так и без него. Используя общий и уникальный участок структуры, они обнаружили, что стероидные гормоны, метаболиты, полученные из пути витамина B, и некоторые аминокислоты были связаны с использованием Pidotimod. В крайних точках этого типа сюжета находятся метаболиты, которые могут быть связаны с интерактивным эффектом пидотимода и пробиотика. К ним относятся метилгиппуровая кислота, кинуренин, 3-глюкуронид дезоксихолевой кислоты и оксоглутаровая кислота. Этот набор метаболитов связан с рядом различных аспектов кишечного микробного метаболизма, включая метаболизм триптофана и желчных кислот. Однако этот паттерн не может быть обусловлен конкретно эффектами пробиотика, поскольку эти изменения наблюдались только при введении Пидотимода с пробиотиком или без него. Учитывая клинический исход, есть подозрение, что эти метаболиты каким-то образом связаны с усилением иммунной функции, но для уточненния требуется дальнейшая работа.
Пробиотики были использованы в ряде исследований у недоношенных детей, при этом большое внимание уделялось лечению некротического энтероколита и позднего сепсиса [38]. Что касается первых, то данные более чем 20 РКИ свидетельствуют о положительном влиянии пробиотиков [39]. В исследовании недоношенных детей, проведенном Abdulkadir et al., секвенирование 16S рРНК и метаболомика на основе LC/MS (жидкостной хроматографии масс-спектрометрии) были использованы для определения влияния пробиотиков на недоношенных детей в отделении интенсивной терапии новорожденных (ОРИТ) [40]. Пробиотик состоял из Lactobacillus acidophilus-NCIMB701748 и Bifidobacterium bifidum-ATCC15696 (продается как Infloran®). Образцы фекалий отбирали до, во время и после приема пробиотика у 7 пациентов и 3 контрольных пациентов с согласованным временем. Образцы также собирали после выписки из отделения интенсивной терапии. Профилирование бактериального сообщества показало большее количество Bifidobacterium и Lactobacillus во время пробиотической обработки по сравнению с контролем. После прекращения приема добавок уровни Lactobacillus снизились, но концентрации Bifidobacterium оставались высокими, что указывало на успешную колонизацию. Самое большое различие в профилях метаболизма было между субъектом после выписки по сравнению с таковыми в отделении интенсивной терапии. Это предполагает, что воздействие новой среды оказывает большее влияние на этих детей, чем пробиотик. К сожалению, конкретные назначения метаболитов в этом исследовании не проводились.
См. дополнительно:
5. Синдром раздраженного кишечника
Синдром раздраженного кишечника является наиболее распространенным функциональным расстройством кишечника и характеризуется ассоциацией боли в животе или дискомфорта с изменениями частоты или консистенции стула без четкой этиологии заболевания [41]. В исследовании Hong et al. целевые методы культивирования были объединены с метаболомикой для оценки влияния пробиотического йогуртового напитка на 74 пациента с СРК [42]. В этом рандомизированном двойном слепом плацебо-контролируемом клиническом исследовании субъекты употребляли пробиотический йогуртовый напиток три раза в день во время еды в течение восьминедельного периода. Пробиотическая терапия оказала положительное влияние на симптомы пациентов, включая боль, метеоризм и показатели дефекации. Количественные методы культивирования клеток показали, что уровни Lactobacillus spp. были значительно увеличены после восьминедельного исследования, в то время как уровни бифидобактерий не изменились.
Это наблюдение за липопротеинами позволило выявить некоторые потенциальные половые эффекты пробиотиков, но, к сожалению, широкие исходные характеристики этих макромолекул мешают количественно соответствовать пикам ЯМР. Спектральные профили сравнивались с использованием интегрального биннинга, которое является менее количественным из-за эффектов спектрального перекрытия и мешающих базовых компонентов. Этот подход анализа также использовался для фекальных образцов. Эти дополнительные источники изменчивости могут иметь ограниченную способность обнаруживать значительные различия метаболитов.
Некоторые из метаболитов, которые различают здоровых и больных СРК-D, указывают на изменения в метаболизме одного углерода, включая сывороточный метионин и саркозин, а также таурин в моче. Это побудило авторов использовать анализ на основе ИФА (иммуноферментного анализа) для измерения другого ключевого промежуточного соединения в одноуглеродном пути, гомоцистеина. Установлено, что уровни гомоцистеина в сыворотке крови повышены в группе СРК-D. После вмешательства уровни были еще более снижены, что позволяет предположить, что одним из механизмов, с помощью которого лечение с помощью синбиотика улучшает симптомы СРК-D, может быть модуляция одноуглеродного метаболизма.
6. Здоровье женщин / беременность
Вагинальная микробиота является частью сложной системы противомикробной защиты, которая защищает женщин от болезней [47]. В здоровом состоянии в микробиоте влагалища доминирует род Lactobacillus [48]. Считается, что лактат, вырабатываемый этими бактериями, создает кислую среду, которая ограничивает рост многих патогенных бактерий. Было показано, что предменопаузальная вагинальная микробиота обладает высокой динамикой по сравнению с постменопаузальным состоянием, вероятно, из-за эффектов гормонального цикла. В исследовании Bisanz et al., было проведено детальное изучение влияния пробиотического лечения на постменопаузальный микробиом влагалища [49]. В этом исследовании семеро испытуемых получали вагинальное введение пробиотика, состоящего из L. rhamnosis GR-1 и L. reuteri RC-14, а семеро получали лечение плацебо. Женщины были оценены с помощью балльной системы Ньюджента, которая используется для оценки бактериального вагиноза (БВ). Все женщины, участвовавшие в исследовании, имели промежуточные баллы, свидетельствующие о потенциальном риске перехода к БВ. Трехдневное лечение не повлияло на оценку Ньюджента, но наблюдались некоторые изменения в микробном сообществе. Анализ с секвенированием 16S рРНК выявил увеличение относительного обилия лактобацилл. Был проведен нецелевой анализ ГХ-МС, но не было обнаружено никаких различий между испытуемыми на пробиотике и плацебо. Получение достаточного количества образцов для метаболомики было отмечено как сложная задача с использованием вагинальных мазков, и были проанализированы образцы только от четырех женщин, которые продемонстрировали увеличение количества лактобацилл. Была обнаружена значительная положительная корреляция между уровнями лактата и количеством бактерий, продуцирующих лактат. Авторы признали, что это может показаться интуитивным открытием, но, насколько им известно, об этой взаимосвязи еще не сообщалось.
Следующее исследование использования пробиотиков для микробиоты влагалища, также проведенное лабораторией Reid, оценило использование оральных пробиотиков у беременных женщин в Руанде [50]. Использование пробиотиков не очень хорошо известно в развивающихся странах, таких как Руанда, но потенциал для лечения и профилактики заболеваний, которые поражают эти страны, таких как урогенитальные, диарейные и респираторные заболевания, очень высок [51,52,53]. В этом рандомизированном слепом плацебо-контролируемом клиническом исследовании в общей сложности 31 женщина завершила исследование (13 плацебо, 18 пробиотиков), получая ежедневные пероральные добавки в течение одного месяца. Влагалищные мазки использовали для сбора образцов для секвенирования 16S рРНК и метаболомики на основе ГХ-МС.
Полученные результаты показали ожидаемое низкое бактериальное разнообразие, связанное со здоровым влагалищем. Между плацебо- и пробиотическим лечением не наблюдалось существенных изменений в составе микробиоты влагалища. Точно так же никаких существенных изменений не наблюдалось и в вагинальном метаболоме. Интересно, что женщины в группе плацебо были значительно более склонны к преждевременным родам с тремя женщинами в группе плацебо по сравнению ни с одной в группе пробиотиков. Учитывая небольшой размер этого исследования, это интригующее открытие должно быть подтверждено в более крупной когорте. Дальнейший анализ данных метаболомики подтвердил ранее наблюдавшийся набор биомаркеров, ассоциированных с бактериальным разнообразием и бактериальным вагинозом [54]. Высокие уровни 2-гидроксиизовалерата и γ-гидроксибутирата, продуцируемых Lactobacillus crispatis и БВ-ассоциированными анаэробами, были значительно выше у испытуемых с высоким баллом Ньюджента.
7. Другие исследования
8. Обсуждение и выводы
С ростом интереса к использованию пребиотических и пробиотических вмешательств для широкого спектра заболеваний становится все более важным понимание подробных биохимических механизмов, посредством которых они функционируют. Как обсуждалось ранее, анализ структуры микробного сообщества с использованием методов секвенирования генов может не дать информацию о реальном функционировании бактерий. Несмотря на множество доклинических исследований, было проведено относительно мало исследований использования пробиотиков и пребиотиков в контексте клинических испытаний на людях, в которых использовались передовые методы метаболомики. Представленные здесь примеры охватывают ряд особенностей, включая патологическое состояние, размер когорты, частоту дозирования и продолжительность. Цель этого обзора состояла в том, чтобы оценить, как эти исследования были разработаны и проанализированы, и рассмотреть пути оптимизации будущих исследований.
Обзор схем исследования клинических испытаний, описанных здесь, показывает одну важную переменную, которая обычно не опрашивалась. Как указано в определении пробиотиков и пребиотиков, эти методы лечения необходимо «вводить в адекватных количествах», чтобы обеспечить благоприятные эффекты для хозяина. В описанных исследованиях доза, частота и продолжительность вмешательств были установлены в начале исследования, и не было дано четких указаний на то, как были получены эти параметры. Определение дозировки для фармацевтического препарата включает исследование доза-ответ с руководящим принципом «начинай с низкого, иди медленно». Поскольку пробиотики и пребиотики, как правило, считаются безопасными, такие исследования доза-ответ будут иметь гораздо меньший риск, чем с фармацевтическими препаратами. Очевидная проблема, связанная с исследованиями в диапазоне доз, заключается в том, что им потребуется большее количество пациентов для оценки эффектов дозирования, частоты и продолжительности, но в какой-то момент эти типы исследований должны быть выполнены. Наиболее практичные применения могут быть в четко определенных когортах, например, у пациентов с указанной патологией. Таким образом, итоговый фенотип должен быть достаточно сильным, чтобы меньшие когорты могли иметь статистическую силу для определения эффективной стратегии дозирования.
Как и в любом метаболомическом анализе, существует ряд аналитических источников вариации, которые необходимо учитывать. Спектр аналитических платформ, используемых в обсуждаемых здесь исследованиях, является репрезентативным для остальной части области метаболомики. Преимущества и недостатки этих платформ были подробно рассмотрены, и резюме различных платформ, используемых в анализе фекальных метаболитов, представлено в обзоре Karu et al. [73,74]. Учитывая сильные и слабые стороны каждой платформы, особенно с точки зрения чувствительности, количественной оценки и воспроизводимости, использование нескольких платформ было бы весьма выгодно. Примеры этого были приведены в нескольких представленных исследованиях, где глобальный нецелевой анализ сочетался с целенаправленной метаболомикой, чтобы обеспечить более количественные измерения важных метаболитов, таких как короткоцепочечные жирные кислоты, которые могут быть пропущены первичным нецелевым подходом.
Еще одним источником изменений в пробах фекалий является содержание воды. Фекальные образцы обычно содержат 60-85% воды, в зависимости от потребления клетчатки [76]. Эта вариабельность меньше, чем обычно обнаруживается в образцах мочи, но все же является значительной при поиске потенциально небольших изменений метаболитов. Как и в случае с образцами мочи, существуют методы обработки данных, которые помогут свести к минимуму эти эффекты. Часто используется «нормализация постоянной суммы», когда общая спектральная область для ЯМР и общее количество ионов для МС устанавливается на выбранное значение. Вероятностная нормализация частных показателей-это еще один метод постобработки нормализации, который был использован для учета изменчивости состава фекалий [77]. Альтернативно, данные могут быть собраны на лиофилизированных образцах, но это может повлиять на состав метаболитов. Интересно, что в большинстве рассмотренных исследований было включено мало подробностей о применении методов нормализации, что, возможно, снизило информативность исследований.
Исследования, рассмотренные здесь, демонстрируют потенциал метаболомики, способствующей пониманию того, как пребиотики и пробиотики функционируют у людей. Продолжение работы по разработке стандартизированных протоколов для фекальной метаболомики поможет минимизировать как биологические, так и аналитические источники вариаций. Эти разработки, наряду с использованием многоплатформенных подходов, обеспечат более подробные и всесторонние данные метаболомики. Объединение этих данных с продвинутым анализом микробного секвенирования поможет выяснить подробные биохимические механизмы, с помощью которых пробиотики и пребиотики могут оптимально применяться для улучшения здоровья человека.
Литература к подразделу III →
Дополнительная информация:
Будьте здоровы!
ССЫЛКИ К РАЗДЕЛУ О ПРЕПАРАТАХ ПРОБИОТИКАХ