Метастазы что это
Метастазы что это
Метастазы причины, симптомы, методы лечения и профилактики
Метастазы – вторичные злокачественные новообразования различных тканей и органов, появляющиеся в результате распространения злокачественных клеток первичной опухоли. На ранних стадиях они не вызывают выраженных симптомов. В дальнейшем клиническая картина зависит от локализации метастазов. Чаще всего злокачественные опухоли метастазируют в печень, легкие и лимфоузлы. Реже они встречаются в центральной нервной системе, почках, надпочечниках, коже, селезенке и костях. Они нарушают работу внутренних органов, что приводит к летальному исходу.
Симптомы метастазов
Метастазы сопровождаются местными симптомами:
При вторичных очагах в головном мозге пациент жалуется на сильные головные боли, тошноту и рвоту, неврологические нарушения. При метастазах в спинном мозге больной ощущает болевой синдром, быстро устает при физических нагрузках, нарушается функционирование органов таза и прогрессируют расстройства движений. При метастазировании в легкие у пациента часто наблюдаются ОРВИ, грипп, воспаление легких или бронхит, сопровождающиеся одышкой и влажным кашлем.
Метастазы в печень характеризуются болью и тяжестью в правом подреберье, нарушением деятельности печени, увеличением ее в размерах. На поздних стадиях онкологического заболевания развивается желтуха, печеночная недостаточность и асцит.
Вторичные опухоли в костях провоцируют патологические переломы, сильные боли и высокий уровень кальция в плазме крови. Они могут привести к сдавлению спинного мозга, сосудистых и нервных стволов. При метастазах в брюшную полость развивается асцит.
Метастазы в коже могут иметь вид плотных одиночных или множественных узлов розового или синего оттенка.
Статью проверил
Дата публикации: 24 Марта 2021 года
Дата проверки: 24 Марта 2021 года
Дата обновления: 22 Августа 2022 года
Содержание статьи
Причины
Врачи выделяют 3 основные пути метастазирования:
У пациентов, прошедших противоонкологическое лечение, невозможно точно определить, будет ли в дальнейшем распространение метастаз или нет, поэтому им следует каждые 3 месяца проходить осмотр в течение двух лет, далее реже.
Возраст онкобольных влияет на количество рецидивов, у молодых пациентов метастазы отличаются быстрым развитием и тяжелым течением, чем у пожилых людей.
Наиболее распространенным раковым поражением у мужчин считается злокачественная опухоль в тканях простаты. Она вызывает затруднение с опорожнением мочевого пузыря и эректильную дисфункцию, метастазы могут возникать кости таза и пояснично-крестцовом отделе позвоночника.
Диагностика
Для выявления метастазов врач назначает расширенное обследование. В него входит общий и биохимический анализы крови, анализ крови на онкомаркеры, рентгенологическое исследование грудной клетки, УЗИ органов малого таза и брюшной полости, компьютерную томографию и МРТ спинного или головного мозга, сцинтиграфию костей скелета и другие. Подтвердить наличие метастазов можно при помощи цитологического или гистологического исследования пораженной ткани.
МРТ (магнитно-резонансная томография)
КТ (компьютерная томография)
К какому врачу обратиться
При первых проявлениях симптоматики обратитесь к онкологу — врач специализируется на злокачественных новообразованиях. Специалист проведет осмотр, соберет анамнез, назначит диагностики, по ее результатам назначит эффективное лечение.
Лечение метастазов
Схема лечения зависит от вида рака и состояния первичного новообразования, общего состояния пациента, размеров и локализации метастазов. К эффективным методам терапии относят:
При метастазировании лимфатических узлов могут проводить лимфаденэктомию и удаление первичной опухоли. При контролируемых первичных новообразованиях и одиночных метастазах иногда показано радикальное иссечение вторичных очагов.
Для уменьшения опухолевого процесса врач назначает витаминные комплексы. Также они поддерживают защитные свойства организма.
Замедлить патологические процессы в костях помогают бисфосфонаты. Эти препараты купируют болевые ощущения, снижают вероятность переломов и регулируют обменные процессы.
Для разрушения раковых клеток показана лучевая терапия. Среднее количество процедур – не менее 10. Прогноз благоприятный только в том случае, если повторение рецидивов вторичных очагов отсутствует.
Прогноз при метастазах зависит от степени запущенности патологии, локализации и стадии первичного новообразования, состояния иммунитета пациента, степени истощения, уровня повреждения других органов и прочего. При метастазировании печени средняя продолжительность жизни составляет 6 месяцев, при поражении головного мозга – несколько недель, при вторичных очагах в почках – 1-3 года, при метастазах в кости – от нескольких месяцев до нескольких лет.
Осложнения
При метастазах в позвоночнике повышается риск возникновения компрессионного синдрома. Он может спровоцировать парезы и параличи. Пациент утрачивает возможность самостоятельно передвигаться и обслуживать себя. Также на фоне заболевания возникают другие соматические патологии, приводящие к летальному исходу.
Если у пациента запущенный рак простаты и яичников, то его частым осложнением считается метастазирование в тазовые кости и тазобедренные суставы. При множественных вторичных очагах костная ткань нарушается, что приводит к обездвиживанию онкобольного.
Профилактика
Для предотвращения онкологических заболеваний и метастазов следует придерживаться следующих рекомендаций:
Метастазы — как выявить раньше вторичной опухоли
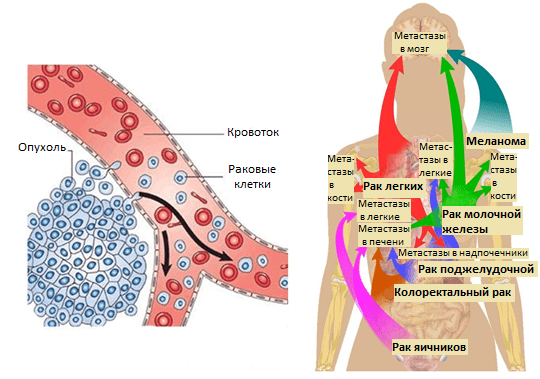
Метастазы — злокачественные клетки, отделившиеся от первичного новообразования и перенесенные с током крови или лимфы в другие участки тела. Зачастую метастазы в органах и тканях обнаруживаются на поздних стадиях онкопатологии. Именно поэтому очень важно вовремя понять, является ли обнаруженная у человека опухоль первичным очагом и распространяет ли он патологические клетки за свои пределы.
Метастазы — что это такое
О том, что такое метастазы при раке и насколько они опасны, знают не только врачи — для людей с онкопатологиями этот термин особенно пугающий. Появление метастазов значит, что раковые клетки оторвались и начали перемещаться из очага, возникшего первым. Результатом их распространения становится образование опухоли в других органах, тканях.
Распротраняются патологические клетки по сосудам с током крови (гематогенные) и лимфы (лимфогенные). Метастазы попадают в кровеносное и лимфатическое русло в случае травмирования сосудов, расположенных в непосредственной близости от первичной опухоли.
В крови и лимфе обнаруживаются циркулирующие опухолевые клетки (ЦОК). Когда они прикрепляются к стенке сосуда или к органу, через который он проходит, метастазы выходят за пределы своего транспортного коридора и начинают активно делиться.
В случае, когда человек обладает крепким иммунитетом, метастазы не образуют новые опухоли. Намного опаснее ситуация, при которой иммунная защита организма ослаблена. Тогда появление аномальных клеток приводит к быстрому образованию и росту множественных очагов опухоли, которые нарушают структуру нормальных тканей, сдавливают жизненно важные органы, вызывают сильные боли и приводят к гибели человека.
Симптомы метастазов
В зависимости от того, в каком органе из-за распространения аномальных клеток сформировалась опухоль, возникают характерные симптомы. Например, метастазы в трубчатых костях, позвоночнике вызывают их хрупкость, возникают множественные переломы. Человек испытывает нестерпимые боли.
При появлении вторичных очагов опухоли в головном мозге возникают характерные симптомы:
Симптомы метастазов в легких (они возникают на фоне рака ЛОР-органов, молочной железы, прямой кишки и других органов):
Появление множественных вторичных очагов в печени сопровождается желтухой, сильной интоксикацией.
Стадии развития метастаз
Риск появления метастазов в других органах зависит от вида рака и стадии на которой выявлена первичная опухоль. Если первичное новообразование диагностировано рано, и пациент с ним получил лечение на первой стадии, то риск метастазирования сведен к минимуму.
Онкологи выделяют несколько стадий развития вторичных опухолевых очагов:
Скорость его развития и симптомы, которые испытывает больной человек, зависят от вида рака, его агрессивности, локализации вторичного новообразования.
Диагностика метастаз
Выявить метастазы удается с использованием различных диагностических методов. Наиболее эффективными для обследования больных с подозрением на метастазы являются:
Метод диагностики врачи определяют в индивидуальном порядке, ориентируясь на вид рака, предполагаемое место, где сформировалась вторичная опухоль (по симптомам) и особенностям крово- и лимфообращения в области первичного новообразования.
Диагностику с целью выявления метастазов проводят как до начала первого курса лечения, так и после удаления первичной раковой опухоли.
Лабораторные исследования также очень информативны, если нужно обнаружить вторичное новообразование и определить характер метастазов на ранних стадиях.
Один из наиболее эффективных методов — ранняя иммунологическая диагностика. Она позволяет выявить единичные циркулирующие опухолевые клетки или целые их конгломераты, вовремя начать лечение и не допустить усугубления патологического процесса.
Циркулирующие опухолевые клетки очень коварны — всего несколько их, попавших в кровоток, может перенестись в головной мозг, легкие, печень или другие органы. Там клетки могут пребывать в состоянии ожидания в течение долгих лет. В случае, если возникает достаточно сильный стимул, они начинают быстро размножаться и формируют опухоль.
ЦОК практически не реагируют на облучение и воздействие химиопрепаратами. Анализ крови на ЦОК позволяет выявить их во время лечения и по окончании полного курса. Те пациенты, у которых после терапии обнаруживаются ЦОК, причисляются к группе повышенного риска, у них могут появиться метастазы.
При каких видах рака выявляется ЦОК
Анализ крови на циркулирующие опухолевые клетки позволяет обнаружить их при большинстве раковых процессов, развивающихся из эпителиальных тканей и при меланоме. Максимально информативна диагностика по крови при новообразованиях молочной железы у женщин, предстательной — у мужчин, а также при раке прямой кишки.
Врачи делают вывод о наличии гематогенных или лимфогенных метастазов, если показатель ЦОК на 7,5 мл венозной крови превышает:
Более высокие показатели сопряжены с большой угрозой метастазирования и коротким периодом ремиссии.
Диагностика по методу ДОК
Чтобы вовремя выявить метастазы при меланоме, раке молочной железы важны и другие методы лабораторной диагностики. Так, единичные патологические клетки удается обнаружить в костном мозге при помощи анализа диссеминированных опухолевых клеток (ДОК). На основании этого исследования специалисты определяют реальную распространенность аномальных клеток и степень риска появления метастатических очагов.
Как проводится анализ на ЦОК и ДОК
Иммунологическое исследование клеток костного мозга (диссеминированые опухолевые клетки), 6 цветная проточная цитометрия;
Иммунологическое исследование опухолевых клеток периферической крови (циркулирующие опухолевые клетки), 6 цветная проточная цитометрия.
ЦОК и ДОК — диагностика относится к числу жидкостных исследований. Для выявления онкологических клеток по методике ЦОК у пациента берут порцию венозной крови, для ДОК проводится стернальная пункция (забор образца костного мозга, от 0,5 до 1 мл).
Полученный биоматериал инкубируют с добавлением специальных антител, а затем определяют количество и качество аномальных клеток, их жизнеспособность.
Диагностика по методу ЦОК и ДОК дает возможность:
Особенности лечения метастазов
Чтобы уничтожить метастазы, применяются хирургические и консервативные методы лечения.
Часто метастазы в лимфоузлах, отдельные очаги, расположенные в органах удаляют одновременно с основной опухолью. Проводится операция по удалению метастазов при помощи традиционных хирургических методов. С этой же целью применяется кибер-нож и протонно-лучевая терапия.
Чтобы остановить распространение новых очагов рака, после операции проводится курс, в котором сочетаются химио— и таргетная терапия, а также облучение.
Противоопухолевые препараты больному вводят внутривенно, в некоторых случаях применяется методика артериального введения лекарства максимально близко к пораженному органу. Комплексное лечение останавливает метастазирования и вызывает уменьшение опухоли.
Своевременно сделанные анализы позволяют выявить онкозаболевания на самых ранних этапах, провести лечение и минимизировать угрозу множественных метастазов при уже имеющихся онкообразованиях.
Пройти иммунологическую диагностику клеток костного мозга (ДОК) или исследование опухолевых клеток, циркулирующих в периферической крови (ЦОК) можно в лабораторном отделении нашего центра.
Филиалы и отделения где применяется инновационный метод диагностики метастазов
МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Метастазы
Метастазы – вторичные злокачественные опухоли различных органов и тканей, возникшие в результате гематогенного, лимфогенного или имплантационного распространения злокачественных клеток первичного новообразования. Могут обнаруживаться в любом органе. На ранних стадиях протекают бессимптомно. В последующем клинические проявления зависят от локализации метастаза. Диагноз устанавливается с учетом анамнеза, жалоб, данных объективного осмотра, результатов анализов и инструментальных исследований. Лечение – химиотерапия, радиотерапия, хирургические вмешательства.
Общие сведения
Метастазы – отдаленные очаги онкологического процесса, возникшие при перемещении злокачественных клеток по организму. Выявляются у лиц любых возрастов, однако наибольшее количество поражений обнаруживаются у пациентов старше 50 лет. Могут появляться при большинстве злокачественных опухолей и поражать любые органы. Чаще всего злокачественные новообразования метастазируют в лимфатические узлы, легкие и печень. Несколько реже встречаются метастазы в кости, надпочечники, почки и центральную нервную систему. Редко диагностируются метастатические поражения поджелудочной железы, селезенки, кожи, скелетных мышц и сердечной мышцы.
Нарушения функции различных органов, обусловленные ростом метастазов, являются ведущей причиной смертности при онкологических заболеваниях. Появление вторичных очагов ухудшает прогноз и делает невозможным радикальное лечение злокачественной опухоли либо создает существенные ограничения при выборе методов терапии. Диагностику и лечение метастазов осуществляют специалисты в области онкологии и других специальностей (в зависимости от локализации вторичного очага).
Этиология и патологическая анатомия метастазов
Без соответствующего лечения со временем метастазы возникают почти при всех злокачественных опухолях, однако сроки их появления могут существенно варьировать. Иногда метастазы обнаруживаются через несколько лет после развития первичного процесса, иногда – через несколько месяцев, а иногда и вовсе становятся первым проявлением онкологического заболевания, поэтому временной интервал между развитием первичной опухоли и возникновением метастазов не удается установить даже приблизительно.
Специалисты считают, что в некоторых случаях злокачественные клетки могут мигрировать в различные органы, образовывая «спящие очаги», которые в последующем активизируются и начинают быстро расти. Однако причины, по которым метастазы при одном и том же заболевании появляются и развиваются с разной скоростью, пока не установлены. Можно лишь перечислить ряд факторов, способствующих быстрому возникновению и прогрессированию вторичных образований.
В числе таких факторов – большое количество мелких сосудов вокруг первичного новообразования, особенности расположения и гистологического строения первичного очага, иммунные расстройства и возраст пациентов (у молодых метастазы возникают и прогрессируют быстрее, чем у пожилых). Большое значение имеет противоопухолевая терапия – после такой терапии трудно прогнозировать вероятность и возможное время появления метастазов. Иногда вторичные очаги возникают спустя несколько лет после прохождения курса лечения, на фоне изменения каких-то жизненных условий или без всяких видимых причин.
Клетки первичной опухоли могут распространяться по организму тремя путями: лимфогенным (по лимфатическим сосудам), гематогенным (по кровеносным сосудам) и имплантационным. Имплантационное метастазирование становится возможным после разрушения капсулы органа и выхода злокачественных клеток в ту или иную естественную полость. Например, клетки рака яичника через брюшную полость могут мигрировать на поверхность печени, а клетки первичного рака легких через плевральную полость – на поверхность плевры.
Преобладающий путь метастазирования определяется происхождением и степенью злокачественности опухоли. Клетки соединительнотканных и эпителиальных новообразований чаще мигрируют по лимфатическим путям. При опухолях высокой степени злокачественности преобладает гематогенное распространение. В большинстве случаев лимфогенные метастазы появляются раньше гематогенных. В первую очередь страдают регионарные лимфоузлы. Затем злокачественные клетки могут распространяться дальше по лимфатической системе.
Знание особенностей лимфотока в той или иной анатомической зоне позволяет определять возможные пути метастазирования и выявлять вторичные скопления злокачественных клеток (за исключением случаев микрометастазирования). Гематогенные метастазы возникают на значительном удалении от органа, пораженного первичным процессом, поэтому для их обнаружения приходится проводить комплексное обследование с учетом наиболее вероятных областей метастазирования.
Разные виды рака с различной частотой метастазируют в те или иные органы. Так, рак молочной железы, рак почек, рак предстательной железы и рак щитовидной железы чаще всего дают метастазы в легкие, кости и печень. При раке желудка, раке яичников, раке толстой кишки, раке тела матки и раке поджелудочной железы поражаются печень, брюшина и легкие. Рак прямой кишки и рак легкого распространяются в печень, надпочечники и легкие (при раке легкого страдает второе легкое). Меланома дает метастазы в печень, легкие, кожу и мышцы.
Среди вторичных новообразований преобладают солидные узловые формы, реже встречаются язвенные поверхности (например, при поражении кожи), слизеобразующие объемные образования (метастазы Крукенберга) и другие типы опухолей. Размер метастазов может варьировать от нескольких миллиметров до 20 и более сантиметров. Возможно одиночное поражение определенного органа, множественное поражение определенного органа, а также одиночные или множественные вторичные очаги в нескольких органах. Отдельно стоит упомянуть так называемые «пылевые» метастазы – множественные мелкие очаги в брюшной полости, провоцирующие развитие асцита.
По своей гистологической структуре вторичные новообразования обычно соответствуют первичной опухоли. Вместе с тем, в отдельных случаях метастазы могут иметь гистологическое строение, отличающееся от строения первичного рака. Обычно такие отличия выявляются при метастазировании опухоли полого органа в паренхиматозный орган (например, при метастатическом раке печени, возникшем вследствие первичного рака толстой кишки). Иногда из-за различия в структуре первичного и вторичного очагов возникают сложности при дифференцировке метастазов и множественного рака.
Симптомы метастазов
На начальных стадиях метастазы обычно протекают бессимптомно. В последующем клинические проявления зависят от локализации вторичного новообразования. Местная симптоматика сочетается с общими признаками онкологического заболевания: гипертермией, потерей аппетита, уменьшением массы тела вплоть до раковой кахексии, общей слабостью и анемией. При метастазах в лимфатические узлы наблюдается увеличение их размера, определяемое при пальпации или в процессе визуального осмотра.
Узлы обычно безболезненные, мягко-эластической консистенции. Чаще всего метастазы локализуются в шейных, паховых, подмышечных и надключичных лимфоузлах. При достаточно большом размере такие очаги могут быть обнаружены уже на этапе обычного осмотра. Выявление метастазов в некоторых лимфатических узлах (забрюшинных, парааортальных, узлах брюшной полости, узлах средостения) возможно только при проведении инструментальных исследований, поскольку эти анатомические образования недоступны для объективного обследования. Подозрение на наличие таких метастазов может возникнуть при их значительном увеличении, вызывающем сдавление близлежащих анатомических образований.
Проявления гематогенных метастазов определяются их локализацией. При вторичных очагах в головном мозге возникают головокружения, распирающие головные боли, тошнота, рвота и очаговые неврологические расстройства. При метастазировании в спинной мозг появляются боли, быстрая утомляемость при физической нагрузке, нарушения деятельности тазовых органов, прогрессирующие расстройства движений и чувствительности. При метастазах в легких наблюдаются частые рецидивы воспалительных заболеваний (бронхита, пневмонии, гриппа, ОРВИ), в последующем присоединяется одышка и кашель с примесью крови в мокроте.
Метастазы в печень проявляются тяжестью и болями в правом подреберье, нарушением печеночных функций, увеличением и бугристостью печени. На поздних стадиях выявляются желтуха, асцит и прогрессирующая печеночная недостаточность. Вторичные новообразования в костях вызывают мучительные боли, гиперкальциемию и патологические переломы. Возможно сдавление спинного мозга, нервных и сосудистых стволов. При метастазах в брюшину возникает асцит, обусловленный нарушением регуляции процесса выделения и всасывания жидкости тканями брюшины.
Метастазы в кожу представляют собой плотные, быстро растущие одиночные или множественные узлы телесного, синеватого или розоватого цвета. В последующем наблюдается их распад и изъязвление. При некоторых первичных новообразованиях (например, при карциноме молочной железы, раке толстого кишечника, раке яичника и раке мочевого пузыря) симптомы вторичных кожных опухолей могут имитировать клиническую картину рожистого воспаления. Реже (обычно – при опухолях молочной железы) выявляются склеродермоподобные метастазы.
Диагностика метастазов
Диагноз устанавливается на основании клинических данных и результатов дополнительных исследований. Из-за высокой склонности к развитию метастазов любое злокачественное новообразование является показанием для расширенного обследования (даже если признаки поражения других органов отсутствуют). Больным с подозрением на метастазы назначают общий анализ крови, биохимический анализ крови и анализ крови на маркеры рака. Пациентов направляют на рентгенографию грудной клетки, УЗИ органов брюшной полости, УЗИ органов малого таза, КТ и МРТ головного мозга, КТ и МРТ спинного мозга, сцинтиграфию костей скелета, рентгенографию костей скелета и другие исследования.
Наличие метастазов окончательно подтверждают при проведении гистологического либо цитологического исследования измененной ткани. Забор гистологического материала из мягких тканей осуществляют путем инцизионной, сердцевинной или щипковой биопсии. При поверхностном расположении метастазов используют скарификационную биопсию, при поражении костей – трепан-биопсию. Материал для цитологического исследования получают путем взятия обычных отпечатков или мазков-отпечатков. Для забора жидкости проводят аспирационную биопсию.
Дифференциальную диагностику метастазов осуществляют с первичными новообразованиями и с множественным раком (при одновременном или почти одновременном обнаружении нескольких очагов в одном или разных органах). В некоторых случаях требуется дифференцировка с дегенеративно-дистрофическими и воспалительными процессами. Так, симптоматическую пневмонию при метастазах в легких необходимо дифференцировать с обычной пневмонией, мелкие метастазы в позвоночник на фоне предшествующего остеопороза – с возрастными изменениями позвоночника и т. д.
Лечение метастазов
Тактика лечения определяется индивидуально с учетом вида рака, состояния первичной опухоли, общего состояния больного, чувствительности клеток к тому или иному типу лечебного воздействия, количества, локализации и размера метастазов. Возможно использование радиотерапии, химиотерапии, иммунохимиотерапии, гормонотерапии, классических хирургических вмешательств, радиохирургии, криохирургии и эмболизации питающих артерий. Как правило, при метастазах применяется комбинация нескольких методов лечения (например, химиотерапии и лучевой терапии, химиотерапии и иммунотерапии, лучевой терапии и хирургического вмешательства и т. д.). Показания к оперативному лечению и объем вмешательства также зависят от количества и локализации метастазов.
При метастазах в регионарные лимфатические узлы обычно проводят лимфаденэктомию в сочетании с удалением первичного новообразования. При контролируемых первичных опухолях и одиночных метастазах в отдаленные органы в некоторых случаях возможно радикальное иссечение вторичных очагов. При множественных метастазах хирургическое вмешательство, как правило, не показано. Исключением являются ситуации, когда паллиативная операция может отсрочить летальный исход или улучшить качество жизни больного (например, краниотомия для снижения опасного внутричерепного давления, вызванного метастатической опухолью мозга).
Прогноз при метастазах
До недавнего времени наличие метастазов рассматривалось, как свидетельство скорой гибели пациента. Сейчас ситуация постепенно меняется, хотя наличие вторичных опухолей по-прежнему рассматривается, как крайне неблагоприятный прогностический признак. Использование новых методов диагностики и лечения в ряде случаев позволяет увеличить среднюю продолжительность жизни больных. При определенных условиях стало возможным радикальное лечение метастазов некоторых локализаций, например, одиночных очагов метастатического рака печени или метастатического рака головного мозга.
В целом прогноз при метастазах определяется степенью запущенности онкологического процесса, возможностями конкретного лечебного учреждения (некоторые лечебные и диагностические методики доступны только в крупных центрах), видом, локализацией и стадией первичной опухоли, возрастом больного, состоянием его иммунной системы, степенью истощения, уровнем нарушения функций различных органов и пр. Средняя продолжительность жизни при метастатическом раке печени составляет около полугода, поражении головного мозга – несколько недель, при метастазах в кости – несколько лет, при вторичных новообразованиях в почках – 1-3 года.
Метастазы
Метастазы — это вторичные очаги поражения, которые возникают в результате распространения клеток первичного злокачественного новообразования по организму.
Акции
Полное обследование на онкологические заболевания для мужчин и женщин.
Онкоконсилиум может потребоваться как при лечении в «СМ-Клиника», так и пациентам других медицинских учреждений с целью получения альтернативного мнения.
«СМ-Клиника» предоставляет своим пациентам предоперационное обследование со скидкой до 72%!
Консультация врача-хирурга по поводу операции бесплатно!
Содержание статьи:
Метастазы — это вторичные очаги поражения, которые возникают в результате распространения клеток первичного злокачественного новообразования по организму. Какое-то время они никак не проявляют себя.
В последующем клиническая картина зависит от метастазирования опухоли. Диагноз ставится на основе данных анамнеза, осмотра и опроса пациента, результатов лабораторных и инструментальных исследований. Лечение комплексное включает в себя удаление первичной опухоли, радио и химиотерапию, оперативное вмешательство (при наличии показаний).
Причины метастазирования рака
Точные причины запуска патологического процесса в организме неизвестны. Но существует ряд провоцирующих факторов, которые повышают риск метастазирования:
Пути метастазирования рака
Выделяют несколько видов метастазирования рака:
Кроме двух основных выделяют еще несколько путей метастазирования:
Рис. 1. Метастазы аденокарциномы легкого в головном мозге (окрашивание гематоксилин эозином)
Этапы метастазирования опухоли
Механизм метастазирования — это довольно сложный процесс. Выделяют 5 основных стадий метастазирования опухолей:
Типичные локализации метастазов
| Вид рака | Стандартные места метастазирования |
| Рак молочной железы | легкие, печень, кости |
| Рак яичников | брюшина, печень, легкие |
| Рак желудка | печень, брюшина, легкие |
| Рак толстого кишечника | печень, брюшина, легкие |
| Рак прямой кишки | печень, легкие, надпочечники |
| Рак предстательной железы | кости, легкие, печень |
| Рак тела матки | печень, легкие, брюшина |
| Рак почки | легкие, печень, кости |
| Рак легкого | надпочечники, печень, второе легкое |
| Меланома | легкие, кожа/мышечные ткани, печень |
| Рак поджелудочной железы | печень, легкие, брюшина |
| Рак щитовидной железы | легкие, печень, кости, центральная нервная система |
Рис. 2. Костные метастазы у пациента с раком предстательной железы
Симптомы метастазов
Симптомы метастазов неспецифические, могут проявляться общими жалобами:
Также симптоматика зависит от локализации метастазов. Если они находятся в легких, то пациент испытывает боли в груди, возникает кашель и одышка. При наличии очагов поражения в печени возникают боли в животе, справа, кожный зуд, желтушность кожи и слизистых, чувство горечи во рту, асцит.
При появлении вторичных опухолевых образований в костях пациент испытывает постоянные сильные боли, которые не снимаются анальгетиками. При очагах поражения в головном мозге появляются сильные головные боли, рвота, судороги, наблюдается расстройство речи, зрения, памяти.
Метастазы в позвоночный столб, могут не проявляться в течение долгого времени. Затем появляется дискомфорт и боли в спине, но списывает все на остеохондроз и другие патологии опорно-двигательного аппарата.
В связи с этим важнейшее значение имеет ранняя диагностика и профилактика метастазирования.
Диагностика метастазов
Чтобы обнаружить регионарные метастазы пациенту могут быть назначены следующие обследования:
При помощи вышеперечисленных методик можно не только подтвердить наличие метастазов, но и оценить их размеры, количество, локализацию, определить характер роста, обнаружить распад. Данные методы диагностики используют и в профилактических целях, для обследования пациентов, которые успешно завершили курс лечения. Это позволяет своевременно обнаружить возможные рецидивы заболевания.
Методы лечения метастазов
Основными целями терапии при появлении метастазов являются:
Препараты вводятся через лимфу, артерии, вены, останавливают процесс метастазирования и уменьшают размер новообразований. К сожалению, полное выздоровление при таких запущенных формах рака наступает редко. Но в большинстве случаев химиотерапия улучшает общее состояние пациента и увеличивает продолжительность жизни.
Прогноз срока жизни при метастазах
Еще совсем недавно процесс метастазирования считался признаком скорой смерти больного. Но в последние годы, с появлением новых технологий, ситуация начинает постепенно меняться, хотя метастазирование злокачественных опухолей по-прежнему значительно ухудшает прогноз заболевания.
Использование новых методик лечения рака с метастазами позволяет увеличить срок жизни больного. При наличии показаний возможно радикальное удаление одиночных метастазов в определенных органах.
В целом прогноз выживаемости при метастазах зависит от локализации новообразования, его вида, стадии болезни и ряда других факторов.
Метастазирование злокачественных опухолей: враг, который всегда впереди
21 февраля 2022
Метастазирование злокачественных опухолей: враг, который всегда впереди
За любыми, казалось бы, сугубо клиническими моментами, такими как принятие решений врачами, их взаимодействие с пациентами, лежат фундаментальные исследования, которые плавно перетекают в практику. Только так можно прийти к прогрессу даже в лечении самых тяжелых заболеваний.
Автор
Редакторы
Статья на конкурс «Био/Мол/Текст»: В современном мире «рак» — это то слово, которое боятся услышать, о котором не хотят говорить, а узнав о таком диагнозе, нередко прощаются с жизнью. Эта болезнь ассоциируется с чем-то абсолютно обреченным. И, конечно, такую репутацию рак заработал не без основания. Эффективно лечить опухолевую патологию научились не так давно, да и не везде, но даже сейчас долгое лечение не приносит уверенности в том, что болезнь ушла навсегда.
Конкурс «Био/Мол/Текст»-2021/2022
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2021/2022.
Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.
Генеральный партнер конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Первоначально этот текст был опубликован в феврале 2021 года в HSO talks — сообществе для врачей-онкологов и студентов-медиков.
В чем же кроется корень зла? Почему опухоли бывает так сложно вылечить, а в развитых странах рак стремится стать первой причиной смерти? Ответ можно выразить лишь в одном слове — «метастазирование», которое означает распространение опухоли в отдаленные органы и ткани организма. Считается, что 90% смертей от рака связано именно с этим явлением. Давайте попробуем разобраться в механизмах этого смертоносного процесса и найдем точки приложения для возможной терапии.
Образование первичной опухоли
Все процессы в здоровом организме регулируются с удивительной точностью, в том числе и процессы размножения, роста и гибели клеток. Иногда в этой сложнейшей машине происходит сбой, который позволяет клеткам бесконтрольно расти, избегать апоптоза и иммунного надзора, что приводит к неограниченному увеличению их численности (рис. 1). Результатом такого сбоя является образование первичной опухоли — места «рождения» злокачественных клеток в организме.
В наглядной форме с процессом апоптоза можно ознакомиться в комиксе «Апоптоз, или Путь самурая» [1].
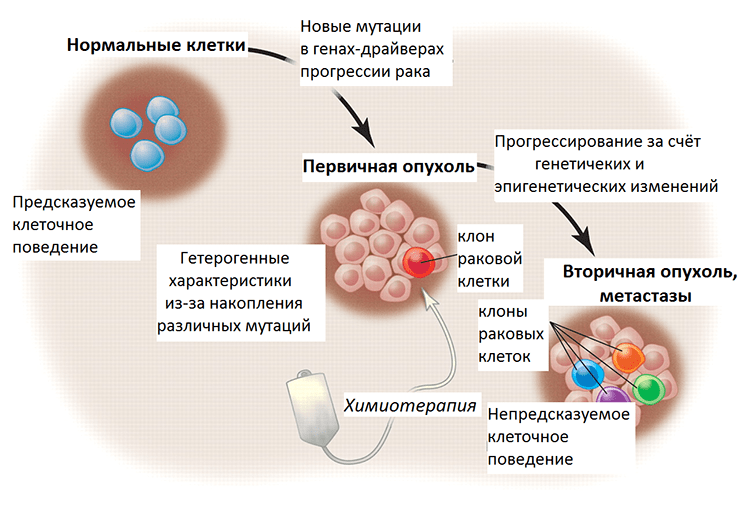
Рисунок 1. Образование первичной опухоли. В одной из нормальных клеток организма произошел сбой регуляции роста, размножения и/или гибели, что привело к образованию массы похожих клеток — опухолевого клона.
рисунок автора статьи
Такие вышедшие из-под контроля клетки довольно ограничены в своих желаниях. Все, что они хотят — это есть, размножаться и распространяться. Но не будем их упрекать за это: маленькие клеточки в масштабах, ограниченных человеческим организмом, всего лишь отражают суть существования всего живого на земле — выживание любыми путями.
После достижения определенного размера клеткам становится недостаточно питательных веществ, поступающих за счет диффузии из близлежащего сосуда. В попытке найти дополнительный источник питания они начинают выделять определенные факторы роста (рис. 2), что приводит к образованию новых кровеносных сосудов — ангиогенезу. В связи с быстро растущими потребностями опухолевой массы, ангиогенез протекает довольно интенсивно и быстро. Но в результате такой спешности образуются «дефектные» сосуды: они извилисты, избыточно разветвлены, негерметичны, а поток крови в них беспорядочный.
Рисунок 2. Ангиогенез. Опухолевые клетки выделяют факторы роста сосудов (например, VEGF — vascular endothelial growth factor, фактор роста эндотелия сосудов), чтобы обеспечить дополнительное поступление питательных веществ.
рисунок автора статьи
Метастазирование
Метастазирование — это далеко не простой процесс, тайны которого еще предстоит изучить огромному количеству ученых. Считается, что это многоступенчатый каскад из связанных между собой событий. В дальнейшем мы рассмотрим каждое такое событие в контексте детально изученных карцином — опухолей эпителиального происхождения (также такой подвид называют раком, однако в обиходе так ошибочно называют все злокачественные новообразования). Предполагается, что метастазирование злокачественных опухолей из соединительной и нервной ткани часто следует похожим принципам [7].
1) Эпителиально-мезенхимальный переход
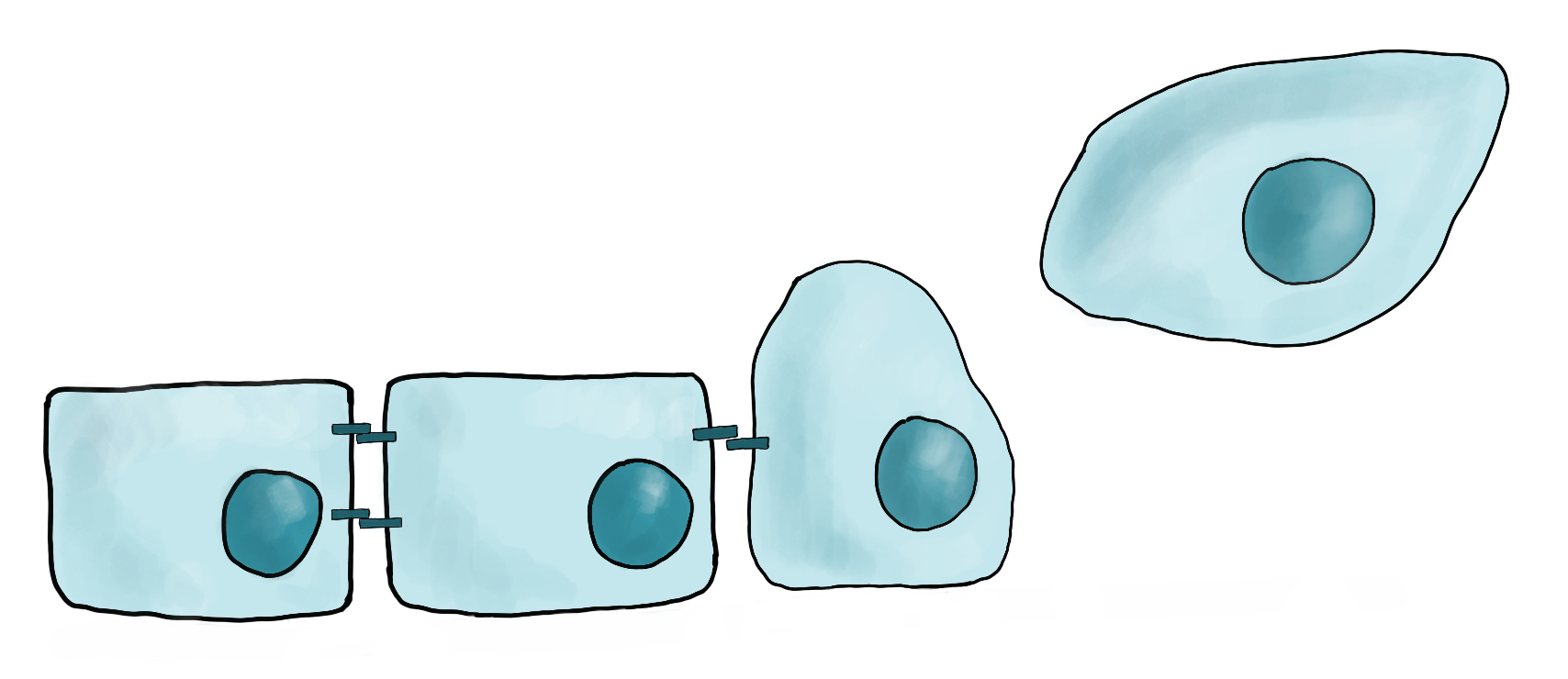
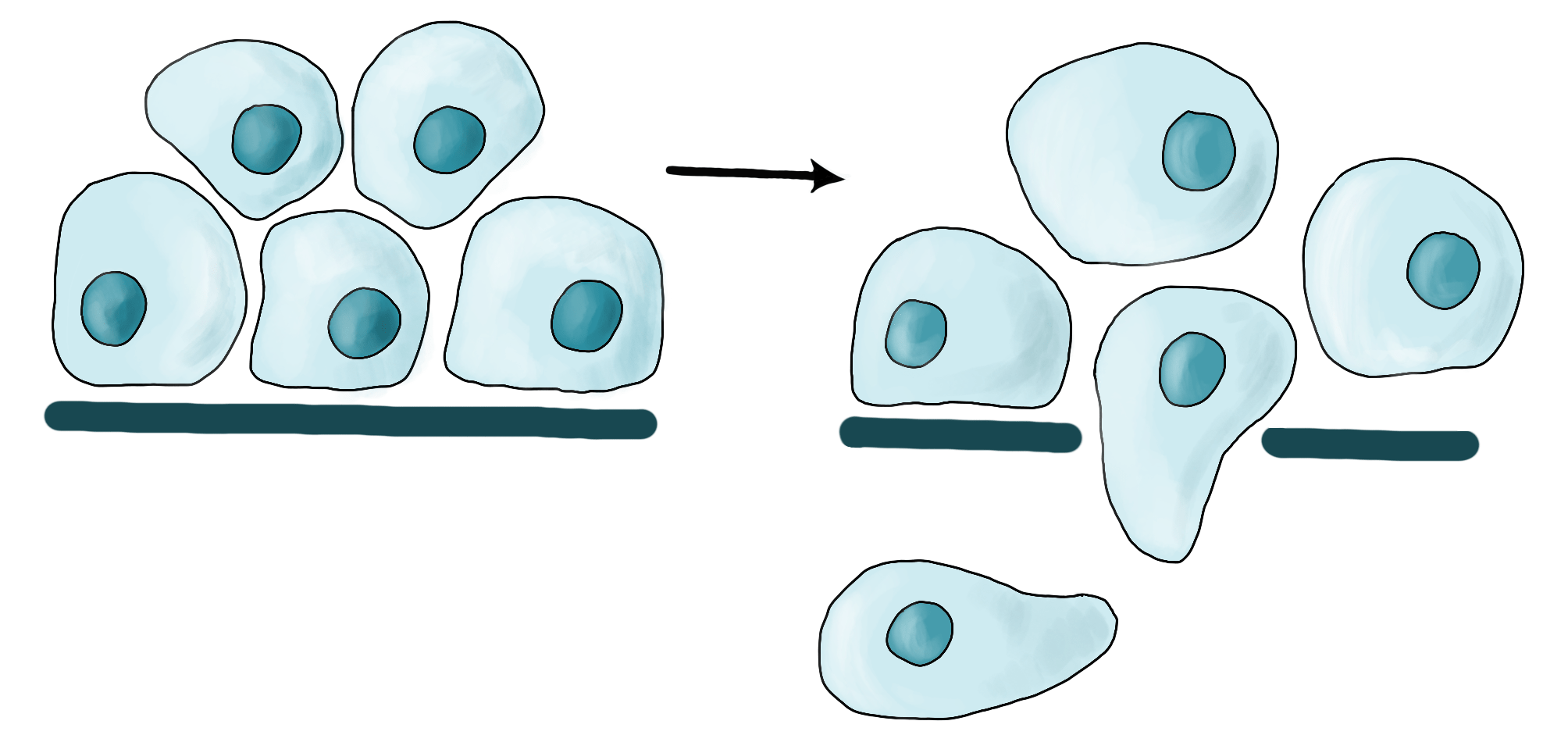
Итак, опухоль решила завоевать просторы человеческого организма. Однако перед ней встает немало проблем. Первая проблема состоит в том, что эпителиальные клетки предназначены для того, чтобы ограничивать различные пространства организма друг от друга. Поэтому они мало приспособлены к передвижению, зато всячески стараются держаться вместе и не двигаться. Для метастазирования такое поведение совершенно не подходит, поэтому опухолевые клетки претерпевают так называемый эпителиально-мезенхимальный_переход (ЭМП), то есть приобретают свойства мезенхимальных клеток:
При этом способность клеток делиться в этом состоянии сильно уменьшается.
Следует отметить, что как опухолевые клетки являются потомками нормальных клеток организма, так и эпителиально-мезенхимальный переход в норме не является для нашего организма патологическим. Так, например, он реализуется в эмбриогенезе и при заживлении ран.
Рисунок 3. Эпителиально-мезенхимальный переход. При эпителиально-мезенхимальном переходе опухолевые клетки теряют связи с соседними эпителиальными клетками и базальной мембраной, меняют форму, становясь более мобильными.
рисунок автора статьи
Существует два варианта распространения метастазов: в виде отдельных клеток и в виде опухолевых кластеров. Кластеры морфологически неоднородны: в их структуре можно найти клетки-лидеры с мезенхимальными свойствами, клетки с промежуточным фенотипом и клетки с эпителиальными свойствами. Для того, чтобы такие конгломераты не распадались, клетки в них продолжают экспрессировать белок E-кадгерин, который помогает поддерживать связь между отдельными клетками [7].
2) Инвазия
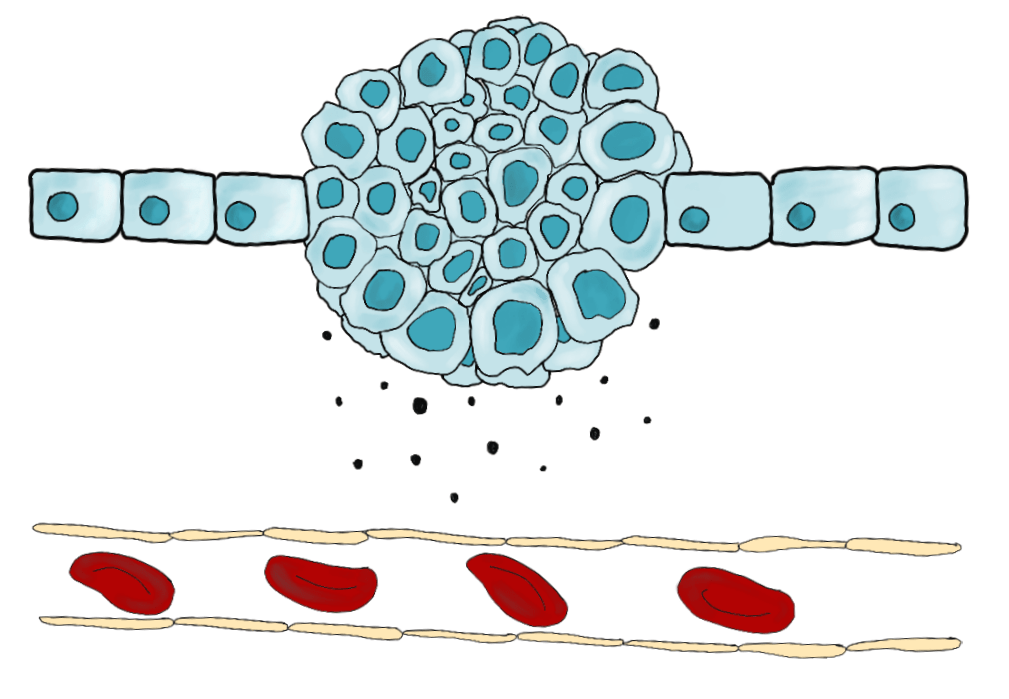
После эпителиально-мезенхимального перехода клетки опухоли приспособились к передвижению, но возникает новая проблема: на пути в системный кровоток расположен барьер в виде базальной мембраны, который отделяет эпителиальный слой от стромы. На такой случай клетки-лидеры в опухолевых кластерах и одиночные клетки имеют решение: в инвадоподиях (выростах плазматической мембраны клетки) выделяются различные протеолитические ферменты, разрушающие внеклеточный матрикс. Так образуются «дырки» для проникновения клеток через базальную мембрану (рис. 4). Данный процесс называется инвазией.
Фактически, только те опухоли, которые могут разрушать базальную мембрану и проникать в окружающие ткани, считаются злокачественными. Многие опухоли долгое время не выходят за пределы эпителиального слоя и не вызывают клинически выявляемых симптомов. Для таких вариантов существует специальный термин — рак in situ (буквально, рак «на месте»).
Рисунок 4. Инвазия. Опухолевые клетки (голубые) могут синтезировать ферменты, разрушающие базальную мембрану (темно-синяя), образуя «дырки», таким образом переходя из стадии рак in situ (слева) в инвазивную форму (справа).
рисунок автора статьи
3) Интравазация
Последним препятствием на пути в кровоток является стенка кровеносного сосуда. Интравазация, то есть проникновение в кровеносные сосуды, осуществляется посредством двух механизмов: активного и пассивного. В первом случае опухолевые клетки активно проходят через эндотелиальный слой, проникая в пространства между отдельными эндотелиоцитами и разрушая межклеточные контакты (рис. 5). Во втором случае опухолевые клетки просто «падают» в кровоток через дефекты вновь сформированных при ангиогенезе сосудов.
Рисунок 5. Интравазация. Опухолевая клетка (голубая) проникает между двумя эндотелиальными клетками (коричневые), чтобы попасть в кровоток.
рисунок автора статьи
Существует несколько путей распространения метастазов:
Далее будет обсуждаться гематогенный путь распространения, так как это, вероятно, основной путь метастазирования. Небольшие метастатические очаги, которые образуются в лимфатических узлах, представляют собой тупик для раковых клеток и функционируют скорее как важный клинический параметр распространения [7].
4) Выживание в системном кровотоке
Наконец, опухолевые клетки попадают на главную магистраль человеческого организма — в кровеносную систему. Здесь они меняют свой статус: теперь они носят название циркулирующих опухолевых клеток (ЦОК). Количество таких клеток в крови пациента потенциально является диагностическим и прогностическим маркером тяжести опухолевого процесса и уже сейчас оценивается в некоторых клиниках нашей страны [7].
Кровь не является дружелюбной средой: опухолевые клетки вынуждены преодолевать различные препятствия. Так, гидродинамическое давление стремится физически разорвать, а иммунный надзор (в лице натуральных киллеров) распознать и обезвредить опухолевые клетки. К тому же отсутствие прикрепления к субстрату может привести к особой форме апоптоза клетки — аноикису. Так же образование и поддержание опухоли сильно зависит от опухолевого микроокружения, которое теперь находится позади. Циркулирующие опухолевые клетки, подобно повзрослевшим детям, покидают привычную и комфортную, но неподходящую для развития среду, пробираясь через тернии к звездам. Но эта история не всегда имеет «счастливый» конец: большая часть клеток погибает в результате действия враждебных факторов.
Однако здесь происходит в определенном роде «предательство» со стороны нашего организма: некоторые клетки начинают всячески поддерживать распространение опухолевых клеток!
Например, тромбоциты, не опознав врага, «обволакивают» ЦОК вскоре после попадания в кровоток, обеспечивая им иммунную и физическую защиту (рис. 6). Тромбоциты выделяют различные факторы, которые подавляют активность натуральных киллеров — основных эффекторов противоопухолевого иммунитета. Кроме того, они физически экранируют опухолевые клетки путем образования защитных оболочек и активации отложения фибрина. Что еще более интересно, тромбоциты активируют внутриклеточные сигнальные пути в ЦОК, что в конечном итоге влияет на их способность вызывать рост метастазов [7].
Рисунок 6. Взаимодействие опухолевой клетки с тромбоцитами. Защитная оболочка циркулирующей опухолевой клетки из тромбоцитов (зеленые частицы) и фибрина (темно-зеленые линии).
рисунок автора статьи
Нейтрофилы защищают ЦОК от действия натуральных киллеров, а также помогают экстравазации — выходу из кровеносного русла. Нейтрофилы формируют внеклеточные ловушки, которые образуются из деспирализованных молекул ДНК. Они предназначены для «ловли» патогенов в ходе иммунного ответа на инфекцию, но также могут быть использованы нейтрофилами для захвата опухолевых клеток в сосудистом русле. Таким «попавшим в ловушку» клеткам легче выживать в просвете сосуда, а также прилипать к эндотелиальным клеткам и выходить за пределы капилляра (рис. 7) [7].
Рисунок 7. Взаимодействие опухолевой клетки с нейтрофилом. Внеклеточная деспирализованная ДНК нейтрофила (фиолетовый) «поймала» циркулирующую опухолевую клетку (голубая), покрытую тромбоцитами (зеленые).
рисунок автора статьи
5) Остановка и экстравазация
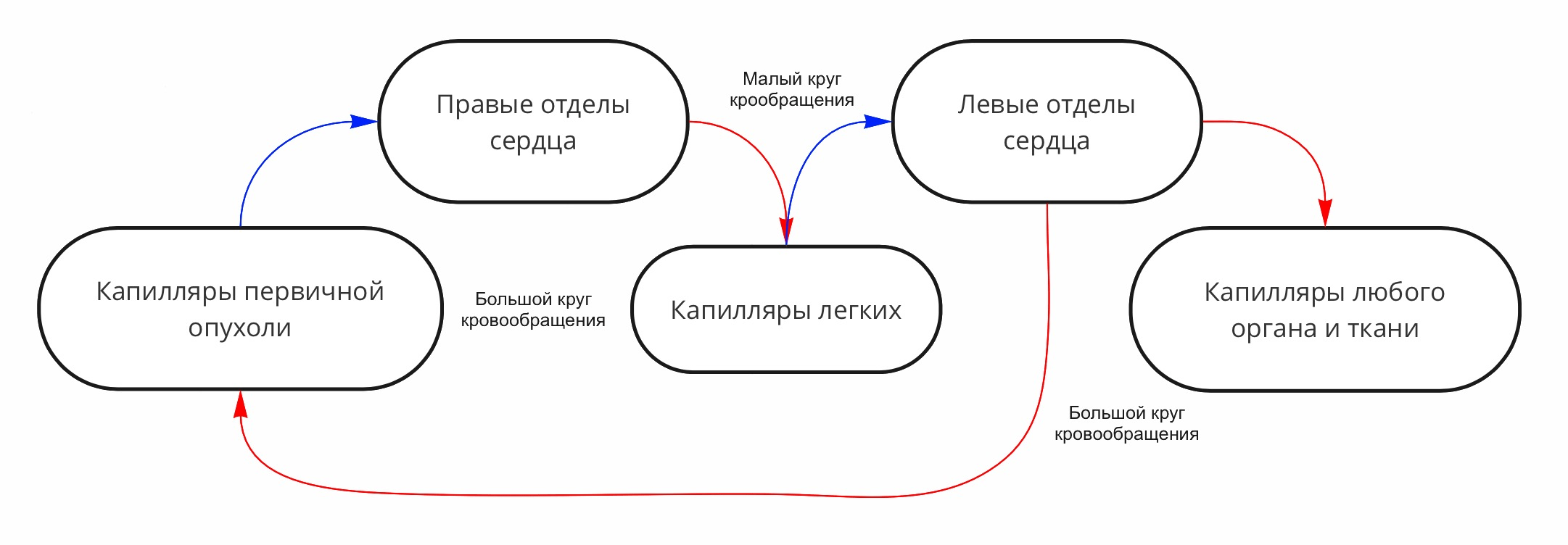
Теперь давайте проследим путь распространения циркулирующих опухолевых клеток (ЦОК). Попав в капилляры, они направляются в более крупные венозные сосуды, затем в правый желудочек и в малый круг кровообращения. Здесь они могут с большой вероятностью остановиться в капиллярах легкого, так как диаметр кластеров ЦОК значительно больше, да и деформируются они не так хорошо, как клетки крови. Однако часто они проходят через капилляры легкого и попадают в артериальную систему, чем обеспечивают себе доступ ко всем тканям организма (рис. 8). Как они это делают, остается не совсем понятным. Есть предположения, что ЦОК формируют цепочки диаметром в одну клетку, сбрасывают часть своей цитоплазмы, уменьшая объем клетки, проходят через артерио-венозные шунты [8]. Вы уже, конечно, поняли, что опухолевые клетки всегда найдут способ решить проблему!
Рисунок 8. Схема миграции циркулирующих опухолевых клеток. По венозным сосудам (синие стрелки) опухолевые клетки/кластеры попадают в правые отделы сердца, затем по артериям (красные стрелки) малого круга кровообращения — в капилляры легких. Дальше они могут либо остановиться, образуя легочные метастазы, либо пройти дальше в вены малого круга, а затем в левые отделы сердца. Оттуда они попадают в артериальную систему большого круга кровообращения, откуда имеют доступ ко всем органам и тканям, потенциально имея возможность образовать метастазы во всех локализациях. Если выйти из кровеносного русла в других тканях у ЦОК не получается, они могут вернуться на место образования первичной опухоли.
рисунок автора статьи
Итак, артериальная система разносит ЦОК по всем органам человека. Остается только найти желаемое пристанище и выйти из кровеносной системы. Но как это сделать?
Взаимодействия ЦОК в кровеносном русле с клетками крови создают предпосылки для последующей остановки и экстравазации. Экстравазация сопровождается процессом, который называется трансэндотелиальной миграцией. Трансэндотелиальная миграция может осуществляться разными путями:
В основном, все модели экстравазации рассматриваются на капиллярах легких. Но так как капилляры в разных органах имеют разное строение, то и процесс выхода из кровеносного русла в разных органах будет иметь специфические признаки. Например, синусоидные капилляры печени позволяют пассивный выход в паренхиму органа и не требуют использования сложных приспособлений. А в головном мозге клеткам необходимо преодолеть гематоэнцефалический барьер, поэтому может потребоваться специфическая программа по экстравазации [7].
6) Состояние покоя
Казалось бы, дело за малым: опухолевые клетки добрались до стромы отдаленных органов, остается только начать пролиферировать. Но клетки (теперь они называются диссеминированными опухолевыми клетками, ДОК) попадают в новую микросреду, которая лишена привычных стромальных клеток, факторов роста и компонентов внеклеточного матрикса, а иногда содержит антипролиферативные факторы. В связи с невозможностью адаптироваться к новой среде, клетки переходят в состояние покоя (рис. 9). Иногда они все-таки не очень интенсивно, но делятся, однако часть клеток погибает под действием враждебных факторов, что, в конечном итоге, не приводит к увеличению численности клеток. Такие небольшие, клинически не проявляющие себя очаги называют микрометастатическими очагами [7].
Рисунок 9. Дремлющая опухолевая клетка. Опухолевые клетки, находящиеся в состоянии покоя, часто располагаются около сосудов (т.е. занимают периваскулярную нишу). Почему так происходит, до конца неясно.
рисунок автора статьи
Пациенты, которые успешно излечились от первичных опухолей и находятся в ремиссии, но имеют такие дремлющие опухолевые клетки, имеют бессимптомное минимальное остаточное заболевание. Этот период покоя может продолжаться в течение многих лет, а иногда и десятилетий. Важно понимать, что уничтожить такие очаги практически невозможно: стандартная химио- и лучевая терапия действуют только на активно делящиеся клетки, поэтому дополнительные циклы терапии принесут массу побочных эффектов, а на микрометастатические очаги все равно никак не подействуют.
7) Вторичный опухолевый рост
Таким образом, полноценная, клинически выявляемая метастатическая колония может быть сформирована как сразу после экстравазации, так и после выхода микрометастатических колоний из состояния покоя. Выход из состояния покоя может быть спровоцирован изменениями в окружающей микросреде. Например, при воспалении или ангиогенезе, когда увеличивается уровень ростовых факторов.
Замечено то, что метастазы повторяют ключевые особенности первичной опухоли, среди них и эпителиальные свойства. Но как быть с тем фактом, что опухолевые клетки претерпели эпителиально-мезенхимальный переход и приобрели свойства мезенхимальных клеток? Многочисленные исследования предполагают наличие процесса, обратного ЭМП — мезенхимально-эпителиального перехода (МЭП) [7].
Интересный вопрос: почему определенные виды опухоли имеют характерные сайты метастазирования? Так, например, рак предстательной железы часто метастазирует в кости, а рак желудка — в печень. Английским хирург Стивен Педжет предложил теорию «семян и почвы», которая предполагает, что определенные типы опухолевых клеток (семена) имеют предрасположенность к метастазированию в определенные локализации организма (почву). Связано это с тем, что более предпочтительная «почва» требует более простых механизмов адаптации. Поэтому и определенные виды рака имеют более характерные сайты метастазирования. Но не нужно забывать, что иногда имеет значение строение местной системы кровообращения. Например, метастазирование при колоректальном раке в печень более предпочтительно просто потому, что портальная вена, дренирующая кишечник, направляет всю кровь через печень [7].
Почему метастазы так опасны?
Новообразованные метастатические колонии являются наиболее опасным проявлением опухолевого процесса, нанося большой ущерб организму. Например, распространение рака молочной железы (РМЖ) в пределах молочной железы не несет угрозу для жизни. Однако метастатические колонии РМЖ в костях могут приводить к разрушению костной ткани, вызывая патологические переломы и мучительную боль. Метастазы в головном мозге могут значительно нарушать функцию центральной нервной системы, тогда как метастазы в легких и печени угрожают жизни в связи с нарушением функций этих жизненно важных органов.
Как еще могут навредить метастазы:
Также агрессивное лечение метастатической болезни может привести к смертельным побочным эффектам. До сих пор метастатическая болезнь — это практически приговор для пациента.
Как могут помочь знания биологических основ метастазирования в клинической практике?
Понимание процессов, лежащих в основе формирования метастазов, критически важно для разработки эффективного лечения рака. Разберем по порядку, какие точки приложения уже используются и могут быть использованы в перспективе:
1) Ангиогенез.
2) Инвазия, интравазация и экстравазация.
Заблокировав образование инвадоподий, можно ограничить такие процессы, как инвазия, интравазация и экстравазация. Ингибиторы тирозинкиназы BCR-ABL GNF-5, а также используемые в клинической практике иматиниб и нилотиниб могут тормозить образование предшественников инвадоподий [10]. Это блокирует полимеризацию актина, который является структурным элементом микрофиламентов. Без них образование инвадоподий невозможно.
3) Взаимодействие с ЦОК
Возможно, вы слышали о таком интересном подходе к лечению заболеваний, как тераностика. Суть этого подхода заключается в создании фармацевтических композиций, которые являются одновременно и средством диагностики, и терапевтическим агентом.
Про онколитические вирусы можно узнать больше в статье «Вирусы против рака» [12].
4) Взаимодействие с тромбоцитами.
Использование антитромбоцитарных препаратов может быть затруднено тем, что на фоне лучевой или химиотерапии зачастую возникает тромбоцитопения (уменьшение количества тромбоцитов ниже нормальных значений). Таким образом, мы можем еще больше увеличить риск кровотечений. Поэтому такие препараты назначаются с большой осторожностью.
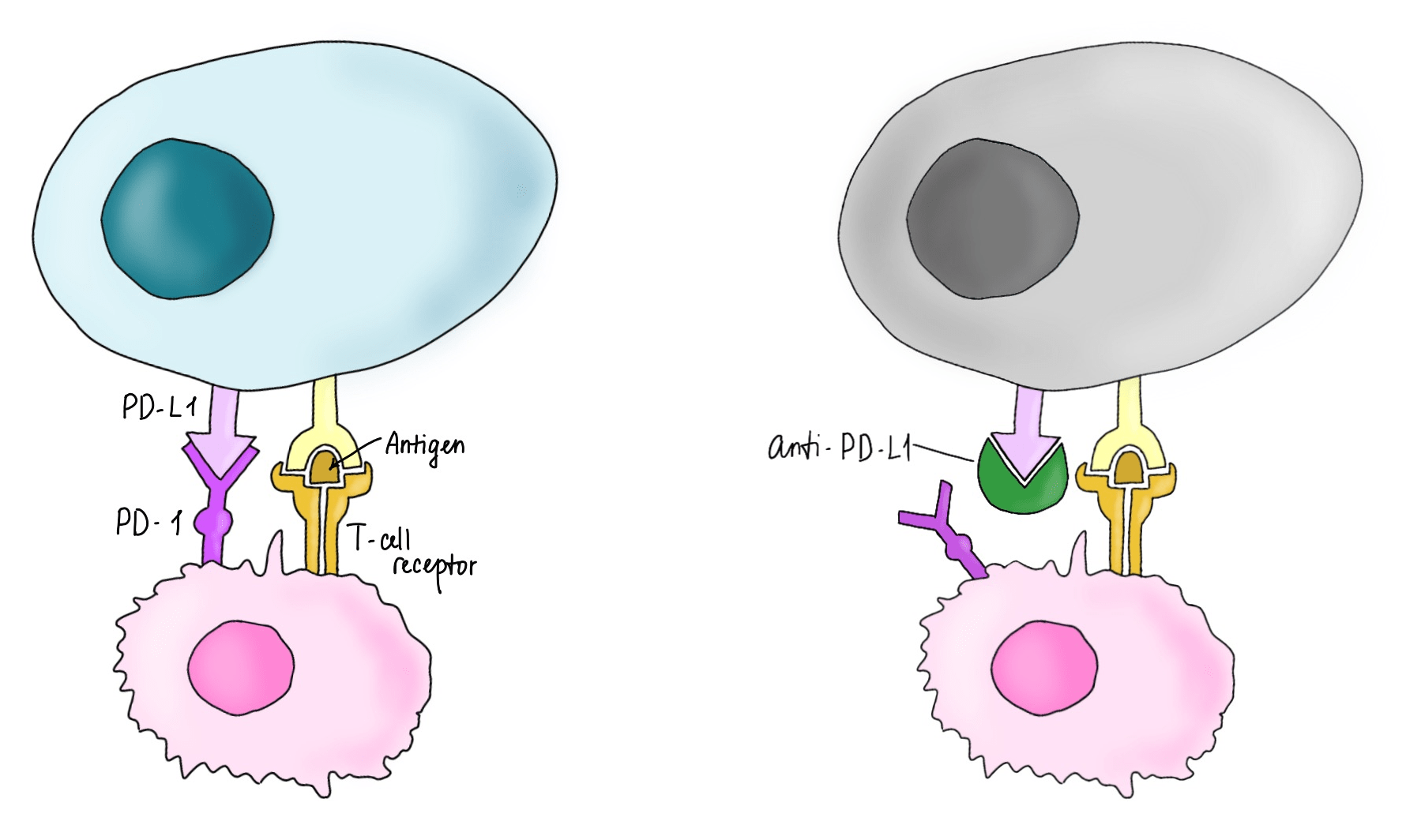
Даже если мы не можем действовать против тромбоцитов, можно заставить их работать на нас. Так была предложена методика доставки противоопухолевых препаратов на мембранах тромбоцитов. Например, мы можем доставить ингибиторы контрольных точек. Иммунные контрольные точки — это такие регуляторные молекулы, которые находятся на Т-клетках и необходимы для защиты здоровых клеток организма от атаки собственной иммунной системой организма [14]. Опухолевые клетки используют этот механизм для избегания иммунного ответа (рис. 10). На животных моделях было показано, что доставка ингибиторов контрольных точек на мембранах тромбоцитов более эффективна, чем стандартная терапия данными препаратами.
Рисунок 10. Взаимодействие опухолевой клетки с Т-клеткой.
Слева: опухолевая клетка (голубая) экспрессирует PD-L1 (programmed death-ligand 1), который связывается с молекулой PD-1 (programmed cell death protein 1) на T-клетке (розовая), что блокирует иммунный ответ против этой клетки.
Справа: ингибитор PD-L1 блокировал данное звено патогенеза, вызвав гибель опухолевой клетки.
рисунок автора статьи
5) Действие на диссеминированные опухолевые клетки (ДОК).
Как мы выяснили раньше, ДОК — это диссеминированные опухолевые клетки, которые зачастую переходят в состояние покоя. Как можно повлиять на такие покоящиеся клетки:
Однако, как это можно сделать, не совсем понятно.
К чему мы пришли?
Метастазирование — сложный, пока что малоизученный процесс, в котором остается много непонятного. Но несмотря на такую таинственность, начинает проявляться ряд общих принципов:
Знание биологических основ метастазирования необходимо для разработки эффективных методов лечения метастатического процесса. Некоторые из возможных точек приложения уже активно используются, однако большинство из перечисленных методик являются экспериментальными и на данный момент практического применения, к сожалению, не имеют. Будем надеяться, что ученые рано или поздно найдут ту самую уникальную особенность метастатических клеток, которая позволит улучшить прогноз онкологических пациентов — вплоть до их полного выздоровления.
Во власти опухоли: почему метастазы так сложно остановить?
Метастазы в цельном мозге мыши, обработанном по специальной методике. Красный — MDA-231-D клетки, экспрессирующие mCherry; зеленый — сосуды, помеченные антителами к α-SMA, альфа-актинам гладких мышц [1].
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Когда в организме случилось несчастье, и из 100 триллионов нормальных клеток хоть одна переродилась в раковую и не была уничтожена, срабатывает спусковой крючок, и запускается рост опухоли. Постепенно она приспосабливает к себе окружающие клетки, а также оказывает значительное влияние на весь организм. С развитием заболевания некоторые раковые клетки покидают опухоль и формируют метастазы — вторичные очаги опухолевого роста. Зачастую своевременное удаление первичной опухоли и послеоперационная терапия не способны вызвать ремиссию. Оказывается, что первичная опухоль способна «обучать» микроокружение в очагах развития будущих метастазов уже на ранних этапах своего роста. Кроме того, метастазные раковые клетки перепрограммируют экспрессию своих генов так, чтобы лучше прижиться в новом месте обитания. Знание того, как предотвратить эти процессы, а не только рост первичной опухоли, поможет спасти до 90% людей, умирающих от основных видов рака.
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2017.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».
Революция в понимании природы метастазирования
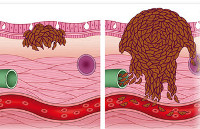
Усилия многих онкологов на протяжении последних десятилетий были направлены на установление деталей возникновения и развития рака — механизмов зарождения опухоли и регуляции ее активного роста, формирования благоприятного микроокружения из клеток стромы [2]. Эти знания несомненно привели к разработке новых подходов в терапии онкозаболеваний. Со временем стало понятно, что основная угроза рака заключена в способности к распространению по организму. Так, некоторые раковые клетки первичной опухоли (то есть развившейся изначально) отделяются от нее за счет эпителиально-мезенхимального перехода или других механизмов [3] и, попадая в кровоток или лимфоток, по маленьким капиллярам путешествуют в главные магистрали сосудистой системы. Они покидают ее за счет задержки в узких капиллярах органов, адгезии к их эндотелиальной стенке и выхода из просвета сосуда в строму органа (рис. 1). Лишь небольшой процент раковых клеток, покинувших первичную опухоль, преуспевает в этом процессе и выживает в новой среде. Эти клетки формируют будущие очаги роста опухоли в новых органах — метастазы.
Рисунок 1. Метастазирование и пути рассеивания раковых клеток.
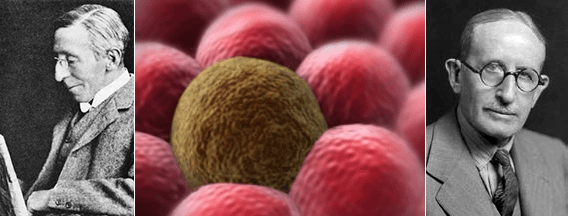
Процесс рассеивания раковых клеток по организму, названный метастазированием (от древнегреч. «менять, переносить»: meta — «через» + histanai — «устанавливать»), впервые описал еще в 1889 году Стивен Педжет [4], но механизм его развития оставался загадкой для ученого сообщества долгое время (рис. 2).
Рисунок 2. Основоположники учений о метастазировании: английский хирург Стивен Педжет (слева) и американский патолог Джеймс Юинг (справа).
Педжет провел аналогию такого распространения раковых клеток с прорастанием семян. Они тоже выживают и делятся на плодотворной «почве» — в подходящем микроокружении. В те времена невозможно было найти этому экспериментального подтверждения, и долго преобладала совсем иная теория — Джеймса Юинга (рис. 2). Он утверждал, что основную роль в распределении метастазов по организму играет динамика кровотока и устройство сосудистой системы.
Наконец в 1970-е годы в ходе нескольких экспериментов по инъекции радиоактивно меченных раковых клеток мышам Исаак Фидлер смог доказать, что результат метастазирования также зависит от природы раковых клеток. В этом случае клетки меланомы развивали метастазы только в легких, но не в печени, в сосудах которой они также задерживались, но позже не выживали [5].
Позднее было установлено еще больше фактов, подтверждающих, что раковые клетки разной природы метастазируют преимущественно в определенные органы и иногда даже в заданной последовательности. Например, клетки рака молочной железы — сначала в кости, печень, лимфатические узлы, легкие, а потом уже в мозг; клетки рака желудочно-кишечного тракта и яичников — в печень и легкие; рака простаты — в основном, в кости (рис. 1). Явление специфичного распределения метастазов по организму назвали органотропией метастазирования. Чаще всего метастазы встречаются в легких, печени и костях.
Несмотря на активные исследования, в онкологии все еще остается много вопросов без ответа. Отличаются ли метастазные раковые клетки от других клеток первичной опухоли? Что лежит в основе органотропии? Как метастазам удается выжить после удаления первичной опухоли и проведенной химиотерапии?
Генетическая и эпигенетическая гетерогенность при метастазировании
Генетическая информация лежит в основе программирования поведения клетки. Перерождение нормальных клеток организма в раковые (злокачественная трансформация) обусловлено мутациями в генах-драйверах, которые приводят к неконтролируемому клеточному делению. Помимо таких выгодных для опухолевых клеток мутаций, также происходят мутации в генах-пассажирах, то есть тех, что изначально не имеют влияния на рост опухоли. С каждым поколением, новым клоном внутри опухоли, накапливаются эти генетические изменения, и некоторые клоны преуспевают больше остальных, что стало основой для формирования представления об эволюции внутри опухоли. Одна из предложенных гипотез, почему некоторые клетки опухоли приобретают способность к метастазированию, основана на схожем со злокачественной трансформацией принципе. По всей видимости, у них тоже накапливаются мутации в генах-драйверах, которые запускают этот процесс. Однако экспериментального подтверждения она так и не нашла, ученые сходятся во мнении, что большинство клеток первичной опухоли способны метастазировать. А вот что происходит позже с геномами метастазных клеток?
В результате сравнения геномов клеток первичных опухолей молочных желез и их локальных (в ближайших лимфатических узлах) и отдаленных метастазов (в печени, легких, дальних лимфатических узлах) было установлено, что геномы метастазов продолжают эволюционировать в своих очагах роста независимо от первичной опухоли [6]. Интересно, что паттерн мутаций схож между метастазами в одном органе, но различен между метастазами в разных органах. Это означает, что раковые клетки на самом глубоком уровне адаптируются к новому микроокружению в зависимости от занятой ими ниши. Изучение генетических изменений при метастазировании рака поджелудочной железы выявило наличие разных субклонов (новых поколений клона), которые формируют метастазы. Однако различия между ними оказались не больше, чем между двумя случайно взятыми клетками одного организма [7].
Интересно, что обнаружили как минимум один ген, FBXW7, мутации в котором противодействуют метастазированию [8]. Происходит это за счет усиления провоспалительной реакции, пролиферации и активности T-лимфоцитов, которые стимулируют формирование адаптивного иммунитета к опухолевым клеткам. Таким образом, мутации в гене FBXW7 противодействуют опухолевой иммунносупрессии. Ее проявления, такие как уменьшение количества лимфатических сосудов и эффекторных T-лимфоцитов в первичной опухоли, связаны с лицензированием метастазирования [8].
Следующую ступень в регуляции экспрессии генов после непосредственных изменений в ДНК (мутаций, вариаций числа копий и т.д.) занимают эпигенетические изменения (метилирование гистонов, ДНК и др.) (рис. 3). По своей природе они более пластичны, более переменчивы по сравнению с генетическими изменениями и подвластны влиянию клеточной сигнализации, которая подстраивается под воздействие внешних факторов. Оказалось, что эпигенетический код значительно отличается в клетках метастазов по сравнению с первичной опухолью. При раке поджелудочной железы потеря большого количества меток неактивного хроматина (гетерохроматина) — метилирования гистонов (H3K9, H4K20) — и ослабление метилирования ДНК связаны с метастазированием. Эти модификации в раковых клетках переводят участки гетерохроматина в активное состояние, доступное для транскрипционных факторов, и в результате усиливают экспрессию генов онкогенеза, таких как регуляторы мезенхимального фенотипа, KRAS-сигнализации и метаболизма [9].
Рисунок 3. Злокачественная трансформация и прогрессирование рака в перспективе генетических и эпигенетических изменений. Нормальные клетки ткани имеют предсказуемое поведение — темпы пролиферации, срок жизни, характер взаимодействия с другими клетками. При злокачественной трансформации накапливаются мутации, и постепенно опухоль становится генетически гетерогенной (состоит из нескольких клонов, поколений раковых клеток). Химиотерапия уничтожает некоторые клоны, тогда как другие, с выгодными в новых условиях мутациями, выживают и создают новых клонов. Их поведение уже непредсказуемо, так как генетические и эпигенетические изменения этих раковых клеток привели к приобретению ими новых свойств.
Метаболическая пластичность при метастазировании
Эпигенетическая регуляция является одним из важнейших механизмов программирования клеточного метаболизма. С ростом опухоли внутри нее образуются области с недостаточным снабжением кислородом (гипоксией), так как до них не доходят кровеносные сосуды. Это вызывает в раковых клетках активацию гена фактора, индуцируемого гипоксией (HIF-1α). Происходит это за счет эпигенетического освобождения, деметилирования промотора гена, который становится доступным для транскрипционных факторов. Усиленное образование и активность белка HIF-1α, в свою очередь, регулирует экспрессию генов множества метаболических ферментов и транспортеров, что приводит к комплексным изменениям метаболизма раковых клеток и поддерживает их потребности.
Клеточный метаболизм разделен на процессы расщепления с выделением энергии (катаболизм) и образования соединений с использованием энергии (анаболизм). Энергетический обмен клетки протекает за счет этапов клеточного дыхания — гликолиза, цикла трикарбоновых кислот и окислительного фосфорилирования. Раковые клетки по-своему приспосабливаются к сохранению продуктивности энергетического обмена в условиях недостатка кислорода. В первичной опухоли они, в основном, используют анаэробный гликолиз, а не окислительное фосфорилирование, как в нормальных клетках. Это усиленное поглощение глюкозы с преобразованием до лактата, выделяемого раковыми клетками, названо эффектом Варбурга. Он позволяет им выжить при гипоксии и активно пролиферировать за счет использования промежуточных соединений для биосинтеза и выделения энергии [10].
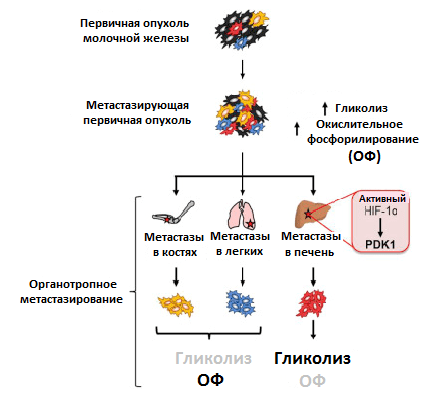
Преимущественный способ генерирования энергии у метастазов, однако, до сих пор мало изучен. Используя клетки рака молочной железы, обладающие широкой или специфической органотропией при метастазировании, ученые обнаружили различия в метаболизме первичной опухоли и метастазов. Раковые клетки, колонизировавшие кости и легкие, активировали использование окислительного фосфорилирования, колонизировавшие печень — гликолиз. Когда раковые клетки колонизировали все вышеперечисленные очаги, они активировали сразу оба метаболических пути (рис. 4) [11]. Похоже, что такая пластичность помогает раковым клеткам освоить новые ниши для колонизации. Например, в печени гликолитический фенотип поддерживается при росте метастазов за счет активности упомянутого ранее фактора HIF-1α, а также повышенной экспрессии белка PDK1. Это фермент, который ингибирует формирование соединения ацетил-КоА. И так как его поток на развилке с гликолитическим путем в цикл трикарбоновых кислот уменьшается, усиливается образование конечного продукта гликолиза — лактата [12].
Рисунок 4. Различия в метаболизме первичной опухоли и метастазов в разных органах. Условные обозначения: ОФ — окислительное фосфорилирование; HIF-1α — индуцируемый гипоксией фактор 1; PDK1 — пируватдегидрогеназный комплекс 1.
Почему же для метастазов в одном органе выгоднее использовать преимущественно один вид метаболизма, чем другой? Ответ на этот вопрос и роль различных факторов в регуляции метаболической пластичности раковых клеток еще только предстоит узнать.
Понятие о преметастазных нишах
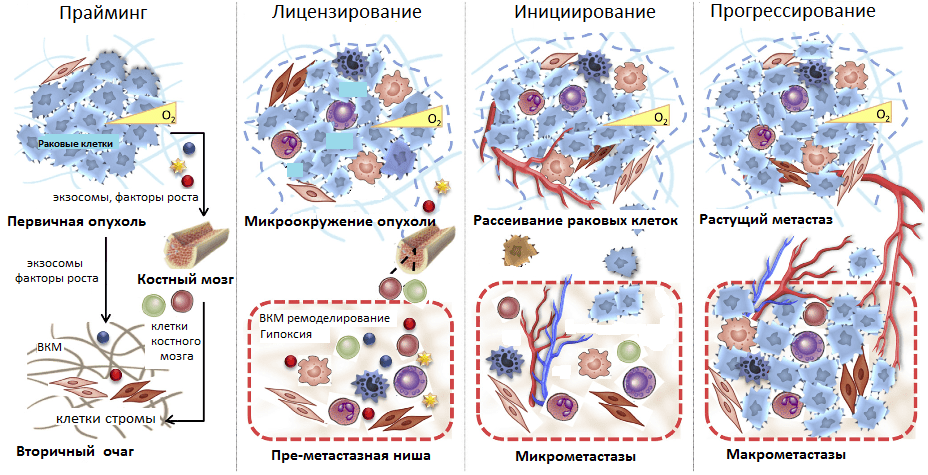
И все же метастазные раковые клетки не могут в одиночку справиться со столь непростой задачей — освоением совершенно незнакомого места обитания. Эксперименты группы Дэвида Лидена в 2005 году впервые показали, что первичная опухоль за счет продуцируемых факторов стимулирует формирование так называемых преметастазных ниш в различных органах. Ученые показали, что раковые клетки первичной опухоли за счет стимулирования рецептора фактора роста сосудов (VEGFR-1) на миелоидных клетках-предшественниках активируют их распространение из костного мозга в известные очаги развития метастазов [13]. Кроме того, в этих очагах запускается избыточная экспрессия фибробластами одного из компонентов внеклеточного матрикса (ВКМ) — фибронектина. Миелоидные клетки-предшественники, имея рецепторы клеточной адгезии (интегрины) к этому белку, активно «ловятся на удочку» и заселяют преметастазные ниши. Они секретируют воспалительные цитокины, факторы роста и проангиогенные факторы, стимулирующие формирование сосудов. Это способствует ремоделированию стромы и колонизации ее метастазами (рис. 5) [13].
Рисунок 5. Стадии развития метастазов. Прайминг, или обучение, будущего вторичного очага роста первичной опухолью; лицензирование — иммуносупрессия первичной опухоли, создание благоприятного микроокружения в преметастазных нишах; инициирование — начало метастазирования и освоения преметастазной ниши; прогрессирование — рост метастазов во вторичном очаге.
Таким образом, в текущем представлении формирование метастазов происходит в несколько стадий. Начиная с раннего роста первичной опухоли происходит прайминг — обучение будущих ниш развития метастазов с помощью выделения различных факторов раковыми клетками, привлечения клеток из костного мозга. Затем клетки стромы первичной опухоли и преметастазных ниш (фибробласты, клетки миелоидного ряда, T-лимфоциты) формируют благоприятное микроокружение, лицензируя дальнейшее расселение метастазов. Фаза инициирования метастазирования заключается в росте сосудов, ангиогенезе, по которым метастазные клетки покидают первичную опухоль и приходят в преметастазные ниши. Прогрессирование — это финальный этап перехода микрометастазов в макрометастазы — вторичные сформированные опухоли. Он может занять от нескольких месяцев до нескольких лет (рис. 5).
Гетерогенность в механизмах формирования преметастазных ниш
Хотя для большинства органов характерна эта общая схема, существуют некоторые особенности в зависимости от места (органа) формирования ниши. Например, преметастазная ниша в печени и легких также формируется за счет привлечения нейтрофилов. Известно, что они могут помогать метастазирующим клеткам при интеграции в новую нишу за счет секретирования протеаз, цитокинов и непосредственного контакта с раковыми клетками при выходе из капилляров. Другой пример — клетки рака поджелудочной железы. Они выделяют экзосомы — липидные везикулы, которые переносят макрофаг-ингибирующий фактор (MIF). Их поглощают клетки Купфера в печени, и это запускает цепочку обучения ниши. Клетки Купфера синтезируют трансформирующий фактор роста β (TGF-β), клетки Ито активируются им и запускают перестраивание ВКМ, затем привлекая к нему макрофагов [15]. Их роль в микроокружении опухоли подробнее рассмотрена в статье «Одураченные макрофаги, или несколько слов о том, как злокачественные опухоли обманывают иммунитет» [16].
Метастазы в костях — одни из самых коварных, и их преметастазная ниша по-своему особенна. Например, оказалось, что при раке молочной железы только раковые клетки без рецепторов к эстрогену метастазируют в кости. Такие клетки первичной опухоли активно выделяют фермент лизилоксидазу. В костях он вызывает образование взрослых остеокластов и за счет этого стимулирует резорбцию кости. [17]. Именно эти «емкости» внутри кости метастазы занимают позднее. Другая и, пожалуй, основная функция лизилоксидазы — формирование поперечных связей между коллагеновыми волокнами ВКМ — также связана с образованием преметастазных ниш, но в легких. Преобразование коллагеновых волокон привлекает миелоидные клетки, а те позднее разрушают коллагеновые сети и дают путь раковым клеткам при заселении ткани легкого [18].
При некоторых типах рака, таких как меланома, для успешного метастазирования в лимфатические узлы и органы необходимо формирование новых лимфатических сосудов в их преметастазной нише. Недавно ученые установили, что такой лимфангиогенез начинается на ранних стадиях роста первичной опухоли, и медиатором его запуска является фактор роста мидкин, секретируемый клетками меланомы в составе экзосом или в свободном виде [19].
Безусловно, механизмы формирования преметастазных ниш в комплексе позволяют лучше понять развитие рака и не перестают удивлять своей сложностью.
Причины органотропии
Описанные различия в специфичных механизмах формирования ниш могут служить одним из объяснений органотропному метастазированию, но как раковые клетки, которые могут метастазировать сразу в несколько органов, выбирают только один из них?
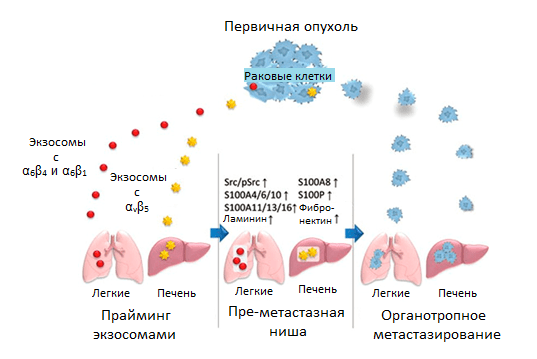
Ключевой механизм, известный на данный момент, основан на обучении будущих очагов рассеивания метастазов с помощью специфичных к ним экзосом. Эти везикулы, ранее описанные в статье «Экзосома — механизм координации и взаимопомощи клеток организма» [20], представляют собой структуры с рецепторами на своей поверхности и генетическим и секретируемым материалом внутри. Ученые провели интересный эксперимент — выделили экзосомы от раковых клеток разного происхождения (рака груди, поджелудочной железы и пр.) и, внедрив их в кровоток мышей с отличным типом опухоли, показали, что с их помощью возможно перепрограммировать распределение метастазов по органам. Это обусловлено тем, что экзосомы разных типов рака преимущественно содержат на своей поверхности основные рецепторы адгезии, интегрины, специфичные к определенному белку ВКМ (к ламинину — α6β4 и α6β1; к фибронектину — αvβ5 и т.д.).
Именно они адресуют доставку экзосом в определенный орган, который преимущественно имеет этот специфический ВКМ-белок в составе стромы. Сливаясь с мембранами клеток стромы того или иного органа, экзосомы доставляют содержимое и запускают свою программу: в фибробластах легких — через экспрессию одних генов S100, в клетках Купфера в печени — через экспрессию других. Активность этих генов стимулирует клеточную сигнализацию и воспалительные реакции, которые занимаются обучением преметастазной ниши (рис. 6) [21].
Рисунок 6. Регуляция органотропного метастазирования с помощью прайминга преметастазной ниши экзосомами со специфическими рецепторами интегринами. Условные обозначения: α6β4 и α6β1 — гетеродимеры интегринового рецептора; Src/pSrc — пропорция неактивной/активной форм киназы.
Перспективы в терапии метастазирования
Подведем итог: описанные здесь механизмы, очевидно, усложняют картину течения онкозаболеваний и развития тактик их лечения. Важно подчеркнуть, что гетерогенность первичной опухоли и метастазов по ряду рассмотренных здесь признаков (генетическая, метаболическая, нишевая) дает понимание того, что следует использовать комбинированное и таргетное лечение на разных стадиях течения болезни. Как подтверждение тому — результаты одного из последних исследований, проведенных на материалах пациента с рецидивами между курсами длительной иммунотерапии. Сравнение популяций T-лимфоцитов из микроокружения разных метастазов показало, что они гетерогенны [22] и, следовательно, первичная, вторичные и т.д. опухоли по-разному отвечали на лечение.
Мы также знаем, что после химиотерапии зачастую выживают субклоны раковых клеток с полезными в новой среде мутациями. Под стрессом воздействия цитостатиков субклоны раковых клеток активируют секрецию факторов роста и запускают клеточную сигнализацию, препятствующую гибели (рис. 7). Кроме того, их выживанию помогает поддержка клеток стромы, заодно изменяющих свое поведение на «оборонительное» под эффектом терапии.
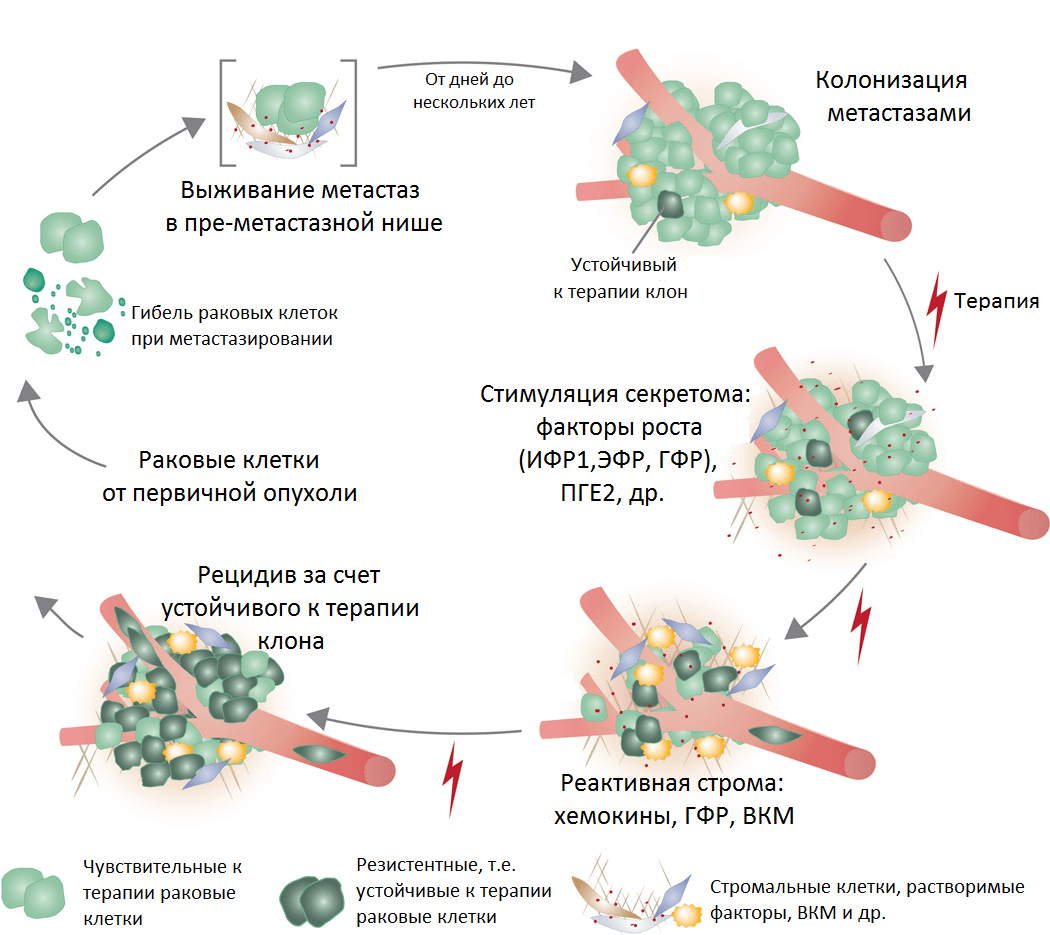
Рисунок 7. Реакция метастазов на терапию, образование резистентности и развитие рецидива. Условные обозначения: ИФР1 — инсулиноподобный фактор роста; ЭФР — эпидермальный фактор роста; ГФР — фактор роста гепатоцитов; ПГЕ2 — простагландин 2; ВКМ — внеклеточный матрикс.
Обнаружение преметастазных ниш и понимание их устройства предложили по-новому взглянуть на развитие подходов в терапии. Если бы стало возможным предотвратить формирование преметастазных ниш, то с большой вероятностью было бы остановлено метастазирование, а значит, и возможность ремиссии. Будем и дальше следить за прорывами в этой области.
Метастазы при раке: возможности лечения
Что такое местастазы? Как они возникают? Прогноз заболевания при метастазах в печени? Сколько живут с метастазами? Возможное лечение метастазов в легких, в костях и других органах.
Уварова Светлана Николаевна
Главный врач, онколог-химиотерапевт, врач высшей категории, врач паллиативной медицины
Что такое метастазы при раке?
Раковые метастазы всегда близки по структуре к клеткам первичной опухоли. По мере увеличения количества клеток в метастатических очагах, они начинают выделять вещества, которые стимулируют активное «питание» опухоли. Так как опухолевые клетки характеризуются быстрым ростом, то они забирают питательные вещества, предназначенные здоровым клеткам. Именно это вызывает раковую интоксикацию и истощение онкологического пациента.
Образование метастазов является одним из главных и принципиальных отличий злокачественных опухолей от доброкачественных.
Наш многолетний опыт подтверждает, что правильно назначенное лечение метастазов при раке позволяет существенно облегчить симптомы, увеличить продолжительность жизни пациента с онкологическим диагнозом и улучшить ее качество.
Тверезовская Ирина Александровна
Онколог-химиотерапевт, врач высшей категории, врач паллиативной медицины
Как проявляются метастазы?
Метастазирование начинается с проникновения клеток первичной опухоли в окружающую соединительную ткань. Высвобождение их из первичного очага происходит в результате ослабления связи между отдельными опухолевыми клетками, под действием механического давления или вследствие продукции специфических белков, нарушающих соединительнотканный каркас опухоли.
Затем эти клетки мигрируют в кровеносные и лимфатические сосуды и образуют метастазы в органах – мишенях благодаря повышенной способности прикрепляться к чужеродному субстрату. Усиленное прорастание в опухоль кровеносных сосудов способствует процессу метастазирования.
Появление метастазов при раке существенно нарушает функционирование органов и систем в организме.
Как происходит процесс метастазирования, можно посмотреть на видео:
Выражаем благодарность авторам ролика за предоставленную возможность использовать видеоматериал.
Локализация метастазов
Около 6% злокачественных образований составляют метастазы без первичного очага. В таком случае диагноз устанавливают с помощью биопсии из метастатического очага. Морфологические данные могут предположительно указать на характер первичной опухоли (например, аденокарцинома), степень дифференцировки опухолевых клеток (низкодифференцированная или высокодифференцированная) и локализацию.
На какой стадии рака появляются метастазы?
В настоящее время не существует никакой методики, с помощью которой можно было бы установить наличие в организме скрытых метастазов в виде микроскопических комплексов опухолевых клеток.
Именно поэтому назначается адъювантная (послеоперационная) системная терапия (химио, гормональная или таргетная) при некоторых онкологических заболеваниях даже на ранних стадиях после радикальных хирургических вмешательств (например, при раке молочной железы).
Симптомы метастазов
Как метастазы влияют на прогноз заболевания?
Метастазы, как и первичная опухоль, сильно нарушают работу организма — они провоцируют раковую интоксикацию, выделяя токсины и биологически активные вещества, разрушая здоровую ткань вокруг них, распадаясь и отравляя организм.
Поэтому наличие отдалённых метастазов значительно ухудшает прогноз, однако есть опухоли, которые остаются потенциально излечимыми и в стадии диссеминации (например, опухоли яичка, некоторые лимфомы, опухоли у детей).
Лечение рака с метастазами с помощью современной противоопухолевой терапии (цитостатической, гормональной, таргетной) может существенно продлить жизнь пациента от нескольких месяцев до нескольких лет при многих онкологических заболеваниях, даже в случае выявления отдалённых вторичных очагов.
Диагностика метастазов
Для диагностики метастазов может использоваться компьютерная и магнитно-резонансная томография, рентгенография, ультразвуковое, радиоизотопное исследование. Информативность разных методов зависит от исследуемой области, типа опухоли. Конкретный диагностический метод назначает только лечащий врач-онколог. Иногда для уточнения диагноза необходимо выполнить биопсию метастатического образования с последующим гистологическим и иммуногистохимическим исследованием.
Каждый пациент, получающий лечение в нашем центре, находится в одних руках – под наблюдением своего лечащего врача, который своевременно назначает необходимое диагностическое исследование для оценки эффекта лечения.
Лечение метастазов
В большинстве случаев при выявлении метастазов (за исключением их локализации в регионарных лимфоузлах) проводится паллиативная системная терапия не с целью полного излечения, а для продления жизни и улучшения её качества. В зависимости от особенностей заболевания применяется химиотерапия или гормонотерапия, таргетные, иммунные и радиофармацевтические препараты.
Иногда при лечении метастатических опухолей требуется другой подход. В некоторых ситуациях может быть рекомендовано хирургическое удаление одиночных метастазов (например, при колоректальном раке, при опухоли почки, при меланоме). Выполняются также циторедуктивные операции, позволяющие уменьшить объём опухоли и улучшить результат системной терапии.
Таким образом, в настоящее время существует много возможностей для того, чтобы помочь пациентам с распространённой стадией онкологического заболевания.
Опыт наших онкологов по лечению метастатического рака подтверждает, что правильно назначенная системная терапия позволяет существенно улучшить качество жизни пациента и ее длительность.
Отзывы
Со словами огромной благодарности в адрес Андрея Сергеевича от всей нашей семьи! Спасибо за Профессионализм, неравнодушие и понимание! Нашли клинику случайно, но ни разу не пожалели, лечим папу, надеемся и верим. Андрей Сергеевич тот врач, которому веришь, а это большая редкость даже в платной медицине. Девушкам-администраторам отдельное спасибо, с первых шагов по центру атмосфера участия, внимательности! Всем здоровья! …
Читать полностью
Маргарита 16.01.2017 09:41:00
Со словами огромной благодарности в адрес Андрея Сергеевича от всей нашей семьи! Спасибо за Профессионализм, неравнодушие и понимание! Нашли клинику случайно, но ни разу не пожалели, лечим папу, надеемся и верим. Андрей Сергеевич тот врач, которому веришь, а это большая редкость даже в платной медицине. Девушкам-администраторам отдельное спасибо, с первых шагов по центру атмосфера участия, внимательности! Всем здоровья!
Мы обратились в клинику Де Вита 6 месяцев назад, лечим здесь отца. За это время ему стало намного лучше, отступила боль, вернулись жизненные силы и хорошее настроение.
Огромное спасибо Светлане Николаевне за грамотно подобранное лечение и особый подход к пациентам, а также всему персоналу клиники. Мы очень рады, что попали именно сюда. …
Читать полностью
Мы обратились в клинику Де Вита 6 месяцев назад, лечим здесь отца. За это время ему стало намного лучше, отступила боль, вернулись жизненные силы и хорошее настроение.
Огромное спасибо Светлане Николаевне за грамотно подобранное лечение и особый подход к пациентам, а также всему персоналу клиники. Мы очень рады, что попали именно сюда.
Уварова Светлана Николаевна
Главный врач, онколог-химиотерапевт, врач высшей категории, врач паллиативной медицины
Метастазы
Метастазы
Метастазы
Практически любая злокачественная опухоль со временем образует метастазы. Это вторичные очаги роста, которые образуются из клеток первичной опухоли, распространившихся током крови или лимфы. Метастазы чаще всего образуются в региональных лимфатических узлах, током крови через малый или большой круг кровообращения они могут быть занесены в печень, легкие.
Появление вторичных очагов значительно ухудшает прогноз заболевания, поэтому при обнаружении опухоли, в первую очередь, стараются определить есть ли метастазирование или нет, и постараться предотвратить его. Вылечить рак невозможно, если в организме останутся метастазы, которые впоследствии будут расти и превратятся в другие очаги.
Факторы риска, какими бывают метастазы?
Не каждая опухоль быстро дает метастазы. Некоторые могут достигать огромных размеров и не метастазировать. Отчего это зависит? Изучение развития рака показывает, что формирование злокачественного новообразования происходит при наличии создании в организме благоприятных условий, первым из которых является снижение общего иммунитета.
Иммунная система ответственна за предотвращение роста клеток, которые генетически отличаются от остальных и бесконтрольно размножаются. Она должна уничтожать их, но сбой в иммунной системе приводит к развитию опухоли. Низкодифференцированные опухоли чаще дают метастазы, поскольку иммунная система не видит в них врага. Она воспринимает их как клетки предшественники различных тканей, ведь обновление, восстановление в организме происходит постоянно.
Распространение клеток с током крови или лимфой может происходить достаточно долго. Неизвестно по какой причине эти клетки, осевшие в других тканях, в какой-то момент начинают выделять фактор роста. Он стимулирует образование вокруг них сери кровеносных сосудов, благодаря которым вторичная опухоль начинает усиленно расти. Именно поглощение опухолью большого количества питательных веществ из крови способствует ее росту в ущерб остальным тканям организма, в том числе приводит к еще большему нарушению в иммунной системе.
Причины возникновения метастазов
Причины возникновения метастазов, до сих пор изучаются. Низкодифференцированные опухоли распространяются по организму быстрее. Их малая дифференциация позволяет им попадать в любые ткани. Помимо дифференцировки клеток, значение может иметь их размер. Так, мелкоклеточный рак легких метастазирует намного чаще, чем крупноклеточный, клеткам которого сложнее проникнуть в лимфатический или кровеносный сосуд.
Но не только это способствует распространению метастазов. Опухоль, имеющая инфильтрирующий, эндофитный рост, вызывает образование отдаленных очагов чаще, чем образование с экзофитным ростом. Прорастая в соседние ткани и структуры, возможно разрушение кровеносных и лимфатических сосудов, что приводит к распространению метастазов.
Симптомы метастазов
Симптомы метастазов могут быть такими же, как если бы опухоль развивалась в этой области изначально, или быть специфичны, например, при гормонозависимых опухолях. Печень и легкие, наиболее часто являются органами, где возникают метастазы. Поскольку в легкие попадает кровь со всего организма, а через печень фильтруется кровь из пищеварительной системы.
Иногда метастазы, обнаруженные в легких или печени, оказываются вторичным очагом из раковых опухолей молочной железы, яичников, кишечника, предстательной и щитовидной железы, почек, кожи. Причем первичная опухоль может быть намного меньше в размерах.
Конечно, иногда больные приходят к врачу с жалобами на дисфункции различных органов. Например, боли в правом подреберье, которые принимают за желчнокаменную болезнь, могут указать на рак печени или метастазы в ней. А проблемы с легкими, одышка, кровохарканье служат признаками поражения легких. Сильные неутихающие боли в спине, не всегда говорят об остеохондрозе, как привыкли думать большинство людей. Они также иногда являются первыми признаками метастазирования в позвоночник.
Диагностика метастазов
Обнаружить метастазы можно, исследовав все органы и ткани организма. Для их выявления проводят:
Есть еще много специфических методик для обследования различных органов, самой эффективной на сегодняшний день является позитронно-эмиссионная компьютерная томография ПЭТ-КТ всего тела. Во время процедуры в организм человека вводят вещество, содержащее радиоизотопы. Поскольку любая злокачественная опухоль имеет хорошее кровоснабжение и активно захватывает питательные вещества из крови, ведь это необходимо ей для активного роста, то при введении радиоизотопного препарата он накапливается в клетках опухоли и в метастазах.
При совместно проводимой компьютерной томографии можно обнаружить очаги скопления радиоизотопных препаратов, первичный и вторичные очаги. ПЭТ-КТ всего тела это эффективная процедура, которую используют для раннего выявления злокачественных новообразований. Во многих развитых странах, она включена в профилактические ежегодные осмотры Check up. ПЭТ-КТ обследование необходимо и для определения стадии заболевания, для выбора метода лечения.
Обнаружение метастазов в региональных лимфатических узлах указывает на запущенное заболевание, которое требует не только местного воздействия — удаление, иссечение опухоли, но и общего.
Лечение метастаз на разных стадиях
При лечении используют различные методы, чем раньше начать лечение, тем больше вероятность, что метастазы будут уничтожены. В онкологии применяют:
Лучевая терапия
Облучение клеток опухоли вызывает их гибель, что используется как для уменьшения размеров образования до операции (неоадъювантная терапия), так и для уничтожения и предотвращения распространения метастазов (адъювантная терапия). Она проводится разными методами. Существует дистанционная лучевая терапия, в этом случае облучают зону опухоли и региональных лимфатических узлов, с целью уменьшит распространение злокачественных клеток и вызвать их гибель.
Конформная лучевая терапия – это направленное облучение, которое позволяет не наносить вред окружающим тканям, еще один вид лучевой терапии это брахиотерапия. Воздействие производится путем внедрения излучающего вещества непосредственно в очаг поражения. Это может быть капсула, или радиоактивная игла.
Есть также методика фотодинамической терапии, она применяется при поражениях кожных покровов. После введения фотодинамических препаратов, и поглощения их опухолью, пораженное место облучают источником света. Фотоэффект приводит к распаду светочувствительного вещества и образованию кислорода, который вызывает гибель клеток. Но такая терапия приемлема, только если вторичный очаг расположен на поверхности тела.
Химиотерапия
Химиотерапия наиболее эффективное средство для борьбы с метастазами. Цитотоксические или цитотоксические вещества, поступая в кровеносное русло, активно захватываются клетками опухоли и приводят к ее гибели. Но они также могут влиять и на здоровые клетки. Поэтому разрабатываются новые методы лекарственные препараты и методы, ограничивающие влияние химиотерапевтических веществ.
Так, при карциноматозе брюшины, или ее вторичном обсеменении эффективна внутриполостная химиотерапия. Препарат вводится непосредственно в брюшную полость и воздействует на вторичный очаг. Но внутривенное введение, курс химиотерапии – наиболее эффективен, поскольку воздействует даже на мелкие не выявленные очаги.
Биологическое лечение
Иммунотерапия рака – это довольно новое направление, цель которого, помочь организму самостоятельно уничтожить онкологическое образование. Так, при таргетной или целевой терапии больной получает препараты, содержащие моноклональные антитела, распознающие клетки опухоли, прикрепляющиеся к ним и останавливающие их рост. Используют также специально выращенные на питательных средах лимфоциты больного «запрограммированные» на уничтожение образования.
Хирургическое лечение
Хирургическое удаление метастазов применяется, если вторичный очаг единичен, доступен и состояние больного позволяет провести оперативное вмешательство. Множественные метастазы удалять с помощью хирургического метода не целесообразно. Для удаления метастазов нередко применяют новейшие разработки, например, радиочастотную аблацию.
Прогноз
Стадии онкологического заболевания определяют с учетом метастатических изменений в лимфатических узлах и отдаленных органах. Единичный метастаз в лимфатическом узле свидетельствует о второй стадии рака. При поражении нескольких или целых групп лимфоузлов говорят о третьей стадии. А наличие вторичных очагов в органах, костях, указывает на четвертую стадию, прогноз которой обычно неблагоприятный.
Профилактика заболевания
Профилактические мероприятия, которые проводятся, чтобы предотвратить метастазы – это своевременное лечение. Удаление опухоли на ранних стадиях, когда еще нет метастизирования, это один из видов профилактики. Соблюдение правил абластики во время операции, удаление опухоли в пределах здоровых тканей, последующая лучевая и химиотерапия – это лучшая профилактика метастазов.
Метастазы в костях: лечение
Любое раковое заболевание может сопровождаться осложнениями в виде метастазов, то есть распространением злокачественных клеток в другие органы и системы организма больного.
В Юсуповской больнице проводят диагностику и лечение онкологических заболеваний. Своевременная диагностика любого заболевания – это залог эффективного лечения. Высококвалифицированные врачи проводят эффективное лечение заболеваний на любой стадии их развития. Использование современных методов позволит вернуть пациента к нормальной полноценной жизни.
Метастазы в костях: причины возникновения
В большинстве случаев метастазы в костях возникают при таких онкологических заболеваниях, как:
При развитии злокачественных новообразований в шейке матки, желудочно-кишечном тракте или яичниках метастазы в костях являются крайне редким явлением. В большинстве случаев метастазы поражают позвоночник, но могут встречаться метастазы в лобной кости, плечевой и бедренной костях, а также в ребрах.
Метастазы в костях: диагностика
Чем раньше будет пройдена терапия, тем больше шансов у пациента на выздоровление. Если у больного в ходе обследования выявили опухоль, он должен постоянно находиться под наблюдением врача. Множественные метастазы в костях может предотвратить лишь квалифицированное лечение под постоянным контролем специалиста.
В Юсуповской больнице врачи проводят диагностику при помощи сцинтиграфии. Данный метод позволяет выявить метастазы в костях всего скелета на ранних стадиях их развития, когда метаболические нарушения только начинают развиваться.
Лабораторные исследования также позволяют диагностировать метастазы в кости. Показатели крови на наличие щелочи и кальция выявляют обменные нарушения. Рентгенологическая диагностика метастазов в кости не способна выявить метастазы на их ранних стадиях развития. Эта методика малоэффективна. С ее помощью можно обнаружить метастазы на поздних стадиях, когда костная ткань разрушена уже наполовину.
Метастазы в позвоночнике
Причины возникновения метастазов в позвоночнике – это раковые опухоли практически любых органов.
Наиболее часто метастазирование в позвоночник наблюдается при следующих видах онкологии:
Метастазы в позвоночнике проявляют себя следующей симптоматикой:
В отсутствие лечения злокачественные клетки начинают прорастать в соседние позвонки, что приводит к значительным разрушениям костной ткани. При этом болевые ощущения в значительной степени усиливаются, анальгетики перестают оказывать эффект.
При значительном разрушении костной ткани метастазами в крови больного повышается уровень кальция. Этот процесс сопровождается появлением следующей симптоматики:
На ранних стадиях метастазы проявляют себя аналогично с остеохондрозом. Часто врачи назначают лечение именно последнего заболевания, усугубляя состояние больного и приводя тем самым к усилению развития онкологии.
Метастазы в костях: симптомы, лечение
Самыми распространенными симптомами метастазов в кости являются ограничение подвижности и боли в костях и позвоночнике.
Если наблюдается компрессия спинного мозга, то у пациента появляются следующие симптомы:
При развитии метастазов костная ткань может либо истончаться, либо утолщаться.
В первом случае речь идет об остеолитических очагах, при которых клетки опухоли разрушают костную ткань, ее плотность меняется и увеличивается риск переломов. При утолщении кости пациент не испытывает выраженного болевого синдрома и патологические переломы маловероятны.
Как правило, при онкологических заболеваниях одновременно у больного развиваются оба вида метастазов кости. Как лечить метастазы в костях? Лечение предполагает следующие мероприятия:
При своевременной диагностике заболевания и вовремя назначенном лечении шансы на выздоровление у пациентов значительно возрастают. Своевременная терапия предотвращает развитие новых очагов метастазов. Кроме того, имеется возможность улучшить качество жизни больного, то есть лечение позволяет избежать истончения кости и патологических переломов, снижает болевые ощущения и компрессию спинного мозга.
В ходе лечения следует помнить, что костные метастазы могут приводить к осложнениям в течении года. Поэтому пациент должен постоянно наблюдаться у врача. Это будет служить лучшей профилактикой дальнейшего развития очагов метастазов.
Обратившись за консультацией к врачам Юсуповской больницы, Вы получите исчерпывающую информацию о возможных методах лечения онкологических заболеваний. Врачи составят индивидуальную программу лечения с использованием наименее травматичных и наиболее эффективных методов лечения.