Нпвп что это за препараты
Нпвп что это за препараты
НПВС СИСТЕМНОГО И МЕСТНОГО ДЕЙСТВИЯ: ПРЕПАРАТЫ ВЫБОРА
Ч. 1 Воспаление — это один из наиболее распространенных патологических процессов, который составляет основу очень большого числа заболеваний — от острых респираторных инфекций до тяжелых хронических остеоартритов.
Преферанская Нина Германовна
Доцент кафедры фармакологии образовательного департамента Института фармации и трансляционной медицины Мультидисциплинарного центра клинических и медицинских исследований Международной школы «Медицина будущего» Первого МГМУ им. И.М. Сеченова (Сеченовский университет), к.фарм.н.
Воспаление характеризуется следующими основными взаимосвязанными фазами: альтерацией (повреждение ткани), экссудацией (выход жидкой части крови на месте воспаления), клеточной эмиграцией (выход лейкоцитов в зону альтерации) и пролиферацией, восстановлением собственной ткани (регенерация) или соединительной ткани (образование рубца). Классическими внешними симптомами воспаления являются: повышение температуры (лихорадка), покраснение (гиперемия), боль (гипералгия) и тканевой отек.
Воспаление — это защитная реакция тканей и органов организма на повреждение, необходимая для их нормального восстановления и заживления. Основная роль любого воспаления заключается в ограничении и удалении повреждающих факторов комплексом сосудисто–экссудативных и пролиферативных реакций, размножение клеток и восстановление целостности поврежденных тканей c устранением интоксикации организма. Патогенез воспаления представляет собой сложное сочетание гуморальных и эффекторных механизмов, обязательными компонентами которого являются: повреждение клеток и тканей, расстройство микроциркуляции с экссудацией и миграцией клеток крови и развитием защитно–приспособительных процессов. Инфильтрация и клеточная эмиграция фагоцитирующими клетками (макрофагами, нейтрофилоцитами, эозинофилами, базофилами) усиливает активность тканевых ферментов, клеточных элементов, медиаторов и ускоряет тканевой метаболизм.
На месте повреждения повышается сосудистая проницаемость, возникает вазодилатация, что увеличивает проникновение жидкости и клеток в пораженную ткань. В кровь поступает большое количество биологически активных веществ (простагландины, лейкотриены, гистамин, кинины, оксид азота (NO) и др.). В ответ на воспалительные стимулы в печени синтезируются реактанты (белки острой фазы) и антиоксидантные ферменты (супероксиддисмутаза, каталаза).
Воспалительный процесс условно разделяют на острый и хронический. Острый воспалительный процесс — это первоначальная реакция организма на повреждение тканей. Острое воспаление начинается с альтерации и нарушения микроциркуляции. При хроническом воспалении возникает активация макрофагов и пролиферация преобладает над фазой экссудации. Ведущей клеткой острого воспаления является нейтрофил, хронического — активный макрофаг. Острое воспаление заканчивается быстро, через 14 дней. Хроническое течет длительно, иногда в течение всей жизни, потому что макрофаги в очаге воспаления имеют длительный жизненный цикл. При небольшом повреждении тканей, при ранах, заживающих первичным натяжением, воспалительный процесс заканчивается полным восстановлением.
Хроническое воспаление сопровождается высвобождением целого ряда медиаторов, которые не связаны с активацией острого воспаления, в основном цитокинов. При гибели большого количества клеток дефект замещается соединительной тканью с образованием рубца. Может быть избыточное образование рубцовой ткани. Все типы воспаления связаны с активацией иммунной системы и изменения иммунологической реактивности организма.
При повреждении клеток в первую очередь страдают клеточные мембраны, основу которых составляет двойной фосфолипидный слой. Под действием фосфолиазы–А2 образуется арахидоновая кислота — предшественник воспалительных эйкозаноидов. Метаболизм арахидоновой кислоты по циклооксигеназному пути ведет к образованию простагландинов. Вначале из арахидоновой кислоты под действием циклооксигеназы (ЦОГ) синтезируются циклические эндопероксиды, а из нестабильных циклических эндопероксидов далее образуются простагландин E2, простациклин (PGI2), тромбоксан (PGA2) и др. простагландины.
Существует несколько изоформ циклооксигеназы — ЦОГ-1, ЦОГ-2, ЦОГ-3. Постоянно присутствует в большинстве тканей ЦОГ-1, но в разном количестве, и относится к «конституционным» ферментам, регулирующим физиологические эффекты простагландинов. ЦОГ-2 локализуется только в некоторых органах (почках, головном мозге, костях, желудочно–кишечном тракте (ЖКТ), репродуктивных органах) и относится к индуцибельным (адаптивным) ферментам под влиянием иммунных медиаторов — цитокинов. Фермент экспрессируется макрофагами, фибробластами, гладкой сосудистой мускулатурой, эндотелиальными клетками и принимает участие в развитии иммунного ответа в виде развития воспаления с последующей клеточной пролиферацией.
ЦОГ-2 менее токсичен в отношении ЖКТ. ЦОГ-3 локализуется в ЦНС и принимает участие в синтезе простагландинов, играющих важную роль в развитии боли и лихорадки. ЦОГ-3 не принимает участие в развитии воспаления.
Избыточное количество простагландинов Е2 и I2 вызывает расширение сосудов (вазодилатация), увеличивают проницаемость сосудистой стенки, усиливают действие других медиаторов воспаления, таких как гистамин и брадикинин, на проницаемость сосудов. Это приводит к экстравазации (от лат. extra — чрез и vasa — сосуд) плазмы, другими словами — происходит вытекание крови или какой-либо жидкости из сосудов (инфильтрация) в окружающие ткани и возникновение отека тканей. Повышается чувствительность (сенсибилизация) ноцицепторов, что вызывает болевые ощущения. Усиливается хемотаксис (двигательные реакции), что приводит к развитию основных признаков воспаления. Простагландин E2 оказывает стимулирующее действие на центр теплорегуляции в гипоталамусе и повышает температуру тела.
ПРИМЕНЕНИЕ ПРОТИВОВОСПАЛИТЕЛЬНЫХ СРЕДСТВ
В настоящее время для борьбы с воспалением используют многочисленные противовоспалительные средства. Их своевременное применение приводит к уменьшению и ограничению интенсивности воспалительной реакции, тормозит образование, высвобождение и фиксацию медиаторов воспаления и предотвращает образование нефункциональной рубцевой ткани, особенно при хроническом воспалении в жизненно важных органах.
Основными группами противовоспалительных средств являются:
Нестероидные противовоспалительные средства (НПВС) ингибируют ЦОГ и таким образом нарушают образование простагландинов, что и определяет их основные фармакологические эффекты: противовоспалительный, анальгезирующий и жаропонижающий. При умеренных и сильных болях НПВС оказывают более сильный анальгетический эффект, чем препараты «анальгетики–антипиретики».
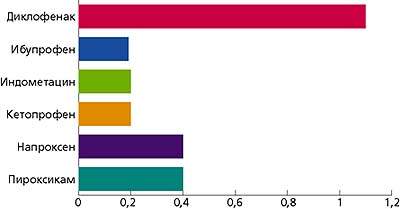
По убыванию противовоспалительной активности НПВС располагаются в следующем порядке: Индометацин > Флурбипрофен > Диклофенак > Пироксикам > Кетопрофен > Напроксен > Фенилбутазон > Ибупрофен > Ацетилсалициловая кислота.
Важно! Препараты не рекомендуют комбинировать между собой. Одновременный прием двух или трех НПВС не только усиливает противовоспалительное действие, но и повышает риск развития побочных эффектов со стороны ЖКТ (рвота, изъязвление, диарея). Не рекомендуется сочетать эти средства с приемом алкогольных напитков, такая комбинация снижает анальгетический эффект и повышает токсическое действие на печень, почки.
Для системного применения назначают препараты НПВС в виде таблеток, таблеток пролонгированных (ретард) или покрытых кишечнорастворимой оболочкой (для уменьшения изъязвления ЖКТ), сублингвальных таблеток, жевательных таблеток, таблеток шипучих, а также в драже, капсулах, суппозиториях, суспензии оральной во флаконах, в гранулах для приготовления суспезии, для приема внутрь и в виде лиофилизированного порошка для инъекций.
Для предупреждения ночных болей и утренней скованности назначают 1 суппозиторию перед сном, таблетки применяют утром и вечером (пролонгированные — один раз) после приема пищи, запивают стаканом воды. Сублингвальную таблетку запивать не надо — ее следует положить под язык, где она должна раствориться. В тяжелых случаях назначают инъекции — один раз в сутки, при необходимости инъекцию повторяют с интервалом в несколько часов.
Для местного применения (наружного) используют препараты НПВС в виде мази, крема, трансдермальных форм в виде геля или пластыря, глазных капель, аэрозоля. Мазь, гель и крем наносят на болезненный участок тела тонким слоем и слегка втирают 2–3 раза в сутки. При местном применении системная абсорбция низкая, поэтому эффект такой терапии можно оценить только спустя 4 недели. При воспалительных процессах неинфекционной природы, с вовлечением передней камеры глаза, используют глазные капли. Закапывают в конъюнктивальный мешок в оба глаза по 1 капле от 3 до 5 раз в сутки.
Нестероидные противовоспалительные средства объединяют различные химические группы веществ. Их классифицируют на:
√ Высокоселективные необратимые ингибиторы ЦОГ-1 (малые дозы) и неселективные ингибиторы ЦОГ-1 и ЦОГ-2 (большие дозы)
1. Производные салициловой кислоты: Ацетилсалициловая кислота (Аспирин).
√ Неселективные обратимые ингибиторы ЦОГ-1 и ЦОГ-2
2. Хлорированное производноефенилуксусной кислоты: Диклофенак (Вольтарен, Ортофен).
3. Индолуксусной кислоты: Индометацин (Метиндол), Этодолак (Нобедолак).
4. Производныепропионовой кислоты:
5. Хлорированное производное гликолевой кислоты: Ацеклофенак (Аэртал).
6. «Оксикамы»
7. Производное пиразолидина: Фенилбутазон (Бутадион).
8. Гетероциклическое производное глицина: Амтолметин гуацил (Найзилат).
√ Высокоселективные обратимые ингибиторы ЦОГ-2
9. «Коксибы»
√ Преимущественно селективные обратимые ингибиторы ЦОГ-2
10. «Оксикамы«
11. Производное метансульфонанамида: Нимесулид (Найз, Нимулид)
√ Комбинированные препараты НПВС —Вимово, Диклоген плюс, Диклоран плюс, Индовазин, Наклофен Протект, Некст, Нейродикловит, Паноксен.
О нестероидных противовоспалительных средствах
Нестероидные противовоспалительные средства (НПВС) являются наиболее широко назначаемой группой лекарств во всем мире. Ежедневно свыше 30 млн. людей в мире принимают какой-либо НПВС, из них 40% — в возрасте старше 60 лет.
Нестероидные противовоспалительные средства (НПВС) являются наиболее широко назначаемой группой лекарств во всем мире. Ежедневно свыше 30 млн. людей в мире принимают какой-либо НПВС, из них 40% — в возрасте старше 60 лет.
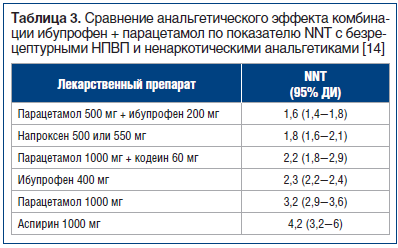
Рекомендательный перечень основных (жизненно необходимых) лекарственных средств ВОЗ (Essential Drug List. WHO, 1999) включает в себя только несколько средств, относящихся к классу неопиоидных анальгетиков, в том числе два НПВС (см. таблицу).
Отбор этих средств для перечня основных лекарственных средств объясняется не только их высокой терапевтической активностью, но и, что наиболее важно, гарантированной безопасностью, проверенной многолетним опытом работы многих врачей всего мира. В то же время эксперты ВОЗ подчеркивают, что приводимый перечень не является «застывшим» документом, он должен регулярно пересматриваться и адаптироваться к условиям конкретных стран; необходимо принимать во внимание квалификацию и опыт врачей, а также новые научные исследования.
Как известно, весь класс неопиоидных анальгетиков может быть условно разделен на две большие группы — кислотные и некислотные производные. И если во вторую, более узкую, входят такие средства, как ацетоминофен (парацетамол), метамизол (анальгин)*, обладающие только анальгетической и антипиретической активностью, то в первую — все так называемые нестероидные противовоспалительные средства, обладающие полным спектром фармакологической активности — анальгетическим, противовоспалительным и антипиретическим действием.
Вся группа НПВС также условно подразделяется на ряд основных «семей» (подклассов) в соответствии с активным веществом, производными которого они являются.
Эксперты разных стран едины во мнении, что различия в эффективности НПВС относительно невелики (Fries J. F., Williams C. A., Bloch D. A., 1991). Обзоры нескольких десятков клинических испытаний различных НПВС при остеоартрите и ревматоидном артрите не дают оснований ранжировать эти лекарства по степени их эффективности (Fries J., 1996). Хотя количество НПВС постоянно увеличивается, ни один из новых препаратов не может быть доказательно признан более эффективным, чем аспирин или ибупрофен. Частота побочных эффектов, возникающих при приеме этих лекарств, также примерно одинакова; возможно, исключением является ибупрофен в низких дозах (Brooks P. M., 1988). В то же время систематизация данных рандомизированных исследований (McQuay H., Moore A., 1998), с использованием критерия максимального полного купирования боли, который до некоторой степени позволяет объективизировать потенциальную значимость различных анальгетиков в обезболивании, дает основание говорить об определенной иерархии в противоболевой активности многих лекарственных средств.
Если эффективность лекарств примерно эквивалентна, то основанием для их выбора могла бы стать относительная безопасность. Однако, за несколькими исключениями, выбора практически нет. Прием НПВС является одной из самых типичных причин нежелательных реакций на фармакотерапию. В Великобритании НПВС составляют 5% всех назначаемых лекарств, однако на их долю приходится 25% всех побочных эффектов, о которых сообщается в Комитет по безопасности медикаментов. По официальным оценкам, в Великобритании 3-4 тыс. смертельных случаев ежегодно обусловлены побочными эффектами НПВС. В США использование НПВС ежегодно приводит к более 70 тыс. госпитализаций и 7 тыс. смертельных случаев.
Для НПВС типичны четыре основных типа побочных эффектов: гастроинтестинальные реакции, включая язву желудка; гиперчувствительность; почечная недостаточность после длительного применения; нарушение функций ЦНС, включая забывчивость, неспособность сосредоточиться, бессонницу, паранойю и депрессию. Реже наблюдается поражение печени, иногда тяжелое.
| Рисунок 1. Данные о частоте нефротоксических побочных реакций при терапии НПВС (Current Problems in Pharmacovigilance, 1994) |
 |
| Число собщений, приходящихся на 100000 выписанных рецептов в год |
Все лекарственные средства в той или иной степени могут быть ассоциированы с нежелательными побочными реакциями. НПВС как класс лекарств характеризуются целым рядом нежелательных реакций, а различие в их выраженности крайне незначительны. Кроме того, эти проблемы потенциально важны для всех пациентов без исключения, независимо от длительности терапии и возраста.
Гастроинтестинальные реакции как проявление нежелательных реакций на прием НПВС являются наиболее частыми и общими для данного класса лечебных препаратов. Клинически эти проявления протекают наиболее тяжело и являются основным фактором риска смертельного исхода.
Прием НПВС оказывает токсическое действие по двум независимым механизмам — локальному (узконаправленному) и общему генерализованному (системному) действию.
Одна из наиболее обоснованных точек зрения на патогенез НПВС-обусловленных поражений гастроинтестинальной системы состоит в том, что эти специфические осложнения терапии обусловлены неселективным подавлением синтеза простагландинов**.
Приблизительно у 50% больных, страдающих НПВС-гастропатией (язвеннно-эрозивными поражениями слизистой желудка и двенадцатиперстной кишки, кровотечениями), заболевание может протекать практически без симптомов, а значит, выявляться с большим запозданием. Такие жизненно опасные состояния могут быть первым и единственным признаком патологических изменений желудочно-кишечного тракта (эта особенность НПВС-гастропатии особенно ярко проявляется у пожилых больных). Более того, достаточно часто нестероидные противовоспалительные средства благодаря особенностям антипростагландиновой активности могут «затушевывать» симптомы патологии желудочно-кишечного тракта, затрудняя тем самым постановку диагноза и лечение заболевания. В то же время у определенной части больных (около 30%) единственным симптомом гастропатии являются абдоминальные боли без патологических соматических изменений. Между язвами, образовавшимися в результате приема НПВС, и возникшими спонтанно, произвольно (язвенная болезнь), существует некоторая разница. Во-первых, язвы, появившиеся в результате приема НПВС, чаще всего протекают бессимптомно. Во-вторых, слизистая оболочка желудка «адаптируется» к длительному воздействию НПВС, так что после 2-8 недель приема лекарства острые поражения уменьшаются, а ряд экспериментов показал, что наиболее опасными могут считаться первые месяцы приема этих средств.
Считается, что риск возникновения гастроинтестинальных кровотечений достаточно высок как при целевом кратковременном, так и при длительном приеме НПВС. В то же время есть все основания полагать, что именно длительностью приема в наибольшей степени обусловлена основная опасность даже безрецептурных НПВС. Длительное ретроспективное исследование (Kurata J. H., Abbey D. E., 1984), проведенное у 4524 больных, показало, что ежедневное использование аспирина в дозе 1000 мг (МДД — 6000 мг) в целях профилактики инфаркта миокарда на протяжении 4 лет повышает риск появления неспецифического язвенного поражения в 10,7 раза по сравнению с контрольной группой (не принимавших аспирин). При этом надо учитывать, что и минимальные дозы салицилатов могут быть достаточно опасны. Исследования (Naschitz J., 1989) наглядно продемонстрировали, что даже такая минимальная доза аспирина, как 75-250 мг, может быть главной причиной возникновения кровотечений в верхних отделах гастроинтестинального тракта у 8,2% пациентов. В то же время одно из проспективных исследований (Lanza F., 1984) показало, что кратковременное трехдневное регулярное применение наиболее безопасного из НПВС препарата — ибупрофена — в суточной дозе 1600 мг (МДД — 2400 мг) не способно вызвать морфологически достоверных изменений слизистой желудка.
Реакции гиперчувствительности. Одним из важнейших критериев использования НПВС в качестве анальгезирующего средства при острой боли (травматического или хирургического происхождения) является аллерго-иммунологический статус больного, риск развития бронхоспазма (Szczeklik A., 1992). Острые приступы аспиринзависимой астмы развиваются примерно у 8-20% взрослых астматиков. У части больных это может быть первым симптомом начинающейся астматической болезни. Отмеченная перекрестная зависимость между аспиринзависимой астмой и бронхоспазмом относится не только к салицилатам, но практически ко всем НПВС. А рассматривая вопрос еще шире, следует признать, что назначение всех кислотных производных НПВС противопоказано пациентам, имеющим в анамнезе любые проявления так называемой «аспириновой триады» — астмы, полипоза в носовых ходах или непереносимости аспирина (Power I., 1993).
| Рисунок 2. Данные о частоте гепатотоксических побочных реакций при терапии НПВС (Current Problems in Pharmacovigilance, 1994) |
 |
| Число собщений, приходящихся на 100000 выписанных рецептов в год |
Нарушение функции почек. Считается, что побочные реакции со стороны почек могут быть обусловлены системным неселективным подавлением синтеза простагландинов, влияющих на регуляцию клубочковой фильтрации, поддержание водно-электролитного баланса. Эти реакции, как правило, проявляются у больных, имеющих в анамнезе какие-либо почечные заболевания. В таких случаях основными симптомами побочных реакций могут стать острая почечная недостаточность, задержка жидкости, гиперкалиемия.
Кроме того, надо учитывать и возможность перекрестных реакций при назначении НПВС на фоне приема мочегонных препаратов, особенно у пожилых больных. Большинство НПВС тормозят действие и повышают нефротоксичность «петлевых» диуретиков, снижают гипотензивное действие бензотиазидов (Johnson A.G., Seideman P., Day R.D., 1993), что также значительно увеличивает риск появления нежелательных реакций.
Нарушение функции печени. Риск развития лекарственного гепатита при приеме НПВС сравнительно невелик. Описаны эксклюзивные случаи острых гепатотоксических реакций с развитием летального исхода (Masana P. et al., 1986). Все они связаны со значительными передозировками препарата и неоправданной длительностью лечения. В то же время в 1-4% случаев может наблюдаться бессимптомное умеренное повышение уровня печеночных ферментов (Насонов Е. Л., Лебедева О. В., 1991).
Нарушение функции центральной нервной системы. Реакции нейротоксичности, проявляющиеся головными болями, некоторой дезориентацией, спутанностью сознания, могут наблюдаться при приеме всех НПВС, однако наиболее часто они возникают, когда речь идет о лекарственных средствах, легко минующих гематоэнцефалический барьер (Goodwin J.S., Regan. M.,1982). Все эти реакции наиболее заметны у пожилых пациентов, что обусловлено их возрастными и физиологическими особенностями. Кроме того, именно эта категория пациентов в связи с нарушением внимания и памяти находится в группе риска по случайной передозировке (так называемой «аспириновой интоксикации»), которую легко оставить без внимания.
Обобщенные данные по безопасности основных НПВС. Так как до 1997 года исследований относительной переносимости аспирина, ибупрофена и парацетамола (наиболее широко используемых в повседневной практике для лечения слабой/умеренной острой боли у взрослых) не проводилось, эта проблема признана достаточно актуальной для общественного здравоохранения. Исходя из этого в 1997-1999 годах было проведено глобальное рандомизированное мультицентровое исследование, ориентированное на получение достоверных данных по объективному сравнению переносимости аспирина, ибупрофена и парацетамола в стандартных рекомендуемых дозах и при эпизодическом приеме по поводу острой боли различной этиологии (The PAIN Study: Paracetamol, Aspirin and Ibuprofen New Tolerability Study // Clin. Drug. Invest, 1999, vol. 18, №2, р. 88-98; Moore N., Van Ganse E., et al. A comparison of the tolerability of Ibuprofen, Acetominophen and Aspirin for short-term analgesia // Proceedings of the 9th World Congress on Pain/Eds. M. Devor, M. C. Rowbotham, Z. Wiesenfeld-Hallin. Seatle: IASP Press, 2000, p. 809-817).
Результаты исследования показали, что все основные характеристики переносимости ибупрофена равнозначны показателям переносимости парацетамола и выше показателей переносимости аспирина. В связи с этим, возможно, следует пересмотреть приоритеты, касающиеся применения анальгетиков первой линии для кратковременного лечения состояний, сопровождающихся болевым синдромом, в общей практике. В первую очередь рекомендуется назначать ибупрофен ввиду худшей переносимости аспирина и потенциальной опасности передозировки парацетамола.
И последнее, на чем стоит остановиться: большинство более новых лекарств стоят значительно дороже, чем появившиеся достаточно давно. Так, известно, что использование простого воспроизведенного анальгетика, такого как ибупрофен, обходится в 2–8 раз дешевле, чем применение нового, «современного» НПВС. Если НПВС назначается вместе с мизопростолом для снижения риска язвенного поражения желудка и кишечника, то стоимость лечения оказывается еще выше. Это лишний раз доказывает, что использовать давно известные НПВС, такие как аспирин и ибупрофен, гораздо выгоднее.
* Препарат как в чистом виде, так и в составе комбинированных средств выведен из обращения в большинстве стран мира по причине высокой токсичности. Исключен из списка жизненно важных и основных лекарственных средств с 2000 г.
** Простагландины играют важную физиологическую роль в защите слизистой оболочки. Такое защитное действие простагландинов включает в себя ряд механизмов:
1) увеличение секреции слизи и щелочи;
2) сохранение целостности эндотелиальных клеток внутри микрососудов слизистой оболочки, способствующее поддержанию кровотока в слизистой;
3) сохранение целостности гранулоцитов и, таким образом, структурной целостности слизистой оболочки.
Нестероидные противовоспалительные препараты — собрание клонов или содружество ярких индивидуальностей? Взгляд клинического фармаколога
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Ключевые слова: НПВП, факторы риска, лекарственные реакции, ибупрофен, парацетамол, Нурофен, капсульная мембрана.
Для цитирования: Прохорович Е.А. Нестероидные противовоспалительные препараты — собрание клонов или содружество ярких индивидуальностей? Взгляд клинического фармаколога. РМЖ. 2020;6:2-9.
Nonsteroidal anti-inflammatory drugs: ensemble of clones or bright individuals? A clinical pharmacologist’s view
A.I. Evdokimov Moscow University of Medicine and Dentistry, Moscow
Nonsteroidal anti-inflammatory drugs (NSAIDs) are the most commonly prescribed medicines. The choice of NSAIDs is made based on patient’s characteristics and risk factors for drug therapy complications. For patients who regularly receive NSAIDs, monitoring is required to di-agnose adverse drug reactions early. Ibuprofen is considered gold standard of analgesia. Ibu-profen is also the safest non-selective NSAID in terms of NSAID gastropathy. Combination of ibuprofen and paracetamol provides greater analgesia as compared with individual components and combination drugs containing codeine. Paracetamol has a central analgesic effect and does not induce NSAID gastropathy. The risk of cardiovascular complications is low as well. Paracetamol is slowly dissolved in alkaline solutions but quickly in acidic solutions (and ibuprofen vice versa). As a result, when taking separately, these drugs are absorbed in various divisions of gastrointestinal tract, i.e., stomach (paracetamol) and intestine (ibuprofen). Modern technologies of capsule membranes optimize dissolution and provide rapid simultaneous release of ibuprofen and paracetamol when taking perorally.
Keywords: NSAID, risk factors, drug reactions, ibuprofen, paracetamol, Nurofen, capsule membrane.
For citation: Prokhorovich E.A. Nonsteroidal anti-inflammatory drugs: ensemble of clones or bright individuals? A clinical pharmacologist’s view. RMJ. 2020;6:2–9.
Введение
Нестероидные противовоспалительные препараты (НПВП) относятся к наиболее часто используемым лекарственным средствам как среди рецептурных препаратов, так и среди средств безрецептурного отпуска, т. е. применяемых самими пациентами для самолечения без назначения врачом. Частота использования НПВП в клинической практике обусловлена спектром их фармакологических эффектов: обезболивающим, противовоспалительным, жаропонижающим, антиагрегационным (ацетилсалициловая кислота). Однако широкий спектр терапевтического действия и высокая клиническая эффективность имеют и обратную сторону: НПВП входят в группу лекарственных препаратов, наиболее часто вызывающих нежелательные лекарственные реакции (НЛР), связанные с токсическим действием, гиперчувствительностью, лекарственными и пищевыми взаимодействиями. Поэтому перед клиницистом стоит непростая задача: подбор НПВП для конкретного пациента.
Выбор лекарственного препарата осуществляется по определенному алгоритму.
Определение показания к применению лекарственного препарата, которое обусловлено клиническим диагнозом пациента: основное заболевание, наличие коморбидной патологии, осложнения, сопутствующие заболевания. Большое значение имеет оценка факторов риска развития осложнений лекарственной терапии: аллергологический анамнез; ранее выявлявшиеся симптомы непереносимости лекарственных препаратов; сопутствующая терапия, в т. ч. применение фитопрепаратов, витаминных препаратов, безрецептурных средств, БАДов; диетические пристрастия пациента, злоупотребление алкоголем, курение.
Определив показание («проблему» пациента), врач выбирает группу лекарственных препаратов и конкретный лекарственный препарат внутри этой группы, исходя из критериев эффективности, безопасности, стоимости и удобства применения.
Определившись с выбором конкретного лекарственного препарата, врач выбирает режим применения препарата: дозу, частоту применения, длительность терапии.
Врач объясняет пациенту в доступной форме, что с ним и почему появились беспокоящие его симптомы, предоставляет информацию о возможных немедикаментозных методах коррекции патологического состояния, объясняет пациенту, почему выбран этот лекарственный препарат и на что должен обращать внимание пациент при использовании данного препарата, при появлении каких симптомов он должен обратиться незамедлительно к врачу и даже прекратить прием препарата. Почти 50% случаев неэффективности фармакотерапии обусловлено низкой комплаентностью пациентов, поэтому так важно достижение сотрудничества с пациентом, соблюдение им регламента лекарственной терапии.
Сам врач в процессе лечения оценивает эффективность и безопасность проводимой фармакотерапии, решает вопрос о показаниях к назначению протективной терапии, прекращению/пролонгированию лечения при достижении поставленной цели или смене препарата при его неэффективности.
Выполнение этого алгоритма возможно только в случае, если врач хорошо знает показания к применению и клинико-фармакологические свойства выбранного лекарственного препарата.
Особенности применения НПВП в клинической практике
Как уже указывалось выше, основные фармакодинамические эффекты НПВП: анальгетический, противовоспалительный, жаропонижающий. Таким образом, препараты этой группы применяются при заболеваниях костно-мышечной системы, суставов, послеоперационной боли, головной боли напряжения, мигрени, дисменореи, почечной и печеночной коликах, синдроме хронической боли, простудных заболеваниях, лихорадке.
Эффективность лекарственного препарата определяется рядом факторов: механизмом действия, биодоступностью (процент от принятой дозы, поступивший в системный кровоток), особенностями метаболизма, концентрацией в крови и тканях организма, скоростью развития терапевтического эффекта и длительностью его удержания. Безопасность применения лекарственного препарата зависит от механизма действия и особенностей метаболизма, выведения препарата, его способности вступать в лекарственные взаимодействия.
Механизм действия НПВП обусловлен их способностью ингибировать фермент циклооксигеназу-2 (ЦОГ-2) в очаге воспаления (рис. 1). Именно ЦОГ-2 принимает участие в образовании провоспалительных простагландинов, которые потенцируют активность медиаторов воспаления (гистамина, серотонина, брадикинина), активирующих болевые рецепторы; участвуют в управлении активностью центра тепловой регуляции, способствуют клеточной пролиферации, мутагенезу и деструкции [1, 2]. При этом НПВП блокируют и циклооксигеназу-1 (ЦОГ-1), которая присутствует во всех органах и обеспечивает нормальные физиологические процессы (синтез защитной слизи желудка, некоторые этапы кроветворения, фильтрации и реабсорбции в почках). Существует также и «конститутивная» ЦОГ-2, которая в высоких концентрациях обнаруживается в головном мозге, костях, органах женской половой системы, почках, обеспечивая их нормальное функционирование.
Дополнительными механизмами противовоспалительного действия НПВП являются:
ингибирование синтеза активности интерлейкина-1;
подавление функции нейтрофилов и взаимодействия лейкоцитов с эндотелием сосудов;
угнетение активации NF-kB (фактора транскрипции), регулирующего синтез «провоспалительных» медиаторов;
активация PPARs (peroxisoma proliferator activated receptors).
Снижение синтеза «полезных» простаноидов лежит в основе механизмов развития НЛР при использовании НПВП.
НПВП можно разделить на две группы: неселективные ингибиторы ЦОГ (ибупрофен, диклофенак, напроксен и т. д.) и селективные, ингибирующие преимущественно ЦОГ-2 (мелоксикам, нимесулид, коксибы). При использовании препаратов второй группы значительно реже развиваются НПВП-гастропатии и НПВП-энтеропатии, желудочно-кишечные кровотечения, но возрастает риск осложнений со стороны сердечно-сосудистой системы [1]. Эффект НПВП возрастает с увеличением дозы препарата, при этом при максимальных дозах избирательность действия селективных НПВП снижается (рис. 2) [3].
Следует также отметить, что при использовании средних и высоких доз различных НПВП их эффективность сопоставима, что вытекает из результатов многоцентровых клинических исследований, в которых сравнивалось анальгетическое и противовоспалительное действие НПВП при травмах, операциях и заболеваниях опорно-двигательного аппарата. Так, при метаанализе данных 29 рандомизированных клинических исследований (n=18 000) оценивали эффективность различных НПВП при остеоартрите. Различия в выраженности снижения интенсивности боли (в миллиметрах визуальной аналоговой шкалы) между НПВП и плацебо составили: для напроксена 1000 мг/сут — 12,9 (95% доверительный интервал (ДИ) — 8,2–17,7), ибупрофена 2400 мг/сут — 9,0 (95% ДИ 5,0–13,1), диклофенака — 16,2 (95% ДИ 11,7–20,6), целекоксиба 200 мг — 14,7 (95% ДИ 12,1–17,3), эторикоксиба 30 мг — 14,2 (95% ДИ 12,6–16,8), эторикоксиба 60 мг — 16,2 (95% ДИ 12,7–19,8) [4].
Существует мнение, что внутривенное или внутримышечное введение лекарственного препарата обеспечивает более быстрый и выраженный терапевтический эффект, чем прием препарата внутрь. Однако это положение не подтверждается данными клинических исследований [5]. В систематическом обзоре 26 РКИ (n=2225) анализировали эффективность НПВП при парентеральном, ректальном, пероральном приеме. Показаниями для назначения НПВП были скелетно-мышечные заболевания, послеоперационная боль, дисменорея, почечная колика. Существенных различий в анальгетическом действии различных лекарственных форм НПВП не отмечено, за исключением почечной колики, при которой было показано достоверное преимущество внутривенного НПВП по сравнению с приемом внутрь [6].
Таким образом, можно сделать следующие выводы [1].
Все НПВП в адекватных противовоспалительных (средних и максимальных) дозах при длительном применении имеют равный обезболивающий потенциал (уровень доказательности 1a).
Эффективность НПВП зависит от дозы. Использование более высоких доз позволяет обеспечить более выраженное обезболивающее и противовоспалительное действие (уровень доказательности 1b).
Нет доказательств, что применение НПВП в виде инъекций или быстрорастворимых форм для приема внутрь имеет преимущество перед пероральными формами при проведении лечения более 1 дня (уровень доказательности 1b).
Риск развития нежелательных лекарственных реакций при использовании НПВП
Так как в терапевтических дозах эффективность НПВП сопоставима, то, выбирая НПВП для конкретного пациента, исходят из возможных рисков развития НЛР (табл. 1) [1]. Факторами риска развития НЛР при использовании НПВП являются: возраст старше 60 лет, избыточная масса тела, курение, язвенная болезнь желудка и двенадцатиперстной кишки в анамнезе, венозные тромбозы и тромбоэмболии в анамнезе, ИБС, цереброваскулярная болезнь, периферический атеросклероз, артериальная гипертензия, нарушения липидного обмена, сахарный диабет, заболевания кишечника, печени, почек, крови, застойная сердечная недостаточность, хроническая алкогольная интоксикация, сочетанный прием лекарственных препаратов, взаимодействующих с НПВП, лактация. Для более дифференцированного выбора НПВП был предложен специальный алгоритм, который подразумевает назначение селективных НПВП пациентам с факторами риска развития осложнений со стороны ЖКТ и применение НПВП с менее выраженным токсическим действием в отношении сердечно-сосудистой системы у больных с высоким сердечно-сосудистым риском, а также назначение протективной терапии (табл. 2) [1].
Согласно российским рекомендациям по рациональному использованию НПВП:
основной метод профилактики развития НЛР при применении НПВП — учет факторов риска, их коррекция (при возможности) и назначение НПВП с более благоприятным профилем желудочно-кишечной (градация рекомендации А) и сердечно-сосудистой безопасности (градация рекомендации В);
дополнительным методом профилактики осложнений со стороны верхних отделов ЖКТ является назначение ингибиторов протонной помпы (ИПП) (градация рекомендации A);
дополнительным методом профилактики осложнений со стороны верхних отделов ЖКТ, тонкой и толстой кишки может быть назначение ребамипида (градация рекомендации В);
не существует эффективных медикаментозных методов нефро- и гепатопротекции для снижения риска НПВП-ассоциированных осложнений.
Комбинация ибупрофен + парацетамол: особенности фармакокинетики, аспекты эффективности и безопасности применения
На российском рынке широко распространены НПВП, содержащие ибупрофен, который был синтезирован в 1961 г. и до настоящего времени считается «золотым стандартом» анальгетика [6]. Он также является наиболее безопасным неселективным НПВП в отношении развития НПВП-гастропатий. Ибупрофен разрешен для безрецептурного применения и доступен в виде различных лекарственных форм. Так, в линейке препаратов под торговым знаком Нурофен ® представлены таблетки, покрытые оболочкой; капсулы, содержащие жидкое действующее вещество, которое всасывается и достигает максимальной концентрации в крови быстрее, чем при приеме таблетированной формы. Выпускается ибупрофен в лекарственной форме суспензии, не содержащей сахара и спирта, для приема внутрь для детей в возрасте от 3 мес. до 12 лет.
Для достижения быстрого наступления обезболивания целесообразно использовать лекарственные формы с более высокой скоростью абсорбции и, следовательно, более быстрым достижением максимальной концентрации в плазме. Moore et al. (2013) опубликовали систематический обзор, в котором было продемонстрировано значительное преимущество быстродействующих форм ибупрофена по сравнению со стандартными в обеспечении анальгетического эффекта. Авторы проанализировали результаты 30 клинических исследований с участием 1015 пациентов и наглядно показали, что при использовании быстродействующих форм ибупрофена максимальные концентрации в плазме крови достигаются в среднем за 50 мин, тогда как для стандартных форм — в пределах 90 мин. При этом анальгетический эффект не только наступает быстрее, но и сопровождается более выраженным обезболиванием в течение 6 ч. Выявлены строгие корреляции между более быстрой редукцией интенсивности боли в сроки 0–60 мин и более выраженным обезболиванием в пределах 0–6 ч. В целом эффективность быстродействующей формы ибупрофена в дозе 200 мг была такой же, как и стандартной его формы в дозе 400 мг, но при этом требовалось меньшее количество повторных прие-мов анальгетиков при сопоставимой безопасности фармакотерапии [8].
Препарат Нурофен ® Интенсив является комбинацией ибупрофена 200 мг и парацетамола 500 мг, которые различаются по своему действию, что позволяет предположить, что при их комбинированном введении за счет особенностей механизмов действия двух составляющих анальгетический эффект суммируется. Ибупрофен является ингибитором ЦОГ-1 и ЦОГ-2; его обезболивающий эффект реализуется за счет ингибирующего действия на периферическом уровне, антипиретический — связан с центральным ингибированием синтеза простагландинов в гипоталамусе. Ибупрофен также ингибирует миграцию лейкоцитов в очаг воспаления и обратимо подавляет агрегацию тромбоцитов. Парацетамол является неселективным ингибитором ЦОГ-2, преимущественно в центральной нервной системе (ЦНС), стимулирует активность нисходящих путей серотонина, что приводит к купированию передачи болевого импульса в спинном мозге [9]; анальгетический эффект ацетаминофена связан с воздействием на каннабиноидную систему ЦНС [10–12].
Принимая во внимание тот факт, что парацетамол медленно растворяется в щелочной среде, но быстро — в кислой, тогда как ибупрофен — наоборот, их прием по отдельности приводит к тому, что их всасывание происходит в разных отделах ЖКТ: парацетамол — преимущественно в желудке, ибупрофен — в кишечнике. При производстве препарата Нурофен ® Интенсив была применена современная технология SynchroTechTM [15], позволившая благодаря использованию уникальной капсульной мембраны оптимизировать растворение препарата с быстрым и одновременным высвобождением активных действующих веществ.
Tanner et al. (2010) показали, что tmax парацетамола при использовании комбинации парацетамола и ибупрофена было значительно ниже, чем при использовании только парацетамола (средняя разница 10 мин; р Литература
Только для зарегистрированных пользователей
Опубликовано в:
СПРАВОЧНИК ПОЛИКЛИНИЧЕСКОГО ВРАЧА | № 1 | 2013
О.В.Котова
ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава РФ
Циклооксигеназа и побочные эффекты НПВП
Классификация НПВП
По механизму действия НПВП можно разделить все существующие НПВП на 4 группы (причем деление на «преимущественные» и «специфические» ингибиторы ЦОГ-2 является во многом условным).
1. Селективные ингибиторы ЦОГ-1 (низкие дозы ацетилсалициловой кислоты).
2. Неселективные ингибиторы ЦОГ (большинство «стандартных» НПВП).
3. Преимущественно селективные ингибиторы ЦОГ-2 (нимесулид, мелоксикам).
4. Специфические (высокоселективные) ингибиторы ЦОГ-2 (коксибы).
Стремление достичь селективности относительно ЦОГ-2 было продиктовано прежде всего желанием получить препараты не менее эффективные, чем «стандартные» НПВП, но менее опасные в плане нежелательных эффектов, в первую очередь по действию на слизистую оболочку ЖКТ. Сопоставимая терапевтическая эффективность ЦОГ-2-селективных и традиционных НПВП была многократно подтверждена в исследованиях на животных и клинических исследованиях.
Селективный ингибитор ЦОГ-2 нимесулид
Нимесулид (Найз®) имеет дополнительные ЦОГ-незави-симые эффекты: влияет на продукцию и действие окислительных радикалов и других компонентов нейтрофильной активации, что усиливает противовоспалительный и анальгетический эффекты и снижает вероятность гастроинтестинального язвообразования. Преимуществом нимесулида является быстрое начало действия. Также ни-месулид представляет собой высокоэффективное средство для купирования острой боли. Благодаря своим химическим свойствам нимесулид может легко проникать в очаги воспаления и накапливаться в них (например, в воспаленном суставе) в концентрации большей, чем в плазме крови.
Селективные ингибиторы ЦОГ-2 в отличие от классических НПВП не оказывают отрицательного влияния на суставной хрящ. Нимесулид, кроме того, ингибирует интер-лейкин-1(5 и фактор апоптоза хондроцитов, подавляет активность металлопротеаз, тем самым оказывая выраженное протективное действие в отношении хряща, что особенно важно для больных с заболеваниями суставов (остеоартро-зом, при поражении суставного аппарата позвоночника).
Нимесулид отличает высокая биодоступность. Уже через 30 мин после приема внутрь его концентрация в крови составляет 25-80% от максимального уровня и отмечается обезболивающий эффект. Пик концентрации препарата, а соответственно, и максимальное анальгетическое действие, достигаются через 1-3 ч.
Безопасность
Нимесулид редко вызывает тяжелые гастроинтестинальные осложнения.
В РФ безопасность Найза у больных, страдающих сочетанной патологией суставов и поражением верхних отделов ЖКТ, оценили в исследовании, в которое вошли 600 больных, получавших препарат в течение 1-3 мес в дозе 200 мг/сут. Хотя 10% этих больных имели язвенный анамнез, ни в одном случае не развилась перфорация или кровотечение из ЖКТ.
Эффективность
Нимесулид оказывает хорошее и быстрое обезболивающее и противовоспалительное действие, что подтверждено данными многочисленных клинических исследований, в частности, в анестезиологической практике. В ходе исследования A.Binning и соавт. больным (n=94), перенесшим артроскопическую операцию, в качестве анальгетика на 3 дня назначались нимесулид 200 мг, напроксен 1000 мг или плацебо. Полученные результаты показали, что оба НПВП достоверно превосходили плацебо по эффективности, но при этом нимесулид обеспечивал более выраженный обезболивающий эффект в первые 6 ч после операции.
Эффективность нимесулида оценивалась и у больных с сочетанием остеоартроза коленного сустава и болью в нижней части спины. Исследование носило характер двойного слепого проспективного контролируемого и продолжалось на протяжении 30 дней (нимесулид назначался по 100 мг 2 раза в сутки). В результате проведенного исследования авторы констатировали достоверное уменьшение выраженности болевого синдрома, нарастание объема активных движений в пораженных суставах, снижение исходно повышенного мышечного тонуса, а также уменьшение выраженности корешкового синдрома. Назначение нимесулида отличалось хорошей переносимостью.
Заключение
*Данное исследование проводилось в 2007 г., когда разрешенная максимальная дозировка была 400 мг/сут.
Нпвп что это за препараты
Самые популярные НПВП
Многие люди даже не представляют, насколько часто нам приходится использовать нестероидные противовоспалительные препараты для излечения от различных хворей, сопровождающих человеческий род со времен изгнания Адама и Евы из райских кущ.
Почитайте список таких средств, наверняка некоторые из них лежат в вашей домашней аптечке. Итак, к НПВП относятся такие лекарства, как: «Аспирин», «Амидопирин», «Анальгин», «Пироксикам», «Быструмгель», «Диклофенак», «Кетопрофен», «Индометацин», «Кеторол», «Напроксен», «Кеторолак», «Флурбипрофен», «Вольтаренгель», «Нимесил», «Диклофенак», «Ибупрофен», «Индопан», «Ипрен», «Упсарин УПСА», «Кетанов», «Месулид», «Мовалис», «Найз», «Нурофен», «Ортофен», «Тромбо АСС», «Ультрафен», «Фастум», «Финалгель».
Да, все это НПВП-препараты. Список получился хоть и большой, но, конечно же, далеко не полный. И все-таки он вполне дает представление о многообразии современных нестероидных противовоспалительных лекарственных средств.
Немного исторических фактов
Но пройдут еще долгие годы научных исследований, прежде чем это лекарство появится на свет. Грандиозное событие свершилось в 1899 году. Врачи и их пациенты быстро оценили преимущества нового лекарственного средства. В 1925 году, когда на Европу обрушилась страшнейшая эпидемия гриппа, «Аспирин» стал спасителем для огромного множества людей.
А в 1950-м данный нестероидный противовоспалительный препарат попал в книгу рекордов Гиннесса как обезболивающее средство с самым большим объемом продаж. Ну а впоследствии фармацевтами были созданы и другие нестероидные противовоспалительные препараты (НПВП).
При каких болезнях применяются противовоспалительные нестероидные лекарства?
Спектр применения НПВП очень широк. Они являются весьма действенными при врачевании как острых, так и хронических болезней, сопровождающихся болями и воспалением.
В наши дни полным ходом идут исследования на предмет изучения эффективности данных препаратов при лечении заболеваний сердца и сосудов. А о том, что их можно использовать при болях в позвоночнике, знают сегодня практически все (НПВП при остеохондрозе являются настоящим спасением).
Вот перечень болезненных состояний, при возникновении которых показано применение различных нестероидных противовоспалительных средств: Лихорадка. Головные боли, мигрени. Почечные колики. Ревматоидный артрит. Подагра. Артрозы. Остеоартрит. Дисменорея. Воспалительные артропатии (псориатический артрит, анкилозирующий спондилоартрит, синдром Рейтера). Болевой синдром послеоперационный. Болевой синдром от слабой до средней степени тяжести при травмах и различных воспалительных изменениях.
Классификация НПВП по их химической структуре
Читая эту статью, вы уже имели возможность убедиться в том, что нестероидных противовоспалительных лекарств очень много. Чтобы ориентироваться среди них хотя бы чуточку получше, давайте займемся классификацией этих средств.
Классификация нестероидных противовоспалительных лекарств по их эффективности
Применение НПВП при остеохондрозе и при лечении других суставных болезней способно в буквальном смысле творить чудеса. Но, к сожалению, не все препараты одинаковы по своей эффективности. Безусловными лидерами среди них можно считать: «Диклофенак», «Кетопрофен», «Индометацин», «Флурбипрофен», «Ибупрофен» и некоторые другие препараты.
Перечисленные лекарственные средства можно назвать базовыми; т. е. на их основе могут разрабатываться и поступать в аптечную сеть новые НПВП, но уже под другим измененным названием и часто по более высокой цене. Чтобы не тратить свои деньги понапрасну, изучите как следует следующую главу.
То же самое можно сказать, например, о «Метиндоле» и «Индометацине» или «Ибупрофене» и «Бруфене» и т. д. Чтобы разобраться в путанице, всегда внимательно смотрите на упаковку, ведь там обязательно должно быть указано основное действующее вещество лекарственного средства. Только написано оно будет, скорее всего, маленькими буковками.
Но это еще не все. Вернее, не все так просто! Применение НПВП-аналога какого-нибудь хорошо знакомого вам лекарства неожиданно может вызвать аллергическую реакцию или побочные действия, которые никогда ранее вами не наблюдались. В чем тут дело? Причина может крыться в дополнительных добавках, о которых, конечно же, на упаковке ничего не было написано. Значит, надо изучать еще и инструкцию.
Список аналогов известных препаратов
Мы публикуем эту небольшую шпаргалку в надежде, что она вам поможет лучше ориентироваться в многочисленных красивых аптечных упаковках. Допустим, вам немедленно требуются эффективные НПВП при артрозе, чтобы снять мучительную боль. Достаете шпаргалку и читаете следующий список:
Правила приема НПВП
Прием НПВП может сопровождаться целым рядом побочных эффектов, поэтому рекомендуется при их приеме соблюдать следующие правила:
Побочные эффекты и нестероидная гастропатия
Теперь вам предстоит узнать, что такое НПВП-гастропатия. К великому сожалению, все НПВП обладают немалыми побочными эффектами. Особенно негативно они влияют на желудочно-кишечный тракт. Больных могут беспокоить такие проявления, как Тошнота (иногда очень сильная). Изжога. Рвота. Диспепсия. Кровотечения желудочно-кишечные. Диарея. Язва двенадцатиперстной кишки и желудка.
Все вышеперечисленные неприятности и есть НПВП-гастропатия. Поэтому врачи так часто стараются назначать своим пациентам минимально возможные дозы классических нестероидных противовоспалительных лекарств. Чтобы свести к минимуму вредное воздействие на желудок и кишечник, рекомендуется никогда не принимать такие препараты на голодный желудок, а делать это только после обильного приема пищи.
Нестероидные противовоспалительные препараты нового поколения
В последние два десятилетия одновременно несколько фармкомпаний усиленно вели разработку новых современных НПВП, которые, наряду с эффективным устранением боли и воспаления, имели бы побочных эффектов как можно меньше.
О некоторых их преимуществах мы расскажем на примере «Мовалиса». Он выпускается как в традиционных таблетках (по 7,5 и 15 мг), так и в суппозиториях по 15 мг, и в стеклянных ампулах для введения внутримышечно (также по 15 мг). Действует данное лекарство очень мягко, но в то же время чрезвычайно эффективно: на весь день достаточно всего одной таблетки. Когда пациенту показано длительное лечение при тяжелых артрозах тазобедренных или коленных суставов, «Мовалис» просто незаменим.
Разные формы, в которых выпускаются НПВП
Большинство популярных нестероидных противовоспалительных средств можно приобрести и использовать не только в виде таблеток и капсул для приема внутрь, но так же и в мазях, гелях, свечах и в растворах для инъекций. И это, безусловно, очень хорошо, так как подобное разнообразие дает возможность в некоторых случаях избежать вреда при лечении с одновременным получением более быстрого лечебного эффекта.
В основном, уколы назначаются при обострении воспалительных и дегенеративно-дистрофических заболеваниях суставов и позвоночника, сопровождающихся сильной нестерпимой болью. После того как состояние пациента улучшается, становится возможным переход на таблетки и наружные средства в виде мазей.
Обычно врачи комбинируют разные лекарственные формы, решая, что и когда может принести больному наибольшую пользу. Вывод напрашивается сам: если не хотите нанести себе вред самостоятельным лечением таких распространенных недугов, как остеохондроз или артроз, обращайтесь за помощью в медицинское учреждение, именно там вам смогут помочь.
Можно ли применять НПВП при беременности
Врачи категорически не советуют принимать НПВП беременным женщинам (особенно этот запрет касается третьего триместра), а также мамочкам, которые кормят грудью. Считается, что лекарства данной группы способны отрицательно сказываться на вынашивание плода и вызывать у него различные пороки развития.
По некоторым данным, такое безобидное лекарство, по мнению многих, как «Аспирин», способно увеличивать риск выкидыша на ранних сроках. Но иногда врачи по показаниям назначают женщинам данный препарат (ограниченным курсом и в минимальных дозах). В каждом конкретном случае решение должно приниматься специалистом-медиком.
НЕСТЕРОИДНЫЕ ПРОТИВОВОСПАЛИТЕЛЬНЫЕ ПРЕПАРАТЫ
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Нестероидные противовоспалительные препараты (НПВП) представляют собой класс фармакологических агентов, терапевтическая активность которых связана с предотвращением развития или снижением интенсивности воспаления. В настоящее время существует более 50 различающихся по химической структуре лекарственных форм, классифицируемых как НПВП, которые в свою очередь подразделяются на несколько основных подкласов (таблица 1).
Н естероидные противовоспалительные препараты (НПВП) представляют собой класс фармакологических агентов, терапевтическая активность которых связана с предотвращением развития или снижением интенсивности воспаления. В настоящее время существует более 50 различающихся по химической структуре лекарственных форм, классифицируемых как НПВП, которые в свою очередь подразделяются на несколько основных подкласов ( таблица 1 ).
Таблица 1. Классификация НПВП
I. Производные кислот
1. Арилкарбоновые кислоты
• аспирин
• дифлунисал
• трисалицилат
• бенорилат
• салицилат натрия
• флуфенамовая кислота
• мефенамовая кислота
• меклофенамовая кислота
2. Арилалкановые кислоты
• диклофенак
• фенклофенак
• алклофенак
•фентиазак
Гетероарилуксусная кислота
• толметин
• зомепирак
• клоперак
• кеторолак триметамин
Индол/инден уксусные кислоты
• индометацин
• сулиндак
• этодолак
• ацеметацин
• ибупрофен
• флурбипрофен
• кетопрофен
• напроксен
• оксапрозин
• фенопрофен
• фенбуфен
• супрофен
• индопрофен
• тиапрофеновая кислота
• беноксапрофен
• пирпрофен
3. Эноликовая кислота
• фенилбутазон
• оксифенилбутазон
• азапропазон
• фепразон
• пироксикам
• изоксикам
• судоксикам
• мелоксикам
II. Некислотные производные
• тиарамид
• буфексамак
• эпиразол
• набуметон
• флуфизон
• тиноридин
• колхицин
III. Комбинированные препараты
НПВП являются одними из наиболее часто используемых в клинической практике лекарственных средств. Их назначают приблизительно 20% стационарных больных, страдающих различными заболеваниями внутренних органов.
Диапазон доз (мг/день)
Кратность приема в течение дня
Время полужизни, ч
В ревматологии НПВП наиболее часто используются по следующим показаниям:
Целесообразность широкого использования нестероидных противовоспалительных препаратов в современной клинической практике: «за» больше чем «против».
НПВП при острой боли
Важнейшей областью применения НПВП являются заболевания и патологические состояния, проявляющиеся острой болью. Как известно, болевой синдром является системным патологическим процессом, включающим местную реакцию на повреждение, передачу и восприятие болевого импульса, его психоэмоциональную оценку и ответную вегетативную и поведенческую реакцию организма. Наиболее часто в клинической практике встречается ноцицептивная боль, связанная с активацией периферических болевых рецепторов вследствие локального повреждения, вызванного травмой, хирургическим вмешательством, воспалением, отеком или ишемией ткани, стойким спазмом поперечно-полосатой или гладкой мускулатуры и др. [3,4]
В настоящее время накоплен большой клинический опыт, подтверждающий, что НПВП (такие, как кеторолак), эффективно купируют острую боль при терапевтических заболеваниях. Так, по данным двойного слепого РКИ Henderson S. и соавт. (2002), в группе из 324 больных с острой желчной коликой кеторолак при в/в введении был столь же эффективен, как опиоидный анальгетик меперидин, однако достоверно реже вызывал такие нежелательные эффекты, как тошнота и головокружение [10].
Следует отметить, что кеторолак демонстрирует столь же значимый анальгетический потенциал, как и весьма, к сожалению, популярный на постсоветском пространстве анальгетик метамизол (анальгин), использование которого ограничено во многих странах мира из-за риска непредсказуемых гематологических осложнений. Серия клинических исследований показала, что при почечной колике, после операций в пластической хирургии и стоматологии кеторолак в терапевтических дозах оказывает аналогичное (или несколько более высокое) обезболивающее действие, как метамизол в высоких дозах 13.
Использование НПВП у больных с ревматическими заболеваниями
При всех хронических воспалительных заболеваниях суставов НПВП существенно эффективнее парацетамола. Данные серии масштабных РКИ (VIGOR, CLASS, MIDAL и др.), в которых сравнивалась эффективность и безопасность различных НПВП, показали, что при ревматоидном артрите (РА) у 60-70% больных их использование достоверно уменьшает выраженность болевого синдрома и улучшает общее самочувствие [2].
При анкилозирующем спондилоартрите НПВП являются препаратом «первой линии» для купирования боли и воспаления, и имеют хорошо доказанный клинический эффект [14]. Более того, имеются единичные публикации (работа Wanders A., 2005), в которых было показано, что многолетний непрерывный прием НПВП способен замедлить прогрессирование рентгенологических изменений в позвоночнике [15].
При некоторых патологических состояниях назначение НПВП носит характер патогенетической терапии. Прежде всего, это воспалительные заболевания околосуставных мягких тканей ревматической природы, такие как плечелопаточный периартрит, тендиниты, бурситы и др. При этой патологии активное использование НПВП в качестве монотерапии достаточно часто позволяет добиться полного купирования клинической симптоматики. Классическим примером использования НПВП как патогенетического средства является лечение острого подагрического артрита, при котором назначение высоких противовоспалительных доз этих препаратов рассматривается как наиболее рациональный терапевтический подход [2].
Таким образом, совершенно очевидно, что назначение НПВП не только желательно, а прямо показано всем больным с ревматическими заболеваниями, испытывающими боли, связанные с острым или хроническим поражением опорно-двигательного аппарата. При этом рациональное применение НПВП подразумевает их длительное и непрерывное использование в адекватных противовоспалительных дозах.
Нежелательные эффекты НПВП: проблема и ее решение
Соответственно, современная концепция безопасного использования НПВП предполагает исключение грубых ошибок при назначении этих препаратов (превышение терапевтических доз и неблагоприятных лекарственных комбинаций), и выделение групп пациентов с основными факторами риска, которым НПВП должны назначаться только при условии соблюдения эффективных методов профилактики НПВП-гастропатии [20].
Классическим представителем ИПП является омепразол, профилактическое действие которого при НПВП-гастропатии доказано серией РКИ (ASTRONAUT, OPPULENT, OMNIUM). В настоящее время несомненным лидером среди гастропротекторов, применяемых в России для профилактики НПВП-гастропатии, является омез ® (омепразол), сочетающий приемлемое качество и невысокую стоимость. Последний параметр имеет очень большое значение, ведь длительность приема ИПП должна соответствовать длительности приема НПВП (перерывы в гастропротективной терапии совершенно недопустимы). Использование более дорогостоящих представителей группы ИПП в этой ситуации приводит к весьма существенным финансовым потерям, и фактически недоступно большей части пациентов.
Другим эффективным методом профилактики нежелательных эффектов со стороны ЖКТ является использование селективных ЦОГ-2 ингибиторов (селективных, с-НПВП). Этот класс лекарственных препаратов был создан специально с целью снижения риска опасных ЖКТ-осложнений, возникающих при использовании «традиционных» НПВП (неселективных, н-НПВП). В настоящее время хорошо доказано, что применение с-НПВП снижает риск развития кровотечения и перфорации язв в 2 раза, эндоскопических язв желудка и/или 12-ти перстной кишки в 3 раза, а поражения тонкого кишечника в 3-4 раза. Селективные НПВП столь же безопасны в плане развития рецидивов язв и желудочно-кишечного кровотечения, как н-НПВП в комбинации с мощными гастропротективными препаратами [20]. Поэтому назначение с-НПВП показано во всех случаях, когда пациент нуждается в противовоспалительной и анальгетической терапии, но при этом имеет факторы риска НПВП-гастропатии.
Рациональный выбор НПВП для длительного применения: нимесулид
Принципиальный подход к выбору того или иного препарата из группы НПВП в реальной клинической практике основывается на оценке баланса эффективности (в идеальном случае, сочетания быстрого анальгетического и мощного противовоспалительного действия), безопасности и доступности для пациента. Весьма удачным сочетанием указанных свойств, на наш взгляд, обладает представитель семейства селективных ЦОГ-2 ингибиторов нимесулид, являющийся на сегодняшний день одним из наиболее востребованных НПВП в России.
Молекула нимесулида была синтезирована в биохимической лаборатории ЗМ (подразделение Riker Laboratories) доктором G.Moore, и лицензирована в 1980 г. швейцарской фирмой Helsinn Healthcare SA. На фармакологическом рынке нимесулид появился в 1985 г. в Италии (там этот препарат остается наиболее популярным НПВП), и на сегодняшний день используется почти в 50 странах мира. По данным фирмы Helsinn Healthcare, которая постоянно отслеживает продажи своего препарата, на 2005 г. в мире было проведено около 450 млн. терапевтических курсов нимесулида [4,21].
Нимесулид обладает интересными фармакологическими особенностями, определяющими его клиническую эффективность. Его молекула, в отличие от многих других НПВП, обладает «щелочными» свойствами, затрудняющими ее проникновение в слизистую верхних отделов ЖКТ и тем самым существенно снижая риск ее контактного повреждения. В тоже время, эта особенность позволяет нимесулиду легко проникать и накапливаться в очагах воспаления в более высокой концентрации, чем в плазме крови.
Помимо основного действия (блокады ЦОГ), нимесулид проявляет ряд иных фармакологических эффектов, что определяет его высокую эффективность при лечении боли и воспаления. Это влияние на синтез важнейших провоспалительных цитокинов (интерликин-6, фактор некроза опухоли-а), блокада синтеза металлопротеиназ, антигистаминное действие, а так же блокада фермента фосфодиэстеразы IV, необходимого для активации в очагах воспаления макрофагов и нейтрофилов, ответственных за острый воспалительный ответ. [21].
Клинические исследования подтвердили быстрый и мощный обезболивающий и противовоспалительный эффект нимесулида. В работах, проведенных в Германии, нимесулид в дозе 200 мг/сутки при плечелопаточном периартрите, бурситах и тендинитах, продемонстрировал сходный (или несколько более высокий) эффект в отношении купирования боли и восстановления функции, по сравнению с высокими дозами «традиционных» НПВП (диклофенак 150 мг/сутки и напроксен 1000 мг/сутки) [24,25].
Нимесулид является эффективным средством для лечения больных с дорсопатиями, в частности, острой болью внизу спины. Так, результаты исследования, проведенного в Финляндии (n=102), показали, что при данной патологии нимесулид в дозе 200 мг/сутки превосходил ибупрофен в дозе 1800 мг/сутки, как по выраженности обезболивающего эффекта, так и по восстановлению функции позвоночника [26].
Особое значение имеют российские данные, подтвердившие высокую эффективность нимесулида при лечении острого подагрического артрита. Интересно, что использование этого препарата позволяло купировать основные симптомы артрита даже у тех больных, у которых была недостаточно эффективна предшествующая терапия высокими дозами «традиционных» НПВП [27].
Нимесулид способен ингибировать активность металлопротеиназ, которые играют важнейшую роль в патогенезе разрушения суставного хряща, что делает перспективным использование этого препарата при остеоартрозе. Так, положительное влияние приема нимесулида на деградацию хряща у больных с ОА коленных и тазобедренных суставов (по динамике концентрации маркеров катаболизма хрящевой ткани), было продемонстрировано в работе Kullich W. и сотр. (2002) [28]. При длительном применении у больных ОА крупных суставов, как было показано в ходе масштабного клинического исследования, нимесулид столь же эффективен, как и диклофенак [29]. Следует отметить, что у пациентов с этой патологией, испытывающих выраженные суставные боли (уровень боли по ВАШ более 50 мм), симптоматический эффект нимесулида наступает существенно быстрее, чем при использовании целекоксиба и рофекоксиба [30].
В настоящее время Институт Ревматологии РАМН проводит длительное (12-ти месячное) исследование лечебного действия и переносимости нимесулида у больных с остеоартрозом, имеющих комбинацию гастроинтестинальных и кардиоваскулярных факторов риска.
В российском исследовании эффективности НПВП при раннем артрите, результаты которого были представлены выше, было показано, что язвы и множественные эрозии желудка или 12-ти перстной кишки на фоне приема нимесулида были выявлены у 2 (1.3%), а среди принимавших диклофенак у 7 (5.9%) (р=0.042) [31].
Мы проводили собственное исследование безопасности нимесулида у больных с высоким риском ЖКТ-осложнений. Согласно плану исследования, нимесулида в дозе 200 мг назначался 20 больным, непосредственно перед этим проходившим курсовое противоязвенное лечение по поводу язвы или множественных (более 10) эрозии желудка и/или 12-ти перстной кишки, возникшие на фоне приема других НПВП. Контроль составили 20 больных, которым после заживления НПВП-гастропатии назначался диклофенак 100 в ректальных свечах. Число рецидивов язв через 2 месяца наблюдения возникло лишь у 1 больного на нимесулиде (5.6%) и у трети больных (33.3%), получавших диклофенак (р ® ), которое не ложится серьезным финансовым бременем на больных с небольшим достатком, представляется выходом из данной ситуации.
К вопросу о гепатотоксичности нимесулида
На наш взгляд, приведенные выше соображения определяют целесообразность широкого использования нимесулида, выгодно сочетающего высокую эффективность, относительную безопасность в отношении риска серьезных ЖКТ-осложнений, а также доступность для широкого круга пациентов.
Необходимо сразу отметить, что вопрос о гепатотоксичности нимесулида поднимается не в первый раз. В 2003 г. медицинские контролирующие органы ряда европейских стран, первой из которых была Финляндия, заявили о приостановке продаж нимесулида вследствие появившихся сообщений о серьезных нежелательных эффектах со стороны печени. Однако впоследствии EMEA (общеевропейский орган по надзору за лекарственными средствами), тщательно рассмотрев вопрос о безопасности нимесулида, принял решение, что гепатотоксичность этого препарата не выше, чем других НПВП, и определил возможность продолжения использования этого препарата в странах Евросоюза [42].
Данная проблема заслуживает серьезного и непредвзятого обсуждения. Возьмем на себя смелость заявить, что большое общемедицинское значение проблемы гепатотоксических реакций при использовании НПВП вызывает сомнение. Это достаточно редкая патология, частота которой (примерно 1 эпизод на 10 тыс. больных), несопоставима с частотой опасных осложнений со стороны ЖКТ [43]. Кроме того, на популяционном уровне печальное первенство среди лекарств, ответственных за тяжелые печеночные осложнения (прежде всего по числу летальных исходов), уверенно принадлежит «безопасному» парацетамолу, а вовсе не НПВП [44]. Так, в ходе исследования, проведенного в нескольких медицинских центрах США, было показано, что из 662 эпизодов острой печеночной недостаточности, наблюдавшихся за период с 1998 по 2003 гг., 275 (42%) были связаны с приемом парацетамола. 74 больных (27%) скончались от данного осложнения, а 23 (8%) перенесли пересадку печени. Важно отметить, что у 131 больного тяжелые гепатотоксические реакции не были связны с суицидальными попытками, и парацетамол у большинства из них использовался для лечения острого или хронического болевого синдрома [45].
Что касается нимесулида, то по официальным данным компании Helsinn Healthcare SA, во всем мире с 1985 по 2001 гг. (за 16 лет!) для этого препарата было зафиксировано всего 192 значимых осложнений со стороны печени, причем серьезными были признан лишь 81 эпизод. Учитывая, что к этому времени нимесулидом было пролечено 280 млн. больных, суммарная частота гепатотоксических реакций составляет 0.1 на 100.000 курсов терапии [46,47].
Необходимо заметить, что решение IMB обосновывалось 53 эпизодами гепатотоксических реакций (за 12 лет использования нимесулида в Ирландии), 9 из которых привели к развитию острой печеночной недостаточности, закончившейся летальным исходом у 4-х больных.
Результаты проспективных исследований эффективности и переносимости нимесулида показывают, что изменения лабораторных биохимических показателей, свидетельствующих о патологии печени, встречаются не чаще, чем при использовании других НПВП. Так, при использовании нимесулида коротким, не более 30 дней, курсом, повышение АЛТ и АСТ в 2 и более раз отмечается лишь у 0.4% больных. При длительном приеме препарата (до года) частота выявления подобных изменений не превышает 1.5% [47].
В цитированном выше исследовании эффективности высоких доз НПВП при раннем ревматоидном артрите, было показано, что повышение АЛТ более чем в 2 раза у пациентов, получавших нимесулид 400 мг в течение 4 недель (n=72), отмечалось лишь у 4.2% (4.8% при использовании диклофенака 200 мг). При этом следует учесть, что у 12.5% из этих пациентов исходно имелась сопутствующая патология гепатобилиарной системы [31].
Большое значение для оценки реальной гепатотоксичности нимесулида может дать российский опыт использования данного препарата при подагрическом артрите, ведь больные подагрой могут считаться группой лиц с высоким риском развития патологии печени. У них наблюдаются метаболические нарушения, исходное поражение печени и желчного пузыря (жировой гепатоз, желчно-каменная болезнь), алиментарные нарушения (прием пищи, содержащей большое количество жиров), злоупотребление алкогольными напитками.
Таким образом, объективный анализ имеющихся на сегодняшний день данных не подтверждает гипотезу о более высокой, нежели у других НПВП, гепатотоксичности нимесулида. Следует добавить, что за весь период использования нимесулида в России (около 10 лет) в российской медицинской прессе не было представлено ни одного описания серьезных осложнений со стороны печени, вызванных этим препаратом.
Кроме того, не вызывает сомнения, что ограничение использования нимесулида негативно скажется на больных, страдающих ревматическими заболеваниями. Особенно из-за этого пострадает большое число людей из малообеспеченных и социально незащищенных групп населения. Преобладающий контингент среди этих пациентов составляют лица пожилого возраста, имеющие множественную сопутствующую патологию (а значит, неизбежное сочетание факторов риска ЖКТ- и кардиоваскулярных лекарственных осложнений), для которых недорогой, достаточно безопасный (в плане наиболее частых побочных эффектов) и качественный генерик нимесулида найз ® является фактически единственной возможностью получать эффективную противовоспалительную и обезболивающую терапию.
Нестероидные противовоспалительные препараты
Нестероидные противовоспалительные препараты (НПВП) – группа негормональных препаратов, оказывающих противовоспалительное действие.
Наиболее часто в детской практике используются препараты, перечисленные ниже.
Аспирин, анальгин, диклофенак, ибупрофен, кетопрофен, напраксен, пироксикам, мелоксикам, нимесулид
Выпускаются в таблетках, капсулах, растворах для инъекций, мазей, гелей, суппозиториях (свечи).
Что такое нестероидные противовоспалительные препараты и как они действуют?
НПВП оказывают противовоспалительное, обезболиваюющее и жаропонижающее действие. Главным механизмом действия является торможение образования простагландинов. Простагландины — это тканевые гормоны, которые способствуют развитию воспаления и сопровождающей его боли.
Для чего используют нестероидные противовоспалительные препараты?
Препараты предназначены для облегчения болей различного характера.
Нестероидные противовоспалительные препараты показаны при воспалительных заболеваниях суставов (ревматоидный артрит, ревматизм, анкилозирующий спондилит, хронический подагрический артрит), дегенеративных заболеваниях (деформирующий остеоартроз, остеохондроз), люмбаго, ишиасе, невралгии, миалгии, заболеваниях внесуставных тканей (тендовагинит, бурсит, ревматическое поражение мягких тканей), посттравматическом болевом синдроме, сопровождающемся воспалением, послеоперационных болях, остром приступе подагры, приступах мигрени, почечной и печеночной колике, инфекциях ЛОР-органов, остаточных явлениях пневмонии. Местно — травмы сухожилий, связок, мышц и суставов (для снятия боли и воспаления при растяжениях, вывихах, ушибах), локализованные формы ревматизма мягких тканей (устранение боли и воспаления).
Что нужно сообщить врачу перед началом лечения нестероидными противовоспалительными препаратами?
Каковы правила приема нестероидных противовоспалительных препаратов?
Что делать если вы пропустили прием препарата?
Что нужно, чтобы лечение было эффективным и безопасным?
Какие проблемы может вызвать прием нестероидных противовоспалительных препаратов?
Как правильно хранить нестероидные противовоспалительные препараты?
Как выбрать противовоспалительное?
Нестероидные противовоспалительные средства (НПВС) — одна из самых распространенных групп лекарств. Они используются практически везде: в неврологии, ревматологии, терапии, гинекологии, хирургии и анестезиологии. Многие противовоспалительные можно купить без рецепта, поэтому они так популярны в домашней практике и часто применяются без назначения врача. Рассказываем как они работают, как их использовать и как понять, какое именно противовоспалительное нужно.
Что это и как работает
Независимо от группы и формы выпуска, НПВС всегда имеет три фармакологических эффекта: противовоспалительный, обезболивающий и жаропонижающий. Чтобы понять механизм действия, нужно кое-что знать о воспалении и боли.
Воспаление — это последовательное выделение химических веществ. Одно из них — циклооксигеназа первого и второго типа (ЦОГ-1 и 2), которая играет ключевую роль в синтезе простагландинов, активных веществ, которые расширяют местные сосуды, вызывают отек, боль и повышают температуру, то есть развивают типовые признаки воспаления.
Физиологическое действие НПВС заключается в том, что они блокируют выработку циклооксигеназы, тем самым не дают простагландинам синтезироваться и вызвать реакции воспаления. Либо, если оно уже есть, НПВС подавляют его.
По воздействию они бывают трех видов:
Это принципиальное и важное в клинической практике разделение. Дело в том, простагландины — это не только воспалительные вещества, но еще и фактор защиты желудка: там они снижают секрецию кислоты и увеличивают продукцию слизи.
Получается, что при применении неселективных НПВС подавляется выработка не только «воспалительных» простагландинов, но еще и физиологических — в желудке, из-за чего нередко возникают побочные эффекты: боль в животе, тошнота, диарея, вздутие, вплоть до язвы и желудочного кровотечения. Именно поэтому врачи, назначая неселективные препараты, подчас добавляют в курс блокаторы протонного насоса (например, омепразол), которые снижают секрецию желудочной кислоты и защищают желудок от вредного действия НПВС.
«Частый побочный эффект противовоспалительных — эрозивно-язвенные поражения органов ЖКТ. К счастью, у врача достаточно средств, чтобы свести к минимуму повреждение желудка, — делится опытом невролог GMS Clinic Сергей Макаров. При курсовом приеме НПВС для лечения, например, обострения боли в спине, пациентам с риском развития побочных эффектов назначают ингибиторы протонной помпы — средства, которые уменьшают выработку соляной кислоты в желудке. Для предотвращения повреждения желудка необходим дополнительный прием ингибиторов протонной помпы утром за 30 мин до завтрака. Курс приема обычно определяется лечащим врачом».
Любой НПВС может быть потенциально токсичен, особенно при хронических заболеваниях печени, почек и сердечно-сосудистой системы. Также вероятность осложнений увеличивается при бесконтрольном приеме — без назначения и наблюдения врача, и при превышении дозы и длительности применения, которые указаны в инструкции. Чтобы прием противовоспалительных не повредил организму, он должен быть согласован с лечащим врачом, который знает о хронических патологиях пациента.
Какие бывают
Их выпускают в таблетках, капсулах, суппозиториях, суспензиях, растворах для инъекций, мазях и гелях. Каждая из форм предназначена для чего-то конкретного, например, мазь — для лечения растяжения связок, инъекцию — когда нужна «ударная» доза, таблетки и капсулы, например, при лихорадке или умеренном болевом синдроме, а суппозитории, или «свечи», при воспалительных заболеваниях прямой кишки и женских половых органов, или когда из-за тошноты и рвоты нет возможности принять таблетку.
Продолжение статьи Вы можете прочитать по ссылке на ФОРМА — блог СБЕР ЕАПТЕКИ.
НПВП – что изменилось за последние 10 лет?
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Нестероидные противовоспалительные препараты (НПВП), имеющие более чем 50-летнюю историю, являются самыми востребованными препаратами в современном мире. При общей тенденции к старению человеческого общества растет и число пациентов, нуждающихся в применении НПВП [1]. В класс традиционных НПВП в настоящее время входят более 20 препаратов, близких по химической структуре, но различающихся между собой по силе анальгетического действия и частоте побочных эффектов. В соответствии с рекомендациями ВОЗ при назначении обезболивающих препаратов должна оцениваться степень болевых ощущений. Общеизвестно, что НПВП – эффективное средство патогенетической терапии острой или хронической боли, которое используется миллионами пациентов в мире. По статистике ВОЗ, данный показатель составляет почти 30 млн человек, среди них 40% – лица пожилого возраста, и эта цифра постоянно растет [2]. Высокая инвалидизация лиц трудоспособного возраста вследствие поражений опорно-двигательного аппарата возводит проблему применения НПВП в лечении остеоартоза (ОА) в ранг актуальных. ОА страдает 10–12% населения Земли [3]. Заболевание коррелирует с возрастом, чаще развивается после 30–35 лет, а в возрасте 60 лет и старше встречается в 97% случаев. По данным ревматологов Европы и США, на долю этого заболевания приходится до 69–70% в структуре всех ревматических болезней [4]. Среди больных, страдающих заболеваниями опорно-двигательного аппарата, артериальная гипертензия (АГ) регистрируется более чем у 1/3 пациентов.
Известно, что неселективные ингибиторы циклооксигеназы (ЦОГ), т. е. все классические НПВП, способны повышать АД вследствие влияния на простагландины (ПГ) почек и снижать эффективность большинства антигипертензивных препаратов: β-блокаторов, ингибиторов ангиотензинпревращающего фермента, диуретиков (за исключением блокаторов Са-каналов). Ингибиторы ЦОГ-2 не влияют на АД и эффективность лекарственных средств для снижения АД. В таблице 1 приведена классификация НПВП по селективности в отношении ЦОГ [5].
Для всех представителей группы НПВП характерны побочные эффекты, которые являются следствием блокады фермента ЦОГ. Анальгетическое и противовоспалительное действие НПВП связано с подавлением функции «индуцируемой» формы данного фермента ЦОГ-2, который отвечает за гиперпродукцию ПГ – важнейших медиаторов боли и воспаления в зоне патологического процесса. Селективные ингибиторы ЦОГ-2 (нимесулид, мелоксикам) уступают в проявлении прямых эффектов неселективным НПВП, но в своих побочных реакциях менее агрессивны в отношении ЖКТ. Значительный риск развития осложнений со стороны сердечно-сосудистой системы (ССС) возникает у лиц, принимающих высокоселективные ингибиторы ЦОГ-2 (коксибы – целекоксиб, эторикоксиб) [6].
Серьезной проблемой, являющейся предметом общеевропейской дискуссии, остается оценка реального риска развития нежелательных реакций при длительном использовании НПВП, вследствие чего их терапевтическая ценность может быть существенно ограничена [1]. Традиционно на первое место среди этих осложнений ставят НПВП-гастропатию – специфическую патологию верхних отделов ЖКТ, характеризующуюся появлением эрозий слизистой оболочки, язв и гастроинтестинальных катастроф: кровотечения и перфорации [7]. «Гастропатия, вызванная НПВП» – термин, который используется для описания поражений (эрозии и язв) верхних отделов ЖКТ как наиболее частого нежелательного побочного действия НПВП [8]. Такая гастропатия обладает характеристиками, отличающими ее от стандартного пептического поражения: наблюдается в основном в антральном отделе и препилорической области, поражает чаще всего лиц пожилого возраста, в частности, женщин, характеризуется бессимптомным течением, представляя большую опасность [9]. По данным 1990-х гг., больные, регулярно получавшие НПВП, погибали от ЖКТ-кровотечений в 2–3 раза чаще в сравнении с людьми, не принимающими каких-либо препаратов этой лекарственной группы [7]. По оценкам, поражения ЖКТ встречаются почти у 25% пациентов, вызывая язвы у 40% из них и повышая риск развития кровотечения, госпитализации и смертельного исхода [10].
Для того чтобы избежать или минимизировать негативное воздействие НПВП на гастродуоденальную слизистую оболочку, используются 2 подхода: 1) совершенствуют сами НПВП с целью сделать их более безопасными; 2) сочетают НПВП с антисекреторными средствами (ингибиторами протонной помпы (ИПП)) или синтетическими аналогами ПГ (табл. 2) [11]. Согласно рекомендациям Американской ревматологической ассоциации (2002), при высоком риске возникновения повреждения слизистой оболочки гастродуоденальной зоны на фоне приема НПВП (2 и более факторов риска, осложнения в анамнезе) необходимо вместо классических (неселективных) НПВП назначать селективные ингибиторы ЦОГ-2 в комбинации с ИПП, при наличии 1-го фактора риска можно ограничиваться только селективным ингибитором ЦОГ-2, а при низком риске (факторов риска нет) применять классические НПВП [8].
В последние годы принципиальное значение в оценке безопасности НПВП придается риску развития опасных осложнений со стороны ССС: инфаркта миокарда, внезапной коронарной смерти и ишемического инсульта (кардиоваскулярные катастрофы). Подавляющее большинство эпизодов серьезных ЖКТ-осложнений, возникающих на фоне приема НПВП, отмечается у больных с так называемыми факторами риска, важнейшими среди которых считаются: пожилой возраст (старше 65 лет), язвенный анамнез, особенно осложненные язвы, прием высоких доз НПВП или одновременный прием НПВП и ангиагрегантов и/или антикоагулянтов, тяжелые сопутствующие заболевания и т. д. При этом оценка факторов риска производится с учетом их градации для каждого пациента индивидуально (табл. 3, 4).
Проведено крупномасштабное исследование по оценке частоты ЖКТ-осложнений при применении НПВП за период 2001–2008 гг. в районе Фриули – Венеция – Джулия (Италия) [13]. Цель исследования: информация о риске развития осложнений со стороны верхних отделов ЖКТ у пациентов, принимающих нимесулид – наиболее распространенный НПВП в Италии. В рамках контроля лекарственного препарата нимесулид со стороны европейских регуляторных органов проведена оценка риска, связанного с применением нимесулида и других НПВП, по сравнению с риском у пациентов, не принимающих данные лекарственные препараты. В исследовании приняли участие 588 827 пациентов, имевшие в общей сложности 3 623 341 назначение НПВП, и, как оказалось, нимесулид был самым популярным препаратом. Коэффициент частоты развития поражения верхних отделов ЖКТ снизился на 50% с 2001 по 2008 г.: 4,45 случая на 1 тыс. пациентов-лет в 2001 г. против 2,21 случая на 1 тыс. пациентов-лет в 2008 г. В исследовании представлены данные относительного риска (ОР) развития поражения при применении НПВП, который в среднем равен 3,28; у таких препаратов, как рофекоксиб, целекоксиб, нимесулид ОР ОР>2; у препаратов кетопрофен, пироксикам – ОР≥5. Значения коэффициента частоты развития поражения верхних отделов ЖКТ в районе Фриули – Венеция – Джулия между 2001 и 2008 г. снизились приблизительно на 50%. Таким образом, был сделан вывод, что нимесулид характеризуется низким или средним интервалом значений ОР.
В отличие от большинства НПВП нимесулид селективно ингибирует «провоспалительную» изоформу ЦОГ–2 и в меньшей степени влияет на «физиологическую» ЦОГ–1 [7], он является первым из синтезированных селективных ингибиторов ЦОГ-2 (табл. 1) [14]. Одновременное ингибирование ЦОГ-1 и ЦОГ-2, свойственное другим НПВП, значительно сужает спектр их применения из-за возможных побочных действий со стороны ЖКТ. Еще одним преимуществом при назначении нимесулида является его некислотное происхождение (в молекуле нимесулида карбоксильная группа заменена сульфонанилидом), что обеспечивает дополнительное защитное действие на слизистую оболочку ЖКТ. Основное преимущество перорального приема нимесулида – его лучшая, по сравнению с другими НПВП, переносимость [5]. В частности, при применении нимесулида намного реже развивались побочные эффекты, связанные с ЖКТ, что, вероятнее всего, обусловлено его селективностью к ЦОГ-2. Нимесулид оказывает противовоспалительное, анальгезирующее, жаропонижающее действие. Существенным фактором безопасности нимесулида является наличие антибрадикининового и антигистаминного действия, что так же важно в послеоперационном периоде, как и противовоспалительное действие [15]. В таблице 5 представлены данные о частоте повреждений слизистой ЖКТ, выявленных у больных в Институте ревматологии РАМН за период 2000–2005 гг. [16].
Характерной особенностью нимесулида является низкий по сравнению с традиционными НПВП риск развития гастропатий [17]. А.Е. Каратеевым и соавт. [5] проведен ретроспективный анализ частоты эрозивно-язвенных осложнений ЖКТ при приеме диклофенака и ЦОГ-2 селективных НПВП у больных ревматическими заболеваниями, получавших стационарное лечение в Институте ревматологии РАМН в период с января 2002 по ноябрь 2004 г. Продемонстрировано более редкое возникновение множественных эрозий и язв при приеме ЦОГ-2 селективных НПВП, особенно при наличии язвенного анамнеза. Наиболее редко поражения ЖКТ развивались именно при приеме нимесулида [18].
Итак, нимесулид – селективный НПВП с хорошим профилем безопасности стал лидером среди назначаемых НПВП в России за последние 10 лет. Многочисленные отечественные и зарубежные исследования показали, что при применении нимесулида наблюдается низкий риск развития побочных эффектов как со стороны ЖКТ, так и со стороны ССС.
На сегодняшний день по-прежнему сохраняется актуальность поиска «безопасных» НПВП. Годовая стоимость лечения поражений ЖКТ равна приблизительно 134 долларам США для пациентов, не получающих лечения с применением НПВП, 180 долларам для тех, кто принимает НПВП эпизодически, и 244 долларам для пациентов, постоянно принимающих НПВП (на 1996 г.); чрезмерные затраты системы здравоохранения, вызванные нежелательными эффектами НПВП, достигли почти 500 млн долларов (на 1998 г.) [10]. Полученные данные свидетельствуют о том, что при определении истинной стоимости НПВП следует также учитывать расходы, связанные с лечением поражений желудка и двенадцатиперстной кишки [10].
С целью повышения безопасности НПВП были созданы молекулы действующих веществ, содержащих NO-группу. Попытка уменьшения количества побочных действий НПВП на ЖКТ и ССС заключалась в связывании НПВП с донором оксида азота (NO), ингибирующего ЦОГ. NO обеспечивает сохранность слизистой оболочки желудка и поддерживает сердечно-сосудистый гомеостаз [19]. Интерес к NO в связи с назначением НПВП обусловлен физиологическими свойствами этой небольшой молекулы, имеющей широкий спектр разнообразных эффектов воздействия на органы и ткани [8]. С действием NO связывают процессы замедления агрегации тромбоцитов и миграции нейтрофилов через сосудистую стенку, расслабление гладкомышечных клеток интимы сосудов, неоангиогенез, неонейрогенез и др. В области воспаления и повреждения ткани NO способен выступать в «негативной» роли медиатора боли, вызывающего сенситизацию и прямую стимуляцию ноцицепторов [20]. Для слизистой оболочки желудка NO выступает как фундаментальный фактор защиты, который «дублирует» протективные свойства ПГ и оказывает с ними однонаправленный эффект. NO стимулирует секрецию слизи, регулирует микроциркуляцию, ингибирует адгезию лейкоцитов к эндотелию. NO – важнейший компонент эндогенной системы слизистой оболочки желудка, двенадцатиперстной и тонкой кишок, защищающий от повреждений, поддерживающий целостность структуры и функции ЖКТ посредством увеличения слизеобразования, секреции бикарбоната, кровотока и снижения провоспалительной активации клеточного состава. Стимулирующий эффект NO на секрецию слизи является важным процессом, обеспечивающим восстановление слизистой оболочки желудка при развитии повреждений ее поверхности [21].
Использование протективных свойств NO для повышения безопасности НПВП послужило основанием для создания на основе неселективного НПВП толметина препарата амтолметин гуацил (АМГ), обладающего гастропротективными свойствами. АМГ – продукт комбинаторной химической технологии, объединившей толметин с аминокислотой глицином и гваяколом, который, ингибируя ЦОГ-1 и ЦОГ-2, нарушает метаболизм арахидоновой кислоты и уменьшает образование ПГ (в т. ч. в очаге воспаления) [22]. За счет механизмов ингибирования ЦОГ АМГ оказывает противовоспалительное, анальгезирующее, жаропонижающее, десенсибилизирующее действие [23]. Защитное действие АМГ на слизистую оболочку желудка реализуется путем стимуляции рецепторов капсаицина (ванилоидные рецепторы), присутствующих в стенках ЖКТ. В составе АМГ присутствует ванилиновая группа [24], за счет чего он стимулирует капсаициновые рецепторы, опосредованно вызывая высвобождение гастроинтестинальных пептидов, включая пептид, кодируемый геном кальцитонина (CGRP), что приводит к увеличению синтеза NO [25]. Фармакологические преимущества препарата АМГ (препарат Найзилат®) в отличие от других НПВП определяются повышением активности NO в слизистой ЖКТ. В самой структуре АМГ заложен защитный эффект для гастродуоденальной слизистой оболочки, который компенсирует ослабление защиты за счет снижения уровня эндогенных ПГ при ингибировании ЦОГ [8].
Результаты проведенного анализа свидетельствуют о том, что АМГ характеризуется, наряду с лучшим профилем переносимости по сравнению с другими НПВП, возможностью экономии затрат. Первый проведенный анализ показал, что, независимо от тяжести поражений и рассматриваемого препарата сравнения, применение АМГ позволяет использовать меньше ресурсов здравоохранения, что приводит к экономии затрат [10]. Зарегистрированное преимущество АМГ перед другими НПВП объясняется еще и тем, что применение АМГ позволяет предупредить возникновение тяжелых поражений (4 степени), вследствие которых пациенты нуждаются в стационарном лечении.
Метаанализ ранних (до 1999 г.) результатов рандомизированных контролируемых клинических исследований, в которых сообщается о желудочной переносимости АМГ в сравнении с другими НПВП при лечении ОА, ревматоидного артрита (РА) и патогенетически связанных с ними заболеваний, показал отсутствие данных о развитии токсических изменений в желудке или почках (на животных моделях), и, наоборот, получены данные о защитном действии на желудочную стенку [26]. Результаты представленного систематического обзора литературы относительно переносимости АМГ в сравнении с другими НПВП, в т. ч. с наиболее часто используемыми лекарственными препаратами данной группы, показывают, что частота случаев с нежелательными реакциями и ранним прекращением лечения значительно ниже у пациентов, которые принимали АМГ, чем у применявших другие НПВП.
В ряде рандомизированных доклинических исследований на экспериментальных моделях (крысы, мыши) была оценена эффективность АМГ и его метаболитов, изучены механизмы влияния на слизистую оболочку желудка и двенадцатиперстной кишки, показаны гастропротекторные эффекты. Так, в гистологических исследованиях на крысах [23, 27–29] было продемонстрировано, что толметин, в отличие от классических НПВП, не вызывает геморрагических или некротических повреждений даже при внутрижелудочном введении в дозах, в 6 раз превышающих дозы, необходимые для уменьшения интенсивности кожного воспаления. АМГ обладает очень низкой гастротоксичностью, обусловленной уникальным механизмом действия препарата. Кроме существенно меньшего ульцерогенного действия при приеме доз, обладающих противовоспалительным эффектом, АМГ защищает слизистую оболочку желудка от раздражающего действия этанола. Считается, что гастропротективный эффект в основном зависит от выработки NO в слизистой оболочке желудка за счет активации индуцибельной изоформы NO-синтазы [23].
Дана оценка гастропротекторных свойств и механизмов АМГ и его метаболитов (MED15) у мышей [30]. Для создания биологической модели и оценки гастропротективных свойств у экспериментальных животных вызывали повреждение слизистой оболочки желудка этанолом. В эксперименте животные в выделенных методом рандомизации группах принимали АМГ в дозах 75, 150 и 300 мг/кг соответственно, толметин – 90 мг/кг, группа контроля была без лекарственной нагрузки. При электронной микроскопии при помощи биохимических методов в слизистой желудка были измерены содержание NO, малондиальдегида, NO-синтетазы и супероксиддисмутазы, тканевых гомогенатов. При повторном назначении АМГ (75, 150 и 300 мг/кг) в течение 7 дней каких-либо повреждений слизистой желудка, индуцированных этанолом, не было выявлено, достоверных отличий от группы контроля нет; в группе толметина (90 мг/кг), напротив, отмечено заметное повреждение слизистой оболочки желудка по сравнению с контрольной группой. Авторы исследования пришли к выводу, что при назначении АМГ (150 и 300 мг/кг) не только существенно возросла активность супероксиддисмутазы, но и, очевидно, снизилось содержание малондиальдегида в гомогенатах желудка мышей.
В другом исследовании на биологических моделях (крысы), целью которого было определить, влияет ли предварительное применение АМГ на изменения в перекисном окислении липидов (ПОЛ) и антиоксидантных ферментных и неферментных защитных системах, которые считаются одной из причин повреждений толстой кишки и желудка, вызванных применением индометацина, этанола и 2,4,6-тринитробензолсульфоновой кислотой (ТНБС) [28]. В исследовании использовались препараты: АМГ, толметин, диклофенак, индометацин и целекоксиб. Согласно протоколу, животные получали перорально АМГ (100 мг/кг), толметин (60 мг/кг), диклофенак (10 мг/кг), целекоксиб (40 мг/кг) или индометацин (20 мг/кг) – все в виде суспензии в 1% карбоксиметилцеллюлозе; тринитробензолсульфоновую кислоту (ТНБС) (30 мг/кг) растворяли в 0,25 мл 30% этанола. По результатам исследования сделан вывод о том, что АМГ эффективно способствовал улучшению изменений, вызванных ТНБС, в ПОЛ и антиоксидантных защитных системах в слизистой оболочке желудка и толстой кишки. Кроме того, в отличие от толметина, АМГ ассоциировался с улучшениями в антиоксидантных защитных системах. Благоприятное влияние АМГ в отношении патологии, индуцированной свободными радикалами кислорода, указывает на возможность того, что в этом механизме может быть задействована антиоксидантная активность [28].
В одном из клинических исследований [31] дана сравнительная оценка эффективности и безопасности АМГ и целекоксиба у больных РА. В исследование вошли 235 больных РА (180 из них закончили исследование): пациенты основной группы (n=85) получали АМГ в дозировке 600 мг 2 р./сут, пациенты группы сравнения (n=95) – целекоксиб 200 мг/сут в течение 24 нед. Эффективность терапии РА оценивалась по индексу Американской коллегии ревматологов. Лекарственные препараты имели сопоставимую эффективность при оценке динамики показателей на 4-й, 12-й и 24-й нед. лечения. В сравниваемых группах не получено достоверных различий при анализе данных ЭГДС, ЭКГ, в клинических анализах крови и мочи, при оценке побочных эффектов и гастроинтестинальных симптомов. Таким образом, данное исследование продемонстрировало одинаковую эффективность и безопасность (в особенности для ЖКТ) как АМГ, так и селективного ингибитора ЦОГ-2 – целекоксиба.
В контролируемых рандомизированных клинических исследованиях показано, что противовоспалительное и обезболивающее действие АМГ эквивалентно эффектам прочих НПВП, таких как диклофенак, напроксен, пироксикам, толметин и других средств для лечения остеоартрита, РА. Так, в одном из исследований [9] дана оценка эффективности применения АМГ в сравнении с диклофенаком у женщин пожилого возраста (средний возраст – 60 лет) с разными патологиями костно-суставной системы (коксартроз, гонартроз, РА и др.). В исследование вошли 50 пациенток, 25 из которых получали АМГ и 25 – диклофенак. Курс лечения составил 30 дней. Режим дозирования: АМГ – в первые 3 дня по 1 таблетке (600 мг) через каждые 12 ч натощак, в остальные 27 дней – 1 таблетка натощак; диклофенак – 3 таблетки (50 мг) после приема пищи. Анализ данных подтвердил незначительное улучшение со стороны слизистой оболочки на 30-й день исследования в группе больных, принимавших АМГ, тогда как в группе принимавших диклофенак отмечено увеличение индекса Грэхема (оценка негативного влияния на слизистую желудка). В целом при приеме АМГ наблюдалось более значимое улучшение состояния (в процентном выражении) в сравнении с диклофенаком: 79% против 54,2% соответственно.
Заключение
За последние 10 лет лидером среди назначаемых НПВП в России стал нимесулид – селективный НПВП с хорошим профилем безопасности. Многочисленные отечественные и зарубежные исследования показали, что при применении нимесулида наблюдается низкий риск развития побочных эффектов как со стороны ЖКТ, так и со стороны ССС.
Таким образом, пациентам без факторов риска можно применять неселективные НПВП, в то время как пациентам с факторами риска следует назначать селективные НПВП (в сочетании с ИПП, если факторов риска имеется более одного). Однако стоит помнить, что риск развития НПВП-гастропатии есть и в группе пациентов без факторов риска развития ЖКТ-патологии, но имеющих другие факторы-провокаторы, например, такие как курение, нерегулярное питание, стрессы, Helicobacter pylori, употребление алкоголя.
Для повышения безопасности НПВП использовали протективные свойства NO, что послужило основанием для создания на основе неселективного НПВП толметина препарата АМГ. Экспериментальные исследования показали, что АМГ не обладает ульцерогенной активностью и оказывает прямое защитное воздействие на стенку желудка. Присутствие ванильных фрагментов в молекуле АМГ (в отличие от других НПВП) индуцирует гастропротекторный эффект, что открывает новые возможности использования препарата при продолжительном лечении воспалительных заболеваний.