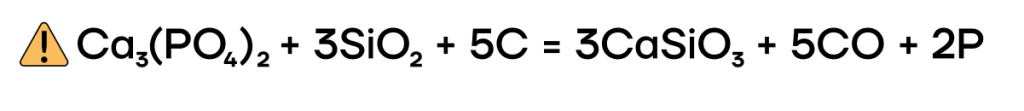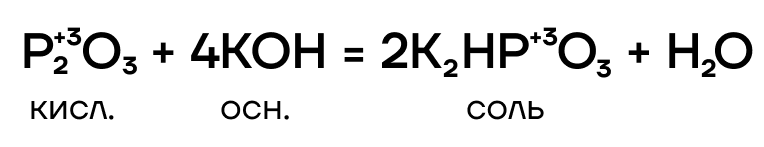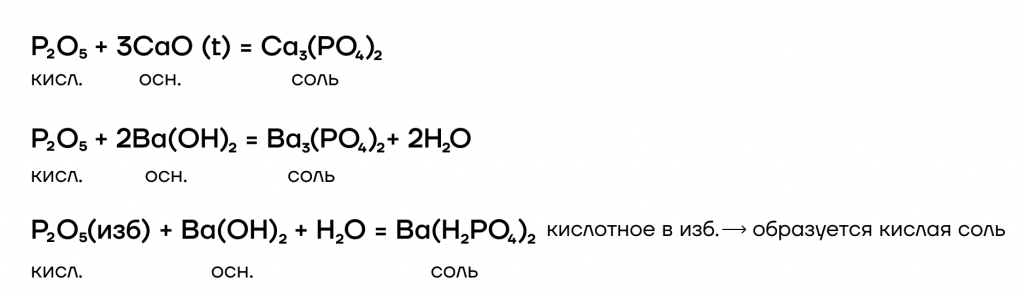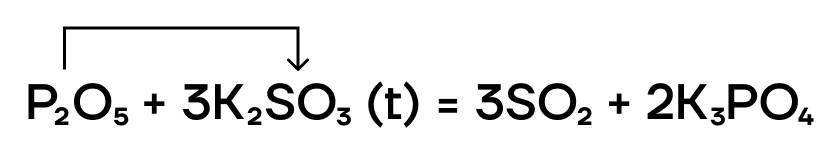P2o5 что это
P2o5 что это
Фосфорный ангидрид
Фосфорный ангидрид
| Оксид фосфора(V) | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид фосфора(V) |
| Химическая формула | P2O5 |
| Отн. молек. масса | 283.889 а. е. м. |
| Молярная масса | 283.889 г/моль |
| Физические свойства | |
| Плотность вещества | 2.39 г/см³ |
| Состояние (ст. усл.) | белый порошок |
| Термические свойства | |
| Температура плавления | 420 о С(Н-форма),569 (О-форма) °C |
| Температура кипения | возгоняется при 359 (Н-форма) °C |
| Энтальпия (ст. усл.) | -3010,1 кДж/моль |
| Химические свойства | |
| Растворимость в воде | реагирует г/100 мл |
| Классификация | |
| номер CAS | [1314-56-3] (P2O5) [16752-60-6] (P4O10) |
Пентаокс́ид фосфора (фо́сфорный ангидрид, пятиокись фосфора, оксид (V) фосфора — P2O5, кислотный оксид.
Содержание
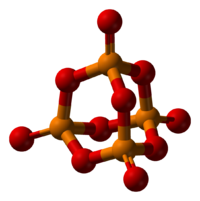
Строение
Другие модификации имеют слоистую полимерную структуру, также построенную из тетраэдров PO4, объединенные в 10-членные (О-форма) и 6-членные (О’-форма) кольца. Эти модификации имеют более высокую температуру возгонки (
580 о С) и менее химически активны. H-форма переходит в О-форму при 300-360 о C.
Свойства
P4O10 очень активно взаимодействует с водой (H-форма поглощает воду даже со взрывом), образуя смеси фосфорных кислот, состав которых зависит от количества воды и других условий:
Он также способен извлекать воду из других соединений, представляя собой сильное дегидратирующее средство:
Оксид фосфора (V) широко применяется в органическом синтезе. Он реагирует с амидами, превращая их в нитрилы:
Также взаимодействует со спиртами, эфирами, фенолами и другими органическими соединениями. При этом происходит разрыв связей P—О—P и образуются фосфорорганические соединения. Реагирует с NH3 и с галогеноводородами, образуя фосфаты аммония и оксигалогениды фосфора:
При сплавлении P4O10 с основными оксидами образует различные твердые фосфаты, природа которых зависит от условий реакции.
Получение
Оксид фосфора(V) получают сжиганием фосфора. Технологический процесс происходит в камере сжигания и включает в себя окисление элементарного P предварительно осушенным воздухом, осаждение P4O10 и очистку отходящих газов. Очищают полученный пентаоксид возгонкой.
Технический продукт имеет вид белой снегообразной массы, состоящей из смеси разных форм P4O10.
Применение
P4O10 применяют как осушитель газов и жидкостей. Также он является промежуточным продуктом в производстве ортофосфорной киcлоты H3PO4 термическим способом.
Широко используется в органическом синтезе в реакциях дегидратации и конденсации.
Литература
Полезное
Смотреть что такое «Фосфорный ангидрид» в других словарях:
ФОСФОРНЫЙ АНГИДРИД — (р2о5) оксид фосфора V (см.); белый порошок, очень гигроскопичен, с водой образует фосфорные (см.); используется как сильный осушитель газов и жидкостей. При попадании на кожу и попытке смыть его водой гарантирован сильный термохим. ожог. При… … Большая политехническая энциклопедия
фосфорный ангидрид — fosforo(V) oksidas statusas T sritis chemija formulė P₂O₅ atitikmenys: angl. phosphorus pentoxide; phosphorus(V) oxide rus. фосфора пентоксид; фосфора пятиокись; фосфора(V) оксид; фосфорный ангидрид ryšiai: sinonimas – difosforo pentoksidas … Chemijos terminų aiškinamasis žodynas
Фосфорный ангидрид — пяти окись фосфора, оксид фосфора (V) P4O10 (P2O5), ангидрид фосфорных кислот. См. Фосфора окислы … Большая советская энциклопедия
фосфорный ангидрид — пятиокись фосфора … Cловарь химических синонимов I
Ангидрид — Ангидриды в неорганической химии солеобразующие оксиды, проявляющие кислотные свойства (см. Кислотные оксиды). Ангидриды в органической химии соединения, состоящие из двух кислотных остатков (например, карбоновых или фосфиновых… … Википедия
Фосфористый ангидрид фосфорноватая окись фосфорный ангидрид — см. Фосфор … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Ангидрид — (от греч. an отрицательная частица и hýdōr вода) химическое соединение какого либо, элемента с кислородом, которое можно получить, отнимая воду от соответствующей кислоты. Известны А. как неорганических, так и органических кислот. А.… … Большая советская энциклопедия
Фосфористый ангидрид — фосфорноватая окись, фосфорный ангидрид см. Фосфор … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
пятиокись фосфора — фосфорный ангидрид … Cловарь химических синонимов I
ФОСФОРНАЯ КИСЛОТА — фосфорный ангидрид, пятиокись фосфора (химическое обозначение Р2О5), белый порошок, жадно поглощающий воду, получается при горении фосфора. По содержанию фосфорного ангидрида в фосфорных удобрениях рассчитывается количество их на 1 га при… … Сельскохозяйственный словарь-справочник
Оксид фосфора(V)
| Оксид фосфора(V) | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид фосфора(V) |
| Химическая формула | P4O10 |
| Физические свойства | |
| Состояние (ст. усл.) | белый порошок |
| Отн. молек. масса | 283.889 а. е. м. |
| Молярная масса | 283.889 г/моль |
| Плотность | 2.39 г/см³ |
| Термические свойства | |
| Температура плавления | 420 о С(Н-форма),569 (О-форма) °C |
| Температура кипения | возгоняется при 359 (Н-форма) °C |
| Энтальпия образования (ст. усл.) | -3010,1 кДж/моль |
| Химические свойства | |
| Растворимость в воде | реагирует г/100 мл |
| Классификация | |
| Рег. номер CAS | [1314-56-3] (P2O5) [16752-60-6] (P4O10) |
Пентаокс́ид фосфора (фо́сфорный ангидрид, пятиокись фосфора, оксид фосфора(V)) — P2O5, кислотный оксид.
Содержание
Строение
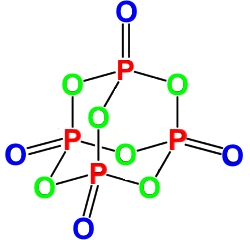
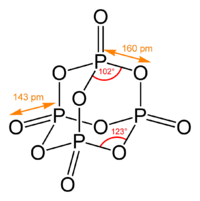
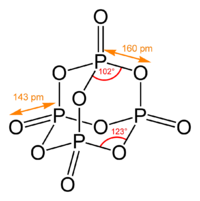
Пары оксида фосфора(V) имеют состав P4O10. Твердый оксид склонен к полиморфизму. Существует в аморфном стекловидном состоянии и кристаллическом. Для кристаллического состояния известны две метастабильные модификации пентаоксида фосфора — гексагональная Н-форма (а = 0,744 нм, = 87°, пространств, гр. R3С) и орторомбическая О-форма (а = 0,923 нм, b — 0,718 нм, с = 0,494 нм, пространств, гр. Рпат), а также одна стабильная орторомбическая О-форма (а =1,63 нм, b= 0,814 нм, с =0,526 нм, пространств. гр. Fdd2). Молекулы P2O5 (Н-форма) построены из 4 групп PO4 в виде тетраэдра, вершины которого занимают атомы фосфора, 6 атомов кислорода располагаются вдоль ребер, а 4 — по оси третьего порядка тетраэдра. Эта модификация легко возгоняется (360 о С) и активно взаимодействует с водой. Другие модификации имеют слоистую полимерную структуру из тетраэдров PO4, объединенные в 10-членные (О-форма) и 6-членные (О’-форма) кольца. Эти модификации имеют более высокую температуру возгонки (
580 о С) и менее химически активны. H-форма переходит в О-форму при 300—360 о C.
Свойства
P4O10 очень активно взаимодействует с водой (H-форма поглощает воду даже со взрывом), образуя смеси фосфорных кислот, состав которых зависит от количества воды и других условий:
Он также способен извлекать воду из других соединений, представляя собой сильное дегидратирующее средство:

Оксид фосфора(V) широко применяется в органическом синтезе. Он реагирует с амидами, превращая их в нитрилы:
Оксид фосфора(V) также взаимодействует со спиртами, эфирами, фенолами и другими органическими соединениями. При этом происходит разрыв связей P—О—P и образуются фосфорорганические соединения. Реагирует с NH3 и с галогеноводородами, образуя фосфаты аммония и оксигалогениды фосфора:
При сплавлении P4O10 с основными оксидами образует различные твердые фосфаты, природа которых зависит от условий реакции.
Получение
Оксид фосфора(V) получают сжиганием фосфора. Технологический процесс происходит в камере сжигания и включает в себя окисление элементарного P предварительно осушенным воздухом, осаждение P4O10 и очистку отходящих газов. Очищают полученный пентаоксид возгонкой.
Технический продукт имеет вид белой снегообразной массы, состоящей из смеси разных форм P4O10.
Применение
P4O10 применяют как осушитель газов и жидкостей. Также он является промежуточным продуктом в производстве ортофосфорной кислоты H3PO4 термическим способом.
Широко используется в органическом синтезе в реакциях дегидратации и конденсации.
Литература
Полезное
Смотреть что такое «Оксид фосфора(V)» в других словарях:
Оксид фосфора — Оксид фосфора: Оксид фосфора(III) Оксид фосфора(V) … Википедия
Оксид фосфора(III) — Оксид фосфора(III) … Википедия
Фосфора оксиды — Известны следующие оксиды фосфора: Название Формула Температура плавления Температура кипения Оксид фосфора(III) P2O3 (P4O6) 23.8 °C 173.5 °C Оксид фосфора(V) P2O5 (P4O10) 569 °C 591 °C … Википедия
Оксид углерода(II) — Оксид углерода(II) … Википедия
фосфора(V) оксид — fosforo(V) oksidas statusas T sritis chemija formulė P₂O₅ atitikmenys: angl. phosphorus pentoxide; phosphorus(V) oxide rus. фосфора пентоксид; фосфора пятиокись; фосфора(V) оксид; фосфорный ангидрид ryšiai: sinonimas – difosforo pentoksidas … Chemijos terminų aiškinamasis žodynas
фосфора(III) оксид — fosforo(III) oksidas statusas T sritis chemija formulė P₂O₃ atitikmenys: angl. phosphorus trioxide; phosphorus(III) oxide rus. фосфора трехокись; фосфора(III) оксид; фосфористый ангидрид ryšiai: sinonimas – difosforo trioksidas … Chemijos terminų aiškinamasis žodynas
фосфора пентоксид — fosforo(V) oksidas statusas T sritis chemija formulė P₂O₅ atitikmenys: angl. phosphorus pentoxide; phosphorus(V) oxide rus. фосфора пентоксид; фосфора пятиокись; фосфора(V) оксид; фосфорный ангидрид ryšiai: sinonimas – difosforo pentoksidas … Chemijos terminų aiškinamasis žodynas
фосфора пятиокись — fosforo(V) oksidas statusas T sritis chemija formulė P₂O₅ atitikmenys: angl. phosphorus pentoxide; phosphorus(V) oxide rus. фосфора пентоксид; фосфора пятиокись; фосфора(V) оксид; фосфорный ангидрид ryšiai: sinonimas – difosforo pentoksidas … Chemijos terminų aiškinamasis žodynas
Оксид углерода (II) — Монооксид углерода Общие Систематическое наименование Монооксид углерода Химическая формула … Википедия
фосфора трехокись — fosforo(III) oksidas statusas T sritis chemija formulė P₂O₃ atitikmenys: angl. phosphorus trioxide; phosphorus(III) oxide rus. фосфора трехокись; фосфора(III) оксид; фосфористый ангидрид ryšiai: sinonimas – difosforo trioksidas … Chemijos terminų aiškinamasis žodynas
Оксид фосфора (V)
Оксид фосфора (V) [P2O5] – соединение фосфора с кислородом, существует в виде димера P4O10 (декаоксид тетрафосфора). Наиболее употребима формула состава P2O5 (пентаоксид фосфора).
Устаревшее название – фосфорный ангидрид. Является действующим веществом всех фосфорсодержащих удобрений
Традиционно содержание Фосфора в удбрениях выражают содержанием Оксида фосфора.
Все свойства Фосфора, как питательного элемента описаны в статье Фосфор.
Химические и физические свойства
Оксид фосфора – бесцветное аморфное или стекловидное вещество, существующеев трех кристаллических, двух аморфных и двух жидких формах. [1]
Токсичное вещество. Вызывает ожоги кожи и раздражение слизистой оболочки.
Пентаоксид фосфора очень гигроскопичен. Реагирует со спиртами эфирами, фенолами, кислотами и прочими веществами. В процессе реакции с органическими веществами происходит разрыв связей фосфора с кислородом, и образуются фосфорорганические соединения. Вступает в химические реакции с аммиаком (NH3) и галогеноводородами с образованием фосфатов аммония и оксигалогенидов фосфора. С основными оксидами образует фосфаты. [3]
Трехмерная модель молекулы
Содержание пентаоксида фосфора в почве и удобрениях
Фактически в почве имеются только соли ортофосфорной кислоты H3PO4, но в сложных удобрениях могут быть и соли мета-, пиро- и полифосфорных кислот. [4]
Основой для образования ортофосфорной кислоты является пентаоксида фосфора. Именно поэтому, а так же в связи с тем, что растения не поглощают элементарный фосфор, условлено обозначать концентрацию фосфора через содержание пентаоксида фосфора. [2]
P2O5 + 3H2O → 2H3PO4
Двузамещенные соли двухвалентных катионов в воде не растворимы, но легко растворяются в слабокислых кислотах корневых выделений и органических кислотах жизнедеятельности микроорганизмов. В этой связи они так же являются хорошим источником P2O5 для растений. [4]
Поглощение пентаоксида фосфора растениями
Как указывалось выше, в природе основной источник фосфора – это соли ортофосфорнонй кислоты H3PO4. Однако после гидролиза пиро-, поли- и метафосфаты так же используются практически всеми культурами.
Гидролиз пирофосфата натрия:
Гидролиз триполифосфата натрия:
Гидролиз метафосфат иона (в кислой среде):
Некоторые растения приспособились усваивать фосфат-ион из фосфорорганических соединений (фитин, глицефосфаты и прочее). Корни данных растений выделяют особый фермент (фотофтазу), который и отщипляет анион фосфорной кислоты от органических соединений, а затем растения поглощают этот анион. К подобного рода растениям относятся горох, бобы, кукуруза. Причем фосфатазная активность возрастает в условиях фосфорного голода.
Опытным путем установлено, что поглощаемый корнями фосфор прежде всего идет на синтез нуклеотидов, а для дальнейшего продвижения в наземную часть фосфаты вновь поступают в проводящие сосуды корня в виде минеральных соединений. [4]
Рерасчет содержения фосфора в удобрениях
В некоторых случаях требуется рассчитать процентное содержание фосфора в удобрении, если дано содержание по P2O5. Расчет производится по формуле:
y = x,% × 30,974 (молярная масса P) × 2 / 30,974 (молярная масса P) × 2 + 15,999 (молярная масса O) × 5
х – содержание P2O5 в удобрении, %;
y – содержание P в удобрении, %
y = x, % × 0,43643
в удобрении содержится 40% оксида фосфора
для пересчета процентного содержания элемента фосфор в удобрении нужно умножить массовую долю оксида в удобрении на массовую долю элемента в оксиде (для P2O5 – 0,43643): 40 * 0,43643 = 17,4572 %
P2o5 что это
I. Оксид фосфора (V) – фосфорный ангидрид

Получение: Получается при горении фосфора в избытке воздуха или кислорода
Применение: Оксид фосфора (V) очень энергично соединяется с водой, а также отнимает воду от других соединений. Применяется как осушитель газов и жидкостей.
Химические свойства: Оксид фосфора (V) – это кислотный оксид, взаимодействует, подобно другим кислотным оксидам с водой, основными оксидами и основаниями.
при нагревании образуется ортофосфорная кислота H3PO4:
II. Ортофосфорная кислота
Наибольшее практическое значение имеет ортофосфорная кислота Н3РO4
Строение молекулы: В молекуле фосфорной кислоты атомы водорода соединены с атомами кислорода:
Физические свойства: Фосфорная кислота представляет собой бесцветное, гигроскопичное твердое вещество, хорошо растворимое в воде.
Получение:
1) Взаимодействие оксида фосфора (V) с водой при нагревании:
2) Взаимодействие природной соли – ортофосфата кальция с серной кислотой при нагревании:
3) При взаимодействии фосфора с концентрированной азотной кислотой
Химические свойства:
Свойства, общие с другими кислотами
Специфические свойства
1. Водный раствор кислоты изменяет окраску индикаторов на красный:
Ортофосфорная кислота диссоциирует ступенчато:
HPO4 2- ↔ H + + PO4 3- (ортофосфат-ион)
2. Взаимодействует с металлами в ряду активности до (Н2):
3. Взаимодействует с основными оксидами:
4. Взаимодействует с основаниями Ме(ОН)n:
если кислота в избытке, то образуется кислая соль:
5. Реагирует с аммиаком (по донорно-акцепторному механизму), если в избытке кислота, образуются кислые соли:
6. Реагирует с солями слабых кислот:
1. При нагревании ортофосфорная кислота постепенно превращается в метафосфорную кислоту:
Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот является реакция с нитратом серебра — образуется жёлтый осадок:
3. Играет большую роль в жизнедеятельности животных и растений. Её остатки входят в состав АТФ. При разложении АТФ выделяется большое количество энергии, что очень важно для живых организмов.
Применение:
В основном для производства минеральных удобрений.
А также, используется при пайке, для очищения от ржавчины металлических поверхностей. Также применяется в составе фреонов, в промышленных морозильных установках как связующее вещество. Ортофосфорная кислота зарегистрирована в качестве пищевой добавки E338. Применяется как регулятор кислотности в газированных напитках.
III. Минеральные удобрения
Минеральные удобрения — неорганические соединения, содержащие необходимые для растений элементы питания.
В почвах обычно имеются все необходимые растению питательные элементы. Но часто отдельных элементов бывает недостаточно для удовлетворительного роста растений. На песчаных почвах растения нередко испытывают недостаток магния, на торфяных почвах – молибдена, на черноземах – марганца и т. п. Применениеминеральных удобрений – один из основных приемов интенсивного земледелия. С помощью минеральных удобренийможно резко повысить урожаи любых культур на уже освоенных площадях без дополнительных затрат на обработку новых земель. Для внесения минеральных удобрений используются туковые сеялки.
Установлено, что в состав растений входит около 70 элементов. Некоторые из них – макроэлементы – необходимы растениям в больших количествах; другие же – микроэлементы – требуются в незначительных количествах.
1. Макроэлементы – углерод, кислород, водород, азот, фосфор, сера, магний, калий, кальций.
Тир важнейших элемента – азот, фосфор и калий – необходимы растениям в больших количествах. Поэтому удобрения, содержащие эти элементы, получают в промышленных масштабах.
При недостатке азота задерживается образование зелёной массы, растения плохо растут, их листья желтеют. Азотные удобрения необходимы растениям в весенний период.
Фосфор необходим при росте и развитии репродуктивных органов растений (цветков, плодов).
Калий ускоряет процесс фотосинтеза и содействует накоплению углеводов (сахара – в сахарной свекле, крахмала в картофеле). У злаковых он способствует укреплению стебля и тем самым устраняет их полегание.
Железо, марганец, бор и другие микроэлементы играют определённую роль в жизни растений. Так, например, при наличии микроэлемента бора растения лучше усваивают азот, фосфор, и калий.Медь, марганец и цинк ускоряют окислительно-восстановительные процессы и тем самым способствуют росту растений. Железо участвует в синтезе хлорофилла.
Минеральные удобрения содержат питательные вещества в виде различных минеральных солей. В зависимости от того, какие питательные элементы содержатся в них, минеральные удобренияподразделяют на простые и комплексные.
1) Простые минеральные удобрения содержат один какой-либо элемент питания (P,K, N). К ним относятся фосфорные, азотные, калийные и микроудобрения.
2) Комплексные минеральные удобрения содержат одновременно два или более основных питательных элемента.
IV. Тренажеры
V. Закрепление
Задание №1. Составьте уравнения реакций оксида фосфора (V) с
1. Na2O
2. NaOH
3. H2O при нагревании
4. H2O без нагревания
Для 2 реакции запишите полное и краткое ионное уравнение.
Задание №2. Составьте молекулярные и ионные уравнения реакций ортофосфорной кислоты с:
1. калием
2. оксидом калия
3. гидроксидом калия
4. сульфитом калия
Задание №4. Вычислите (в %), какое из фосфорных удобрений: двойной суперфосфат или преципитат богаче фосфором? Химические формулы удобрений найдите в схеме самостоятельно.
Оксид фосфора (V), свойства, получение, химические реакции
Оксид фосфора (V), свойства, получение, химические реакции.
Оксид фосфора (V) – неорганическое вещество, имеет химическую формулу P4O10 и P2O5.
Краткая характеристика оксида фосфора (V). Формула оксида фосфора (V) :
Оксид фосфора (V) – неорганическое вещество белого цвета.
Оксид фосфора (V) содержит четыре атома фосфора и десять атомов кислорода.
Химическая формула оксида фосфора (V) P4O10 и P2O5. Для простоты записи используют последнюю формулу.
В воде не растворяется, а взаимодействует с ней, образуя кислоты.
Модификации оксида фосфора (V):
Твердый оксид фосфора (V) склонен к полиморфизму. Существуют три формы-модификации оксида фосфора (V): H, O`, O и G формы-модификации.
| гексагональная H-форма | орторомбическая O`-форма | орторомбическая O-форма | G-форма | |
| Состояние вещества | Кристаллический вид | Кристаллический | Кристаллический вид | Стекловидный вид |
| Характер стабильности формы | Метастабильная форма | Стабильная форма | Метастабильная форма | |
| Другие характеристики | a=0,744 нм, угол = 87°, пространственная группа R3C | a=1,63 нм, b=0,814 нм, c=0,526 нм, пространственная группа Fdd2 | a=0,923 нм, b = 0,718 нм, c = 0,494 нм, пространственная группа Pnam |
H-форма переходит в O-форму при 300-360 °C (процесс заканчивается при 378 °C).
Оксид фосфора (V)
| Оксид фосфора | |
|---|---|
 | |
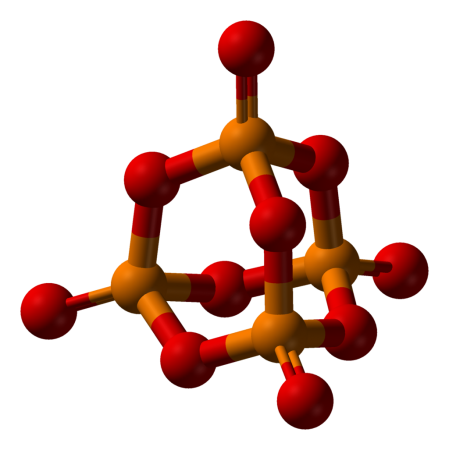 | |
| Систематическое наименование | Оксид фосфора (V) |
| Хим. формула | P2O5 |
| Состояние | белый порошок |
| Молярная масса | 141,94 г/моль |
| Плотность | 2.39 г/см³ |
| Т. плав. | 420 о С(Н-форма),569 (О-форма) |
| Т. кип. | возгоняется при 359 (Н-форма) °C |
| Энтальпия образования | -3010,1 кДж/моль |
| Растворимость в воде | реагирует |
| Рег. номер CAS | [1314-56-3] (P2O5) [16752-60-6] (P4O10) |
| PubChem | 14812 |
| SMILES | |
| RTECS | TH3945000 |
| ChEBI | 37376 |
| ChemSpider | 14128 и 21428497 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Пентаоксид фосфора, также оксид фосфора (V) (фосфорный ангидрид, пятиокись фосфора) — неорганическое химическое соединение класса кислотных оксидов с формулами P4O10 и P2O5
Содержание
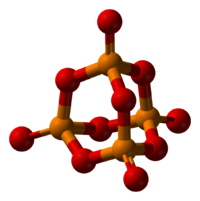
Строение
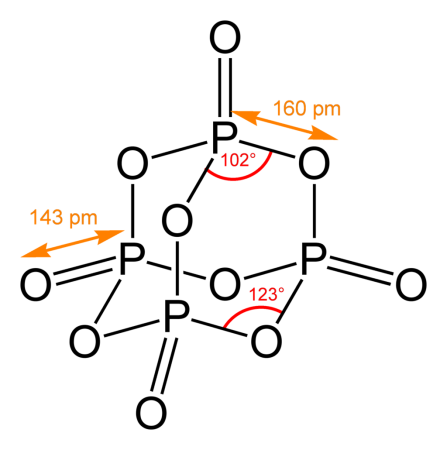
Пары оксида фосфора(V) имеют состав P4O10. Твердый оксид склонен к полиморфизму. Существует в аморфном стекловидном состоянии и кристаллическом. Для кристаллического состояния известны две метастабильные модификации пентаоксида фосфора — гексагональная Н-форма (а = 0,744 нм, = 87°, пространств, гр. R3С) и орторомбическая О-форма (а = 0,923 нм, b = 0,718 нм, с = 0,494 нм, пространств, гр. Рпат), а также одна стабильная орторомбическая О-форма (а =1,63 нм, b= 0,814 нм, с =0,526 нм, пространств. гр. Fdd2). Молекулы P4O10 (Н-форма) построены из 4 групп PO4 в виде тетраэдра, вершины которого занимают атомы фосфора, 6 атомов кислорода располагаются вдоль ребер, а 4 — по оси третьего порядка тетраэдра. Эта модификация легко возгоняется (360°С) и активно взаимодействует с водой. Другие модификации имеют слоистую полимерную структуру из тетраэдров PO4, объединенные в 10-членные (О-форма) и 6-членные (О’-форма) кольца. Эти модификации имеют более высокую температуру возгонки (
580°С) и менее химически активны. H-форма переходит в О-форму при 300—360 о C.
Свойства
P4O10 очень активно взаимодействует с водой (H-форма поглощает воду даже со взрывом), образуя смеси фосфорных кислот, состав которых зависит от количества воды и других условий:
При сильном нагревании распадается на:
Он также способен извлекать воду из других соединений, представляя собой сильное дегидратирующее средство:
Оксид фосфора(V) широко применяется в органическом синтезе. Он реагирует с амидами, превращая их в нитрилы:
Карбоновые кислоты переводит в соответствующие ангидриды:
Оксид фосфора(V) также взаимодействует со спиртами, эфирами, фенолами и другими органическими соединениями. При этом происходит разрыв связей P—О—P и образуются фосфорорганические соединения. Реагирует с NH3 и с галогеноводородами, образуя фосфаты аммония и оксигалогениды фосфора:
При сплавлении P4O10 с основными оксидами образует различные твёрдые фосфаты, природа которых зависит от условий реакции.
Получение
Оксид фосфора(V) получают сжиганием фосфора в избытке кислорода или воздуха. Технологический процесс происходит в камере сжигания и включает в себя окисление элементарного P предварительно осушенным воздухом, осаждение P4O10 и очистку отходящих газов. Очищают полученный пентаоксид возгонкой.
Технический продукт имеет вид белой снегообразной массы, состоящей из смеси разных форм P4O10.
Применение
P4O10 применяют как осушитель газов и жидкостей. Также он является промежуточным продуктом в производстве ортофосфорной кислоты H3PO4 термическим способом.
Широко используется в органическом синтезе в реакциях дегидратации и конденсации.
Оксид фосфора (V): получение и свойства
| Оксиды азота | Цвет | Фаза | Характер оксида |
| P2O3 Оксид фосфора (III), фосфористый ангидрид | белый | твердый | кислотный |
| P2O5 Оксид фосфора(V), фосфорный ангидрид | белый | твердый | кислотный |
Оксид фосфора (V) – это кислотный оксид. В нормальных условиях образует белые кристаллы. В парах состоит из молекул P4О10. Очень гигроскопичен (используется как осушитель газов и жидкостей).
Способы получения. Оксид фосфора (V) получают сжиганием фосфора в избытке кислорода.
Химические свойства
1. Оксид фосфора (V) – очень гигроскопичное вещество, которое используется для осушения газов. Обладая высоким сродством к воде, оксид фосфора (V) дегидратирует до ангидридов неорганические и органические кислоты.
В зависимости от количества воды и от других условий образуются мета-фосфорная, орто-фосфорная или пиро-фосфорная кислота:
Видеоопыт взаимодействия оксида фосфора с водой можно посмотреть здесь.
Еще пример : оксид фосфора взаимодействует с оксидом бария (при сплавлении):
Фосфор
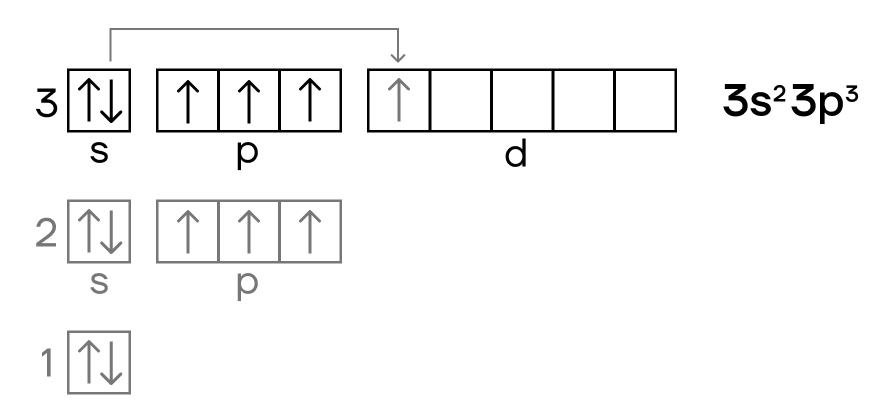
Основное и возбужденное состояние фосфора
При возбуждении атома фосфора электроны на s-подуровне распариваются и переходят на d-подуровень.
Природные соединения
В промышленности фосфор получают в ходе сплавления фосфата кальция, песка и угля.
Химическая активность фосфора значительно выше, чем у азота. Активность также определяется аллотропной модификацией: наиболее активен белый фосфор, излучающий видимый свет из-за окисления кислородом.
В жидком и газообразном состоянии до 800 °C фосфор состоит из молекул P4. Свыше 800 °C молекулы P4 распадаются до P2.
C неметаллами фосфор часто проявляет себя как восстановитель и окислитель. Легко окисляется кислородом.
Схожим образом происходит взаимодействие фосфора и хлора.
2P + 3Cl2 → 2PCl3 (недостаток хлора)
2P + 5Cl2 → 2PCl5 (избыток хлора)
2P + 3Ca → Ca3P2 (фосфид кальция)
При взаимодействии с водой фосфор вступает в реакцию диспропорционирования (так называются реакции, в которых одно и то же вещество является и окислителем, и восстановителем).
При добавлении фосфора в растворы щелочей также происходит реакция диспропорционирования.
При поджигании спичек происходит реакция между фосфором и бертолетовой солью, которая выступает в качестве окислителя.
Кислотный оксид, пары которого имеют формулу P4O10. Твердый оксид характеризуется белым цветом.
Активно реагирует с водой с образованием фосфорной кислоты. При недостатке воды образует метафосфорную кислоту.
Обладает выраженным водоотнимающим (дегидратационным) свойством: легко извлекает воду из других соединений.
Фосфорные кислоты
Фосфорноватистая кислота способна вытеснять из солей малоактивные металлы, при этом превращаясь в ортофосфорную кислоту.
Ортофосфорная кислота
В твердом виде представляет собой кристаллы белого цвета, хорошо растворимые в воде.
Фосфорную кислоту получают из фосфатов, воздействуя на них серной кислотой. Также известны способы гидролиза пентахлорида фосфора, взаимодействия оксида фосфора V с водой.
Фосфорная кислота может образоваться при окислении фосфора сильной кислотой:
За счет кислотных свойств отлично реагирует с основными оксидами, основаниями. При различных соотношениях кислоты и основания получаются различные соли (фосфаты, гидрофосфаты и дигидрофосфаты).
В реакции с карбонатами образуется нестойкая угольная кислота, которая распадается на воду и углекислый газ.
Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из фосфорной кислоты.
При сильном нагревании ортофосфорная кислота теряет воду и переходит в метафосфорную кислоту.
Соли фосфорной кислоты
Соли фосфорной кислоты получаются в ходе реакции ортофосфорной кислоты и оснований.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Оксид фосфора (V). Ортофосфорная кислота.
Оксид фосфора (V) – фосфорный ангидрид
Физические свойства: Оксид фосфора (V) Р 2О 5 — белый гигроскопичный порошок (поглощает воду), следует хранить в плотно закрытых сосудах.
Получение: Получается при горении фосфора в избытке воздуха или кислорода
4P + 5O 2 = 2P 2 O 5
Применение: Оксид фосфора (V) очень энергично соединяется с водой, а также отнимает воду от других соединений. Применяется как осушитель газов и жидкостей.
P 2 O 5 + H 2 O = HPO 3
при нагревании образуется ортофосфорная кислота H 3PO 4:
P 2 O 5 + 3H 2 O = 2H 3 PO 4 (t˚C)
При нагревании H 3PO 4 можно получить пирофосфорную кислоту H 4P 2O 7:
2H 3 PO 4 = H 2 O + H 4 P 2 O 7 (t˚C)
Свойства кислотного оксида
Типичный кислотный оксид:
3CaO + P 2 O 5 = Ca 3 (PO 4 ) 2 ,
3Ca(OH) 2 + P 2 O 5 = Ca 3 (PO 4 ) 2 + 3H 2 O.
Элементы VА группы. Фосфор
На этой странице вы узнаете
Фосфор был открыт в результате поисков философского камня. Хотели получить золото и бессмертие, а вместо этого обнаружили элемент, который светится зеленым цветом в темноте. Чем ещё отличается фосфор — расскажем в статье.
Общая характеристика
Конфигурация его внешнего слоя такая же, как и у азота. Но фосфор имеет на этом слое полностью свободный d-подуровень, куда в случае возбуждения атома может переехать его электрон.
Таким образом, благодаря наличию в возбужденном состоянии пяти неспаренных электронов, фосфор может максимально образовывать в соединениях пять химических связей.
В отличие от азота, у фосфора максимальная валентность (V) и высшая степень окисления (+5) численно совпадают.
Какие степени окисления фосфора возможны?
Физические свойства
Фосфор как простое вещество, аналогично углероду, имеет несколько аллотропных модификаций.
О трех фосфорных братах
Можно запомнить основные свойства по “характерам” модификаций:
Химические свойства
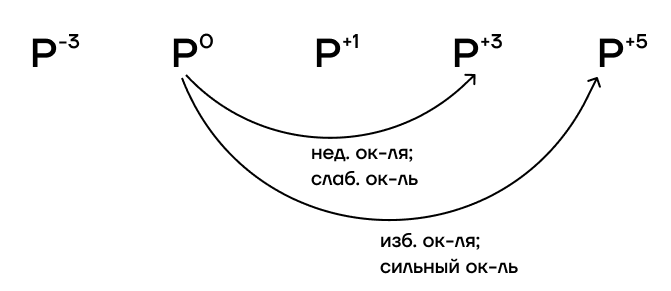
Фосфор имеет низкое значение электроотрицательности. Это значит, что фосфор проявляет ярко выраженные восстановительные свойства. Онплохо притягивает к себе электроны, поэтому у него их легко отобрать.
При избытке окислителя или воздействии такого сильного окислителя, как F2, фосфор переходит в степень окисления +5. При недостатке окислителя или воздействии такого слабого окислителя, как I2, фосфор переходит только в степень окисления +3.
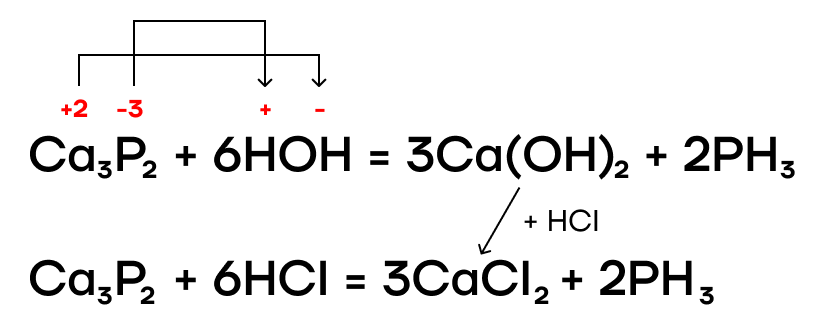
Как и многие бинарные соединения, галогениды фосфора способны гидролизоваться в различных средах (нейтральной, щелочной, кислой). Эти реакции мы, как и всегда, пишем по принципу «притяни плюс к минусу».
Фосфиды металлов также подвергаются гидролизу в разных средах.
В результате протекания этих реакций образуется ядовитый газ с неприятным запахом чеснока (или тухлой рыбы) — фосфин PH3. Он проявляет очень слабые основные свойства.
Фосфор — один из тех неметаллов, который способен взаимодействовать со щелочами (выражение для запоминания — «LiPSSi Ha»). Так как щёлочь не проявляет выраженных окислительных или восстановительных свойств, фосфору в этой реакции приходится отдуваться за двоих: играть роль как окислителя, так и восстановителя.
Из-за низкой электроотрицательности фосфор является типичным восстановителем («жертвой»). Поэтому он способен взаимодействовать с окислителями. В ОВР он в подавляющем большинстве случаев как восстановитель повышает свою степень окисления до +5. Она является крайне устойчивой для него. Из-за этого соединения фосфора (V) не являются типичными окислителями, потому что фосфор не хочет уходить из любимой степени окисления.
Получение фосфора
В промышленности главным способом получения фосфора является спекание фосфорита (ортофосфата кальция) с диоксидом кремния и коксом. Для чего это делают?
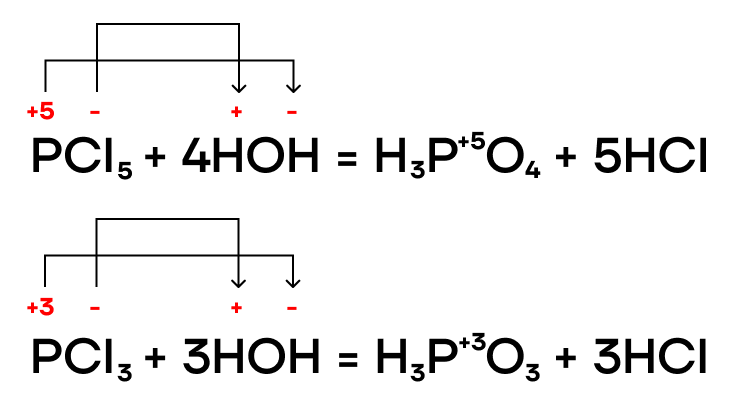
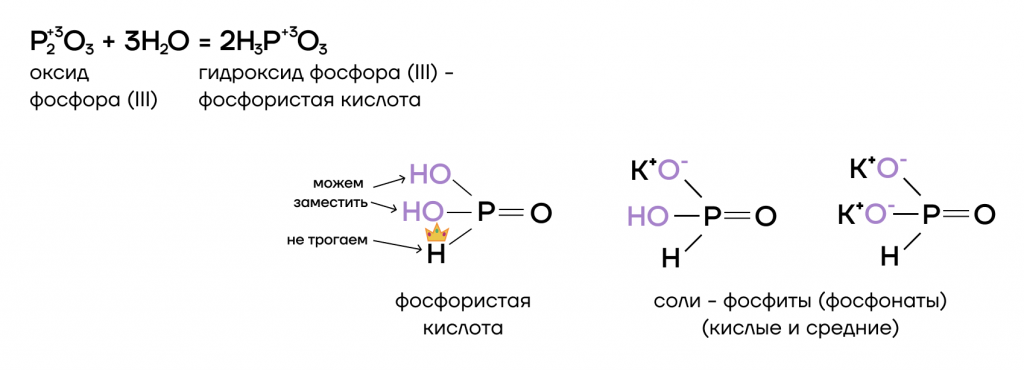
Оксид фосфора (III) P2O3 и фосфористая кислота H3PO3
Оксид фосфора (III) — типичный кислотный оксид. Это значит, он способен реагировать с водой с образованием соответствующей кислоты и вступать в основно-кислотные взаимодействия со своими противоположностями — основаниями и основными оксидами.
За счет степени окисления +3 оксид фосфора (III) проявляет восстановительные свойства, повышая в реакциях степень окисления до +5.
Как типичный кислотный оксид, P2O3 способен взаимодействовать с водой с образованием соответствующего гидроксида (кислоты).
Тут все очень просто! P2O3 — кислотный оксид, он проявляет кислотные свойства. Значит, он способен вступать в основно-кислотные взаимодействия со своими противоположностями — основаниями и основными оксидами — с образованием солей.
Оксид фосфора (V) P2O5
Оксид фосфора (V) P2O5 как типичный кислотный оксид будет реагировать с водой и вступать в основно-кислотные взаимодействия со своими противоположностями — основаниями и основными оксидами. Также как условно «сильный» оксид он способен вытеснять условно «слабые» из их солей при сплавлении.
При взаимодействии с водой оксид фосфора (V) образует соответствующий гидроксид — ортофосфорную кислоту.
Происходят с основаниями и основными оксидами. При этом образуются соли.
В отношении реакций вытеснения P2O5 — это условно «сильный» оксид. Он способен вытеснять условно «слабые» (CO2 и SO2) из их солей при сплавлении (t).
Это вещество обладает крайне сильными дегидратирующими свойствами: оно активно осушает что?, отбирает воду. Он настолько жаден до воды, что может её отобрать даже у безводных кислородсодержащих летучих кислот.
Ортофосфорная кислота H3PO4 и ортофосфаты
Ортофосфорная кислота — ничем не примечательная слабая кислота.
Как и все кислоты, она обладает кислотными свойствами. Она способна вступать в основно-кислотные взаимодействия с веществами, проявляющими основные свойства.
Опять же как и другие кислоты, она является электролитом. Это значит, она может распадаться на ионы и обмениваться ими с другими электролитами, то есть вступать в реакции ионного обмена.
Фактчек
Проверь себя
Задание 1.
Количество электронов на внешнем энергетическом уровне атома фосфора равно:
Задание 2.
Какой аллотропной модификации фосфора не существует?
Задание 3.
Фосфин можно получить реакцией:
Задание 4.
Фосфористая кислота H3PO3 является:
Ответы: 1. — 3; 2. — 2; 3. — 4; 4. — 2.
Оксид фосфора P2O5(V)
Фосфор является очень «плодовитым» элементом, образуя много разнообразных оксидов и кислот.
Самым устойчивым является оксид фосфора P2O5(V), который называется фосфорным ангидридом.
Физические свойства фосфорного ангидрида:
В узлах кристаллической модификации расположены, соединенные попарно, молекулы P2O5.
Химические свойства P2O5(V)
Фосфорный ангидрид является типичным кислотным оксидом, активно взаимодействует с водой, с образованием фосфорных кислот:
P2O5+H2O = 2HPO3 (метафосфорная к-та)
P2O5+2H2O = H4P2O7 (пирофосфорная к-та)
P2O5+3H2O = 2H3PO4 (ортофосфорная к-та)
В реакциях со щелочами кислотный оксид P2O5(V) образует, как средние, так и кислые соли, в зависимости от соотношения реагентов:
P2O5+4NaOH = 2Na2HPO4+H2O
P2O5+2NaOH+H2O = 2NaH2PO4
Поскольку фосфорный ангидрид является водоотнимающим средством, он применяется для получения других оксидов из их кислот:
P2O5+2HNO3 = 2HPO3+N2O5
Несмотря на то, что в фосфорном ангидриде фосфор имеет максимально возможную степень окисления (+5), оксид фосфора P2O5(V) не обладает выраженными окислительными свойствами, что объясняется тем, что +5 является крайне неустойчивой степенью окисления для фосфора.
Получают P2O5(V) при горении фосфора в избытке кислорода:
4P+5O2 = 2P2O5
Выше уже было сказано, что фосфорный ангидрид является хорошим водопоглотителем, что позволяет его использовать в качестве осушителя разнообразных веществ (в эксикаторах), при проведении реакций дегидратации и проч.
Оксид фосфора P2O3(III)
P2O3(III) реагирует с основаниями и основными оксидами с образованием фосфитов (солей фосфористой кислоты):
P2O3+4NaOH = 2Na2HPO3+H2O
Получают оксид фосфора P2O3(III) окислением фосфора при недостатке кислорода:
4P+3O2 = 2P2O3
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время.
Вы можете также связаться с преподавателем напрямую:
Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте.
Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши.
Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить».
Внимание, если вы не нашли в базе сайта нужную реакцию, вы можете добавить ее самостоятельно.
Здесь вы можете выбрать параметры отображения органических соединений.
Эти параметры действуют только для верхнего изображения вещества и не применяются в реакциях.
| Размер шрифта |
| Отображение гетероатомов |
Корректная работа сайта обеспечена на всех браузерах, кроме Internet Explorer.
Если вы пользуетесь Internet Explorer, смените браузер.
На сайте есть сноски двух типов:
Урок №37. Оксид фосфора (V). Фосфорная кислота и её соли. Фосфорные удобрения
Оксид фосфора (V) – фосфорный ангидрид
Физические свойства:
Оксид фосфора (V) Р 2 О 5 — белый гигроскопичный порошок (поглощает воду), следует хранить в плотно закрытых сосудах.
Получение:
Получается при горении фосфора в избытке воздуха или кислорода
4P + 5O 2 = t, °C = 2P 2 O 5
Применение:
Оксид фосфора (V) очень энергично соединяется с водой, а также отнимает воду от других соединений. Применяется как осушитель газов и жидкостей.
Химические свойства:
Оксид фосфора (V) – это кислотный оксид, взаимодействует, подобно другим кислотным оксидам с водой, основными оксидами и основаниями.
P 2 O 5 + H 2 O = холод = HPO 3
при нагревании образуется ортофосфорная кислота H 3 PO 4 :
P 2 O 5 + 3H 2 O = t, °C = 2H 3 PO 4
При нагревании H 3 PO 4 можно получить пирофосфорную кислоту H 4 P 2 O 7 :
2H 3 PO 4 = t, °C = H 2 O + H 4 P 2 O 7
Ортофосфорная кислота
Строение молекулы:
В молекуле фосфорной кислоты атомы водорода соединены с атомами кислорода:
Физические свойства:
Фосфорная кислота представляет собой бесцветное, гигроскопичное твердое вещество, хорошо растворимое в воде.
Получение:
1) Взаимодействие оксида фосфора (V) с водой при нагревании:
P 2 O 5 + 3H 2 O = t, °C = 2H 3 PO 4
2) Взаимодействие природной соли – ортофосфата кальция с серной кислотой при нагревании:
Сa 3 (PO 4 ) 2 + 3H 2 SO 4 = t, °C = 3CaSO 4 + 2H 3 PO 4
3) При взаимодействии фосфора с концентрированной азотной кислотой
3P + 5HNO 3 + 2H 2 O = 3H 3 PO 4 + 5NO
Химические свойства:
Свойства, общие с другими кислотами
1. Водный раствор кислоты изменяет окраску индикаторов на красный:
Ортофосфорная кислота диссоциирует ступенчато:
HPO 4 2- ↔ H + + PO 4 3- (ортофосфат-ион)
2. Взаимодействует с металлами в ряду активности до (Н 2 ):
металл+ H 3 PO 4 =соль+Н 2 ↑
3. Взаимодействует с основными оксидами:
оксид металла + H 3 PO 4 = соль + Н 2 О
основание + H 3 PO 4 = соль + Н 2 О
если кислота в избытке, то образуется кислая соль:
H 3 PO 4(изб) + NaOH = NaH 2 PO 4 + H 2 O или
H 3 PO 4(изб) + 2NaOH = Na 2 HPO 4 + 2H 2 O
5. Реагирует с аммиаком (по донорно-акцепторному механизму), если в избытке кислота, образуются кислые соли:
6. Реагирует с солями слабых кислот:
2H 3 PO 4 +3Na 2 CO 3 = 2Na 3 PO 4 + 3H 2 O + 3CO 2 ↑
Специфические свойства
1. При нагревании ортофосфорная кислота постепенно превращается в метафосфорную кислоту:
2H 3 PO 4 = t, °C =H 2 O + H 4 P 2 O 7
H 4 P 2 O 7 = t, °C = H 2 O + 2HPO 3
2. Качественная реакция на фосфат-ионы
Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот является реакция с нитратом серебра — образуется жёлтый осадок :
Н 3 РО 4 + 3AgNO 3 = Ag 3 PO 4 ↓+ 3HNO 3
3. Играет большую роль в жизнедеятельности животных и растений.
Её остатки входят в состав АТФ. При разложении АТФ выделяется большое количество энергии, что очень важно для живых организмов.
Применение:
А также, используется при пайке, для очищения от ржавчины металлических поверхностей. Также применяется в составе фреонов, в промышленных морозильных установках как связующее вещество. Ортофосфорная кислота зарегистрирована в качестве пищевой добавки E338. Применяется как регулятор кислотности в газированных напитках.
Фосфорные удобрения
Фосфор – элемент важнейшего органического соединения для любого организма аденозинтрифосфорной кислоты – АТФ. Эта кислота служит аккумулятором энергии в живой клетке. Фосфор входит в состав нуклеиновых кислот – ДНК и РНК, а без них невозможно хранение и воспроизведение генетической информации, содержащейся в клетке. Фосфор принимает активное участие в восстановлении и и распаде углеводов, оказывая большое влияние на рост растения, его цветение и плодоношение.
Растения усваивают фосфор из почвы главным образом в виде фосфат – иона (РО 4 3- ). Как известно, фосфорная кислота образует три типа солей: орто-, гидро- и дигидрофосфаты. Для усвоения растением удобрение должно быть растворимо в воде, из средних фосфатов растворимы только соли щелочных металлов, гидрофосфаты растворимы лучше, зато дигидрофосфаты растворимы все без исключения.
Однако, и нерастворимая фосфоритная мука Са 3 (РО 4 ) 2 и труднорастворимый преципитат СаНРО 4 прекрасно усваиваются некоторыми культурами (люпин, горох, горчица, гречиха…). Дело в том, что корневые волоски этих растений выделяют органические кислоты, растворяющие неподатливые в воде соли.
Са 3 (РО 4 ) 2 + 4Н 3 РО 4 + 3Н 2 О = 3Са(Н 2 РО 4 ) 2 ∙Н 2 О
СаСО 3 + 2Н 3 РО 4 = Са(Н 2 РО 4 ) 2 ∙Н 2 О + СО 2
2Н 3 РО 4 + Са(ОН) 2 = Са(Н 2 РО 4 ) 2 + 2Н 2 О
Са(Н 2 РО 4 ) 2 + Са(ОН) 2 = 2СаНРО 4 + 2Н 2 О
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Составьте уравнения реакций оксида фосфора (V) с
3. H 2 O при нагревании
4. H 2 O без нагревания
Для 2 реакции запишите полное и краткое ионное уравнение.
№2. Составьте молекулярные и ионные уравнения реакций ортофосфорной кислоты с:
2. оксидом калия
3. гидроксидом калия
4. сульфитом калия
№3. Осуществите превращения по схеме:
№4. Вычислите (в %), какое из фосфорных удобрений: двойной суперфосфат или преципитат богаче фосфором?
Химические свойства оксида фосфора 5 и его применение
Оксид фосфора (V) — что это такое
Оксид фосфора (V) является кислотным оксидом. Представляет собой кристаллическое вещество белого цвета молекулярного строения.
Химическая формула оксида фосфора (V):
P 4 O 10 и P 2 O 5
Структурные модификации оксида фосфора (V):
Характеристика модификаций оксида фосфора (V) с разным строением:
Химические и физические свойства
Список физических свойств оксида фосфора (V):
Оксид фосфора (V) относят к группе кислотных оксидов неметаллов. К примеру, оксид кремния (IV) и оксид серы (VI) также являются кислотными оксидами.
Взаимодействие оксида фосфора (V) с белым фосфором можно описать с помощью уравнения:
3 P 4 O 10 + 2 P 4 → 5 P 4 O 6 ( t = 50 ° C )
Результатом реакции является образование оксида фосфора (III).
При соединении оксида фосфора (V) с натрием образуются соли метафосфат натрия N a P O 3 и фосфид натрия N a 3 P :
Химическая реакция оксида фосфора (V) и лития приводит к образованию солей в виде метафосфата лития L i P O 3 и фосфида лития L i 3 P :
При контакте оксида фосфора (V) со фтором образуются оксид-трифторид фосфора(V) и кислород:
P 4 O 10 + 6 F 2 → 4 P O F 3 + 3 O 2 ( t = 100 ° C )
Химическая реакция оксида фосфора (V) и воды протекает таким образом:
P 4 O 10 + 6 H 2 O → 4 H 3 P O 4 или P 2 O 5 + 3 H 2 O → 2 H 3 P O 4
P 4 O 10 + 2 H 2 O → 4 H P O 3 или P 2 O 5 + H 2 O → 2 H P O 3
Взаимодействие оксида фосфора (V) с оксидом кальция приводит к образованию солей:
C a O + P 2 O 5 → C a ( P O 3 ) 2
2 C a O + P 2 O 5 → C a 2 P 2 O 7
3 C a O + P 2 O 5 → C a 3 ( P O 4 ) 2 ( t ° )
Взаимодействие оксида фосфора (V) с оксидом натрия приводит к образованию соли в виде ортофосфата натрия:
3 N a 2 O + P 2 O 5 → 2 N a 3 P O 4
Реакция оксида фосфора (V) и оксида бора является процессом образования фосфата бора:
2 B 2 O 3 + P 4 O 10 → 4 B P O 4 ( t ° )
В процессе реакции оксида фосфора (V) и гидроксида натрия образуются соль ортофосфат натрия и вода:
P 4 O 10 + 12 N a O H → 4 N a 3 P O 4 + 6 H 2 O или P 2 O 5 + 6 N a O H → 2 N a 3 P O 4 + 3 H 2 O
Оксид фосфора (V) вступает в реакцию с плавиковой кислотой, что приводит к образованию оксида-трифторида фосфора и метафосфорной кислоты:
Оксид фосфора (V) реагирует с бромоводородом, что в результате позволяет получить оксид-трибромид фосфора и метафосфорную кислоту:
P 4 O 10 + 3 H B r → P O B r 3 + 3 H P O 3 ( t = 200 ° C )
Взаимодействие оксида фосфора (V) с азотной кислотой с образованием оксида азота и метафосфорной кислоты:
4 H N O 3 + P 4 O 10 → 2 N 2 O 5 + 4 H P O 3 или 2 H N O 3 + P 2 O 5 → N 2 O 5 + 2 H P O 3 ( t = – 10 ° C )
Оксид фосфора (V) взаимодействует с ортофосфорной кислотой, что сопровождается образованием дифосфорной (пирофосфорной) кислоты:
Взаимодействие оксида фосфора (V) и пероксида водорода с образованием дипероксодиоксофосфата водорода и воды:
P 4 O 10 + 8 H 2 O 2 → 4 H 3 P O 2 ( O 2 ) 2 + 2 H 2 O ( t = – 20 ° C )
В процессе реакции оксида фосфора (V) с амидами они превращаются в нитрилы. При взаимодействии вещества со спиртами, эфирами, фенолами, другими органическими соединениями образуются фосфорорганические соединения.
Получение и использование оксида фосфора (V)
Практическое применение полученного в результате данной химической реакции оксида фосфора (V) заключается в его использовании для осушения газообразных и жидких веществ, в органическом синтезе (как водоотнимающее средство). Соединение активно используют в производстве такой продукции, как:
Другим соединением фосфора является фосфин. Вещество представляет собой ядовитый газ c неприятным запахом, самовоспламеняющийся на воздухе. Фосфин является продуктом разложения органических веществ.
Оксид фосфора(V) Строение



Химические свойства.
Химическая активность фосфора значительно выше, чем у азота. Химические свойства фосфора во многом определяются его аллотропной модификацией. Белый фосфор очень активен, в процессе перехода к красному и чёрному фосфору химическая активность резко снижается. Белый фосфор на воздухе светится в темноте, свечение обусловлено окислением паров фосфора до низших оксидов.
В жидком и растворенном состоянии, а также в парах до 800 °С фосфор состоит из молекул Р4. При нагревании выше 800 °С молекулы диссоциируют: Р4 = 2Р2. При температуре выше 2000 °С молекулы распадаются на атомы. Взаимодействие с простыми веществами
Фосфор легко окисляется кислородом:
4P + 3O2 → 2P2O3 (при медленном окислении или при недостатке кислорода).
Взаимодействует со многими простыми веществами — галогенами, серой, некоторыми металлами, проявляя окислительные и восстановительные свойства:
с металлами — окислитель, образует фосфиды:
фосфиды разлагаются водой и кислотами с образованием фосфина
с неметаллами — восстановитель:
Не взаимодействует с водородом.
Взаимодействие с водой
Взаимодействует с водой, при этом диспропорционирует:
Взаимодействие со щелочами
В растворах щелочей диспропорционирование происходит в большей степени:
Восстановительные свойства
Сильные окислители превращают фосфор в фосфорную кислоту:
Реакция окисления также происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль:
Применение
Фосфор является важнейшим биогенным элементом и в то же время находит очень широкое применение в промышленности. Красный фосфор применяют в производстве спичек. Его вместе с тонко измельчённым стеклом и клеем наносят на боковую поверхность коробки. При трении спичечной головки, в состав которой входят хлорат калия и сера, происходит воспламенение.
PHal3, P2S3), при избытке — соединения фосфора (V) (Р2О5, PHal5,
P2Ss)- Окислительная активность фосфора проявляется при
взаимодействии с металлами. При нагревании в воде и в особенности в
щелочных растворах фосфор диспропорционирует.
В технике фосфор получают прокаливанием фосфата кальция с
углем и песком в электропечах при 1500° С:
2Са3J(к) + ЮС(к) + 6SiO2(T) = 6CaSiO3(T) + 10СО(г) + Р4(г);
Эта реакция эндотермична, но сопровождается увеличением
энтропии. Температура, при которой она протекает, определяется условием
TAS > АН. При конденсации выделяющихся паров образуется белый
фосфор, который длительным нагреванием при 280—340°С переводят в
красный. Основная масса красного фосфора используется в спичечном,
33.
Оксид фосфора(V) Строение
Пары оксида фосфора(V) имеют состав P4O10. Твердый оксид склонен к полиморфизму. Существует в аморфном стекловидном состоянии и кристаллическом. Для кристаллического состояния известны две метастабильные модификации пентаоксида фосфора — гексагональная Н-форма (а = 0,744 нм, = 87°, пространств, гр. R3С) и орторомбическая О-форма (а = 0,923 нм, b — 0,718 нм, с = 0,494 нм, пространств, гр. Рпат), а также одна стабильная орторомбическая О-форма (а =1,63 нм, b= 0,814 нм, с =0,526 нм, пространств. гр. Fdd2). Молекулы P2O5 (Н-форма) построены из 4 групп PO4 в виде тетраэдра, вершины которого занимают атомы фосфора, 6 атомов кислорода располагаются вдоль ребер, а 4 — по оси третьего порядка тетраэдра. Эта модификация легко возгоняется (360 о С) и активно взаимодействует с водой. Другие модификации имеют слоистую полимерную структуру из тетраэдров PO4, объединенные в 10-членные (О-форма) и 6-членные (О’-форма) кольца. Эти модификации имеют более высокую температуру возгонки (
580 о С) и менее химически активны. H-форма переходит в О-форму при 300—360 о C.
A. Свойства
P4O10 очень активно взаимодействует с водой (H-форма поглощает воду даже со взрывом), образуя смеси фосфорных кислот, состав которых зависит от количества воды и других условий:
Он также способен извлекать воду из других соединений, представляя собой сильное дегидратирующее средство:
Оксид фосфора(V) широко применяется в органическом синтезе. Он реагирует с амидами, превращая их в нитрилы:
Карбоновые кислоты переводит в соответствующие ангидриды:
Также взаимодействует со спиртами, эфирами, фенолами и другими органическими соединениями. При этом происходит разрыв связей P—О—P и образуются фосфорорганические соединения. Реагирует с NH3 и с галогеноводородами, образуя фосфаты аммония и оксигалогениды фосфора:
При сплавлении P4O10 с основными оксидами образует различные твердые фосфаты, природа которых зависит от условий реакции.
Сульфид фосфора ( V) P2Ss подобно P2Os существует в виде нескольких модификаций.
34. Ортофо́сфорная кислота́ (фо́сфорная кислота́) [1] — неорганическая кислота с химической формулой H3PO4, которая при стандартных условияхпредставляет собой бесцветные гигроскопичные кристаллы.
При температуре выше 213 °C она превращается в пирофосфорную кислоту H4P2O7. Очень хорошо растворима в воде. Обычно ортофосфорной (или просто фосфорной) кислотой называют 85 % водный раствор (бесцветная сиропообразная жидкость без запаха). Растворима также в этаноле и других растворителях.
A. Получение
Фосфорную кислоту получают из фосфорита:
Можно получить гидролизом пентахлорида фосфора:
Или взаимодействием с водой оксида фосфора(V), полученного сжиганием фосфора в кислороде:
С водой реакция идет очень бурно, поэтому оксид фосфора(V) обрабатывают нагретым до 200 °C концентрированным раствором ортофосфорнойкислоты.
Расплавленная ортофосфорная кислота и ее концентрированные растворы обладают большой вязкостью, что обусловлено образованием межмолекулярных водородных связей.
H3PO4 — трехосновная кислота средней силы. При взаимодействии с очень сильной кислотой, например HClO4, фосфорная кислота проявляет признаки амфотерности — образуются соли фосфорила, например [Р(ОН)4]·(ClO4).
Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот является реакция с нитратом серебра — образуется жёлтый осадок:
Качественной реакцией на ион РО4 3− является образование ярко-жёлтого осадка молибденофосфата аммония:
Дифосфорная кислота — неорганическое соединение, четырёхосновная кислородсодержащая кислота с формулой H4P2O7, бесцветные кристаллы, растворимые в воде, образует кристаллогидраты.
Оксид фосфора (V)
Традиционно содержание Фосфора в удбрениях выражают содержанием Оксида фосфора.
Все свойства Фосфора, как питательного элемента описаны в статье Фосфор.
Химические и физические свойства
Оксид фосфора – бесцветное аморфное или стекловидное вещество, существующеев трех кристаллических, двух аморфных и двух жидких формах.
Токсичное вещество. Вызывает ожоги кожи и раздражение слизистой оболочки.
Пентаоксид фосфора очень гигроскопичен. Реагирует со спиртами эфирами, фенолами, кислотами и прочими веществами. В процессе реакции с органическими веществами происходит разрыв связей фосфора с кислородом, и образуются фосфорорганические соединения. Вступает в химические реакции с аммиаком (NH3) и галогеноводородами с образованием фосфатов аммония и оксигалогенидов фосфора. С основными оксидами образует фосфаты.
Содержание пентаоксида фосфора в почве и удобрениях
Фактически в почве имеются только соли ортофосфорной кислоты H3PO4, но в сложных удобрениях могут быть и соли мета-, пиро- и полифосфорных кислот.
Основой для образования ортофосфорной кислоты является пентаоксида фосфора. Именно поэтому, а так же в связи с тем, что растения не поглощают элементарный фосфор, условлено обозначать концентрацию фосфора через содержание пентаоксида фосфора.
P2O5 + 3H2O → 2H3PO4
Все встречающиеся в почве соли ортофосфорной кислоты и одновалентных катионов (NH4, Na, K) и однозамещенные соли двухвалентных катионов (Ca(H2PO4)2 и Mg(H2PO4)2) растворимы в воде.
Двузамещенные соли двухвалентных катионов в воде не растворимы, но легко растворяются в слабокислых кислотах корневых выделений и органических кислотах жизнедеятельности микроорганизмов. В этой связи они так же являются хорошим источником P2O5 для растений.
Поглощение пентаоксида фосфора растениями
Как указывалось выше, в природе основной источник фосфора – это соли ортофосфорнонй кислоты H3PO4. Однако после гидролиза пиро-, поли- и метафосфаты так же используются практически всеми культурами.
Гидролиз пирофосфата натрия:
Гидролиз триполифосфата натрия:
Гидролиз метафосфат иона (в кислой среде):
Некоторые растения приспособились усваивать фосфат-ион из фосфорорганических соединений (фитин, глицефосфаты и прочее). Корни данных растений выделяют особый фермент (фотофтазу), который и отщипляет анион фосфорной кислоты от органических соединений, а затем растения поглощают этот анион. К подобного рода растениям относятся горох, бобы, кукуруза. Причем фосфатазная активность возрастает в условиях фосфорного голода.
Опытным путем установлено, что поглощаемый корнями фосфор прежде всего идет на синтез нуклеотидов, а для дальнейшего продвижения в наземную часть фосфаты вновь поступают в проводящие сосуды корня в виде минеральных соединений.
Рерасчет содержения фосфора в удобрениях
В некоторых случаях требуется рассчитать процентное содержание фосфора в удобрении, если дано содержание по P2O5. Расчет производится по формуле:
y = x,% × 30,974 (молярная масса P) × 2 / 30,974 (молярная масса P) × 2 + 15,999 (молярная масса O) × 5
х – содержание P2O5 в удобрении, %;
y – содержание P в удобрении, %
y = x, % × 0,43643
в удобрении содержится 40% оксида фосфора
для пересчета процентного содержания элемента фосфор в удобрении нужно умножить массовую долю оксида в удобрении на массовую долю элемента в оксиде (для P2O5 – 0,43643): 40 * 0,43643 = 17,4572 %
Соединения фосфора
Фосфин (PH3)
Способы получения фосфина
Прямым синтезом PH3 получить нельзя.
Физические свойства фосфина
При нормальной температуре фосфин является бесцветным газом с резким чесночным запахом. В воде малорастворим, хорошо растворим в органических растворителях
Фосфин — Яд!
Химические свойства фосфина
PH3 — Проявляет свойства сильного восстановителя.
Практического значения фосфин не имеет.
Фосфиды
Способы получения
Взаимодействие фосфора с металлами:
Физические свойства, строение фосфидов
Фосфиды – представляют собой продукты взаимодействия фосфора с металлами.
Фосфиды щелочных и щелочноземельных металлов имеют ионное строение.
Химические свойства фосфидов
Фосфиды крайне неустойчивы и легко подвергаются необратимому гидролизу с образованием РН3:
Оксид фосфора (III), триоксид фосфора (P2O3)
Способы получения оксида фосфора (III)
Физические свойства оксида фосфора (III)
При комнатной температуре Р2О3 — белая воскообразная масса с неприятным запахом. Легко испаряется, его Тпл = 23,5°С
Пары существует в виде димеров Р4О6.
!Очень ядовит
Химические свойства оксида фосфора (III)
Окисление кислородом воздуха:
Окисление галогенами:
Оксид фосфора (V), пентаоксид фосфора, фосфорный ангидрид (Р2О5)
Способы получения фосфорного ангидрида
Сжигание фосфора в избытке воздуха:
Физические свойства фосфорного ангидрида
При комнатной температуре Р2О5 — белые стеклообразные хлопья без запаха. Существует в виде димеров Р4О10.
Очень гигроскопична, при соприкосновении с воздухом расплывается в сиропообразную жидкость (НРO3). Р2О5 — самое эффективное осушающее средство и водоотнимающий агент. Применяется для осушения нелетучих веществ и газов.
Химические свойства фосфорного ангидрида
Р2О5 проявляет кислотные свойства.
Как кислотный оксид Р2О5 взаимодействует:
Фосфорные кислоты
Фосфор образует только 2 устойчивых оксида, в которых он находится в степенях окисления +5 и +3. Однако существует большое число кислот, в которых фосфор имеет валентность равную V (пять ковалентных связей) и степени окисления +5, +4, +3, +1.
Строение наиболее известных кислот выражается следующими формулами:
Наибольшее практическое значение имеют ортофосфорная (фосфорная) и ортофосфористая (фосфористая) кислоты.
Фосфористая кислота ( H3PO3)
Способы получения фосфористой кислоты
Физические свойства, строение фосфористой кислоты
Для молекулы фосфористой кислоты H3PO3 известны 2 таутомерные формы. В одной из них 2 атома водорода молекулы связаны с кислородом, а один атом водорода связан непосредственно с атомом фосфора. Такой атом водорода не может быть замещен атомами металлов, поэтому кислота является двухосновной.
В другой таутомерной форме – все три атома водорода связаны с кислородом.
Формула фосфористой кислоты выглядит следующим образом: Н2[НРО3]
При комнатной температуре H3PO3 – кристаллическое вещество без цвета, хорошо растворимое в воде, Тпл = 74°С.
Валентность фосфора в фосфористой кислота равна V, а степень окисления +3.
Химические свойства фосфористой кислоты
Является слабой кислотой.
Кислота и ее соли являются сильными восстановителями:
Соли фосфористой кислоты (Фосфиты)
Способы получения фосфитов
Физические свойства фосфитов
Двухосновная фосфористая кислота образует два типа солей:
а) однозамещенные фосфиты (кислые соли), в молекулах которых атомы металлов связаны с анионами Н2РО3, например: NaH2PO3, Са(H2PO3)
б) двухзамещенные фосфиты (средние соли), в молекулах которых атомы металлов связаны с 2 или 1 анионом HPO3, например: Na2HPO3, СаHPO3.
Хорошо растворимы в воде только фосфиты щелочных металлов и кальция, остальные фосфиты плохо растворимы.
Химические свойства фосфитов
Имеют химические свойства, характерные для солей
Ортофосфорная кислота, фосфорная кислота (Н3РO4)
Способы получения фосфорной кислоты
В промышленности Н3РO4 получают двумя способами:
1 стадия — восстановление природных фосфоритов коксом
2 стадия – окисление получающихся паров свободного фосфора кислородом воздуха
3 стадия – орошение водой получающейся окиси фосфора:
Лабораторный способ
Физические свойства, строение фосфорной кислоты
Степень окисления фосфора в фосфорной кислоте равна +5, валентность равна V.
При нагревании орто-фосфорной кислоты выше +213 °C, она переходит в пирофосфорную H4P2O7.
При нагревании выше 700°С переходит в метафосфорную кислоту HPO3:
Качественные реакции для обнаружения фосфат-иона
Для обнаружения анионов фосфорной кислоты используют раствор AgNO3, при помощи которого также можно различить мета-, пиро- и ортофосфорные кислоты друг от друга.
При добавлении AgNO3 к кислотам образуются осадки различного цвета:
Химические свойства фосфорной кислоты
Фосфорная кислота H3PO4 – это электролит средней силы и представляет собой трехосновную кислоту.
Диссоциация протекает в основном по 1-й ступени:
По 2-й и 3-й ступеням диссоциация протекает в ничтожно малой степени:
В отличие от аниона NO3 — в азотной кислоте, анион РO4 3- окисляющим действием не обладает.
Соли ортофосфорной кислоты (ортофосфаты, фосфаты)
Способы получения фосфатов
Получают кислоты с металлами, оксидами металлов, гидроксидами (см. Химические свойства ортофосфорной кислоты)
Физические свойства фосфатов
Н3РO4 является 3х-основной кислотой, поэтому образует 3 типа солей:
| Анион соли | Название | Растворимость в воде | Примеры солей |
| PO4 3- | Фосфат (ортофосфат) | большинство нерастворимы (кроме фосфатов щелочных металлов и аммония) | Na3РO4; Са3(РO4)2 |
| HPO4 2- | Гидрофосфат | растворимы | Na2НРO4; СаНРО4 |
| Н2РO4 — | Дигидрофосфат | очень хорошо растворимы | NaH2PO4; Са(Н2РO4)2 |
Химические свойства фосфатов
Фосфорные удобрения
Фосфаты и гидрофосфаты кальция и аммония используются в качестве фосфорных удобрений.
При достаточном количестве фосфора растения быстро растут и хорошо плодоносят. Внесение фосфорных удобрений благоприятствует росту корневой системы растения и повышению урожайности. В связи с этим такие удобрения важны при выращивании овощных, зерновых и плодово-ягодных культур.
В таблице ниже приведены основные виды фосфорных удобрений.
Категории V группа (азот, фосфор), НЕОРГАНИЧЕСКАЯ ХИМИЯ
Фосфор. Химия фосфора и его соединений
Фосфор
Положение в периодической системе химических элементов
Фосфор расположен в главной подгруппе V группы (или в 15 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение фосфора
Электронная конфигурация фосфора в основном состоянии :
Атом фосфора содержит на внешнем энергетическом уровне 3 неспаренных электрона и одну неподеленную электронную пару в основном энергетическом состоянии. Следовательно, атом фосфора может образовывать 3 связи по обменному механизму. Однако, в отличие от азота, за счет вакантной 3d орбитали атом фосфора может переходить в возбужденное энергетическое состояние.
Электронная конфигурация фосфора в возбужденном состоянии:
При этом один электрон из неподеленной электронной пары на 3s-орбитали переходит на переходит на 3d-орбиталь. Для атома фосфора в возбужденном энергетическом состоянии характерна валентность V.
Таким образом, максимальная валентность фосфора в соединениях равна V (в отличие от азота). Также характерная валентность фосфора в соединениях — III.
Физические свойства и нахождение в природе
Фосфор образует различные простые вещества (аллотропные модификации).
Белый фосфор — это вещество состава P4. Мягкий, бесцветный, ядовитый, имеет характерный чесночный запах. Молекулярная кристаллическая решетка, а следовательно, невысокая температура плавления (44°С), высокая летучесть. Очень реакционно способен, самовоспламеняется на воздухе.
Покрытие бумаги раствором белого фосфора в сероуглероде. Спустя некоторое время, когда сероуглерод испаряется, фосфор воспламеняет бумагу (процесс лег в основу различных фокусов с самовозгоранием или получением огня из ничего):
Белый фосфор можно расплавить в ёмкости с тёплой водой, поскольку он имеет температуру плавления в 44,15 °C.
Черный фосфор – то наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Чёрный фосфор — это чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, полностью нерастворимое в воде или органических растворителях.
В природе фосфор встречается только в виде соединений. В основном это апатиты (например, Ca3(PO4)2), фосфориты и др. Фосфор входит в состав важнейших биологических соединений —фосфолипидов.
Соединения фосфора
Типичные соединения фосфора:
| Степень окисления | Типичные соединения |
| +5 | оксид фосфора (V) P2O5 ортофосфорная кислота H3PO4 метафосфорная кислота HPO3 Галогенангидриды: PОCl3, PCl5 |
| +3 | Оксид фосфора (III) P2O3 Галогенангидриды: PCl3 |
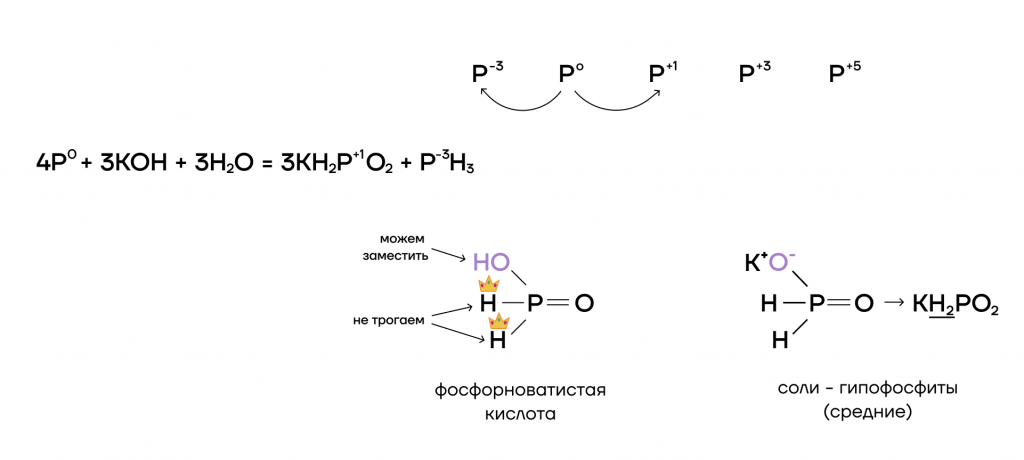
| +1 | Фосфорноватистая кислота H3PO2 Соли фосфорноватистой кислоты — гипофосфиты: MeH2PO2 |
| -3 | Фосфин PH3 Фосфиды металлов MeP |
Способы получения фосфора
4HPO3 + 10C → P4 + 2H2O + 10 CO
3. Красный и черный фосфор получают из белого фосфора.
Химические свойства фосфора
При нормальных условиях фосфор довольно химически активен.
1.1. При взаимодействии с кислородом воздуха образу
ются оксиды – ангидриды соответствующих кислот :
Горение белого фосфора:
Горение красного фосфора:
1.2. При взаимодействии фосфора с галогенами образуются галогениды с общей формулой PHal3 и PHal5:
Фосфор реагирует с бромом:
1.3. При взаимодействии фосфора с серой образуются сульфиды:
1.4. При взаимодействии с металлами фосфор проявляет свойства окислителя, продукты реакции называют фосфидами.
Еще пример : натрий взаимодействует с фосфором с образованием фосфида натрия:
P + 3Na → Na3P
1.5. С водородом фосфор непосредственно не взаимодействует.
2. Со сложными веществами фосфор реагирует, проявляя окислительные и восстановительные свойства. Фосфор диспропорционирует при взаимодействии с некоторыми веществами.
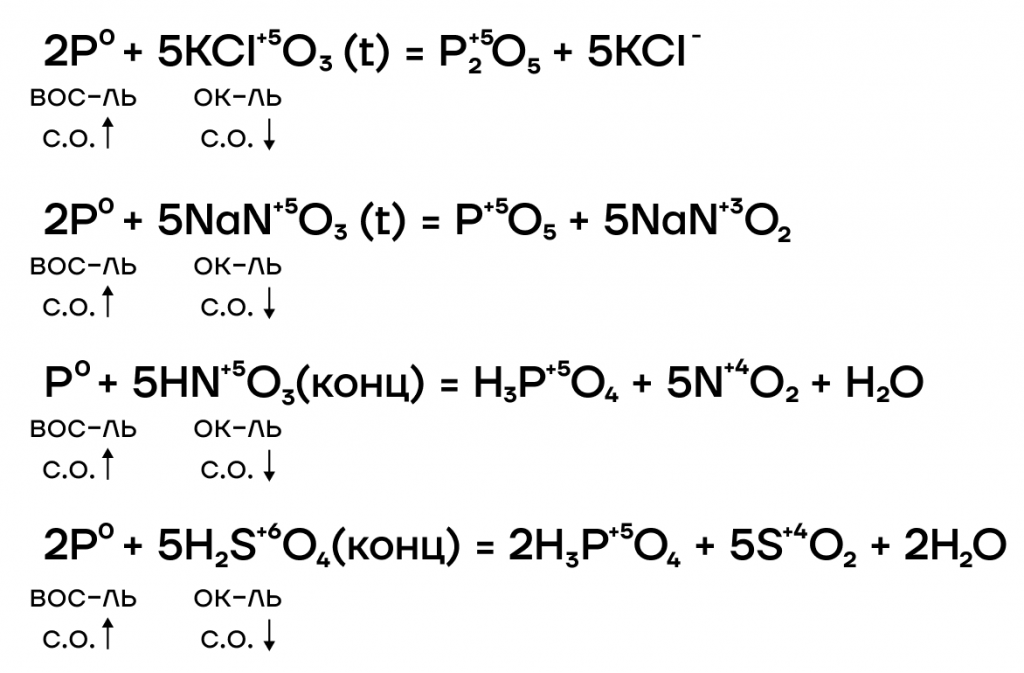
2.1. При взаимодействии с окислителями фосфор окисляется до оксида фосфора (V) или до фосфорной кислоты.
Серная кислота также окисляет фосфор:
Реакция красного фосфора с бертолетовой солью. Этот процесс заложен в принципе возгорания спички при трении её о шершавую поверхность коробка.
2.2. При растворении в щелочах фосфор диспропорционирует до гипофосфита и фосфина.
Или с гидроксидом кальция:
Фосфин
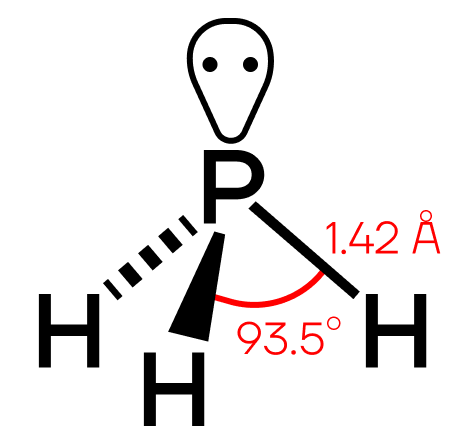
Строение молекулы и физические свойства
Фосфин PH3 – это бинарное соединение водорода с фосфором, относится к летучим водородным соединениям. Следовательно, фосфин газ, с неприятным запахом, бесцветный, мало растворимый в воде, химически нестойкий и ядовитый. Водородные связи между молекулами фосфина не образуются. В твердом состоянии имеет молекулярную кристаллическую решетку.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
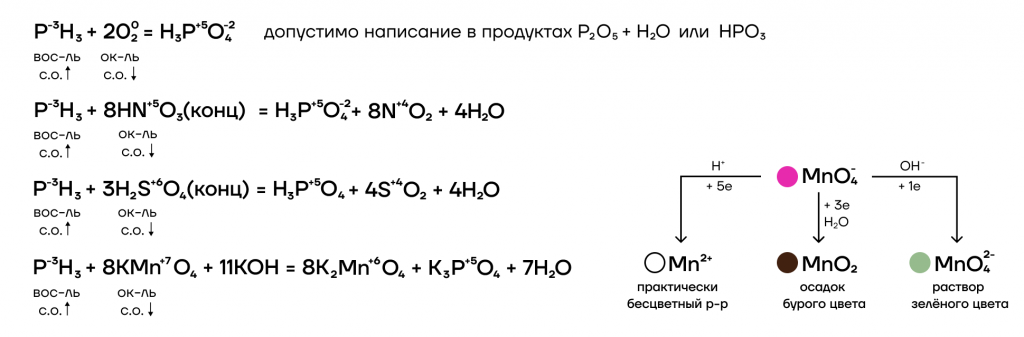
Химические свойства фосфина
Соли фосфония неустойчивые, легко гидролизуются.
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Серная кислота также окисляет фосфин:
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
2PH3 + 2PCl3 → 4P + 6HCl
Фосфиды
Способы получения фосфидов
Фосфор взаимодействует с натрием:
P + 3Na → Na3P
Химические свойства фосфидов
1. Фосфиды легко разлагаются водой или кислотами с образованием фосфина.
Фосфид магния разлагается соляной кислотой:
Оксиды фосфора
| Оксиды азота | Цвет | Фаза | Характер оксида |
| P2O3 Оксид фосфора (III), фосфористый ангидрид | белый | твердый | кислотный |
| P2O5 Оксид фосфора(V), фосфорный ангидрид | белый | твердый | кислотный |
Оксид фосфора (III)
Получить оксид фосфора (III) можно окислением фосфора при недостатке кислорода :
Химические свойства оксида фосфора (III):
Оксид фосфора (III) очень ядовит и неустойчив. Для P2O3 (P4O6) характерны два типа реакций.
1. Поскольку фосфор в оксиде фосфора (III) проявляет промежуточную степень окисления, то он принимает участие в окислительно-восстановительных процессах, повышая либо понижая степень окисления атома фосфора. Характерны для P2O3 реакции диспропорционирования.
2. При взаимодействии с окислителями P2O3 проявляет свойства восстановителя.
3. С другой стороны Р2О3 проявляет свойства кислотного оксида (ангидрид фосфористой кислоты), взаимодействуя с водой с образованием фосфористой кислоты:
а со щелочами – с образованием солей (фосфитов):
Оксид фосфора (V)
Оксид фосфора (V) – это кислотный оксид. В нормальных условиях образует белые кристаллы. В парах состоит из молекул P4О10. Очень гигроскопичен (используется как осушитель газов и жидкостей).
Способы получения. Оксид фосфора (V) получают сжиганием фосфора в избытке кислорода.
Химические свойства.
1. Оксид фосфора (V) – очень гигроскопичное вещество, которое используется для осушения газов. Обладая высоким сродством к воде, оксид фосфора (V) дегидратирует до ангидридов неорганические и органические кислоты.
В зависимости от количества воды и от других условий образуются мета-фосфорная, орто-фосфорная или пиро-фосфорная кислота:
Видеоопыт взаимодействия оксида фосфора с водой можно посмотреть здесь.
Еще пример : оксид фосфора взаимодействует с оксидом бария (при сплавлении):
Фосфорная кислота
Строение молекулы и физические свойства
Фосфор в степени окисления +5 образует несколько кислот: орто-фосфорную H3PO4, мета-фосфорную HPO3, пиро-фосфорную H4P2O7.
Фосфорная кислота H3PO4 – это кислота средней силы, трехосновная, прочная и нелетучая. При обычных условиях фосфорная кислота – твердое вещество, хорошо растворимое в воде и гигроскопичное.
Валентность фосфора в фосфорной кислоте равна V.
При температуре выше +213 °C орто-фосфорная кислота переходит в пирофосфорную H4P2O7.
При взаимодействии высшего оксида фосфора с водой на холоде образуется метафосфорная кислота HPO3, представляющая собой прозрачную стекловидную массу.
Способы получения
Наибольшее практическое значение из фосфорных кислот имеет орто-фосфорная кислота.
1. Получить орто-фосфорную кислоту можно взаимодействием оксида фосфора (V) с водой:
Промышленный способ получения фосфорной кислоты обработка фосфорита концентрированной серной кислотой:
3. Фосфорную кислоту также можно получить жестким окислением соединений фосфора в водном растворе в присутствии кислот.
Химические свойства
1. Фосфорная кислота частично и ступенчато диссоциирует в водном растворе.
HPO4 2– ⇄ H + + PO4 3–
2. Фосфорная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Еще пример : при взаимодействии фосфорной кислоты с гидроксидом калия образуются фосфаты, гидрофосфаты или дигидрофосфаты:
3. Фосфорная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов и др.). Также фосфорная кислота вступает в обменные реакции с солями.
4. При нагревании H3PO4 до 200°С происходит отщепление от нее молекулы воды с образованием пирофосфорной кислоты H2P2O7:
5. Фосфорная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Фосфорная кислота взаимодействует также с аммиаком с образованием солей аммония:
7. Качественная реакция на фосфат-ионы и фосфорную кислоту — взаимодействие с нитратом серебра. При этом образуется ярко-желтый осадок фосфата серебра:
Видеоопыт взаимодействия фосфата натрия и нитрата серебра в растворе (качественная реакция на фосфат-ион) можно посмотреть здесь.
Фосфористая кислота
Фосфористая кислота H3PO3 — это двухосновная кислородсодержащая кислота. При нормальных условиях бесцветное кристаллическое вещество, хорошо растворимое в воде.
Валентность фосфора в фосфористой кислота равна V, а степень окисления +3.
Получение фосфористой кислоты.
Фосфористую кислоту можно получить гидролизом галогенидов фосфора (III).
Фосфористую кислоту можно получить также взаимодействием оксида фосфора (III) с водой:
Химические свойства.
1. Фосфористая кислота H3PO3 в водном растворе — двухосновная кислота средней силы. Взаимодействует с основаниями с образованием солей-фосфитов.
Еще пример : фосфористая кислота окисляется соединениями ртути (II):
Соли фосфорной кислоты — фосфаты
Фосфорная кислота образует разные типы солей: средние – фосфаты, кислые – гидрофосфаты, дигидрофосфаты.
1. Качественная реакция на фосфаты — взаимодействие с нитратом серебра. При этом образуется желтый осадок фосфата серебра.
2. Нерастворимые фосфаты растворяются под действием сильных кислот, либо под действием фосфорной кислоты.
Фосфат кальция растворяется под действием серной кислоты:
3. За счет фосфора со степенью окисления +5 фосфаты проявляют слабые окислительные свойства и могут взаимодействовать с восстановителями.
Фосфат кальция также восстанавливается алюминием при сплавлении:
Под действием едкого кали гидрофосфат калия образует более среднюю соль — фосфат калия: