Парентеральное питание что это такое
Парентеральное питание что это такое
Парентеральное питание что это такое
Энтеральное или парентеральное питание после операции. Энтеральное питание.
Алиментарная поддержка может быть обеспечена энтеральным (через ЖКТ) или парентеральным (внутривенным путем) питанием. Преимущества энтераль-ного питания заключаются в том, что оно менее дорого, сопряжено с меньшим количеством осложнений, с улучшением иммунного статуса и меньшей вероятностью бактериального заражения.
Преимущество парентерального питания заключается в возможности его применения при функциональной несостоятельности ЖКТ. Спорных вопросов больше не существует: если кишки работают, используйте их! Совершенно ясно, что энтеральное питание безопаснее, дешевле и более физиологично, чем парентеральное!
Энтеральное питание
Вкусная пища, принимаемая естественным путем, — идеальная ситуация для пищеварения. Пероральное питание требует, чтобы у пациента были сохранены глотательный механизм и нормальная перистальтика. У пациентов в бессознательном состоянии, находящихся на ИВЛ, главная проблема заключается не в глотании, а в том, что после абдоминальных операций желудок становится более ленивым, чем кишечник. Иными словами, после лапаротомии перистальтика кишечника восстанавливается раньше, чем желудка: кишка готова абсорбировать питание уже в первый послеоперационный день, а в желудке сохраняется замедленное опорожнение по крайней мере еще несколько дней. Поэтому ясно, что при необходимости в раннем послеоперационном питании (или если пероральный прием пищи неадекватен) пища должна поступать, минуя пищевод и желудок.
Пути энтерального питания
Когда питание через рот недоступно, остаются следующие возможности для энтерального питания:
• Назогастральный и назоэнтеральный зонд. Первый из них не используют, если желудок не функционирует. Второй доставляет пищу непосредственно в двенадцатиперстную или тощую кишку. Трансназальное введение даже узкой и мягкой трубки весьма некомфортно, может привести к травме носа, придаточных пазух, в редких случаях — к травме бронхов с последующим попаданием пищевого содержимого в плевральную полость.
• Гастростомия и трансгастроеюнальный зонд. Питательный зонд вводится оперативным путем в желудок и проводится через привратник в тощую кишку.
Это — хирургическая процедура, она связана с нарушением целостности стенки желудка. Основным осложнением, которое встречается редко, но потенциально опасно, является подтекание содержимого мимо трубки наружу или непосредственно в брюшную полость.
• Еюностомический зонд. Питательный зонд (или катетер) вводят непосредственно в проксимальную часть тощей кишки, как это изложено выше. Ясно, что введение пищи прямо в тощую кишку (а не в желудок) чревато меньшей опасностью аспирации.
Должен ли я сам устанавливать еюнальный питательный зонд?
Об этом вы должны спросить себя в конце экстренной лапаротомии. Гораздо удобнее установить зонд на этом этапе, вместо того чтобы делать это в послеоперационном периоде. Вам нужно ответить на 3 поставленных выше вопроса: какова вероятность того, что пациент сможет самостоятельно питаться через 7—10 дней; достаточно ли он упитан; какова тяжесть болезни?
Если пациент — истощенный алкоголик, которому требуется тотальная гастрэктомия с эзофагоеюноанастомозом по поводу массивного желудочно-кишечного кровотечения, это классический повод для установления питательного зонда в тощую кишку. Другой подобный пример — политравма с вовлечением грудной клетки, таза и длинных трубчатых костей и необходимостью лапа-ротомии по поводу повреждения печени. В то же время у хорошо упитанного пациента после резекции желудка введение еюнального питательного зонда не показано — потенциальный риск манипуляции превышает ее преимущества. Вы ведь не хотите вводить зонд пациенту, который в этом вовсе не нуждается?!
ПАРЕНТЕРАЛЬНОЕ ПИТАНИЕ
ПАРЕНТЕРАЛЬНОЕ ПИТАНИЕ (греч, para около, мимо + enteron кишка) — особый вид заместительной терапии, при к-рой питательные вещества для восполнения энергетических, пластических затрат и поддержания нормального уровня обменных процессов вводят в организм парентерально, т. е. минуя желудочно-кишечный тракт. Наиболее часто препараты вводят внутривенно, реже подкожно, внутримышечно, внутрикостно, внутриартериально.
Теоретическое обоснование и решение многих практических вопросов П. п. тесно связано с развитием теории и практики переливания крови. Начиная с середины 20 в., благодаря достижениям в области биологии, химии, биохимии, физики, научно-техническому прогрессу, проведены углубленные исследования обменных процессов при различных патол, состояниях, синтезированы препараты для П. п., разработана техника их применения и методы оценки клин, эффекта.
Сущность П. п. состоит в обеспечении организма всеми необходимыми для нормальной жизнедеятельности субстратами, участвующими в регуляции белкового, углеводного, жирового, водно-электролитного, витаминного обмена и кислотно-щелочного равновесия. Эффект П. п. зависит от адекватного по количеству и качеству введения питательных веществ и степени их усвоения. В количественном отношении вводимые субстраты должны соответствовать основным потребностям организма, компенсировать потери и предупреждать дефицит жидкости и питательных веществ. В качественном отношении они должны быть источниками азота, энергии, воды, минеральных веществ, витаминов. Степень усвоения веществ зависит от правильного выбора препаратов с учетом патофизиол, изменений в организме, обусловленных заболеванием, нарушением нейрогуморальной регуляции обменных процессов, изменением активности ферментативных систем. Многочисленные исследования механизма действия препа-# ратов для П. п. показали, что при правильном применении они способствуют уменьшению катаболизма и создают анаболическую направленность метаболических процессов на клеточном, субклеточном и молекулярном уровнях.
П. п. может быть полным, т. е. включать все необходимые компоненты для восполнения пластических и энергетических затрат и поддержания необходимого уровня обменных процессов, и неполным, при к-ром одни ингредиенты, напр, азотсодержащие вещества, вводят внутривенно, а другие (углеводы, жиры, электролиты и др.) — энтеральным путем.
Содержание
Показания
Показания: тяжелые заболевания и травмы, сопровождающиеся усилением катаболических и угнетением анаболических процессов, отрицательным азотистым балансом, к-рый не удается корригировать вследствие затруднения введения необходимых ингредиентов питания энтеральным путем или нарушения их усвоения. Выделяют абсолютные и относительные показания к П. п.
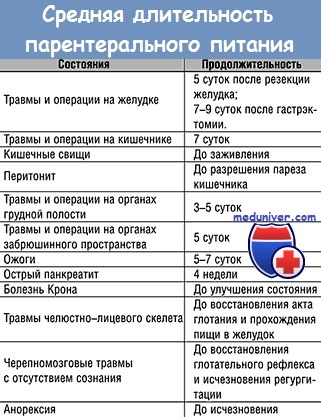
Абсолютные показания: 1) предоперационная подготовка больных с явлениями полного или частичного голодания вследствие локализации патол, процесса в ротовой полости,, глотке, различных отделах пищеварительного тракта, в верхних дыхательных путях (опухоли, рубцовые сужения, ожоги и др.); 2) первые дни после обширных операций на гортани, глотке, пищеводе, органах брюшной и грудной полостей; 3) осложнения послеоперационного периода — несостоятельность различных анастомозов, перитонит, свищи; 4) тяжелые гнойно-септические процессы, обширные ожоги, травмы, кровопотеря; 5) инф. болезни (холера, дизентерия); 6) реанимация и интенсивная терапия с использованием длительной искусственной вентиляции легких (поражения ц. н. с., столбняк, отравления, асфиксия новорожденных и др.); 7) неврологические и психические заболевания при анорексии, рвоте, отказе от приема пищи. При абсолютных показаниях необходимо применение полного П. п.
Относительные показания возникают при недостаточной компенсации пластических потребностей, энергетического и гидроионного баланса организма, несмотря на возможное питание энтеральным путем: 1) нарушение всасывания, переваривания и эвакуации нищи при тяжелых гастритах, энтероколитах, язвенных колитах, язвенной болезни желудка и двенадцатиперстной кишки, дизентерии, токсической диспепсии и др.; 2) усиленный распад белка при хрон, заболеваниях — гнойных процессах, гипертермии, тиреотоксикозе, токсикозе беременных и др.; 3) нарушения синтеза белка при органических и функц, поражениях печени. При относительных показаниях П. п. является неполным, дополнительным.
Противопоказания
Противопоказания к применению отдельных препаратов зависят от характера и степени патофизиол, изменений в организме, обусловленных основным и сопутствующими заболеваниями. При печеночной, почечной недостаточности противопоказаны гидро лизаты белков, аминокислотные смеси, жировые эмульсии; при отеке головного мозга, инфаркте миокарда, сахарном диабете, гиперлипемии, нарушениях коагуляционной способности крови — жировые эмульсии. Большую опасность представляет применение П. п. у больных с аллергическими заболеваниями. Необходим индивидуальный подход в выборе количественного и качественного состава питательных сред.
Препараты
Основными компонентами П. п. являются источники азота и энергии, препараты для нормализации гидроионного равновесия, кислотно-щелочного равновесия, витамины, анаболические гормоны.
Источники азота — гидролизаты белка (см. Гидролизаты) и сбалансированные синтетические аминокислотные смеси (см. Кровезамещающие жидкости, кровезаменители для парентерального питания). Гидролизаты белка (гидролизат казеина, гидролизин Л-103, гидролизин-2, аминопептид, аминокровин, амиген, аминозол и др.) содержат общий азот в пределах 0,7—0,9%. Аминокислотные смеси содержат рационально сбалансированное соотношение незаменимых и заменимых аминокислот и лишены пептидов. Их применение является перспективным, т. к. позволяет создавать целесообразную комбинацию количественного и качественного состава смеси в зависимости от потребностей организма. Они дают более выраженный анаболический эффект. Отечественный препарат амикин содержит 6,5—7,5 г/л общего азота, все незаменимые аминокислоты и полузаменимые — аргинин, гистидин, а также все заменимые, кроме цистина и тирозина; препарат полиамин (ЦОЛИПК) содержит, кроме смеси аминокислот, сорбит как энергетическое средство. Применяют также зарубежные аминокислотные смеси — аминоинфузин, альвезин, мориамин S-2 и др.
В качестве источников энергии широко применяют углеводы (моносахариды), различные спирты и жировые эмульсии. Они удовлетворяют энергетические потребности и оказывают азотсберегающий эффект. Из углеводов наряду с глюкозой (см. Глюкоза как препарат) используют фруктозу и р-р инвертного сахара — смесь равного количества глюкозы и фруктозы. При одинаковой калорийности с глюкозой фруктоза может усваиваться в отсутствие инсулина, в 10 раз быстрее фосфо-рилируется с образованием АТФ и гликогена. Применяют 10% р-ры, оказывающие минимальное раздражающее действие на сосудистую стенку. Инвертный сахар (10% р-р) обладает большим азотсберегающим эффектом, чем глюкоза.
Спирты (этиловый спирт, сорбит, ксилит) по калорийности превосходят углеводы. Этиловый спирт (см.) вводят из расчета 1 г на 1 кг веса тела; противопоказан он при заболеваниях печени. Сорбит и ксилит используют как дополнительные источники энергии в сочетании с углеводами и жировыми эмульсиями. Они обладают витаминсберегающим действием (особенно группы В). Сорбит (20% р-р) оказывает осмодиуретический эффект, улучшает микроциркуляцию. Он хорошо растворяется в белковых гидролизатах.
Жировые эмульсии являются высококалорийными препаратами. Они состоят из дисперсионной среды, жиров растительного происхождения и эмульгаторов. Применение жировых эмульсий позволяет вводить в небольшом объеме значительное количество энергетических субстратов. Оптимальная доза жиров в клин, условиях — 1—2 г на 1 кг веса тела в сутки. Для предотвращения накопления в организме кетоновых тел жировые эмульсии вводят с углеводами в соотношении 1:1. В нашей стране получили распространение 10 и 20% р-ры интралипида (Швеция), обеспечивающие 1000 и 2000 ккал/л. Для предупреждения побочных реакций рекомендуется медленное внутривенное введение эмульсий, начиная с 10 капель в 1 мин. с постепенным увеличением темпа до 60—70 капель в 1 мин. Возможные побочные реакции — озноб, повышение температуры, рвота, головная боль. Для предупреждения гиперкоагуляции на каждый 1 мл жировой эмульсии вводят 5 ЕД гепарина.
Препараты для нормализации гидроионного и кислотно-щелочного равновесия вводят из расчета общих суточных потерь соответственно специфике патол, процесса. Средние суточные потребности в воде — 2200—2600 мл; в электролитах: натрий — 3 ммоль, хлор — 2—3 ммоль, калий — 1 — 3 ммоль на 1 ккал. Предложено большое количество простых и сложных солевых р-ров, введение к-рых контролируется по показателям ионограммы и кислотнощелочного равновесия.
В комплекс П. п. включают также витамины (см.), минеральные вещества (см.) и анаболические гормоны (см. Анаболические стероиды). При введении витаминов должно быть адекватное количество аминокислот, иначе они выводятся с мочой как инородные тела. Рекомендуемые дозы витаминов представлены в таблице 1.
Методика и техника
Питательные ингредиенты вводят наиболее часто внутривенно (см. Катетеризация вен пункционная) через системы одноразового пользования. Р-ры подогревают до t° 37° и вводят медленно капельным способом. Дозы препаратов рассчитывают индивидуально. Средняя потребность в калориях для взрослых составляет 30 ккал на 1 кг веса в сутки. Контроль адекватности П. п. осуществляют: по изменению веса тела, нормализации показателей азотистого баланса, по стабилизации или повышению общего количества циркулирующего в плазме альбумина, уменьшению анемии, улучшению лейкоцитарной формулы.
Осложнения
Для предупреждения этих осложнений важно строгое соблюдение правил асептики и антисептики, исключение возможности бактериального загрязнения растворов. Осложнения, обусловленные реакцией организма на компоненты П.п.: гиперосмолярная некетонная гипергликемия вследствие быстрого введения высоких концентраций глюкозы и недостаточной инсулинотерапии; пирогенные реакции, зависящие от наличия гумусовых веществ в гидролизатах белка (необходим медленный темп вливания и подогревание р-ров, сочетание их с р-рами глюкозы), пирогенности воды, многократного использования инфузионных систем; жировая эмболия (у больных с артериовенозным легочным шунтом); гиперкоагуляция крови при введении жировых эмульсий; гипогликемия при передозировке инсулина; гипераммониемия у больных с нарушенной функцией печени; развитие почечной недостаточности у больных хрон, заболеваниями почек; осмолярный нефроз при быстрой инфузии большого количества гиперосмолярных р-ров (глюкозы, мочевины, декстрана, маннита и др.). Избежать возможных осложнений можно только при тщательном соблюдении методики и техники П. п. и правильном расчете рациона (табл. 1, 2, 3, 4).
Парентеральное питание у детей
Показания: тяжелые гастроэнтериты, некротические энтероколиты, идиопатическая диарея, токсическая диспепсия, синдромы нарушенного кишечного всасывания, состояние после операций по поводу кишечной непроходимости, резекции кишечника и создание кишечных анастомозов, разлитой перитонит, свищи тонкой кишки, обширные ожоги тела, ближайший послеоперационный период после всех тяжелых операций на органах жел.-киш. тракта, невозможность энтерального искусственного питания.
П. п. ребенка, как и взрослого, может быть полным, частичным, дополнительным.
Нередко полное П. п. является единственным способом питания ребенка. Оно может проводиться кратковременно (2—5 дней) и длительно (до нескольких месяцев и даже лет).
П. п. детей осуществляется внутривенным путем. Другие пути введения питательных веществ признаны нерациональными и используются в крайних случаях. Для П. п. используют любые вены, но у детей младшего возраста возможности доступа к венозному руслу ограничены. Наиболее часто производится катетеризация крупных сосудов. Распространенным способом доступа к венозному руслу является катетеризация по Сельдингеру (см. Сельдингера метод). При введении катетера через крупные вены, коллектором к-рых служит верхняя полая вена, внутренний конец катетера следует устанавливать в нижней трети последней. Желателен рентгенол. контроль его положения. Необходима надежная наружная фиксация и предотвращение возможности удаления катетера ребенком. При определенных условиях возможно длительное полное П. п. и через периферические вены, особенно у детей старшего возраста.
Для П. п. применяют препараты белка, к к-рым относятся гидролизаты белка и р-ры кристаллических L-аминокислот. Из отечественных препаратов лучшим для детей можно считать гидролизат казеина ЦОЛИПК.
В качестве энергетического субстрата наиболее часто используют глюкозу. Широкое распространение получают жировые эмульсии. Применяют в педиатрии также р-ры фруктозы, инвертного сахара, сорбита, ксилита, диолов. По данным большинства отечественных и зарубежных исследователей, среди углеводов глюкоза является наиболее физиологичным источником энергии.
П. п. детей может проводиться по системе сбалансированного парентерального питания, или по так наз. скандинавской системе, а также но системе Дадрика, или так наз. гипералиментации. Принципиальным различием их является применение в качестве энергетических субстратов в первом случае — глюкозы и жира, а во втором — только глюкозы.
Для обеих систем характерно одновременное введение пластических и энергетических субстратов. Все препараты должны вводиться с минимальной скоростью (в течение 22 — 24 час.), что обеспечивает максимальное усвоение вводимых веществ и значительно уменьшает возможность развития осложнений. Препараты белка можно смешивать с концентрированными р-рами глюкозы, электролитов, витаминов, микроэлементов. Смешивание этих веществ в одном резервуаре с жировыми эмульсиями не допускается. Одновременное введение жировых эмульсий с препаратами белка, глюкозы и другими растворами осуществляется через Y-образный тройник, присоединяемый к адаптеру катетера. При приготовлении препаратов и их смесей к введению необходимо строгое соблюдение асептики. Хранение приготовленных смесей для парентерального питания не допускается. Препараты хранятся только в фабричной упаковке с соблюдением условий, указанных предприятием-изготовителем.
П. и. по сбалансированной системе характеризуется введением доз питательных веществ, соответствующих нормальным потребностям организма, и может проводиться длительное время через периферические вены у детей любого возраста. До 40% энергетических потребностей обеспечивается окислением нейтрального жира, вводимого в виде жировых эмульсий. Потребность в углеводах компенсируется введением 10 —15% р-ров глюкозы.
При П. п. по Дадрику необходима катетеризация крупных вен, т. к. применяемые р-ры имеют высокую концентрацию, и их введение может вести к повреждению эндотелия вены малого калибра. Длительное П. п. но этой системе требует постепенного повышения толерантности организма ребенка к глюкозе в течение 2—3 дней, что достигается постепенным повышением концентрации р-ров и суточных доз. Основной р-р для введения составляют из 50% р-ра глюкозы и какого-либо белкового препарата с добавлением необходимых количеств электролитов, витаминов, микроэлементов. Потребность в микроэлементах может быть удовлетворена введением плазмы 2 раза в неделю по 10 мл/кг. Отмену «гипералиментации» проводят постепенно во избежание гипогликемических состояний. Инсулин обычно не применяют. Допускается глюкозурия величиной 1—2% от введенного количества глюкозы.
Наиболее сложным является проведение полного П. п. у детей первых месяцев жизни. Состав полного П. п. по двум системам для детей до 3-месячного возраста приведен в таблице 5.
Осложнения П. п. у детей те же, что и у взрослых; необходимость использовать главным образом крупные вены увеличивает возможность осложнений, связанных с погрешностями катетеризации. К гидролизатам белка для П. п. детей предъявляются особо жесткие требования относительно очистки, апирогенности, антигенных свойств.
Таблицы
Таблица 1. ПРИМЕРНЫЙ РАСЧЕТ КОМПОНЕНТОВ ПОЛНОГО ПАРЕНТЕРАЛЬНОГО ПИТАНИЯ ДЛЯ ВЗРОСЛЫХ
Современные возможности парентерального питания
Опубликовано в журнале:
Вестник интенсивной терапии »» № 2 ’98 А.Л. Костюченко, А.В. Канючевский
ВмедА, С.-Петербург, Медицинский центр ЦБ РФ, Москва
Проблема парентерального искусственного питания (ПИП) в целом не утратила своего значения даже на фоне бума искусственного энтерального зондового питания, который в настоящее время переживает клиническая медицина в целом и хирургия, в частности (А.Л. Костюченко и др., 1996). Противопоставлять эти два метода поддержания энергетического и пластического обеспечения организма больного или раненого было бы не правильно: клиницисты должны с одинаковым мастерством пользоваться как тем, так и другим методом.
Принципиально показания к ПИП в клинической медицине могут быть сведены к четырем позициям, которые в свое время были сформулированы A. Wretlind и A. Shenkin (1980). Три из них используются в практике работы хирургических стационаров особенно часто. Полагаем, что данный вид искусственного питания следует назначать раненым (больным) в случаях:
Принципиальное решение лежит в использовании сред, имеющих параметры, на сегодняшний день близкие к идеальным, например, чтобы 1 л препарата, содержавшего фруктозу, глюкозу, ксилит, обеспечивал половину суточной потребности взрослого («среднего») больного в энергии. Производство подобных препаратов вряд ли доступно отечественной промышленности, в то же время энергетический полиионный раствор (ПИЛ), разработанный и апробированный многолетней практикой в клиниках ВМедА может производиться как в условиях клинической аптеки, так и в заводских условиях (Ю.Н. Шанин, 1978). Он представляет 25% р-р глюкозы, к 1 л которого добавлено 3 г КСl, 0,8 г СаСl2 и 0,4 г MgСl2. Энергетическая емкость такого раствора (при полном усвоении глюкозы) составляет 1 ккал/мл, что облегчает расчет адекватного энергетического обеспечения.
Кроме прямого нутритивного эффекта ЖЭ существует еще по крайней мере три важных аспекта применения этих препаратов как лекарственных средств. Первый может быть отнесен к использованию ЖЭ как средств подавления избыточной липаземии при деструктивном панкреатите в фазу эндогенной интоксикации. Н.И. Батвиников, П.В. Гарелик (1983), В.К. Гостищев, С.В. Залит (1983) показали, что при вливании жировой эмульсии (даже по 500 мл в день) последняя становится для сывороточной липазы приоритетной «мишенью», и фермент расходуется на поступившие в кровь триглицериды, что приводит не только к хорошему эффекту парентерального питания, но и к быстрому разрешению панкреатической эндогенной интоксикации при остром панкреатите. К такому же выводу пришли Н.П. Бычихин и Д.А. Смирнов (1987), считающие, что полное насыщение фосфолипаз таким субстратом регулирует секреторную активность поджелудочной железы.
Второй аспект касается клинической ситуации, когда медленно вводимая с гепарином ЖЭ используется для реституции легочных сурфактантов при остром повреждении легких с их прогрессирующим уплотнением и развитием легочной несостоятельности.
Наконец, имеется и третий аспект. Исследованиями, проведенными на кафедре анестезиологии Калифорнийского университета В.В. Сериковым (1996), доказано взаимодействие липопротеидов крови с микробным эндотоксином и установлена возможность использования экзогенных липопротеидов для дезиптоксикации организма больного при бактериальном сепсисе. Открытие антитоксической и иммуномодулирующей функции липопротеидов открывает новые перспективы их применения в медицине критических состояний.
Прорыв был осуществлен фирмой B. Braun Melsungen AG созданием препарата Липофундин МСТ/ЛСТ, жировой компонент которого представлен как длинноцепочечными (ЛСТ), так и среднецепочечными (МСТ) триглицеридами. Это позволило добиваться как быстрой элиминации жира из кровеносного русла, так и его полного включения в обменные процессы, ибо среднецепочечные триглицериды покидают кровеносное русло быстрее и окисляются более полно. Кроме того, в таком случае отсутствует их взаимодействие с системой резидентных макрофагов и существенно меньше возможность дисфункции печени при длительном применении. Желательно инфузировать ЖЭ через отдельный инфузионный тракт, лучше всего с помощью инфузионного насоса (ДЛВ-1 ВНИИМП, Инфузомат Braun, Фло-Гард 6201 Baxter и др.), что позволяет четко выдерживать темп ее введения (0,5-1 мл/кг в ч). Обязательно сочетанное вливание этого источника питательных субстратов с растворами моносахаридов: доля ЖЭ в пуле энергетического обеспечения за счет искусственного питания не должна превышать 30-35%.
У больных, получавших данную жировую эмульсию, в динамике исследовали уровень триглицеридов в плазме (табл. 1).
Таблица 1
Динамика концентрации ТГ в плазме крови (в мМоль/л) на этапах ПИП с включением Липофуидина МСТ/ЛСТ.
| Этап исследования | Исходн. (n0=51) | 7-8 сут. (n1=23) | 15-18 сут. (n2=14) | 25-40 сут. (n3=7) |
| Норма 0,10-2,15 | 1,22+/-0,68 | 3,43+/-1,25 | 4,54+/-2,05 | 5,96+/-2,98 |
Ни у одного из больных не было непосредственных реакций на вливание этой среды. Только у 5 пациентов при применении эмульсии в сроки от 16-18 до 28-35 сут. отмечены признаки, которые можно было считать проявлением синдрома перегрузки; гепатомегалия, спленомегалия, анемия, лейкопения, тромбоцитопения и снижение коагуляционного потенциала, повышение уровня ТГ плазмы в 2,5-3,5 раза. У одной пациентки на 72 сут. от начала применения ЖЭ наблюдали гипер-билирубинемию и отчетливую желтуху (сывороточный гепатит и механическая желтуха исключены). Однако установить четкую связь перечисленных симптомов с синдромом перегрузки не представляется возможным, так как у всех этих больных диагностировались: системный воспалительный ответ/сепсис, множественная органная дисфункция или органная несостоятельность.
У части больных с диагностированным синдромом острого повреждения легких не выявлено углубления нарушений газообмена в легких и расстройств легочной гемодинамики, а у больных с сепсисом не доказано отрицательного влияния ЖЭ на кардиореспираторные показатели.
Таким образом, длительное использование структурированных липидов МСТ/ЛСТ (40-50 и более суток) не сопровождалось отчетливыми побочными эффектами. Полагаем, что при соблюдении режима инфузии Липофундин МСТ/ЛСТ является не только эффективным, но и безопасным источником энергии по сравнению с ЛСТ-эмульсиями (на основании анализа опыта прошлых лет в различных лечебных учреждениях).
Хотя неполные гидролизаты белков крови или молока на первом этапе развития проблемы ПИП обеспечивали формирование оптимальных для того времени (70-е годы) программ нутритивной поддержки в хирургической клинике (Dudrick S.J, et аl., 1972), время их широкого использования прошло. Относительно частая непереносимость даже хорошо очищенных гидролизатов вследствие индивидуальных особенностей пациентов, сенсибилизация к чужеродным белкам, субъективные факторы нередко затрудняли их применение, даже в тех случаях, когда использовали медленное введение, буферированне добавлением раствора гидрокарбоната натрия, медикаментозное сопровождение инфузии гидролизатов антигистаминными препаратами.
В настоящее время отечественному реаниматологу доступны около 10 коммерческих аминокислотных смесей; вышеперечисленные критерии являются предпочтительными при выборе конкретного препарата.
Если для коротких курсов ПИП эти различия малосущественны (с более или менее одинаковым успехом можно использовать отечественный Полиамин или Аминостерил (Haemopharm) с содержанием 25% незаменимых аминокислот и отношением LEU/ILE 1,50, то для длительного парентерального питания предпочтительнее Вамин 14 или Вамин 18 (Upjohn & Pharmacia) с содержанием 45% незаменимых левовращающих аминокислот, но отношением LEU/ILE 1,40 или Аминостерил (Fresenius) с отношением LEU/ ILE 1,51.
К сожалению, приходится наблюдать, как эти препараты, иногда очень качественные и дорогие, переливаются с помощью обычной инфузионной системы. Следует еще раз подчеркнуть, что при полном ПИП аминокислотные смеси переливают только параллельно с р-рами углеводов или жировыми эмульсиями, используя устройства типа КП-11-01 или два соединенных устройства Р-11-01, что создается проколом иглой одной инфузионной системы инъекционного узла другой. При этом, соотношение между энергодающими питательными субстратами и источниками азота должно соответствовать алгоритму Scifart: не менее 30 небелковых калорий на 1 г аминокислот. Иногда можно использовать принцип «все в одном» и смешивать аминокислотные смеси с энергосубстратами, например с концентрированными растворами углеводов. Однако необходимость медленного вливания такой смеси сохраняется во избежание неблагоприятных реакций и осложнений данного варианта нутритивной поддержки.
Азотосберегающее действие адекватного энергетического обеспечения с помощью ЖЭ или энергетического полиионного р-ра может быть усилено в конкретной клинической ситуации. Наряду с оптимальным подбором программы и доз питательных веществ эффект значительно возрастает при подборе адекватных доз инсулина, использования витаминов группы В (кобаламин, фолиевая кислота), анаболиков (метилурацил) и анаболических стероидов (метандриол, нероболил, ретаболил, дека-дураболин).
Иногда для усиления утилизации аминокислот и более быстрого включения их в процессы синтеза белка используют специальные решения. К ним может быть отнесено применение ненаркотических доз оксибутирата натрия вместе с инфузионной средой или применение ГБО в терапевтических барокамерах после завершения каждого сеанса ПИП.
Парентеральное питание что это такое
Развеиваем мифы о парентеральном питании
1. Может ли проведение в предоперационном периоде полного парентерального питания (ППП) улучшить исход хирургической операции?
Уже доказано, что при нарушении питания повышается риск септических осложнений, ухудшается заживление ран, увеличивается продолжительность пребывания в стационаре и повышается летальность. Однако результаты последних исследований, касающихся проведения полного парентерального питания (ППП) в предоперационном периоде и исходов хирургических операций, весьма разнообразны.
Они указывают на то, что полное парентеральное питание (ППП) способствует увеличению количества послеоперационных септических осложнений. По-видимому при незначительных или умеренных нарушениях питания риск осложнений, связанных с проведением ППП в предоперационном периоде, превышает пользу от пего. Однако в случаях серьезного нарушения питания представляется полезным проведение ППП в течение 10 дней перед операцией.
2. Соответствует ли процентное содержание жировых калорий в растворах полного парентерального питания (ППП) диете здоровых жителей развитых стран (т.е. 30% килокалорий)?
Согласно рекомендациям Американской кардиологической ассоциации (АКА) 30 % всех получаемых калорий должны обеспечиваться жирами. Такое распределение калорий предотвращает развитие сердечно-сосудистых заболеваний, но неприемлемо для парентерального питания тяжелых больных.
Кроме того, АКА рекомендует, чтобы жировые калории в равной степени обеспечивались насыщенными, мононенасыщенными и полиненасыщенными жирами, включая группу жирных кислот омега-3. Существующие в настоящее время в США жировые эмульсии изготовлены из масла соевых бобов или из смеси соевого и подсолнечного масел. Поэтому они содержат преимущественно полиненасыщенные (омега-6) жирные кислоты.
Наиболее выгодным в экономическом отношении источником калорий является глюкоза. Следом идут стандартные растворы аминокислот и жиры. Парентеральное введение жиров в количестве, превышающем 1 г/кг веса тела, вызывает снижение иммунитета и ухудшает оксигенацию у тяжелых больных. Возможно некоторые из этих проблем разрешатся, когда в США появятся растворы, содержащие смешанные жиры, структурированные жиры и рыбий жир.
3. Оказывают ли положительное влияние на клинический исход растворы с повышенным содержанием аминокислот с разветвленными радикалами (антистрессовые растворы и растворы, применяемые при печеночной недостаточности)?
К специальным растворам аминокислот, предназначенным для удовлетворения специфических потребностей при печеночной или почечной недостаточности, относятся «стресс»-формулы с высокой концентрацией аминокислот с разветвленными радикалами (АРР) и низкой концентрацией ароматизированных аминокислот.
Специальный «почечный» состав с высоким содержанием незаменимых аминокислот был разработан для максимального обеспечения белком больных с острой почечной недостаточностью в условиях отсутствия диализа. Стоимость специальных изотонических азотсодержащих растворов в 20 раз превышает стоимость стандартных растворов аминокислот. Сравнительные исследования стандартных растворов парентерального питания и растворов аминокислот с разветвленными радикалами у хирургических больных продемонстрировали положительное влияние последних на поддержание уровня азота, висцерального белка и иммунитета.
Однако заметных преимуществ в снижении уровня заболеваемости и летальности не наблюдалось. Специальные растворы, применяемые при печеночной или почечной недостаточности, не улучшают питательный статус или исход заболевания.
4. Всегда ли при панкреатите показано парентеральное питание?
Когда нужно предоставить «отдых» поджелудочной железе, стандартной мерой по обеспечению питательными веществами является полное парентеральное питание. Однако последние исследования показывают, что в подобных случаях также возможно проводить энтеральное кормление через тощую кишку. По сравнению с полным парентеральным питанием (ППП) кормление через тощую кишку не стимулирует поджелудочную железу и приводит к сокращению септических осложнений.
Раннее энтеральное питание хорошо переносится и гораздо дешевле парентерального питания. Состав питательных растворов и уровень введения энтеральных смесей в желудочно-кишечный тракт определяют степень экзокринной стимуляции поджелудочной железы.
5. Действительно ли парентеральный глутамин улучшает клинический исход при трансплантации костного мозга?
Глутаминовая кислота является доминирующей аминокислотой в мышцах и плазме. Уровень ее снижается при хирургических вмешательствах, травмах или стрессе. Поэтому она считается условно незаменимой аминокислотой. Глутаминовая кислота — это метаболический субстрат для быстроделящихся клеток. Считается, что она поддерживает анатомическую и функциональную сохранность кишечного барьера и защищает его от свободных радикалов, поддерживая концентрацию глутатиона.
Из-за ограниченной растворимости и относительной нестабильности глутаминовая кислота не входит в состав стандартных растворов аминокислот. Ее дипептидная форма, связанная с аланином или глицином, является более стабильной и лучше растворима. Пероральный прием глутаминовой кислоты снижает тяжесть и продолжительность воспаления слизистой полости рта и глотки у больных с аутогенной трансплантацией костного мозга.
При парентеральном введении глутаминовая кислота повышает азотный баланс, облегчает клинические симптомы инфекционных осложнений, сокращает продолжительность и стоимость лечения в стационаре и способствует восстановлению лимфоцитов после трансплантации костного мозга.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Принципы парентерального питания
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
ММА имени И.М. Сеченова
П итание является важным компонентом лечения многих заболеваний и травматических повреждений.
Искусственное питание (энтеральное или парентеральное) показано больным, не получающим пищу на протяжении 7–10 суток, а также в тех случаях, когда самостоятельное питание недостаточно для поддержания нормального питательного статуса.
Парентеральное питание применяется при невозможности или недостаточности естественного питания.
Целью парентерального питания является обеспечение организма пластическими материалами, энергетическими ресурсами, электролитами, микроэлементами и витаминами.
Необходимость в парентеральном питании связана с катаболической направленностью обмена при травматических повреждениях, заболеваниях внутренних органов, тяжелых инфекционных процессах и в послеоперационном периоде. Выраженность катаболической реакции прямо пропорциональна тяжести поражения или заболевания.
При любой травме могут возникать расстройства гемодинамики и дыхания, приводящие к гипоксии, нарушению водно–электролитного баланса, кислотно–щелочного состояния, гемостаза и реологических свойств крови. Одновременно при стрессе через гипофиз, кору надпочечников, щитовидную железу стимулируется основной обмен, повышается расход энергии, усиливается распад углеводов и белков.
Запасы глюкозы в виде гликогена (в мышцах и печени) при голодании быстро (через 12–14 часов) истощаются, затем происходит расщепление собственного белка до аминокислот, которые в печени преобразуются в глюкозу. Этот процесс (глюконеогенез) неэкономичен (из 100 г белка вырабатывается 56 г глюкозы) и приводит к быстрой потере белка.
Большие потери белка отрицательно влияют на репаративные процессы, иммунитет и создают условия для развития осложнений. Недостаточность питания у хирургических больных приводит к увеличению послеоперационных осложнений в 6 раз, а летальности – в 11 раз (G.P.Buzby и J.L.Mullen, 1980).
Оценка состояния питания
Предложено много способов оценки питательного статуса. Некоторые из них приведены в таблице 1.
Важное значение для оценки питания имеют анамнез (отсутствие аппетита, тошнота, рвота, похудание) и осмотр больного (атрофия мышц, утрата подкожного жирового слоя, гипопротеинемические отеки, симптомы авитаминозов и дефицита других питательных веществ).
Выбор оптимального метода нутритивной поддержки
Искусственная нутритивная поддержка больных может осуществляться в форме парентерального или (и) энтерального питания.
Выделяют полное парентеральное питание, при котором обеспечение питательными веществами осуществляется только внутривенными вливаниями (используются, как правило, центральные вены) и дополнительное парентеральное питание через периферические вены (назначается на короткий срок как дополнение к энтеральному питанию).
Алгоритм рационального выбора нутритивной поддержки представлен на рисунке 1.
Показания к парентеральному питанию
Показания к парентеральному питанию могут быть условно объединены в 3 группы: первичная терапия, при которой предполагается влияние питания на заболевание, явившееся причиной нарушения нутритивного статуса; поддерживающая терапия, при которой обеспечивается нутритивная поддержка, но отсутствует влияние на причину заболевания; показания, которые находятся в стадии изучения (J.E. Fischer, 1997).
Эффективность доказана (Проведены рандомизированные проспективные исследования.)
Эффективность доказана (Проведены рандомизированные проспективные исследования.)
После выявления показаний к парентеральному питанию необходимо рассчитать необходимые компоненты для адекватной коррекции энергетических затрат, выбора оптимальных растворов для вливания на основе определения потребности в белке, жирах, углеводах, витаминах, микроэлементах и воде.
Расчет энергетических потребностей
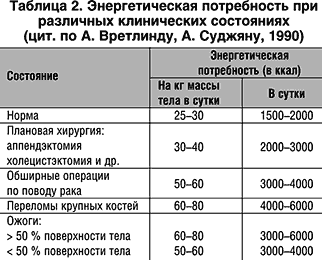
Энергетические затраты зависят от тяжести и характера заболевания или травмы (табл. 2).
Для более точного подсчета энергетических затрат используют основной обмен.
Основной обмен представляет собой минимальные энергетические потребности в условиях полного физического и эмоционального покоя, комфортной температуре и при 12–14 часовом голодании.
Величина основного обмена определяется с помощью уравнения Харриса–Бенедикта (Harris–Benedict):
для мужчин: ОО = 66 + (13,7хВТ) + (5хР) – (6,8хВ)
для женщин: ОО = 655 + (9,6хВТ) + (1,8хР) – (4,7хВ)
ОО = основной обмен в ккал, ВТ = вес тела в кг, Р = рост в см, В = возраст в годах.
В норме истинный расход энергии (ИРЭ) превышает основной обмен и его оценивают по формуле:
А – фактор активности:
| Постельный режим | 1,1 |
| Полупостельный режим | 1,2 |
| Общий режим | 1,3 |
Т – температурный фактор (температура тела):
| 38°С | 1,1 |
| 39°С | 1,2 |
| 40°С | 1,3 |
| 41°С | 1,4 |
П – фактор повреждения:
| Пациент без осложнений | 1,0 |
| После операции | 1,1 |
| Перелом костей | 1,2 |
| Сепсис | 1,3 |
| Перитонит | 1,4 |
| Политравма, реабилитация | 1,5 |
| Политравма + сепсис | 1,6 |
| Ожоги 30–50% | 1,7 |
| Ожоги 50–70% | 1,8 |
| Ожоги 70–90% | 2,0 |
В среднем, на долю белков приходится 15–17%, углеводов – 50–55% и жиров – 30–35% выделяемой энергии (в зависимости от конкретных условий метаболизма и диеты).
Расчет потребности белка
В качестве показателя белкового обмена используется азотистый баланс (разница между количеством азота, поступающим в организм с белками и теряемым различными путями) (табл. 3).
Применяют также определение потери азота по содержанию мочевины в суточной моче (мочевина в граммах х 0,58).
Потеря азота соответствует потере белка и приводит к уменьшению массы тела (1 г азота = 6,25, белка = 25 г мышечной массы)
Основной целью введения белков является поддержание баланса между поступлением белка и его расходом в организме. При этом, если одновременно не поступает достаточно калорий небелкового происхождения, то окисление белка усиливается. Поэтому следует соблюдать следующее соотношение между небелковым калоражем и азотом: число небелковых калорий/азот в граммах=100–200 ккал/г.
Азотистый компонент в рационе парентерального питания может быть представлен гидролизатами белка и аминокислотными смесями, получаемыми путем синтеза. Использование для парентерального питания препаратов нерасщепленного белка (плазмы, протеина, альбумина) малоэффективно в силу слишком большого периода полураспада экзогенного белка.
Гидролизаты белка, используемые для парентерального питания, являются растворами аминокислот и простейших пептидов, получаемых при гидролитическом расщеплении гетерогенных белков животного или растительного происхождения. Гидролизаты белков хуже (по сравнению с аминокислотными смесями) утилизируются организмом из–за наличия в них высокомолекулярных фракций пептидов. Более оправдано использование аминокислотных смесей, из которых затем синтезируются специфические органные белки.
Аминокислотные смеси для парентерального питания должны отвечать следующим требованиям: содержать адекватное и сбалансированное количество заменимых и незаменимых аминокислот; быть биологически адекватными, т.е. чтобы организм мог трансформировать аминокислоты в собственные белки; не вызывать побочных реакций после их поступления в сосудистое русло.
Противопоказания к введению гидролизатов белка и аминокислотных смесей:
1. нарушение функции печени и почек – печеночная и почечная недостаточность (используются специальные аминокислотные смеси);
2. любые формы дегидратации;
3. шоковые состояния;
4. состояния, сопровождающиеся гипоксемией;
5. острые гемодинамические нарушения;
6. тромбоэмболические осложнения;
7. выраженная сердечная недостаточность.
Углеводы являются наиболее доступными источниками энергии для организма больного. Их энергетическая ценность составляет 4 ккал/г.
Для парентерального питания применяют глюкозу, фруктозу, сорбитол, глицерол. Минимальная суточная потребность тканей в глюкозе составляет около 180 г.
Оптимально введение 30% раствора глюкозы с добавлением инсулина (1 ЕД инсулина на 3–4 г сухого вещества глюкозы). У пожилых больных в первые 2 суток после операции целесообразно снизить концентрацию глюкозы до 10–20%.
Введение глюкозы снижает глюконеогенез, поэтому глюкозу включают в состав парентерального питания не только как энергоноситель, но и для получения белковосберегающего эффекта.
Избыточное введение глюкозы, однако, может вызвать осмотический диурез, с потерей воды, электролитов и развитием гиперосмолярной комы. Передозировка глюкозы приводит к усилению липонеогенеза, при котором организм синтезирует триглицериды из глюкозы. Этот процесс происходит, в основном, в печени и жировых тканях и сопровождается очень высокой продукцией СО2, что приводит к резкому возрастанию минутного дыхательного объема и, соответственно, частоты дыхания. Кроме того, может возникнуть жировая инфильтрация печени, если гепатоциты не справляются с выведением образующихся триглицеридов в кровь. Поэтому доза глюкозы для взрослых не должна превышать 6 г/кг веса тела в сутки.
Жиры являются самым выгодным источником энергии (энергетическая ценность составляет 9,3 ккал/г).
На долю жиров приходится 30–35% ежедневного поступления калорий, из них большую часть составляют триглицериды (эфиры, состоящие из глицерола и жирных кислот). Они являются источником не только энергии, но и незаменимых жирных кислот, линолевой и a–линоленовой – предшественников простагландинов. Линолевая кислота принимает участие в построении клеточных мембран.
Оптимальная доза жиров в клинических условиях составляет 1–2 г/кг массы тела за сутки.
Потребность в жирах при парентеральном питании обеспечивается жировыми эмульсиями.
Введение жировых эмульсий в изолированном виде нецелесообразно (возникает кетоацидоз), поэтому используют одновременное введение раствора глюкозы и жировой эмульсии с соотношением числа калорий 50:50 (в норме 70:30; при политравме, ожогах – 60:40).
Из используемых в нашей стране наибольшее распространение получили препараты интралипид и липофундин. Достоинством интралипида является то, что в 20% концентрации он изотоничен плазме и его можно вводить даже в периферические вены.
Противопоказания к введению жировых эмульсий в основном такие же, как и для введения белковых растворов. Нецелесообразно введение жировых эмульсий больным с нарушениями жирового обмена, при сахарном диабете, тромбоэмболии, остром инфаркте миокарда, беременности.
Потребность в воде при парентеральном питании рассчитывается исходя из количества потерь (моча, кал, рвотные массы, дыхание, отделяемое по дренажам, отделяемое из свищей и т.д.) и тканевой гидратации. Клинически это оценивается по количеству мочи и ее относительной плотности, эластичности кожи, влажности языка, наличию жажды и изменению массы тела.
В норме водные потребности превышают диурез на 1000 мл. При этом эндогенное образование воды не учитывается. Потеря белков, электролитов и глюкозурия значительно увеличивают потребность организма в экзогенной воде.
При парентеральном питании рекомендуется вводить 30–40 мл воды на 1 кг массы тела для взрослых. Считается, что цифровое количество вводимых килокалорий должно соответствовать цифровому значению объема перелитой жидкости (в миллилитрах).
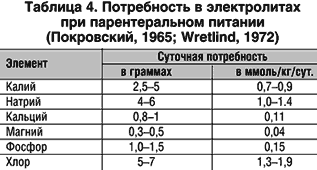
Электролиты являются неотъемлемыми компонентами полного парентерального питания. Калий, магний и фосфор необходимы для оптимального удержания азота в организме и для образования тканей; натрий и хлор – для поддержания осмоляльности и кислотно–щелочного равновесия; кальций – для предотвращения деминерализации костей (табл. 4).
Для покрытия потребности организма в электролитах используются следующие инфузионные среды: изотонический раствор хлорида натрия, сбалансированные растворы электролитов (лактосол, ацесоль, трисоль и т.д.), раствор 0,3% хлорида калия, растворы хлорида, глюконата и лактата кальция, лактата и сульфата магния.
Расчет витаминов и микроэлементов
Проведение парентерального питания предусматривает использование витаминных комплексов и микроэлементов. Количество витаминов и микроэлементов, достаточное для удовлетворения суточных потребностей, следует добавлять к основному раствору для парентерального питания (табл. 5 и 6). Применение витаминов в рационе оправдано при полном аминокислотном обеспечении, в противном случае они не усваиваются, а экскретируются преимущественно с мочой. Не следует вводить избыточных количеств жирорастворимых витаминов (А, D) в связи с опасностью развития гиперкальциемии и других токсических эффектов.
Для парентерального питания применяются специальные смеси витаминов и микроэлементов.
В последние годы производят комбинированные препараты, содержащие аминокислоты, минеральные элементы и глюкозу.
Условия эффективности проведения парентерального питания
До проведения парентерального питания состояние больного должно быть стабилизировано и устранена гипоксия, так как полное усвоение компонентов парентерального питания происходит только в аэробных условиях. Поэтому в первые часы после обширных операций, травме, ожогах, при терминальных состояниях и шоке при централизации кровообращения можно использовать только растворы глюкозы.
Скорость введения препаратов должна соответствовать скорости их оптимального усвоения (табл. 7).
В расчете суточной калорийности парентерального питания вклад белка не должен учитываться, ибо в противном случае недостаток энергии приведет к сжиганию аминокислот и процессы синтеза не будут реализованы в полном объеме.
Введение средств парентерального питания следует начинать с раствора глюкозы с инсулином (1 ед. на 4–5 г сухого вещества глюкозы). После инфузии 200–300 мл раствора глюкозы подключают аминокислотный препарат или белковый гидролизат. В дальнейшем аминокислотную смесь или гидролизат белка вводят вместе с глюкозой, электролитами и витаминами. Аминокислоты, гидролизаты белка и 30% глюкозу целесообразно вводить со скоростью не более 40 капель в минуту. Жировые эмульсии разрешается переливать вместе с растворами аминокислот и гидролизатами. Не рекомендуется их введение одновременно с электролитами, поскольку последние способствуют укрупнению жировых частиц и повышают риск жировой эмболии. Скорость введения жировой эмульсии вначале не должна превышать 10 капель в минуту. При отсутствии реакции скорость можно увеличить до 20–30 капель в минуту. На каждые 500 мл жировой эмульсии вводят 5000 ЕД гепарина.
Для своевременной коррекции парентерального питания используются клинические и лабораторные методы оценки эффективности питания.
Особенности искусственного питания при некоторых состояниях
Для больных с почечной недостаточностью особое значение имеют объем вводимой жидкости, количество азота и электролитов. При острой почечной недостаточности, если не проводится лечение диализом полное парентеральное питание осуществляют концентрированными растворами (70% глюкоза, 20% жировая эмульсия, 10% раствор аминокислот), что позволяет уменьшить объем жидкости и обеспечивает достаточное количество энергии. В питательной смеси уменьшают содержание азота (при расчете суточной потребности в белках исходят из нормы 0,7 г/кг), снижают также содержание калия, кальция, магния и фосфора.
На фоне лечения диализом количество белка можно увеличить до 1,0–1,5 г/кг/сут.
При печеночной недостаточности страдают все виды обмена, и в первую очередь – белковый. Нарушение синтеза мочевины приводит к накоплению в крови аммиака и других токсичных азотистых соединений. Искусственное питание должно обеспечивать потребности организма в белках и других питательных веществах, но не сопровождаться появлением или усилением энцефалопатии.
Применяют полное парентеральное питание со сниженным содержанием азота; при расчете суточной потребности в белках исходят из нормы 0,7 г/кг веса. При асците, кроме того, ограничивают объем питательной смеси и снижают содержание натрия.
Нарушения белкового метаболизма при печеночной недостаточности приводят к аминокислотному дисбалансу (увеличение концентраций ароматических кислот фенилаланина и тирозина, а также снижение концентраций разветвленных аминокислот изолейцина, лейцина и валина) (J.E. Fischer и соавт., 1976). Эти нарушения вызывают энцефалопатию и, наряду с ограничением в белке, являются главной причиной высокого катаболизма у таких больных.
При снижении функции печени и шунтировании портальной крови, сбалансированный аминокислотный состав в плазме нарушается (особенно аминокислот – предшественников центральных моноаминных нейротрансмиттеров), что сопровождается снижением уровня нейротрансмиттеров в ЦНС и является одной из причин энцефалопатии.
Коррекция аминокислотного дисбаланса достигается введением адаптированной аминокислотной смеси, в которой фракция ароматических аминокислот снижена, а разветвленных – увеличена. Поскольку эти аминокислотные растворы содержат все незаменимые аминокислоты и широкий спектр заменимых аминокислот, они также могут применяться для парентерального питания при печеночной недостаточности.
Парентеральное питание при печеночной недостаточности рекомендуется в следующих дозах: адаптированные аминокислоты – до 1,5 г/кг веса тела в сутки, глюкоза – до 6 г/кг веса тела в сутки и жиры –до 1,5 г/кг веса тела в сутки.
Сердечная и дыхательная недостаточность.
При сердечной недостаточности ограничивают поступление натрия и уменьшают объем питательной смеси. Больным с дыхательной недостаточностью назначают питательные смеси с пониженным содержанием глюкозы и повышенным содержанием жиров. Замена источника энергии с углеводов на жиры позволяет снизить продукцию СО2 и риск гиперкапнии. Жир имеет меньший дыхательный коэффициент, чем углеводы (0,7 и 1,0 соответственно). Больные с гиперкапнией должны получать 40% энергии в виде жировой эмульсии.
Осложнения парентерального питания
При парентеральном питании, как и при других видах инфузионной терапии, возможны аллергические и посттрансфузионные реакции.
Кроме того, выделяют еще несколько видов осложнений парентерального питания:
1. Технические (5%):
– воздушная эмболия;
– повреждение артерии;
– повреждение плечевого сплетения;
– артериовенозная фистула;
– перфорация сердца;
– эмболия катетером;
– смещение катетера;
– пневмоторакс;
– тромбоз подключичной вены;
– повреждение грудного протока;
– повреждение вен.
2. Инфекционные (5%):
– инфекция в месте венепункции;
– «тоннельная» инфекция;
– катетер–ассоциированный сепсис.
3. Метаболические (5%):
– азотемия;
– избыточное введение жидкости;
– гипергликемия;
– гиперхлоремический метаболический ацидоз;
– гиперкальциемия;
– гиперкалиемия;
– гипермагнезиемия;
– гиперосмолярная кома;
– гиперфосфатемия;
– гипервитаминоз А;
– гипервитаминоз D;
– гипогликемия;
– гипокальциемия;
– гипомагнезиемия;
– гипонатриемия;
– гипофосфатемия.
4. Нарушение функции печени.
5. Желчнокаменная болезнь.
6. Метаболические нарушения костной ткани.
7. Дефицит микроэлементов.
8. Дыхательная недостаточность.
Методы контроля эффективности парентерального питания
Клинические показатели:
1) масса тела (взвешивание);
2) центральное венозное давление;
3) почасовой диурез;
4) артериальное давление, пульс;
5) общее состояния больного.
Лабораторные показатели:
1) азотистый баланс;
2) аминокислоты плазмы крови (аминограмма);
3) белки плазмы крови и их фракций (1 раз в сутки);
4) липиды плазмы крови (1 раз в 2–3 сут.);
5) билирубин и его фракции;
6) активность аминотрансфераз;
7) оценка гемостаза.
Продолжительность парентерального питания определяется возможностью и целесообразностью перехода на энтеральное или естественное питание (табл. 8).
Парентеральное питание новорожденных
Общая информация
Краткое описание
Парентеральное питание – это вид искусственного питания или нутритивной поддержки, при котором все питательные вещества или определенная часть вводятся в организм внутривенно, минуя желудочно-кишечный тракт.
Название протокола: Парентеральное питание новорожденных
Код протокола:
Сокращения, используемые в протоколе:
Дата разработки протокола: 2015 год.
Категория пациентов: новорожденные.
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с не высоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+). Результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++или+), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование, или мнение экспертов. |
| GPP | Наилучшая фармацевтическая практика. |
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
13-15 октября, Алматы, «Атакент»
600 брендов, более 150 компаний-участников из 20 стран.
Новинки рынка стоматологии. Цены от производителей
Классификация
Диагностика
Перечень основных и дополнительных диагностических мероприятий
Оценка объема жидкости:
При назначении парентерального питания с нутритивными целями определяется необходимостью следующих процессов [5] (УД – А):
Оценка эффективности ПП согласно рекомендациям ВОЗ «Шкалы прироста массы тела у мальчиков и девочек (Fenton T.R., 2013)» (приложение 1).
В период транзиторной убыли массы тела концентрация натрия (Na+) в экстрацеллюлярной жидкости возрастает. Ограничение Na+ в этот период понижает риск некоторых заболеваний у новорожденных, но гипонатриемия ( Вес ребенка, грамм
Необходимо полное покрытие всех компонентов потребляемой энергии с помощью парентерального и энтерального питания. Только при наличии показаний к полному ПП все потребности необходимо обеспечивать парентеральным путем. В остальных случаях парентерально должно вводиться лишь то количество энергии, которое недополучено энтеральным путем. Наиболее высокая скорость роста характерна для наименее зрелых детей, поэтому необходимо как можно раньше обеспечить ребенка энергией для роста. В транзиторный период необходимо предпринимать усилия для минимизации потерь энергии (выхаживание в условиях термонейтральной зоны, ограничение испарения с кожи, охранительный режим). В 1-3-е сутки жизни обеспечьте поступление энергии, равной обмену покоя, 45-60 ккал/кг. Необходимо увеличивать калорийность ПП ежедневно на 10-15 ккал/кг с целью достижения калорийности 105 ккал/кг к 7-10-м суткам жизни.
При частичном ПП теми же темпами необходимо увеличивать суммарное поступление энергии с целью достижения калорийности 120 ккал/кг к 7-10-м суткам жизни. Отмену ПП необходимо проводить, только когда калорийность энтерального питания достигнет не менее 100 ккал/кг. После отмены ПП должен быть продолжен контроль антропометрических показателей, производите коррекцию питания.
При невозможности достижения оптимального физического развития при исключительно энтеральном питании должно быть продолжено парентеральное питание. Примерный расход энергии у недоношенных новорожденных представлен в табл. 2.
Таблица 2. Компоненты энергетического обмена у недоношенных детей
Жиры являются более энергоемким субстратом, чем углеводы. Белки у недоношенных детей также частично могут использоваться организмом для получения энергии. Избыток небелковых калорий вне зависимости от источника используется для синтеза жиров.
Белки – это важный источник пластического материала для синтеза новых белков, и энергетический субстрат, у детей с ЭНМТ и ОНМТ. 30% поступающих аминокислот может использоваться для целей синтеза новых белков в организме ребенка. При недостаточной обеспеченности небелковыми калориями (углеводами, жирами) доля белка, используемого для синтеза энергии, увеличивается, а на пластические цели используется меньшая доля, что нежелательно. Дотация аминокислот в дозе 3 г/кг в сутки в течение первых 24 часов после рождения у детей с ОНМТ и ЭНМТ безопасна и связана с лучшей прибавкой массы [5] (УД – А);.
Препараты альбумина, свежезамороженной плазмы и других компонентов крови не являются препаратами для парентерального питания. При назначении парентерального питания их не следует принимать в расчет в качестве источника белка.
Метаболический ацидоз не является противопоказанием к применению аминокислот. Необходимо помнить, что метаболический ацидоз в большинстве случаев является проявлением другого заболевания, не имея отношения к применению аминокислот у новорожденных.
Потребность в белке определяется количеством белка, исходя из количества, необходимого на синтез и ресинтез белка в организме (запасаемый белок), идущего на окисление как источник энергии и количества экскретируемого белка.
Оптимальное количество белка или аминокислот в питании определяется гестационным возрастом ребенка, так как композиционный состав тела меняется по мере роста плода.
У наименее зрелых плодов в норме скорость синтеза белка выше, чем у более зрелых, большую долю во вновь синтезированных тканях занимает белок. Поэтому чем меньше гестационный возраст, тем больше потребность в белке.
Оптимальное соотношение белка и небелковых калорий в питании плавное, меняется от 4 г/100 ккал и более у наименее зрелых недоношенных до 2,5 г/100 ккал у более зрелых. Это позволяет моделировать композицию массы тела, характерную для здорового плода.
Тактика дотации белков:
Стартовые дозы, темп увеличения и целевой уровень дотации белка в зависимости от гестационного возраста указаны в таблице 3.
У детей с массой тела при рождении менее 1500 г дотация парентерального белка должна оставаться неизменной до достижения объема энтерального питания 50 мл/кг в сутки.
1,2 г аминокислот из растворов для парентерального питания эквивалентен примерно 1 г белка. Для рутинного расчета принято округлять это значение до 1 г.
Обмен аминокислот у новорожденных имеет ряд особенностей, поэтому для проведения безопасного ПП следует использовать препараты белка, разработанные с учетом особенностей обмена аминокислот у новорожденных и разрешенные с рождения (0 месяцев). Препараты для ПП взрослых не должны применяться у новорожденных.
Дотация аминокислот может осуществляться как через периферическую вену, так и через центральный венозный катетер.
Контроль безопасности и эффективности дотации белка
На сегодняшний день не разработано эффективных тестов, позволяющих контролировать достаточность и безопасность парентерального введения белка. Оптимально использовать для этой цели показатель азотистого баланса, однако в практической медицине для интегральной оценки состояния белкового обмена используется мочевина.
Контроль уровня мочевины информативен в отношении безопасности применения аминокислот, начиная со 2-й недели жизни. Исследование следует проводить с периодичностью 1 раз в 7-10 дней. При этом низкий уровень мочевины ( Масса тела при рождении, грамм
* Белковая нагрузка не изменяется до достижения объема энтерального питания 50 мл/кг в сутки.
** точно не определена, потребность повышается при состояниях, сопровождающихся высоким катаболизмом (сепсис).
Потребность в углеводах рассчитывается на основе потребности в калориях и скорости утилизации глюкозы. В случае переносимости углеводной нагрузки (уровень глюкозы в крови не более 8 ммоль/л) углеводную нагрузку следует увеличивать ежедневно на 0,5-1 мг/кг в 1 мин, но не более 12 мг/кг в 1 мин. Тактика дотации углеводов 1 г глюкозы содержит 3,4 кал.
Тактика назначения представлена в таблице 3.
7,5% КСl – 1,0 ммоль/л
10% КСl – 1,35 ммоль/л
Панангин КСl – 0,25 ммоль/л
10% NаCl – 1,5 ммоль/мл
0,66 мл 10% NаCl = 1 ммоль
Цинк.
Цинк участвует в обмене энергии, макронутриентов и нуклеиновых кислот. Быстрый темп роста глубоконедоношенных детей обусловливает их более высокую потребность в цинке по сравнению с доношенными новорожденными. Глубоконедоношенные дети и дети с высокими потерями цинка, обусловленными диареей, наличием стомы, тяжелыми заболеваниями кожи, требуют включения цинка сульфата в парентеральное питание.
Селен:
Селен является антиоксидантом и компонентом активной глутатионпероксидазы – фермента, защищающего ткани от повреждения активными формами кислорода.
Низкий уровень селена часто встречается у недоношенных детей, что способствует развитию у данной категории детей БЛД и ретинопатии недоношенных. Потребность в селене у недоношенных детей – 1-3 мг/кг в сутки (актуально при очень длительном парентеральном питании в течение нескольких месяцев).
В настоящее время в Казахстане не зарегистрированы препараты фосфора, цинка и селена для парентерального введения, что делает невозможным их использование у новорожденных в ОРИТ.
Парентеральное питание новорожденных
Общая информация
Краткое описание
Клинические рекомендации
Парентеральное питание новорожденных
2015
⨳ Минимизировать число осложнений при проведении парентерального питания.
Лечение
Оценка объема жидкости, который требуется новорожденному – чрезвычайно важный параметр при назначении парентерального питания. Особенности гомеостаза жидкости определяются перераспределением между межклеточным пространством и сосудистым руслом, которые происходят в первые несколько дней жизни, а также возможными потерями через незрелую кожу у детей с экстремально низкой массой тела.
3. Дополнительным количеством для обеспечения формирования новых тканей: нарастание массы на 15-20 г/кг/ сут потребует от 10 до 12 мл/кг/сут воды (0.75 мл/г новых тканей).
Постнатальный период в зависимости от изменений водно-электролитного обмена можно разделить на 3 периода: период транзиторной убыли массы тела, период стабилизации массы и период стабильного нарастания массы.
В транзиторный период происходит убыль массы тела за счет потерь воды, величину убыли массы тела желательно минимизировать у недоношенных путем предотвращения испарения жидкости, но она не должна быть менее 2% от массы при рождении. Обмен воды и электролитов в транзиторный период у недоношенных новорожденных, по сравнению с доношенными, характеризуется: (1) высокими потерями экстрацеллюлярной воды и повышением концентрации электролитов плазмы в связи с испарением с кожи, (2) меньшей стимуляцией спонтанного диуреза, (3) низкой толерантностью к колебаниям ОЦК и осмолярности плазмы.
В период транзиторной убыли массы тела концентрация натрия в экстрацеллюлярной жидкости возрастает. Ограничение натрия в этот период понижает риск некоторых заболеваний у новорожденных, но гипонатриемия (
Парентеральное питание что это такое
Парентеральное питание в хирургии. Принципы парентерального питания
В зависимости от способа доставки питательных компонентов различают:
• центральное парентеральное питание — через магистральные сосуды;
• периферическое парентеральное питание — через периферические вены.
Выбор режимов парентерального питания диктуется имеющейся ситуацией и состоянием больного. При подготовке больного к хирургическому вмешательству в зависимости от его питательного статуса может быть использовано ВПП или ЧПП, которые при относительно небольших сроках проведения могут осуществляться через периферические сосуды. Послеоперационное ПП пациентов, находящихся в отделениях реанимации либо интенсивной терапии, подразумевает ППП и проводится через центральные вены; при небольших сроках использования этого метода возможно ЧПП.
При выборе способа доставки питательных компонентов следует помнить, что введение препаратов в периферические вены является только временной мерой у больных, которых в ближайшие 3—5 дней планируется перевести на энтеральное питание. При абсолютной невозможности питаться естественным путем (нарушение акта глотания, непроходимость кишечника, отсутствие полноценного усвоения, кишечные фистулы, несостоятельность анастомоза, резекции тонкой кишки, т. е. все варианты длительного ПП) используется только ППП через центральные вены. Полное периферическое ПП по сравнению с центральным требует существенно большего объема жидкости, ухудшает венозный кровоток и чревато тромбозом вен конечностей, как правило, не давая при этом адекватного белкового и калорийного обеспечения. ППП предъявляет наиболее высокие требования как к персоналу, так и к материальному обеспечению лечебного учреждения.
При этом любой из выбранных режимов подразумевает прежде всего адекватность обеспечения питательными компонентами, поэтому весьма важным процессом является определение потребности больного в питательных компонентах.
Вретлиндом и Суджяном выдвинуты три основных принципа ИЛП, не зависящих от метода доставки питательных ингредиентов:
• своевременность начала проведения ИП, ибо предупредить кахексию легче, чем ее лечить;
• оптимальность срока проведения ИП, что означает, что проводить его следует до момента стабилизации основных параметров трофического статуса — метаболических, антропометрических, иммунологических;
• адекватность проведения ИП, т. е. полноценное обеспечение пациента всеми питательными компонентами (белки, жиры, углеводы, витамины, минеральные вещества).
Парентеральное питание — метод введения питательных компонентов непосредственно в сосудистое русло и далее в печень связан с довольно большой водной нагрузкой, нарушением осмолярности и кислотно-щелочного состояния крови, вмешательством в метаболические процессы на уровне биологически активных веществ (свободные аминокислоты и жирные кислоты, триглицериды, простые сахара и т. п.). Для успешного усвоения и метаболизма вводимых основных питательных компонентов (белков, жиров, углеводов) требуется достаточное обеспечение кислородом, фосфором и другими веществами, активно влияющими на метаболические процессы. Поэтому ПП противопоказано при шоке, остром кровотечении, гипоксемии, дегидратации и гипергидратации, декомпенсации сердечной деятельности, острой почечной и печеночной недостаточности, значительных нарушениях осмолярности, кислотно-щелочного состояния (КЩС) и ионного баланса.
В то же время в практике интенсивной терапии весьма значительное и частое явление — циркуляторный шок. Независимо от этиологии шока общим для всех форм является остро наступающее уменьшение кровотока тканей с нарушением кровоснабжения клеток различных органов и расстройством микроциркуляции. Критическое уменьшение кровотока означает недостаточное снабжение кислородом тканей и нарушение притока продуктов обмена веществ и оттока шлаков. Следствием этого является нарушение или утрата нормальной функции клеток, а в крайних случаях — гибель самой клетки. Патофизиологически это означает расстройство капиллярной перфузии с недостаточным снабжением кислородом и нарушением обмена веществ клеток различных органов. Нормальное снабжение органов и тканей кислородом и питательными веществами не может поддерживаться в условиях критического падения периферического кровоснабжения. Истощается энергоснабжение, накапливаются патологические продукты обмена веществ, развиваются гипоксия и ацидоз. В отсутствие своевременного и адекватного лечения первоначально поправимые нарушения переходят в необратимые повреждения клеток и органов.
В основе нарушений гемодинамики лежат снижение объема циркулирующей крови или ее патологическое перераспределение, уменьшение внутрисосудистого давления и сердечного выброса, сочетающиеся с увеличением сопротивления току крови в периферических сосудах и сосудах легких, как следствие централизации кровообращения. Гиповолемические состояния сопровождаются нарушениями макро- и микроциркуляции.
Нарушения микроциркуляции в различных органах характеризуются изменениями реологии крови: повышается вязкость крови и плазмы, увеличивается агрегационная способность эритроцитов, возрастает уровень фибриногена. Помимо этого повышается агрегационная способность тромбоцитов и свертываемость крови, что сопровождается увеличением проницаемости сосудов.
В целом, основной проблемой при шоке является несоответствие между потребностью и возможностью обеспечения тканей и органов кислородом и другими питательными компонентами, транспортируемыми системой кровообращения.
В связи с этим собственно парентерального питания должны предшествовать ряд лечебных мероприятий, направленных на поддержание нормальной гемодинамики и реологических свойств крови, коррекцию нарушений водно-солевого и кислотно-щелочного состояний, ликвидацию гипоксемии. Критериями длительности введения кристаллоидных и плазмозамещающих растворов могут служить увеличение диуреза, коррекция гематокрита, нормализация кислотно-щелочного состояния.
Современные подходы к парентеральному питанию у детей
Лазарев В.В., Цыпин Л.Е., Корсунский А.А., Байбарина Е.Н.
Кафедра детской анестезиологии и интенсивной терапии ФУВ Российской Детской Клинической больницы, Научный Центр Акушерства, Гинекологии и Перинатологии РАМН
В последние годы особое внимание уделяется вопросам рационального питания пациентов, находящихся на стационарном лечении. Статистические данные свидетельствуют, что 30-40% пациентов педиатрических стационаров имеют нарушения пищевого статуса. Среди детей, госпитализированных по экстренным показаниям, в 70% случаев нарушения питания остаются нераспознанными, что является отягощающим фактором в эффективности лечения, неизменно ведет к ухудшению клинического прогноза и результата. Исследователями установлена взаимосвязь между недостаточностью питания и количеством осложнений, летальностью. При снижении массы тела пациентов на 5% за время нахождения в стационаре продолжительность их госпитализации возрастает в 3,3 раза.
Нарушение пищевого статуса снижает иммунорезистентность, увеличивает риск инфекций, ухудшает процессы регенерации, вызывает гастроинтестинальную дисфункцию, увеличивает затраты на лечение. Поэтому в настоящее время стандарт лечебных мероприятий включает «нутритивную поддержку», задачей которой является обеспечение полноценным питанием больных и пострадавших.
Целью искусственного лечебного питания (нутритивной поддержки) является обеспечение пациента необходимым количеством калорий и сохранение его собственного белка с помощью ряда методов, отличных от обычного приема пищи.
Основополагающими принципами искусственного лечебного питания являются своевременное начало, полноценность и оптимальный срок продолжительности. Лечебное питание осуществляют до достижения стабильных показателей, отражающих процессы метаболизма, антропометрических и иммунологических параметров. Лечебное питание проводят с помощью орального, энтерального, частичного или полного парентерального питания (ПП).
Форму питания устанавливают на основании клинико-лабораторных показателей, возрастных и анатомо-физиологических особенностей каждого конкретного больного. Из множества факторов, влияющих на форму проведения лечебного питания, наиболее значимыми являются: 1) наличие или отсутствие сознания, 2) состояние функции сосания, жевания и глотания, 3) степень проходимости верхних отделов пищеварительного тракта, 4) выраженность недостаточности питания, 5) объем и характер оперативного вмешательства, 6) состояние пищеварения и всасывания при анатомической сохранности желудочно-кишечного тракта, 7) вид кишечной фистулы, 8) степень гиперкатаболизма.
Каждый из способов доставки питания имеет свои достоинства и недостатки. У больных при различных патологических состояниях, когда нет возможности проводить питание естественным путем через желудочно-кишечный тракт это позволяет сделать парентеральное питание. Нефизиологичность парентерального пути введения питательных компонентов компенсируется биологической активностью и доступностью этих веществ, что позволяет оказывать целенаправленное влияние на метаболические процессы и значительно быстрее получать необходимые результаты.
ПП новорожденных и детей до 2 лет.
Вопросы нутритивной поддержки новорожденных, находящихся в отделениях и палатах интенсивной терапии, занимают особое место ввиду значительных физиологических и морфологических различий у детей данной возрастной группы по сравнению со старшими. Так у них уровень основного обмена в 2 раза, а потребность в жидкости в 5 раз выше, чем у взрослых в то время как фракция экскреции натрия в 10 раз меньше. В первые дни жизни происходит существенное перераспределение жидкости между секторами, существенную роль могут играть неощутимые потери. Следует отметить также, что в силу структурной и функциональной незрелости органов пищеварения способность недоношенных новорожденных к самостоятельному энтеральному питанию ограничена. Устойчивая перистальтика у плода появляется только после 28-30 недель гестации, координация сосания и глотания развивается после 33-36 недель гестации, процесс всасывания жирных кислот с длинной цепью затруднен в связи с недостаточной активностью желчных кислот, секреторная функция поджелудочной железы полностью устанавливается только к концу первого года жизни.
Потенциальные последствия недостаточного питания у недоношенных новорожденных
| Малые энергетические резервы | Раннее наступление катаболической стадии |
| Влияние на РДС | Снижение (задержка) синтеза сурфактанта. Слабость дыхательной мускулатуры |
| Защита от гипероксии/баротравмы | Снижение целостности эпителия, Инактивация системы защиты от свободных радикалов |
| Развитие БЛД | Снижение биосинтеза в легких Замедление восстановления поврежденных клеток |
| Влияние на рост легких | Замедление структурного созревания (альвеолизация) |
| Возрастает риск развития инфекции | Повышение проницаемости клеточных барьеров Угнетение клеточного и гуморального иммунитета |
Хотя в мире активно применяются препараты для ПП, доступные в нашей стране, используется этот метод питания у новорожденных недостаточно широко и не всегда адекватно. Внедрение современных протоколов адекватного питания в отделении неонатальной интенсивной терапии способствует улучшенному потреблению и усвоению питательных веществ, росту ребенка, сокращению пребывания его в стационаре и, следовательно, снижению стоимости лечения.
В выполнении ПП у новорожденных особое значение имеет оценка его эффективности. Классические критерии, как прибавка массы тела и увеличение толщины кожной складки в острых ситуациях отражают в основном динамику водного обмена. При отсутствии патологии со стороны почек возможно использование метода оценки инкремента мочевины, который основан на том, что если молекула аминокислоты не вступает в синтез белка, то происходит ее распад с образованием молекулы мочевины. Разница концентрации мочевины после и до введения аминокислот называется инкрементом. Чем он ниже (вплоть до отрицательных величин), тем выше эффективность ПП. Можно пользоваться также приблизительным расчетом баланса азота исходя из того, что 65% его выделяется с мочевиной, поскольку классический метод определения баланса азота крайне трудоемок для рутинного применения. Этот показатель хорошо коррелирует с другими клиническими и биохимическими показателями и позволяет контролировать адекватность проводимой терапии.
В Европе и США в нутритивной поддержке новорожденных и грудных детей, нуждающихся в ПП, применяются только специальные растворы кристаллических аминокислот (РКА) направленного действия, в основу которых положен аминокислотный состав женского молока, т. е. специальные препараты для детей, содержащие таурин.
Создание этих растворов для детей продиктовано неполноценностью ферментов, участвующих в белковом метаболизме новорожденного и особенно недоношенного ребенка. Некоторые аминокислоты, которые у взрослого являются заменимыми, у новорожденных переводятся в ранг незаменимых. Аминокислотные препараты для ПП новорожденных обогащаются цистеином, метионином, тирозином, таурином. Таурин способствует развитию сетчатки и всасыванию жирных кислот с длинной цепью без участия желчных кислот, поэтому аминокислотные препараты для детей должны содержать достаточное количество таурина. Последние данные о влиянии различных аминокислот свидетельствуют о том, что в состав РКА для детей не следует вводить глютаминовую кислоту (не путать с глутамином!), поскольку вызываемое ею увеличение содержания натрия и воды в глиальных клетках неблагоприятно при острой церебральной патологии. Избыток фенилаланина оказывает нейротоксическое действие у недоношенных детей, поэтому концентрация ароматических аминокислот в адаптированных препаратах снижается.
Аминокислоты с разветвленной цепью (лейцин, изолейцин, валин) способствует созреванию ЦНС. Достаточное количество аргинина предупреждает развитие гипераммонийемии.
Для парентерального питания новорожденных и детей до 2 лет в настоящее время разрешен к применению и используется единственный аминокислотный препарат Аминовен инфант 6% и 10% (Фрезениус Каби, Германия).
Использование всех других аминокислотных растворов у детей до 2-х лет не разрешено, поскольку они не адаптированы для маленьких детей и не имеют зарегистрированного показания к применению в этом возрасте.
|   | Аминовен Инфант 6% | Аминовен Инфант 10% |
| Незаменимых аминокислот | 52% | 52% |
| Разветвленных аминокислот | 30% | 30% |
| Общее содержание азота, г/л | 9 | 14,9 |
| Осмолярность мосм/л | 531 | 885 |
| Углеводы и электролиты | нет | нет |
| Таурин | есть | есть |
| Форма выпуска | 100 мл | 100/(250) мл |
ПП новорожденных и детей старше 2 лет.
На отечественном фармацевтическом рынке для детей старше 2-х лет присутствует значительное число стандартных препаратов, сбалансированных по содержанию незаменимых и заменимых аминокислот: аминовен 5%, 10%, 15%, аминостерил КЕ 10%, инфезол (Германия), вамин 18, вамин EF (Швеция), полиамин, хаймикс (Россия) и др. Данные препараты зарегистрированы и применяются только у пациентов после 2-х лет или более. Следует отметить, что из них только аминовен является стандартным препаратом аминокислот с таурином.
Помимо новорожденных в группу особого отношения по вопросам парентерального питания необходимо отнести и детей находящихся в критических состояниях. Многочисленные исследования показали, что усиление межклеточной кишечной проницаемости при критических состояниях, приводит к увеличению случаев транслокации бактерий и токсинов из просвета кишечника в системный кровоток и в последующем к инфекционным осложнениям, таким как сепсис и синдром полиорганной недостаточности (ПОН). Клинические и экспериментальные данные свидетельствуют, что применение глутамина до или немедленно после хирургического вмешательства, ожогов, в составе интенсивной терапии оказывает защитный эффект и снижает интенсивность повышения кишечной проницаемости. Наиболее успешным оказалось внутривенное применение фармакологических доз глутамина у больных в критических состояниях со сниженной всасывательной способностью кишечника, поскольку при этом было установлено более эффективное восстановление уровня плазменного глутамина. В настоящее время доказано, что глутамин эффективен в отношении «острой» кишечной недостаточности и повышенной проницаемости, но пока невозможно дать заключение о том, оказывает ли глутамин «терапевтический» эффект на повышенную хроническую кишечную проницаемость. Дозы глутамина, оказывающие «защитный» эффект путем предотвращения или уменьшения интенсивности повышенной кишечной проницаемости при внутривенном применении до или немедленно после начала ситуации повреждения должны составлять около 0,34 г/кг/день, соответствующие 0,50 г/кг/день аланил-глутамина. Более того, этот глутамин не должен рассчитываться как часть пищевого белка, потребляемого больным.
Особое значение в проведении полного парентерального питания уделяется технологии его выполнения имеющей принципиально важное значение при критических состояниях. По данным оценки правильности проведения ПП в 140 ОРИТ США было отмечено, что 47% больных имели респираторный коэффициент (отношение продукции СО2 к потреблению О2) выше 1,0. Это было обусловлено несоблюдением дозировок и скорости введения глюкозы. Помимо излишнего введения глюкозы гипергликемии способствовало и раздельное введение нутриентов. Внедрение новой технологии ПП «три в одном» и отказ от инфузий глюкозы в концентрации более 20%, позволил снизить до минимума число отмечавшихся ранее осложнений.
В настоящее время готовые к использованию препараты «три в одном» в трехкамерном пакете считаются стандартом как для краткосрочного, так и для длительного ПП у детей старшего возраста и взрослых пациентов.
| Показатель | Кабивен (Центральный) | Оликлиномель (7-1000) |
| Азот/небелковые калории | 1/148 | 1/158 |
| Глюкоза/Липиды (ккал) | 55/45% | 62/38% |
| Доля незаменимых АК | 45% | 40,5% |
| Лейцин/Изолейцин | 1/1,45 | 1/1,2 |
| Незаменимые жирные кислоты | 62% | 20% |
| Соотношение ω-3/ω-6 жирных кислот | 1/7 | 1/9 |
| Концентрация глюкозы | 19% | 40% |
Ввиду невысокого содержания в препарате Кабивен глюкозы как источника энергии, он предпочтителен к применению у больных с дыхательной недостаточностью и сахарным диабетом. Препарат предназначен в первую очередь для пациентов старше 2 лет. У детей до 2 лет Кабивен может применяться только по жизненным показаниям при отсутствии специальных адаптированных аминокислотных растворов, содержащих таурин (Аминовен инфант).
Наиболее часто применяемым 3-компонентным препаратом в Европе является кабивен, представляющий собой пакет, состоящий из 3 камер, содержащих раствор аминокислот (вамин18), жировую эмульсию (интралипид) и 19% раствор глюкозы. Камеры разделены перегородками, которые перед применением разрушаются и содержимое пакетов смешивается. Кроме того, преимущества применения технологии «три в одном» перед изолированным введением раствора аминокислот, жировой эмульсии и глюкозы заключаются в отсутствии необходимости рассчитывать дозу, скорость инфузии отдельно аминокислот, жировой эмульсии и глюкозы, соотношение вводимых аминокислот и энергии, соотношение глюкозы и жиров. Используя 3-камерный пакет, следует только выбрать его нужный размер с учетом массы тела пациента. При этом практически исключается риск ошибок в дозировании и технике проведения ПП. В препарате технологически приготовлен максимально сбалансированный состав, что приводит к снижению риска метаболических осложнений. В пакете существует специальный вход для дополнительного введения витаминов и микроэлементов. Это закрытая система, что позволяет минимизировать риск микробной контаминации. В конечном итоге, использование готового препарата, ускоряет и упрощает работу среднего медицинского персонала.
При различных патологических состояниях меняется количественная и качественная потребность в аминокислотах с возникновением их избирательной недостаточности. В этом случае применение стандартных аминокислотных смесей не позволяет в полной мере обеспечить требуемый спектр аминокислотного баланса у пациентов с различной патологией, либо на разных стадиях патологического процесса у одного больного.
Повышенное содержание аминокислот с разветвленной цепью обеспечивает детоксикацию аммиака и повышает синтез белка. Сниженный состав ароматических аминокислот и метионина препятствует образованию ложных нейротрансмиттеров. Необходимость повышения содержания аргинина обусловлена потребностью активации детоксикации аммиака в печени и предупреждения гипераммониемии. Поскольку при печеночной недостаточности в крови повышается концентрация ароматических аминокислот, метионина и снижается содержание разветвленных аминокислот, соответственно целесообразно использовать растворы аминокислот с противоположным соотношением данного спектра аминокислот.
В парентеральном питании при комплексной терапии больных с почечной недостаточностью используются специальные растворы аминокислот: Нефротект, Аминостерил КЕ-нефро, (Германия).
Специально подобранный спектр аминокислот данных растворов позволяет добиваться включения азотистых шлаков организма в метаболические процессы с выработкой новых заменимых аминокислот, синтезом белка и снижением азотемии. В перечне требований предъявляемых к растворам аминокислот используемых при почечной недостаточности важное место отводится содержанию углеводов и электролитов, которое должно быть минимальным или вообще отсутствовать.
Увеличение концентрации разветвленных аминокислот в растворах парентерального питания и применение их в постагрессивном периоде снижает потери белка, стимулирует его синтез и уменьшает распад, позитивно влияет на состояние азотистого баланса.
Актуальность использования жировых эмульсий на сегодняшний день не вызывает сомнений. Их значимость в группе препаратов 1111 определяется не только как наиболее эффективный источник энергии, поскольку при метаболизме 1 г жира образуется 9,3 килокалории. Помимо энергии жировые эмульсии являются источниками незаменимых жирных кислот (линолевой и линоленовой), которые обеспечивают структурными компонентами все клеточные мембраны и способствуют их восстановлению проницаемости и осмотической резистентности. Ненасыщенные жирные кислоты участвуют в синтезе простагландинов, тромбоксанов и лейкотриенов и тем самым оказывают значимое действие на метаболическую и газообменную функцию легких, транспорт жирорастворимых витаминов, активность иммунной системы. Положительное влияние жировых эмульсий заключается и в их изоосмолярности (280-380 мосм/л), что позволяет корригировать осмотическую активность растворов ПП при совместном применении жировых эмульсий, а также вводить их в периферические вены.
В настоящее время существуют различные варианты жировых эмульсий, отличающиеся по составу, соотношению ингредиентов, а тенденции в разработке и создании новых характеризуются появлением жировых эмульсий многокомпонентного состава с содержанием жиров растительного, животного, синтетического происхождения.
Жировые эмульсии
Новым вариантом жировых эмульсий, в котором сочетаются преимущества четырех различных видов масел, уже используемых в парентеральном питании в настоящее время является СМОФлипид. Она содержит:
Глюкоза, как компонент ПП является не только источником энергии, но и активным участником пластических процессов, синтеза белка. При дефиците энергетических ресурсов для их обеспечения используется белок, аминокислоты, введенные извне или собственно организма, вследствие чего могут наступать процессы катаболизма. Между обменом углеводов, аминокислот и липидов существует тесная взаимосвязь. Глюкоза широко используется в ПП как источник небелковых калорий в виде 20-50% раствора. Однако применению больших объемов высококонцентрированных (превышающих 30%) растворов глюкозы может приводить к увеличению минутного объема дыхания, респираторного коэффициента, продолжительности ИВЛ, гиперосмолярности, гипергликемии, глюкозурии, жировой инфильтрации печени. В связи с чем рекомендуется применять в ПП не более 20-30% растворы глюкозы. В качестве источника углеводов и энергии используются помимо глюкозы также фруктоза, сорбит и ксилит.
Современные подходы к парентеральному питанию новорожденных
Парентеральное питание (ПП) новорожденных применяется в нашей стране уже более двадцати лет, за это время накоплено много данных как по теоретическим, так и по практическим аспектам его использования. Хотя в мире активно разрабатываются и производятся препараты для ПП, доступные в нашей стране, используется этот метод питания у новорожденных недостаточно широко и не всегда адекватно.
II. ОЦЕНКА ЭФФЕКТИВНОСТИ ПП
Оценка эффективности ПП при критических состояниях у новорожденных непроста. Такие классические критерии, как прибавка массы тела и увеличение толщины кожной складки в острых ситуациях отражают в основном динамику водного обмена. При отсутствии патологии со стороны почек возможно использование метода оценки инкремента мочевины, который основан на том, что если молекула аминокислоты не вступает в синтез белка, то про исходит ее распад с образованием молекулы мочевины. Разница концентрации мочевины до и после введения аминокислот называется инкрементом. Чем он ниже (вплоть до отрицательных величин), тем выше эффективность ПП.
Классический метод определения баланса азота крайне трудоемок и вряд ли применим в широкой клинической практике. Mы пользуемся приблизительным расчетом баланса азота исходя из того, что 65% выделяемого детьми азота приходится на азот мочевины мочи. Результаты применения этой методики хорошо коррелируют с другими клиническими и биохимическими показателями и позволяют контролировать адекватность проводимой терапии.
III. ПРЕПАРАТЫ ДЛЯ ПАРЕНТЕРАЛЬНОГО ПИТАНИЯ
Источники аминокислот. Современными препаратами этого класса являются растворы кристаллических аминокислот (РКА). Гидролизаты белка обладают многими недостатками (несбалансированность аминокислотного состава, наличие балластных веществ) и в неонатологии уже не используются. Наиболее известными препаратами этого класса являются Вамин 18, Аминостерил КЕ 10% (Fresenius Kabi), Мориамин-5-2 (Руссель Морисита). Состав РКА постоянно совершенствуется. Теперь, кроме препаратов общего назначения создаются так называемые препараты направленного действия, способствующие не только оптимальному усвоению аминокислот при определенных клинических состояниях (почечная и печеночная недостаточность, гиперкатаболические состояния), но и ликвидации присущих этим состояниям видов дисбаланса аминокислот.
Одним из направлений в создании препаратов направленного действия является разработка специальных препаратов для новорожденных и грудных детей, в основу которых положен аминокислотный состав женского молока. Специфика его состава заключается в высоком содержании незаменимых аминокислот (около 50%), цистеина, тирозина и пролина, в то время, как фенилаланин и глицин представлены в незначительном количестве. В последнее время необходимым считается введение в состав РКА для детей таурина, биосинтез которого из метионина и цистеина у новорожденных снижен. Таурин (2-аминоэтансульфоновая кислота) для новорожденных является незаменимой АК. Таурин участвует в нескольких важных физиологических процессах, в том числе в регуляции входящего кальциевого тока и возбудимости нейронов, детоксикации, стабилизации мембран и регуляции осмотического давления. Таурин участвует в синтезе желчных кислот. Таурин предотвращает или устраняет холестаз и предотвращает развитие дегенерации сетчатки, (развивается при дефиците таурина у детей). Наиболее известны следующие препараты для парентерального питания грудных детей: Аминовен Инфант (Fresenius Kabi), Ваминолакт (в 2004 г прекращен ввоз в РФ). Есть мнение о том, что в состав РКА для детей не следует вводить глютаминовую кислоту (не путать с глутамином!), поскольку вызываемое ею увеличение содержания натрия и воды в глиальных клетках неблагоприятно при острой церебральной патологии. Есть сообщения об эффективности введения глутамина при парентеральном питании новорожденных.
Концентрация аминокислот в препаратах обычно составляет от 5 до 10%, при полном парентеральном питании доза аминокислот (сухого вещества!) составляет 2-2,5г/кг.
Источники энергии. К препаратам этой группы относятся глюкоза и жировые эмульсии. Энергетическая ценность 1г глюкозы составляет 4 ккал. 1г жира примерно 9-10 ккал. Наиболее известными жировыми эмульсиями являются Интралипид (Fresenius Kabi), Липофундин (B.Braun), Липовеноз (Fresenius Kabi), Доля энергии, поставляемой углеводами и жирами, может быть различной. Применение жировых эмульсий обеспечивает организм полиненасыщенными жирными кислотами, способствует защите стенки вен от раздражения гиперосмолярными растворами. Таким образом, применение сбалансированного ПП следует считать предпочтительным, однако при отсутствии жировых эмульсий возможно обеспечить ребенка необходимо энергией только за счет глюкозы. По классическим схемам ПП за счет глюкозы дети получают 60-70% небелкового энергообеспечения, за счет жира 30-40%. При введении жиров в меньших пропорциях задержка белка в организме новорожденных уменьшается.
IV. ДОЗИРОВКИ ПРЕПАРАТОВ ДЛЯ ПП
Примерная суточная потребность в энергии составляет:
V. АЛГОРИТМ СОСТАВЛЕНИЯ ПРОГРАММЫ ПП
1. Расчет общего объема жидкости, необходимой ребенку на сутки
2. Решение вопроса о применении препаратов для инфузионной терапии специального назначения (препараты волемического действия, внутривенные иммуноглобулины и др.) и их объеме.
5. Определение объема жировой эмульсии. В начале применения ее доза составляет 0,5г/кг, затем повышается до 2- 2,5г/кг
7. Проверка и, при необходимости, коррекция соотношений между пластическими и энергетическими субстратами. При недостаточном энергообеспечении в пересчете на 1г аминокислот следует увеличить дозу глюкозы и/или жира, либо уменьшить дозу аминокислот.
8. Распределить полученные объемы препаратов. Скорость их введения рассчитывают таким образом, чтобы общее время инфузии составляло до 24 часа в сутки.
VI. ПРИМЕРЫ СОСТАВЛЕНИЯ ПРОГРАММ ПП
Пример 1. (Смешанное ПП)
Перспективой проведения парентерального питания у данного ребенка является постепенное, по мере улучшения состояния, увеличение объема энтерального питания при снижении объема парентерального.
Пример 2 (ПП ребенка с экстремально низкой массой тела).
Наиболее частой проблемой ПП детей с экстремально низкой массой тела является гипергликемия, требующая введения инсулина. Поэтому при проведении им ПП следует тщательно следить за уровнем глюкозы в крови и моче (определение качественным методом глюкозы в каждой порции мочи позволяет уменьшить количество взятия крови из пальца, что очень важно для маловесных детей).
VII. ВОЗМОЖНЫЕ ОСЛОЖНЕНИЯ ПАРЕНТЕРАЛЬНОГО ПИТАНИЯ И ИХ ПРЕДУПРЕЖДЕНИЕ
Хотя метод ПП к настоящему времени достаточно хорошо изучен, может длительно применяться и давать хорошие результаты, не следует забывать, что он не является физиологичным. Энтеральное питание следует вводить, когда ребенок сможет усваивать хотя-бы минимальные количества молока. Равнее введение энтеральнрго питания, преимущественно нативного материнского молока, даже если вводится по 1-3 мл за кормление, не внося существенного вклада в энергообеспечение, улучшает пассаж по ЖКТ, ускоряет процесс перевода на энтеральное питание за счет стимуляции желчеотделения, снижает частоту развития холестаза.
Список Литературы на сайте журнала Вестник Интенсивной терапии.