Пергидроль что это
Пергидроль что это
Пергидроль
Смотреть что такое «Пергидроль» в других словарях:
пергидроль — пергидроль … Орфографический словарь-справочник
пергидроль — пероксид Словарь русских синонимов. пергидроль сущ., кол во синонимов: 1 • пероксид (1) Словарь синонимов ASIS. В.Н. Тришин … Словарь синонимов
пергидроль — я, м. perhidrol m. <лат.per сверх + hydor вода. Тридцатипроцентный водный раствор перекиси водорода, сильный окислитель. Химические опыты с пергидролем. Васюкова 1999. Невозможно было скрыть на экране деликатную, интеллигентскую красоту,… … Исторический словарь галлицизмов русского языка
ПЕРГИДРОЛЬ — (пергидрол) 30 процентный водный раствор перекиси водорода (см.). Прозрачная бесцветная жидкость без запаха. Используется для приготовления 3 процентных растворов перекиси водорода, которые менее стойки, чем пергидроль … Краткая энциклопедия домашнего хозяйства
ПЕРГИДРОЛЬ — см. Водорода пероксид … Большой Энциклопедический словарь
пергидроль — раствор перекиси водорода … Словарь сокращений и аббревиатур
ПЕРГИДРОЛЬ — Perhydrolum. Синонимы: раствор перекиси водорода концентрированный, гиперол, лапирол, ортизон. Свойства. Бесцветная прозрачная жидкость без запаха или со слабым своеобразным запахом, слабокислой реакции. Медленно разлагается при взаимодействии с … Отечественные ветеринарные препараты
пергидроль — я; м. [от лат. per через и греч. hydōr вода] Водный раствор перекиси водорода. Волосы, обесцвеченные пергидролем. ◁ Пергидролевый, ая, ое. П. состав. П ая маска. * * * пергидроль см. Водорода пероксид. * * * ПЕРГИДРОЛЬ ПЕРГИДРОЛЬ, см. Водорода… … Энциклопедический словарь
пергидроль — perhidrolis statusas T sritis chemija apibrėžtis 30% vandenilio peroksido vandeninis tirpalas. atitikmenys: angl. perhydrol rus. пергидроль … Chemijos terminų aiškinamasis žodynas
ПЕРГИДРОЛЬ
Синонимы: раствор перекиси водорода концентрированный, гиперол, лапирол, ортизон.
Свойства. Бесцветная прозрачная жидкость без запаха или со слабым своеобразным запахом, слабокислой реакции. Медленно разлагается при взаимодействии со щелочами и органическими веществами, выделяя кислород. Содержит 27,5-31 % перекиси водорода (Н 2 0 2 ).
Хранят с предосторожностью (список Б), в склянках с притертыми стеклянными пробками, в прохладном, защищенном от света месте.
Действие и применение. При соприкосновении с органическими и другими легкоокисляющимися веществами растворы перекиси водорода разлагаются с выделением кислорода. При этом 1 л 3 % раствора перекиси водорода образует до 10 л кислорода. Разложение перекиси водорода происходит под влиянием тканевых ферментов (пероксидазы и каталазы). Если расщепление идет по пероксидазному типу, то образуется активный атомарный кислород, а если по каталазному, то освобождается молекулярный кислород. Образующийся атомарный кислород как окислитель действует антимикробно, дезодорирующе. Выделяющийся кислород образует мельчайшие пузырьки, которые механически способствуют очищению раны от загрязнения и омертвевших тканей.
В качестве дезинфицирующего и дезодорирующего средства применяют для промываний и полосканий при воспалительных заболеваниях слизистых оболочек полости рта, глотки, при гинекологических болезнях, кровоточивости из слизистых оболочек (1-2 % раствор). Для промывания гнойных ран, язв, полостей, а также при воспалении наружного уха (3 % раствор). Используют для снятия прилипших повязок.
При укусах ядовитых змей и пауков тампонируют пергидролем или вводят подкожно вокруг места укуса 3-4 % раствор перекиси водорода (мелким животным 1-5 мл).
Для дезинфекции птичников применяют 3 % раствор перекиси водорода с 0,5 % молочной кислоты. Для приготовления данного раствора берут 1 часть пергидроля и 9 частей воды, а затем добавляют 0,5 % молочной кислоты. 3 % раствор перекиси водорода используют для обеззараживания шприцев-катетеров, применяемых при искусственном осеменении, с последующим промыванием их изотоническим раствором хлорида натрия. Для дезинфекции ульев при американском и европейском гнильце пчел применяют 10 % раствор перекиси водорода с 3 % раствором уксусной или муравьиной кислоты при трехкратном нанесении из расчета 1 л на 1 м 2 площади с часовым интервалом. Дезинфекцию спецодежды рабочих на пасеках проводят не реже одного раза в месяц путем погружения в 2 % раствор перекиси водорода на 3 часа или в камере парами формальдегида.
Пергидроль
Пергидроль
| Пероксид водорода | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Пероксид водорода |
| Химическая формула | H2O2 |
| Отн. молек. масса | 34,01 а. е. м. |
| Молярная масса | 34,01 г/моль |
| Физические свойства | |
| Плотность вещества | 1.4 г/см³ |
| Состояние (ст. усл.) | жидкость |
| Термические свойства | |
| Температура плавления | −0,432 °C |
| Температура кипения | 150,2 °C |
| Энтальпия (ст. усл.) | -136.11 кДж/моль |
| Химические свойства | |
| pKa | 11.65 |
| Растворимость в воде | неограниченная г/100 мл |
| Классификация | |
| номер CAS | [7722-84-1] |
Перокси́д водоро́да (перекись водорода), H2O2 — простейший представитель пероксидов. Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем. Из воды выделяется в виде неустойчивого кристаллогидрата H2O2•2H2O.
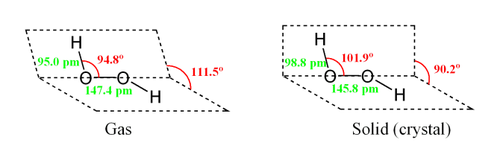
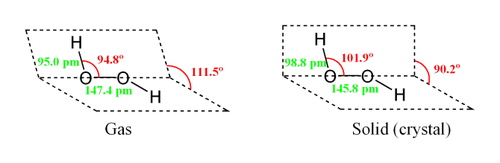
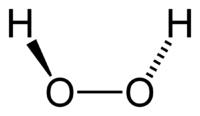
Молекула пероксида водорода имеет следующее строение:
Содержание
Физические свойства
Чистый пероксид водорода очень сильно отличается от знакомого всем 3%-ного раствора Н2О2, который стоит в домашней аптечке. Прежде всего, он почти в полтора раза тяжелее воды (плотность при 20° С равна 1,45 г/см3). Замерзает Н2О2 при температуре, немного меньшей, чем температура замерзания воды – при минус 0,41° С, но если быстро охладить чистую жидкость, она обычно не замерзает, а переохлаждается, превращаясь в прозрачную стеклообразную массу. Растворы Н2О2 замерзают при значительно более низкой температуре: 30%-ный раствор – при минус 30° С, а 60%-ный – при минус 53° С. Кипит Н2О2 при температуре более высокой, чем обычная вода, – при 150,2° С. Смачивает стекло Н2О2 хуже, чем вода, и это приводит к интересному явлению при медленной перегонке водных растворов: пока из раствора отгоняется вода, она, как обычно, поступает из холодильника в приемник в виде капель; когда же начинает перегоняться Н2О2, жидкость выходит из холодильника в виде непрерывной тоненькой струйки. На коже чистый пероксид водорода и его концентрированные растворы оставляют белые пятна и вызывают ощущение жгучей боли из-за сильного химического ожога.
Чистый Н2О2, как и сахарный сироп, сильно преломляет свет. Действительно, коэффициент преломления безводного Н2О2 (1,41) намного больше, чем у воды (1,33). Однако то ли в результате неверного толкования, то ли из-за плохого перевода с французского, практически во всех учебниках до сих пор пишут, что чистый пероксид водорода – «густая сиропообразная жидкость», и даже объясняют это теоретически – образованием водородных связей. Но ведь вода тоже образует водородные связи. На самом деле вязкость у Н2О2 такая же, как и у чуть охлажденной (примерно до 13° С) воды, но нельзя сказать, что прохладная вода густая, как сироп.
Химические свойства
Разлагается на кислород и воду при нагревании, под действием ультрафиолетового излучения, а также в присутствии ионов переходных металлов и серебра:
Однако очень чистый пероксид водорода устойчив.
Пероксид водорода проявляет очень слабые кислотные свойства (К = 1,4·10 –12 ). При действии концентрированного раствора Н2O2 на гидроксиды в ряде случаев можно выделить пероксиды металлов (Li2O2, MgO2 и др.):
Окислительно-восстановительные свойства
Пероксид водорода обладает сильными окислительными, а также восстановительными свойствами. Он окисляет нитриты в нитраты, выделяет иод из иодидов металлов, расщепляет ненасыщенные соединения по месту двойных связей. Пероксид водорода восстанавливает соли золота и серебра, а также кислород при реакции с водным раствором перманганата калия в кислой среде.
При действии сильных окислителей H2O2 проявляет восстановительные свойства, выделяя свободный кислород:
Реакцию KMnO4 с Н2O2 используют в химическом анализе для определения содержания Н2O2:
Окисление органических соединений пероксидом водорода (например, сульфидов и тиолов) целесообразно проводить в среде уксусной кислоты.
Биологические свойства
Перекись водорода относится к реактивным формам кислорода и при повышенном образовании в клетке вызывает оксидативный стресс. Некоторые ферменты, например глюкозоксидаза, образуют в ходе окислительно-восстановительной реакции пероксид водорода, который может играть защитную роль в качестве бактерицидного агента. В клетках млекопитающих нет ферментов, которые бы восстанавливали кислород до перекиси водорода. Однако несколько ферментных систем (ксантиноксидаза, НАД(Ф)H-оксидаза, циклоксигеназа и др.) продуцируют супероксид, который спонтанно или под действием супероксиддисмутазы превращается в перекись водорода.
Получение
Пероксид водорода получаются в промышленности по реакции с участием органических веществ, в частности, каталитическим окислением изопропилового спирта:
Ценным побочным продуктом этой реакции является ацетон.
В лабораторных условиях для получения пероксида водорода используют реакцию
Концентрирование и очистку пероксида водорода проводят осторожной перегонкой.
Применение
Благодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту и в промышленности, где используется, например, как отбеливатель на текстильном производстве и при изготовлении бумаги. Применяется как ракетное топливо — в качестве окислителя или как однокомпонентное (с разложением на катализаторе). Используется в аналитической химии, в медицине, в качестве пенообразователя при производстве пористых материалов, в производстве дезинфицирующих и отбеливающих средств. В промышленности пероксид водорода также находит свое применение в качестве катализатора, гидрирующего агента, как эпоксидирующий агент при эпоксидировании олефинов. В медицине растворы пероксида водорода применяются как антисептическое средство. При контакте с поврежденной кожей и слизистыми пероксид водорода под влиянием фермента каталазы распадается с выделением кислорода, что способствует сворачиванию крови и создает неблагоприятные условия для развития микроорганизмов. Однако такое действие непродолжительно и обладает слабым эффектом. Тем не менее, пероксид водорода (аптечное название — перекись водорода, 3 %) применяется при первичной обработке ран (в том числе открытых). Перекись водорода очень эффективна для лечения небольших царапин, особенно у детей — она не «щиплет», не имеет запаха, бесцветна. Однако она может вызывать небольшое жжение в районе открытой раны. Стоимость пузырька такого раствора (на 2009 год) — около 6 руб. В пищевой промышленности растворы пероксида водорода применяются для дезинфекции технологических поверхностей оборудования, непосредственно соприкасающихся с продукцией. Кроме того, на предприятиях по производству молочной продукции, соков, растворы перекиси водорода используются для дезинфекции упаковки (технология «Тетра Пак»). Для технических целей пероксид водорода применяют в производстве электронной техники.
Формы выпуска
Выпускается в виде водных растворов, стандартная концентрация 3, 30, 38, 50, 60, 85, 90 и 98%. 30% водный раствор пероксида водорода, стабилизированный добавлением фосфатов натрия, называется пергидролем.
Опасность применения
Несмотря на то, что пероксид водорода не токсичен, его концентрированные растворы при попадании на кожу, слизистые оболочки и в дыхательные пути вызывают ожоги. В больших концентрациях недостаточно чистый пероксид водорода может быть взрывоопасен.
Пероксид водорода
| Пероксид водорода | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Пероксид водорода |
| Химическая формула | H2O2 |
| Физические свойства | |
| Состояние (ст. усл.) | жидкость |
| Отн. молек. масса | 34,01 а. е. м. |
| Молярная масса | 34,01 г/моль |
| Плотность | 1.4 г/см³ |
| Термические свойства | |
| Температура плавления | −0,432 °C |
| Температура кипения | 150,2 °C |
| Энтальпия образования (ст. усл.) | -136.11 кДж/моль |
| Химические свойства | |
| pKa | 11.65 |
| Растворимость в воде | неограниченная |
| Классификация | |
| Рег. номер CAS | 7722-84-1 |
| SMILES | OO |
| Регистрационный номер EC | 231-765-0 |
Перокси́д водоро́да (перекись водорода), H2O2 — простейший представитель пероксидов. Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем. Из воды выделяется в виде неустойчивого кристаллогидрата H2O2•2H2O.
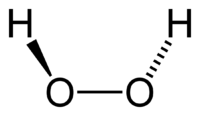
Молекула пероксида водорода имеет следующее строение:
Вследствие несимметричности молекула H2O2 сильно полярна (μ = 0,7·10 −29 Кл·м). Относительно высокая вязкость жидкого пероксида водорода обусловлена развитой системой водородных связей. Поскольку атомы кислорода имеют неподелённые электронные пары, молекула H2O2 также способна образовывать донорно-акцепторные связи.
Содержание
Химические свойства
Оба атома кислорода находятся в промежуточной степени окисления −1, что и обуславливает способность пероксидов выступать как в роли окислителей, так и восстановителей. Наиболее характерны для них окислительные свойства:

При взаимодействии с сильными окислителями пероксид водорода выступает в роли восстановителя, окисляясь до кислорода:
Молекула пероксида водорода сильно полярна, что приводит к возникновению водородных связей между молекулами. Связь O—O непрочна, поэтому H2O2 — неустойчивое соединение, легко разлагается. Так же этому может поспособствовать присутствие ионов переходных металлов. В разбавленных растворах пероксид водорода тоже не устойчив и самопроизвольно диспропорционирует на H2O и O2.Реакция диспропорционирования катализируется ионами переходных металлов, некоторыми белками:
Однако очень чистый пероксид водорода устойчив.
Пероксид водорода проявляет слабые кислотные свойства (К = 1,4·10 −12 ), и поэтому диссоциирует по двум ступеням:
При действии концентрированного раствора Н2O2 на некоторые гидроксиды в ряде случаев можно выделить пероксиды металлов, которые можно рассматривать как соли пероксида водорода (Li2O2, MgO2 и др.):

Пероксид водорода может проявлять как окислительные, так и восстановительные свойства. Например, при взаимодействии с оксидом серебра он является восстановителем:
В реакции с нитритом калия соединение служит окислителем:
Пероксидная группа [—O—O—] входит в состав многих веществ. Такие вещества называют пероксидами, или пероксидными соединениями. К ним относятся пероксиды металлов (Na2O2, BaO2 и др.). Кислоты, содержащие пероксидную группу, называют пероксокислотами, например, пероксомонофосфорная H3PO5 и пероксидисерная H2S2O8 кислоты.
Окислительно-восстановительные свойства
Пероксид водорода обладает окислительными, а также восстановительными свойствами. Он окисляет нитриты в нитраты, выделяет иод из иодидов металлов, расщепляет ненасыщенные соединения по месту двойных связей. Пероксид водорода восстанавливает соли золота и серебра, а также кислород при реакции с водным раствором перманганата калия в кислой среде.
При восстановлении Н2O2 образуется Н2O или ОН-, например:
При действии сильных окислителей H2O2 проявляет восстановительные свойства, выделяя свободный кислород:
Реакцию KMnO4 с Н2O2 используют в химическом анализе для определения содержания Н2O2:
Окисление органических соединений пероксидом водорода (например, сульфидов и тиолов) целесообразно проводить в среде уксусной кислоты.
Биологические свойства
Перекись водорода относится к реактивным формам кислорода и при повышенном образовании в клетке вызывает оксидативный стресс. Некоторые ферменты, например глюкозоксидаза, образуют в ходе окислительно-восстановительной реакции пероксид водорода, который может играть защитную роль в качестве бактерицидного агента. В клетках млекопитающих нет ферментов, которые бы восстанавливали кислород до перекиси водорода. Однако, несколько ферментных систем (ксантиноксидаза, НАД(Ф)H-оксидаза, циклоксигеназа и др.) продуцируют супероксид, который спонтанно или под действием супероксиддисмутазы превращается в перекись водорода.
Получение
Пероксид водорода получают в промышленности при реакции с участием органических веществ, в частности, каталитическим окислением изопропилового спирта:
Ценным побочным продуктом этой реакции является ацетон.
В промышленных масштабах пероксид водорода получают электролизом серной кислоты, в ходе которого образуется надсерная кислота, и последующим разложением последней до пероксида и серной кислоты.
В лабораторных условиях для получения пероксида водорода используют реакцию:
Концентрирование и очистку пероксида водорода проводят осторожной перегонкой.
Применение
Благодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту и в промышленности, где используется, например, как отбеливатель на текстильном производстве и при изготовлении бумаги. Применяется как ракетное топливо — в качестве окислителя или как однокомпонентное (с разложением на катализаторе). Используется в аналитической химии, в качестве пенообразователя при производстве пористых материалов, в производстве дезинфицирующих и отбеливающих средств. В промышленности пероксид водорода также находит свое применение в качестве катализатора, гидрирующего агента, как эпоксидирующий агент при эпоксидировании олефинов.
Хотя разбавленные растворы перекиси водорода применяется для небольших поверхностных ран, исследования показали что этот метод обеспечивая антисептический эффект и очищение и удлиняет время заживления. [1] [2] Обладая хорошими очищающими свойствами, перекись водорода на самом деле не ускоряет заживление ран. Достаточно высокие концентрации, обеспечивающие антисептический эффект, могут также удлинять время заживления из-за повреждения прилегающих к ране клеток. [3] Более того, перекись водорода может мешать заживлению и способствовать образованию рубцов из-за разрушения новообразующихся клеток кожи. [4] Однако, в качестве средства для очистки глубоких ран сложного профиля, гнойных затеков, флегмон, и других гнойных ран санация которых затруднена, перикись водорода остается препаратом выбора. Так как она обладает не только антисептическим эффектом, но и продуцирует большое количество пены, при взаимодействии с ферментом пероксидазой. Что в свою очередь позволяет размягчить и отделить от тканей некротизированные участки, сгустки крови, гноя, которые буду легко смыты последующим введением в полость раны антисептического раствора. Без предварительной обработки перекисью водорода, антисептический раствор не сможет удалить данные патологические образования, что приведет значительному увеличению времени заживления раны, и ухудшит состояние больного.
В пищевой промышленности растворы пероксида водорода применяются для дезинфекции технологических поверхностей оборудования, непосредственно соприкасающихся с продукцией. Кроме того, на предприятиях по производству молочной продукции, соков, растворы перекиси водорода используются для дезинфекции упаковки (технология «Тетра Пак»). Для технических целей пероксид водорода применяют в производстве электронной техники.
В быту применяется также для выведения пятен MnO2, получившихся при взаимодействии перманганата калия «марганцовки» с предметами (ввиду его окислительных свойств).
Пероксид водорода в аквариумистике
3%-ный раствор пероксида водорода используется в аквариумистике для оживления задохнувшейся рыбы, а также для очистки аквариумов и борьбы с нежелательной флорой и фауной в аквариуме (гидры, планарии, паразиты, водоросли, бактерии и др.)
Формы выпуска
Выпускается в виде водных растворов, стандартная концентрация 1-6 %, 30, 38, 50, 60, 85, 90 и 98 %. 30 % водный раствор пероксида водорода, стабилизированный добавлением фосфатов натрия, называется пергидролем.
Опасность применения
Несмотря на то, что пероксид водорода не токсичен, его концентрированные растворы при попадании на кожу, слизистые оболочки и в дыхательные пути вызывают ожоги. В больших концентрациях недостаточно чистый пероксид водорода может быть взрывоопасен. Опасен при приёме внутрь концентрированных растворов. Вызывает выраженные деструктивные изменения, сходные с действиями щелочей. Летальная доза 30%-го раствора пероксида водорода (пергидроля) — 50—100 мл. [7]
+7 (495) 508 65 64
Работаем с физ.лицами и юр.лицами, почта для заявок юр.лиц: waterhim@yandex.ru
Пергидроль
Перекись водорода для бассейнов 3000 руб.
Прозрачная голубая вода без усилий, моментальный эффект!
Доставка по Москве и МО, отправим в регионы.
*Для концентрации 50% канистра 25 кг, для концентрации 37% канистра 34 кг
Перекись водорода для бассейна (пергидроль) – это раствор, содержащий 37-50 % активного вещества. Эффективно применение в комплексе с другими средствами:
Примерный алгоритм очистки воды в бассейне перекисью водорода:
Состав, свойства, описание
Пероксид водорода – неустойчивый кристаллогидрат H2O2+2H2O, бесцветная жидкость. В неограниченном количестве растворяется в воде, эфире, спирте. В концентрированном виде взрывоопасен, образует ожоги. Будучи сильным окислителем, может вызывать коррозию металлов.
Широкая сфера применения (медицина, дезинфекция, техника, промышленность) объясняется тем, что это соединение является окислителем, восстановителем, катализатором. Примеры: в реакции с нитритами выступает как окислитель (превращает в нитраты), для очистки серебра используются восстановительные свойства (восстанавливает Ag2O до чистого Ag с выделением кислорода и воды).
Используется как катализатор различных химических процессов, гидрирующий агент.
Как антимикробное средство H2O2 уничтожает возбудителей туберкулеза, холеры, чумы, сибирской язвы, других грамположительных и грамотрицательных бактерий, вирусов.
Международное наименование: Водорода пероксид (Hydrogen peroxide)
Групповая принадлежность: Антисептическое средство
Описание действующего вещества (МНН): Водорода пероксид
Перокси́д водоро́да (перекись водорода), H2O2 — простейший представитель пероксидов. Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны.
Молекула пероксида водорода сильно полярна, что приводит к возникновению водородных связей между молекулами. Связь O—O непрочна, поэтому H2O2 — неустойчивое соединение, легко разлагается. Так же этому может поспособствовать присутствие ионов переходных металлов и серебра.В разбавленных растворах пероксид водорода тоже не устойчив и самопроизвольно диспропорционирует на H2O и O2, т.е. разлогается на воду и кислород.
30 % водный раствор пероксида водорода, стабилизированный добавлением фосфатов натрия, называется пергидролем.
Лекарственная форма:
раствор [дезинфицирующий], раствор для наружного применения, раствор для наружного применения [спиртовой]
Фармакологическое действие:
Антисептическое средство из группы оксидантов. При контакте перекиси водорода с поврежденной кожей или слизистыми оболочками высвобождается активный кислород, при этом происходит механическое очищение и инактивация органических веществ (протеины, кровь, гной). Антисептическое действие не является стерилизующим, при его применении происходит лишь временное уменьшение количества микроорганизмов. Обильное пенообразование способствует тромбообразованию и остановке кровотечений из мелких сосудов.
Показания:
Воспалительные заболевания слизистых оболочек, гнойные раны, капиллярное кровотечение из поверхностных ран, носовые кровотечения. Для дезинфекции и дезодорирования: стоматит, тонзиллит, гинекологические заболевания. В качестве антидота (в комбинации с 3% раствором уксусной кислоты) при отравлении калия перманганатом.
Побочные действия: Жжение в момент обработки раны, аллергические реакции.
Способ применения и дозы:
Для наружного применения используют 1-3% раствор, для полоскания полости рта и горла, нанесения на слизистые оболочки — 0.25% раствор. Поврежденные участки кожи или слизистой оболочки обрабатывают аэрозолем, ватным или марлевым тампоном, смоченным раствором препарата. Тампоны следует держать пинцетом. Возможно струйное орошение раневой поверхности. В токсикологической практике 3% раствор применяют внутрь (в комбинации с 3% раствором уксусной кислоты).
Для лабораторных целей пероксид водорода получают классическим способом (оксид бария + серная кислота, именно так его обнаружил первооткрыватель).
В промышленности применяется каталитическое окисление изопропилового спирта, электролиз серной кислоты.
В промышленности технический пергидроль применяется:
Выдержка из wikipedia:
В практическом аквариумном рыбоводстве перекись водорода приносит свои положительные эффекты и используется в следующих случаях:
Не следует забывать, что перекись водорода — очень сильный окислитель, и чтобы избежать ожогов на теле рыб и растений, перед внесением в аквариум ее следует разбавить 10-20 частями воды и только потом вносить в аквариум и непосредственно перед выходным отверстием фильтра. При применении перекиси обязательно обильное аэрирование воды. Не рекомендуется превышать дозировку более 4 мл. 3%-ной перекиси водорода на 10 л. воды.
Что соответствует 7 мл на 10 литров воды 37% пергидроли или 86 мл 3% перекиси на 10 литров воды. (если я правильно посчитал)
Данная концентрация значительно превышает рекомендуемую концентрацию для аквариумов, и в первые сутки после добавления пергидроли в бассейн, купаться всеже не рекомендуется, как вобщем-то и как после добавления любой химии для шоковой обработки воды.
На второй день концентрация пергидроли значительно уменьшается, т.к. она распадается на воду и кислород.
О результате эксперимента доложу позже.
Оживление задохнувшейся рыбы — купания (до 4 мл. перекиси водорода на 10 л. воды, бывает достаточно и 2 мл);
Удушье рыб — добавление раствора в аквариум (10-20 мл. на каждые 100 л. аквариумной воды). Этот метод хорош, когда нет возможности запустить компрессор, а кислород рыбам остро необходим. Процедура проделывается не больше 1-го раза в сутки, и при этом учитывается заселение аквариума: если аквариум перенаселен, то можно слегка увеличить дозировку.
Борьба с нежелательной живностью в аквариуме (гидры, планарии) — до 40 мл. на каждые 100 л. аквариумной воды, вносить каждый день 1 раз, продолжительность процедур 1 неделя и более. Желательно предварительно убрать растения.
Борьба с простейшими и паразитами — купания по 5-15 мин. (10 мл. на 1 л. воды). Необходимо следить за состоянием рыб и при надобности сократить время купания.
Бактериальная инфекция на теле рыбы и ее плавниках — купания (2-3 мл на 10 л воды) — 2 раза в сутки в течение 7-14 дней.
Борьба с сине-зелеными водорослями в аквариуме — вносить раствор в аквариум (20-30 мл. на 100 л. воды). Эффект виден на 3-й день.
Борьба с водорослями на растениях — купания (4 мл. на 10 л. воды) по 30-60 мин. Метод применим только для жестколистных растений — хорошо помогает в борьбе с нитчатой водорослью «вьетнамкой» (лат. Compsopogon).[3]
ВОДОРОДА ПЕРОКСИД
ВОДОРОДА ПЕРОКСИД – (старое название – перекись водорода), соединение водорода и кислорода Н2О2, содержащее рекордное количество кислорода – 94% по массе. В молекулах Н2О2 содержатся пероксидные группы –О–О– (см. ПЕРОКСИДЫ), которые во многом определяют свойства этого соединения.
Впервые пероксид водорода получил в 1818 французский химик Луи Жак Тенар (1777 – 1857), действуя сильно охлажденной соляной кислотой на пероксид бария:
BaO2 + 2HCl ® BaCl2 + H2O2. Пероксид бария, в свою очередь, получали сжиганием металлического бария. Для выделения из раствора Н2О2 Тенар удалил из него образовавшийся хлорид бария: BaCl2 + Ag2SO4 ® 2AgCl + BaSO4. Чтобы не использовать дорогую соль серебра в последующем для получения Н2О2 использовали серную кислоту: BaO2 + H2SO4 ® BaSO4 + H2O2, поскольку при этом сульфат бария остается в осадке. Иногда применяли другой способ: пропускали углекислый газ во взвесь ВаО2 в воде: BaO2 + H2O + CO2 ® BaCO3 + H2O2, поскольку карбонат бария также нерастворим. Этот способ предложил французский химик Антуан Жером Балар (1802–1876), прославившийся открытием нового химического элемента брома (1826). Применяли и более экзотические методы, например, действие электрического разряда на смесь 97% кислорода и 3% водорода при температуре жидкого воздуха (около –190° С), так был получен 87%-ный раствор Н2О2.
Концентрировали Н2О2 путем осторожного упаривания очень чистых растворов на водяной бане при температуре не выше 70–75° С; так можно получить примерно 50%-ный раствор. Сильнее нагревать нельзя – происходит разложение Н2О2, поэтому отгонку воды проводили при пониженном давлении, используя сильное различие в давлении паров (и, следовательно, в температуре кипения) Н2О и Н2О2. Так, при давлении 15 мм рт.ст. сначала отгоняется в основном вода, а при 28 мм рт.ст. и температуре 69,7° С, отгоняется чистый пероксид водорода. Другой способ концентрирования – вымораживание, так как при замерзании слабых растворов лед почти не содержит Н2О2. Окончательно можно обезводить поглощением паров воды серной кислотой на холоде под стеклянным колоколом.
Физические свойства.
Чистый пероксид водорода очень сильно отличается от знакомого всем 3%-ного раствора Н2О2, который стоит в домашней аптечке. Прежде всего, он почти в полтора раза тяжелее воды (плотность при 20° С равна 1,45 г/см 3 ). Замерзает Н2О2 при температурой немного меньшей, чем температура замерзания воды – при минус 0,41° С, но если быстро охладить чистую жидкость, она обычно не замерзает, а переохлаждается, превращаясь в прозрачную стеклообразную массу. Растворы Н2О2 замерзают при значительно более низкой температуре: 30%-ный раствор – при минус 30° С, а 60%-ный – при минус 53° С. Кипит Н2О2 при температуре более высокой, чем обычная вода, – при 150,2° С. Смачивает стекло Н2О2 хуже, чем вода, и это приводит к интересному явлению при медленной перегонке водных растворов: пока из раствора отгоняется вода, она, как обычно, поступает из холодильника в приемник в виде капель; когда же начинает перегоняться Н2О2, жидкость выходит из холодильника в виде непрерывной тоненькой струйки. На коже чистый пероксид водорода и его концентрированные растворы оставляют белые пятна и вызывают ощущение жгучей боли из-за сильного химического ожога.
В статье, посвященной получению пероксида водорода, Тенар не очень удачно сравнил это вещество с сиропом, возможно, он имел в виду, что чистый Н2О2, как и сахарный сироп, сильно преломляет свет. Действительно, коэффициент преломления безводного Н2О2 (1,41) намного больше, чем у воды (1,33). Однако то ли в результате неверного толкования, то ли из-за плохого перевода с французского, практически во всех учебниках до сих пор пишут, что чистый пероксид водорода – «густая сиропообразная жидкость», и даже объясняют это теоретически – образованием водородных связей. Но ведь вода тоже образует водородные связи. На самом деле вязкость у Н2О2 такая же, как и у чуть охлажденной (примерно до 13° С) воды, но нельзя сказать, что прохладная вода густая, как сироп.
Реакция разложения.
Взрывы Н2О2 объясняются сильной экзотермичностью реакции, цепным характером процесса и значительным снижением энергии активации разложения Н2О2 в присутствии различных веществ, о чем можно судить по следующим данным:
| Катализатор | Энергия активации, кДж/моль | Относительная скорость реакции при 25° С |
| Без катализатора | 73 | 1 |
| Ионы I – | 56 | 1,1·10 3 |
| Платина | 48 | 2,3·10 4 |
| Ионы Fe 2+ | 42 | 2,5·10 5 |
| Каталаза | 7 | 3·10 11 |
Фермент каталаза содержится в крови; именно благодаря ей «вскипает» от выделения кислорода аптечная «перекись водорода», когда ее используют для дезинфекции порезанного пальца. Реакцию разложения концентрированного раствора Н2О2 под действием каталазы использует не только человек; именно эта реакция помогает жуку-бомбардиру бороться с врагами, выпуская в них горячую струю (см. ВЗРЫВЧАТЫЕ ВЕЩЕСТВА). Другой фермент – пероксидаза действует иначе: он не разлагает Н2О2, но в его присутствии происходит окисление других веществ пероксидом водорода.
Ферменты, влияющие на реакции пероксида водорода, играют большую роль в жизнедеятельности клетки. Энергию организму поставляют реакции окисления с участием поступающего из легких кислорода. В этих реакциях промежуточно образуется Н2О2, который вреден для клетки, так как вызывает необратимое повреждение различных биомолекул. Каталаза и пероксидаза совместно превращают Н2О2 в воду и кислород.
H2O2 + Fe 2+ ® Fe 3+ + OH . + OH –
ОН . + Н2О2 ® H2O + HO2 .
HO2 . + Fe 3+ ® Fe 2+ + O2 + H +
При определенных условиях возможно цепное разложение Н2О2, упрощенный механизм которого можно представить схемой
ОН . + Н2О2 ® H2O + HO2 . 2 . + H2O2 ® H2O + O2 + OH . и т.д.
Быстрое разложение Н2О2 можно использовать для эффектного лекционного опыта, если до внесения катализатора добавить к раствору поверхностно-активное вещество (мыло, шампунь). Выделяющийся кислород создает обильную белую пену, которую назвали «зубной пастой для слона».
Некоторые катализаторы инициируют нецепное разложение Н2О2, например:
Нецепная реакция идет и в случае окисления ионов Fe 2+ в кислых растворах: 2FeSO4 + H2O2 + H2SO4 ® Fe2(SO4)3 + 2H2O.
Поскольку в водных растворах почти всегда есть следы различных катализаторов (катализировать разложение могут и ионы металлов, содержащихся в стекле), к растворам Н2О2, даже разбавленным, при их длительном хранении добавляют ингибиторы и стабилизаторы, связывающие ионы металлов. При этом растворы слегка подкисляют, так как при действии чистой воды на стекло получается слабощелочной раствор, что способствует разложению Н2О2.
Все эти особенности разложения Н2О2 позволяют разрешить противоречие. Для получения чистого Н2О2 необходимо проводить перегонку при пониженном давлении, поскольку вещество разлагается при нагревании выше 70° С и даже, хотя очень медленно, при комнатной температуре (как сказано в Химической энциклопедии, со скоростью 0,5% в год). В таком случае, как же получена фигурирующая в той же энциклопедии температура кипения при атмосферном давлении, равная 150,2° С? Обычно в таких случаях используют физико-химическую закономерность: логарифм давления пара жидкости линейно зависит от обратной температуры (по шкале Кельвина), поэтому если точно измерить давление пара Н2О2 при нескольких (невысоких) температурах, то легко можно рассчитать, при какой температуре это давление достигнет 760 мм рт.ст. А это и есть температура кипения при обычных условиях.
Теоретически радикалы ОН . могут образоваться и в отсутствие инициаторов, в результате разрыва более слабой связи О–О, но для этого нужна довольно высокая температура. Несмотря на относительно небольшую энергию разрыва этой связи в молекуле Н2О2 (она равна 214 кДж/моль, что в 2,3 раза меньше, чем для связи Н–ОН в молекуле воды), связь О–О все же достаточно прочная, чтобы пероксид водорода был абсолютно устойчив при комнатной температуре. И даже при температуре кипения (150° С) он должен разлагаться очень медленно. Расчет показывает, что при этой температуре разложение на 0,5% должно происходить тоже достаточно медленно, даже если длина цепи равна 1000 звеньев. Несоответствие расчетов и опытных данных объясняется каталитическим разложением, вызванным и мельчайшими примесями в жидкости и стенками реакционного сосуда. Поэтому измеренная многими авторами энергия активации разложения Н2О2 всегда значительно меньше, чем 214 кДж/моль даже «в отсутствие катализатора». На самом деле катализатор разложения всегда есть – и в виде ничтожных примесей в растворе, и в виде стенок сосуда, именно поэтому нагревание безводного Н2О2 до кипения при атмосферном давлении неоднократно вызывало взрывы.
В некоторых условиях разложение Н2О2 происходит очень необычно, например, если нагреть подкисленный серной кислотой раствор Н2О2 в присутствии иодата калия KIO3, то при определенных концентрациях реагентов наблюдается колебательная реакция, при этом выделение кислорода периодически прекращается, а потом возобновляется с периодом от 40 до 800 секунд.
Химические свойства Н2О2.
Растворы Н2О2, особенно концентрированные, обладают сильным окислительным действием. Так, при действии 65%-ного раствора Н2О2 на бумагу, опилки и другие горючие вещества они воспламеняются. Менее концентрированные растворы обесцвечивают многие органические соединения, например, индиго. Необычно идет окисление формальдегида: Н2О2 восстанавливается не до воды (как обычно), а до свободного водорода: 2НСНО + Н2О2 ® 2НСООН + Н2. Если взять 30%-ный раствор Н2О2 и 40%-ный раствор НСНО, то после небольшого подогрева начинается бурная реакция, жидкость вскипает и пенится. Окислительное действие разбавленных растворов Н2О2 больше всего проявляется в кислой среде, например, H2O2 + H2C2O4 ® 2H2O + 2CO2, но возможно окисление и в щелочной среде:
Окисление черного сульфида свинца до белого сульфата PbS + 4H2O2 ® PbSO4 + 4H2O можно использовать для восстановления потемневших свинцовых белил на старых картинах. Под действием света идет окисление и соляной кислоты:
H2O2 + 2HCl ® 2H2O + Cl2. Добавление Н2О2 к кислотам сильно увеличивает их действие на металлы. Так, в смеси H2O2 и разбавленной H2SO4 растворяются медь, серебро и ртуть; иод в кислой среде окисляется до иодной кислоты HIO3, сернистый газ – до серной кислоты и т.д.
Необычно происходит окисление калий-натриевой соли винной кислоты (сегнетовой соли) в присутствии хлорида кобальта в качестве катализатора. В ходе реакции KOOC(CHOH)2COONa + 5H2O2 ® KHCO3 + NaHCO3 + 6H2O + 2CO2 розовый CoCl2 изменяет цвет на зеленый из-за образования комплексного соединения с тартратом – анионом винной кислоты. По мере протекания реакции и окисления тартрата комплекс разрушается и катализатор снова розовеет. Если вместо хлорида кобальта использовать в качестве катализатора медный купорос, то промежуточное соединение, в зависимости от соотношения исходных реагентов, будет окрашено в оранжевый или зеленый цвет. После окончания реакции восстанавливается синий цвет медного купороса.
Совершенно иначе реагирует пероксид водорода в присутствии сильных окислителей, а также веществ, легко отдающих кислород. В таких случаях Н2О2 может выступать и как восстановитель с одновременным выделением кислорода (так называемый восстановительный распад Н2О2), например:
Последняя реакция интересна тем, что в ней образуются возбужденные молекулы кислорода, которые испускают оранжевую флуоресценцию (см. ХЛОР АКТИВНЫЙ). Аналогично из растворов солей золота выделяется металлическое золото, из оксида ртути получается металлическая ртуть и т.д. Такое необычное свойство Н2О2 позволяет, например, провести окисление гексацианоферрата(II) калия, а затем, изменив условия, восстановить продукт реакции в исходное соединение с помощью того же реактива. Первая реакция идет в кислой среде, вторая – в щелочной:
(«Двойственный характер» Н2О2 позволил одному преподавателю химии сравнить пероксид водорода с героем повести известного английского писателя Стивенсона Странная история доктора Джекила и мистера Хайда, под влиянием придуманного им состава он мог резко изменять свой характер, превращаясь из добропорядочного джентльмена в кровожадного маньяка.)
Получение Н2О2.
На катоде, как обычно, идет выделение водорода, так что суммарная реакция описывается уравнением 2H2O ® H2O2 + H2. Но основной современный способ (свыше 80% мирового производства) – окисление некоторых органических соединений, например, этилантрагидрохинона, кислородом воздуха в органическом растворителе, при этом из антрагидрохинона образуются Н2О2 и соответствующий антрахинон, который потом снова восстанавливают водородом на катализаторе в антрагидрохинон. Пероксид водорода извлекают из смеси водой и концентрируют перегонкой. Аналогичная реакция протекает и при использовании изопропилового спирта (она идет с промежуточным образованием гидропероксида): (СН3)2СНОН + О2 ® (СН3)2С(ООН)ОН ® (СН3)2СО + Н2О2. При необходимости образовавшийся ацетон также можно восстановить до изопропилового спирта.
Применение Н2О2.
Пероксид водорода находит широкое применение, а его мировое производство исчисляется сотнями тысяч тонн в год. Его используют для получения неорганических пероксидов, как окислитель ракетных топлив, в органических синтезах, для отбеливания масел, жиров, тканей, бумаги, для очистки полупроводниковых материалов, для извлечения из руд ценных металлов (например, урана путем перевода его нерастворимой формы в растворимую), для обезвреживания сточных вод. В медицине растворы Н2О2 применяют для полоскания и смазывания при воспалительных заболеваниях слизистых оболочек (стоматиты, ангина), для лечения гнойных ран. В пеналах для хранения контактных линз в крышку иногда помещают очень небольшое количество платинового катализатора. Линзы для их дезинфекции заливают в пенале 3%-ным раствором Н2О2, но так как этот раствор вреден для глаз, пенал через некоторое время переворачивают. При этом катализатор в крышке быстро разлагает Н2О2 на чистую воду и кислород.
Когда-то модно было обесцвечивать волосы «перекисью», сейчас для окраски волос существуют более безопасные составы.
В присутствии некоторых солей пероксид водорода образует как бы твердый «концентрат», который удобнее перевозить и использовать. Так, если к сильно охлажденному насыщенному раствору борнокислого натрия (буры) добавить Н2О2 в присутствии, постепенно образуются большие прозрачные кристаллы пероксобората натрия Na2[(BO2)2(OH)4]. Это вещество широко используется для отбеливания тканей и как компонент моющих средств. Молекулы Н2О2, как и молекулы воды, способны внедряться в кристаллическую структуру солей, образуя подобие кристаллогидратов – пероксогидраты, например, К2СО3·3Н2О2, Na2CO3·1,5H2O; последнее соединение широко известное под названием «персоль». Так называемый «гидроперит» CO(NH2)2·H2O2 представляет собой клатрат – соединение включения молекул Н2О2 в пустоты кристаллической решетки мочевины.
В аналитической химии с помощью пероксида водорода можно определять некоторые металлы. Например, если к раствору соли титана(IV) – сульфата титанила добавить пероксид водорода, раствор приобретает ярко-оранжевый цвет вследствие образования надтитановой кислоты:
TiOSO4 + H2SO4 + H2O2 ® H2[TiO2(SO4)2] + H2O. Бесцветный молибдат-ион MoO4 2– окисляется Н2О2 в интенсивно окрашенный в оранжевый цвет пероксидный анион. Подкисленный раствор дихромата калия в присутствии Н2О2 образует надхромовую кислоту: K2Cr2O7 + H2SO4 + 5H2O2 ® H2Cr2O12 + K2SO4 + 5H2O, которая довольно быстро разлагается: H2Cr2O12 + 3H2SO4 ® Cr2(SO4)3 + 4H2O + 4O2. Если сложить эти два уравнения, получится реакция восстановления пероксидом водорода дихромата калия:
Надхромовую кислоту можно извлечь из водного раствора эфиром (в растворе эфира она значительно более устойчива, чем в воде). Эфирный слой при этом окрашивается в интенсивный синий цвет.
пергидроль
Смотреть что такое «пергидроль» в других словарях:
пергидроль — пергидроль … Орфографический словарь-справочник
пергидроль — пероксид Словарь русских синонимов. пергидроль сущ., кол во синонимов: 1 • пероксид (1) Словарь синонимов ASIS. В.Н. Тришин … Словарь синонимов
пергидроль — я, м. perhidrol m. <лат.per сверх + hydor вода. Тридцатипроцентный водный раствор перекиси водорода, сильный окислитель. Химические опыты с пергидролем. Васюкова 1999. Невозможно было скрыть на экране деликатную, интеллигентскую красоту,… … Исторический словарь галлицизмов русского языка
ПЕРГИДРОЛЬ — (пергидрол) 30 процентный водный раствор перекиси водорода (см.). Прозрачная бесцветная жидкость без запаха. Используется для приготовления 3 процентных растворов перекиси водорода, которые менее стойки, чем пергидроль … Краткая энциклопедия домашнего хозяйства
ПЕРГИДРОЛЬ — см. Водорода пероксид … Большой Энциклопедический словарь
пергидроль — раствор перекиси водорода … Словарь сокращений и аббревиатур
ПЕРГИДРОЛЬ — Perhydrolum. Синонимы: раствор перекиси водорода концентрированный, гиперол, лапирол, ортизон. Свойства. Бесцветная прозрачная жидкость без запаха или со слабым своеобразным запахом, слабокислой реакции. Медленно разлагается при взаимодействии с … Отечественные ветеринарные препараты
пергидроль — perhidrolis statusas T sritis chemija apibrėžtis 30% vandenilio peroksido vandeninis tirpalas. atitikmenys: angl. perhydrol rus. пергидроль … Chemijos terminų aiškinamasis žodynas
Пергидроль — техническое название 30% ного водного раствора перекиси водорода (См. Перекись водорода) H2O2. Прозрачная жидкость без цвета и запаха, с «металлическим» привкусом. П. окислитель и отбеливатель во многих производствах. Разбавлением П.… … Большая советская энциклопедия
Перекись водорода для бассейна: виды, преимущества и недостатки, чем заменить
Принято считать, что чистка бассейна перекисью водорода поможет добиться чистоты и безопасности. Предлагаем разобраться, насколько это утверждение правдиво и что еще можно использовать в качестве альтернативы.
Как действует перекись водорода и каких видов бывает
Перекись водорода — бесцветное вещество, которое ничем не пахнет и легко распадается на безвредные компоненты. Когда оно соединяется с водой, выделяется активный кислород. Благодаря ему, пергидроль для бассейна приобретает дезинфицирующие, бактерицидные свойства.
Обычно для санации используется несколько видов пероксида:
медицинский — концентрация вещества 30–40%;
технический, тип А — 37%
технический, тип В — 60%.
Вещества с концентрацией свыше 60% не применяются, так как становятся способными взрываться.
Как применять перекись водорода для очищения бассейна
Чтобы добиться нужного результата, очистка бассейна перекисью водорода должна проводиться по инструкции. Особое значение имеет правильный расчет действующего вещества.
Расчет количества перекиси водорода
Если использовать слишком много вещества, вода может стать опасной для здоровья и жизни пользователей. Если взять слишком мало пергидроли, очищающего эффекта не получится. Поэтому крайне важно правильно рассчитать дозировку. На нее влияет не только размер бассейна, количество воды, но и количество загрязнений. Смотрим, сколько препарата нужно добавлять с учетом степени загрязненности воды.
Степень загрязненности воды
Концентрация 30–40% (г)
Концентрация 60% (г)
Время применения (ч)
Подготовка бассейна перед чисткой
Прежде чем добавлять пергидроль, нужно провести уборку. Выловить сачком листья, крупный мусор. Специальным скребком счищается налет, которые образуется на стенках. Далее нужно проверить уровень pH воды. Если он держится на уровне 7,2–7,6, все хорошо. Если он превышает эти значения, нужно использовать вещества для его нормализации.
Добавление перекиси водорода и других химических реагентов должно производиться через циркуляционный насос. Только так вы сможете обеспечить быстрое и равномерное распределение вещества в воде.
Работа с циркуляционным насосом
Дезинфекция вручную
Для справки! Вам нужно знать, что сегодня пероксид в больших объемах продавать запрещено. Однако не стоит расстраиваться, так как производители предлагают широкий выбор аналогов для ухода за бассейном.
Какие средства-аналоги можно использовать
Даже если вы регулярно чистите бассейн механически, это не защитит воду от микроорганизмов, грибов, вирусов. Именно поэтому так важно иметь под рукой эффективное дезинфицирующее средство. Оно уничтожит опасные патогены без вреда для здоровья купающихся.
На основе хлора
Хлор — самое популярное и действенное средство для чистки от вредоносных патогенов. Имеет резкий запах, а при излишней концентрации может провоцировать аллергию или покраснение кожи, слизистых. Именно поэтому хлор заслужил особую нелюбовь со стороны пользователей. Однако он лучше остальных справляется с бактериальной флорой. Удаляет даже кишечную палочку, поэтому санитарные службы многих стран рекомендуют его для дезинфекции искусственных водоемов.
Главное — правильно рассчитать дозировку и выдержать указанное производителем время. Обычно требуется около суток, чтобы вещество справилось с вредоносными микроорганизмами и разложилось на безвредные составляющие.
Если нужно провести быструю дезинфекцию, обычно применяются хлорсодержащие вещества быстрого действия.
Хлоритэкс. Препарат быстрее растворяется и начинает действовать, чем ускоряет обработку бассейна. Подходит для конструкций с чашей из полиэстера и винила. Может использоваться при любой жесткости воды, не содержит кальция и не влияет на pH.
Хлороксон. Не только дезинфицирует, но и осветляет воду. Эффективно уничтожает вирусы, бактерии, другие микроорганизмы. Содержит стабилизатор, который делает хлор устойчивым к воздействию УФ-лучей. Совмещается как с песчаными, так и с картриджными фильтрами. Не содержит кальция, имеет нейтральный pH.
| Для справки! Хлорсодержащие вещества действуют только при нейтральном уровне pH. Поэтому сначала нужно привести показатель в норму, а уже потом проводить санацию. |
На основе брома
Бром также обладает дезинфицирующим действием. Обычно его используют, если у владельца бассейна аллергия на хлорсодержащие препараты. К тому же он хорошо действует при любом уровне кислотно-щелочного баланса.
Минус в том, что бром стоит дороже хлорсодержащих аналогов. При этом менее эффективен. Это значит, что его потребуется больше, чем в случае с хлором. Рекомендован для очистки детских бассейнов до 20 куб. м.
На основе активного кислорода
Особенность таких составов в том, что радикалы кислорода могут убивать бактерии. Эффективность веществ несколько ниже, чем у хлора. Однако состав не имеет запаха, не вызывает аллергии или раздражения кожи. Обеззараживает воду, не создавая неприятного запаха. Но если неправильно рассчитать дозировку, можно получить ожоги.
Оксибас. В основе лежит пероксигидрат водорода, который активно борется с мутностью воды, цветением, налетом на стенках. При соприкосновении с жидкостью молекула распадается на воду и активный кислород. Последний убивает патогенные бактерии, микроорганизмы, способствует осветлению и очищению воды. Не влияет на кислотно-щелочной баланс. Хорошо совмещается с любыми фильтрами, а результат сохраняется до одного месяца.
Альгициды
Есть также препараты, которые предназначены для очистки воды от зелени и водорослей. Если бассейн открытый, такие вещества будут необходимы. Поскольку под воздействием солнца на стенках и дне конструкции постепенно образуется зеленоватая пленка.
Альгициды предотвращают цветение воды или помогают избавиться от уже образовавшейся зеленой пленки. Обычно применяются перед началом купального сезона. Вам нужно протереть раствором стенки и дно конструкции. Обычно берут 100 мл вещества, которые разбавляют в 600 мл воды. Когда вода уже набрана, их также можно добавлять. Обязательно проводить профилактику еженедельно или по наличию слизи, зелени. Для профилактики обычно достаточно 50 мл на 10 куб. м. Ударная доза будет достигать 200 мл. Однако после такой обработки купаться можно будет не раньше, чем через сутки.
Альгитинн. Универсальное вещество, которое также может применяться и в СПА-бассейнах. Не пенится, не содержит хлора. Способствует очищению и осветлению воды.
Преимущества и недостатки перекиси, ее аналогов
Мы решили сравнить несколько самых популярных химических средств с перекисью водорода, чтобы вам было проще принять решение.
Перекись водорода
Относится ко второму классу опасности (высокоопасные вещества), поэтому нельзя недооценивать риски, сопряженные с применением этой популярной жидкости.
отсутствует неприятный запах;
простота в применении;
обесцвечивает зеленые водоросли;
не изменяет кислотно-щелочной баланс воды;
не вредит окружающей среде;
результат сохраняется до двух месяцев;
может использоваться самостоятельно.
передозировка может привести к серьезным химическим ожогам кожи, тогда как передозировка хлором чревата только жжением слизистых, сухостью кожи;
обходится дороже, чем традиционное хлорирование;
должен чередоваться с хлорсодержащими составами, так как пергидроль хуже справляется с бактериями, вирусами, палочками;
эффективен при температуре ниже +27 градусов;
не сочетается с хлором, известью;
при длительном применении способствует тому, что кожные покровы человека стареют;
требует не менее суток на обработку.
Хлорсодержащие вещества
Действующим веществом в таким препаратах является не сам хлор, а хлорноватистая кислота или «свободный хлор». Запах у нее присутствует, однако его нельзя назвать резким.
Когда кислота вступает во взаимодействие с загрязнениями, она распадается на безвредные вещества. Однако при контакте с потом, слюной, другими загрязнениями может образоваться хлорамин. Именно это вещество ответственно за резкий неприятный запах в общественных бассейнах. Если такое произошло, нужно просто добавить больше дезинфицирующего состава. Если не сделать этого, запах усилится, а хлорамин не будет устранен.
можно одновременно дезинфицировать воду и чашу;
пролонгированное действие препаратов;
возможность использования для ударной, быстрой очистки;
доступность и невысокая стоимость;
надежное устранение вирусов, грибков, патогенных бактерий, спор микроводорослей, посторонних запахов;
опция осветления воды.
не уничтожает споры;
патогенные микроорганизмы привыкают к небольшим дозам хлора, поэтому регулярно требуется проводить ударную обработку высокими дозами;
нужно тщательно следить за расчетом дозировки;
необходимость деактивировать хлорамины.
Активный кислород
Препараты бесхлорной дезинфекции растворяются в воде. В итоге образуются активные радикалы, которые эффективно уничтожают болезнетворную органику. При этом может снижаться кислотно-щелочной баланс воды, а эффект от дезинфекции хуже, чем от хлора. Поэтому составы на активном кислороде не применяются в общественных бассейнах.
подходит для шоковой чистки и регулярного ухода за водой;
совместим с хлором;
действует при контакте с водой;
хорошо справляется с биологическими загрязнениями;
не раздражает слизистую;
никакого негативного воздействия на волосы;
астматики и аллергики могут купаться в бассейне после обработки;
неприятный запах отсутствует;
вредные побочные продукты не образуются;
оборудованию не вредит;
уничтожает микроскопические водоросли, вода не зацветет.
может снижать кислотно-щелочной баланс воды, поэтому после обработки его обязательно нужно проверить;
стоит дороже, чем хлорсодержащие составы;
быстро разлагается, поэтому его дозировку придется регулярно увеличивать, что негативно сказывается на расходах;
при передозировке может быть опасен;
не справится с сильными загрязнениями, поэтому придется использовать хлор дополнительно;
вызывает активный рост водорослей.
Дополнительные уходовые средства для бассейна
Если вы собираетесь обзавестись бассейном, то для ухода за ним потребуются дополнительные средства.
Регуляторы уровня ph
Чистота воды, комфорт при купании зависят от кислотно-щелочного баланса. Если он повышен, хлорсодержащие средства просто не подействуют, а состояние внутренних деталей конструкции будет серьезно страдать. Оптимальный уровень pH составляет 7,2–7,4. Если он ниже указанного, может возникнуть ржавчина, а цементные швы начнут разрушаться. Кроме этого, кислая среда вызывает покраснение, раздражение кожных покровов.
Если уровень высокий, стенки начинает покрывать беловатый налет, а вода мутнеет. Но самая большая опасность состоит в том, что хлор перестает окисляться до конца. В итоге в воде образуются хлорамины — те самые вещества, которые ответственны за неприятный запах в бассейне, раздражение кожи, резь в глазах, аллергию.
Чтобы этого избежать, нужно еженедельно замерять уровень pH и регулировать его, если требуется. Для корректировки используются такие препараты, как «Экви Плюс» и «Экви Минус». Могут производиться в таблетках, гранулах или растворе.
Очистка от грязи и отложений
Не менее важно очищать воду от грязи и известковых отложений. Для таких целей используется препарат «Антикальцит». Обычно создается в виде распыляемого раствора. Его можно применять для очистки бортов, лестниц, внутреннего оборудования, держателей. Достаточно распрыскать состав над поверхностью, которая будет обрабатываться.
Средство не должно попадать на поверхности, которые плохо переносят воздействие кислот. Например, из алюминия или эмали. Также хромированное оборудование нужно очищать крайне осторожно. Нельзя, чтобы средство контактировало с поверхностью дольше, чем рекомендует производитель.
Очистка проводится, когда вода спущена. Средство оставляется на 10–15 минут, после чего поверхность очищается с помощью щеток и скребков, ополаскивается теплой водой. Желательно, чтобы был приток свежего воздуха, если очистка ведется в помещении.
Видеоинструкция по уходу за бассейном
Мы подготовили для вас инструкцию, которая поможет разобраться, что и в каком порядке нужно использовать. Если будете действовать в таком порядке, вода в бассейне всегда будет чистой, безопасной, приятной для купания.
Перекись водорода, как и многие другие народные средства, привлекают внимание своей дешевизной, а также мнимой безопасностью. Однако, как вы могли убедиться, пергидроль является высокоопасным препаратом. Очень важно тщательно рассчитать количество вещества, чтобы очистить воду и не навредить пользователям. Иначе люди могут получить серьезные химические ожоги при контакте с водой. К тому же, купаясь в такой воде, вы можете заработать аллергические реакции.
Что немаловажно, в большинстве случаев все равно придется применять хлорсодержащие составы. Ведь только они уничтожают кишечные палочки, вирусы и бактерии на 100%. И бояться таких препаратов не стоит, поскольку в них используется не технический хлор, который мы используем для мытья сантехники, а специальный. Растворяясь в воде, он разлагается на безопасные вещества. Однако и в этом случае нужно тщательно следить за дозировкой.
Перекись водорода
Перекись водорода – незаменимый антисептик
Понятие и особенности

История появления
Перекись водорода появилась в начале XIX века, ее открыл практически в чистом виде химик Луис Тенар (Франция, 1818 год) в результате химической реакции пероксида бария с серной кислотой. В те времена она называлась «окисленной водой». Промышленное производство пероксида по методу французского химика началось полвека спустя (Берлин, 1873 год), но срок годности его был довольно короткий, поэтому его должны были использовать почти сразу же после получения. Широкое применение пероксид водорода нашел лишь 100 лет спустя, когда советский ученый Волькенштейн открыл его в безопасном виде.
Перекись водорода применялась во время Второй Мировой войны при изготовлении военной техники. Также, в зависимости от концентрации, начала использоваться в промышленных целях (например, в качестве отбеливающего средства), в фармакологии (антисептик).
Применением перекиси водорода в лечебных целях занимался в начале прошлого века американский врач Уильям Дуглас, после чего она стала широко применяться в медицине.
Применение
На сегодняшний день данный химический реактив, благодаря своим окислительным свойствам, нашел свое применение практически во всех областях промышленности:
— в целлюлозно-бумажной (для отбелки механических и химических масс, для изготовления бумаги);
— в текстильной (в качестве отбеливателя различных тканей, мехов);
— в химической (в качестве окислителя);
— в горнодобывающей (для добычи золота, урана);
— в нефтедобывающей и нефтеперерабатывающей;
— в сельском хозяйстве (для обработки сельскохозяйственных культур);
— в рыбном хозяйстве (для лечения рыб);
— в пищевой (для дезинфекции и стерилизации);
— в косметологии (как очищающее и отбеливающее средство, для приготовления краски для волос);
— в стоматологии (для отбеливания зубов);
— в быту (для поддержания чистоты);
— в ракетно-космической промышленности (для изготовления ракетного топлива);
— в медицине и фармакологии.
Применение перекиси водорода в медицине
Несмотря на вышеупомянутый перечень отраслей, перекись водорода нашла свое самое большое применение в медицине, особенно в хирургии, как антисептическое, дезинфицирующее, дезодорирующее средство.
Перекись может быть использована как наружно, так и внутренне, но самый безопасный и эффективный способ применения– это наружное. Для внутреннего применения в качестве профилактики от многих болезней используют только слабоконцентрированный 3% раствор перекиси и не более одного раза в день.
В медицине перекись используют при лечении:
— аллергии;
— хронического бронхита;
— герпеса;
— гипертонии;
— гриппа;
— инсульта;
— опухолей (также и злокачественных);
— болезни Паркинсона;
— артроза;
— рассеянного склероза;
— болезней кожи;
— чесотки;
— кариеса;
— невралгии и многое др.
Перекись водорода является незаменимым антисептиком при чистке крови, а также для лечения инфекционных заболеваний.
Опасно! Несмотря на то, что перекись водорода нетоксичена и неопасна, при попадании концентрированного раствора на кожу, слизистую оболочку глаз или дыхательные пути может вызвать ожог. Первая помощь – промыть обильно холодной водой и обратиться к врачу. Следует помнить, что самолечение перекисью водорода может быть опасно для здоровья.
Купить перекись водорода
Магазин химических реактивов в Москве розница “Prime Chemicals Group” – это огромный выбор лабораторного оборудования и химических реактивов по доступным ценам. Купить перекись водорода 37% под заказ или перекись водорода цена (50%) всего за 52 руб.
Перекись водорода
Состав
В состав перекиси водорода, выпускаемой в форме раствора 3-процентного, входят от 7,5 до 11 грамм медицинской перекиси водорода (концентрация на 100 мл раствора), что — в зависимости от фактической концентрации вещества в исходной субстанции — соответствует содержанию пероксида водорода 3 грамма (от 30 процентов до 40 процентов).
Вспомогательные компоненты: бензоат натрия и очищенная вода.
Форма выпуска
Трехпроцентный р/р для наружного и местного применения.
По 40 и 100 мл (упаковка №1) в:
Для стационаров средство выпускают в флаконах объемом 0,5 л (упаковка №12) и 1 л (упаковка №8).
Фармакологическое действие
Фармакодинамика и фармакокинетика
Перекись водорода — это антисептик из группы антиоксидантов. При контакте вещества с поврежденными слизистыми или кожей высвобождается активный кислород, что в свою очередь способствует размягчению и отделению некротизированных участков тканей, а также сгустков гноя и крови.
В дальнейшем инактивированные органические вещества легко смываются при введении в полость раны антисептического раствора.
В Википедии указывается, что без предварительной обработки раствором перекиси водорода удаление патологических образований из раны не представляется возможным. Как результат — время заживления поврежденных тканей затягивается, а состояние больного ухудшается.
Перекись водорода не оказывает стерилизующего действия — при применении раствора количество микроорганизмов лишь временно уменьшается.
Большое количество пены, образующейся при попадании перекиси в рану, способствует образованию тромбов и остановке кровотечения из мелких сосудов.
Показания к применению: для чего нужна Перекись водорода?
В традиционной медицине раствор применяется для обработки гнойных ран и воспаленных слизистых оболочек, при кровотечениях (носовых и капиллярных из поверхностных ран).
Дезодорирующие и дезинфицирующие свойства средства позволяют использовать его для полоскания горла и для полоскания полости рта. В частности, полоскание горла перекисью водорода показано при ангине, тонзиллите, стоматите.
Чистка ушей перекисью водорода позволяет убрать серные пробки. Кроме того, средство применяется в гинекологии для лечения женских болезней.
Полоскания ротовой полости перекисью являются радикальным способом избавиться от запаха изо рта.
Мифы и реальность или можно ли принимать Перекись водорода во внутрь?
Для чего пьют раствор перекиси и что лечит внутрь принятый раствор? Основной целью применения перекиси водорода внутрь является уничтожение переродившихся клеток (в том числе при раке). Кроме того, клетками-мишенями являются клетки иммунной системы.
Встречаясь с микроорганизмом, клетка иммунной системы вырабатывает синглетный кислород, который прожигает оболочку микробной клетки и делает таким образом микроорганизм нежизнеспособным.
Однако следует помнить, что при приеме внутрь водного раствора перекиси, последний действует разрушающе на слизистую пищеварительного канала: активный кислород, выделяясь уже внутри организма, уничтожает не только патогенную микрофлору, но также окисляет и слизистую ротовой полости, пищевода, желудка и тонкого отдела кишечника.
Это в свою очередь приводит к нарушению всасывающей способности слизистой и, следовательно, к тому, что пища начинает хуже перевариваться и в значительно меньшей степени усваиваться. Описанный процесс является практически необратимым: клетки кишечника постепенно погибают, а возможность усвоения поступающей пищи, соответственно, нарушается.
После всасывания в кишечнике перекись попадает в плазму крови и впоследствии в печень. В крови активный окислитель необходим только лишь самой малочисленной фракции структурных элементов — лейкоцитам. Для эритроцитов и тромбоцитов перекись напротив опасна, поскольку способствует их разрушению.
Под воздействием средства уменьшается количество тромбоцитов и на короткое время снижается вероятность тромбообразования, что можно расценить как плюс. Однако быстрое разрушение эритроцитов — это, несомненно, огромный минус.
Со временем, при условии что костный мозг не утратил способности синтезировать эритроциты и тромбоциты, количество последних должно увеличиться. Этот эффект обусловлен тем, что под воздействием перекиси на периферии усиливается распад тромбоцитов и эритроцитов, а в костном мозге — их продукция.
Описанное лечебное свойство, как правило, используется при таких состояниях, как заражении крови или сепсис, и, скорее, как жест отчаяния.
Теоретически эффективным может оказаться и лечение перекисью водорода желудка и кишечника. Это связано с тем, что при приеме средства внутрь могут погибать патогенные микроорганизмы и уменьшаться проявления пресловутого дисбактериоза.
Очень важно знать, как принимать препарат, чтобы не навредить: принимать раствор — в особенности при проблемах с ЖКТ — следует с большой осторожностью, в малых дозах (не больше 2 капель на 2 ст. ложки воды) и только на голодный желудок (после последнего приема пищи должно пройти не менее 40 минут, а лучше — 2-3 часа).
Перекись — это растворимое в жирах вещество, поэтому если раствор принимать внутрь после приема жирной пищи, она может попасть в лимфатическую систему. С уверенностью сказать, с чем она столкнется в первую очередь — с вирусом, бактериальной клеткой или с клеткой иммунной системы, — невозможно. Следовательно, ситуация вполне может выйти из-под контроля.
Таким образом, рассматривая целесообразность приема перекиси водорода внутрь, следует учитывать, что на современного человека и так действует огромное количество окислителей, поэтому сознательное введение в организм еще одного, по меньшей мере, не разумно.
Применение в народной медицине: лечение перекисью водорода по Неумывакину
В народной медицине перекись водорода используется в первую очередь для лечения заболеваний сердца и сосудов. Особенно широко средство стали применять после того, как профессор Неумывакин провел исследование его свойств.
Доктор Неумывакин на вопрос “Что лечит перекись?”, отвечает, что применение препарата по его методике эффективно при самых разнообразных заболеваниях (причем как в профилактических целях, так и для лечения).
Если в инструкции по применению раствор описывается только как средство наружного применения, то профессор Неумывакин о лечении перекисью водорода (в видео и книге “Перекись водорода. На страже здоровья”) советует использовать его при псориазе, для промывания носа, от грибка ногтей, от потливости подмышек, при ангине, остеохондрозе, зубной боли, и даже вводить перекись водорода в/в.
Также он дает советы, как полоскать горло и как чистить уши перекисью.
В нос раствор перекиси применяют при простудных и неврологических заболеваниях. При фронтите и гайморите разведенный водой препарат можно использовать для промывания. Для приготовления раствора нужной концентрации 1 ч. ложку перекиси разводят в 50 мл воды.
При заболеваниях неврологического характера средство закапывают в носовые ходы в чистом виде.
Для промывания уха профессор рекомендует закапывать в каждый носовой ход или в уши по 3-5 капель препарата. Кроме того, применение в ухо раствора перекиси водорода позволяет быстро и легко удалять серные пробки в ушах.
Лечение перекисью водорода пародонтоза и десен по методу Неумывакина проводят с использованием состава, для приготовления которого 20 капель трехпроцентного раствора добавляют к 10 каплям лимонного сока и 3 г питьевой соды.
Чтобы вылечить пародонтоз, этой смесью следует чистить зубы. Очень важно в течение 15 минут после процедуры воздерживаться от употребления пищи.
Применение средства для лечения десен позволяет не только уничтожить вредные бактерии, но также купировать воспалительный процесс и справиться с кровоточивостью десен.
Лечение грибка ногтевого при помощи перекиси проводят следующим образом: для начала ногу распаривают в горячей воде с добавлением соды (1 ч. ложка на 1 л воды), затем к больному ногтю на 40-60 минут прикладывают вырезанный по его форме и пропитанный трехпроцентным раствором ватный диск. Процедуру нужно повторять дважды в день.
Чтобы вылечить грибок также можно 2-3 раза в день капать препарат в полость ногтя. Если поражены ногти на руках, время воздействия препарата следует сократить до 15 минут.
Чтобы более подробно узнать о мнении профессора Неумывакина о перекиси водорода, а также о том, как пить перекись водорода по Неумывакину правильно, можно скачать бесплатно его книги или читать их онлайн.
Отзывы о лечении по методу доктора Ивана Неумывакина довольно противоречивы. Кто-то считает, что необходимо иметь очень здоровый организм, чтобы ставить на себе эксперименты с перекисью. Другие же уверяют, что применение перекиси водорода (в/в или внутрь) принесло огромную пользу для организма.
Применение в косметологии
В косметологии перекись применяется в качестве средства от пигментных пятен на лице, от черных точек и угрей, для отбеливания лица, а также против прыщей.
Для ухода за кожей можно просто протирать лицо перекисью водорода (подобную процедуру повторяют не более 2 раз в неделю), а можно делать маски на основе трехпроцентного раствора.
Помогает ли от прыщей раствор перекиси? Женщины, применявшие препарат, утверждают, что помогает.
Наиболее эффективны от прыщей — отзывы являются тому подтверждением — составы с добавлением стрептоцида или дрожжей.
При использовании стрептоцида в таблетках, препарат следует растереть, а затем 1 ч. ложку полученного порошка смешать с детской присыпкой (чуть меньше 1 ст. ложки) и развести перекисью, чтобы образовалась однородная, не слишком густая кашица.
Маску наносят на лицо и оставляют до высыхания. Снимать ее следует, не смывая. Процедуру повторяют не чаще 1 раза в неделю.
Для приготовления дрожжевой маски следует развести раствором до кашицеобразного состояния 2 ст. ложки пивных или обычных дрожжей. Состав наносят на лицо в 3 подхода, а когда он полностью высохнет на коже, смывают холодной водой. Повторять процедуру можно не чаще, чем 2 раза в неделю.
Очень хорошо при кожных проблемах зарекомендовала себя маска из бодяги с перекисью.
Для ее приготовления 4 г порошка бодяги разводят раствором перекиси до кашицеобразного состояния. Маску наносят на лицо и через 5-10 минут аккуратно смывают водой. Если она попала в глаз при смывании, следует тщательно промыть глаза до исчезновения жжения.
Более мягко и безопасно действует перекись водорода от прыщей в составе медовой маски с йодом. Чтобы ее приготовить, нужно смешать 1 ст. ложку меда, 1 ст. ложку сока алоэ, 2 капли перекиси и 2 капли йода. Наносить такое средство необходимо непосредственно на прыщи. Время воздействия — 15 минут. После этого маску смывают.
Улучшить цвет лица, убрать прыщи и угревую сыпь помогает также маска для лица с содой и перекисью. Ингредиенты смешивают в пропорциях 1:2 (1 часть соды на 2 части трехпроцентного раствора) и наносят на лицо на 10 минут. Снимать маску рекомендуется круговыми движениями кончиками пальцев. Процедуру повторяют не чаще 1 раза в 2 недели.
При использовании препарата следует помнить, что средство наиболее эффективно, если кожа проблемная или склонна к жирности.
Как отбелить лицо при помощи Перекиси?
Для отбеливания кожи можно просто несколько раз в день прикладывать к пигментированным участкам смоченный в растворе ватный тампон.
После каждой процедуры отбеливания лица кожу рекомендуется протирать влажной салфеткой и покрывать толстым слоем увлажняющего крема.
Отбеливание с помощью препарата также проводят с использованием творожной маски. Для приготовления состава следует смешать 1 ст. ложку жирного творога с желтком 1 яйца и 5 каплями трехпроцентного раствора. Время воздействия — 10-15 минут, после чего лицо умывают теплой водой.
Применять перекись водорода для лица в течение месяца рекомендуется не чаще 1-2 раз в неделю, после чего необходимо выдержать перерыв продолжительностью в 2-3 месяца.
Обесцвечивание волос Перекисью водорода
Обесцвечивание волос перекисью является одним из наиболее доступных способов придать волосам более светлый оттенок.
При осветлении волос перекисью водорода кислород, соединяясь с красящим пигментом, создает химическую реакцию, в результате которой естественный цвет меланина изменяется на более светлый.
Применение перекиси для осветления волос помогает приподнять чешуйки верхнего защитного слоя волоса, благодаря чему тот становится более пористым и впоследствии лучше окрашивается. По этой причине женщины обычно используют раствор перед тем, как покрасить волосы.
Также перекись можно использовать и после окрашивания для осветления волос.
Тем не менее, следует помнить, что регулярное воздействие препарата губительно для волос, поскольку со временем он разрушает в стержнях волос меланин и приводит к серьезным повреждениям волос (вплоть до их полной потери).
Применение в быту
Полезные свойства перекиси водорода нередко используются и в быту. Средство применяют для чистки серебра и для чистки золота, для чистки рабочих поверхностей на кухне, поверхности раковины/ванны и труб, мытья полов, устранения грибка и плесени, мытья посуды, травления печатных плат (в смеси с соляной кислотой) и для отбеливания белья. Многие хозяйки также знают, как осветлить джинсы при помощи перекиси.
Поместив в раствор перекиси зубную щетку или губку для мытья посуды, можно бороться с вредными микробами на них. Для уничтожения бактерий зубную щетку опускают в чистый трехпроцентный раствор на три минуты, а губку для посуды — на 10 минут в разведенный водой в соотношении 1:1 раствор.
Чтобы почистить золото перекисью, к 200 мл воды следует добавить 1 ч. ложку нашатырного спирта, 1 ч. ложку жидкого мыла и 40 мл трехпроцентного раствора перекиси, а затем поместить в полученный раствор ювелирные изделия. Время воздействия — 20 минут. Потом украшения промывают водой и высушивают салфеткой.
Химические свойства препарата позволяют использовать его и для растений. При обработке семян перекисью уничтожаются препятствующие их прорастанию ингибиторы (семена перед высадкой замачивают в растворе перекиси). Кроме того, средство нередко применяют для обеззараживания любых ран при операциях на растениях.
Опрыскивание сельскохозяйственных культур разведенным раствором способствует повышению урожайности. Кроме того, раствор используют для гигиены корней. Для полива растений обычно используется раствор, приготовленный в концентрации: 60 мл перекиси на 3 л воды.
Чтобы приготовить действенный и безопасный инсектицид для растений, следует добавить к 2 л воды 100 г сахара и 100 мл перекиси.
Также перекись водорода является одним из наиболее доступных, надежных и эффективных средств для дезинфекции и очистки бассейна.
Средство работает благодаря своим свойствам окислителя, которые основаны не на воздухе, в котором содержатся молекулы кислорода, а на кислороде. Однако при добавлении в бассейн перекиси вместо хлора эффект ограничивается быстрым повторным соединением кислорода. По этой причине очистка бассейнов в общественных местах с использованием кислородно-пероксидного метода запрещена.
Тем не менее, благодаря отсутствию каких-либо раздражителей, посторонних запахов и продуктов разложения частные лица широко применяют перекись водорода для бассейна в качестве альтернативы хлорному методу очистки.
Дозировка для бассейна зависит от концентрации вещества. Так, на тонну воды следует брать 700 г 30-40%-ной или 500 г 50%-ной перекиси водорода. Нужное количество вещества отмеряют в отдельную емкость и затем равномерно распределяют по всей поверхности бассейна.
Купаться в бассейне рекомендуется не ранее, чем спустя 12 часов (а лучше — через сутки после обработки).
Перекись можно использовать против водорослей в аквариуме, оживления задохнувшейся рыбы, борьбы с нежелательной живностью (например, с гидрами или планариями), а также для лечения бактериальных инфекций на плавниках и теле рыб.
Дозировка в аквариуме зависит от цели применения препарата: так, для того, чтобы убрать сине-зеленые водоросли и вылечить инфицированных рыб, перекись водорода ежедневно добавляют в аквариум из расчета 25 мл на 100 л воды (эффект виден на 3-й день, но для его закрепления процедуру повторяют в течение недели), а для оживления рыбы и уничтожения нежелательных организмов на аналогичный объем воды берут 40 мл раствора.
Любители ставить дома химические опыты смешивают воду, перекись водорода, соль и уксус для получения светящейся жидкости. Смешав марганцовку и перекись водорода с водой и жидким мылом, можно получить очень красивую пену красно-белого цвета.
Для получения пены измельченные в порошок таблетки гидроперита высыпают в колбу с узким горлом, вливают туда жидкое мыло, добавляют воду, а затем — раствор перманганата калия (предварительно приготовленный в отдельной колбе).
При взаимодействии концентрированного раствора (20-50%) с ацетоном, в присутствии серной кислоты и при охлаждении до 0°С образуется перекись ацетона — огне- и взрывоопасное даже при незначительном контакте с влагой вещество.
Противопоказания
Наружное применение раствора противопоказано при гиперчувствительности к его компонентам.
Относительные противопоказания на лечение водорода перекисью 3%:
Побочные действия
Побочные эффекты проявляются в виде реакций гиперчувствительности и жжения в момент обработки раны.
Инструкция по применению Перекиси водорода
В соответствии с инструкцией по применению, перекись водорода 3-процентная предназначена для местного и наружного применения.
Для дезинфекции горла и полости рта используют раствор с концентрацией от 1 до 3%. На слизистые наносят 0,25%-ный раствор.
Для его приготовления можно использовать гидроперит и перекись водорода. Если используется гидроперит (пероксид водорода, выпускаемый в виде таблеток твердого клатрата с карбамидом), для получения раствора нужной концентрации следует растворить 1 таблетку этого средства в 200 мл воды.
Если используется трехпроцентный раствор, то его следует развести в воде в соотношении 1:11.
Как обработать рану при помощи препарата?
Поврежденные слизистые и кожу обрабатывают смоченным раствором тампоном из марли или ваты. Во время обработки тампон удерживают пинцетом. Допускается также струйное орошение поврежденных тканей.
Как полоскать рот препаратом для устранения неприятного запаха?
От запаха изо рта используют разведенные в стакане воды 3-4 ч. ложки 3-хпроцентного раствора. Процедуру полоскания с применением такого раствора следует проводить до 3 р./день. Как правило, для устранения запаха обычно достаточно 2-3 дней.
Следует помнить, что использовать для обработки ротовой полости следует только 3-процентный раствор. Перекись водорода 6 процентов является слишком концентрированной для этих целей и может вызвать ожог.
Как пользоваться препаратом для удаления волос?
Удаление волос перекисью водорода — это доступная и быстрая процедура. Под воздействием препарата волос истончается, становится более светлым и замедляет рост. Полностью удалить волосяной стержень средство не способно.
При использовании для удаления волос трехпроцентного раствора необходимо учитывать, что его эффективность тем выше, чем тоньше и светлее волосы.
Способ применения средства очень прост: для достижения желаемого результата необходимо просто регулярно протирать волоски на теле смоченным в растворе ватным тампоном. Чем чаще повторяется процедура, тем быстрее осветляются волоски.
Перекись водорода от нежелательных волос можно также использовать в сочетании нашатырным спиртом.
Рекомендации, как сделать в домашних условиях средство для удаления лишней растительности на теле, следующие: к 50 мл трехпроцентного раствора добавляют нашатырный спирт (5 капель) и нейтральный крем для бритья, тщательно перемешивают ингредиенты до получения однородной массы, а затем тампоном наносят на волосяной покров.
Время воздействия — от 15 до 20 минут. После этого состав смывают теплой водой. Процедуру нужно повторять ежедневно в течение недели.
Как обесцветить волосы перекисью водорода?
Рекомендации относительно того, как осветлить волосы перекисью водорода, следующие:
Перед тем, как отбелить волосы, рекомендуется провести тест: чтобы убедиться, что результат осветления не разочарует, на прядь с затылочной части головы ватным тампоном наносят на 30 минут раствор перекиси, а затем смывают средство холодной водой.
Чтобы осветлить волосы до нужного оттенка, процедуру необходимо повторять через день (или каждый день — в зависимости от состояния волос). Для ускорения процесса осветления можно использовать тепло.
Для осветления отдельных прядей можно на часть волос наносить препарат при помощи тампона, а можно просто распылить средство на верхний слой волос.
Раствор Н2О2 для волос в большей степени подходит блондинкам, поскольку темные волосы при таком способе осветления приобретают рыжеватый оттенок.
Как Перекисью осветлить волосы на лице?
Средство может также использоваться для обесцвечивания волосков на подбородке и над верхней губой. Для этого пропитанный раствором ватный тампон прикладывают к коже на 1,5-2 минуты до тех пор, пока не будет получен нужный результат.
Специалисты, которые приводят рекомендации, как осветлить усы, говорят, что для обесцвечивания волос над губой обычно достаточно 1 процедуры. Для осветления волос на шее и подбородке требуется больше времени.
Можно ли капать Перекись водорода в ухо?
На вопрос, можно ли закапывать в ухо раствор, специалисты отвечают, что применение препарата для ушей помогает весьма эффективно убирать ушные пробки.
Перед тем, как капать в ухо лекарство, голову наклоняют, чтобы заложенное ухо было в горизонтальном положении. После этого в пипетку набирают 5 капель раствора и аккуратно вводят его в ухо.
После введения в ухо перекись водорода начинает пениться и шипеть. Такая реакция является нормальной. Через несколько минут размягчившаяся сера начнет вытекать из слухового прохода.
Чистить уши после размягчения серы следует очень осторожно, чтобы отделяемое из уха не попало обратно. Для чистки можно использовать ватную палочку, салфетку или ватный тампон.
Аналогичные рекомендации приводятся относительно того, как почистить уши при помощи перекиси ребенку. Однако очень важно помнить, что перед тем как промыть ухо ребенку, следует проконсультироваться с врачом.
Как почистить пятки при помощи раствора H2O2?
Для пяток H2O2 применяется в виде ванночек. Чтобы быстро убрать огрубевшую кожу, рекомендуется растворить в 4 л воды 2 ст. ложки соли и опустить ноги в полученную жидкость на 7 минут.
Затем сюда же добавляют 3 ст. ложки 3-процентного раствора (или 2 таблетки гидроперита) и снова опускают в раствор ноги на 7 минут.
Размягчившуюся кожу счищают щеткой или пемзой.
Как полоскать горло Перекисью водорода?
Лечение горла перекисью применяется при ангине, стоматите, тонзиллите, а также легких простудных заболеваниях.
При попадании препарата в горло происходит высвобождение активной формы кислорода, что способствует очищению миндалин от налета, снижению количества болезнетворных бактерий и уменьшению тяжести интоксикации.
Полоскать горло перекисью рекомендуется до 5 раз в день, но чаще, чем 1 раз в 3 часа. Чтобы приготовить лекарство нужной концентрации, в стакане воды следует растворить 1 ст. ложку трехпроцентного раствора или 1 таблетку гидроперита.
После процедуры ротовую полость и горло рекомендуется дополнительно прополоскать содовым раствором, настоем ромашки или отваром шалфея.
Отбеливание зубов Перекисью водорода
Перекись для отбеливания зубов используется еще с 19-го века. Причем в наши дни средство применяют в том числе при проведении профессиональных чисток в клиниках.
Отзывы об отбеливании зубов при помощи раствора довольно неоднозначны. Кто-то совершенно не замечает результата и жалуется на неприятные ощущения, кто-то, напротив, вовсю хвалит эффективность средства.
Чтобы отбелить зубы, можно полоскать рот разведенным водой в соотношении 1:1 раствором Н2О2, а можно смешать 1 часть препарата с 2 частями воды и с использованием мягкой щетки почистить этим раствором зубы.
Также можно смешать пищевую соду с соком лимона (по 0,5 ч. ложки), добавить к этой смеси 7 капель раствора, а затем нанести состав на ватный диск и приложить на пару минут к зубам.
После применения H2O2 следует обязательно полоскать рот чистой водой или отваром трав.
Фото отбеливания. Сода и перекись водорода для зубов
Применение при гинекологических заболеваниях: спринцевание Перекисью водорода
В народной медицине H2O2 нередко используют для лечения миомы матки и молочницы.
При миоме матки ванны с добавлением перекиси и спринцевания способствует прижиганию больного органа и препятствуют разрастанию опухоли, при молочнице оказывают мощное антисептическое действие.
Спринцевание при молочнице и фибромиоме проводят с использованием раствора, для приготовления которого к 300 мл охлажденной до комнатной температуры кипяченой воды добавляют 100 мл трехпроцентного раствора перекиси (раствор может быть и менее концентрированным).
К этому средству можно добавить 1 ст. ложку отвара коры дуба или ромашки или же 1-2 капли масла чайного дерева.
Как правильно спринцеваться раствором Н2О2? Спринцевания рекомендуется проводить, лежа на кровати с разведенными ногами, или в ванной. Готовый раствор заливают в спринцовку, затем наконечник помещают во влагалище и сжимают спринцовку. Длительность процедуры — от 10 до 15 минут.
Вначале спринцевания следует проводить 2 раза в день, затем кратность применений препарата сокращают до 2-3 раз в неделю. Курс лечения при гинекологических заболеваниях состоит из 7-10 процедур.
Передозировка
Передозировка H2O2 проявляется в виде раздражения верхних дыхательных путей (бронхо-, ларингоспазм, ожог).
Что будет, если выпить Перекись водорода?
Симптомы отравления при случайном проглатывании большого количества раствора:
Лечение: промывание желудка раствором гидрокарбоната натрия и 0,5%-ным раствором Тиосульфата натрия, а также введение в вену 30%-ного раствора тиосульфата натрия (до 300 мл).
Если ребенок выпил H2O2, следует вызвать врача, а до его приезда сделать промывание желудка и дать ребенку активированный уголь.
Взаимодействие
Раствор нестабилен в щелочной среде, в тепле, на свету, в присутствии сложных радикалов отдельных оксидантов, солей металлов.
Условия продажи
Рецепт на латинском (образец): Rp. Sol. Hydrogenii peroxydi 3% 100 ml D.S. Для промывания ран.
Условия хранения
Рекомендации относительно того, как хранить препарат, следующие: раствор должен храниться в прохладном, светозащищенном месте.
Срок годности
Особые указания
Что такое Перекись водорода?
Вещество представляет собой бинарное соединение гидрогена с оксигеном. Химическая формула перекиси водорода — H2O2. Название вещества на латыни — Hydrogen peroxide, на украинском — Перекис водню.
Плотность вещества — 1.4 г/см³, молярная масса — 34,01 г/моль.
Согласно ОКПД, код пероксида водорода 24.13.53.000.
Класс опасности груза по ДОПОГ (ООН) — 5.1.
Техническую (марки А и марки Б) и медицинскую Н2О2 производят в соответствии с медицинским ГОСТ 177-88.
Почему пенится на ране раствор Перекиси?
Ответ на вопрос, почему шипит на ране H2O2, следующий — контактируя с поврежденными слизистыми и кожей, под влиянием каталазы (главным образом) и пероксидазы происходит разложение пероксида водорода. Реакция сопровождается выделением О2, в том числе его активных форм.
При попадании средства на раневую поверхность за счет поднимающихся со стенок пузырьков газа начинается обильное пенообразование.
Меры предосторожности
Препарат нельзя применять для орошения полостей. Не рекомендуется использовать средство под окклюзионные повязки.
Обработка раны препаратом не защищает от заражения раневой инфекцией и столбняком.
В токсикологии может раствор применяться внутрь в комбинации с 3%-ным раствором уксусной кислоты в качестве антидота при отравлении перманганатом калия.