Ti rads 2 щитовидной железы что это
Ti rads 2 щитовидной железы что это
Классификация TI-RADS
Категории по TI-RADS
Ультразвуковой тип узла
Коллоидный зоб, Коллоидный зоб 2 типа, Псевдоузел Хашимото 1 типа, Подострый тиреоидит
Коллоидный зоб 3 типа, Псевдоузел Хашимото 2 типа, Коллоидный узел 4 типа, Кистозный узел
Подозрение на рак
Злокачественный тип узла
Узел, злокачественность которого доказана ранее
Использование TI-RADS способствует четкому определению степени риска развития рака щитовидной железы в выявленных узлах и показаний к проведению тонкоигольной аспирационной биопсии для определения целесообразности хирургического вмешательства. [27].
При УЗИ брюшной полости и забрюшинного пространства обязательно оценивается печень, поджелудочная железа, надпочечники (исключение феохромоцитомы), яичники у девочек, при необходимости, проводится исследование яичек у мальчиков. При диагностике МРЩЖ обязательно выполняется УЗИ надпочечников.
— Рекомендуется всем пациентам с подозрением на злокачественное новообразование ЩЖ, а также перед проведением радиойодтерапии выполнить КТ органов грудной клетки для исключения метастатического поражения легких [5, 20].
— Рекомендуется при подозрении на врастание опухоли в трахею, пищевод, загрудинном расположении опухоли или опухолевом поражении лимфатических узлов верхнего средостения выполнить КТ и/или МРТ органов шеи с внутривенным контрастированием для определения распространенности опухолевого поражения [2, 5, 10, 16, 21].
— Рекомендуется пациентам с неясными данными УЗИ или с признаками вовлечения органов брюшной полости и забрюшинного пространства по данным УЗИ выполнение МРТ брюшной полости для исключения поражения органов брюшной полости и забрюшинного пространства [2, 4, 5, 10, 16, 21, 22].
— Рекомендуется пациентам с подозрением на злокачественное новообразование ЩЖ, а также перед проведением радиойодтерапии выполнить сцинтиграфию щитовидной железы и лимфатических узлов шеи [5, 11, 23, 24].
Комментарии: метод сцинтиграфии основан на различиях в поглощении радионуклидов опухолевой и здоровой тканью щитовидной железы, он позволяет определить распространенность опухолевого процесса. В подавляющем проценте случаев рак щитовидной железы визуализируется как «холодный» узел. Сцинтиграфия показана при определении причин тиреотоксикоза с наличием узла в щитовидной железе для исключения автономии, которая встречается также при РЩЖ.
Сцинтиграфия с I131 и I123 используется для оценки радикальности проведенного хирургического лечения и в случае подозрения на рецидив заболевания.
— Рекомендуется при медуллярном и анапластическом РЩЖ выполнить сцинтиграфию костей всего тела для исключения или подтверждения метастатического поражения [25, 26].
— Рекомендуется всем пациентам с подозрением на РЩЖ и с установленным диагнозом при нарушении фонации, затруднении дыхания выполнить ларингоскопию для исключения пареза или паралича голосовых складок, оценки объема движения надгортанника [2, 5, 10, 16].
Комментарии: при нарушении фонации, затруднении дыхания обязательно проведение ларингоскопии, обнаруживающей в ряде случаев вовлечение в процесс возвратного нерва или повреждение его во время предыдущих операций, врастание опухоли в стенку трахеи. При подозрении на врастание опухоли в стенку трахеи или пищевода показано применение трахеоскопии и эзофагоскопии.
Комментарии: основным показанием к проведению ПЭТ является рост уровня тиреоглобулина в динамике при отсутствии накопления по данным сцинтиграфии с I131.
— Пациентам, у которых МРЩЖ представлен в сочетании с синдромом МЭН 2Б (см. раздел 1.2 данных рекомендаций), рекомендуется выполнение колоноскопии для исключения неврином слизистой оболочки [31].
TIRADS
Рак щитовидной железы – злокачественная опухоль, развивающаяся из элементов железистого эпителия щитовидной железы.
Этиология
На сегодняшний день выделяют ряд основных факторов развития рака щитовидной железы: длительная стимуляция ткани щитовидной железы высокими дозами тиреотропного гормона (ТТГ), йодный дефицит, воздействие на ткань щитовидной железы ионизирующего излучения, наличие в ткани щитовидной железы неопластических процессов (аденомы, аденоматоза), наследственные синдромы (семейный аденоматозный полипоз, синдром Карни, синдром Каудена, МЭН 2А и 2B).
TIRADS
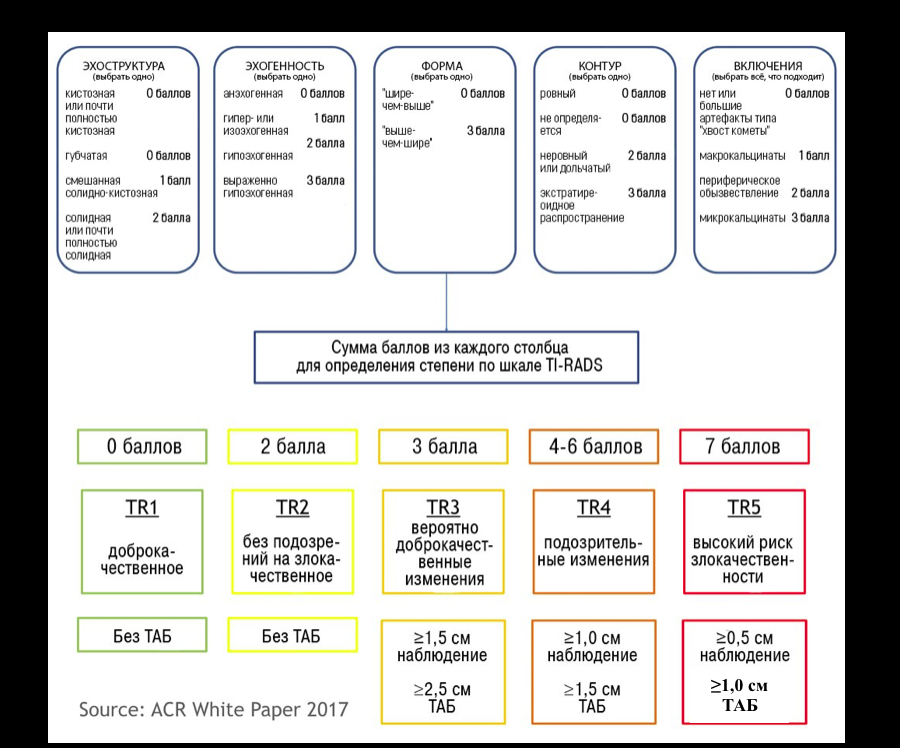
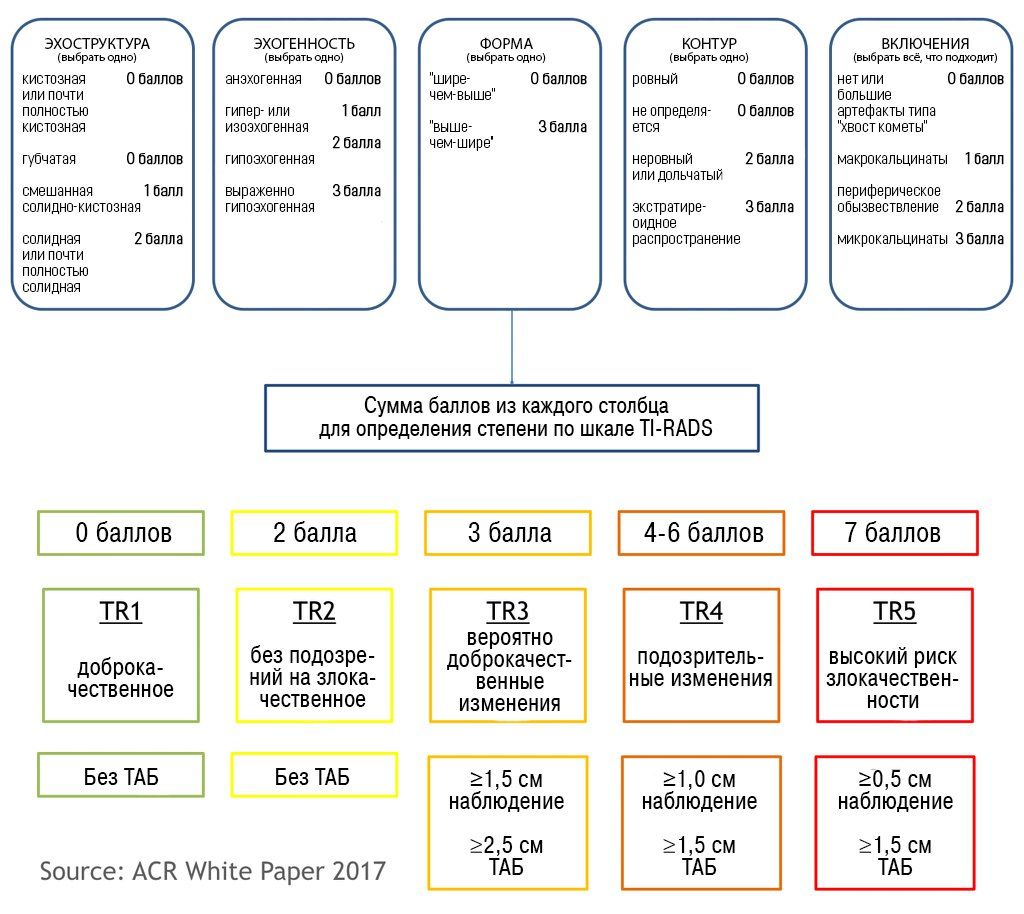
Рекомендации были разработаны Horvath и другими (3), модифицированы Jin Kwark и другими (4). Классификация TIRADS, разработанная American College of Radiology (ACR), используется для того, чтобы определить дальнейшую тактику ведения пациентов, у которых выявили узловые изменения в щитовидной железы. В 2017 году разработана стандартизированная шкала оценки изменений щитовидной железы (шкала ACR TIRADS), рекомендации для выполнения тонкоугольной аспирационной биопсии (ТАБ) и повторных исследований.
Классификация TIRADS
Схожая с классификацией BIRADS, в сонографической классификации TIRADS выделяют:
Обновлённые критерии TI-RADS — диагностика узловых поражений щитовидной железы
Узловые поражения щитовидной железы широко распространены: у примерно 1/3 взрослого населения на УЗИ обнаруживаются узловые поражения щитовидной железы. Однако менее 10% из них являются злокачественными. УЗИ высокого разрешения является методом первой линии для выявления и оценки узловых поражений щитовидной железы. Всё возрастающее число проводимых УЗИ-исследований и важность их результатов в дальнейшей тактике ведения больного обусловили потребность в наличии единой терминологии, которая позволила бы УЗИ-специалистам и клиницистам лучше понимать друг друга, а также единой системы классификации найденных узловых поражений, на основе которой можно было бы оценить вероятность злокачественности находок и тактику их дальнейшего ведения.
В 2009 году Eleonora Horvath с соавторами опубликовали результаты 8-летнего проспективного трехэтапного исследования, целью которого было создание такой единой УЗИ-классификации. Авторы проанализировали УЗИ-картины в общей сложности 1959 пациентов с узловыми поражениями щитовидной железы. Всем пациентам была проведена тонкоигольная аспирационная биопсия, а затем проанализирована корреляция результатов цитологического и гистологического исследования и найденных УЗИ-критериев.
На основе этих данных была создана классификация TI-RADS (Thyroid Imaging Reporting and Data System). В 2011 году Jin Young Kwak с соавторами предложили более простую в использовании модель, основанную на подсчете количества подозрительных ультразвуковых признаков. Эта модель была названа К-TIRADS (Korean Thyroid Imaging Reporting and Data System).В настоящий момент в клинической практике применяются несколько модификаций TI-RADS: чилийская, украинская, корейская и французская. Эти модификации не имеют принципиальных отличий.
По результатам проведенного Xi Wei (Head Neck, июнь 2016) метаанализа TI-RADS, чувствительность и специфичность этого диагностического инструмента составили 0,79 и 0,71 соответственно; это указывает на то, что категории TI-RADS являются перспективным инструментом для оценки доброкачественных и злокачественных узлов щитовидной железы и для принятия решения о дальнейшей биопсии. Стоит заметить, что TI-RADS не является единственной классификацией узловых поражений ЩЖ. Специалисты УЗИ используют также шкалы, разработанные Американской (American Thyroid Association (АTA), Statement on Preoperative Imaging for Thyroid Cancer Surgery, 2014) и Британской (British Thyroid Association (BTA), Ultrasound assessment of thyroid nodules, 2014) Тиреоидными Ассоциациями. Однако, на сегодняшний день TI-RADS и её различные модификации являются самыми популярными.
В марте 2017 года Journal of American College of Radiology опубликовал новую версию TI-RADS (ACR TI-RADS) и рекомендации к ее использованию. Еще более упрощенная, новая схема подразумевает, что каждому приведенному признаку будет присвоено определенное количество баллов, а затем по результатам подсчета найденное образование можно будет отнести к одной из существующих категорий. Для разработки новых рекомендаций были использованы данные литературы, результаты программы SEER (Surveillance, Epidemiology, and End Results) Национального Института Рака США и оценка существующих классификационных систем.
По заявлению Комитета TI-RADS, новые критерии должны:
снизить количество проводимых биопсий узловых образований ЩЖ с низким риском злокачественности;
давать возможность оценить все возможные узловые образования;
базироваться на уже разработанном лексиконе;
быть простыми в применении специалистами УЗИ-диагностики.
ACR TI-RADS согласуется с большинством других рекомендаций, предписывающих биопсию для образований высокого риска размером 1 см и более. Однако, порог для образований среднего и умеренного риска (2,5 и 1,5 см соответственно) выше, чем рекомендованые ATA и Korean Society of Thyroid Radiology. Последние ссылаются на исследование Machens с соавт., которое показало, что совокупный риск отдаленных метастазов от сосочкового и фолликулярного рака щитовидной железы существенно возрастал при размере образования 2 и более см. По утверждению авторов TI-RADS, они опирались на собственную интерпретацию данных этого исследования и отметили постепенное нарастание рисков, которое начиналось с большего размера узла. Немаловажно также и то, что Machens и др. основывали свой анализ на размере опухоли при патологоанатомическом исследовании, а не на параметрах, измеренных при УЗИ — а эти данные могут значительно отличаться. Исключение может быть сделано для узловых образований категории TR5 размерами 5‒9 мм.
Авторы рекомендуют определять эхоструктуру образования как губчатую только в том случае, если оно более чем на 50% состоит из небольших кистозных включений. В новой классификации понятия преимущественно солидного и преимущественно кистозного образования объединены в графу смешанного образования, так как само появление солидного компонента оказалось более прогностически важным, чем соотношение. Кроме того, хотя определение кровотока во включении с помощью доплеровского картирования не вошло в критерии новой классификации, авторы рекомендуют использовать его, чтобы отличить истинно солидный компонент от включений и кровоизлияния.
Наличие или отсутствие гидрофильной границы (HALO) также было опущено в новой версии TI-RADS. Зато появился термин «границы плохо определяются». Это нововведение позволит классифицировать большее количество образований. Термин «неровный дольчатый край» включает в себя зубчатые края, с или без протрузии в окружающую паренхиму. Могут возникнуть трудности с распознанием данного критерия, если контур не определяется, если эхогенность окружающей узел ткани ЩЖ гетерогенна или если узловых образований много и они «упираются» краями друг в друга. Выход контура образования за пределы железы обычно классифицируют при описании как обширный или минимальный. Обширное экстратиреоидное расширение, которое характеризуется выраженным прорастанием в смежные мягкие ткани и/или сосудистые структуры, является очень надёжным признаком злокачественности и неблагоприятным прогностическим фактором. Минимальное экстратиреоидное распространение может быть заподозрено по выпучиванию контура железы или снижению его эхогенности в месте образования, однако прогностическая ценность этого критерия дискутабельна. Авторы рекомендуют с осторожностью определять минимальное экстратиреоидное распространение, особенно если образование доброкачественно по другим критериям.
В случае если не удаётся оценить внутреннюю структуру образования из-за кальцификатов, дающих сильные акустические тени, авторы рекомендуют считать их солидными. Примечательно, что небольшие эхогенные включения, обнаруживаемые в губчатых узлах, чаще всего представляют собой задние стенки мелких кист. Такие включения не должны учитываться при подсчете баллов. В протоколе исследования следует особо указывать на локализацию образования в критических местах — если узел расположен близко к трахее или к борозде возвратного нерва. Важной частью протокола УЗИ является сонографическая оценка шейных лимфоузлов. Если пациенту ранее проводились оперативные вмешательства и/или биопсии ЩЖ, это также должно быть указано в протоколе.
Что касается сроков наблюдения, комитет TI-RADS рекомендует для категории TR5 обследования каждый год последующие 5 лет. Для TR4 сканирование должно проводиться через 1, 2, 3 и 5 лет. Для TR3 последующая визуализация может быть выполнена на 1-й, 3-й, и 5-й год. Наблюдение можно прекращать через 5 лет, если УЗИ-картина остается без изменений. Следует помнить, что данные критерии носят рекомендательный характер, и решение о дальнейшей биопсии и/или оперативном вмешательстве выносит клиницист после обсуждения тактики с пациентом, при этом учитывая многие другие факторы риска для каждого конкретного пациента, включая его семейный анамнез, возраст, пол, сопутствующую патологию и т.д.
Источники
Xu T. et al. Thyroid nodule sizes influence the diagnostic performance of TIRADS and ultrasound patterns of 2015 ATA guidelines: a multicenter retrospective study //Scientific reports. – 2017. – Т. 7. – С. 43183.
Tessler F. N. et al. ACR thyroid imaging, reporting and data system (TI-RADS): white paper of the ACR TI-RADS committee //Journal of the American College of Radiology. – 2017. – Т. 14. – №. 5. – С. 587-595.
Ti rads 2 щитовидной железы что это

Поиск
МУЛЬТИПАРАМЕТРИЧЕСКОЕ УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ С ПРИМЕНЕНИЕМ КЛАССИФИКАЦИИ TI-RADS В ОПРЕДЕЛЕНИИ ДИАГНОСТИЧЕСКОЙ ТАКТИКИ ПРИ ТИРЕОИДНЫХ УЗЛОВЫХ ОБРАЗОВАНИЯХ
УДК 616.414
1 Чувашский государственный университет имени И.Н. Ульянова, 428015, г. Чебоксары, Московский просп., д. 15
2 Республиканский клинический онкологический диспансер МЗ Чувашской Республики, 428020, г. Чебоксары, ул. Гладкова, д. 31
3 Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И.Кулакова МЗ Российской Федерации. 117997, г. Москва, ул. Академика Опарина, д. 4
Контактная информация:
Тимофеева Любовь Анатолиевна – кандидат медицинских наук, доцент кафедры пропедевтики внутренних болезней с курсом лучевой диагностики тел. +7-967-475-18-46, е-mail: adabai@mail.ru
Сенча Александр Николаевич – доктор медицинских наук, заведующий отделом визуальной диагностики, тeл. +7-905-130-52-23, е-mail: asencha@yandex.ru
Статья поступила: 16.03.2018, принята к печати: 28.03.2018.
1 Chuvash State University named after I.N. Ulyanov, 15 Moskovskiy prospekt, Cheboksary, Russian Federation, 428015
2 Republican Clinical Oncology Center of the Public Health Ministry of the Chuvash Republic 31 Gladkov Str., Cheboksary, Russian Federation, 428015
3 National Medical Research Center of Obstetrics, Gynecology, and Perinatology named after Academician V.I. Kulakov, Ministry of Health of Russia, 4 Acad. Oparina Str., Moscow, Russian Federation, 117997
Multi-parametric ultrasonic examination using TI-RADS classification in determining diagnostic tactics in thyroid nodular palpable abnormalities
Contact:
Timofeeva L.A. – Cand. Med. Sc., Associate Professor of the Department of Propedeutics of Internal Diseases with a course of radiodiagnostics, tel. +7-905-130-52-2, e-mail: adabai@mail.ru
Sencha A.N. – D. Med. Sc., Head of the Visual Diagnostics Department, tel. +7-905-130-52-23, e-mail: asencha@yandex.ru
The work is based on the results of ultrasound examination of 2076 patients of active treatment group (N1) and 100 patients of the control group (N2). Active treatment group (N1) patients were distributed to TI-RADS categories by ultrasound protocols results. Our data showed that in active treatment group (N1) 1011 patients were referred to category TI-RADS 2 (48.7%, p длины; при эластографии сдвиговой волной, неоднородное окрашивание в узле
В зависимости от поставленной категории TI-RADS и с учетом рекомендаций ACR TI-RADS (март 2017 г.), ТАБ была проведена 584 пациентам, в результате в 296 случаях был выявлен рак ЩЖ (таблица 2).
Таблица 2.
Результаты выполнения ТАБ с учетом категории TI-RADS
и рекомендаций ACR TI-RADS
| Категории TI-RADS | Количество пациентов | Рекомендации ACRTI-RADS по проведению ТАБ | Количество выполненных ТАБ | Количество выявленных случаев рака ЩЖ |
| TI-RADS 1 контрольная группа (N2) | 100 | Без ТАБ | 0 | 0 |
| TI-RADS 2 | 1011 | Без ТАБ | 0 | 0 |
| TI-RADS 3 | 310 | ≥ 1,5 см наблюдение ≥ 2,5 см ТАБ | 105 | 6 |
| TI-RADS 4а | 473 | ≥ 1,0 см наблюдение ≥ 1,5 см ТАБ | 203 | 24 |
| TI-RADS 4b | 116 | ≥ 1,0 см наблюдение ≥ 1,5 см ТАБ | 110 | 106 |
| TI-RADS 5 | 166 | ≥ 0,5 см наблюдение ≥ 1,5 см ТАБ | 166 | 160 |
| Итого | 2176 | 584 | 296 |
Из общего количества пациентов признаки категории TI-RADS 3 были определены при раке ЩЖ в 6 случаях (2,0%), TI-RADS 4a(возможно злокачественный узел) – в 24 (8,0%), TI-RADS 4b (скорее всего злокачественный) – в 106 (36,0%), TI-RADS 5 (злокачественный) – в 160 случаях (54,0%) (Рисунок 4).
Рисунок 4.
Распределение пациентов с раком ЩЖ по категориям TI—RADS.
Распределение пациентов по категориям TI-RADS с учетом морфологических форм рака ЩЖ представлены в таблице 3. «Под маской» доброкачественного образования категории TI-RADS 3 (T-R=6, p
Узлы щитовидной железы: разбираем актуальные вопросы

— Сергей Анатольевич, что такое узел щитовидной железы и чем он опасен?
— Насколько распространены узлы щитовидной железы и часто ли встречается рак?
— Как выявляются узлы щитовидной железы?
— Можно ли понять по УЗИ, является узел опасным или раковым заболеванием?
— Если по УЗИ нашли узел T HI RADS 4, значит нужно уже оперировать?
— Тогда, когда нужно оперировать?
— В случае, если после пункции этого узла есть подозрение на опухоль по результатам цитологического заключения.
— Насколько опасны опухоли щитовидной железы?

— Пациенты, у которых диагностирован рак на ранних стадиях заболевания, как правило, хорошо реагируют на лечение, а рецидивы встречаются крайне редко (пятилетняя выживаемость составляет почти 97 процентов). Некоторые типы рака щитовидной железы имеют более высокую частоту рецидивов.
— А где в Челябинской области можно выполнить пункцию щитовидной железы, чтобы распознать опухоль как можно раньше?
— Очень часто пациенту требуется не только выполнение пункции, но и консультация врача хирурга-эндокринолога для определения дельнейшей тактики, составления плана лечения и наблюдения, а при необходимости и направления на госпитализацию.
Хирурги-эндокринологи консультируют в Челябинском центре эндокринной хирургии (ГКБ №1) и в различных медицинских клиниках (например, СИТИМЕД, ул. Лесопарковая, 6 тел. +7 (351) 265-55-15). Однако область у нас большая, и не всегда пациентам удобно приезжать в Областной центр.
В настоящее время прием хирурга-эндокринолога и выполнение тонкоигольной биопсии щитовидной железы организовано в различных медицинских центрах области, где есть профессиональное оборудование для диагностики, а цитологические исследования выполняются специалистами в соответствии с международным стандартом:
Узелки щитовидной железы: что делать врачу
Почти у каждого второго человека можно выявить один или несколько узелков в щитовидной железе. В поле зрения клинициста попадают узелки, найденные при физикальном осмотре или самим пациентом, а также те, которые были выявлены случайно при проведении лучевых исследований по другому поводу (например, УЗИ сонных артерий, КТ головы и шеи, ПЭТ). Самая важная тактическая задача врача в этой ситуации – исключить рак щитовидной железы, встречающийся у 4-7% пациентов, обратившихся за консультацией по поводу выявленного узелка.
Непальпируемые узелки (инсиденталомы) имеют такую же вероятность оказаться раком, как и пальпируемые узелки такого же размера. Поэтому начальное обследование, вне зависимости от того, пальпируется ли узелок, должно включать в себя физикальный осмотр, измерение уровня ТТГ и УЗИ щитовидной железы.
Анамнез и осмотр
Физикальное обследование обладает низкой прогностической ценностью в отношении рака щитовидной железы. Однако некоторые факты анамнеза могут насторожить в отношении этой патологии – к ним относятся быстрый рост образования на шее, перенесенная лучевая терапия на область головы и шеи, семейный анамнез рака щитовидной железы и опухолевых синдромов (MEN2, FAP, синдром Cowden). Физикальные находки несмещаемой плотной опухоли, симптомы обструкции дыхательных путей и паралич голосовых связок также крайне подозрительны в отношении рака щитовидной железы.
При пониженном уровне ТТГ существует вероятность, что узел гормонально активен. В таком случае следует выполнить сцинтиграфию щитовидной железы.
При нормальном или повышенном ТТГ и показаниях к пункции по данным УЗИ следующий шаг – тонкоигольная биопсия узла. Дополнительно к этому, пациентам с низким ТТГ необходимо обследование для поиска причины гипотиреоза.
Сцинтиграфия щитовидной железы используется для оценки функционального статуса узелка. Понижение ТТГ увеличивает вероятность того, что найденный узел гиперфункционирует. Так как такие «горячие» узлы очень редко являются злокачественными, нет необходимости их пунктировать. Нефункционирующие узлы – выглядят «холодными», то есть захватывают радиофармпрепарат слабее, чем окружающая ткань; для них может потребоваться биопсия. Автономные узлы выглядят «горячими» (захватывают РФП сильнее, чем окружающая паренхима), если они гиперфункционируют. Такие узлы составляют всего 5-10% от всех пальпируемых, крайне редко оказываются злокачественными, и поэтому не требуют биопсии. Узлы неопределенного характера: так как сцинтиграфия – двухмерное исследование, из-за наложения окружающей паренхимы железы невозможно определить функциональное состояние многих, особенно мелких, узелков; такие результаты исследования тоже не исключают необходимости тонкоигольной биопсии.
УЗИ щитовидной железы
Метод позволяет определить размер узла, анатомию железы и других структур шеи, включая лимфоузлы; он гораздо более информативен, чем КТ, сцинтиграфия и физикальный осмотр.
Существуют сонографические признаки, подозрительные в отношении злокачественности узла. Однако их предсказательная ценность широко варьируется, и лишь на основании УЗ-картины невозможно выставить показания к хирургическому лечению. Однако, данные УЗИ можно использовать для отбора пациентов на биопсию.
УЗ-признаки, ассоциированные с различной вероятностью злокачественности узелка. Также в последние годы в практику активно внедряется шкала TIRADS, позволяющая стандартизовать заключения диагностов и достигнуть высокой воспроизводимости результатов.
Тонкоигольная аспирационная биопсия
Показания по результатам УЗИ — накапливаются доказательства, что наличие подозрительной УЗ-картины имеет большую предсказательную ценность в отношении рака щитовидной железы, чем просто размер узелка.
Тонкоигольной биопсии подлежат все узелки, вне зависимости от размеров, со следующими свойствами:
Субкапсулярно расположенные и прилегающие к возвратным нервам или трахее
Выходящие за пределы капсулы органа
Любые узелки при наличии шейной лимфаденопатии
«Выпячивание» тканей узелка за ободок кальцификатов
Узелки менее 5 мм трудно пропунктировать, перед биопсией такого узелка стоит обсудить с пациентом риск неинформативного исследования и ложноотрицательного результата.
Также биопсии подлежат узелки размером от 1 см в наибольшем измерении, если они солидные или гипоэхогенные, и обладают одним или более из следующих признаков:
Преобладание переднезаднего размера («высоты») над латеральным («шириной»)
Также возможность биопсии стоит рассмотреть у некоторых пациентов с семейным анамнезом рака ЩЖ, опухолевыми синдромами, анамнезом облучения головы и шеи в детском возрасте, или у предпочитающих биопсию наблюдению. Однако, большинство пациентов с подозрительными субсантиметровыми узелками можно наблюдать.
Узелки с сонографической картиной, характерной для группы низкого риска (изоэхогенные, гиперэхогенные, частично кистозные без подозрительных находок в солидном компоненте можно подвергнуть биопсии при достижении ими размера в 1,5-2 см.
Полностью кистозные узелки без солидного компонента стенок не требуют биопсии.
Наблюдение за узелками, не попадающими под критерии для биопсии
Частота контрольных обследований зависит от УЗ-характеристик узелка. Одна из допустимых схем наблюдения:
1 раз в 6-12 месяцев для субсантиметровых узелков с подозрительными характеристиками;
1 раз в 1-2 года для узелков низкого и среднего риска;
1 раз в 2-3 года для узелков очень низкого риска.
В дальнейшем период между исследованиями можно увеличить при стабильности размеров узлов.
Кистозные узелки — подавляющее большинство таких узелков являются доброкачественными дегенерирующими аденомами. Однако, раки щитовидной железы тоже могут быть кистозными. Как и для солидных, для кистозных узелков наличие подозрительных признаков на УЗИ имеет большую предсказательную ценность в отношении ЗНО, чем сам по себе размер узла.
Выбор оптимального лечения зависит от морфологических характеристик узелка и его функционального статуса.
Цитологическое исследование — результаты тонкоигольной биопсии оцениваются по шкале Bethesda, включающей 6 категорий результатов, каждый из которых требует разного подхода к лечению.
Результаты цитологического исследования оцениваются по стандартизованной системе Bethesda, имеющей 6 категорий результатов, каждому из которых соответствуют своя вероятность наличия злокачественной опухоли в узелке.
Им проводят периодический УЗ-мониторинг, сначала раз в 1-2 года, а затем – раз в 2-5 лет, при необходимости сокращая интервал для больших узелков и при наличии подозрительной УЗ-картины, или удлиняя для меньших узелков с классическими УЗ-признаками доброкачественного процесса. При наличии подозрительной УЗ-картины возможно повторное проведение ТАБ через 12 месяцев, если по результатам предыдущей получено заключение о доброкачественности.
Небольшие изменения размера узла в динамике не являются показанием к повторной ТАБ. Однако, рекомендуется повторная пункция в следующих сценариях:
Значительный рост (более чем на 50% в объеме или 20% в диаметре, при условии, что рост в двух измерениях не менее 2 мм)
Появление новых подозрительных в отношении ЗНО признаков в узелке
Новые симптомы, связанные с узелком
При повторном доброкачественном результате ТАБ дальнейшее наблюдение за узелком с помощью УЗИ не нужно.
Неопределенная цитология (Bethesda III и IV) — При получении цитологического ответа о наличии фолликулярного образования/атипии неопределенного значения (FLUS/AUS) или фолликулярного новообразования, результат исследования считается неопределенным. Дальнейшая диагностика и лечение таких узелков включает в себя повторную ТАБ, молекулярно-генетическое исследование, в некоторых случаях – хирургическое лечение.
Подозрение на ЗНО (Bethesda V) — в эту диагностическую категорию попадают образования с признаками характерными, но недостаточными для диагноза папиллярного рака ЩЖ. Вероятность наличия рака или неинвазивного фолликулярного образования (NIFTP) у таких пациентов около 50-75%, их необходимо направить на хирургическое лечение.
Злокачественное образование (Bethesda VI) — в эту категорию включены папиллярный, медуллярный и анапластический рак, лимфома щитовидной железы и метастазы опухолей других органов. Таким пациентам также необходимо хирургическое лечение.
Для доказанной морфологически папиллярной микрокарциномы, не выходящей за пределы органа при отсутствии поражения лимфоузлов и признаков низкой дифференцировки, альтернативой операции является активное наблюдение, в особенности для коморбидных пациентов. Однако, предоперационный диагноз папиллярной микрокарциномы редок при следовании вышеописанным рекомендациям для биопсии.
Неинформативный (Bethesda I) — важно, что отсутствие злокачественных клеток в пунктате не может считаться отрицательным результатом биопсии, если при процедуре не было получено достаточного количества фолликулярной ткани. В этом случае предлагается повторить ТАБ через 4-6 недель, используя УЗИ-наведение.
При повторной неинформативной цитологии стоит рассмотреть проведение трепанобиопсии под УЗИ. В исследовании на пациентах с предыдущей неинформативной ТАБ, при трепанобиопсии диагностически значимый результат был получен в 74 процентах случаев, в то время как при повторной ТАБ – лишь в 52%; после двух неинформативных ТАБ, аналогичные показатели составили 86 и 29%.
Хирургическое удаление, в особенности для больших солидных узелков с подозрительными УЗ-признаками, или наблюдение (особенно – для меньших, частично кистозных узелков), являются разумными опциями ведения для пациентов с повторно неинформативными результатами биопсий.
Devita, Hellman, and Rosenberg’s Cancer : principles & practice of oncology—10th edition
Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid 2016; 26:1.
Ti rads 2 щитовидной железы что это
Наиболее важную роль в развитии рака щитовидной железы отводят ионизирующему излучению, наследственности, стрессам, хроническому дефициту йода [38]. Ионизирующее излучение среди множества факторов экзогенного характера занимает первое место, что было установлено многими эпидемиологическими исследованиями [26].
Клиническая картина, течение и прогноз определяются степенью дифференцировки и клеточным происхождением опухоли. По степени дифференцировки принято выделять дифференцированный, умеренно дифференцированный и недифференцированный РЩЖ [35].
К высокодифференцированным злокачественным новообразованиям щитовидной железы относят папиллярный и фолликулярный рак щитовидной железы.
Папиллярный рак щитовидной железы является наиболее распространенной формой рака щитовидной железы, на его долю приходится 50-60%. ПРЩЖ обладает благоприятным течением, о чем свидетельствует 10-летняя выживаемость, которая составляет более 90% [11]. Тем не менее есть данные некоторых авторов, сообщающие о частоте возникновения рецидивов в 8-23% случаев после оперативного лечения [18].
Фолликулярный рак щитовидной железы занимает второе место по частоте среди всех карцином щитовидной железы и наблюдается у 10-20% больных. Частота лимфогенного метастазирования составляет 2-10%, гематогенные метастазы наблюдаются в 20% случаев. Опухоль характеризуется медленным развитием и благоприятным прогнозом. 5-летняя выживаемость составляет 80%, более10 лет живут 70-75% больных [25; 30].
Медуллярный рак щитовидной железы происходит из кальцитонин-секретирующих парафолликулярных клеток (C-клеток) щитовидной железы. Данный вид опухоли составляет 4–10% всех случаев рака щитовидной железы [8]. Выживаемость при данном заболевании в наибольшей степени зависит от распространенности опухолевого процесса на момент диагностики. Так, общая 5-летняя выживаемость составляет 50-58% [34].
Недифференцированный или анапластический рак щитовидной железы составляет 4-15% всех карцином щитовидной железы. Основная особенность этих новообразований заключается в чрезвычайно быстром, прогрессивном росте первичной опухоли. Для анапластического рака характерно раннее появление отдаленных метастазов. В клинической картине превалируют симптомы, связанные с интенсивным ростом опухоли. Учитывая быстрое прогрессирование заболевания, медиана выживаемости составляет 5-6 мес. [25; 34].
Диагностика рака щитовидной железы
В настоящее время, несмотря на широкий спектр диагностических методов исследований, выявление злокачественных новообразований щитовидной железы все еще остается актуальной проблемой для онкологии [25; 37]. Особое значение в предоперационном планировании лечения занимает комплексное обследование пациентов, включающее как субъективные, так и объективные методы исследований. Диагностические методы для оценки распространенности опухолевого процесса при раке щитовидной железы можно разделить на методы лабораторной и лучевой диагностики, эндоскопические методы исследования. К методам лучевой диагностики относят ультразвуковое исследование (УЗИ), магнитно-резонансную томографию (МРТ), позитронно-эмиссионную томографию (ПЭТ), сцинтиграфию. К методам лабораторной диагностики относят исследование уровня некоторых гормонов щитовидной железы (Т3, Т4, кальцитонин, ТТГ), тонкоигольную пункционную биопсию. Эндоскопические методы исследования представлены ларингоскопией, фибробронхоскопией, эзофагоскопией.
У большинства пациентов с доброкачественными и злокачественными узловыми образованиями щитовидной железы отмечается наличие эутиреоза. Несмотря на это, всем пациентам с узловыми образованиями ЩЖ рекомендовано определение сывороточного тиреоглобулина. Если уровень сывороточного ТТГ низкий, то рекомендовано выполнение тиреосцинтиграфии для определения функционирующей способности узлового образования («горячий» или «холодный» узел). Если содержание сывороточного ТТГ повышено, то рекомендовано выполнение ТАБ (тонкоигольной аспирационной биопсии) щитовидной железы для определения риска злокачественности узловых образований. Измерение уровня кальцитонина для предоперационной диагностики медуллярного рака щитовидной железы остается спорным. По мнению некоторых авторов, определение кальцитонина играет немаловажную роль в тех случаях, когда тонкоигольная биопсия оказалась не информативной. Поэтому они предлагают проводить измерение уровня кальцитонина для диагностической оценки узловых образований щитовидной железы [7].
Ультразвуковое исследование (УЗИ) занимает ведущее место в диагностике узловых образований щитовидной железы. Это связано прежде всего с его доступностью, высокой разрешающей способностью, информативностью. Однако необходимо помнить, что ни один из УЗ-признаков или способов обследования не позволяет отличить доброкачественные узловые образования от злокачественных. Так, например, в одном из исследований было выявлено, что в 66% доброкачественных узловых образований определялся как минимум один признак рака щитовидной железы по данным ультразвукового исследования, а в 66% случаев папиллярного рака щитовидной железы определялся как минимум один признак, характерный для доброкачественного узлового образования. Тем не менее именно совокупность ультразвуковых признаков при исследовании узловых образований щитовидной железы позволяет выявить высокий риск злокачественного процесса [20].
Ультразвуковая диагностика позволяет оценить размеры, локализацию и характеристики узловых образований, такие как: форма (правильная/неправильная), эхогенность (ан-/ гипо-/ изо-/ гиперэхогенное), структура (однородная/неоднородная), контур (четкий/нечеткий, ровный/неровный), наличие капсулы (нет/есть), наличие кальцинатов (нет/есть – единичные/множественные, микро-/макро), наличие кистозных полостей (нет/есть – размер, форма), особенности кровотока в узле (интра-/перинодулярный, гипо-/гипер-/аваскуляризация), увеличение шейных лимфоузлов (нет/есть – изменены/не изменены) [5].
По данным Kim et al. (2002), для дифференциальной диагностики между злокачественными и доброкачественными опухолями щитовидной железы имеет значение форма узлового образования [9]. В 97% случаев при злокачественных опухолях узловые образования имеют неправильную овальную форму. Однако довольно часто узловые образования с подобной формой могут встречаться и при тиреодите. Кальцинаты представляют собой гиперэхогенные структуры, которые могут иметь акустическую тень. При ультразвуковом исследовании кальцинаты выявляются как в доброкачественных опухолях щитовидной железы, так и в злокачественных. Но, по данным исследований Papini E et al., Khoo ML et al. (2002), в 86-95% случаев они характерны для папиллярного рака щитовидной железы [17]. Наличие в узле макрокальцинатов, окруженных по периферии микрокальцинатами, может свидетельствовать о некрозе центральной зоны и об образовании псаммомных телец на периферии, что характерно для злокачественных новообразований [20]. Гипоэхогенный ободок, или halo, встречается как при злокачественных, так и при доброкачественных узловых образованиях щитовидной железы [21]. Считается, что ободок представляет собой компрессию перинодулярных сосудов, так как доброкачественные узлы растут медленно и с увеличением их размера кровеносные сосуды оттесняются к периферии. В большинстве случаев (около 50%) тонкий halo характерен для доброкачественных узлов и гораздо реже для злокачественных. Frates M.C. с соавторами считают, что для злокачественных узлов характерен нечеткий halo [21]. Границы новообразований щитовидной железы представлены двумя основными группами – четкими и нечеткими. Некоторые злокачественные узлы могут иметь непрерывную границу по большей окружности с отдельными участками прерывистой границы. Таким образом, границы и halo необходимо проследить по всей окружности узла. Для злокачественных узлов с инвазией в ткань щитовидной железы характерна прерывистая граница. Воспроизводимость этого признака при УЗИ невысока, что объясняет противоречивые результаты исследований по выявлению признаков злокачественности [20]. Для оценки внутриопухолевой васкуляризации узловых образований щитовидной железы используется метод ультразвуковой цветной доплерографии. Кровоснабжение узлов оценивают в зависимости от степени васкуляризации и выделяют гипер-, гипо, аваскулярные образования, а также узлы со средней степенью васкуляризации. При этом выделяют нодулярный, интранодулярный и смешанный типы кровотока [28]. Кисты аваскулярны в 85,3%, в коллоидных узлах преимущественно наблюдается перинодулярный, умеренной интенсивности кровоток, в аденомах – смешанный (интра- и перинодулярный) тип кровотока [27]. В оценке васкуляризации злокачественных опухолей также не существует единого мнения. Так, большинством авторов отмечено, что для РЩЖ характерна гиперваскуляризация с интра- и перинодулярным типом кровотока [23; 32].
Для классификации узлов щитовидной железы и стратификации риска злокачественности Horvath et al. (2011) предложили использовать специально разработанную программу TI-RADS с измененными рекомендациями Kwak J.Y. et al. [10]. Эта классификация отражает риск злокачественности, выраженный в процентах (табл. 1).
Категория по TI-RADS
Ультразвуковой тип узла
Вероятность злокачественности
Рекомендации
Коллоидный 1 типа. Коллоидный 2 типа. Псевдоузел Хашимото 1 типа. Подострый тиреоидит
Коллоидный 3 типа. Псевдоузел Хашимото 2 типа. Коллоидный 4 типа. Кистозный узел
Подозрительный на рак
Узел, злокачественность которого доказана ранее
Использование TI-RADS способствует четкому определению показаний к проведению тонкоигольной аспирационной биопсии узловых образований щитовидной железы и хирургического лечения и, следовательно, сокращению числа необоснованных малоинвазивных и оперативных вмешательств на ЩЖ [29].
Одним из наиболее достоверных признаков злокачественности является плотная консистенция узла щитовидной железы при пальпации. Однако сама пальпация является достаточно субъективным методом оценки и зависит от опыта врача, который ее проводит. Поэтому для оценки жесткости тканей используют новый инструментальный метод – ультразвуковую эластографию даже в случае непальпируемых узлов [2]. В ультразвуковой эластографии используется несколько режимов: режим сдвиговой волны, с усиленным акустическим импульсом и реального времени. Но для оценки образований щитовидной железы, как правило, используется режим реального времени. Принцип эластографии в реальном времени состоит в том, что плотные образования не деформируются, а эластичные образования обладают способностью сжиматься под давлением. Таким образом, система анализирует количество искажений, которые возникают во время небольшого давления датчиком на образование. Изначально эластография была внедрена для оценки локальных образований молочной железы. В последующем Rago (2007) и Asteria (2008) модифицировали ее для узловых образований щитовидной железы [19]. При данном исследовании плотная ткань, включая злокачественную опухоль, имеет отображение синего цвета, мягкие ткани – красного и зелёного.
Несмотря на то что УЗИ является методом с высокой разрешающей способностью, многообразие ультразвуковой семиотики опухолей ЩЖ создаёт определённые трудности в их интерпретации [38]. В целом чувствительность УЗИ в диагностике РЩЖ составляет 46–93%, специфичность 50–92%, точность 74–87% [31; 32].
Важным дополнением сонографии, существенно повышающим ее информативность, является тонкоигольная пункционная биопсия (ТАБ) щитовидной железы. Пункционная биопсия, выполненная под контролем УЗИ, позволяет с большей точностью верифицировать диагноз и улучшить диагностическую ценность полученных биоптатов до 75-98% [12]. Более высокая точность проведения пункции под контролем УЗИ позволяет добиться цитологической верификации диагноза у пациентов с узлами менее 5 мм [14]. Ряд ученых считают тонкоигольную аспирационную биопсию методом скрининга [4], что во многом объясняется его высокими чувствительностью и специфичностью. Однако оценка основных показателей информативности метода, по данным литературы, различается. В частности, чувствительность ТАБ составляет 55-100%, специфичность — 50-90%, точность — 87-92%, частота ложноположительных результатов — 0-20%, ложноотрицательных — 2-95% [24].
В 2007 году была утверждена единая система интерпретации цитологического материала, полученного по материалам тонкоигольной аспирационной биопсии щитовидной железы – The Bethesda System for Reporting Thyroid Cytology. В соответствии с последней версией классификации выделяют 6 диагностических категорий (табл. 2).
The Bethesda System for Reporting Thyroid Cytology
Диагностическая категория
Характеристика образования
Вероятность злокачественности, %
Рекомендации
Повторная ТАБ под УЗИ-контролем
Атипия неопределенного значения, фолликулярное поражение неопределенного поражения
Фолликулярная неоплазия или подозрение на фолликулярную неоплазию
Подозрение на малигнизацию
Субтотальная тиреоидэктомия или гемитиреоидэктомия
Оценка эффективности использования данной классификации проводилась различными авторами. C. Theoharis и соавт. (2009) отмечают повышение чувствительности и специфичности тонкоигольной аспирационной биопсии, что приводит к более верной тактике ведения пациентов. В то же время применение классификации сопряжено с некоторыми сложностями в использовании той или иной категории, что объясняется отсутствием достаточного числа объективных критериев для пограничных образцов [15].
В последнее время активно внедряется в клиническую практику ультразвуковое исследование щитовидной железы с контрастированием (CEUS), которое значительно повышает качество исследования и обеспечивает получение новой важной информации. Во многих странах начиная с 2008 г. широко применяется данная методика. Суть метода заключается в использовании микропузырьков газа, имеющих высокую степень эхогенности, разность в эхогенности между газом микропузырьков и мягкими тканями организма очень велика, в связи с этим формируется ультразвуковое изображение с высоким контрастом, с микропузырьками газа.
В качестве контрастного вещества в 99% случаев применяется SonoVie, относящийся к контрастам нового поколения, в котором микропузырьки заполнены газом (перфторуглеродом или гексафторидом серы), заключенным в фосфолипидные мембраны [7].
Ультразвуковое исследование щитовидной железы с контрастированием обладает рядом достоинств:
— высокая способность дифференцировки мягких тканей по сравнению с традиционным УЗИ;
— нет необходимости применения инвазивной катетеризации;
— не используются йодсодержащие контрастные вещества;
— отсутствует риск нефротоксичности;
— не применяется анестезия или седация;
— использование небольшого количество ультразвукового контраста (чаще 0,5–1 мл, максимально до 5 мл);
— применяется в случае, когда пациенты имеют большой вес и не могут быть обследованы другими методами визуализации.
Контрастная эхография отличается многочисленными преимуществами перед компьютерной томографией и магнитно-резонансной томографией. Ультразвуковые исследования могут быть проведены многократно, без всяких предварительных лабораторных тестов и осуществляться практически в любых условиях. Ультразвуковую диагностику с контрастным усилением рекомендуют в том числе пациентам с противопоказаниями к исследованиям с лучевой нагрузкой, или с непереносимостью контрастных препаратов, применяемых при рентгенографии, компьютерной томографии или магнитно-резонансной томографии [7].
Магнитно-резонансная томография – это один из методов лучевой диагностики, при котором возможно получить как послойное, так и трехмерное изображение любого участка тела. На сегодняшний день из всех методов лучевой диагностики МРТ является самым точным, т.к. позволяет получить изображение с наибольшей контрастностью. Практически в 90% случаев обеспечивает точную оценку местной распространенности опухолевых процессов в отношении как первичного очага в щитовидной железе, так и регионарных метастазов в лимфатические узлы шеи. С помощью МРТ можно определить объемные образования размером вплоть до 1-2 мм, оценить его контуры, наличие капсулы и её состояние, определить, прорастает ли это образование в соседние ткани, не смещает ли оно рядом расположенные органы. По сравнению с другими методами лучевой диагностики, МРТ позволяет оценить состояние гортани, трахеи, голосовой щели, отношение опухоли к магистральным сосудам. МРТ позволяет выявить метастатически измененные лимфоузлы, располагающиеся ретротрахеально, загрудинно и по ходу сосудисто-нервных пучков. По данным Тимофеевой Л.А. с соавторами, специфичность метода составила 89%, точность 91%, чувствительность 93% [39].
С распространением ультразвуковых методов исследований значение радионуклидных методов исследований в диагностике узловых образований щитовидной железы снизилось, однако в некоторых случаях тиреосцинтиграфия по-прежнему широко используется [37]. Метод сцинтиграфии основан на различиях в поглощении радионуклидов в опухолевой и здоровой тканях щитовидной железы, с помощью которых можно оценить степень распространенности опухолевого процесса. Для исследования применяются изотопы I 131, I 123, Tc 99m, селективно поглощаемые функционирующей тканью щитовидной железы. Чаще всего сцинтиграфия используется для оценки радикальности проведенного лечения, наличия остаточной ткани щитовидной железы, ее локализации. Кроме того, сцинтиграфия показана для выявления эктопированной щитовидной железы, функционирующих метастазов, при загрудинном расположении опухоли. Радиофармпрепарат накапливается исключительно в области узла и не накапливается в других отделах органа. На полученных изображениях участки, окрашенные в красный цвет, носят название «горячих» и указывают на интенсивную выработку тиреоидных гормонов данной частью органа. Синие участки, или «холодные», соответствуют частям железы с низкой активностью и слабой выработкой гормонов. «Горячий» узел интерпретируется как доброкачественный. Однако известны случаи, когда при сцинтиграфии рак щитовидной железы представлен «горячим» узлом [36]. «Холодный» узел в некоторых случаях также может быть доброкачественным. Несмотря на эффективность и безопасность проведения радиоизотопного сканирования, этот метод имеет некоторые минусы. Сцинтиграфия не эффективна при дифференцировке «холодных» узлов при раке щитовидной железы и доброкачественными образованиями. Она также не определяет участки размером менее 1 см, что может стать причиной поздней диагностики заболеваний.
Для уточнения вовлечения в опухолевый процесс трахеи, гортани, глотки, пищевода, необходимо выполнение эндоскопических методов исследования, включающих ларингоскопию, трахео-, эзофагоскопию. Данные методы исследования позволяют получить полную информацию о состоянии верхних дыхательных и пищеварительных путей. Фибробронхоскопия выявляет как прямые, так и косвенные признаки поражения трахеи. К прямым эндоскопическим признакам поражения трахеобронхиального дерева относятся: наличие экзофитной опухолевой ткани в просвете трахеи и/или бронха; опухолевые инфильтраты слизистой оболочки с плоской или неровной, бугристой, шероховатой поверхностью бледно-розового цвета, с расширенными инъецированными сосудами. Косвенным признаком поражения трахеи могут быть сглаженность складок слизистой оболочки, гиперемия с расширенной сосудистой сетью; выбухание по задней стенке трахеи.
Лечение рака щитовидной железы
В лечении рака щитовидной железы применяются следующие виды лечения: хирургический, радиойодотерапия, лучевая терапия, химиотерапия, таргетная терапия. Тактика лечения зависит от типа рака щитовидной железы и степени распространения опухолевого процесса. Хирургическое лечение является приоритетным. Объем оперативного лечения зависит от ряда факторов: локализации образования, размеров первичной опухоли и объема поражения регионарных лимфатических узлов, наличия инвазии в те или иные анатомические структуры, морфологической природы опухоли. При этом должны учитываться следующие прогностические факторы: возраст пациентов, морфологическая дифференцировка опухоли, половая принадлежность, наличие экстратиреоидного распространения опухоли и двустороннего поражения лимфоузлов шеи, повышающего риск развития метастазов в легких [11]. Минимальным объемом оперативного лечения является гемитиреоидэктомия с резекцией перешейка. Выполнение профилактической центральной лимфодиссекции является спорным вопросом, поскольку не влияет на отдалённые результаты лечения, но позволяет уточнить стадию заболевания [16]. При больших размерах опухоли или инвазии за пределы капсулы железы рекомендовано выполнение тиреоидэктомии с центральной лимфодиссекцией [11]. Метастатическое поражение лимфоузлов на шее является показанием для проведения шейной лимфодиссекции. При возникновении рецидива заболевания, прорастании злокачественной опухолью трахеи, магистральных сосудов, пищевода хирургическое лечение носит расширенно-комбинированный характер. При поражении трахеи возможно выполнение ее циркулярной резекции с формированием анастомоза конец в конец. При поражении гортани одновременно с резекцией верхних колец трахеи выполняется ларингэктомия с формированием концевой трахеостомы. Если же по данным предоперационного обследования выявлено врастание опухолевого конгломерата во внутреннюю яремную вену, то целесообразно выполнение операции типа Крайля, сопровождающейся резекцией внутренней яремной вены.
Лечение анапластического рака, учитывая агрессивный характер заболевания, должно быть начато как можно раньше. Пациентам с местнораспространенным процессом проводится хирургическое лечение. При распространённом процессе и невозможности оперативного лечения рекомендовано проведение лучевой терапии или химиотерапии. С целью улучшения результатов лечения может быть рассмотрена адъювантная лучевая терапия с химиотерапией или без нее как у пациентов с резектабельной опухолью, так и с нерезектабельной. Из-за быстрого роста анапластического рака химиотерапия должна проводиться сразу после оперативного лечения. Традиционно в качестве химиопрепарата используется доксорубицин с добавлением препаратов платины или без них. В ходе проведенного исследования в лечении анапластического рака щитовидной железы с применение таксанов были получены обнадеживающие результаты [1].
Особую сложность представляет лечение больных с неоперабельными формами медуллярного рака, рецидивными опухолями и с высокодифференцированным раком, устойчивым к терапии радиоактивным йодом.
В настоящее время ведутся активные исследования по применению таргетной терапии. В частности, изучается активность ингибиторов тирозинкиназы (Вандетаниб). В ходе исследований, проведенных Wells S.A и соавт., данный препарат показал частичный ответ у 45% пациентов; безрецидивный период составил 19,5 месяца в группе плацебо и 30,5 месяца в группе пациентов, получавших вандетаниб [22].
Для лечения, прогрессирующего местнораспространенного или метастатического дифференцированного рака щитовидной железы, рефрактерного к радиоактивному йоду, предназначен ингибитор мультикиназы препарат Нексавар (Сорафениб). Основой для принятия решения по использованию сорафениба стали результаты III фазы клинического исследования, согласно которым сорафениб способствует увеличению выживаемости без прогрессирования заболевания по сравнению с плацебо. У пациентов, принимавших сорафениб, риск прогрессирования заболевания или летального исхода уменьшился на 41% по сравнению с теми, кто получал плацебо. Медиана выживаемости без прогрессирования составила 10,8 месяца у участников, принимавших сорафениб, и 5,8 месяца в группе плацебо [3].
Несмотря на достигнутые успехи в диагностики опухолевых заболеваний щитовидной железы, необходим поиск единого алгоритма предоперационного обследования больных с распространенным раком щитовидной железы, позволяющего сократить сроки диагностики и облегчить выбор лечебной тактики.
Рак щитовидной железы — всё не так страшно, как мы привыкли думать!
Авторы
Редакторы
Статья на конкурс «био/мол/текст»: Рак — та проблема, которая так или иначе волнует каждого из нас, а некоторых, к сожалению, коснулась напрямую. Сегодня заболеваемость онкологическими патологиями неуклонно растет. Однако сейчас мы бы хотели поговорить с вами о том виде рака, который бояться в большинстве случаев совсем не нужно! Это рак щитовидной железы. Заинтригованы? Читайте эту статью.
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2019.
Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий выступила компания BioVitrum.
Несомненно, XXI век — время развития научно-технического прогресса. Вместе с совершенствованием технологий приходит и их доступность в повсеместном использовании. Медицина не является исключением. Благодаря развитию технологий диагностики и лечения самых разных заболеваний мы стали спасать тех пациентов, которые когда-то входили в число неизлечимых. Однако не на все сферы медицины прогресс повлиял так положительно. Поэтому сегодня мы бы хотели познакомить вас с такими животрепещущими вопросами медицины, как гипердиагностика и гиперлечение. Сейчас мы остановимся лишь на одной, но весьма значимой стороне данной проблемы — гипердиагностика узлов щитовидной железы, а также гиперлечение этих узлов и рака щитовидной железы.
Что мы знаем сегодня про узлы щитовидной железы?
26 сентября 2019 года в группе «Медфронт» во «ВКонтакте» появилась небольшая статья Александра Циберкина, врача-эндокринолога, создателя блога «Занимательная эндокринология» [1]. Проблема, которая поднималась в статье, достаточно проста: многим из нас когда-то предлагали сделать УЗИ щитовидной железы на всякий случай. На наш взгляд, Александр рассказывает о проблеме гипердиагностики и гиперлечения для того, чтобы врачи всерьез задумались, правильно ли назначать не всегда нужные анализы всем, и насколько серьезной проблемой является обнаружение узла в щитовидной железе в процессе такого скрининга.
Однако то, что эта проблема была озвучена совсем недавно, не значит, что о ней больше не надо писать. Мы не хотим загружать вас медицинской терминологией, вновь писать о TI-RADS и разбирать по кусочкам, что может написать функциональный диагност в заключении. Мы обращаемся к вам в качестве потенциальных пациентов и хотим донести мысль, что не всегда узел в щитовидной железе опасен, а рак априори смертелен.
База, с которой нам нужно познакомиться: щитовидная железа
Немножко о щитовидной железе (ЩЖ). Это орган эндокринной системы человека, который располагается на передней поверхности шеи в области гортани, прямо перед щитовидным хрящом. Состоит железа из левой и правой долей и перешейка. ЩЖ богато кровоснабжается разными артериями, а иннервируется гортанными нервами.
Главной функцией щитовидной железы (лат. glandula thyroidea) является синтез тиреоидных гормонов, необходимых нашему организму. Под тиреоидными гормонами мы подразумеваем два соединения: тироксин (Т4) и трийодтиронин (Т3). Основной функцией Т4 и Т3 является увеличение потребления клетками кислорода. Иначе говоря, эти гормоны стимулируют все энергетические процессы в клетке и обмен веществ, причем их влияние распространяется на все клетки организма.
Также клетки ЩЖ производят кальцитонин, ответственный за обмен кальция в организме.
Прямо за щитовидной железой располагаются четыре небольшие паращитовидные железы. Последние производят паратиреоидный гормон, который также отвечает за поддержание уровня кальция в организме, причем в большей степени, чем кальцитонин.
Откуда берется столько случаев рака щитовидки?
Рак щитовидной железы (РЩЖ) — наиболее распространенное злокачественное новообразование эндокринной системы [2]. Все чаще мы слышим, что заболеваемость РЩЖ неуклонно растет. И звучит это ужасающе, однако так ли всё просто на самом деле? Возможно, вы будете шокированы, какая правда скрывается за этими, на первый взгляд, однозначными научными фактами. И прежде, чем мы разберемся с истинной причиной роста заболеваемости РЩЖ, необходимо ознакомиться с тем, какие виды рака щитовидки существуют.
Итак, начнем. Сейчас нам понадобится привести немного численных данных, но не пугайтесь их, всё крайне просто. В научном сообществе выделяют пять типов РЩЖ:
Наиболее благоприятными принято считать два первых типа РЩЖ. И как мы можем заметить, они встречаются наиболее часто. Их также называют высокодифференцированными типами рака. Медуллярный, низкодифференцированный и недифференцированный типы считаются агрессивными формами РЩЖ. В нашей статье мы сделаем акцент лишь на первых двух типах РЩЖ, так как они являются наиболее распространенными.
Что означает понятие «дифференцировка»?
Когда-то давно, еще до нашего рождения, каждый из нас представлял собой одну-единственную клетку. Во время внутриутробного развития клеток стало в триллионы раз больше! И каждая из них обрела свою собственную функцию: одни отвечают за биение нашего сердца, другие защищают наш организм от внешних и внутренних опасностей, а третьи отвечают за когнитивные функции. И таких видов клеток более 230! Путь, который проходит клетка от той единственной, стоявшей в начале нашего пути, до высоко специализированной клетки, у которой есть четкие обязанности, и называется «дифференцировка».
Что касается рака — если клетки, из которых состоит опухоль, являются высокодифференцированными, в большинстве случаев врачи считают исход благоприятным. Однако если опухоль состоит из низкодифференцированных клеток, то с большой вероятностью она склонна к агрессивному течению. Как уже было сказано, наиболее часто выявляемые РЩЖ являются высокодифференцированными.
Папиллярный РЩЖ — наиболее распространенная форма: 80–85%. И с самым хорошим прогнозом. Пятилетняя выживаемость пациентов с РЩЖ — 98,1% [2]. Что это значит для пациента? Что наиболее часто выявляемые случаи РЩЖ имеют благоприятный исход!
Рак, ушедший в себя
Наше традиционное понимание РЩЖ, а именно его развития, в корне изменилось благодаря трем исследованиям 2014 года (Thyroid cancer trilogy) [3–5]. Казалось бы, все злокачественные образования по мере развития подвергаются прогрессии, а потому нуждаются в ранней диагностике и оперативном лечении. Впервые за всю историю человека было обнаружено существование «самоограничивающихся раков» (self-limiting cancers), которые являются злокачественными, но при этом не прогрессируют в летальные формы из-за ограниченной способности к делению клеток, составляющих опухоль. Конечно же, существуют и так называемые летальные РЩЖ (lethal thyroid cancers). Различие между ними заключается в происхождении раковых клеток, что и определяет развитие заболевания и его исход. Во втором случае клетки как бы затаиваются на долгий срок, на годы и даже на десятилетия, а потом по невыясненным еще причинам внезапно начинают делиться и приводят к неблагоприятному исходу. Однако на данный момент считается, что именно «самоограничивающиеся» типы РЩЖ составляют большинство.
Подбираемся к корню проблемы: статистика и диагностика
Вернемся к распространенности РЩЖ. Теперь мы готовы понять, что возросшее число случаев данной патологии не является поводом для беспокойства.
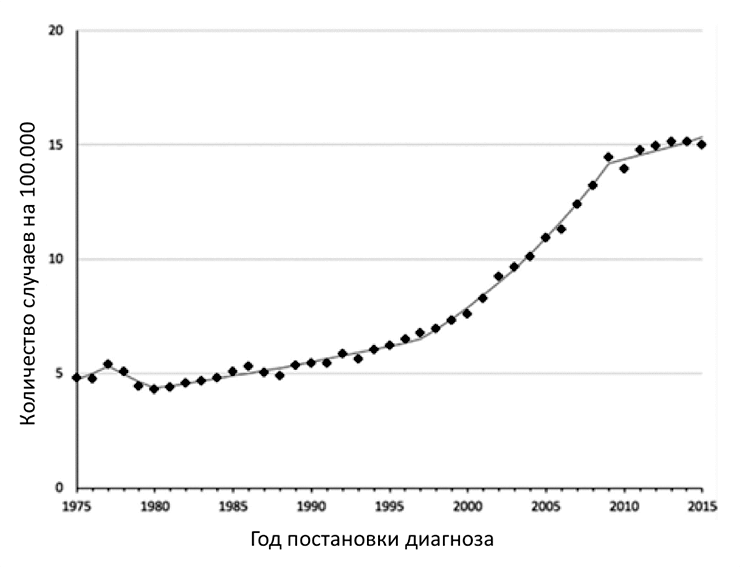
В 1975 году заболеваемость РЩЖ составляла 4,9 на 100 000 человек и оставалась относительно стабильной до начала 1990-х годов [6]. За последние 25 лет заболеваемость РЩЖ выросла более чем в 3 раза, то есть на 300% (рис. 1) [7], [8], причем в большинстве случаев за счет высокодифференцированного папиллярного РЩЖ. При этом очень важно понимать, что, несмотря на такой значительный рост, смертность от РЩЖ остается стабильной, примерно 0,5 случаев на 100 000 человек [6].
Рисунок 1. Данные заболеваемости раком щитовидной железы в период с 1975 по 2015 годы
Чувствуете, что тут что-то не так? Нет связи между возросшим числом случаев РЩЖ и смертностью от этой патологии! Среди врачей и ученых до сих пор продолжаются дебаты, почему так происходит. Сейчас выделяют несколько теорий. Наиболее вероятная — широкое распространение методов ультразвуковой диагностики (УЗИ). Пусть корни УЗИ уходят к Леонардо да Винчи и XV веку, широкое медицинское распространение данный метод получил с 50-х годов XX века [9], [10]. Сегодня УЗИ является наиболее простым, дешевым, неинвазивным и информативным методом выявления опухолевых образований щитовидной железы. Поэтому, как вы можете догадаться, УЗИ стали делать почти всем, причем независимо от показаний.
Сейчас научное сообщество активно дискутирует на тему, связаны ли такие показатели с истинным увеличением заболеваемости РЩЖ, или же проблема в гипердиагностике тех небольших образований ЩЖ, которые не требуют никакого вмешательства со стороны человека [11], [12].
Для более полного понимания проблемы вернемся на чуть более ранний этап диагностики РЩЖ.
Что такое узлы и как их найти?
Узлы ЩЖ — это радиологически различимые объемные образования в ЩЖ, которые могут быть доброкачественными и злокачественными. Узлы можно найти в 50% случаев всех проводимых УЗИ ЩЖ. При этом только 5% выявляемых образований будут злокачественными [13], [14].
Весомый вклад УЗИ в возросшее количество диагностированных узлов и РЩЖ можно показать на примере одного нашумевшего исследования в Южной Корее [3], [15], [16]. В 1999 году там была утверждена национальная программа, направленная на скрининг злокачественных заболеваний. Под программу попала и щитовидная железы. В результате повсеместного внедрения УЗИ щитовидки частота выявления рака выросла в 15 (!) раз с 1993 по 2011 год. И это мы еще не говорим просто об узлах, которые также могут быть психологической проблемой пациента. Большинство выявляемых случаев — папиллярный РЩЖ. Как вы помните, этот вид рака имеет весьма благоприятный исход. Однако простому населению идея жить с раком настолько чужда и неприятна, что было проведено огромное число полного удаления щитовидных желез, причем часто без видимой на то необходимости! А такая операция имеет серьезные последствия, о которых мы расскажем чуть ниже.
Врачи, осознав свою ошибку, убрали УЗИ щитовидки из списка обязательных скрининговых тестов. И результат не заставил себя ждать. В последней на эту тему публикации 2015 года сказано, что на 30% снизилась заболеваемость РЩЖ, а число операций на щитовидной железе снижалось на 35% ежегодно. Вывод напрашивается сам собой: в основе увеличения числа диагностированных случаев узлов щитовидки (в том числе и РЩЖ) является ставшее таким доступным УЗИ.
Думаем, следует также сказать, что образования ЩЖ выявляются не только при выполнении УЗИ, но и при использовании других методов лучевой диагностики (КТ, МРТ, ПЭТ), что стало возможным благодаря улучшению разрешающей способности оборудования. Следовательно, увеличилось чисто случайно выявляемых образований щитовидной железы (в том числе, рака) — инциденталóм (от англ. incidence — случайность) [17]. Инциденталомы клинически никак себя не проявляют и могут оставаться в организме бессимптомно всю жизнь. И многие из таких инциденталом обнаруживались лишь посмертно, случайно, и не являлись причиной кончины человека. Это позволяет говорить нам о существовании резервуара пациентов с узлами или раком щитовидной железы, который клинически является скрытым и никак себя не проявляет до его случайного обнаружения [18].
Приведенные данные обобщены на рисунке 2.
Рисунок 2. Что даст нам УЗИ щитовидки на самом деле?
рисунок авторов статьи
Напомним, что в нашей статье мы делаем акцент на наиболее распространенных типах РЩЖ (папиллярный, фолликулярный). Агрессивные формы РЩЖ (медуллярный, низкодифференцированный, недифференцированный и редко папиллярный) требуют дальнейшего более детального изучения
Самое главное: почему гипердиагностика и гиперлечение РЩЖ являются проблемой?
Является ли столь чрезмерное выявление объемных образований ЩЖ проблемой? Да, и очень даже серьезной. И она получила свое название — гипердиагностика (overdiagnosis) [19], [20]. И проблема состоит в том, что следствием ее становится гиперлечение. На самом деле она касается не только ЩЖ и представляет более серьезную опасность, чем может казаться на первый взгляд, а по мере развития методов диагностики приобретает все более и более масштабный характер, о чем говорит в своей статье «На всякий случай. » врач-эндокринолог В.В. Фадеев [28]. Говоря о ЩЖ, большинство пациентов с папиллярным РЩЖ подвергаются оперативному лечению — тотальной тиреоидэктомии или гемитиреоидэктомии [21]. Тем не менее в некоторых исследованиях [22], [23] показано, что при выборе лечения в пользу «активного наблюдения» (active surveillance) у пациентов с папиллярным РЩЖ (который относится к low-risk РЩЖ) диаметром менее одного сантиметра обнаруживались такие же исходы заболевания, как и при выполнении хирургических операций. В связи с этим в 2015 году в клинических рекомендациях Американской тиреоидологической ассоциации (American thyroid association, ATA) впервые была принята стратегия «активного наблюдения» для пациентов с low-risk cancers [24].
В связи с выявленным фактом, что в оперативном лечении таких РЩЖ, вполне возможно, нет необходимости (а ведь удаление ЩЖ сопровождается серьезными последствиями, о чем мы расскажем далее), с 2015 года в США уже принимаются меры по снижению частоты гипердиагностики и гиперлечения [24]. Например, уже настоятельно рекомендовано не проходить скрининг РЩЖ пациентам, у которых нет никаких симптомов, поскольку выявление агрессивных типов рака в этом случае крайне маловероятно.
Еще одной мерой предотвращения гиперлечения является изменение классификации типов РЩЖ, которые ведут себя как доброкачественные. Иначе говоря, их больше не называют «рак». Зачем? Все дело в психологической реакции пациента. Инстинкт самосохранения — самый живучий инстинкт человека и животных. И реализуется он во многом благодаря страху. Благодаря страху антилопа убегает ото льва, а змея жалит потенциальный объект угрозы — животные стремятся выжить. То же и с человеком. Всеми способами человек хочет продлить свое существование на этой земле. И диагноз «рак», который социум привык ассоциировать c мучительным завершением жизни, заставляет человека сделать все, чтобы от этого самого рака избавиться. В нашем случае, если у человека нашли РЩЖ, самая стойкая мысль — избавиться от этого мучения. И в большинстве случаев выбор падает на полное удаление щитовидной железы, вне зависимости от того, необходимо ли это. Как говорится, на всякий случай. И во многих случаях это не оправдано.
В одном из исследований [25] было выяснено, что люди, как правило, имеют общее представление о РЩЖ, но не знают о его диагностике и лечении, полагая, что по распространенности и смертности РЩЖ схож с другими типами рака. Страх дальнейшего прогрессирования заболевания заставляет пациента выбирать радикальное лечение. Так, недавно проведенные исследования неинвазивного рака груди [24], [25], а впоследствии и папиллярного РЩЖ [25], показали влияние терминологии на выбор лечения: замена термина «рак» в описании обоих патологических состояний способствовала выбору пациентом нехирургического лечения. Таким образом, данная стратегия оказывает влияние на психологическое состояние пациентов, тем самым предотвращая гиперлечение. Возможно ли жить с диагнозом «рак»? Как бы ответили на этот вопрос вы?
Что врачи думают о данной проблеме?
Проблема гиперлечения РЩЖ существует не только среди пациентов, но и среди медицинского сообщества.
Конечно, выбор, удалять ли щитовидную железу или нет, стоит больше перед пациентом, нежели перед лечащим врачом. И пациент вполне может выбрать хирургическую тактику лечения. А врач должен определять, сколько ткани щитовидной железы в конкретном случае нужно убирать.
В качестве уменьшения гипердиагностики Американская тиреоидологическая ассоциация рекомендует воздержаться от скрининга и биопсии мелких образований щитовидной железы при отсутствии на то иных клинических симптомов [6].
Как вообще лечат рак щитовидной железы?
Давайте разберемся, какие существуют пути лечения РЩЖ [26].
Почему мы, авторы, так не хотим, чтобы щитовидную железу удаляли без серьезных на то причин? Казалось бы, мы уберем орган, где сидит рак, и будем жить себе спокойно, только лишь принимая препараты гормонов щитовидной железы. Это ведь лучше, чем жить с раком. Или все-таки нет? Так вот, сама сложность вопроса заключается в операции.
Чем чревато полное удаление щитовидки (или, как говорят врачи, тотальная тиреоидэктомия)?
Существует два серьезных осложнения тотальной тиреоидэктомии [27].
Какой существует выход?
Одним из наиболее перспективных выходов из ситуации является частичное удаление ткани ЩЖ, а именно поврежденной доли. В таком случае пациент, во-первых, избавляется от необходимости принимать пожизненную заместительную терапию гормонами щитовидной железы, а во-вторых, избегает тех серьезных последствий, которые несет за собой операция полного удаления ЩЖ. Однако стоит понимать, что такой вариант не касается опухолей большого размера, а также тех новообразований, которые потенциально могут быть агрессивными (это решает врач!).
Сейчас терапевты и хирурги, которые занимаются патологией щитовидной железы, разделились на два лагеря: те, кто считает, что лучше перестраховаться, и при выявлении даже самой маленькой опухоли удалить всю щитовидную железу, и те, кто считает, что лучшим выходом будет частичное удаление ткани железы, а именно поврежденной ее доли. К сожалению, этот вопрос до сих пор остается открытым. Врачи все еще не могут прийти к единому знаменателю в данном вопросе. Проблема в том, что достоверная объективная доказательная база, на которую врачи могли бы опираться в качестве актуального клинического руководства, вовсе отсутствует. Существуют лишь отдельные исследования, которые обозревают вопрос лишь с одной субъективной стороны [21]. Оптимальным решением данной проблемы, на наш взгляд, стало бы объединение всех существующих статей с объективным и всесторонним взглядом на этот вопрос. Однако подобное исследование лишь ожидает нас в будущем.
Финальный аккорд
Итак, вот мы и подошли к последним строкам нашей статьи. Могло показаться, что мы и вовсе против УЗИ щитовидной железы, однако это не так. Существует группа риска пациентов, которым необходимо сделать УЗИ щитовидки (например, РЩЖ у кого-то из членов семьи). Также нельзя игнорировать тот факт, что УЗИ сильно продвинуло врачей в ранней диагностике агрессивных быстротекущих форм РЩЖ. Однако бóльшая часть врачей-эндокринологов, особенно за границей, против того, чтобы делать УЗИ щитовидки тогда, когда нет никаких симптомов болезни! Необходимой к прочтению, на наш взгляд, является работа профессора Фадеева В.В. «На всякий случай. » [28].
В этой статье высококвалифицированный врач обращает внимание читателя на то, что часто врачи оценивают результаты лабораторных и инструментальных анализов только на основании общепринятых границ норм. В случае несоответствия данной «норме» пациент признается больным. Очень важно понимать, что человек — индивидуальность, и показатель нормы у каждого может варьировать в зависимости от особенностей организма. Поэтому и лечить мы должны не анализы, не болезнь, а пациента. Врачу необходимо оценивать не только цифры в листе анализов, но и состояние пациента, а также качество жизни, которое ждет человека после лечения. Это и называется клиническим мышлением, которое, к сожалению, зачастую отсутствует у врачей в век, когда мы хотим слепо довериться цифрам, а машина начинает думать за человека.
С этими и другими мыслями вы можете ознакомится по оставленной нами ссылке [26].
Итак, дорогие наши читатели! Опираясь на всё, о чем мы рассказали выше, мы бы хотели, чтобы вы сделали три главных вывода:
Всем хорошего дня, и берегите свои щитовидки и нервы. 🙂
О необходимости внедрения классификации TI-RADS в России
Полный текст:
Аннотация
В мировых профессиональных медицинских сообществах продолжается активное обсуждение модификаций системы стратификации признаков злокачественности узлов щитовидной железы TI-RADS (англ. Thyroid Imaging Reporting And Diagnostic System). Система предназначена в первую очередь для отбора узлов для выполнения пункционной биопсии. Классификация должна быть единой для всех медицинских учреждений нашей страны, простой в использовании и понятной для врачей различных специальностей. В статье представлена модификация TI-RADS, подготовленная для обсуждения в профессиональных сообществах России. Выделены “большие” эхопризнаки (специфичность ≥95%), наиболее характерные для рака щитовидной железы, и “малые” признаки (специфичность ≥90%), дополнительные, позволяющие перевести узел из категории TI-RADS 3 в категорию TI-RADS 4 для выполнения пункции. При сравнении показателей диагностической информативности данного варианта TI-RADS с европейским (EU-TIRADS) отмечено, что оба варианта имели одинаковую специфичность – 93%. Отечественный вариант несколько превышал европейский по показателям чувствительности, соответственно 94,2 и 91,0%, что можно объяснить учетом дополнительных “малых” признаков злокачественности, что позволяет рекомендовать к обсуждению в России предложенный отечественными экспертами вариант TI-RADS.
Ключевые слова
Для цитирования:
Фисенко Е.П., Сенча А.Н., Катрич А.Н., Сыч Ю.П., Цветкова Н.В., Борсуков А.В., Костромина Е.В. О необходимости внедрения классификации TI-RADS в России. Клиническая и экспериментальная тиреоидология. 2019;15(2):55-63. https://doi.org/10.14341/ket10115
For citation:
Fisenko E.P., Sencha A.N., Katrich A.N., Sych Yu.P., Tsvetkova N.V., Borsukov A.V., Kostromina E.V. Оn the need to introduce the TI-RADS classification in Russia. Clinical and experimental thyroidology. 2019;15(2):55-63. (In Russ.) https://doi.org/10.14341/ket10115
Система стратификации признаков злокачественности узлов ЩЖ TI-RADS должна быть проста в применении и понятна не только специалистам, выполняющим пункционную биопсию узлов ЩЖ, но и тем врачам первичного звена (в первую очередь специалистам ультразвуковой диагностики), которые чаще первыми дифференцируют очаговые изменения ЩЖ и должны решить вопрос о передаче пациента в службы (специалистам-клиницистам), непосредственно занимающиеся морфологической оценкой и определением дальнейшей тактики ведения пациента. На это в очередной раз обращено внимание в последних предложенных вариантах TI-RADS американскими и европейскими коллегами [1, 2].
Система TI-RADS также предполагает стандартизацию обмена медицинской информацией между врачами-клиницистами (эндокринологами, хирургами) и специалистами ультразвуковой диагностики, что требует более быстрой валидации данной системы в РФ с закреплением этого в клинических рекомендациях для двух специальностей: эндокринологии и ультразвуковой диагностики.
Дифференцировка узлов ЩЖ часто проводится не столько по наличию основных признаков злокачественности (раки), сколько по их отсутствию (доброкачественные образования) [3, 4]. Однако хорошо известно, что рак щитовидной железы (РЩЖ) имеет много “масок” (клинических, ультразвуковых, цитологических) и часто имитирует доброкачественную природу узла.
Набор эхопризнаков, наиболее часто встречающихся при РЩЖ при мультипараметрическом УЗИ, практически совпадает в большинстве литературных источников [5–10], что представлено и в Российских клинических рекомендациях по диагностике и лечению высокодифференцированного РЩЖ у взрослых (2017) [11]:
– снижение эхогенности узла;
– вертикальная пространственная (или непараллельная) ориентация узла или “размеры выше больше, чем шире”;
– наличие микрокальцинатов в узле;
– неровные (мелкодольчатые, звездчатые, лучистые) и нечеткие контуры.
Эти признаки являются высокоспецифичными (таблица), что подтверждается многочисленными исследованиями, в том числе метаанализом [5, 9, 10, 12–20].
Таблица. Показатели специфичности эхографических признаков злокачественности в узлах щитовидной железы по данным различных авторов
Автор
УЗ-признак
Неровный контур
Вертикальная ориентация
Снижение эхогенности
Микрокальцинаты
Popowicz B., 2009
Remonti L.R., 2015
Митьков В.В., 2016
Бэскин Г.Дж.-ст., 2018
В работах последних лет обращено внимание, что признак “понижение эхогенности” узлов ЩЖ следует подразделять на “умеренное” и “значительно сниженное” [1, 2]. При этом специфичность признака “выраженное снижение эхогенности” значительно превышает “умеренное снижение эхогенности” узла в диагностике РЩЖ [19, 20].
Наибольшие разногласия возникают при обсуждении термина “нечеткие границы” узла, что связано с субъективной оценкой врача-оператора. Известно, что доброкачественные гиперпластические процессы, представленные узловыми образованиями, часто не имеют капсулы, в связи с чем четкость их контуров тем хуже определяется, чем меньше размер очага [14, 20, 21], что приводит к гипердиагностике инвазивных процессов. Использование высокочастотных датчиков (12–18 МГц) позволяет определить микродольчатость, лучистость/игольчатость/звездчатость инфильтрирующих краев опухоли, что более важно для проведения дифференциально-диагностического процесса [1, 20].
Основные противоречия представленных в литературе модификаций TI-RADS сводятся к распределению узлов в категориях Т3 и Т4, Т5. В первой группе более ранних вариантов TI-RADS в категорию Т3 предложено определять узлы без перечисленных выше признаков злокачественности, соответственно начиная с Т4 – с признаками злокачественности [5–9]. Пункцию предложено выполнять и в категории Т3 (однако не представлены критерии отбора узлов для пункции в данной категории), и в категориях Т4, Т5. Распределение узлов в Т4 и Т5 определяется количеством выявленных признаков злокачественности. При этом Т4 подразделяется на подкатегории (2 или 3).
Во второй группе вариантов TI-RADS предложено отказаться от подразделения Т4 на подкатегории, что значительно облегчает работу. Разделение на категории преимущественно идет по характеру их эхогенности [1, 2].
В нашей стране также продолжается обсуждение классификации TI-RADS. Выделены ультразвуковые признаки, по которым происходит отбор узлов из категории Т3 (изо- или гиперэхогенных) в Т4 для пункции (согласно логике системы BI-RADS, а именно она взята в основу TI-RADS [22], узел, требующий выполнения биопсии, из Т3 (категория для динамического наблюдения узлов) должен быть перенесен в категорию Т4). Основными критериями в этом случае для узлов ЩЖ являются следующие “малые” ультразвуковые признаки злокачественности, полученные в В-режиме [19, 23, 24]:
– умеренное снижение эхогенности или неравномерная эхогенность узла (наличие гипоэхогенных включений);
– округлая форма узла;
– неравномерной толщины хало вокруг узла;
– наличие макрокальцинатов в узле.
Таким образом, появление этих признаков в гипер- или изоэхогенных узлах указывает на необходимость их морфологической оценки, т.е. перевода в категорию Т4 для выполнения пункционной биопсии.
К “малым” признакам отнесены также патологический интранодулярный сосудистый рисунок (по результатам применения цветокодированных режимов) и высокая жесткость узла (по результатам применения количественных и качественных параметров ультразвуковой эластографии). Эти методики широко внедряются в мировой ультразвуковой диагностике, однако на настоящий момент для оценки узлов ЩЖ являются дополнительными [23, 25]. При наличии соответствующей аппаратуры эти признаки могут быть определены как на этапе первичного диагностического поиска, так и на этапе непосредственного решения вопроса о выполнении биопсии при использовании оборудования высокого или экспертного класса.
Суммируя вышесказанное, мы предлагаем на страницах журнала обсудить возможный вариант TI-RADS, приемлемый для всех служб в нашей стране, и, возможно, сформировать общие рекомендации.
Проект TI-RADS
TI-RADS 1. Нет очаговых изменений в паренхиме ЩЖ.
TI-RADS 2. Очаговые образования, не требующие морфологической оценки (макрофолликулы; губчатые или кистозные узлы), представленные на рис. 1.
TI-RADS 3. Очаговые структуры, требующие динамического наблюдения без выполнения биопсии (гипер- или изоэхогенные образования с ровными контурами, в том числе на фоне аутоиммунного тиреоидита; кальцинированные узлы по типу “яичной скорлупы”) (рис. 2).
Пункция в категории TI-RADS 3 возможна по настоянию пациента или при наличии клинической необходимости по рекомендации лечащего врача.
При отрицательной динамике в процессе выполнения динамического мониторинга предполагается перевод в категорию TI-RADS 4 узлов, которые за 6–12 мес наблюдения значительно изменили свои характеристики в В-режиме:
– увеличились размеры узла (объем увеличился более чем на 30%);
– узлы приобрели шаровидную форму, появились кальцинаты, деформация капсулы узла (и/или капсулы ЩЖ);
– появились патологически измененные лимфатические узлы шеи, не выявляемые ранее.
Все гипоэхогенные узлы предлагается отнести в категории 4 и 5.
Рис. 1. Категория TI-RADS 2: а – кистозно расширенный или макрофолликул; б – губчатый узел (стрелки).
Рис. 2. Категория TI-RADS 3: а – изоэхогенный очаг (стрелки), окруженный тонким хало (узловой зоб); б – гиперэхогенный очаг округлой формы, с четкими контурами, тонким гипоэхогенным ободком на фоне аутоиммунного тиреоидита; в – кальцинированный узел по типу “яичной скорлупы”.
TI-RADS 4. Узлы более 1,0 см в диаметре с “малыми” признаками злокачественности для выполнения ПУНКЦИИ (рис. 3):
– неравномерно утолщенное хало;
Рис. 3. TI-RADS 4: а – узел шаровидной формы, с ровными и четкими контурами, умеренно пониженной эхогенности, с участками более низкого эхо, с макрокальцинатом. Узел окружен тонким хало (фолликулярная неоплазия); б, в, г (поперечное и продольное сканирование левой доли ЩЖ) – изоэхогенные узлы с гипоэхогенными включениями, с четкими контурами, с тонким хало (фолликулярная аденома); д – изоэхогенный узел с гипоэхогенными включениями, с неравномерно утолщенным хало (фолликулярный рак).
TI-RADS 5. Солидные узлы с “большими” признаками злокачественности для выполнения ПУНКЦИИ:
– значительно сниженная эхогенность;
– вертикальная пространственная ориентация образования;
– неровный контур образования: бугристый, микродольчатый, лучистый;
– наличие в опухоли микрокальцинатов;
Рис. 4. TI-RADS 5. Узлы ЩЖ размером >1,0 см (папиллярные раки): а, б – узлы значительно пониженной эхогенности с микрокальцинатами, с неровными микродольчатыми контурами; в – узел вертикальной пространственной ориентации, с нечеткими, неровными контурами, значительно сниженной эхогенности, с множественными микрокальцинатами; г – узел с микродольчатыми нечеткими контурами, неравномерно пониженной эхогенности, с микрокальцинатами; д – узел значительно пониженной эхогенности, вертикальной пространственной ориентации, с нечеткими, неровными (лучистыми) контурами; е – узел с нечеткими контурами, с множественными микрокальцинатами.
При наличии измененных лимфатических узлов (шаровидная форма, исчезновение дифференцировки внутренних структур, кистозные изменения, кальцинаты) к указанию категории ТI-RADS целесообразно в заключении добавлять “ЛИМФАДЕНОПАТИЯ”. На основании заключения ультразвукового исследования и клинико-лабораторных данных врач-эндокринолог принимает окончательное решение о необходимости выполнения пункционной биопсии узла ЩЖ и измененных лимфатических узлов шеи.
Представленный вариант модификации TI-RADS наиболее близок к европейскому варианту [1]. Для работы в условиях нашей страны менее приемлемыми представляются варианты TI-RADS, предлагающие присвоение баллов каждому ультразвуковому признаку, с дальнейшим распределением узлов по категориям TI-RADS в зависимости от суммы баллов [2, 9].
Группой авторов проведено пилотное исследование по оценке воспроизводимости европейского варианта системы ТI-RADS и варианта, предложенного группой отечественных авторов, при помощи критерия Кохрейна [26]. Доля совпадений результатов (когда разные исследователи относили один и тот же узел к одинаковой категории) составила 79%, коэффициент Кохрейна составил 03–05 (p < 0,001), что свидетельствует о хорошей воспроизводимости данного метода оценки злокачественного потенциала узлов ЩЖ разными операторами.
Оба варианта TI-RADS имели одинаковую специфичность – 93%. Отечественный вариант несколько превышал европейский по показателям чувствительности: 94,2 против 91,0% соответственно, что можно объяснить учетом большего количества “малых” признаков злокачественности. Нам представляется важным обратить внимание на эти признаки. В ряде работ показано, что в 13,4% случаев в раковых узлах ЩЖ не удается выявить ни одного “большого” признака злокачественности; в 10,1% случаев выявляется только один “большой” признак рака; в 25,6% случаев определяется сочетание одного “большого” признака с несколькими “малыми”; в 13% случаев удается дифференцировать только “малые” признаки злокачественности [21, 27].
“Малые” признаки чаще возникают в узлах, приближающихся к 2,0 см в диаметре [21]. В настоящее время мы оперируем размерами узлов до 1,0 см и свыше 1,0 см, согласно ряду российских клинических рекомендаций [11, 28]. В последних западных вариантах TI-RADS размеры узлов разделяют от 0,5; 1,0; 1,5; 2,0 см и более [1, 2]. Возможно, нам также следует рассмотреть данные модификации.
Заключение
Мы предлагаем провести широкое обсуждение предложенного варианта классификации TI-RADS для его дальнейшей оптимизации и приемлемой стандартизации в обозримом будущем. Наш подход обусловлен желанием сблизить позиции отечественных специалистов ультразвуковой диагностики и российских эндокринологов. Переход на единую информационную диагностическую площадку этих двух специальностей, надеемся, будет положительно влиять на конечные показатели результатов ведения пациентов с узловыми новообразованиями ЩЖ.
Дополнительная информация
Источник финансирования. Работа выполнена без привлечения внешних источников финансирования на личные средства авторов.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов: Фисенко Е.П. – концепция и инициатива создания публикации, анализ материалов, написание текста; Сыч Ю.П. – сбор и обработка материалов, анализ материалов, написание текста; Сенча А.Н. – сбор и анализ материалов, редактирование текста; Катрич А.Н. – сбор и анализ материалов, редактирование текста; Цветкова Н.В. – сбор и анализ материалов, редактирование текста; Борсуков А.В. – сбор и анализ материалов, редактирование текста; Костромина Е.В. – сбор и анализ материалов, редактирование текста. Все авторы внесли существенный вклад в проведение поисково-аналитической работы и подготовку статьи, прочли и одобрили итоговую версию до публикации.
Благодарности. Коллектив авторов выражает искреннюю благодарность коллегам, принявшим активное участие в обсуждении и подготовке материалов статьи: профессору кафедры ультразвуковой диагностики ФГБОУ ДПО РМАНПО Заболоцкой Наталье Владленовне, заведующей отделением ультразвуковой диагностики ФГБУ “НМИЦ эндокринологии” Минздрава России Солдатовой Татьяне Васильевне, заведующей отделением ультразвуковой диагностики НИИ клинической и экспериментальной радиологии ФГБУ “НМИЦ онкологии им. Н.Н. Блохина” Минздрава России, профессору Синюковой Галине Тимофеевне, старшему научному сотруднику НИИ клинической и экспериментальной радиологии ФГБУ “НМИЦ онкологии им. Н.Н. Блохина” Минздрава России Данзановой Татьяне Юрьевне, врачу отделения лучевой диагностики ФБУ здравоохранения “Центральная медико-санитарная часть № 141” ФМБА России, г. Удомля Тверской области, Пищугиной Алене Владимировне.
О необходимости внедрения классификации TI-RADS в России
Полный текст:
Аннотация
В мировых профессиональных медицинских сообществах продолжается активное обсуждение модификаций системы стратификации признаков злокачественности узлов щитовидной железы TI-RADS (англ. Thyroid Imaging Reporting And Diagnostic System). Система предназначена в первую очередь для отбора узлов для выполнения пункционной биопсии. Классификация должна быть единой для всех медицинских учреждений нашей страны, простой в использовании и понятной для врачей различных специальностей. В статье представлена модификация TI-RADS, подготовленная для обсуждения в профессиональных сообществах России. Выделены “большие” эхопризнаки (специфичность ≥95%), наиболее характерные для рака щитовидной железы, и “малые” признаки (специфичность ≥90%), дополнительные, позволяющие перевести узел из категории TI-RADS 3 в категорию TI-RADS 4 для выполнения пункции. При сравнении показателей диагностической информативности данного варианта TI-RADS с европейским (EU-TIRADS) отмечено, что оба варианта имели одинаковую специфичность – 93%. Отечественный вариант несколько превышал европейский по показателям чувствительности, соответственно 94,2 и 91,0%, что можно объяснить учетом дополнительных “малых” признаков злокачественности, что позволяет рекомендовать к обсуждению в России предложенный отечественными экспертами вариант TI-RADS.
Ключевые слова
Для цитирования:
Фисенко Е.П., Сенча А.Н., Катрич А.Н., Сыч Ю.П., Цветкова Н.В., Борсуков А.В., Костромина Е.В. О необходимости внедрения классификации TI-RADS в России. Клиническая и экспериментальная тиреоидология. 2019;15(2):55-63. https://doi.org/10.14341/ket10115
For citation:
Fisenko E.P., Sencha A.N., Katrich A.N., Sych Yu.P., Tsvetkova N.V., Borsukov A.V., Kostromina E.V. Оn the need to introduce the TI-RADS classification in Russia. Clinical and experimental thyroidology. 2019;15(2):55-63. (In Russ.) https://doi.org/10.14341/ket10115
Система стратификации признаков злокачественности узлов ЩЖ TI-RADS должна быть проста в применении и понятна не только специалистам, выполняющим пункционную биопсию узлов ЩЖ, но и тем врачам первичного звена (в первую очередь специалистам ультразвуковой диагностики), которые чаще первыми дифференцируют очаговые изменения ЩЖ и должны решить вопрос о передаче пациента в службы (специалистам-клиницистам), непосредственно занимающиеся морфологической оценкой и определением дальнейшей тактики ведения пациента. На это в очередной раз обращено внимание в последних предложенных вариантах TI-RADS американскими и европейскими коллегами [1, 2].
Система TI-RADS также предполагает стандартизацию обмена медицинской информацией между врачами-клиницистами (эндокринологами, хирургами) и специалистами ультразвуковой диагностики, что требует более быстрой валидации данной системы в РФ с закреплением этого в клинических рекомендациях для двух специальностей: эндокринологии и ультразвуковой диагностики.
Дифференцировка узлов ЩЖ часто проводится не столько по наличию основных признаков злокачественности (раки), сколько по их отсутствию (доброкачественные образования) [3, 4]. Однако хорошо известно, что рак щитовидной железы (РЩЖ) имеет много “масок” (клинических, ультразвуковых, цитологических) и часто имитирует доброкачественную природу узла.
Набор эхопризнаков, наиболее часто встречающихся при РЩЖ при мультипараметрическом УЗИ, практически совпадает в большинстве литературных источников [5–10], что представлено и в Российских клинических рекомендациях по диагностике и лечению высокодифференцированного РЩЖ у взрослых (2017) [11]:
– снижение эхогенности узла;
– вертикальная пространственная (или непараллельная) ориентация узла или “размеры выше больше, чем шире”;
– наличие микрокальцинатов в узле;
– неровные (мелкодольчатые, звездчатые, лучистые) и нечеткие контуры.
Эти признаки являются высокоспецифичными (таблица), что подтверждается многочисленными исследованиями, в том числе метаанализом [5, 9, 10, 12–20].
Таблица. Показатели специфичности эхографических признаков злокачественности в узлах щитовидной железы по данным различных авторов
Автор
УЗ-признак
Неровный контур
Вертикальная ориентация
Снижение эхогенности
Микрокальцинаты
Popowicz B., 2009
Remonti L.R., 2015
Митьков В.В., 2016
Бэскин Г.Дж.-ст., 2018
В работах последних лет обращено внимание, что признак “понижение эхогенности” узлов ЩЖ следует подразделять на “умеренное” и “значительно сниженное” [1, 2]. При этом специфичность признака “выраженное снижение эхогенности” значительно превышает “умеренное снижение эхогенности” узла в диагностике РЩЖ [19, 20].
Наибольшие разногласия возникают при обсуждении термина “нечеткие границы” узла, что связано с субъективной оценкой врача-оператора. Известно, что доброкачественные гиперпластические процессы, представленные узловыми образованиями, часто не имеют капсулы, в связи с чем четкость их контуров тем хуже определяется, чем меньше размер очага [14, 20, 21], что приводит к гипердиагностике инвазивных процессов. Использование высокочастотных датчиков (12–18 МГц) позволяет определить микродольчатость, лучистость/игольчатость/звездчатость инфильтрирующих краев опухоли, что более важно для проведения дифференциально-диагностического процесса [1, 20].
Основные противоречия представленных в литературе модификаций TI-RADS сводятся к распределению узлов в категориях Т3 и Т4, Т5. В первой группе более ранних вариантов TI-RADS в категорию Т3 предложено определять узлы без перечисленных выше признаков злокачественности, соответственно начиная с Т4 – с признаками злокачественности [5–9]. Пункцию предложено выполнять и в категории Т3 (однако не представлены критерии отбора узлов для пункции в данной категории), и в категориях Т4, Т5. Распределение узлов в Т4 и Т5 определяется количеством выявленных признаков злокачественности. При этом Т4 подразделяется на подкатегории (2 или 3).
Во второй группе вариантов TI-RADS предложено отказаться от подразделения Т4 на подкатегории, что значительно облегчает работу. Разделение на категории преимущественно идет по характеру их эхогенности [1, 2].
В нашей стране также продолжается обсуждение классификации TI-RADS. Выделены ультразвуковые признаки, по которым происходит отбор узлов из категории Т3 (изо- или гиперэхогенных) в Т4 для пункции (согласно логике системы BI-RADS, а именно она взята в основу TI-RADS [22], узел, требующий выполнения биопсии, из Т3 (категория для динамического наблюдения узлов) должен быть перенесен в категорию Т4). Основными критериями в этом случае для узлов ЩЖ являются следующие “малые” ультразвуковые признаки злокачественности, полученные в В-режиме [19, 23, 24]:
– умеренное снижение эхогенности или неравномерная эхогенность узла (наличие гипоэхогенных включений);
– округлая форма узла;
– неравномерной толщины хало вокруг узла;
– наличие макрокальцинатов в узле.
Таким образом, появление этих признаков в гипер- или изоэхогенных узлах указывает на необходимость их морфологической оценки, т.е. перевода в категорию Т4 для выполнения пункционной биопсии.
К “малым” признакам отнесены также патологический интранодулярный сосудистый рисунок (по результатам применения цветокодированных режимов) и высокая жесткость узла (по результатам применения количественных и качественных параметров ультразвуковой эластографии). Эти методики широко внедряются в мировой ультразвуковой диагностике, однако на настоящий момент для оценки узлов ЩЖ являются дополнительными [23, 25]. При наличии соответствующей аппаратуры эти признаки могут быть определены как на этапе первичного диагностического поиска, так и на этапе непосредственного решения вопроса о выполнении биопсии при использовании оборудования высокого или экспертного класса.
Суммируя вышесказанное, мы предлагаем на страницах журнала обсудить возможный вариант TI-RADS, приемлемый для всех служб в нашей стране, и, возможно, сформировать общие рекомендации.
Проект TI-RADS
TI-RADS 1. Нет очаговых изменений в паренхиме ЩЖ.
TI-RADS 2. Очаговые образования, не требующие морфологической оценки (макрофолликулы; губчатые или кистозные узлы), представленные на рис. 1.
TI-RADS 3. Очаговые структуры, требующие динамического наблюдения без выполнения биопсии (гипер- или изоэхогенные образования с ровными контурами, в том числе на фоне аутоиммунного тиреоидита; кальцинированные узлы по типу “яичной скорлупы”) (рис. 2).
Пункция в категории TI-RADS 3 возможна по настоянию пациента или при наличии клинической необходимости по рекомендации лечащего врача.
При отрицательной динамике в процессе выполнения динамического мониторинга предполагается перевод в категорию TI-RADS 4 узлов, которые за 6–12 мес наблюдения значительно изменили свои характеристики в В-режиме:
– увеличились размеры узла (объем увеличился более чем на 30%);
– узлы приобрели шаровидную форму, появились кальцинаты, деформация капсулы узла (и/или капсулы ЩЖ);
– появились патологически измененные лимфатические узлы шеи, не выявляемые ранее.
Все гипоэхогенные узлы предлагается отнести в категории 4 и 5.
Рис. 1. Категория TI-RADS 2: а – кистозно расширенный или макрофолликул; б – губчатый узел (стрелки).
Рис. 2. Категория TI-RADS 3: а – изоэхогенный очаг (стрелки), окруженный тонким хало (узловой зоб); б – гиперэхогенный очаг округлой формы, с четкими контурами, тонким гипоэхогенным ободком на фоне аутоиммунного тиреоидита; в – кальцинированный узел по типу “яичной скорлупы”.
TI-RADS 4. Узлы более 1,0 см в диаметре с “малыми” признаками злокачественности для выполнения ПУНКЦИИ (рис. 3):
– неравномерно утолщенное хало;
Рис. 3. TI-RADS 4: а – узел шаровидной формы, с ровными и четкими контурами, умеренно пониженной эхогенности, с участками более низкого эхо, с макрокальцинатом. Узел окружен тонким хало (фолликулярная неоплазия); б, в, г (поперечное и продольное сканирование левой доли ЩЖ) – изоэхогенные узлы с гипоэхогенными включениями, с четкими контурами, с тонким хало (фолликулярная аденома); д – изоэхогенный узел с гипоэхогенными включениями, с неравномерно утолщенным хало (фолликулярный рак).
TI-RADS 5. Солидные узлы с “большими” признаками злокачественности для выполнения ПУНКЦИИ:
– значительно сниженная эхогенность;
– вертикальная пространственная ориентация образования;
– неровный контур образования: бугристый, микродольчатый, лучистый;
– наличие в опухоли микрокальцинатов;
Рис. 4. TI-RADS 5. Узлы ЩЖ размером >1,0 см (папиллярные раки): а, б – узлы значительно пониженной эхогенности с микрокальцинатами, с неровными микродольчатыми контурами; в – узел вертикальной пространственной ориентации, с нечеткими, неровными контурами, значительно сниженной эхогенности, с множественными микрокальцинатами; г – узел с микродольчатыми нечеткими контурами, неравномерно пониженной эхогенности, с микрокальцинатами; д – узел значительно пониженной эхогенности, вертикальной пространственной ориентации, с нечеткими, неровными (лучистыми) контурами; е – узел с нечеткими контурами, с множественными микрокальцинатами.
При наличии измененных лимфатических узлов (шаровидная форма, исчезновение дифференцировки внутренних структур, кистозные изменения, кальцинаты) к указанию категории ТI-RADS целесообразно в заключении добавлять “ЛИМФАДЕНОПАТИЯ”. На основании заключения ультразвукового исследования и клинико-лабораторных данных врач-эндокринолог принимает окончательное решение о необходимости выполнения пункционной биопсии узла ЩЖ и измененных лимфатических узлов шеи.
Представленный вариант модификации TI-RADS наиболее близок к европейскому варианту [1]. Для работы в условиях нашей страны менее приемлемыми представляются варианты TI-RADS, предлагающие присвоение баллов каждому ультразвуковому признаку, с дальнейшим распределением узлов по категориям TI-RADS в зависимости от суммы баллов [2, 9].
Группой авторов проведено пилотное исследование по оценке воспроизводимости европейского варианта системы ТI-RADS и варианта, предложенного группой отечественных авторов, при помощи критерия Кохрейна [26]. Доля совпадений результатов (когда разные исследователи относили один и тот же узел к одинаковой категории) составила 79%, коэффициент Кохрейна составил 03–05 (p < 0,001), что свидетельствует о хорошей воспроизводимости данного метода оценки злокачественного потенциала узлов ЩЖ разными операторами.
Оба варианта TI-RADS имели одинаковую специфичность – 93%. Отечественный вариант несколько превышал европейский по показателям чувствительности: 94,2 против 91,0% соответственно, что можно объяснить учетом большего количества “малых” признаков злокачественности. Нам представляется важным обратить внимание на эти признаки. В ряде работ показано, что в 13,4% случаев в раковых узлах ЩЖ не удается выявить ни одного “большого” признака злокачественности; в 10,1% случаев выявляется только один “большой” признак рака; в 25,6% случаев определяется сочетание одного “большого” признака с несколькими “малыми”; в 13% случаев удается дифференцировать только “малые” признаки злокачественности [21, 27].
“Малые” признаки чаще возникают в узлах, приближающихся к 2,0 см в диаметре [21]. В настоящее время мы оперируем размерами узлов до 1,0 см и свыше 1,0 см, согласно ряду российских клинических рекомендаций [11, 28]. В последних западных вариантах TI-RADS размеры узлов разделяют от 0,5; 1,0; 1,5; 2,0 см и более [1, 2]. Возможно, нам также следует рассмотреть данные модификации.
Заключение
Мы предлагаем провести широкое обсуждение предложенного варианта классификации TI-RADS для его дальнейшей оптимизации и приемлемой стандартизации в обозримом будущем. Наш подход обусловлен желанием сблизить позиции отечественных специалистов ультразвуковой диагностики и российских эндокринологов. Переход на единую информационную диагностическую площадку этих двух специальностей, надеемся, будет положительно влиять на конечные показатели результатов ведения пациентов с узловыми новообразованиями ЩЖ.
Дополнительная информация
Источник финансирования. Работа выполнена без привлечения внешних источников финансирования на личные средства авторов.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов: Фисенко Е.П. – концепция и инициатива создания публикации, анализ материалов, написание текста; Сыч Ю.П. – сбор и обработка материалов, анализ материалов, написание текста; Сенча А.Н. – сбор и анализ материалов, редактирование текста; Катрич А.Н. – сбор и анализ материалов, редактирование текста; Цветкова Н.В. – сбор и анализ материалов, редактирование текста; Борсуков А.В. – сбор и анализ материалов, редактирование текста; Костромина Е.В. – сбор и анализ материалов, редактирование текста. Все авторы внесли существенный вклад в проведение поисково-аналитической работы и подготовку статьи, прочли и одобрили итоговую версию до публикации.
Благодарности. Коллектив авторов выражает искреннюю благодарность коллегам, принявшим активное участие в обсуждении и подготовке материалов статьи: профессору кафедры ультразвуковой диагностики ФГБОУ ДПО РМАНПО Заболоцкой Наталье Владленовне, заведующей отделением ультразвуковой диагностики ФГБУ “НМИЦ эндокринологии” Минздрава России Солдатовой Татьяне Васильевне, заведующей отделением ультразвуковой диагностики НИИ клинической и экспериментальной радиологии ФГБУ “НМИЦ онкологии им. Н.Н. Блохина” Минздрава России, профессору Синюковой Галине Тимофеевне, старшему научному сотруднику НИИ клинической и экспериментальной радиологии ФГБУ “НМИЦ онкологии им. Н.Н. Блохина” Минздрава России Данзановой Татьяне Юрьевне, врачу отделения лучевой диагностики ФБУ здравоохранения “Центральная медико-санитарная часть № 141” ФМБА России, г. Удомля Тверской области, Пищугиной Алене Владимировне.