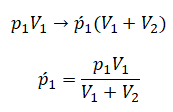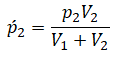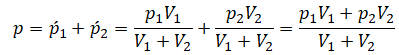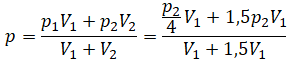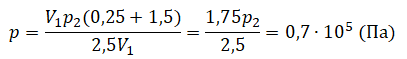закон постоянных отношений дальтона
Кратных отношений закон
Полезное
Смотреть что такое «Кратных отношений закон» в других словарях:
КРАТНЫХ ОТНОШЕНИЙ ЗАКОН — если два химических элемента образуют друг с другом более одного соединения, то массы одного элемента, приходящиеся на одну и ту же массу другого, относятся как целые числа, обычно небольшие. Так, в оксидах азота N2O, NO, N2O3, N2O4, N2O5 массы… … Большой Энциклопедический словарь
КРАТНЫХ ОТНОШЕНИЙ ЗАКОН — КРАТНЫХ ОТНОШЕНИЙ ЗАКОН: если два химических элемента образуют друг с другом более одного соединения, то массы одного элемента, приходящиеся на одну и ту же массу другого, относятся как целые числа, обычно небольшие. Так, в оксидах азота N2O, NO … Энциклопедический словарь
КРАТНЫХ ОТНОШЕНИЙ ЗАКОН — если два элемента образуют неск. соед., то массы одного элемента, приходящиеся на единицу массы другого, относятся как целые числа. Напр., в соед. NO и NO2 на 1 маc. ч. азота приходится соотв. 1,14 и 2,28 маc. ч. кислорода; отношение указанных… … Химическая энциклопедия
КРАТНЫХ ОТНОШЕНИЙ ЗАКОН — один из осн. законов химии: если 2 вещества (простые или сложные) образуют друг с другом более одного соединения, то массы одного в ва, приходящиеся на одну и ту же массу др. в ва, относятся как целые числа, обычно небольшие … Большой энциклопедический политехнический словарь
КРАТНЫХ ОТНОШЕНИЙ ЗАКОН — если два хим. элемента образуют друг с другом более одного соединения, то массы одного элемента, приходящиеся на одну и ту же массу другого, относятся как целые числа, обычно небольшие. Так, в оксидах азота N20, NO, N203, N204, N2О5 массы… … Естествознание. Энциклопедический словарь
Закон кратных отношений — В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете … Википедия
ЗАКОН КРАТНЫХ ОТНОШЕНИЙ ОТРЕЗКОВ — син. термина закон рациональности отношений параметров. Геологический словарь: в 2 х томах. М.: Недра. Под редакцией К. Н. Паффенгольца и др.. 1978 … Геологическая энциклопедия
ЗАКОН КРАТНЫХ ОТНОШЕНИЙ — один из основных законов химии: если два вещества (простые или сложные) образуют друг с другом несколько хим. соединений, то массы одного вещества, приходящиеся на одну и ту же массу др. вещества, относятся как целые числа, обычно небольшие. Напр … Большая политехническая энциклопедия
закон кратных отношений Дальтона — Daltono kartotinių santykių dėsnis statusas T sritis fizika atitikmenys: angl. Dalton law of multiple proportion vok. Gesetz der mehrfachen Gewichts verhältnisse, n; Gesetz der mehrfachen verhältnisse, n; Gesetz der multiplen Proportionen, n rus … Fizikos terminų žodynas
Закон Дальтона
теория по физике 🧲 молекулярная физика, МКТ, газовые законы
Давление смеси газов равно сумме их парциальных давлений.
К примеру, давление воздуха складывается из давления азота, кислорода, углекислого газа, водяного пара и т. д.
Парциальное давление — давление, которое производил бы данный газ, если бы другие газы отсутствовали.
Применение закона Дальтона при решении задач
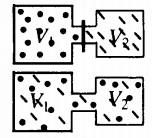
Самая популярная задача на закон Дальтона, это случай, когда газы находятся в сосудах, соединенных трубкой с краном. По условию этой задачи нужно найти давление, которое установится после того, как этот кран будет открыт.
После открытия крана первый и второй газы заполнят оба сосуда. Используем закон Бойля — Мариотта для первого газа (так как температура остается постоянной):
Этот же закон можем применить для второго газа. Тогда мы получим:
Применим закон Дальтона и получим:
Пример №1. Два сосуда соединены трубкой с краном. Определить давление, которое установится после того, как кран будет открыт. Считать, что объем второго сосуда в 1,5 раза больше первого. Давление во втором сосуде составляет половину от атмосферного давления. В первом сосуде оно меньше в 4 раза.
Проанализируем условия задачи и запишем:
Теперь можем применить выведенную ранее формулу:
Преобразуем выражение и найдем установившееся давление:
Алгоритм решения
Решение
Запишем исходные данные:
После того, как открыли кран между 2 и 3 сосудом, объем возрос вдвое, и давление распределилось по нему равномерно. Согласно закону Дальтона, оно стало равным сумме давлений, оказываемых газами в количестве вещества ν2 и ν3. Так как объем после открытия крана увеличивается вдвое, то парциальное давление каждого из количества вещества равно половине исходного давления:
Потом кран 2–3 закрыли, но открыли кран 1–2. Применим закон Дальтона, получим:
Теперь применим закон Менделеева — Клапейрона:
Для начального состояния газа в 1 сосуде:
Для конечного состояния газа в 1 сосуде:
Так как температура и объем неизменны, но давление увеличилось в 1,5 раза, то и количество газа в первом сосуде увеличилось в 1,5 раза.
pазбирался: Алиса Никитина | обсудить разбор | оценить

Для каждой величины определите соответствующий характер изменения:
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Алгоритм решения
Решение
Сначала парциальное давление неона и аргона равно. Это объясняется тем, что давление газов при неизменном количестве вещества зависит только от объема и температуры. Эти величины постоянны.
Когда из сосуда выпустили половину газовой смеси, в нем оказалось по половине моля каждого из газов. Затем в сосуд впустили 1 моль аргона. Следовательно, в сосуде стало содержаться 0,5 моль неона и 1,5 моль аргона. Запишем уравнение Менделеева — Клапейрона:
Из уравнения видно, что давление и количество вещества — прямо пропорциональные величины. Следовательно, если количество неона уменьшилось, то его парциальное давление тоже уменьшилось.
Общая сумма количества вещества равна сумме количеств вещества 1 (неона) и 2 (аргона): 0,5 + 1,5 = 2 (моль). Изначально в сосуде тоже содержалось 2 моль газа. Так как количество вещества, температура и объем сохранились, давление тоже осталось неизменным.
pазбирался: Алиса Никитина | обсудить разбор | оценить
Закон Дальтона
Давление смеси газов, не взаимодействующих друг с другом химически, равно сумме парциальных давлений этих газов.
Воздух в комнате, где мы находимся, представляет собой смесь нескольких газов, в основном — азота (около 80%) и кислорода (около 20%). Парциальное давление каждого из этих газов — это давление, которое имел бы газ, если бы он один занимал весь объем. К примеру, если бы все газы, кроме азота, удалили из комнаты, то давление того, что осталось, и было бы парциальным давлением азота. Закон Дальтона утверждает, что общее давление всех газов вместе взятых равно сумме парциальных давлений каждого газа в отдельнсти. (Строго говоря, закон применим только к идеальным газам, но с достаточно хорошим приближением он описывает также и реальные газы.)
Джон Дальтон сформулировал этот закон в 1801 году, хотя молекулярно-кинетическая теория газов (модель, описывающая поведение газов), из которой он непосредственно вытекает, была разработана позже — уже в середине XIX века. Давление газа на стенки сосуда представляет собой результат столкновения молекул газа с этими стенками. Рассматривая газ с этих позиций, нетрудно понять, что количество столкновений со стенкой молекул каждого вида будет зависеть от того, как много молекул этого вида присутствует в газе. А из этого следует, что общее давление, представляющее собой сумму столкновений всех молекул, получается при сложении числа столкновений молекул каждого вида.
Английский химик и физик. Родился в городе Иглсфилде (графство Камбрия), в семье квакеров. Дальтон бросил школу в 11 лет, но позже начал изучать метеорологию. Два года он работал сельскохозяйственным рабочим, затем стал ассистентом в квакерской школе. Знания в области естественных наук и математики Дальтон получил от своих коллег. Чтобы прокормиться, открыл собственную школу. Его главным вкладом в науку стала современная атомная теория. Интерес к погоде, а затем и к поведению газов привел его к идее атомов.
Закон Дальтона
В природе и в технике мы очень часто имеем дело не только с одним чистым газом, но со смесью нескольких газов. Например воздух, это смесь азота, кислорода, аргона, углекислого газа и других газов. От чего зависит давление смеси газов?
В 1801 г. Джон Дальтон установил, что давление смеси нескольких газов равно сумме парциальных давлений всех газов, составляющих смесь.
Этот закон получил название закона парциальных давлений газов
Закон Дальтона Парциальное давление каждого газа, входящего в состав смеси, это давление, которое создавалось бы той же массой данного газа, если он будет занимать весь объем смеси при той же температуре.
Закон Дальтона устанавливает, что давление смеси (идеальных) газов составляет сумму парциальных давлений компонент смеси (парциальное давление компоненты – это давление, которое компонента оказала бы, если бы она одна занимала все пространство, занятое смесью). Этот закон указывает, что на каждую компоненту не воздействует присутствие других компонент и свойства компоненты в смеси не меняются.
Два закона Дальтона
Закон 1 Давление смеси газов равно сумме их парциальных давлений. Из этого следует, что парциальное давление компонента газовой смеси равно произведению давления смеси на молярную долю этого компонента.
Закон 2 Растворимость компонента газовой смеси в данной жидкости при постоянной температуре пропорциональна парциальному давлению этого компонента и не зависит от давления смеси и природы других компонентов.
Законы сформулированы Дж. Дальтоном соотв. в 1801 и 1803.
Уравнение закона Дальтона
Как уже отмечалось, отдельные компоненты смеси газов считаются независимыми. Поэтому каждая компонента создает давление:
\[ p = p_i k T \quad \left(1\right), \]
а полное давление равно сумме давлений компонент:
\[ p = p_ <01>k T + p_ <02>k T + \cdots + p_ k T = p_ <01>+ p_ <02>+ \cdots + p_ \quad \left(2\right),\]
При больших концентрациях, больших давлениях закон Дальтона не выполняется в точности. Так как проявляется взаимодействие между компонентами смеси. Компоненты перестают быть независимыми. Дальтон объяснил свой закон с помощью атомистической гипотезы.
Если ввести \( \left\langle \mu \right\rangle \) такую, что:
то уравнение (3) запишем в виде:
Закон Дальтона можно записать в виде:
Следствием закона Дальтона можно считать следующее выражение:
\[ p_i=x_ip\ \quad \left(7\right), \]
где \( x_i-молярная\ концентрация\ i-го \) газа в смеси, при этом:
Закон кратных отношений
Закон кратных отношений — Если один и тот же элемент образует несколько соединений с другим элементом, то на одну и ту же массовую часть первого элемента будут приходиться такие массовые части второго, которые относятся друг к другу как небольшие целые числа.
История открытия
Закон кратных отношений открыт в 1803 Дж.Дальтоном и истолкован им с позиций атомизма.
Примеры
1) Состав оксидов азота (в процентах по массе) выражается следующими числами:
| Закись азота N2O | Окись азота NO | Азотистый ангидрид N2O3 | Двуокись азота NO2 | Азотный ангидрид N2O5 | |
|---|---|---|---|---|---|
| N | 63.7 | 46.7 | 36.8 | 30.4 | 25.9 |
| O | 36.3 | 53.3 | 63.2 | 69.6 | 74.1 |
| Частное O/N | 0.57 | 1.14 | 1.71 | 2.28 | 2.85 |
Разделив числа нижней строки на 0,57, видим, что они относятся как 1:2:3:4:5.
2) Хлористый кальций образует с водой 4 кристаллогидрата, состав которых выражается формулами: CaCl2·H2O, CaCl2·2H2O, CaCl2·4H2O, CaCl2·6H2O, т. е. во всех этих соединениях массы воды, приходящиеся на одну молекулу CaCl2, относятся как 1: 2: 4: 6.
См. также
| Атомно-молекулярное учение | Закон сохранения массы • Закон постоянства состава ( закон кратных отношений) • Закон Авогадро (закон объёмных отношений) • Закон эквивалентов |
|---|---|
| Другие | Периодический закон |
| Разделы химии • Хронология химии | |
Полезное
Смотреть что такое «Закон кратных отношений» в других словарях:
ЗАКОН КРАТНЫХ ОТНОШЕНИЙ — один из основных законов химии: если два вещества (простые или сложные) образуют друг с другом несколько хим. соединений, то массы одного вещества, приходящиеся на одну и ту же массу др. вещества, относятся как целые числа, обычно небольшие. Напр … Большая политехническая энциклопедия
ЗАКОН КРАТНЫХ ОТНОШЕНИЙ ОТРЕЗКОВ — син. термина закон рациональности отношений параметров. Геологический словарь: в 2 х томах. М.: Недра. Под редакцией К. Н. Паффенгольца и др.. 1978 … Геологическая энциклопедия
закон кратных отношений Дальтона — Daltono kartotinių santykių dėsnis statusas T sritis fizika atitikmenys: angl. Dalton law of multiple proportion vok. Gesetz der mehrfachen Gewichts verhältnisse, n; Gesetz der mehrfachen verhältnisse, n; Gesetz der multiplen Proportionen, n rus … Fizikos terminų žodynas
ЗАКОН РАЦИОНАЛЬНОСТИ ОТНОШЕНИЙ ПАРАМЕТРОВ — двойные отношения параметров (отрезков), отсекаемых двумя любыми гранями к ла на трех пересекающихся его ребрах, равны отношениям целых и сравнительно малых чисел. На основании этого закона могут быть выведены все возможные грани к ла, а с… … Геологическая энциклопедия
КРАТНЫХ ОТНОШЕНИЙ ЗАКОН — если два химических элемента образуют друг с другом более одного соединения, то массы одного элемента, приходящиеся на одну и ту же массу другого, относятся как целые числа, обычно небольшие. Так, в оксидах азота N2O, NO, N2O3, N2O4, N2O5 массы… … Большой Энциклопедический словарь
КРАТНЫХ ОТНОШЕНИЙ ЗАКОН — КРАТНЫХ ОТНОШЕНИЙ ЗАКОН: если два химических элемента образуют друг с другом более одного соединения, то массы одного элемента, приходящиеся на одну и ту же массу другого, относятся как целые числа, обычно небольшие. Так, в оксидах азота N2O, NO … Энциклопедический словарь
Кратных отношений закон — закон Дальтона, один из основных законов химии: если два вещества (простых или сложных) образуют друг с другом более одного соединения, то массы одного вещества, приходящиеся на одну и ту же массу другого вещества, относятся как целые… … Большая советская энциклопедия
КРАТНЫХ ОТНОШЕНИЙ ЗАКОН — если два элемента образуют неск. соед., то массы одного элемента, приходящиеся на единицу массы другого, относятся как целые числа. Напр., в соед. NO и NO2 на 1 маc. ч. азота приходится соотв. 1,14 и 2,28 маc. ч. кислорода; отношение указанных… … Химическая энциклопедия
КРАТНЫХ ОТНОШЕНИЙ ЗАКОН — один из осн. законов химии: если 2 вещества (простые или сложные) образуют друг с другом более одного соединения, то массы одного в ва, приходящиеся на одну и ту же массу др. в ва, относятся как целые числа, обычно небольшие … Большой энциклопедический политехнический словарь