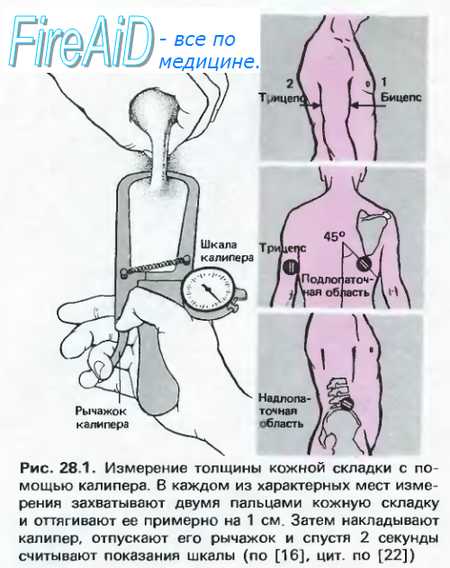
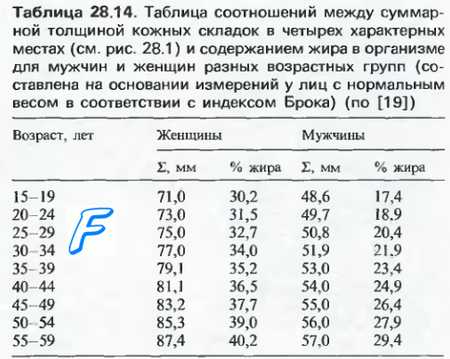
запасающая форма липидов в организме
Запасающая форма липидов в организме
Липиды организма человека — это, главным образом, нейтральные сложные эфиры глицерина и высших жирных кислот — триглицериды, фосфолипиды и стерины. Высшие жирные кислоты, входящие в состав сложных липидных молекул в виде углеводородных радикалов, бывают насыщенными и ненасыщенными, содержащими одну и более двойных связей. Липиды играют в организме энергетическую и пластическую роль. По сравнению с молекулами углеводов и белков молекула липидов является более энергоемкой. Поэтому при окислении липидов в организме образуется больше молекул АТФ и тепла. За счет окисления жиров обеспечивается около 50 % потребности в энергии взрослого организма.
Запасы нейтральных жиров-триглицеридов в жировых депо человека в среднем составляют 10—20 % массы его тела. Из них около половины локализуется в подкожной жировой клетчатке. Кроме того, значительные запасы нейтрального жира откладываются в большом сальнике, околопочечной клетчатке, в области гениталий и между мышцами. Жиры, откладываясь в жировых депо, служат долгосрочным резервом питания организма.
Нарушения обмена липидов у детей приводит к различным расстройствам. Особенно актуально нарушение обмена жиров в жаркое время года, что грозит психическими расстройствами. Жиры являются источником образования эндогенной воды. При окислении 100 г нейтрального жира в организме образуется около 107 г воды. Если в удовлетворении энергетических потребностей организма основную роль играют нейтральные молекулы жира (триглицериды), то пластическая функция липидов в организме осуществляется, главным образом, за счет фосфолипидов, холестерина, жирных кислот. Эти липидные молекулы являются структурными компонентами клеточных мембран (липопротеинов) и предшественниками синтеза стероидных гормонов, желчных кислот и простагландинов.
Клеточные липиды
В состав клеточных липидов входят фосфолипиды и холестерин, являющиеся необходимыми структурными компонентами поверхностной и внутриклеточных мембран. Триглицериды откладываются в клетках в виде жировых капель, формируя жировые депо. Последние являются не инертной массой, а активной динамической тканью, в которой запасенные жиры подвергаются постоянному расщеплению и ресинтезу.
При действии на организм холода, в состоянии голода, при физической или психоэмоциональной нагрузке происходит интенсивное расщепление (липолиз) запасенных триглицеридов. Образующиеся при этом неэстерифицированные жирные кислоты используются в организме как энергодающие или как пластические вещества, необходимые для синтеза сложных липидных молекул. В условиях покоя после приема пищи происходят ресинтез и отложение нейтральных липидов в подкожной жировой клетчатке, брюшной полости, мышцах.
Структура и физиологическое значение липидов и липопротеидов в плазме крови
Международные названия
Содержание
Дефиниция
Липиды идентифицируются как биологические субстанции, включающие в себя молекулы с широким спектром химических свойств, такие как жирные кислоты, фосфолипиды, стеролы, сфинголипиды, терпены и т.п., для которых характерны преимущественно гидрофобные качества и способность растворяться в органических растворителях (Smith A., 2000; Christie W.W., 2003). Важнейшей биологической ролью липидов является их участие в образовании клеточных мембран, внутриклеточных структур и органелл, а также в энергетическом метаболизме и синтезе ряда биологически активных соединений, таких как простагландины, стероидные гормоны, жирорастворимые витамины и некоторые коферменты (убихинон).
Современная классификация системы липидов
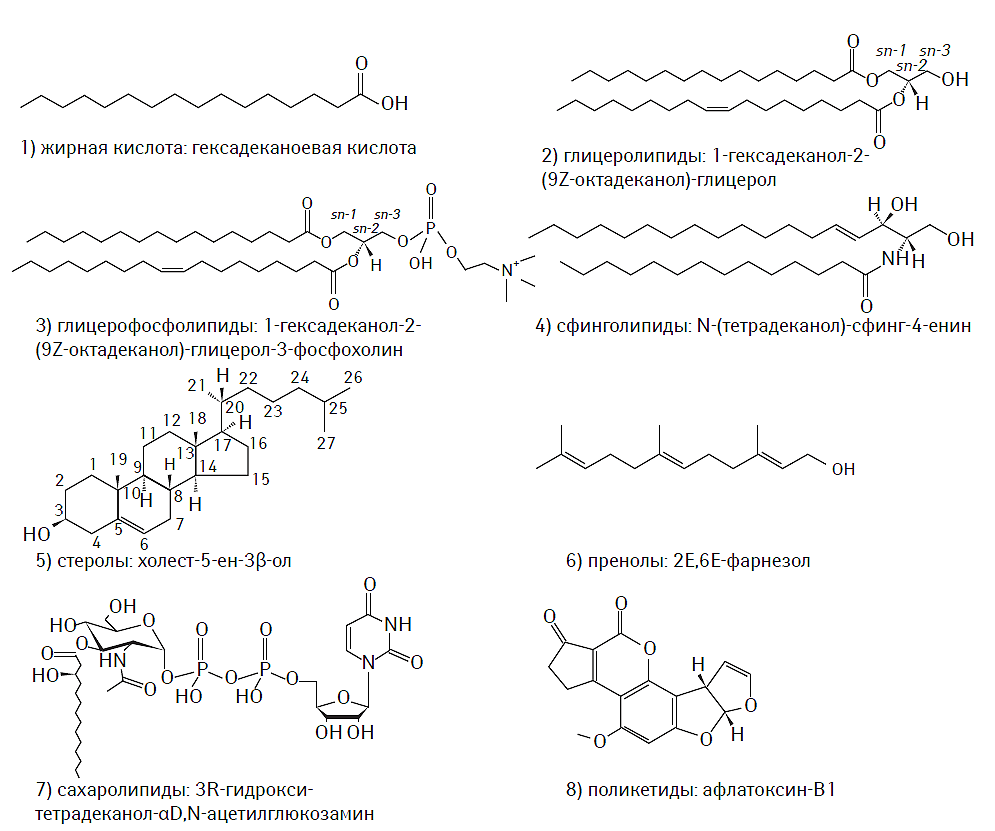
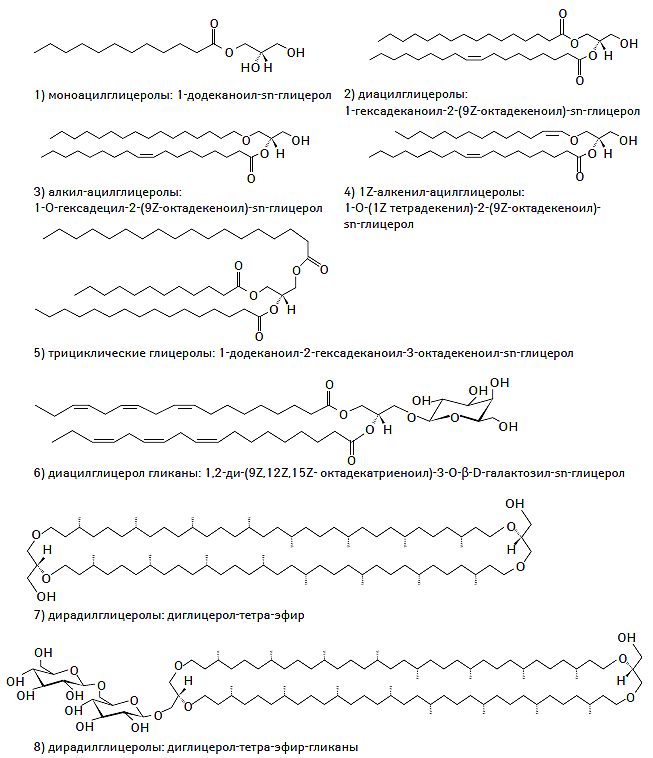
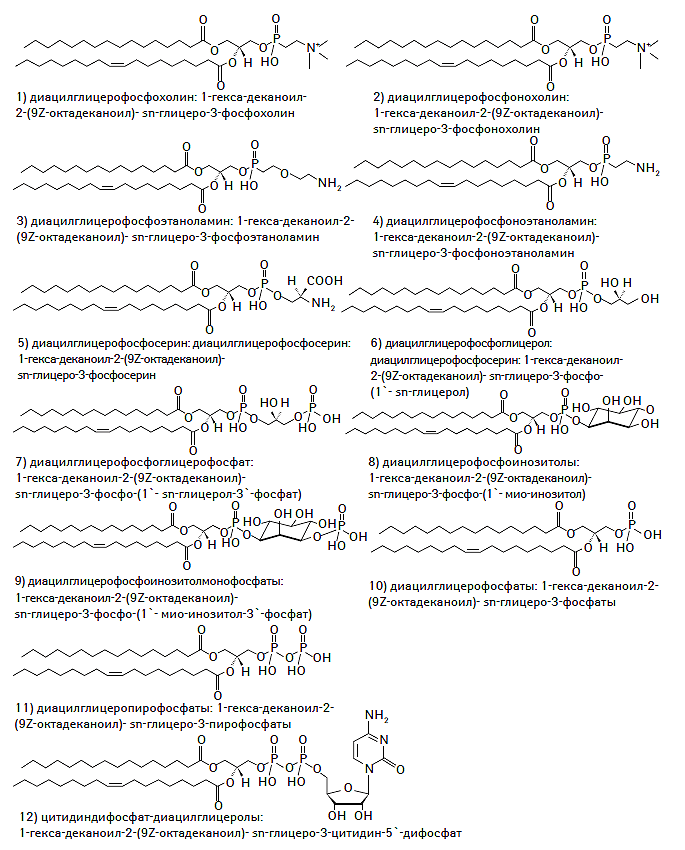
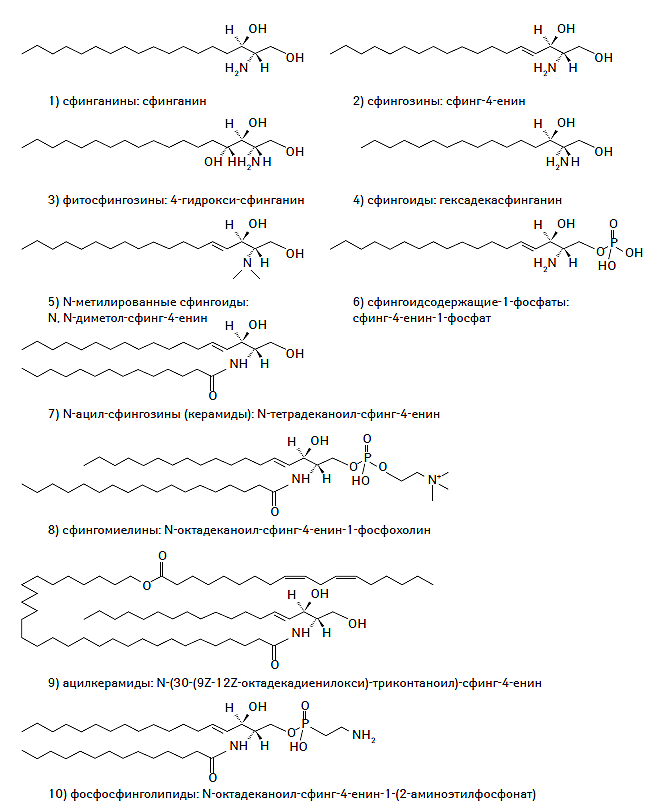
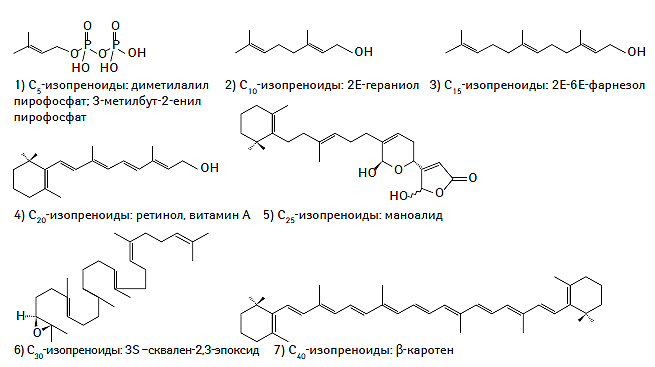
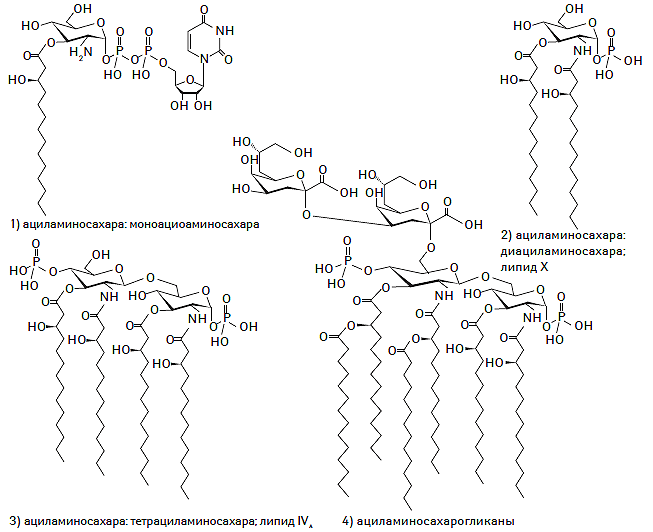
К настоящему времени создана и унифицирована современная классификация системы липидов, основанная на уникальных особенностях их строения и молекулярной структуры, а также их гидрофильных или гидрофобных свойствах. В соответствии с номенклатурой IUPAC-IUB (International Union of Pure and Applied Chemistry — International Union of Biochemistry) Commission on Biochemical Nomenclature выделяют восемь классов липидов, включающих жирные кислоты, глицеролипиды, глицерофосфолипиды, сфинголипиды, стеролы, пренолы, сахаролипиды и поликетиды (IUPAC-IUB Commission on Biochemical Nomenclature, 1977–2000). Химическая структура каждого из классов липидов представлена на рис. 1.1.
Рис. 1.1. Химическая структура основных классов липидов в соответствии с номенклатурой IUPAC-IUB Commission on Biochemical Nomenclature
Классы и подклассы липидов
Свободные жирные кислоты
Свободные жирные кислоты (СЖК) относятся к наиболее распространенным в организме человека классам липидов. Они имеют длинную неразветвленную цепь, состоящую из атомов углерода, и завершающуюся карбоксильным остатком (Caffrey M., Hogan J., 1992). Эти соединения обладают гидрофобными качествами благодаря наличию в составе молекулы СЖК повторяющейся серии из метиленовых групп. В зависимости от наличия или отсутствия в структуре СЖК двойных связей различают насыщенные (пальмитиновая, стеариновая и др.) и ненасыщенные (олеиновая, линолевая, линоленовая, арахидоновая) жирные кислоты соответственно (Small D.M., 1986).
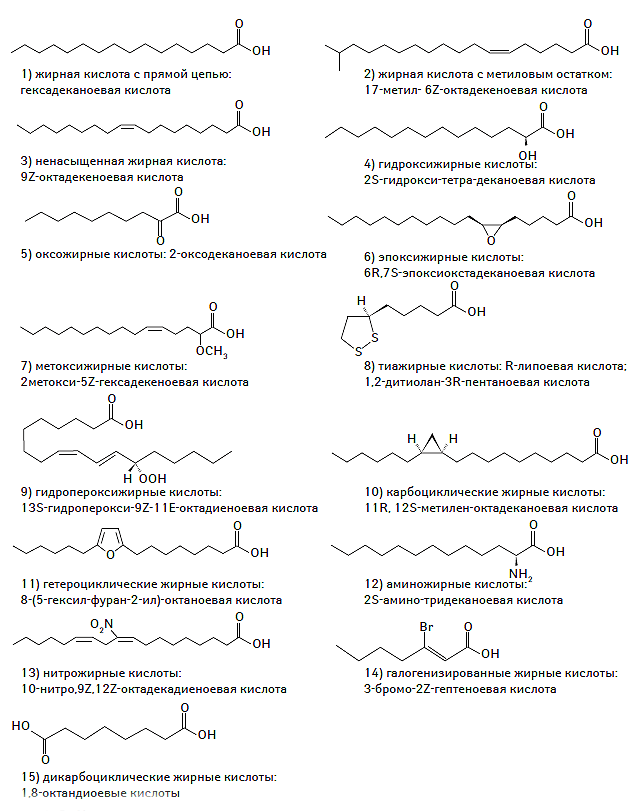
Кроме того, существуют и другие классы СЖК: СЖК с прямой цепью (гексадеканоиды), метилсодержащие октадеканоиды, гидроксижирные кислоты, оксожирные кислоты (оксо-деканоиды), эпоксижирные кислоты (окстадеканоиды), метоксижирные кислоты, липокси-жирные кислоты (пентакоиды), гидропероксижирные кислоты, карбоциклические и гетероциклические производные, аминосодержащие жирные кислоты, нитрожирные кислоты (нитроокстадеканоиды), галогенированные и декарбоксилированные производные (Vance D.E., Vance J.E., 2002).
Ненасыщенные жирные кислоты, содержащие в структуре молекулы от 2 до 4 двойных связей, относят к незаменимым соединениям, поскольку в организме человека они не синтезируются и должны поступать с пищей, преимущественно с растительными маслами (Small D.M., 1986). Наиболее распространенные полиненасыщенные жирные кислоты (ПНЖК) — линолевая, линоленовая и арахидоновая, имеющие, соответственно, 2, 3 и 4 двойные связи. Биологическая роль полиненасыщенных жирных кислот в организме заключается в регуляции амфифильного состояния липидов клеточных мембран и в предотвращении депонирования холестерина (ХС) и других липидов в субинтиме стенки артерий. Кроме того, ПНЖК являются предшественниками простагландинов, лейкотриенов и других дериватов, а их w-3 производные принимают участие в метаболизме зрительных пигментов (Bazan N.G., 1989). СЖК с прямой цепью (гексадеканоиды) содержат терминальный карбоксильный остаток и часто являются конечным продуктом деградации поликетидов. Метилсодержащие октадеканоиды, а также циклические и гетероциклические СЖК широко представлены в природе (Ohlrogge J.B., 1997). Подклассы серосодержащих СЖК входят в состав биотина. Тиолы и их дериваты участвуют в синтезе и метаболизме полиненасыщенных жирных кислот. Многие подклассы СЖК, такие как гидроксижирные, оксожирные кислоты, а также окстадеканоиды являются прекурсорами критических этапов биологического синтеза ряда важнейших соединений, растительных эстрогенов, простагландинов и лейкотриенов (Murphy R.C., Smith W.L., 2002; Agrawal G.K. et al., 2004). Кроме того, многие эстерифицированные СЖК, такие как моно- и диэстерифицированные производные, а также лактоны, играют важную роль в обмене медиаторов, коэнзимов и карнитина. Липокси- и метоксижирные кислоты (пентакоиды), а также аминосодержащие СЖК занимают важное место в стабилизации клеточных мембран в организме человека и формировании устойчивости бактериальной стенки к антибиотикам (Roche D.M. et al., 2004). Химическая структура различных подклассов СЖК представлена на рис. 1.2.
Рис. 1.2. Химическая структура различных подклассов СЖК
Глицеролипиды
Несмотря на то что в структуре глицеролипидов и глицерофосфолипидов содержатся остатки молекулы глицерина, последние выделены в отдельную группу, поскольку часто выступают в роли биологических регуляторов синтеза триглицеридов (ТГ) в различных органах и тканях, а также в качестве сигнальных молекул. Среди глицеролипидов доминируют моно-, ди- и тризамещенные глицеролы, хорошо известные как ацилглицерины (так называемые нейтральные жиры) (Stam H. et al., 1987; Coleman R.A., Lee D.P., 2004). Другие подклассы представлены глицерогликанами, которые содержат один или несколько остатков гликолизированного глицерина (Pahlsson P. et al., 1998). Химическая структуры глицеролипидов представлена на рис. 1.3.
Рис. 1.3. Химическая структура глицеролипидов
Глицерофосфолипиды
Глицерофосфолипиды образуются в результате связывания одной из гидроксильных групп глицерина с фосфатной группой, а двух других — с СЖК (Ivanova P.T. et al., 2004). Этот класс липидов является ключевым компонентом желчных кислот, предшественником кардиолипина, внутриклеточных мессенджеров, сигнальных молекул, факторов свертывания крови, а также входит в состав биологических мембран и цитоскелета (Kennedy E.P., 1962; Cevc G., 1993; Forrester J.S. et al., 2004; Ivanova P.T. et al., 2004; Pereto J. et al., 2004). Большая часть глицерофосфолипидов представлена фосфатидилхолинами (лецитином) и фосфатидилэтаноламинами. Химическая структура глицерофосфолипидов представлена на рис. 1.4.
Рис. 1.4. Химическая структура глицерофосфолипидов
Сфинголипиды
Сфинголипиды — одно из наиболее широко представленных в природе семейств липидов, синтезирующихся de novo из серина и длинноцепочечного ацил-коэнзима А (ацил-КoA), а затем конвертирующегося в различные дериваты, такие как керамиды, фосфосфинголипиды, гликосфинголипиды и другие продукты (Taniguchi N. et al., 2002). Сфинголипиды входят в состав миелиновых оболочек и биологических мембран различных клеток, особенно эпидермальных. Химическая структура сфинголипидов представлена на рис. 1.5.
Рис. 1.5. Химическая структура сфинголипидов
Стеролы
Стеролы представляют собой производные восстановленных конденсированных циклических систем — циклопентанпергидрофенантренов. К числу производных C21-стеролов относятся прогестерон, кортикостерон, минералкортикоиды, к дериватам C18-стеролов — кортизол, тестостерон, андростерон, эстрогены, а также многие сигнальные молекулы. Кроме того, производными стеролов являются желчные кислоты, ХС, витамин D, таурин, глицин, глюкуроновая кислота и др. (Jones G. et al., 1998; Taniguchi N. et al., 2008). Стеролы входят в состав биологических мембран и цитоскелета вместе с глицеролипидами, лизофосфатидами, сфингомиелином (Merrill A.H. Jr., Sandhoff K., 2002; Bach D., Wachtel E., 2003; Russell D.W., 2003). Химическая структура стеролов представлена на рис. 1.6.
Рис. 1.6. Химическая структура стеролов
Пренолы
Пренолы синтезируются из пяти углеродных предшественников изопентилдифосфата и диметилалилдифосфата, которые являются промежуточными продуктами метаболизма мевалоната (Kuzuyama T., Seto H., 2003). Необходимо отметить, что дериватами пренолов являются многие жирорастворимые витамины, такие как витамин А, Е и К, а также природные антиоксиданты и коэнзимы (убихинон) (Porter J.W., Spurgeon S.L., 1981; Meganathan R., 2001; Ricciarelli R. et al., 2001; Demming-Adams B., Adams W.W., 2002). Полипренолы (долихолы) играют важную роль в обеспечении транспорта олигосахаридов через биологические мембраны, модулировании гликации белков и липидов, а также синтезе полисахаридов (Lazar K., Walker S., 2002; Raetz C.R.H., Whitfield C., 2002). Химическая структура пренолов представлена на рис. 1.7.
Рис. 1.7. Химическая структура пренолов
Сахаролипиды
В соответствии с современной номенклатурой термин «гликолипиды» заменен на «сахаролипиды», поскольку все восемь основных классов липидов имеют гликолипидные и фосфогликолипидные дериваты. Сахаролипиды входят в состав биологических мембран, а также являются компонентом бактериальной стенки грамотрицательных бактерий, обладающей чрезвычайно высокой иммунно- и анафилактогенностью (Spaink H.P., 2000; Lazar K., Walker S., 2002; Raetz C.R.H., Whitfield C., 2002). Химическая структура сахаролипидов представлена на рис. 1.8.
Рис. 1.8. Химическая структура сахаролипидов
Поликетиды
Поликетиды представлены ароматическими, макролидными и гибридными производными, основной биологической ролью которых является непосредственное участие в синтезе липидов различных классов (Walsh C.T., 2004). Структура поликетидов подвергается модификации в ходе реакций гликолизации, окисления, гидроксилирования и метилирования и некоторых других (Khosla C. et al., 1999). Сами поликетиды часто вовлекаются в процессы рибосомального протеинсинтеза. Кроме того, большинство эпитопов различных антибиотиков и антифунгицидов являются поликетидами или их дериватами. С другой стороны, многие поликетиды являются потенциальными токсинами (Moore B.S., Hartweck C., 2002; Reeves C.D., 2003). Химическая структура поликетидов представлена на рис. 1.9.
Рис. 1.9. Химическая структура поликетидов
Липопротеиды
Липопротеиды являются транспортными формами липидов, имеют глобулярную структуру в виде радиально расположенных вокруг молекул ТГ и ХС полярных молекул фосфолипидов, направленных гидрофильным полюсом центрально. Они состоят из апопротеина и липидного компонента. Основные свойства липопротеидов определяются преимущественно протеиновыми компонентами, тогда как их липидная часть обладает значительно меньшей специфичностью. Большинство клеточных рецепторов способны распознавать именно молекулу апопротеина, благодаря которой осуществляются кооперация, поглощение, деградация и клиренс липопротеида, а также обмен ХС и ТГ между липопротеидами различных классов.
Основные классы липопротеидов отличаются по своим физико-химическим свойствам: размеру частиц, их плотности и соотношению входящих в их состав апопротеина, ТГ, ХС и фосфолипидов (табл. 1.1).
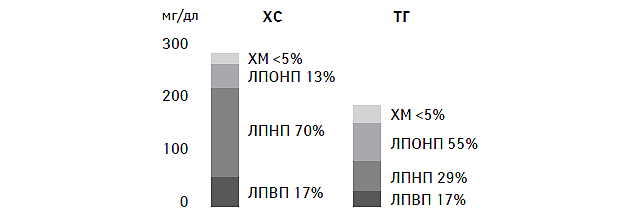
В физиологических условиях у человека ХС и ТГ распределены в различных липопротеидах в определенных взаимоотношениях (рис. 1.10). Причем последние не являются «жесткими» и могут существенно модифицироваться при различных состояниях, таких как голодание, прием пищи, обогащенной экзогенными жирами, вегетарианском питании, после физических нагрузок высокой интенсивности и т.п.
Рис. 1.10. Удельное распределение ХС и ТГ в липопротеидах у здоровых лиц натощак ХМ — хиломикроны.
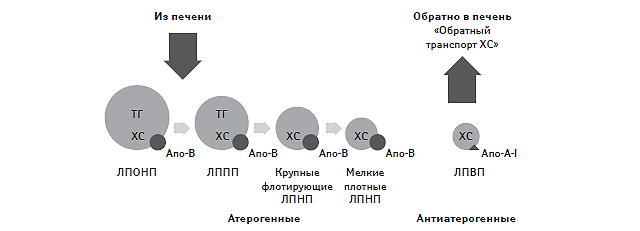
Основные апопротеины, входящие в состав липопротеидов, указаны в табл. 1.2. Так, хиломикроны и липопротеиды очень низкой плотности (ЛПОНП) состоят главным образом из ТГ и содержат апо-В48-, апо-С- и апо-Е-протеины. Они отличаются очень низкой плотностью и достаточно крупными размерами частиц (от 30–80 нм до 100–150 нм). Липопротеиды низкой плотности (ЛПНП) относятся к апо-В100-содержащим липопротеидам, имеют менее крупные частицы (20 нм) и обогащены ХС. Удельное содержание в них апо-В100-протеина не превышает 25%. Наиболее мелкими частицами являются липопротеиды высокой плотности (ЛПВП), состоящие преимущественно из апо-А-I-, апо-А-II- и апо-С-липопротеина, а также фосфолипидов. Апо-В-содержащие липопротеиды являются основной транспортной формой эндогенного ХС, обеспечивая его транспорт в клетки периферических тканей, и обладают потенциально атерогенными качествами, тогда как ЛПВП участвуют в процессах обратного транспорта ХС в гепатоциты и проявляют антиатерогенные качества (рис. 1.11). Более подробно о процессах эндогенного синтеза ХС и взаимоотношениях различных вне- и внутриклеточных липидных транспортных систем изложено в главе 2.
Кроме ТГ, ХС и фосфолипидов в плазме крови присутствуют так называемые неэстерифицированные жирные кислоты (НЭЖК), адсорбированные на альбумине, и хиломикроны, хотя период их полужизни чрезвычайно ограничен. НЭЖК освобождаются из липоцитов и транспортируются к различным органам и тканям. Хиломикроны являются основной транспортной формой экзогенных ТГ.
Таблица 1.1 Физико-химические характеристики липопротеидов
| Липопротеиды | Плотность, г/мл | Содержание липидов, % | ||
| ТГ | ХС | Фосфолипиды | ||
| ХМ | 0,95 | 80–95 | 2–7 | 3–9 |
| ЛПОНП | 0,95–1,006 | 55–80 | 5–15 | 10–20 |
| ЛППП | 1,006–1,019 | 20–50 | 20–40 | 15–25 |
| ЛПНП | 1,019–1,063 | 5–15 | 40–50 | 20–25 |
| ЛПВП | 1,063–1,21 | 5–10 | 15–25 | 20–30 |
В табл. 1 и 2: ХМ — хиломикроны, ЛПОНП — липопротеиды очень низкой плотности, ЛППП — липопротеиды промежуточной плотности, ЛПНП — липопротеиды низкой плотности, ЛПВП — липопротеиды высокой плотности.
Таблица 1.2 Основные апопротеины, входящие в состав липопротеидов
| Липопротеиды | Апопротеины |
| ХМ | Апо-В48, апо-С, апо-Е |
| ЛПОНП | Апо-В100, апо-С, апо-Е |
| ЛПНП | Апо-В100 |
| ЛППП | Апо-В100, апо-Е |
| ЛПВП | – |
| Субфракция 2 | Апо-А-I, апо-А-II, апо-С |
| Субфракция 3 | Апо-А-II, апо-А-I, апо-С |
Рис. 1.11. Потенциально про- и антиатерогенные липопротеиды
Таким образом, биологическая роль липидов в организме человека многообразна и не сводится только к выполнению пластической функции и участию в энергетическом метаболизме. Многие коферменты, энзимы, сигнальные молекулы и рецепторные субъединицы либо сами являются дериватами липидов, либо инкорпорируют последние в свою структуру. Если клинические значения для многих компонентов системы экзогенного и эндогенного путей метаболизма липидов уже установлены (общий ХС, хиломикроны, фракции липопротеидов, ТГ, НЭЖК, мицеллы, содержащие СЖК, субклассы СЖК, апопротеины, липопротеиды (a) — ЛП (a), фосфолипиды), то для регуляторных субъединиц, сигнальных молекул и многих других соединений такую роль еще придется документировать.
Запасающая форма липидов в организме
В настоящее время имеются научные доказательства о генетически детерминированных нарушениях барьерных свойств кожи, что облегчает проникновение аллергенов в глубь кожи, повышает склонность к воздействию раздражающих факторов и, в конечном итоге, способствует воспалению. Дефицит филаггрина — наиболее изученная аномалия, в результате которой возрастает трансэпидермальная потеря воды (ТЭПВ). Помимо этого, дефицит межклеточных липидов в роговом слое и нарушенное соотношение между холестерином, незаменимыми жирными кислотами и церамидами усиливает ТЭПВ, что обусловливает образование эпидермальных микротрещин. Нарушение целостности барьерного слоя кожи ведет к нарушению метаболизма кожи и воспалению, что является ключевым промежуточным звеном патогенеза атопического дерматита (АтД) и ряда других дерматологических заболеваний. Базовым элементом терапии АтД, помимо устранения контакта со специфическими и неспецифическими провоцирующими факторами, является восстановление нарушенной барьерной функции кожи путем применения топических гидратирующих и защитных средств. Наружное применение смягчающих средств — одна из важных стратегий лечения АтД и многих других дерматозов для восстановления барьерной функции кожи.
Структура и свойства кожи
Кожа — самый большой орган человека; ее масса составляет 11—15% от массы тела. Кожа обеспечивает несколько важнейших функций: является барьером, отделяющим окружающую среду от внутренней; защищает от механических, тепловых, химических повреждений; регулирует количество воды в организме; обеспечивает осязание; защищает от инвазии патогенов, обеспечивает персистенцию симбиотических микроорганизмов; помогает вырабатывать витамин D и ряд гормонов.
Одним из наиболее важных белков, участвующих и регулирующих ороговение, является филаггрин. В процессе дифференцировки кератиноцитов в корнеоциты филаггрин формируется из предшественника белка — профилаггрина, который сохраняется в кератогиалиновых гранулах. Высвобождение и модификация профилаггрина в филаггрин вызывают агрегацию кератиновых филаментов и гибель клеток. Мутации в гене филаггрина часто выявляют у больных при АтД, астме и других дерматологических заболеваниях [3, 4].
Поверхностный слой эпидермиса состоит уже из частиц, которые постепенно отшелушиваются (см. рисунок, г). Для удержания чешуек вместе и сохранения целостности барьера кожа вырабатывает липидный клей, состоящий преимущественно из церамидов.
Церамиды и другие липиды рогового слоя
Структурно церамид состоит из двух молекул: сфингозидного полярного основания и жирной гидрофобной кислоты, соединенных амидной связью (см. рисунок, д).
Сфингозид через систему мембран аппарата Гольджи связан с клетками рогового слоя; жирные кислоты заполняют межклеточное пространство перпендикулярно пластам клеток (см. рисунок, е, ж). Красной линией отмечено расположение липидов между слоями клеток. Церамиды в области полярной части, прикрепленной к «мертвым» кератиноцитам, формируют малоподвижную псевдокристаллическую решетку; средняя часть липидной прослойки образована хвостами жирных кислот, имеющих меньший объем, чем сфингозиды, что обеспечивает их большую подвижность. Между ними пространство заполняется холестерином и СЖК, не связанными с церамидами, что обеспечивает текучесть (см. рисунок, е, ж) среднего пласта липидов. Таким образом, церамиды обеспечивают плотность рогового слоя, а средняя зона обеспечивает его эластичность.
Анализ структуры церамидов методом обращенно-фазовой жидкостной хроматографии в сочетании с квадрупольной времяпролетной масс-спектрометрией высокого разрешения показал, что вариантов комбинаций сфингозинов с жирными кислотами может быть более 1000 [6, 7]. В целом церамиды получаются комбинацией вариантов сфингозиновой полярной части и жирных кислот с разным числом атомов углерода (см. таблицу). 
Синтез церамидов
В состав церамидов чаще всего входят длинноцепочечные насыщенные жирные кислоты, содержащие от 14 до 26 атомов углерода. Церамиды в организме образуются тремя различными путями, а именно синтезируются de novo в эндоплазматическом ретикулуме клеток из серина и пальмитата в результате гидролиза сфингомиелинидазой сфингомиелина, являющегося составной частью клеточных мембран, и из остаточного сфингозина [8]. Синтез церамидов прямо зависит от количества жировых отложений в организме. Так, уровень сывороточных церамидов С16:0, С18:0, С24:0 и С24:1 достоверно повышен у людей с ожирением [8].
Характеристика липидного состава при заболеваниях
Впервые церамиды были открыты в головном мозге, откуда и получили свое название (cerebrum). Церамиды также являются компонентами липопротеидов крови. Концентрация церамидов в мозге и крови значительно ниже, чем в коже. Изменение количества церамидов в крови часто имеет диагностическое значение, например при болезни Альцгеймера [8—11].
В норме соотношение церамидов, холестерина и СЖК составляет 3:1:1. С возрастом снижается продукция липидов кожи, но соотношение не меняется [12]. При различных метаболических нарушениях концентрация липидов кожи, а также церамидов крови может служить прогностическим и диагностическим маркерами сердечно-сосудистых заболеваний, ожирения, сахарного диабета, инсулинорезистентности и неалкогольной жировой болезни печени [13—16].
При АтД нарушение состава липидов кожи ассоциировано с расстройством синтеза как церамидов, так и СЖК. M. Danso и соавт. [17] показали, что при АтД снижаются количество насыщенных и доля длинноцепочечных (С22—С28) СЖК, а также изменяется баланс церамидов разных классов. Так, повышается доля AS и NS церамидов и снижается доля ЕОН и ОН церамидов. Изменения в составе СЖК и церамидов ассоциированы с нарушением функциональной активности ферментов стеарол CoA десатуразы (церамиды) и элонгазы 1 (СЖК). Аналогичное повышение доли AS и NS церамидов выявляют также у детей с АтД [18].
Нарушение в составе и количестве церамидов кожи наблюдается также при акне. В целом разнообразие церамидов в коже больных не нарушено. Так, Pappas и соавт. идентифицировали 283 типа церамидов при снижении общего количества липидов и доли NH, AH, EOS и EOH церамидов [19]. При акне (так же, как и при АтД) наблюдают снижение количества длинноцепочечных (>С18) СЖК. Авторы заключили, что NH и AH церамиды наиболее важны для формирования нормального барьера кожи [19].
Имеются ограниченные данные по изменению состава и количества церамидов при псориазе. Показано снижение церамида EOS [20]. В то же время состав церамидов на не пораженных псориазом и АтД участках кожи не отличается от такового у здоровых доноров [21]. Данных по составу и количеству церамидов в коже больных розацеа нет. По-видимому, при розацеа липиды кожи находятся в пределах нормы. В большинстве случаев нарушение состава липидов кожи ассоциировано с повышенной ТЭПВ. Имеются ограниченные сведения, что при розацеа ТЭПВ повышается только в области лица, что может являться в большей степени результатом патологического процесса, чем генерализованного дисбаланса липидов кожи [22]. Этими же авторами показано, что при АтД повышенная ТЭПВ является генерализованной.
Компенсаторные механизмы при нарушении барьерной функции эпидермиса
При нарушении эпидермального барьера (травмы, воспаление, аутоиммунные процессы) в течение минут начинаются репаративные процессы. В первую очередь высвобождаются ЛТ из клеточных депо и начинается синтез de novo СЖК, а затем церамидов [23]. При наложении непроницаемой мембраны наблюдается подавление синтеза ЛТ, что препятствует восстановлению эпидермального барьера [24]. Процесс репарации стимулируется изменением градиента кальция в эпидермисе, вызванного локальной потерей воды [25]. Нанесение на кожу топических препаратов, содержащих СЖК, ускоряет восстановление барьерных свойств кожи за счет включения экзогенных СЖК в липидный слой эпидермиса [26]. Аналогичное действие оказывают и синтетические церамиды [27]. Однако в состав топических средств входит несколько компонентов, создающих на коже пленку. В большей степени они служат окклюзивным барьером, помогающим удерживать воду и снижать ТЭПВ, уменьшать зуд и обеспечивать экзогенными липидами и церамидами [28].
Терапия кожи увлажняющими средствами
Показано, что использование увлажняющих препаратов замедляет прогрессию АтД и снижает тяжесть заболевания [30, 31]. K. Mori и соавт. [30] оценивали эффект геля на основе синтетических церамидов и экстракта эвкалипта в слепом клиническом исследовании 27 больных из Японии с умеренным АтД. Авторы показали, что в сухой летний период использование геля значительно улучшало состояние кожи, снижало покраснение, зуд, улучшало самочувствие больных по сравнению с больными, не использовавшими гель. Аналогичные данные были получены у больных себорейным дерматитом [31]. Этот же состав увлажняющего средства в сочетании с умеренной очисткой лица оказывал достоверный протективный эффект при акне средней тяжести у подростков с сухой и чувствительной кожей [32]. Авторы показали увеличение общего количества церамидов кожи, доли длинноцепочечных церамидов NS и NP в результате обработки кожи.
Использование топических средств, содержащих компоненты ЛТ, позволяет снизить побочные эффекты кортикостероидных препаратов. Так, короткий курс 0,05% клобетазола замедлял регенерацию эпидермального барьера; при одновременном нанесении крема, содержащего СЖК, холестерол и церамиды, снижались побочные эффекты кортикостероида и ускорялась репарация кожи [33]. Аналогичные данные были получены S. Ahn и соавт. [34] в модели на мышах.
Иммуносупрессивные препараты, влияющие на физиологические процессы кожи, подавляют репарацию: так, ингибиторы кальциневрина пимекролимус и такролимус задерживают восстановление барьерной функции и снижают количество липидов в эпидермисе [35]. Использование топических препаратов, включающих физиологические липиды в сочетании с пимекролимусом, улучшает репарацию кожи и состав липидов эпидермиса.
Применение в качестве наружной терапии воспалительных дерматозов комбинации топических кортикостероидов или ингибиторов кальциневрина с препаратами, содержащими физиологические липиды, позволяет улучшить восстановление эпидермального барьера и снизить побочные эффекты противовоспалительных агентов на барьерную функцию кожи.
В России разработан комбинированный препарат, содержащий 0,1% метилпреднизолона ацепонат и керамиды (Комфодерм К крем, патент 2011120522.15), который позволяет расширить возможности терапии стероидчувствительных дерматозов у взрослых и детей.
На рынке имеется большое количество кремов, содержащих церамиды. Чаще всего в косметические кремы вводятся церамиды NP и EOS, что способствует снижению ТЭПВ. В увлажняющие препараты и терапевтические кремы для лечения псориаза могут добавляться церамиды AP, AS и EOS. В настоящее время в основном используют синтетические церамиды, которые по действию идентичны природным. Несмотря на известное соотношение церамидов, холестерина и СЖК в нормальной коже, применение увлажняющих кремов, содержащих большое количество церамидов разных классов, может быть нецелесообразным. Так, значительный клинический эффект при умеренном АтД получен при использовании крема РС-104 на основе смеси амидов пальмитиновой кислоты, глицирретиновой кислоты и экстракта виноградных косточек [36]. Раннее начало использования эмолиентов с церамидами значительно снижает частоту заболеваемости АтД у младенцев из группы риска [37, 38]. Синтетические фитоцерамиды NP и EOP эффективны также при псориазе [39].