Атомный радиус как определить
Атомный радиус как определить
Периодический закон
Периодический закон был открыт Д.И. Менделеевым в 1868 году. Его современная формулировка: свойства химических элементов и образуемых ими соединений (простых и сложных) находятся в периодической зависимости от величины заряда атомного ядра.
Периодический закон лежит в основе современного учения о строении вещества. Периодическая система Д.И. Менделеева является наглядным отражением периодического закона.
Группой называют вертикальный ряд химических элементов в периодической таблице. Элементы собраны в группы на основе степени окисления в высшем оксиде. Каждая из восьми групп состоит из главной подгруппы (а) и побочной подгруппы (б).
Периодическая таблица Д.И. Менделеева содержит колоссальное число ответов на самые разные вопросы. При умелом ее использовании вы сможете предполагать строение и свойства веществ, успешно писать химические реакции и решать задачи.
Радиус атома
Радиусом атома называют расстояние между атомным ядром и самой дальней электронной орбиталью. Это не четкая, а условная граница, которая говорит о наиболее вероятном месте нахождения электрона.
В периоде радиус атома уменьшается с увеличением порядкового номера элементов («→» слева направо). Это связано с тем, что с увеличением номера группы увеличивается число электронов на внешнем уровне. Запомните, что для элементов главных подгрупп номер группы равен числу электронов на внешнем уровне.
С увеличением числа электронов они становятся более скученными, так как притягиваются друг к другу сильнее: это и есть причина маленького радиуса атома.
Чем меньше электронов, тем больше у них свободы и больше радиус атома, поэтому радиус увеличивается в периоде «←» справа налево.
Период, группа и электронная конфигурация
Правило составления электронной конфигурации, которое вы только что увидели, универсально. Если вы имеете дело с элементом главной подгруппы, то увидев номер группы вы знаете, сколько электронов у него на внешнем уровне. Посмотрев на период, знаете номер его внешнего уровня.
Длина связи
Убедимся в этом на наглядном примере, сравнив длину связей в четырех веществах: HF, HCl, HBr, HI.
Чем больше радиусы атомов, которые образуют химическую связь, тем больше между ними и длина связи. Радиус атома водорода неизменен во всех трех веществах, а в ряду F → Cl → Br → I происходит увеличение радиуса атома. Наибольшим радиусом обладает йод, поэтому самая длинная связь в молекуле HI.
Металлические и неметаллические свойства
Сравним металлические и неметаллические свойства Rb, Na, Al, S. Натрий, алюминий и сера находятся в одном периоде. Металлические свойства возрастают S → Al → Na. Натрий и рубидий находятся в одной группе, металлические свойства возрастают Na → Rb.
Основные и кислотные свойства
Замечу, что здесь есть одно важное исключение. Как и в общем случае: исключения только подтверждают правила. В ряду галогенводородных кислот HF → HCl → HBr → HI происходит усиление кислотных свойств (а не ослабление, как должно быть по логике нашего правила).
Восстановительные и окислительные свойства
Электроотрицательность (ЭО), энергия связи, ионизации и сродства к электрону
Для примера сравним ЭО-ость атомов Te, In, Al, P. Индий расположен в одной группе с алюминием, ЭО-ость In → Al возрастает (снизу вверх). Алюминий расположен в одном периоде с серой, ЭО-ость возрастает Al → S (слева направо). Сравнивая серу и теллур, мы видим, что сера расположена в группе выше теллура, значит и ее электроотрицательность тоже выше.
Энергия связи (а также ее прочность) возрастают с увеличением электроотрицательности атомов, образующих данную связь. Чем сильнее атом тянет на себя электроны (чем больше он ЭО-ый), тем прочнее получается связь, которую он образует.
Продемонстрирую на примере. Сравним энергию связи в трех молекулах: H2O, H2S, H2Se.
Высшие оксиды и летучие водородные соединения (ЛВС)
В периодической таблице Д.И. Менделеева ниже 7 периода находится строка, в которой для каждой группы указаны соответствующие высшие оксиды, ниже строка с летучими водородными соединениями.
Для элементов главных подгрупп начиная с IV группы (в большинстве случае) максимальная степень окисления (СО) определяется по номеру группы. К примеру, для серы (в VI группе) максимальная СО = +6, которую она проявляет в соединениях: H2SO4, SO3.
На экзамене строка с готовыми «высшими» оксидами, как в таблице наверху, может отсутствовать. Считаю важным подготовить вас к этому. Предположим, что эта строчка внезапно исчезла из таблицы, и вам нужно записать высшие оксиды для фосфора и углерода.
С летучими водородными соединениями (ЛВС) ситуация аналогичная: их может не быть в периодической таблице Д.И. Менделеева, которая попадется на экзамене. Я расскажу вам, как легко их запомнить.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Атомный радиус
Важной характеристикой атома является его размер, т. е. атомный радиус. Размер отдельного атома не определен, поскольку внешняя его граница размыта за счет вероятностного нахождения электронов в различных точках околоядерного пространства. В силу этого, в зависимости от типа связи между атомами различают металлические, ковалентные, ван-дер-ваальсовы, ионные и др. атомные радиусы.
«Металлические» радиусы (rme) найдены путем деления пополам кратчайших межатомных расстояний в кристаллических структурах простых веществ с координационным числом 12. При других значениях к.ч. учитывается необходимая поправка.
Значения ковалентных радиусов (rcov) рассчитаны как половина длины гомоатомной связи. В случае невозможности определить длину одинарной гомоатомной связи, значение rcov атома элемента A получают вычитанием ковалентного радиуса атома элемента B из длины гетероатомной связи A-B. Ковалентные радиусы зависят, главным образом, от размеров внутренней электронной оболочки.
Длина связи дана в ангстремах (1 Å = 0.1 нм = 100 пм).
| Элемент | rme | rcov | rw | rcmp |
| H | 0.46 | 0.37 | 1.20 | 0.25 |
| He | 1.22 | 0.32 | 1.40 | — |
| Li | 1.55 | 1.34 | 1.82 | 1.45 |
| Be | 1.13 | 0.90 | — | 1.05 |
| B | 0.91 | 0.82 | — | 0.85 |
| C | 0.77 | 0.77 | 1.70 | 0.70 |
| N | 0.71 | 0.75 | 1.55 | 0.65 |
| O | — | 0.73 | 1.52 | 0.60 |
| F | — | 0.71 | 1.47 | 0.50 |
| Ne | 1.60 | 0.69 | 1.54 | — |
| Na | 1.89 | 1.54 | 2.27 | 1.80 |
| Mg | 1.60 | 1.30 | 1.73 | 1.50 |
| Al | 1.43 | 1.18 | — | 1.25 |
| Si | 1.34 | 1.11 | 2.10 | 1.10 |
| P | 1.30 | 1.06 | 1.80 | 1.00 |
| S | — | 1.02 | 1.80 | 1.00 |
| Cl | — | 0.9 | 1.75 | 1.00 |
| Ar | 1.92 | 0.97 | 1.88 | — |
| K | 2.36 | 1.96 | 2.75 | 2.20 |
| Ca | 1.97 | 1.74 | — | 1.80 |
| Sc | 1.64 | 1.44 | — | 1.60 |
| Ti | 1.46 | 1.36 | — | 1.40 |
| V | 1.34 | 1.25 | — | 1.35 |
| Cr | 1.27 | 1.27 | — | 1.40 |
| Mn | 1.30 | 1.39 | — | 1.40 |
| Fe | 1.26 | 1.25 | — | 1.40 |
| Co | 1.25 | 1.26 | — | 1.35 |
| Ni | 1.24 | 1.21 | 1.63 | 1.35 |
| Cu | 1.28 | 1.38 | 1.40 | 1.35 |
| Zn | 1.39 | 1.31 | 1.39 | 1.35 |
| Ga | 1.39 | 1.26 | 1.87 | 1.30 |
| Ge | 1.39 | 1.22 | — | 1.25 |
| As | 1.48 | 1.19 | 1.85 | 1.15 |
| Se | 1.60 | 1.16 | 1.90 | 1.15 |
| Br | — | 1.14 | 1.85 | 1.15 |
| Kr | 1.98 | 1.10 | 2.02 | — |
| Rb | 2.48 | 2.11 | — | 2.35 |
| Sr | 2.15 | 1.92 | — | 2.00 |
| Y | 1.81 | 1.62 | — | 1.80 |
| Zr | 1.60 | 1.48 | — | 1.55 |
| Nb | 1.45 | 1.37 | — | 1.45 |
| Mo | 1.39 | 1.45 | — | 1.45 |
| Tc | 1.36 | 1.56 | — | 1.35 |
| Ru | 1.34 | 1.26 | — | 1.30 |
| Rh | 1.34 | 1.35 | — | 1.35 |
| Pd | 1.37 | 1.31 | 1.63 | 1.40 |
| Ag | 1.44 | 1.53 | 1.72 | 1.60 |
| Cd | 1.56 | 1.48 | 1.58 | 1.55 |
| In | 1.66 | 1.44 | 1.93 | 1.55 |
| Sn | 1.58 | 1.41 | 2.17 | 1.45 |
| Te | 1.70 | 1.35 | 2.06 | 1.40 |
| I | — | 1.33 | 1.98 | 1.40 |
| Xe | 2.18 | 1.30 | 2.16 | — |
| Cs | 2.68 | 2.25 | — | 2.60 |
| Ba | 2.21 | 1.98 | — | 2.15 |
| La | 1.87 | 1.69 | — | 1.95 |
| Ce | 1.83 | — | — | 1.85 |
| Pr | 1.82 | — | — | 1.85 |
| Nd | 1.82 | — | — | 1.85 |
| Pm | — | — | — | 1.85 |
| Sm | 1.81 | — | — | 1.85 |
| Eu | 2.02 | — | — | 1.80 |
| Gd | 1.79 | — | — | 1.80 |
| Tb | 1.77 | — | — | 1.75 |
| Dy | 1.77 | — | — | 1.75 |
| Ho | 1.76 | — | — | 1.75 |
| Er | 1.75 | — | — | 1.75 |
| Tm | 1.74 | — | — | 1.75 |
| Yb | 1.93 | — | — | 1.75 |
| Lu | 1.74 | 1.60 | — | 1.75 |
| Hf | 1.59 | 1.50 | — | 1.55 |
| Ta | 1.46 | 1.38 | — | 1.45 |
| W | 1.40 | 1.46 | — | 1.35 |
| Re | 1.37 | 1.59 | — | 1.35 |
| Os | 1.35 | 1.28 | — | 1.30 |
| Ir | 1.35 | 1.37 | — | 1.35 |
| Pt | 1.38 | 1.28 | 1.75 | 1.35 |
| Au | 1.44 | 1.44 | 1.66 | 1.35 |
| Hg | 1.60 | 1.49 | 1.55 | 1.50 |
| Tl | 1.71 | 1.48 | 1.96 | 1.90 |
| Pb | 1.75 | 1.47 | 2.02 | 1.80 |
| Bi | 1.82 | 1.46 | — | 1.60 |
| Po | — | — | — | 1.90 |
| At | — | — | — | — |
| Rn | — | 1.45 | — | — |
| Fr | 2.80 | — | — | — |
| Ra | 2.35 | — | — | 2.15 |
| Ac | 2.03 | — | — | 1.95 |
| Th | 180 | — | — | 1.80 |
| Pa | 1.62 | — | — | 1.80 |
| U | 1.53 | — | 1.86 | 1.75 |
| Np | 1.50 | — | — | 1.75 |
| Pu | 1.62 | — | — | 1.75 |
| Am | — | — | — | 1.75 |
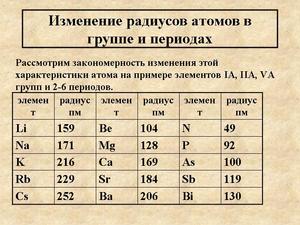
Общая тенденция изменения атомных радиусов такова. В группах атомные радиусы возрастают, так как с увеличением числа энергетических уровней увеличиваются размеры атомных орбиталей с большим значением главного квантового числа. Для d-элементов, в атомах которых заполняются орбитали предшествующего энергетического уровня, эта тенденция не имеет отчетливого характера при переходе от элементов пятого периода к элементам шестого периода.
В малых периодах радиусы атомов в целом уменьшаются, так как увеличение заряда ядра при переходе к каждому следующему элементу вызывает притяжение внешних электронов с возрастающей силой; число энергетических уровней в то же время остается постоянным.
Изменение атомного радиуса в периодах у d-элементов носит более сложный характер.
Атомный радиус: что такое и как определить
Чтобы разобраться в вопросе, что в современной науке называется радиусом атома, вспомним, что из себя представляет сам атом. По классическим представлениям в центре атома находится ядро, состоящее из протонов и нейтронов, а вокруг ядра каждый на своей орбите вращаются электроны.
Радиус атома в физике
Поскольку в данной модели строения атома электроны являются пространственно ограниченными частицами, т. е. корпускулами, логично считать атомным радиусом (а. р.) расстояние от его ядра до самой дальней, или внешней, орбиты, по которой вращаются так называемые валентные электроны.
Однако по современным, квантовомеханическим представлениям, определить данный параметр нельзя так однозначно, как это делается в классической модели. Здесь электроны уже не представляются в виде частиц-корпускул, а получают свойства волн, т. е. пространственно-неограниченных объектов. В такой модели точно определить положение электрона просто невозможно. Здесь эта частица уже представляется в виде электронной орбитали, плотность которой меняется, в зависимости от расстояния до ядра атома.
Итак, в современной модели строения атома его радиус нельзя определить однозначно. Поэтому в квантовой физике, общей химии, физике твердого тела и других смежных науках эту величину сегодня определяют как радиус сферы, в центре которой находится ядро, внутри которой сосредоточено 90-98% плотности электронного облака. Фактически это расстояние и определяет границы атома.
Если рассмотреть Периодическую таблицу химических элементов (таблицу Менделеева), в которой приведены атомные радиусы, можно увидеть определенные закономерности, которые выражаются в том, что в пределах периода эти числа уменьшаются слева направо, а в пределах группы они увеличиваются сверху вниз. Такие закономерности объясняются тем, что внутри периода при движении слева направо заряд атома возрастает, что увеличивает силу притяжения им электронов, а при движении внутри группы сверху вниз все больше заполняется электронных оболочек.
Атомный радиус в химии и кристаллографии
Какие бывают виды
Данная характеристика сильно варьируется, в зависимости от того, в какой химической связи состоит атом. Поскольку все вещества в природе в подавляющем своем большинстве состоят из молекул, понятие а. р. используют для определения межатомных расстояний в молекуле. А данная характеристика зависит от свойств входящих в молекулу атомов, т. е. их положения в Периодической системе химических элементов. Обладая разными физическими и химическими свойствами, молекулы образуют все огромное разнообразие веществ.
По сути, эта величина очерчивает сферу действия силы электрического притяжения ядра атома и его внешних электронных оболочек. За пределами этой сферы в действие вступает сила электрического притяжения соседнего атома. Существует несколько типов химической связи атомов в молекуле:
Соответственно этим связям таким же будет и атомный радиус.
Как зависит от типа химической связи
При ковалентной связи АР определяется как половина расстояния между соседними атомами в одинарной химической связи Х—Х, причем Х — это неметалл, ибо данная связь свойственна неметаллам. Например, для галогенов ковалентный радиус будет равен половине межъядерного расстояния Х—Х в молекуле Х2, для молекул селена Se и серы S — половине расстояния Х—Х в молекуле Х8, для углерода С он будет равен половине кратчайшего расстояния С—С в кристалле алмаза.
Данная химическая связь обладает свойством аддитивности, т. е. суммирования, что позволяет определять межъядерные расстояния в многоатомных молекулах. Если связь в молекуле двойная или тройная, то ковалентный АР уменьшается, т. к. длины кратных связей меньше одинарных.
При ионной связи, образующейся в ионных кристаллах, используют значения ионного АР для определения расстояния между ближайшими анионом и катионом, находящимися в узлах кристаллической решетки. Такое расстояние определяется как сумма радиусов этих ионов.
Существует несколько способов определения ионных радиусов, при которых отличаются значения у индивидуальных ионов. Но в результате эти способы дают примерно одинаковые значения межъядерных расстояний. Эти способы или системы были названы в честь ученых, проводивших в этой области соответствующие исследования:
При металлической связи, возникающей в кристаллах металлов, АР принимаются равными половине кратчайшего расстояния между ними. Металлический радиус зависит от координационного числа К. При К=12 его значение условно принимается за единицу. Для координационных чисел 4, 6 и 8 металлические радиусы одного и того же элемента соответственно будут равны 0.88, 0.96 и 0.98.
Если взять два разных металла и сравнить металлические радиусы их элементов, то близость этих значений друг к другу будет означать необходимое, но недостаточное условие взаимной растворимости этих металлов по типу замещения. Например, жидкие калий К и литий Li в обычных условиях не смешиваются и образуют два жидких слоя, потому что их металлические радиусы сильно различаются (0.236 нм и 0.155 нм соответственно), а калий К с цезием Cs образуют твердый раствор благодаря близости их радиусов (0.236 нм и 0.268 нм).
Ван-дер-ваальсовы АР используют для определения эффективных размеров атомов благородных газов, а также расстояний между ближайшими одноименными атомами, принадлежащими разным молекулам и не связанными химической связью (пример — молекулярные кристаллы). Если такие атомы сблизятся на расстояние, меньшее суммы их ван-дер-ваальсовых радиусов, между ними возникнет сильное межатомное отталкивание. Эти радиусы определяют минимально допустимые границы контакта двух атомов, принадлежащих соседним молекулам.
Кроме того, данные АР используют для определения формы молекул, их конформаций и упаковки в молекулярных кристаллах. Известен принцип «плотной упаковки», когда молекулы, образующие кристалл, входят друг в друга своими «выступами» и «впадинами». На основе этого принципа интерпретируются данные кристаллографии и предсказываются структуры молекулярных кристаллов.
Видео
Это полезное видео поможет вам понять, что такое радиус атома.
Атомный радиус, как он измеряется, как он изменяется в периодической таблице, примеры
атомный радиус это важный параметр для периодических свойств элементов таблицы Менделеева. Это напрямую связано с размером атомов, поскольку на большем радиусе они больше или громоздче. Кроме того, это связано с электронными характеристиками того же.
Пока атом имеет больше электронов, тем больше его размер и атомный радиус. Оба определяются электронами валентной оболочки, потому что на расстояниях за пределами их орбит вероятность обнаружения электрона приближается к нулю. В окрестности ядра происходит обратное: увеличивается вероятность нахождения электрона.
Верхнее изображение представляет собой упаковку ватных шариков. Обратите внимание, что каждый из них окружен шестью соседями, не считая другого возможного верхнего или нижнего ряда. Способ уплотнения ватных шариков будет определять их размеры и, следовательно, их радиусы; как это происходит с атомами.
Элементы в соответствии с их химической природой так или иначе взаимодействуют со своими собственными атомами. Следовательно, величина атомного радиуса варьируется в зависимости от типа присутствующей связи и твердой упаковки ее атомов..
Как измеряется атомный радиус?
На основном изображении можно легко измерить диаметр ватных шариков, а затем разделить его на два. Однако сфера атома не полностью определена. Почему? Потому что электроны циркулируют и диффундируют в определенных областях пространства: орбитали.
Поэтому атом можно рассматривать как сферу с неощутимыми краями, о которых невозможно точно сказать, в какой степени они заканчиваются. Например, на верхнем изображении центральная область около ядра выглядит более интенсивной, а ее края размыты.
Изображение представляет двухатомную молекулу E2 (как Cl2, H2, О2, и т.д.). Предполагая, что атомы являются сферическими телами, если расстояние было определено d что разделяет оба ядра в ковалентной связи, то было бы достаточно разделить его на две половины (d/ 2) получить атомный радиус; точнее, ковалентный радиус E для E2.
А если Е не образует с собой ковалентных связей, но это металлический элемент? то d это будет указано числом соседей, которые окружают Е в его металлической структуре; то есть по координационному числу (N.C) атома в упаковке (помните ватные шарики основного изображения).
Определение межъядерного расстояния
Определить d, это межъядерное расстояние для двух атомов в молекуле или упаковке, это требует методов физического анализа.
Одной из наиболее часто используемых является дифракция рентгеновских лучей, в которой пучок света облучается через кристалл, и изучается дифракционная картина, возникающая в результате взаимодействия электронов с электромагнитным излучением. В зависимости от упаковки могут быть получены различные дифракционные картины и, следовательно, другие значения d.
Если атомы «плотно» в кристаллической решетке, они будут представлять разные значения d по сравнению с тем, что они имели бы, если бы они были «удобными». Кроме того, эти межъядерные расстояния могут колебаться в значениях, поэтому атомный радиус фактически состоит из среднего значения таких измерений.
Как связаны атомный радиус и координационное число? В. Гольдшмидт установил взаимосвязь между ними, в которой для N.C. из 12 относительное значение равно 1; от 0,97 для упаковки, где атом имеет N.C, равный 8; 0,96 для N.C, равного 6; и 0,88 для N.C. из 4.
единицы
Из значений для N.C, равных 12, было построено много таблиц, сравнивающих атомные радиусы всех элементов периодической таблицы..
Поскольку не все элементы образуют такие компактные структуры (N.C меньше 12), соотношение В. Гольдшмидта используется для расчета их атомных радиусов и выражения для одной и той же упаковки. Таким образом, измерения атомных радиусов стандартизированы.
Как это меняется в периодической таблице?
На протяжении периода
Слева направо в тот же период, ядро добавляет протоны и электроны, но последние ограничены тем же уровнем энергии (главное квантовое число). Как следствие, ядро оказывает увеличивающийся эффективный заряд ядра на валентные электроны, который сжимает атомный радиус..
Таким образом, неметаллические элементы в тот же период имеют тенденцию иметь атомные (ковалентные) радиусы меньше, чем металлы (металлические радиусы).
По убыванию группой
При спуске по группе включаются новые уровни энергии, которые позволяют электронам иметь больше места. Таким образом, электронное облако преодолевает большие расстояния, его размытая периферия все больше отдаляется от ядра, и, следовательно, радиус атома расширяется.
Сокращение лантаноидов
Электроны внутреннего слоя помогают экранировать эффективный заряд ядра на валентных электронах. Когда орбитали, составляющие внутренние слои, имеют много «дырок» (узлов), как и в случае f-орбиталей, ядро сильно сжимает атомный радиус из-за плохого экранирующего эффекта орбиталей..
Этот факт подтверждается сокращением лантаноидов в период 6 периодической таблицы. От La до Hf происходит значительное сжатие атомного радиуса, создаваемого орбиталями f, которые «заполняются» при прохождении через блок f: у лантаноидов и актиноидов.
Аналогичный эффект можно наблюдать и с элементами блока p периода 4. На этот раз произведение слабого экранирующего эффекта орбиталей d, которые заполняются при пересечении периодов переходных металлов..
примеров
Для периода 2 периодической таблицы атомные радиусы ее элементов:
-Быть: 112 вечера
Обратите внимание, что металлический литий имеет наибольший атомный радиус (257 мкм), в то время как фтор, расположенный в крайней правой части периода, является наименьшим из них (64 мкм). Атомный радиус уменьшается слева направо за тот же период, и перечисленные значения показывают его.
Литий, образуя металлические связи, его радиус металлический; и фтор, поскольку он образует ковалентные связи (F-F), его радиус является ковалентным.
А если вы хотите выразить атомные радиостанции в единицах ангстрема? Просто разделите их на 100: (257/100) = 2,57Å. И так далее с остальными ценностями.
Радиус атома
Содержание
Оценка радиуса атома
Согласно квантовой механике, атомы не имеют четких границ, но вероятность найти электрон, связанный с ядром данного атома, на определенном расстоянии от этого ядра быстро убывает с увеличением расстояния. Поэтому атому приписывают некоторый определённый радиус, полагая, что в сфере этого радиуса заключена подавляющая часть электронной плотности (порядка 90 процентов).
Радиус атома и межъядерные расстояния
Во многих случаях кратчайшее расстояние между двумя атомами действительно примерно равно сумме соответствующих атомных радиусов. В зависимости от типа связи между атомами различают металлические, ионные, ковалентные и некоторые другие атомные радиусы.
См. также
Ссылки
Полезное
Смотреть что такое «Радиус атома» в других словарях:
радиус атома — atomo spindulys statusas T sritis fizika atitikmenys: angl. atomic radius vok. Atomradius, m rus. атомный радиус, m; радиус атома, m pranc. rayon atomique, m; rayon de l’atome, m … Fizikos terminų žodynas
АТОМА СТРОЕНИЕ — раздел физики, изучающий внутреннее устройство атомов. Атомы, первоначально считавшиеся неделимыми, представляют собой сложные системы. Они имеют массивное ядро, состоящее из протонов и нейтронов, вокруг которого в пустом пространстве движутся… … Энциклопедия Кольера
Радиус Ван-дер-Ваальса — Ван дер ваальсовы радиусы определяют эффективные размеры атомов благородных газов. Кроме того, ван дер ваальсовыми радиусами считают половину межъядерного расстояния между ближайшими одноимёнными атомами, не связанными между собой химической… … Википедия
атомный радиус — atomo spindulys statusas T sritis fizika atitikmenys: angl. atomic radius vok. Atomradius, m rus. атомный радиус, m; радиус атома, m pranc. rayon atomique, m; rayon de l’atome, m … Fizikos terminų žodynas
БОРОВСКИЙ РАДИУС — радиус а 0 первой (ближайшей к ядру) орбиты электрона в атоме водорода, согласно теории атома Н. Бора (1913); а 0= 5,2917706(44)*10 11 м. В квантовомех. теории атома Б. р. соответствует расстояние от ядра, на к ром с Наиб. вероятностью можно… … Химическая энциклопедия
Бора радиус — радиус первой (ближайшей к ядру) орбиты электрона в атоме водорода, согласно теории атома Н. Бора; обозначается символом a0 или a. Б. р. равен (5,29167±0,00007)×10 9см = 0,529 Å; выражается через универсальные постоянные: а0 = ћ2/me2, где … Большая советская энциклопедия
БОРОВСКИЙ РАДИУС — радиус ао первой (ближайшей к ядру) орбиты электрона в атоме водорода, согласно теории строения атома Н. Бора (1913); а0 = 0,529 х 10 10 м = 0,529 А … Естествознание. Энциклопедический словарь
Боровская модель атома — Боровская модель водородоподобного атома (Z заряд ядра), где отрицательно заряженный электрон заключен в атомной оболочке, окружающей малое, положительно заряженное атомное ядро … Википедия
Атомный радиус: как его измеряют, как он меняется и примеры
Видео: Атомный радиус: как его измеряют, как он меняется и примеры
Содержание:
В атомное радио это важный параметр для периодических свойств элементов таблицы Менделеева. Это напрямую связано с размером атомов, поскольку чем больше радиус, тем они больше или объемнее. Точно так же это связано с их электронными характеристиками.
Чем больше в атоме электронов, тем больше его атомный размер и радиус. Оба они определяются электронами валентной оболочки, поскольку на расстояниях за пределами их орбит вероятность найти электрон приближается к нулю. Вблизи ядра происходит обратное: вероятность найти электрон увеличивается.
Верхнее изображение представляет собой упаковку ватных шариков. Обратите внимание, что каждый из них окружен шестью соседями, не считая другого возможного верхнего или нижнего ряда.То, как уплотняются ватные шарики, определяет их размеры и, следовательно, их радиус; так же, как с атомами.
Элементы в соответствии с их химической природой так или иначе взаимодействуют со своими атомами. Следовательно, величина атомного радиуса меняется в зависимости от типа присутствующей связи и твердой упаковки ее атомов.
Как измеряется атомный радиус?
На основном изображении можно легко измерить диаметр ватных шариков, а затем разделить его на два. Однако сфера атома полностью не определена. Зачем? Потому что электроны циркулируют и диффундируют в определенных областях пространства: орбиталях.
Поэтому атом можно рассматривать как сферу с неосязаемыми краями, по которым невозможно точно сказать, насколько далеко они заканчиваются. Например, на изображении выше область центра, близкая к ядру, имеет более интенсивный цвет, а ее края размыты.
Изображение представляет собой двухатомную молекулу E2 (как Cl2, H2, ИЛИ2, так далее.). Предполагая, что атомы представляют собой сферические тела, если бы расстояние было определено d который разделяет оба ядра ковалентной связью, тогда достаточно было бы разделить его на две половины (d/ 2) для получения атомного радиуса; точнее, ковалентный радиус от E до E2.
Что, если бы E не образовывал ковалентных связей с самим собой, а был бы металлическим элементом? Так d на это указывает количество соседей, окружающих E в его металлической структуре; то есть по координационному числу (N.C) атома внутри упаковки (вспомните ватные шарики на основном изображении).
Определение межъядерного расстояния
Чтобы определить d, которое представляет собой межъядерное расстояние для двух атомов в молекуле или упаковке, требует методов физического анализа.
Одним из наиболее широко используемых является дифракция рентгеновских лучей, при которой луч света облучается через кристалл и изучается дифракционная картина, возникающая в результате взаимодействия электронов с электромагнитным излучением. В зависимости от упаковки могут быть получены разные дифракционные картины и, следовательно, другие значения d.
Если атомы «плотно» в кристаллической решетке, они будут иметь разные значения d по сравнению с тем, что они имели бы, будь они «удобными». Кроме того, эти межъядерные расстояния могут колебаться в значениях, поэтому атомный радиус фактически является средним значением таких измерений.
Как связаны атомный радиус и координационное число? В. Гольдшмидт установил взаимосвязь между ними, в которой для N.C, равного 12, относительное значение равно 1; 0,97 для упаковки, в которой N.C атома равно 8; 0,96 для N.C, равного 6; и 0,88 для Н.З. 4.
Единицы
Начиная со значений N.C, равных 12, было построено множество таблиц, в которых сравниваются атомные радиусы всех элементов периодической таблицы.
Поскольку не все элементы образуют такие компактные структуры (N.C менее 12), соотношение В. Гольдшмидта используется для вычисления их атомных радиусов и выражения их для одной и той же упаковки. Таким образом стандартизируются измерения атомного радиуса.
Как это меняется в периодической таблице?
За период
Таким образом, неметаллические элементы в один и тот же период, как правило, имеют меньшие атомные (ковалентные) радиусы, чем металлы (металлические радиусы).
Спуск по группе
Когда вы спускаетесь по группе, активируются новые уровни энергии, которые позволяют электронам иметь больше места. Таким образом, электронное облако покрывает большие расстояния, его размытая периферия в конечном итоге удаляется от ядра, и, следовательно, атомный радиус увеличивается.
Сокращение лантаноидов
Электроны во внутренней оболочке помогают защитить эффективный заряд ядра от валентных электронов. Когда орбитали, составляющие внутренние слои, имеют много «дыр» (узлов), как это происходит с f-орбиталями, ядро сильно сокращает атомный радиус из-за их плохого экранирующего эффекта.
Об этом свидетельствует сокращение лантаноидов в периоде 6 периодической таблицы. От La до Hf происходит значительное сокращение атомного радиуса в результате f-орбиталей, которые «заполняются» по мере прохождения f-блока: это лантана и актиноидов.
Аналогичный эффект можно наблюдать и с элементами p-блока из периода 4. На этот раз в результате слабого экранирующего эффекта d-орбиталей, которые заполняются при прохождении через периоды переходных металлов.
Примеры
Для периода 2 периодической таблицы атомные радиусы ее элементов равны:
Обратите внимание, что металлический литий имеет самый большой атомный радиус (257 пм), а фтор, расположенный в крайнем правом углу периода, является самым маленьким из них (64 пм). За тот же период атомный радиус спускается слева направо, и приведенные значения подтверждают это.
Литий при образовании металлических связей его радиус металлический; и фтор, поскольку он образует ковалентные связи (F-F), его радиус ковалентен.
Что, если вы хотите выразить атомные радиусы в единицах ангстрема? Просто разделите их на 100: (257/100) = 2,57Å. И так далее с остальными ценностями.
Ссылки
10 крупнейших планет Вселенной
Малибу (напиток): история, дистилляция и рецепты
Радиус атома
Из Википедии — свободной энциклопедии
Электроны не имеют четко определённых орбит или границ. Скорее, их положения могут быть описаны как распределения вероятностей, которые постепенно сужаются по мере удаления от ядра без резкого сокращения. Кроме того, в конденсированном веществе и молекулах электронные облака атомов обычно в некоторой степени перекрываются, и некоторые из электронов могут перемещаться в области, охватывающей два или более атомов («принадлежать» нескольким атомам одновременно).
Во многих случаях форма атома может быть аппроксимирована сферой. Это лишь грубое приближение, но оно может дать количественные представления и выступить в качестве базовой модели для описания для многих явлений, таких как плотность жидкостей и твердых веществ, диффузия жидкостей через молекулярные сита, расположение атомов и ионов в кристаллах, а также размер и форма молекул.
Радиусы атомов изменяются, подчиняясь определённым закономерностям периодической таблицы химических элементов. Например, радиусы атомов обычно уменьшаются при перемещении слева направо вдоль каждого периода (строки) таблицы, от щелочных металлов до благородных газов, и возрастают по мере продвижения сверху вниз в каждой группе (столбце). Радиусы атомов резко возрастают при переходе между благородным газом в конце каждого периода и щелочным металлом в начале следующего периода. Эти тенденции изменения радиусов атомов (наряду с другими химическими и физическими свойствами элементов) могут быть объяснены с точки зрения теории электронной оболочки атома, а также представляют доказательства подтверждения квантовой теории. Радиусы атомов уменьшаются в периодической таблице, потому что с увеличением атомного номера увеличивается число протонов в атоме, а дополнительные электроны добавляются в одну и ту же квантовую оболочку. Следовательно, эффективный заряд атомного ядра по отношению к внешним электронам увеличивается, притягивая внешние электроны. В результате электронное облако сжимается и атомный радиус уменьшается.
АТОМНЫЕ РАДИУСЫ
Ван-дер-ваальсовы радиусы определяют эффективные размеры атомов благородных газов. Считают также, что эти радиусы равны половине межъядерного расстояния между ближайшими одинаковыми атомами, не связанными между собой хим. связью, т.е. принадлежащими разным молекулам, напр. в молекулярных кристаллах. Значения ван-дер-ваальсовых радиусов находят, пользуясь принципом аддитивности атомных радиусов, из кратчайших контактов соседних молекул в кристаллах. В среднем они на
0,08 нм больше ковалентных радиусов. Знание ван-дер-ваальсовых радиусов позволяет определять конформацию молекул и их упаковку в молекулярных кристаллах. Энергетически выгодными обычно бывают такие конформации молекул, в к-рых перекрывание ван-дер-ваалъсовых радиусов валентно не связанных атомов невелико. Ван-дер-ваальсовы сферы валентно связанных атомов в пределах одной молекулы перекрываются. Внеш. контур перекрывающихся сфер определяет форму молекулы. Молекулярные кристаллы подчиняются принципу плотной упаковки, согласно к-рому молекулы, моделируемые своим «ван-дер-ваальсовым окаймлением», располагаются т. обр., что «выступы» одной молекулы входят во «впадины» другой. Пользуясь этими представлениями, можно интерпретировать кристаллографич. данные, а в ряде случаев и предсказывать структуру молекулярных кристаллов.
===
Исп. литература для статьи «АТОМНЫЕ РАДИУСЫ» : Боки и Г. Б., Кристаллохимия, 3 изд., М., 1971, с. 136-41; Полинг Л., По лин г П., Химия, пер. с англ., М., 1978; Современная кристаллография, т. 2, М., 1979, с. 67-88. В. Г. Дашевский.
Страница «АТОМНЫЕ РАДИУСЫ» подготовлена по материалам химической энциклопедии.
атомные радиусы
Полезное
Смотреть что такое «атомные радиусы» в других словарях:
АТОМНЫЕ РАДИУСЫ — хар ки атомов, позволяющие приближённо оценивать межатомные (межъядерные) расстояния в молекулах и кристаллах. Атомы не имеют чётких границ, однако, согласно представлениям квант. механики, вероятность найти эл н на определ. расстоянии от ядра… … Физическая энциклопедия
АТОМНЫЕ РАДИУСЫ — характеристики, позволяющие приближенно оценивать межатомные (межъядерные) расстояния в молекулах и кристаллах. Определяются главным образом из данных рентгеновского структурного анализа … Большой Энциклопедический словарь
АТОМНЫЕ РАДИУСЫ — эффективные характеристики атомов, позволяющие приближенно оценивать межатомное (межъядерное) расстояние в молекулах и кристаллах. Согласно представлениям квантовой механики, атомы не имеют четких границ, однако вероятность найти электрон,… … Химическая энциклопедия
Атомные радиусы — характеристики атомов, позволяющие приблизительно оценивать межатомные расстояния в веществах. Согласно квантовой механике, атом не имеет определённых границ, но вероятность найти электрон на данном расстоянии от ядра атома, начиная с… … Большая советская энциклопедия
АТОМНЫЕ РАДИУСЫ — характеристики, позволяющие приближённо оценивать межатомные (межъядерные) расстояния в молекулах и кристаллах. А. р. имеют порядок 0,1 нм. Определяются гл. обр. из данных рентгеновского структурного анализа … Естествознание. Энциклопедический словарь
РАДИУСЫ ИОННО-АТОМНЫЕ (ОРБИТАЛЬНЫЕ) — система размеров атомов, предложенная Лебедевым в 1966г., исходящая из рассчитанных на основе квантовой механики орбитальных радиусов Уэбера, и Кровера (Waber, Grower, 1965) и волновых функций от гелия до аргона (Братцев, 1966), а также из… … Геологическая энциклопедия
ВАН-ДЕР-ВААЛЬСОВЫ РАДИУСЫ — ВАН ДЕР ВААЛЬСОВЫ РАДИУСЫ, см. в ст. Атомные радиусы (см. АТОМНЫЕ РАДИУСЫ) … Энциклопедический словарь
ВАН-ДЕР-ВААЛЬСОВЫ РАДИУСЫ — см. Атомные радиусы … Химическая энциклопедия
ИОННЫЕ РАДИУСЫ — см. Атомные радиусы … Химическая энциклопедия
КОВАЛEНТНЫЕ РАДИУСЫ — см. Атомные радиусы … Химическая энциклопедия
Электроны не имеют определенных орбит или четко определенных диапазонов. Скорее их положения должны быть описаны как распределения вероятностей, которые постепенно сужаются по мере удаления от ядра без резкого ограничения; их называют атомными орбиталями или электронными облаками. Более того, в конденсированных средах и молекулах электронные облака атомов обычно до некоторой степени перекрываются, и некоторые электроны могут перемещаться по большой области, охватывающей два или более атомов.
СОДЕРЖАНИЕ
История
Определения
Широко используемые определения атомного радиуса включают:
Эмпирически измеренный атомный радиус
| Группа (столбец) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
| Период (строка) | |||||||||||||||||||
| 1 | H 25 | Он | |||||||||||||||||
| 2 | Ли 145 | Быть 105 | В 85 | С 70 | № 65 | O 60 | П 50 | Ne | |||||||||||
| 3 | Na 180 | Мг 150 | Al 125 | Si 110 | P 100 | S 100 | Cl 100 | Ar | |||||||||||
| 4 | К 220 | Около 180 | Сбн 160 | Ti 140 | V 135 | Кр 140 | Пн 140 | Fe 140 | Co 135 | Ni 135 | Cu 135 | Zn 135 | Ga 130 | Ge 125 | Как 115 | Пн 115 | Br 115 | Kr | |
| 5 | 235 руб. | Sr 200 | Y 180 | Zr 155 | Nb 145 | Пн 145 | Tc 135 | Ru 130 | Rh 135 | Pd 140 | Ag 160 | CD 155 | В 155 г. | Sn 145 | Сб 145 | Te 140 | Я 140 | Xe | |
| 6 | CS 260 | Ba 215 | * | Lu 175 | Hf 155 | Ta 145 | W 135 | Re 135 | Os 130 | Ir 135 | Пт 135 | Au 135 | Hg 150 | Tl 190 | Pb 180 | Би 160 | Po 190 | В | Rn |
| 7 | Пт | Ra 215 | ** | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Ур. | Ц | Og |
| * | La 195 | CE 185 | Pr 185 | Nd 185 | PM 185 | См 185 | Eu 185 | Gd 180 | ТБ 175 | Dy 175 | Ho 175 | Er 175 | ТМ 175 | Yb 175 | |||||
| ** | Ac 195 | Чт 180 | Па 180 | U 175 | Np 175 | Pu 175 | Am 175 | См | Bk | Cf | Es | FM | Мкр | Нет |
Объяснение общих тенденций
То, как атомный радиус изменяется с увеличением атомного номера, можно объяснить расположением электронов в оболочках фиксированной емкости. Оболочки обычно заполняются в порядке увеличения радиуса, поскольку отрицательно заряженные электроны притягиваются положительно заряженными протонами в ядре. По мере увеличения атомного номера вдоль каждой строки периодической таблицы дополнительные электроны переходят в ту же самую внешнюю оболочку; радиус которого постепенно сужается из-за увеличения заряда ядра. В благородном газе самая внешняя оболочка полностью заполнена; следовательно, дополнительный электрон следующего щелочного металла перейдет в следующую внешнюю оболочку, учитывая внезапное увеличение атомного радиуса.
Возрастающий заряд ядра частично уравновешивается увеличением количества электронов, явление, известное как экранирование ; что объясняет, почему размер атомов обычно увеличивается вниз по каждому столбцу. Однако есть одно примечательное исключение, известное как сжатие лантаноидов : 5d-блок элементов намного меньше, чем можно было бы ожидать, из-за слабого экранирования 4f-электронов.
По сути, атомный радиус уменьшается через периоды из-за увеличения количества протонов. Следовательно, существует большее притяжение между протонами и электронами, потому что противоположные заряды притягиваются, и большее количество протонов создает более сильный заряд. Более сильное притяжение притягивает электроны ближе к протонам, уменьшая размер частицы. Следовательно, атомный радиус уменьшается. Вниз по группам атомный радиус увеличивается. Это потому, что существует больше уровней энергии и, следовательно, большее расстояние между протонами и электронами. Кроме того, электронная защита снижает притяжение, поэтому оставшиеся электроны могут уходить дальше от положительно заряженного ядра. Следовательно, размер или атомный радиус увеличивается.
В следующей таблице приведены основные явления, влияющие на атомный радиус элемента:
Сокращение лантаноидов
Из-за сокращения лантаноидов можно сделать 5 следующих наблюдений:
сокращение d-блока
Расчетные атомные радиусы
В следующей таблице показаны атомные радиусы, рассчитанные на основе теоретических моделей, опубликованных Энрико Клементи и другими в 1967 году. Значения даны в пикометрах (пм).
Атомные радиусы
Определение атомных радиусов также связано с некоторыми проблемами. Во-первых, атом не является сферой со строго определенными поверхностью и радиусом. Напомним, что атом представляет собой ядро, окруженное облаком электронов. Вероятность обнаружения электрона по мере удаления от ядра постепенно возрастает до некоторого максимума, а затем постепенно уменьшается, но становится равной нулю только на бесконечно большом расстоянии. Во-вторых, если мы все же выберем некоторое условие для определения радиуса, такой радиус все равно нельзя будет измерить экспериментально.
Эксперимент позволяет определять только межъядерные расстояния, другими словами-длины связей (и то с определенными оговорками, приведенными в подписи к рис. 2.21). Для их определения используется рентгеноструктурный анализ или метод электронографии (основанный на дифракции электронов). Радиус атома полагают равным половине наименьшего межъядерного расстояния между одинаковыми атомами.
Вандерваальсовы радиусы. Для несвязанных между собой атомов половина наименьшего межъядерного расстояния называется вандерваальсовым радиусом. Это определение поясняет рис. 2.22.
Рис. 2.21. Длина связи. Вследствие того что молекулы непрерывно колеблются, межъядерное расстояние, или длина связи, не имеет фиксированного значения. Этот рисунок схематически изображает линейное колебание простой двухатомной молекулы. Колебания не позволяют определить длину связи просто как расстояние между центрами двух связанных атомов. Более точное определение выглядит так: длина связи это расстояние между связанными атомами, измеренное между центрами масс двух атомов и соответствующее минимуму энергии связи. Минимум энергии показан на кривой Морзе (см. рис. 2.1).
Ковалентные радиусы. Ковалентный радиус определяется как половина межъядерного расстояния (длины связи) между двумя одинаковыми атомами, связанными друг с другом ковалентной связью (рис. 2.22, б). В качестве примера возьмем молекулу хлора Cl2, длина связи в которой составляет 0,1988 нм. Ковалентный радиус хлора полагается равным 0,0944 нм.
Зная ковалентный радиус атома одного элемента, можно вычислить ковалентный радиус атома другого элемента. Например, экспериментально установленное значение длины связи С—Cl в CH3Cl равно 0,1767 нм. Вычитая из этого значения ковалентный радиус хлора (0,0994 нм), находим, что ковалентный радиус углерода равен 0,0773 нм. Такой метод вычисления основан на принципе аддитивности, согласно которому атомные радиусы подчиняются простому закону сложения. Таким образом, длина связи С—Cl представляет собой сумму ковалентных радиусов углерода и хлора. Принцип аддитивности применим только к простым ковалентным связям. Двойные и тройные ковалентные связи имеют меньшую длину (табл. 2.7).
Длина простой ковалентной связи зависит еще от ее окружения в молекуле. Например, длина связи С—H изменяется от 0,1070 нм у тризамещенного атома углерода до 0,115 нм в соединении CH3CN.
Металлические радиусы. Металлический радиус полагается равным половине межъядерного расстояния между соседними ионами в кристаллической решетке металла (рис. 2.22, в). Термин атомный радиус обычно относится к ковалентному радиусу атомов неметаллических элементов, а термин металлический радиус
к атомам металлических элементов.
Ионные радиусы. Ионный радиус-это одна из двух частей межъядерного расстояния между соседними одноатомными (простыми) ионами в кристаллическом ионном соединении (соли). Определение ионного радиуса тоже сопряжено с немалыми проблемами, поскольку экспериментально измеряют межионные расстояния, а не сами ионные радиусы. Межионные расстояния зависят от упаковки ионов в кристаллической решетке. На рис. 2.23 показаны три возможных способа упаковки ионов в кристаллической решетке. К сожалению, экспериментально измеренные межионные расстояния
Рис. 2.23. Ионные радиусы, с-анионы соприкасаются друг с другом, но катионы не соприкасаются с анионами; б-катионы соприкасаются с анионами, но анионы не соприкасаются друг с другом; в условно принятое расположение ионов, при котором катионы соприкасаются с анионами и анионы соприкасаются друг с другом. Расстояние а определяется экспериментально. Оно принимается за удвоенный радиус аниона. Это позволяет вычислить межионное расстояние b, представляющее собой сумму радиусов аниона и катиона. Зная межионное расстояние Ь, можно вычислить радиус катиона.
не позволяют судить о том, какой из этих трех способов упаковки действительно осуществляется в каждом конкретном случае. Проблема заключается в том, чтобы найти пропорцию, в которой следует разделить межионное расстояние на две части, соответствующие радиусам двух ионов, другими словами, решить, где же на самом деле кончается один ион и где начинается другой. Как показывает, например, рис. 2.12, этот вопрос не позволяют решить и карты электронной плотности солей. Для преодоления указанной трудности обычно предполагают, что: 1) межионное расстояние представляет собой сумму двух ионных радиусов, 2) ионы имеют сферическую форму и 3) соседние сферы соприкасаются друг с другом. Последнее предположение соответствует способу упаковки ионов, изображенному на рис. 2.23, е. Если известен один ионный радиус, другие ионные радиусы можно вычислить на основании принципа аддитивности.
Таблица 2.8. Сопоставление атомных радиусов различных типов

АТОМНЫЕ РАДИУСЫ
Ван-дер-ваальсовы радиусы определяют эффективные размеры атомов благородных газов. Считают также, что эти радиусы равны половине межъядерного расстояния между ближайшими одинаковыми атомами, не связанными между собой хим. связью, т. е. принадлежащими разным молекулам, напр. в молекулярных кристаллах. Значения ван-дер-ваальсовых радиусов находят, пользуясь принципом аддитивности А. р., из кратчайших контактов соседних молекул в кристаллах. В среднем они на
0,08 нм больше ковалентных радиусов. Знание ван-дер-ваальсовых радиусов позволяет определять конформацию молекул и их упаковку в молекулярных кристаллах. Энергетически выгодными обычно бывают такие конформации молекул, в к-рых перекрывание ван-дер-ваалъсовых радиусов валентно не связанных атомов невелико. Ван-дер-ваальсовы сферы валентно связанных атомов в пределах одной молекулы перекрываются. Внеш. контур перекрывающихся сфер определяет форму молекулы. Молекулярные кристаллы подчиняются принципу плотной упаковки, согласно к-рому молекулы, моделируемые своим «ван-дер-ваальсовым окаймлением», располагаются т. обр., что «выступы» одной молекулы входят во «впадины» другой. Пользуясь этими представлениями, можно интерпретировать кристаллографич. данные, а в ряде случаев и предсказывать структуру молекулярных кристаллов.
Лит.: Боки и Г. Б., Кристаллохимия, 3 изд., М., 1971, с. 136-41; Полинг Л., По лин г П., Химия, пер. с англ., М., 1978; Современная кристаллография, т. 2, М., 1979, с. 67-88. В. Г. Дашевский.
Полезное
Смотреть что такое «АТОМНЫЕ РАДИУСЫ» в других словарях:
АТОМНЫЕ РАДИУСЫ — хар ки атомов, позволяющие приближённо оценивать межатомные (межъядерные) расстояния в молекулах и кристаллах. Атомы не имеют чётких границ, однако, согласно представлениям квант. механики, вероятность найти эл н на определ. расстоянии от ядра… … Физическая энциклопедия
АТОМНЫЕ РАДИУСЫ — характеристики, позволяющие приближенно оценивать межатомные (межъядерные) расстояния в молекулах и кристаллах. Определяются главным образом из данных рентгеновского структурного анализа … Большой Энциклопедический словарь
атомные радиусы — характеристики, позволяющие приближённо оценивать межатомные (межъядерные) расстояния в молекулах и кристаллах. Атомные радиусы имеют порядок 0,1 нм. Определяются главным образом из данных рентгеновского структурного анализа. * * * АТОМНЫЕ… … Энциклопедический словарь
Атомные радиусы — характеристики атомов, позволяющие приблизительно оценивать межатомные расстояния в веществах. Согласно квантовой механике, атом не имеет определённых границ, но вероятность найти электрон на данном расстоянии от ядра атома, начиная с… … Большая советская энциклопедия
АТОМНЫЕ РАДИУСЫ — характеристики, позволяющие приближённо оценивать межатомные (межъядерные) расстояния в молекулах и кристаллах. А. р. имеют порядок 0,1 нм. Определяются гл. обр. из данных рентгеновского структурного анализа … Естествознание. Энциклопедический словарь
РАДИУСЫ ИОННО-АТОМНЫЕ (ОРБИТАЛЬНЫЕ) — система размеров атомов, предложенная Лебедевым в 1966г., исходящая из рассчитанных на основе квантовой механики орбитальных радиусов Уэбера, и Кровера (Waber, Grower, 1965) и волновых функций от гелия до аргона (Братцев, 1966), а также из… … Геологическая энциклопедия
ВАН-ДЕР-ВААЛЬСОВЫ РАДИУСЫ — ВАН ДЕР ВААЛЬСОВЫ РАДИУСЫ, см. в ст. Атомные радиусы (см. АТОМНЫЕ РАДИУСЫ) … Энциклопедический словарь
ВАН-ДЕР-ВААЛЬСОВЫ РАДИУСЫ — см. Атомные радиусы … Химическая энциклопедия
ИОННЫЕ РАДИУСЫ — см. Атомные радиусы … Химическая энциклопедия
КОВАЛEНТНЫЕ РАДИУСЫ — см. Атомные радиусы … Химическая энциклопедия
Как определить радиус атома
Под радиусом атома воспринимается расстояние между ядром данного атома и его самой далекой электронной орбитой. На сегодняшний день общепризнанной единицей измерения ядерного радиуса является пикометр(пм). Определить радиус атома дюже легко.
Вам понадобится
Инструкция
1. Первым делом, под рукой должна иметься обыкновенная таблица Менделеева, в которой по порядку расставлены все вестимые обществу химические элементы. Обнаружить эту таблицу дюже легко в любом справочнике по химии, школьном учебнике, либо же ее дозволено купить отдельно, в ближайшем книжном магазине.
Совет 2: Как определить радиус ядра
Инструкция
1. Одним из первых высказал предположение о существовании ядра британский химик и физик Генри Кавендиш в XVIII веке. Ему удалось вычислить массу и среднюю плотность Земли. Он сравнил плотность Земли с плотностью пород на поверхности. Было установлено, что поверхностная плотность гораздо ниже средней.
2. Немецким сейсмологом Э. Вихертом было подтверждено существование ядра Земли в 1897 году. Заокеанский геофизик Б. Гуттенберг в 1910 году определил глубину залегания ядра – 2900 км. По предположениям ученых, ядро состоит из сплава железа, никеля и других элементов, владеющих сродством к железу: золота, углерода, кобальта, германия и других.
3. Средний радиус ядра составляет 3500 километров. Помимо того, в строении ядра Земли выделяют твердое внутреннее ядро, имеющее радиус около 1300 километров, и жидкое внешнее радиус ом около 2200 километров. В центре ядра температура достигает 5000°C. Массу ядра оценивают примерно в 2•10^24 кг.
4. Дозволено провести параллель между строением планет и строением атома. В атоме также выдается центральная часть – ядро, причем в ядре сконцентрирована основная масса. Размеры ядерных ядер составляют несколько фемтометров (от лат. femto – 15). Приставка «фемто» обозначает домножение на десять в минус пятнадцатой степени. Таким образом, ядро атома в 10 тысяч раз поменьше самого атома, и в 10^21 раз поменьше размеров ядра Земли.
Видео по теме
Совет 3: Как определить массу атома
Вам понадобится
Инструкция
1. Определение массы атома твердого тела либо жидкости Для определения массы атома вещества, определите его природу (из каких атомов оно состоит). В таблице Менделеева обнаружьте ячейку, в которой описывается соответствующий элемент. Обнаружьте массу одного моля этого вещества в граммах на моль, которая находится в этой ячейке (это число соответствует массе атома в ядерных единицах массы). Поделите молярную массу вещества на 6,022•10^(23) (число Авогадро), итогом будет масса атома данного вещества в граммах. Дозволено определить массу атома и иным методом. Для этого ядерную массу вещества в ядерных единицах массы взятую в таблице Менделеева умножьте на число 1,66•10^(-24). Получите массу одного атома в граммах.
2. Определение массы атома газа В том случае, если в сосуде есть газ неведомой природы, определите его массу в граммах, взвесив пустой сосуд и сосуд с газом, и обнаружьте разность их масс. Позже этого измерьте объем сосуда с поддержкой линейки либо рулетки, с дальнейшим произведением расчетов либо другими способами. Итог выразите в кубических метрах. Манометром измерьте давление газа внутри сосуда в паскалях, и измерьте его температуру термометром. Если шкала термометра проградуирована в градусах Цельсия, определите значение температуры в Кельвинах. Для этого к значению температуры на шкале термометра прибавьте число 273.
3. Для определения массы молекулы газа массу данного объема газа умножьте на его температуру и число 8,31. Итог поделите на произведение давления газа, его объема и числа Авогадро 6,022•10^(23) (m0=m•8,31•T/(P•V•NА)). Итогом будет масса молекулы газа в граммах. В том случае, если вестимо, что молекула газа двухатомная (газ не инертный) получившееся число поделите на 2. Помножив итог на 1,66•10^(-24) дозволено получить его ядерную массу в ядерных единицах массы, и определить химическую формулу газа.
Видео по теме
Полезный совет
Стоит подметить, что радиус всякого атома обратно пропорционален числу протонов в его ядре, а также равен заряду его ядра.
Атомные радиусы.
Вследствие волнового характера движения
электронов атом не имеет строго определенных границ. За радиус атома принимается теоретически рассчитанное положение главного максимума плотности внешних электронных облаков.
Радиус атомов в периодах уменьшается. В больших периодах в пределах семейств d- и /-элементов наблюдается постепенное уменьшение радиусов. Это уменьшение называется соответственно (1- и /-сжатием.
Рис. 3.4. Зависимость орбитальных радиусов атомов от порядкового номера элементов
Окислительно-восстановительные свойства атомов элементов.
В периодах энергия ионизации увеличивается не монотонно, так как конфигурации s 2 и р 3 более устойчивы, для отрыва электрона в этих случаях требуется большая энергия ионизации (рис. 3.5). В группах с ростом радиуса атома энергия ионизации уменьшается, что легко объяснить с позиций закона Кулона: сила притяжения к ядру уменьшается обратно пропорционально квадрату расстояния между зарядами (чем дальше электрон от ядра, тем легче его оторвать). Самым низким значением энергии ионизации обладают щелочные металлы, самым высоким — благородные газы, у которых в устойчивой электронной конфигурации находится восемь электронов (сила взаимодействия зарядов пропорциональна их величине). В побочных подгруппах, в отличие от главных, восстановительные свойства элементов (сверху вниз) ослабевают из-за ^/-сжатия.
Рис. 35. Зависимость первой энергии ионизации от порядкового
номера элемента Z
В периодах энергия сродства к электрону растет, в группах падает. Наибольшие значения энергии сродства к электрону имеют галогены, кислород, сера, а наименьшие и даже отрицательные значения ее — элементы с электронной конфигурацией s 2 (He, Be, Mg, Zn), с полностью или наполовину заполненными ^-подуровнями (Ne, Аг, Кг).
Для характеристики окислительно-восстановительных свойств атомов вводится понятие электроотрицательное™. Электроотрицательность (ЭО) равна полусумме энергий ионизации и сродства к электрону:
Например, для фтора: ЭО(F) = ———= 1068(кДж/моль).
Для сравнения свойств различных элементов более удобно пользоваться относительной электроотрицательностью (ОЭО), которая показывает, во сколько раз ЭО элемента отличается от ЭО лития. ЭО лития принята за единицу. У фтора самая высокая ОЭО, она равна четырем. ОЭО характеризует способность атома притягивать к себе электроны. Чем выше значение ОЭО, тем сильнее окислительные свойства элемента и слабее восстановительные. В периодах ОЭО растет, в главных подгруппах — падает (приложение 12).
Как найти радиус атома
Периодический закон
Периодический закон был открыт Д.И. Менделеевым в 1868 году. Его современная формулировка: свойства химических элементов и образуемых ими соединений (простых и сложных) находятся в периодической зависимости от величины заряда атомного ядра.
Периодический закон лежит в основе современного учения о строении вещества. Периодическая система Д.И. Менделеева является наглядным отражением периодического закона.
В периодической таблице элементы расположены в порядке увеличения атомного заряда, группируются в “строки и столбцы” – периоды и группы.
Период – ряд горизонтально расположенных химических элементов. 1, 2 и 3 периоды называются малыми, они состоят из одного ряда элементов. 4, 5, 6 – называются большими периодами, они состоят из двух рядов химических элементов.
Группой называют вертикальный ряд химических элементов в периодической таблице. Элементы собраны в группы на основе степени окисления в высшем оксиде. Каждая из восьми групп состоит из главной подгруппы (а) и побочной подгруппы (б).
Периодическая таблица Д.И. Менделеева содержит колоссальное число ответов на самые разные вопросы. При умелом ее использовании вы сможете предполагать строение и свойства веществ, успешно писать химические реакции и решать задачи.
Радиус атома
Радиусом атома называют расстояние между атомным ядром и самой дальней электронной орбиталью. Это не четкая, а условная граница, которая говорит о наиболее вероятном месте нахождения электрона.
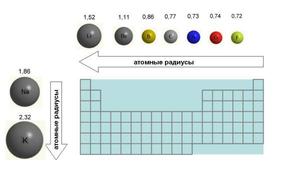
В периоде радиус атома уменьшается с увеличением порядкового номера элементов (“→” слева направо). Это связано с тем, что с увеличением номера группы увеличивается число электронов на внешнем уровне. Запомните, что для элементов главных подгрупп номер группы равен числу электронов на внешнем уровне.
С увеличением числа электронов они становятся более скученными, так как притягиваются друг к другу сильнее: это и есть причина маленького радиуса атома.
Чем меньше электронов, тем больше у них свободы и больше радиус атома, поэтому радиус увеличивается в периоде “←” справа налево.
В группе радиус атома увеличивается с увеличением заряда атомных ядер – сверху вниз “↓”. Чем больше период, тем больше электронных орбиталей вокруг атома, соответственно, и больше его радиус.
С уменьшением заряда атома в группе радиус атома уменьшается – снизу вверх “↑”. Это связано с уменьшением количества электронных орбиталей вокруг атома. Для примера возьмем атомы бора и алюминия, элементов, расположенных в одной группе.
Период, группа и электронная конфигурация
Обратите внимание еще раз на важную деталь: элементы, находящиеся в одной группе (главной подгруппе!), имеют сходную конфигурацию внешнего уровня. Так у бора на внешнем уровне расположены 3 электрона, у алюминия – тоже 3. Оба они в III группе.
Такая закономерность иногда может сильно облегчить жизнь, однако у элементов побочных подгрупп она отсутствует – там нужно считать электроны “вручную”, располагая их на электронных орбиталях.
Раз уж мы повели речь об электронных конфигурациях, давайте запишем их для бора и алюминия, чтобы лучше представлять их внешний уровень и увидеть то самое “сходство”:
Общую электронную конфигурацию для элементов III группы главной подгруппы можно записать ns2np1. Это будет работать для бора, внешний уровень которого 2s22p1, алюминия – 3s23p1, галия – 4s24p1, индия – 5s25p1 и таллия – 6s26p1. За “n” мы принимаем номер периода.
Правило составления электронной конфигурации, которое вы только что увидели, универсально. Если вы имеете дело с элементом главной подгруппы, то увидев номер группы вы знаете, сколько электронов у него на внешнем уровне. Посмотрев на период, знаете номер его внешнего уровня.
Вам остается только распределить известное число электронов по s и p ячейкам, а затем подставить номер периода – и вот быстро получена конфигурация внешнего уровня. Предлагаю посмотреть на примере ниже 🙂
Очень надеюсь, что теперь вы знаете: только глядя на положение элемента в периодической таблице, на группу и период, в которых он расположен, вы уже можете составить конфигурацию его внешнего уровня. Безусловно, это для элементов главных подгрупп. Повторюсь: у побочных – только “вручную”.
Длина связи
Длина связи – расстояние между атомами химически связанных элементов. Очевидно, что понятия длины связи и атомного радиуса взаимосвязаны напрямую. Чем больше радиус атома, тем больше длина связи.
Убедимся в этом на наглядном примере, сравнив длину связей в четырех веществах: HF, HCl, HBr, HI.
Чем больше радиусы атомов, которые образуют химическую связь, тем больше между ними и длина связи. Радиус атома водорода неизменен во всех трех веществах, а в ряду F → Cl → Br → I происходит увеличение радиуса атома. Наибольшим радиусом обладает йод, поэтому самая длинная связь в молекуле HI.
Металлические и неметаллические свойства
В периоде с увеличением заряда атома металлические свойства ослабевают, неметаллические – усиливаются (слева направо “→”). В группе с увеличением заряда атома металлические свойства усиливаются, а неметаллические – ослабевают (сверху вниз “↓”).
Сравним металлические и неметаллические свойства Rb, Na, Al, S. Натрий, алюминий и сера находятся в одном периоде. Металлические свойства возрастают S → Al → Na. Натрий и рубидий находятся в одной группе, металлические свойства возрастают Na → Rb.
Таким образом, самые сильные металлические свойства проявляет рубидий, но с другой стороны – у него самые слабые неметаллические свойства. Сера обладает самыми слабыми металлическими свойствами, но, если посмотреть по-другому, сера – самый сильный неметалл.
Распределение металлов и неметаллов в периодической таблице также является наглядным отображением этого правила. Если провести условную линию, проходящую от бора до астата, то справа окажутся неметаллы, а слева – металлы.
Основные и кислотные свойства
Основные свойства в периоде с увеличением заряда атома уменьшаются, кислотные – возрастают. В группе с увеличением заряда атома основные свойства усиливаются, а кислотные – ослабевают.
Кислотные и основные свойства противопоставлены друг другу, как противопоставлены металлические и неметаллические. Где первые усиливаются, вторые – убывают. Все аналогично, поэтому смело ассоциируйте одни с другими, так будет гораздо легче запомнить.
Замечу, что здесь есть одно важное исключение. Как и в общем случае: исключения только подтверждают правила. В ряду галогенводородных кислот HF → HCl → HBr → HI происходит усиление кислотных свойств (а не ослабление, как должно быть по логике нашего правила).
Это можно объяснить в темах диссоциации и химических связей. Когда мы дойдем до соответствующей темы, я напомню про HF и водородные связи между молекулами, которые делают эту кислоту самой слабой. Сейчас воспринимайте это как исключение: HF – самая слабая из этих кислот, а HI – самая сильная.
Восстановительные и окислительные свойства
Восстановительные свойства в периоде с увеличением заряда атома ослабевают, окислительные – усиливаются. В группе с увеличением заряда атома восстановительные свойства усиливаются, а окислительные – ослабевают.
Ассоциируйте восстановительные свойства с металлическими и основными, а окислительные – с неметаллическими и кислотными. Так гораздо проще запомнить 😉
Электроотрицательность (ЭО), энергия связи, ионизации и сродства к электрону
Электроотрицательность – способность атома, связанного с другими, приобретать отрицательный заряд (притягивать к себе электроны). Мы уже касались ее в статье, посвященной степени окисления. Это важное свойство, ведь более ЭО-ый атом притягивает к себе электроны и уходит в отрицательную степень окисления со знаком минус “-“.
Все перечисленные в подзаголовке свойства вместе с ЭО усиливаются в периоде с увеличением заряда атома, в группе с увеличением заряда атома они ослабевают. Таким образом, самый электроотрицательный элемент расположен справа вверху таблицы Д.И. Менделеева – это фтор.
Для примера сравним ЭО-ость атомов Te, In, Al, P. Индий расположен в одной группе с алюминием, ЭО-ость In → Al возрастает (снизу вверх). Алюминий расположен в одном периоде с серой, ЭО-ость возрастает Al → S (слева направо). Сравнивая серу и теллур, мы видим, что сера расположена в группе выше теллура, значит и ее электроотрицательность тоже выше.
Энергия связи (а также ее прочность) возрастают с увеличением электроотрицательности атомов, образующих данную связь. Чем сильнее атом тянет на себя электроны (чем больше он ЭО-ый), тем прочнее получается связь, которую он образует.
Понятию ЭО-ости “синонимичны” также понятия сродства к электрону – энергии, выделяющейся при присоединении электрона к атому, и энергии ионизации – количеству энергии, которое необходимо для отщепления электрона от атома. И то, и другое возрастают с увеличением электроотрицательности.
Продемонстрирую на примере. Сравним энергию связи в трех молекулах: H2O, H2S, H2Se.
Высшие оксиды и летучие водородные соединения (ЛВС)
В периодической таблице Д.И. Менделеева ниже 7 периода находится строка, в которой для каждой группы указаны соответствующие высшие оксиды, ниже строка с летучими водородными соединениями.
Для элементов главных подгрупп начиная с IV группы (в большинстве случае) максимальная степень окисления (СО) определяется по номеру группы. К примеру, для серы (в VI группе) максимальная СО = +6, которую она проявляет в соединениях: H2SO4, SO3.
В таблице видно, что для VIa группы формула высшего оксида RO3, а, к примеру, для IIIa группы – R2O3. Напишем высшие оксиды для веществ из VIa : SO3, SeO3, TeO3 и IIIa группы: B2O3, Al2O3, Ga2O3.
На экзамене строка с готовыми “высшими” оксидами, как в таблице наверху, может отсутствовать. Считаю важным подготовить вас к этому. Предположим, что эта строчка внезапно исчезла из таблицы, и вам нужно записать высшие оксиды для фосфора и углерода.
С летучими водородными соединениями (ЛВС) ситуация аналогичная: их может не быть в периодической таблице Д.И. Менделеева, которая попадется на экзамене. Я расскажу вам, как легко их запомнить.
ЛВС характерны для IV, V, VI и VII группы. Элементы этих групп более электроотрицательны, чем водород, поэтому ходят в “-” отрицательную СО. Минимальная степень окисления для элементов главных подгрупп, начиная с IV группы, может быть рассчитана так: номер группы – 8.
Так как общее строение ЛВС в пределах одной группы сходно, то, вспомнив например H2O для кислорода в VI группе, вы легко найдете формулы других ЛВС VI группы: серы – H2S, H2Se, H2Te, H2Po.
Разница между атомным радиусом и ионным радиусом
Атомы являются строительными блоками материи. Вся материя состоит из атомов. Эти атомы могут быть преобразованы в ионы путем добавления одного или нескольких электронов извне.
Поскольку атомы и ионы являются круговыми трехмерными структурами, мы можем измерить радиус атома или иона. Но это не простая задача. Потому что атом или ион состоит из электронов, которые находятся в движении.
Радиус атома – это расстояние между ядром атома и границей его электронного облака. Ионный радиус – это радиус иона атома. Радиус иона может быть больше или меньше радиуса атома, в зависимости от электрического заряда иона.
Основное различие между атомным радиусом и ионным радиусом этот атомный радиус является радиусом нейтрального атома, тогда как ионный радиус является радиусом электрически заряженного атома.
Ключевые области покрыты
1. Что такое атомный радиус
– Определение, тренды в периодической таблице
2. Что такое ионный радиус
– Определение, тренды в периодической таблице 3. В чем разница между атомным радиусом и ионным радиусом– Сравнение основных различий
Ключевые слова: атомный радиус, атомы, электронная оболочка, ионный радиус, ионы
Что такое атомный радиус
Радиус атома – это расстояние от ядра атома до его границы электронного облака. Другими словами, это расстояние от ядра до самого дальнего электрона, который принадлежит этому атому. Атомный радиус может быть определен только для изолированных и нейтральных атомов.
При рассмотрении периодической таблицы элементов существует структура атомного радиуса элементов. В период периодической таблицы, атомный номер постепенно уменьшается. Элементы в один и тот же период имеют одинаковое количество электронных оболочек.
Если число присутствующих электронов выше, притяжение между электронами и ядром также велико. В начале периода на внешней орбите присутствует меньше электронов. Тогда притяжение со стороны ядра меньше. Следовательно, атом велик, и радиус атома также велик.
Но при движении по периоду число протонов в ядре увеличивается вместе с количеством электронов, присутствующих в атоме. Поэтому сила притяжения между электронами и ядром велика. Это приводит к уменьшению размера атома; тогда атомный радиус уменьшается.
Аналогично, при движении по периоду размер атома постепенно уменьшается, равно как и атомный радиус.
Рисунок 1: Сравнение атомных размеров
При движении вниз по группе периодической таблицы элементов атомный радиус увеличивается. После каждого периода к атому добавляется еще одна электронная оболочка. Поэтому при движении вниз по группе размер атома увеличивается. Атомный радиус также увеличен.
Но в элементах d-блока нет большей разницы между атомными радиусами атомов двух соседних элементов в одном и том же периоде. Это потому, что электроны здесь добавляются к той же орбитали, которая находится в качестве внутренней орбитали. Поскольку внешняя оболочка остается постоянной, атомные радиусы этих элементов не имеют существенных различий.
Что такое ионный радиус
Ионный радиус – это радиус иона атома. Ионы не могут существовать одни. Если это положительно заряженный ион, он будет реагировать с отрицательно заряженным ионом (или наоборот) и станет стабильным нейтральным соединением. Это соединение называется ионным соединением, потому что оно состоит из ионных компонентов.
Ионное соединение состоит из катионов и анионов. Катион меньше по размеру, потому что катион образуется путем удаления одного или нескольких электронов из атома.
Анион большой, потому что у него есть дополнительные электроны, которые отталкиваются ядром, что приводит к увеличению расстояния между ядром и самым дальним электроном электронного облака.
Самый точный способ найти ионный радиус – это разделить расстояние между двумя ядрами двух ионов в соответствии с их размерами. Например, если ионное соединение состоит из катиона и аниона с атомным размером, который в три раза больше, расстояние между двумя ядрами должно быть разделено на 4, чтобы получить радиус катиона.
Рисунок 2: Атомный и ионный радиусы некоторых элементов
Ионы одного и того же химического элемента могут быть разных размеров в зависимости от их электрических зарядов. Наиболее распространенным методом определения ионного радиуса является рентгеновская кристаллография. Как и в атомном радиусе, ионный радиус также имеет тренды в периодической таблице.
По мере того, как мы движемся вниз по группе в периодической таблице, ионный радиус увеличивается. Это потому, что новая электронная оболочка добавляется за каждый период, когда мы идем вниз группой.
В течение периода ионный радиус уменьшается, поскольку эффективное положительное притяжение со стороны ядра постепенно увеличивается.
Определение
Радиус атома: Радиус атома – это радиус нейтрального атома.
Ионный Радиус: Ионный радиус – это радиус иона атома.
расчет
Радиус атома: Радиус атома можно рассчитать как расстояние от ядра атома до его границы электронного облака.
Ионный Радиус: Ионный радиус можно рассчитать путем деления расстояния между двумя ядрами двух ионов в соответствии с их размерами.
Размеры
Радиус атома: Нейтральные атомы одного и того же элемента имеют одинаковый размер, поэтому атомный радиус равен друг другу.
Ионный Радиус: Катионы имеют меньший атомный радиус, чем у анионов.
определение
Радиус атома: Атомный радиус определяется с учетом нейтральных газообразных атомов химических элементов.
Ионный Радиус: Ионный радиус определяется с учетом катионов и анионов, находящихся в ионной связи (в ионных соединениях).
Заключение
Атомный радиус и ионный радиус химических элементов имеют тренды в периодической таблице элементов. Увеличение или уменьшение атомных или ионных размеров по периоду или по группе периодической таблицы может быть объяснено с использованием электронных конфигураций элементов.
Однако существуют значительные различия между атомным радиусом и ионным радиусом. Основное различие между атомным радиусом и ионным радиусом состоит в том, что атомный радиус – это радиус нейтрального атома, тогда как ионный радиус – это радиус электрически заряженного атома.
Рекомендации:
1. Хельменстин, Энн Мари. «Вот какие тренды следуют ионному радиусу в периодической таблице». ThoughtCo,
Как определить радиус атома | Сделай все сам
Под радиусоматома воспринимается расстояние между ядром данного атома и его самой далекой электронной орбитой. На сегодняшний день общепризнанной единицей измерения ядерного радиуса является пикометр(пм). Определить радиус атома дюже легко.
Вам понадобится
Инструкция
1. Первым делом, под рукой должна иметься обыкновенная таблица Менделеева, в которой по порядку расставлены все вестимые обществу химические элементы. Обнаружить эту таблицу дюже легко в любом справочнике по химии, школьном учебнике, либо же ее дозволено купить отдельно, в ближайшем книжном магазине.
3. Скажем, порядковый номер хлора (Cl) – 17. Это обозначает, что расстояние от ядра атома хлора до самой далекой его орбиты движения стабильного электрона равно 17 пм.
Совет 2: Как определить радиус ядра
Совет 3: Как определить массу атома
Вам понадобится
Атомный радиус • ru.knowledgr.com
Атомный радиус химического элемента – мера размера ее атомов, обычно среднее или типичное расстояние от центра ядра к границе окружающего электронного облака.
Так как граница не четко определенный физический объект, есть различные неэквивалентные определения атомного радиуса.
Три широко используемых определения атомного радиуса – радиус Ван-дер-Ваальса, ионный радиус и ковалентный радиус.
В зависимости от определения термин может примениться только к изолированным атомам, или также к атомам в конденсированном веществе, ковалентно связанном в молекулах, или в ионизированных и взволнованных государствах; и его стоимость может быть получена посредством экспериментальных измерений или вычислена из теоретических моделей. В соответствии с некоторыми определениями, ценность радиуса может зависеть от государства и контекста атома.
электронов нет определенных орбит или резко определенных диапазонов.
Скорее их положения должны быть описаны как распределения вероятности, которые постепенно сужаются, поскольку каждый переезжает от ядра без острого сокращения.
Кроме того, в конденсированном веществе и молекулах, электронные облака атомов обычно накладываются в некоторой степени, и некоторые электроны могут бродить по большой области, охватывающей два или больше атома.
В соответствии с большинством определений радиусы изолированных нейтральных атомов располагаются между 30 и 15:00 (trillionths метра), или между 0,3 и 3 ангстремами. Поэтому, радиус атома – больше чем 10 000 раз радиус своего ядра (1–10 из), и меньше, чем 1/1000 длины волны видимого света (400-700 нм).
Во многих целях атомы могут быть смоделированы как сферы. Это – только сырое приближение, но оно может обеспечить количественные объяснения и предсказания для многих явлений, таких как плотность жидкостей и твердых частиц, распространения жидкостей через молекулярные решета, расположение атомов и ионов в кристаллах, и размера и формы молекул.
Атомные радиусы варьируются по предсказуемому и объяснимому способу через периодическую таблицу. Например, радиусы обычно уменьшаются вдоль каждого периода (ряд) стола от щелочных металлов до благородных газов; и увеличьте вниз каждую группу (колонка).
Радиус увеличивается резко между благородным газом в конце каждого периода и щелочным металлом в начале следующего периода.
Эти тенденции атомных радиусов (и различных других химических и физических свойств элементов) могут быть объяснены электронной теорией раковины атома; они представили важные свидетельства для развития и подтверждения квантовой теории.
История
В 1920, вскоре после того, как стало возможно определить размеры атомов, используя кристаллографию рентгена, было предложено, чтобы у всех атомов того же самого элемента были те же самые радиусы.
Однако в 1923, когда больше кристаллических данных стало доступным, было найдено, что приближение атома как сфера не обязательно держится, сравнивая тот же самый атом в различных кристаллических структурах.
Определения
Широко используемые определения атомного радиуса включают:
Опытным путем измеренные атомные радиусы
Шоу следующей таблицы опытным путем измерили ковалентные радиусы для элементов, как издано Дж. К. Слейтером в 1964. Ценности находятся в picometers (пополудни или 1×10 m,), с точностью до около 17:00. Оттенок диапазонов коробки от красного до желтого как радиус увеличивается; серый указывает на отсутствие данных.
Объяснение общих тенденций
Путем атомный радиус меняется в зависимости от увеличения атомного числа, может быть объяснен расположением электронов в раковинах фиксированной способности. Раковины вообще заполнены в порядке увеличивающегося радиуса, так как отрицательно заряженные электроны привлечены положительно заряженными протонами в ядре.
Когда атомное число увеличивается вдоль каждого ряда периодической таблицы, дополнительные электроны входят в ту же самую наиболее удаленную раковину; чей радиус постепенно сокращается, из-за увеличивающегося ядерного обвинения.
В благородном газе наиболее удаленная раковина абсолютно заполнена; поэтому, дополнительный электрон следующего щелочного металла войдет в следующую внешнюю оболочку, составляя внезапное увеличение атомного радиуса.
Следующая таблица суммирует главные явления, которые влияют на атомный радиус элемента:
Сокращение лантанида
Электроны в 4f-подраковине, которая прогрессивно заполнена от церия (Z = 58) к lutetium (Z = 71), не особенно эффективные при ограждении увеличивающегося ядерного обвинения от подраковин далее.
У элементов немедленно после лантанидов есть атомные радиусы, которые меньше, чем ожидалось бы и которые немедленно почти идентичны атомным радиусам элементов выше их. Следовательно у гафния есть фактически тот же самый атомный радиус (и химия) как цирконий, и у тантала есть атомный радиус, подобный ниобию и т.д.
Эффект сокращения лантанида примечателен до платины (Z = 78), после которого это замаскировано релятивистским эффектом, известным как инертный эффект пары.
Из-за сокращения лантанида, 5 после наблюдений могут быть оттянуты:
сокращение d-блока
Сокращение d-блока менее явное, чем сокращение лантанида, но является результатом подобной причины. В этом случае это – плохая способность ограждения 3-х электронов, которая затрагивает атомные радиусы и химию элементов немедленно после первого ряда металлов перехода от галлия (Z = 31) к брому (Z = 35).
Расчетные атомные радиусы
Следующая таблица показывает атомные радиусы, вычисленные из теоретических моделей, как издано Энрико Клементи и другими в 1967. Ценности находятся в picometres (пополудни).
В радиус атома из химический элемент это мера размера его атомы, обычно среднее или типичное расстояние от центра ядро к границе окружающей снаряды из электроны. Поскольку граница не является четко определенной физической сущностью, существуют различные неэквивалентные определения атомного радиуса. Три широко используемых определения атомного радиуса: Радиус Ван-дер-Ваальса, ионный радиус, и ковалентный радиус.
В зависимости от определения, термин может применяться только к изолированным атомам или также к атомам в конденсированное вещество, ковалентное связывание в молекулы, или в ионизированный и возбужденные состояния; и его значение может быть получено путем экспериментальных измерений или рассчитано на основе теоретических моделей. Значение радиуса может зависеть от состояния и контекста атома. [1]
Электроны не имеют определенных орбит или четко определенных диапазонов. Скорее их позиции должны быть описаны как распределения вероятностей которые постепенно сужаются по мере удаления от ядра, без резкого обрыва; они называются атомные орбитали или электронные облака. Более того, в конденсированных средах и молекулах электронные облака атомов обычно в некоторой степени перекрываются, и некоторые электроны могут перемещаться по большой области, охватывающей два или более атомов.
Согласно большинству определений радиусы изолированных нейтральных атомов составляют от 30 до 300. вечера (триллионных метра) или от 0,3 до 3 Ангстремс. Следовательно, радиус атома более чем в 10000 раз больше радиус его ядра (1–10 FM ), [2] и менее 1/1000 длина волны видимых свет (400–700 нм ).
Для многих целей атомы можно моделировать как сферы. Это только грубое приближение, но оно может дать количественные объяснения и предсказания для многих явлений, таких как плотность жидкостей и твердых тел, распространение жидкостей через молекулярные сита, расположение атомов и ионов в кристаллы, а размер и форма молекул. [ нужна цитата ]
Атомные радиусы изменяются предсказуемым и объяснимым образом в периодическая таблица. Например, радиусы обычно уменьшаются вдоль каждого периода (строки) таблицы, начиная с щелочных металлов к благородные газы; и увеличивайте каждую группу (столбец). Радиус резко увеличивается между благородным газом в конце каждого периода и щелочным металлом в начале следующего периода. Эти тенденции изменения атомных радиусов (и различных других химических и физических свойств элементов) могут быть объяснены электронная оболочка теория атома; они предоставили важные доказательства для развития и подтверждения квантовая теория. Радиусы атомов уменьшаются по Периодической таблице, потому что по мере увеличения атомного номера количество протонов увеличивается по периоду, но дополнительные электроны добавляются только к той же квантовой оболочке. Следовательно, эффективный заряд ядра по отношению к самым удаленным электронам увеличивается, притягивая самые удаленные электроны ближе. В результате электронное облако сжимается и атомный радиус уменьшается.
Содержание
История
В 1920 году, вскоре после того, как появилась возможность определять размеры атомов с помощью Рентгеновская кристаллография, было высказано предположение, что все атомы одного элемента имеют одинаковые радиусы. [3] Однако в 1923 году, когда стало доступно больше данных о кристаллах, было обнаружено, что приближение атома как сферы не обязательно выполняется при сравнении одного и того же атома в разных кристаллических структурах. [4]
Определения
Широко используемые определения атомного радиуса включают:
Эмпирически измеренный атомный радиус
В следующей таблице показаны эмпирически измеренные ковалентный радиусы элементов, опубликованные Дж. С. Слейтер в 1964 г. [8] Значения указаны в пикометры (pm или 1 × 10 −12 м), с точностью около 5 м. Оттенок рамки варьируется от красного до желтого по мере увеличения радиуса; серый цвет указывает на отсутствие данных.
| Группа (столбец) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| Период (ряд) | ||||||||||||||||||
| 1 | ЧАС 25 | Он | ||||||||||||||||
| 2 | Ли 145 | Быть 105 | B 85 | C 70 | N 65 | О 60 | F 50 | Ne | ||||||||||
| 3 | Na 180 | Mg 150 | Al 125 | Si 110 | п 100 | S 100 | Cl 100 | Ar | ||||||||||
| 4 | K 220 | Ca 180 | Sc 160 | Ti 140 | V 135 | Cr 140 | Mn 140 | Fe 140 | Co 135 | Ni 135 | Cu 135 | Zn 135 | Ga 130 | Ge 125 | Так как 115 | Se 115 | Br 115 | Kr |
| 5 | Руб. 235 | Sr 200 | Y 180 | Zr 155 | Nb 145 | Пн 145 | Tc 135 | RU 130 | Rh 135 | Pd 140 | Ag 160 | Компакт диск 155 | В 155 | Sn 145 | Sb 145 | Te 140 | я 140 | Xe |
| 6 | CS 260 | Ба 215 | * | Hf 155 | Та 145 | W 135 | Re 135 | Операционные системы 130 | Ir 135 | Pt 135 | Au 135 | Hg 150 | Tl 190 | Pb 180 | Би 160 | По 190 | В | Rn |
| 7 | Пт | Ра 215 | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ц | Og |
| Лантаноиды | * | Ла 195 | Ce 185 | Pr 185 | Nd 185 | Вечера 185 | См 185 | ЕС 185 | Б-г 180 | Tb 175 | Dy 175 | Хо 175 | Э 175 | Тм 175 | Yb 175 | Лу 175 | ||
| Актиниды | ** | Ac 195 | Чт 180 | Па 180 | U 175 | Np 175 | Пу 175 | Am 175 | См | Bk | Cf | Es | FM | Мкр | Нет | Lr |
Объяснение общих тенденций
Изменение радиуса атома с увеличением атомный номер можно объяснить расположением электронов в оболочках фиксированной емкости. Оболочки обычно заполняются в порядке увеличения радиуса, так как отрицательно заряжен электроны притягиваются положительно заряженными протоны в ядре. По мере увеличения атомного номера вдоль каждой строки периодической таблицы дополнительные электроны переходят в ту же самую внешнюю оболочку; радиус которого постепенно сужается из-за увеличения заряда ядра. В благородном газе самая внешняя оболочка полностью заполнена; следовательно, дополнительный электрон следующего щелочного металла перейдет в следующую внешнюю оболочку, учитывая внезапное увеличение атомного радиуса.
Увеличивающийся заряд ядра частично уравновешивается увеличением количества электронов, явление, известное как защита; что объясняет, почему размер атомов обычно увеличивается в каждом столбце. Однако есть одно заметное исключение, известное как сокращение лантаноидов: блок элементов 5d намного меньше, чем можно было бы ожидать, из-за слабого экранирования 4f-электронов.
По сути, атомный радиус уменьшается через периоды из-за увеличения количества протонов. Следовательно, существует большее притяжение между протонами и электронами, потому что противоположные заряды притягиваются, и большее количество протонов создает более сильный заряд. Более сильное притяжение притягивает электроны ближе к протонам, уменьшая размер частицы. Следовательно, атомный радиус уменьшается. Вниз по группам атомный радиус увеличивается. Это потому, что существует больше уровней энергии и, следовательно, большее расстояние между протонами и электронами. Кроме того, защита электронов снижает притяжение, поэтому оставшиеся электроны могут уходить дальше от положительно заряженного ядра. Следовательно, размер (атомный радиус) увеличивается.
В следующей таблице приведены основные явления, влияющие на атомный радиус элемента:
Сокращение лантаноидов
Электроны в 4f-подоболочка, который постепенно заполняется от церий (Z = 58) в лютеций (Z = 71), не особенно эффективны при защите возрастающего ядерного заряда от более удаленных суб-оболочек. Элементы, следующие сразу за лантаноиды имеют атомные радиусы, которые меньше, чем можно было бы ожидать, и которые почти идентичны атомным радиусам элементов непосредственно над ними. [9] Следовательно гафний имеет практически такой же атомный радиус (и химический состав), что и цирконий, и тантал имеет атомный радиус, подобный ниобий, и так далее. Эффект сокращения лантаноидов заметен до платина (Z = 78), после чего маскируется релятивистский эффект известный как эффект инертной пары.
Из-за сокращения лантаноидов можно сделать 5 следующих наблюдений:
сокращение d-блока
Сокращение d-блока менее выражено, чем сокращение лантаноида, но возникает по той же причине. В этом случае именно плохая экранирующая способность 3d-электронов влияет на атомные радиусы и химический состав элементов, следующих сразу за первой строкой переходные металлы, от галлий (Z = 31) в бром (Z = 35). [9]
Расчетные атомные радиусы
В следующей таблице показаны атомные радиусы, рассчитанные на основе теоретических моделей, опубликованных Энрико Клементи и другие в 1967 году. [10] Значения указаны в пикометрах (пм).