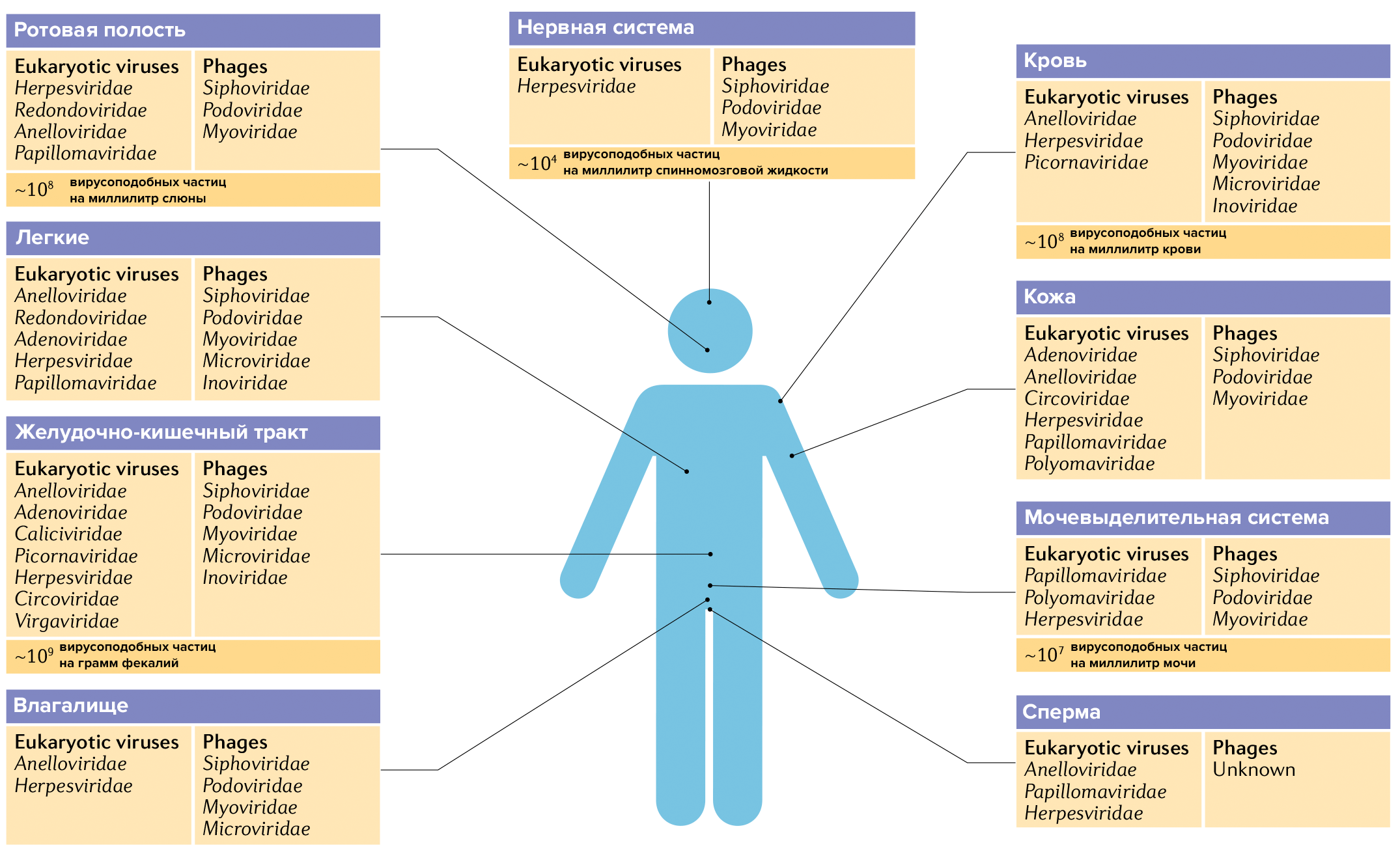
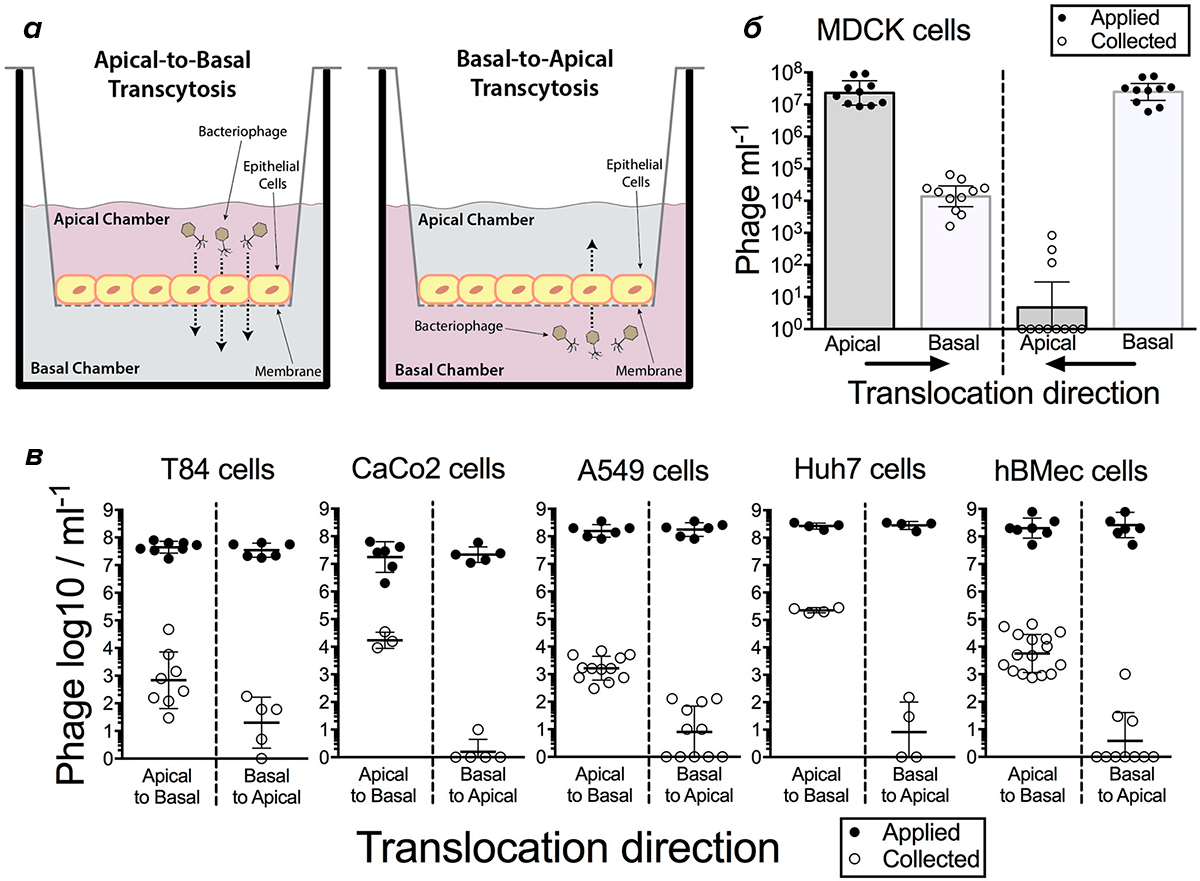
Бактериофаги что это
Бактериофаги что это
Бактериофаги
БАКТЕРИОФАГИ КАК АЛЬТЕРНАТИВА АНТИБИОТИКАМ В ЛЕЧЕНИИ ИНФЕКЦИЙ
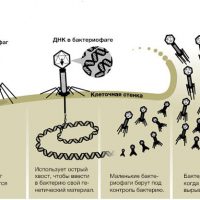
Бактериофаги — вирусы бактерий, естественные микроорганизмы, которые, размножаясь внутри бактериальной клетки, ведут к ее быстрой гибели.
Из истории открытия
В 1896 году английский бактериолог Э. Ханкин, исследуя антибактериальное действие воды индийских рек, пришел к выводу о существовании агента, проходящего через бактериальные фильтры и вызывающего лизис холерных вибрионов. Российский микробиолог Н. Ф. Гамалея в 1897 году наблюдал лизис бацилл сибирской язвы. Однако первой научной публикацией о фагах стала статья английского микробиолога Ф. Туорта, в которой он в 1915 году описал инфекционное поражение стафилококков, значительно изменявшее морфологию колоний. В 1917 году канадский бактериолог Ф. Д’Эрелль независимо от Туорта сообщил об открытии вируса, «пожирающего» бактерии — бактериофага.
Интересный факт: при нанесении бактериофага на влажные слизистые он за 20 минут очищает их от определенного вида бактерий, например от стафилококка. Так быстро не работает ни один антибиотик.
Действие бактериофагов отличается от действия антибиотиков:
В лаборатории KDL предлагается 2 варианта посевов на флору с определением чувствительности выделенной культуры микроорганизма к препаратам бактериофагов и разным наборам антибиотиков в зависимости от ситуации пациента (выбирает врач), например:
Какие инфекции можно лечить бактериофагами:
Возбудителями этих инфекций могут быть такие бактерии, как золотистый стафилококк, синегнойная палочка, патогенные формы кишечной палочки, сальмонеллы, стрептококки.
В Новосибирском научном центре технологии персонализированного лечения бактериофагами в большой коллекции бактериофагов есть уникальные штаммы, способные бороться с недавно появившимися и уже получившими широкое распространение возбудителями больничных инфекций, такими как грамотрицательные бактерии Acinetobacter baumanii, Stenotrophomonas maltophilia и др.
Последние годы ознаменовались широкими исследованиями бактериофагов из-за нарастающей проблемы антибиотикорезистентности микроорганизмов, которые находят всё новые применения не только в терапии и профилактике, но и в биотехнологиях. Их очевидным практическим результатом должно стать возникновение нового мощного направления персонализированной медицины, а также создание целого спектра технологий в пищевой промышленности, ветеринарии, сельском хозяйстве и в производстве современных материалов. Мы ждем, что второе столетие исследований бактериофагов принесет не меньше открытий, чем первое.
Что такое бактериофаги простыми словами
В 1928 году британский бактериолог Александр Флеминг вернулся из отпуска в Шотландии в свою лабораторию в Лондоне и обнаружил, как в одной из чашек Петри бурно разрослась колония плесневых грибов (Penicillium notatum). С выделением пенициллина началась эра антибиотиков.
С тех пор антибиотики спасли миллионы жизней по всей планете. Флеминг также обнаружил, что бактерии обладали устойчивостью к антибиотикам, если действовали малым количеством пенициллина, либо если антибиотик употреблялся слишком короткое время.
Алмрот Райт предсказал устойчивость к антибиотикам еще до того, когда это было обнаружено экспериментально. Бактериальная резистентность — явление естественное по своей природе, а потому неизбежное.
Вот уже более десятка лет Всемирная организация здравоохранения, Центр по контролю заболеваний в США, многие крупные эксперты в России открыто признают, что мы вступили в так называемую пост антибиотиковую эру.
В 2016 году в США зафиксирован случай заражения человека одной из разновидностей энтеробактерий. Штамп оказался устойчивым к воздействию тетрациклина, колистина, ко всем до единого из 26 видов антибиотиков, представленных на рынке. Женщину так и не удалось спасти.
Ученые по всему миру продолжают изучать явление резистентности в надежде минимизировать угрозы. Однако одной из самых подходящих альтернатив можно назвать препараты (комбинированные или моно) на основе бактериофагов.
Бактериофаги являются важнейшим компонентом нашей продукции и помогают при профилактике бактериальных заболеваний и борьбе с ними. Название звучит непривычно и немного непонятно. На самом деле, с бактериофагами люди знакомы уже более ста лет.
Бактериофаг в переводе с греческого означает «пожиратель бактерий». Не самое доброе «существо», но в действительности никто никого не пожирает. Бактериофаги — это природные агенты, которые естественным образом ограничивают размножение бактерий. Они способны избирательно устранять только те бактерии, которым они соответствуют, при этом не повреждая нормофлору или человеческие клетки.
Они являются самым распространенным биологическим объектом на Земле.
Бактериальные вирусы были открыты дважды: в 1915 году Фредериком Уильямом Туортом и в 1917 году Феликсом Д’Эреллем, который и предложил термин «бактериофаг».
Второе открытие было сделано во время исследования вспышки дизентерии среди французских солдат во время Первой мировой войны. При изучении лизиса (разрушения клетки под действием собственных или чужеродных ферментов) бактериальных культур.
Ученый обратил внимание, что какое-то существо, невидимое в обычный микроскоп, разрушает выращенные им культуры бактерий. Микробиологу удалось настроить его размножение: бактерии, зараженные им, погибали, а количество агента увеличивалось.
В 1919 году ученый успешно вылечил бактериофагами первых пациентов. Он описал случай успешного лечения дизентерии с использованием фагов, доказав, что они обеспечивают выздоровление больного организма. Были проведены и первые опыты по применению фагов при раневых инфекциях, холере, тифе и даже бубонной чуме. Успех выглядел вполне убедительно.
После открытия бактериофаги начали использовать для борьбы с бактериальными патогенами. Однако в Западной Европе и США от такой терапии вскоре отказались из-за сомнительных результатов. Это было неудивительно, принимая во внимание тогдашний уровень понимания биологии бактериофагов и отсутствие стандартизации. А открытие в 1928 году пенициллина и последовавшая за этим событием «эра антибиотиков» надолго отодвинули интерес к профилактическому и медицинскому использованию бактериофагов.
Хотя в государствах Восточной Европы, таких как СССР, применение бактериофагов в терапии продолжилось, чему способствовало основание в 1934 году Института Бактериофага в Тбилиси Георгием Элиавой совместно с Феликсом Д’Эреллем.
В мире интерес к фаговой терапии возобновился только в 1980-е годы, когда эффективность лечения антибиотиками значительно снизилась, а бактерии стали более устойчивы к лекарствам. Сейчас исследования в этой области активно ведутся по всему миру.
Бактериофаги – альтернатива антибиотикам или помощь им?
В 1896 г. британский химик Э. Ханкин, изучая антибактериальное действие вод индийской реки Ганг и в 1898 году российский ученый Н. Ф. Гамалея впервые наблюдали и описали уничтожение бактерий другими «агентами», а в 1917 году ученым Ф.Д. Эрелем из института Пастера в Париже были открыты микроорганизмы, которые питаются бактериями. Именно он предложил назвать их бактериофагами – пожирателями бактерий. Бактериофаги являются абсолютными внутриклеточными паразитами бактерий разного вида.
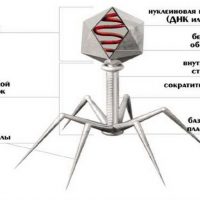
Бактериофаги еще в прошлом столетии доказали свою эффективность и безопасность. Почему же бактериофаги до сих пор не стали основными средствами борьбы с инфекцией? Это объясняется несколькими причинами. Главная — открытие новой группы препаратов – антибиотиков, надолго оттеснившее интерес к бактериофагам. Плюс:
Что такое бактериофаги
В 1939 году А. Флемингом был открыт антибиотик, и началась эра антибиотиков в лечении бактериальных инфекций. Появилось большое количество антибиотиков 1, 2, 3, 4 поколений, причем антибиотики последнего поколения, которыми пользуются и сейчас, появились еще в 70-е годы прошлого столетия. На Западе и Америке отказались от бактериофагов и активно начали применять антибиотики.
Но А. Флеминг предупреждал о некоторых обязательных моментах применения антибиотиков:
Несоблюдение хотя бы части этих требований могло привести и, как оказалось, приводит к кризису антибиотиковой эры. Бактерии перестают реагировать на препараты. Пока ещё действуют антибиотики последнего поколения, решая труднейшие клинические проблемы, но рассчитывать на появление новых антибиотиков не приходится.
Россия на сегодняшний день оказалась самой развитой страной в области микробиологии изучения бактериофагов. Бактериофаги – это естественные антагонисты бактерий.
Каков механизм действия бактериофагов
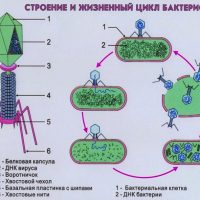
В организме человека бактериофаги попадают в очаг инфекции, там размножаются до тех пор, пока есть «свои» бактерии, и затем выводятся естественным путем.
Сегодня многие заболевания вызываются стафилококками, стрептококками, клебсиеллами и другими бактериями, и успешно могут лечиться бактериофагами. Это естественная альтернатива антибиотикам, возврат к природе.
Какие преимущества имеют бактериофаги в лечении бактериальных инфекций
Бактериофаги много тысяч лет делали свое дело, не давая бактериям уничтожить все живое на земле.
Бактериофаги могут применяться и у беременных, и у детей, во всех возрастных группах людей. Противопоказаний к их применению нет.
Фаги совместимы с различными лекарствами, в том числе с антибиотиками, причем они уменьшают непереносимость (резистентность) бактерий к антибиотикам.
Курс лечения бактериофагами более короткий (7-14 дней). Фаги практически не дают побочных явлений. Они определяются бактериальной зараженностью и распадом бактерий с выделением эндотоксина, но они значительно меньше, чем при приеме антибиотиков, эти явления легко снимаются приёмом энтеросорбентов. Бактериофаги можно применять при аллергических реакциях на антибиотики.
Бактериофаги, благодаря своей специфичности воздействия на бактерии, не убивают хорошие бактерии и не изменяют нормальную микрофлору кишечника. Они, в отличие от антибиотиков, не нарушают микробиом человека.
Какие виды бактериофагов известны
Известно, что бактериофаги действуют на один штамм бактерий, поэтому производятся препараты бактериофагов, действующих против разных штаммов одного возбудителя:
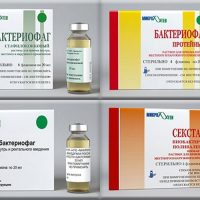
Особенность бактериофагов – узкая специфичность, в следствие чего они могут применяться против определенных штаммов бактерий, поэтому необходимо иметь большую коллекцию бактериофагов, из которой можно выбрать подходящий препарат или фаговый коктейль для конкретного пациента. Коллекция бактериофагов составляет более 200 препаратов.
Производителем бактериофагов в России является научно-производственное объединение Микроген — мировой лидер изучения бактериофагов.
При каких заболеваниях применяются бактериофаги
Бактериофаги применяются при:
Инфекции желудочно-кишечного тракта, вызванные сальмонеллой, золотистым стафилококком, протеем, и др. и сопровождающиеся диареей (поносами), успешно лечатся бактериофагами.
Применяться бактериофаги при острых кишечных инфекциях могут:
Используются бактериофаги в дерматологии, в детской практике, хирургии. С профилактической целью — в детских садах и школах для предотвращения эпидемий, например, дизентерии. Бактериофаги уже более 100 лет на службе человека. Может быть, как раз сейчас начинается эпоха бактериофагов. В новосибирском научном центре разрабатываются технологии персонализированного лечения. Медицинские центры Франции, Бельгии, Швейцарии проводят клинические исследования коктейлей бактериофагов.
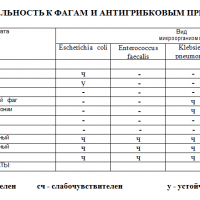
| Участок заражения | Обследование |
| желудочно-кишечный тракт | анализ на микробиом толстой кишки (на дисбактериоз) |
| носоглотка | мазок на микрофлору |
| урологические заболевания | посев мочи, посев секрета простаты |
| гинекологические заболевания | мазки |
| раневые поверхности и язвы, в том числе при диабетической стопе | посев |
В настоящее время при выявлении бактериального возбудителя болезни есть возможность определить его чувствительность к бактериофагу. Перед началом лечения необходимо пройти это обследование.
Как принимаются бактериофаги
Бактериофаги хранятся в холодильнике при температуре 2-8 градусов.
Бактериофаги — это крупные частицы. Они трудно проникают в ткани органов, поэтому лучше вводить их при лечении прямо к месту локализации инфекции. Это могут быть ингаляции при легочной патологии, промывания при лор-заболеваниях, аппликации при трофических язвах, ожогах, ранах. При инфекциях мочевыводящих путей для достижения успеха препараты бактериофагов вводятся в полость мочевого пузыря (хронический цистит).
Для внутреннего употребления есть бактериофаги во флаконах по 20 мл, 4 флакона в упаковке. Перед употреблением флакон следует подержать в руке, согреть, перелить в чистую посуду и принять внутрь. Принимать 2 раза в день натощак и после ужина, курс лечения 6 дней.
В настоящее время проводят лечение бактериофагами диабетической стопы. Из больных тканей берут мазок для выявления конкретных патогенных бактерий. Затем из коллекции бактериофагов подбирают те, которые способны ликвидировать именно эти бактерии. Бактериофаг наносят на стерильную салфетку, прикладывают к ране. Лечение около недели.
Бактериофаги применяются в медицине местно или внутрь. Еще в 30-ые годы прошлого столетия бактериофаги доказали свою безопасность и высокую эффективность в клинических условиях. Но покупать бактериофаги и лечиться самостоятельно не стоит.
Заключение
Не всегда бактериофаги могут заменить антибиотики. Так, если имеет место острая ситуация, когда заподозрена бактериальная инфекция, но нет времени определить бактериальный фон болезни, чтобы подобрать препарат бактериофаг, то применяется лечение антибиотиками. При хронических инфекционных болезнях, когда установлена нечувствительность бактерий к антибиотикам и бактериальный фон заболевания, предпочтение следует отдать бактериофагам.
Хотя бактериофаги, возможно, не смогут полностью заменить антибиотики, но вместе они могут бороться со многими серьезными болезнями в клинической практике.
Пожиратели бактерий: убийцы в роли спасителей
17 октября 2016
Пожиратели бактерий: убийцы в роли спасителей
«Враг моего врага — мой друг» — это утверждение как нельзя лучше выражает главную причину интереса человека к вирусам бактерий. Фото фагов: Claudius Schulze.
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Сегодня в связи с нарастающей проблемой антибиотикорезистентности ученые всего мира ведут поиски новых антибиотиков и способов борьбы с инфекционными заболеваниями. И всё больше ученые оглядываются на естественный, но почти забытый метод — фаготерапию. Бактериофаги — природные враги бактерий, существовавшие задолго до появления человека. Почему же мы не используем их вместо антибиотиков, которые привели к такой глобальной проблеме, как резистентность бактерий, ну или хотя бы в дополнение к ним? Что это за диковинные создания и могут ли они быть полезны человеку? Безопасны ли они? В этом обзоре мы попытались собрать воедино имеющиеся данные о бактериофагах и показать вам, насколько красив и многообразен их невидимый мир.
«Био/мол/текст»-2016
Эта работа опубликована в номинации «Своя работа» конкурса «био/мол/текст»-2016.
Спонсор номинации — Future Biotech, проект, объединяющий профессионалов и энтузиастов в области биологии и биотехнологий.
Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Спонсором приза зрительских симпатий выступила фирма «Атлас».
Спонсор публикации этой статьи — Виктор Татарский.
ХХ столетие называют веком атома, нейлона и антибиотиков. С началом массового применения пенициллина в 1943 году медики всего мира получили мощнейший механизм для защиты организма от атак, казалось бы, всех болезнетворных бактерий. И ученые, подхватив знамя антибиотикотерапии, ринулись на поиски и разработку новых антибактериальных средств. Но если мирный атом и синтетические материалы с лихвой оправдали возложенные на них ожидания, то надежды на всемогущество антибиотиков, увы, постепенно тают: резистентность бактерий к ним становится всё шире. 16 сентября 2000 года на Всемирном дне резистентности в Торонто была принята Декларация по борьбе с бактериальной резистентностью [1], а годом позже ВОЗ опубликовала Глобальную стратегию по сдерживанию устойчивости к противомикробным препаратам, в тексте которой есть такие строки: «Без согласованных действий всех стран многие великие открытия, сделанные учеными-медиками за последние 50 лет, могут утратить свое значение из-за распространения антибиотикорезистентности» [2]. Означает ли это, что мы в скором времени вновь окажемся бессильны перед бактериями? Существуют ли альтернативные подходы к борьбе с инфекционными заболеваниями? К счастью, да. Один из них — применение бактериофагов, самых многочисленных, древних и распространенных на нашей планете вирусов [3], существующих на Земле свыше 3 млрд лет и неоправданно заброшенных исследователями в 1960–1970-е годы на фоне успехов антибиотикотерапии.
Открытие
Несомненно, многие бактериологи наблюдали и описывали проявления действия фага на бактериальные культуры. В 1896 году английский бактериолог Э. Ханкин, исследуя антибактериальное действие воды индийских рек, пришел к выводу о существовании агента, проходящего через бактериальные фильтры и вызывающего лизис холерных вибрионов. По некоторым данным, российский микробиолог Н.Ф. Гамалея в 1897 году наблюдал лизис бацилл сибирской язвы. Однако первая научная публикация о фагах — статья 1915 года английского микробиолога Ф. Туорта, в которой он описал инфекционное поражение стафилококков, значительно изменявшее морфологию колоний. Инфекционный агент свободно проходил через бактериальные фильтры, и его можно было переносить из одной колонии в другую. Туорт выдвинул несколько гипотез, объясняющих это явление, в частности — гипотезу о фильтрующемся вирусе, подобном вирусам растений и животных. Однако его работа не привлекла внимания ученых, а Туорт забросил ее из-за службы в армии: началась Первая мировая.
В 1917 году канадский бактериолог Ф. Д’Эрелль независимо от Туорта сообщил об открытии вируса, «пожирающего» бактерий, — бактериофага [4]. Микробиологи того времени считали, что чума свиней вызывается совместным действием микроба и вируса. Д’Эрелль предположил, что схожая этиология и у дизентерии. С помощью свечей Шамберлана он отфильтровал фекалии больных дизентерией и добавил их в пробирки с культурами шигелл, намереваясь ввести смесь бактерий и предполагаемого вируса экспериментальным животным. Однако на следующие сутки он обнаружил, что бульон, в котором росли шигеллы, стал прозрачным, что свидетельствовало о гибели бактерий. Профильтровав бульон из этих пробирок, он снова заразил полученными фильтратами культуры шигелл. И вновь на следующие сутки он обнаружил, что бульон стал прозрачным. Полученное «литическое начало» можно было бесконечно пассировать от одной культуры к другой, что привело Д’Эрелля к мысли о существовании вируса, разрушающего бактерии. В дальнейшем он обнаружил фаги стафилококка, холерного вибриона и сальмонеллы. Учитывая эффективность фагов против патогенных микроорганизмов и их широкое распространение в природе, Д’Эрелль предположил, что они играют определенную роль в развитии иммунитета к инфекционным заболеваниям и выздоровлении.
В 1920–1940-е годы было проведено множество исследований по клиническому применению бактериофагов, однако стабильных результатов получено не было, и на Западе бактериофаги стали в основном объектом изучения биологов. В 1931 году Совет фармации и химии Американской медицинской ассоциации опубликовал обзор 150 работ по фаготерапии, в котором M. Итон и С. Бэйн-Джонс [5] утверждали, что природа фага неживая; возможно, это фермент, и ошибочно связывать воздействие фага на бактерии или его терапевтический эффект с его жизнедеятельностью. Такие выводы способствовали существенному сокращению капиталовложений в исследования по медицинскому применению фагов на Западе.
В СССР в ранние годы бактериофагам уделяли достаточно внимания. В 1923 грузинский микробиолог Г.Г. Элиава, ученик Д’Эрелля, основал в Тбилиси Институт бактериофагов, ставший впоследствии Всесоюзным центром фаготерапии, коллекция которого на сегодняшний день составляет около 3000 фаговых штаммов. Однако успешное применение антибиотиков в 1960–1970-е годы практически похоронило идеи фаготерапии. Так, например, в Большой советской энциклопедии указано: «Антибиотики и другие химиотерапевтические средства оказались эффективнее фагов, в связи с чем их применение с лечебной целью сузилось».
Происхождение
Вопросом о природе бактериофага задавался еще Туорт в своей первой статье. Д’Эрелль в своем фундаментальном труде выдвинул несколько теорий (гипотез) происхождения фагов, из которых две сохранили значение до настоящего времени: «теория вируса» и «регрессивная теория».
В рамках вирусной теории бактериофаги, подобно вирусам растений и животных, рассматриваются как прямые потомки неких очень примитивных форм, существовавших еще до появления клеток, и представляют собой автономные агенты, являющиеся облигатными паразитами бактерий. Этой теории придерживался Д’Эрелль в самом начале своих исследований, и ее принимало как нечто само собой разумеющееся большинство вирусологов. Но эта концепция, по сути, мало что дает, так как в применении к вирусам такие термины, как автономность и паразитизм, трудно поддаются определению, а сама гипотеза сложно доказуема, поскольку нет ископаемых останков вирусов, а их родственные связи можно изучать только методами молекулярной филогенетики [6].
Согласно регрессивной теории, фаги постепенно развивались из более сложных форм жизни путем утраты всей протоплазмы, ненужной для присущего бактериофагу способа существования. Эта гипотеза лучше вписывается в современную биологию, так как промежуточные стадии процесса дегенерации довольно легко себе представить, а постепенную утрату бактериями способности к синтезу можно изучать экспериментально.
Вполне возможно, что бактериофаги произошли из примитивного полового аппарата бактерий, первоначально развившегося для передачи генетического материала от одной бактериальной клетки к другой. Это могло бы объяснить, почему некоторые фаги и в настоящее время способны выполнять эту функцию путем лизогенной конверсии. Теория предполагает, что генетический материал фагов — это редуцированный и модифицированный нуклеоид бактерий, сохранивший гомологию с «прародителем» и потому способный с ним рекомбинировать или даже частично замещать его. Это могло бы объяснить свойства умеренных фагов, способных встраиваться в определенные локусы ДНК клетки-хозяина, становясь частью бактериального наследственного аппарата. В процессе эволюции умеренные фаги могли путем дальнейших мутаций, влияющих на спектр литического действия [7], необратимо превращаться в вирулентные, поражающие хозяев, с которыми они не имели генетического родства. Согласно этой теории, различные штаммы фагов филогенетически не связаны друг с другом, и определенный фаг даже может быть филогенетически ближе клетке-хозяину, нежели другим фагам. Отсюда следует, что если данная теория верна, то между бактериофагами и вирусами животных и растений нет никакого родства, а фенотипическое сходство — чисто внешнее, обусловленное сходной экологией.
Тем не менее биоинформатические подходы — сравнения огромных массивов геномов и фолдингов белков, а особенно «архитектуры» фаговых частиц — всё же позволяют находить у бактериофагов, фагов архей и вирусов в целом филогенетически общие признаки [3], [8].
Строение и классификация
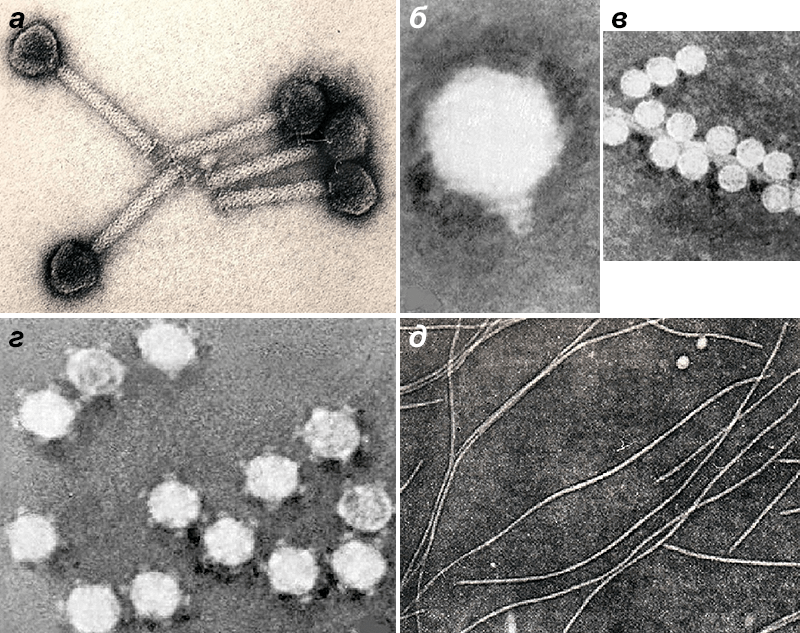
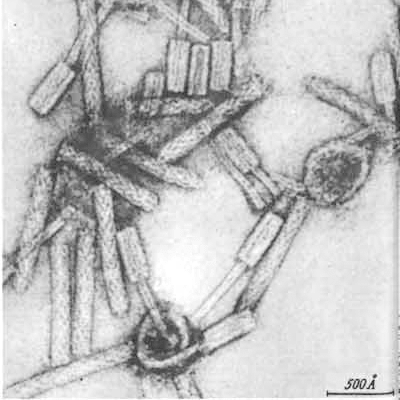
На протяжении почти 70 лет бактериофаги, как и другие вирусы, были для биологов такими же невидимыми, как атомы для физиков, в силу их субмикроскопических размеров. И только в 1942 году, с помощью недавно изобретенного (М. Кнолль, Э. Руска, 1931 г.) электронного микроскопа, будущий нобелевский лауреат С. Лурия (Колумбийский университет) и Т. Андерсон (RCA-лаборатория, Камден, Нью-Джерси) получили первые фотографии бактериофага Т2, или «анти-коли РС», как его называли Лурия и Андерсон (рис. 1).
Рисунок 1. Изображения бактериофага Т2, полученные С. Лурия и Т. Андерсоном с помощью просвечивающего электронного микроскопа: а — первая в мире фотография бактериофага (2 марта 1942 г.); б — бактериофаг Т2 в культуре Escherichia coli (2 марта 1942 г.); в — Т2 «крупным планом» (29 марта 1962 г.).
[42] (фото а и б)
Рисунок 2. Микрофотография фага Т2, полученная с помощью сканирующего электронного микроскопа.
Фаги весьма разнообразны по морфологии — в отличие от вирусов животных и растений. Все известные в настоящее время вирусы эукариот имеют либо форму многогранника (икосаэдра), либо спиралевидный тип симметрии. Что же касается фагов, то среди них тоже встречаются формы со спиралевидным или кубическим типами симметрии, но подавляющее число изученных к настоящему времени фагов сочетает в одной частице оба типа: кубический — у головки, а спиралевидный — у отростка (рис. 2). Столь своеобразное строение фагов, отличающее их от других вирусов, объясняется наличием у бактерий ригидной клеточной стенки, которая исключает возможность проникновения вирионов в клетку путем пиноцитоза или виропексиса. Такая структурная особенность бактерий способствовала формированию у фагов других способов инфицирования, что и нашло отражение в их облике.
Именно морфология легла в основу современной классификации бактериофагов. Казалось бы, целесообразнее разделять фаги по принципу их связи с определенным видом микроорганизма, который они поражают, — что и легло в основу первых классификаций. Но этот принцип не обеспечивает необходимой точности, так как один штамм фага может поражать разные микроорганизмы, то есть иметь широкий литический спектр. И наоборот, один вид бактерий может поражаться несколькими фагами, различающимися между собой по целому ряду свойств, в том числе морфологически, тогда как фаги, активные в отношении разных видов и даже родов микроорганизмов, могут быть морфологически тождественны.
Были попытки классифицировать фаги и по сумме признаков (антигенных, физиологических, биохимических, физико-химических, морфологии негативных колоний, спектру литического действия и т. п.).
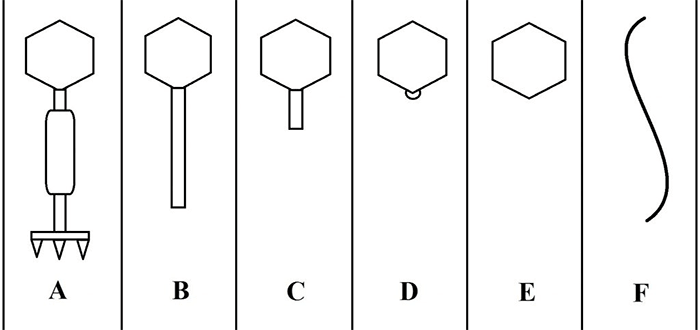
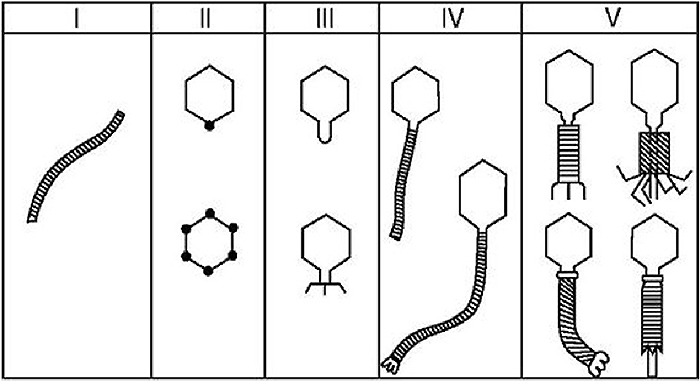
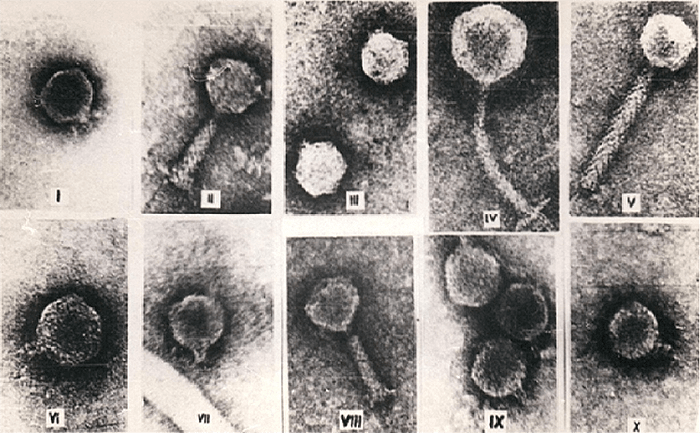
С развитием электронной микроскопии появилась возможность классифицировать фаги по морфологии. Дэвид Бредли в 1967 году предложил разделить фаги на шесть морфологических групп: с A по F (табл. 1, рис. 3). Вторая используемая классификация, предложенная А.С. Тихоненко в 1968, объединяет фаги групп D и E в одну (табл. 1, рис. 4). Микрофотографии фагов, относящихся к разным морфогруппам, представлены на рисунках 5 и 6.
| Группа по Бредли | Группа по Тихоненко | Морфология | Тип нуклеиновой кислоты |
|---|---|---|---|
| A | V | С сокращающимся отростком | Двухцепочечная ДНК |
| B | IV | С длинным несокращающимся отростком | Двухцепочечная ДНК |
| C | III | С коротким несокращающимся отростком | Двухцепочечная ДНК |
| D | II | Без отростка, с капсомерами | Одноцепочечная ДНК |
| E | II | Без отростка и капсомеров | Одноцепочечная РНК |
| F | I | Нитевидные | Одноцепочечная ДНК |
Рисунок 3. Схематическое изображение фаговых морфогрупп по Бредли (1967).
рисунок автора статьи
Рисунок 4. Схематическое изображение фаговых морфогрупп по Тихоненко (1968)
Рисунок 5. Различные морфоварианты бактериофагов.
микрофотографии автора статьи
Рисунок 6. Микрофотографии бактериофагов из разных морфогрупп: а — фаг 1997 Yersinia enterocolitica с длинным несокращающимся чехлом; б — фаг Т3 с коротким отростком; в — фаг МS2 без отростка; г — фаг Х174 без отростка, с капсомерами; д — нитчатый фаг Fd.
микрофотографии автора статьи
Рисунок 7. Схема строения вириона фага семейства Myoviridae
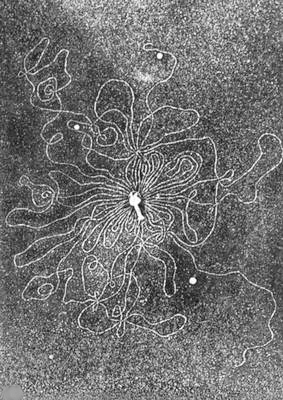
Большинство фагов состоит из головки диаметром 45–140 нм и отростка («хвоста») толщиной 10–40 нм и длиной 100–200 нм (рис. 7). Так выглядят представители порядка Caudovirales («хвостатых фагов»), и именно их образ обычно извлекается из памяти при упоминании термина «бактериофаг». Содержимое головки состоит преимущественно из плотно упакованной молекулы ДНК или (реже) РНК, длина которой во много раз превышает размеры головки и достигает 60–70 мкм (рис. 8), и иногда небольшого количества белка — например, ферментов, которые осуществляют первичную транскрипцию генетического материала фага или способствуют ей. Капсид представляет собой белковую или (не у Caudovirales) липопротеиновую оболочку, собранную из множества копий одного или двух белков. Капсид может быть икосаэдрическим, сферическим, лимоновидным или плеоморфным [9], и именно он, по сути, определяет размер фагового генома.
Рисунок 8. Микрофотография бактериофага с высвободившейся нитью ДНК.
Отросток представляет собой белковую трубку, окруженную у ряда бактериофагов (семейства Myoviridae, типовой представитель которого — фаг Т4) чехлом, состоящим из сократительных белков, подобных мышечным, благодаря чему он способен сокращаться, обнажая часть стержня. С головкой отросток стыкуется с помощью белкового кольца — «портала» («воротничка»). На противоположном конце, в основании, отросток содержит лизоцим (как домен белка, пронзающего клеточную стенку), служащий для точечного растворения пептидогликана. Возможно и нахождение в основании отростка АТФазы, обеспечивающей энергией инъекции нуклеиновой кислоты в бактерию [10]. Там же у фагов такого типа имеется гексагональная базальная пластинка с несколькими шиповидными выростами и тонкими длинными нитями, с помощью которых фаг распознает рецепторы «своих» бактерий и прикрепляется к ним.
Нитевидные фаги имеют размеры 8×800 нм и лишены выраженных «органов».
Бактериофаги довольно устойчивы к воздействию различных химических и физических факторов. Они выдерживают колебания рН в пределах 5,0–8,0; большинство резистентно к действию холодных водных растворов глицерина и этанола, а также цианидов, фторидов, динитрофенола, хлороформа, тимола и фенола. Бактериофаги хорошо сохраняются в лиофилизированном состоянии, но разрушаются при кипячении, УФ-облучении, действии некоторых химических дезинфектантов (в частности, кислот и формалина). Фаги хорошо сохраняются при низких температурах (до −200 °С в глицерине), но быстро инактивируются при 65–70 °С [10].
Взаимодействие с бактериями
Фаги — облигатные внутриклеточные паразиты, так как у них нет механизмов для выработки энергии и рибосом для синтеза белка. Размножение фага происходит только внутри бактерии-хозяина и посредством ее синтетической машинерии. Важным свойством бактериофагов является их специфичность: фаги могут поражать определенный вид бактерий (моновалентные фаги) или же только избранные штаммы/варианты внутри вида (типовые фаги, например, фаги V. cholerae classica и El Tor), но некоторые не столь разборчивы и поражают бактерий разных видов и даже родов (поливалентные фаги) [11]. Тем не менее очень сложно судить о специфичности фагов в природных условиях, поскольку там действуют многочисленные методологические ограничения и популяционные закономерности, и порой один и тот же фаг можно принять как за «генералиста», так и за «специалиста» [12].
По характеру действия на бактерии различают вирулентные и умеренные фаги.
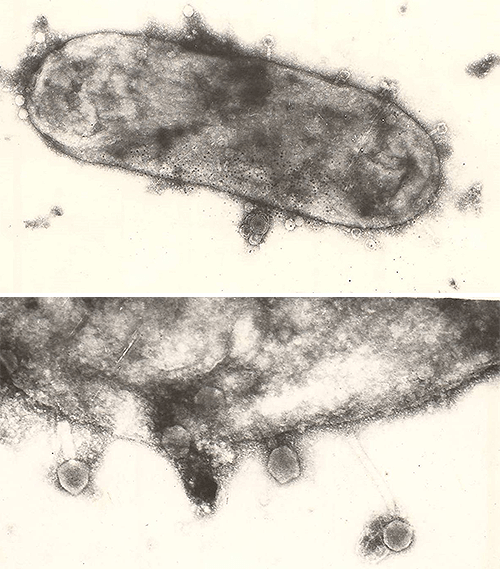
Рисунок 9. Адсорбция фага PIcmlclr 100ts на поверхности Yersinia pestis.
микрофотографии автора статьи
Рисунок 10. Лизис E. coli и выход фаговых частиц. Справа — зрелая форма бактериофага.
микрофотографии автора статьи
Но некоторые фаги способны покидать клетку без лишнего шума. Так делает, например, фаг L2, паразитирующий в бактериях рода Acholeplasma, лишенных клеточной стенки (их знаменитые родственники — микоплазмы). Вначале он проходит все стадии, соответствующие определению «литический цикл» — но за исключением собственно лизиса хозяина: вирионы как бы отпочковываются от бактерии, захватывая небольшие участки ее мембраны, которые становятся оболочкой фага. После такого деликатного литического цикла L2 может приступить к лизогенизации [20].
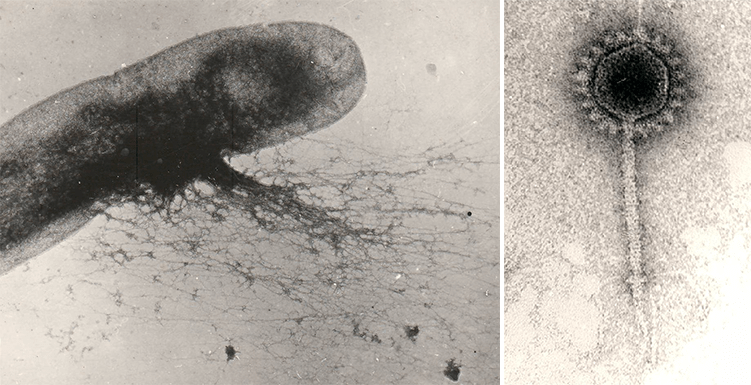
Рисунок 11. Дефектные фаги — пиоцины (бактериоцины Pseudomonas aeruginosa). Многие бактерии (особенно γ-протеобактерии) экспонируют на своей поверхности тейлоцины (tailocins) — «перевернутых безголовых фагов». Эти фаговые хвосты незаменимы в конкурентной борьбе бактерий с близкими родственниками (такие структуры называют бактериоцинами), а иногда служат для поражения эукариотических клеток (PLTS, фагоподобные структуры для транслокации белков). Гены тейлоцинов бактерии заимствовали у различных профагов семейств Myoviridae и Podoviridae, причем ДНК одной бактерии может содержать несколько генетических кластеров разных тейлоцинов наряду с полноценными родственными либо неродственными профагами, кодирующими все «запчасти» вириона [43]. Размножаться «дефектные фаги» не могут из-за отсутствия головки с ДНК, однако множественные отростки на поверхности клетки-хозяина способны подобно шприцам с токсичным содержимым повреждать клетки жертв.
микрофотография автора статьи
Бактериальный иммунитет
Казалось бы: если бактериофаги атакуют любых бактерий и их численность настолько велика (фаги — самые многочисленные вирусные формы в биосфере Земли, их общее количество — 10 30 –10 32 фаговых частиц [21], что примерно равно количеству бактерий, 4–6×10 30 ), то почему они до сих пор не уничтожили всех бактерий? Ответ очевиден: в процессе эволюционного соразвития бактерии выработали своего рода иммунитет против фагов. Причем иммунитет многослойный. Во-первых, бактерия может быть изначально лишена рецепторов к тому или иному фагу или лишиться их посредством мутаций. Во-вторых, бактерия может быть иммунизирована уже «прописавшимися» в ней профагами, которые с помощью специфических репрессоров просто не дадут вновь прибывшим сородичам размножиться. В-третьих, бактерия (или ее мобильные генетические элементы) кодирует рестрикционно-модификационные системы, которые просто рубят на кусочки нуклеиновые кислоты, не содержащие особых метильных меток — подписей «я свой».
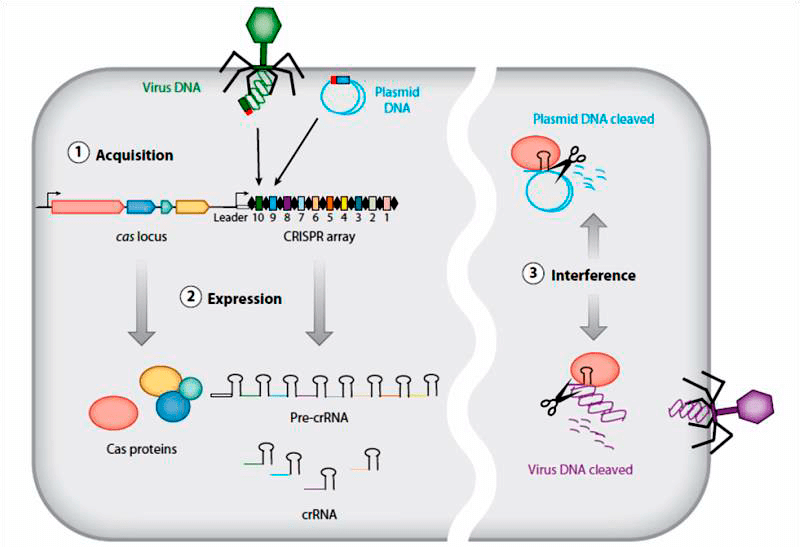
А в-четвертых. В 2005 году стало известно, что функциональной основой бактериального иммунитета является система CRISPR [22], двумя годами позже — что для ее работы критически важен белок Cas, а в 2012-м уже появилась возможность создания инженерных систем на основе CRISPR-Cas9 Streptococcus pyogenes [23]. Работа системы CRISPR-Cas основана на том, что небольшой фрагмент, вырезанный из проникшей в бактериальную клетку фаговой ДНК, вставляется в специальный участок (локус CRISPR) генома бактерии. Каждый локус CRISPR содержит множество таких вставок (спейсеров, разделенных особыми короткими нуклеотидными повторами), представляющих собой фрагменты ДНК встреченных когда-либо фагов и плазмид. На основе спейсеров синтезируются молекулы РНК, комплементарные соответствующему участку фагового (или плазмидного) генома. Эти РНК в комплексе с белками Cas затем опознают и обезвреживают мишень — чужеродную ДНК с комплементарной последовательностью нуклеотидов. Таким образом, если в клетку однажды проникла фаговая ДНК, но клетка выжила и встроила фрагмент чужеродного генома в свой нуклеоид, то последующие попытки таких же фагов эксплуатировать клетку или ее потомков будут неэффективны [24].
Впрочем, бактериофаги за счет случайных мутаций и отбора умеют обходить системы CRISPR-Cas. Чтобы конкретный спейсер потерял эффективность, достаточно даже незначительного изменения комплементарного ему фрагмента фагового генома. Поэтому фаги успешно и довольно быстро преодолевают приобретенный иммунитет бактерий за счет точечных мутаций. С другой стороны, системы CRISPR очень широко распространены у бактерий и, судя по всему, обеспечивают своим обладателям надежную защиту. Эффективность CRISPR обеспечивается тем, что даже две разные бактерии одного и того же штамма встраивают в свой геном разные спейсеры, соответствующие разным участкам генома фага. В результате популяция бактерий быстро приобретает генетическое разнообразие, что значительно повышает их шансы на выживание. Точечные мутации, «обезвреживающие» один спейсер, позволят фагам заразить только небольшую часть бактериальной популяции. К тому же, бактериофаг не может определить заранее, какие спейсеры имеются у конкретной клетки. Поэтому большинство фагов в полиморфной популяции бактерий погибает даже при высокой скорости появления точечных мутаций.
Такой феномен коллективного бактериального иммунитета был продемонстрирован на бактериях P. aeruginosa и фагах DMS3vir [28]. Для начала ученые убедились, что система CRISPR действительно защищает бактерий от данной разновидности фагов, а культуры бактерий с отключенной CRISPR-системой активно этим фагом поражаются, хотя и выработали иную форму защиты: у них распространились мутации, меняющие рецептор, к которому прикрепляется фаг. Такой способ защиты оказался менее эффективным, так как по истечении 30 суток эксперимента бактериофаги всё еще находились в популяции. Чтобы доказать, что разнообразие спейсеров системы CRISPR-Cas — основа эффективности коллективной иммунной защиты, ученые сравнили устойчивость к фагам у бактериальных популяций с разным уровнем разнообразия спейсеров. Оказалось, что фаги в монокультурах бактерий уже в первые сутки приобретали мутации, нейтрализующие соответствующие спейсеры. У фагов же в популяциях, составленных из нескольких клонов бактерий с различными спейсерами, устойчивость формировалась лишь в немногих случаях. В популяциях, сформированных из 24–48 клонов, фаги не смогли преодолеть защиту CRISPR-Cas.
Отсюда следует, что в монокультуре единичная мутация фаговой ДНК, обеспечивающая защиту от конкретного спейсера, позволяет фагу заразить любую бактерию, а в полиморфной культуре из 48 клонов точно такая же мутация обеспечивает успех с вероятностью лишь 1/48. Даже при условии, что ДНК фага встроится в бактерию, защиту которой он преодолел, его потомки снова столкнутся с той же проблемой, и она будет усугубляться по мере снижения численности бактерий, чувствительных к этому фагу.
Таким образом, точечные мутации и отбор — недостаточно эффективная для вирусов эволюционная стратегия, что объясняет успешность систем CRISPR-Cas и их широкое распространение у бактерий. Но тогда почему бактериофаги до сих пор не «вымерли» — раз эта система так эффективна? Не так давно у них обнаружили особые гены, подавляющие работу CRISPR [29]. А что же могут противопоставить бактерии? Ответ, опять же, в разнообразии: существует много разных вариантов системы CRISPR, каждый из которых уязвим только для некоторых анти-CRISPR-генов и защищен от других. Содержать же в своем геноме множество подобных генов бактериофаги не могут, так как отбор у них ведется преимущественно в направлении компактизации генома — в угоду увеличению скорости размножения.
Такая антагонистическая коэволюция фагов и бактерий, протекающая параллельно на разных уровнях и в разных временных масштабах (формирование новых спейсеров бактериями — точечные мутации фагов, выработка новых генов анти-CRISPR — формирование новых вариантов системы CRISPR) позволяет соблюдать баланс в системе «бактериофаг — бактерия» на уровне одной популяции и биоценоза в целом [28], [30].
Получение бактериофагов
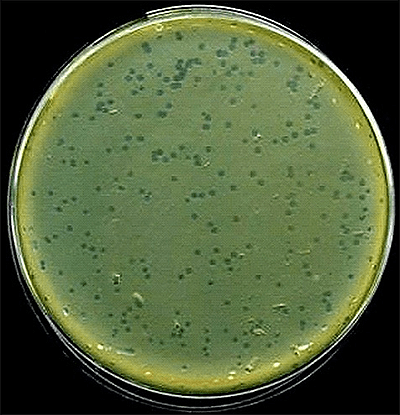
Рисунок 12. Фаговые бляшки (зоны лизиса на культуре E. coli).
Бактериофаги широко распространены в природе. Везде, где есть бактерии — есть фаги. Их можно выделить из открытых полостей организма человека и животных, водоемов, сточных вод, почвы, из соответствующих культур бактерий и т.д. Большое количество бактериофагов находится в выделениях больных людей и животных, особенно в период выздоровления от инфекционных заболеваний.
Таким образом, поиск и выделение новых фагов не представляет трудности. Для выделения бактериофага исследуемый материал (воду, испражнения, гной, почву и др.) засевают в жидкую питательную среду, инкубируют в термостате, и через сутки помутневшую жидкость пропускают через бумажный, а затем через бактериальный фильтры, асбестовые пластины, керамические свечи. Полученный фильтрат исследуют на наличие бактериофага путем совместного посева с подходящей микробной культурой на плотные или в жидкие питательные среды. Если бактериофаг выделился, то после 18-часовой инкубации на поверхности агара вырастает сплошной газон культуры с прозрачными бляшками — зонами лизиса (рис. 12). В бульоне бактериофаг обусловливает просветление среды.
Для выделения чистой культуры бактериофага материал из отдельной бляшки переносят бактериологической иглой в суспензию молодой микробной культуры.
Материал из вновь возникшего стерильного пятна засевают вместе с фагочувствительными микробами в жидкую питательную среду. После 6–18 часов инкубации среду фильтруют и получают чистую культуру бактериофага.
Для изготовления серийного препарата бактериофага применяют только апробированные штаммы и культуры микробов, обладающие типичными морфологическими, биохимическими и серологическими свойствами. Штаммы бактериофагов должны быть музейными и рабочими. Музейные производственные штаммы ежегодно обновляются путем выделения новых или пассажами имеющихся фаговых штаммов через организм больного, а также адаптацией к свежевыделенным, резистентным к данному бактериофагу культурам.
Промышленное получение бактериофага в настоящее время осуществляют в специальных аппаратах — реакторах емкостью 250–1000 л, с применением аэрации как фактора, стимулирующего развитие микроорганизмов. В реактор наливают жидкую питательную среду, которую стерилизуют при температуре 110 °С в течение 40 минут. После стерилизации среду охлаждают до 39 °С и засевают соответствующей микробной культурой и бактериофагом одновременно. Для засева используют 18-часовые агаровые культуры, которые прибавляют из расчета 50 млн микробных клеток на миллилитр среды. Бактериофаг добавляют в количестве не более 0,3 % по отношению к объему питательной среды. Среду с бактериальной культурой и фагом оставляют при температуре 37 °С на 6–18 часов. Фаги активно размножаются внутри бактериальных клеток и вызывают их лизис, что внешне проявляется полным просветлением среды. К полученному лизату добавляют в качестве консерванта хинозол (0,01 %) или фенол (0,25 %) и не позже чем через два часа после этого фильтруют содержимое реактора через бактериальные фильтры для удаления оставшихся микробных клеток.
Полученный препарат бактериофага должен иметь вид совершенно прозрачной жидкости желтого цвета. Он проходит контроль на стерильность, безвредность и литическую активность. Безвредность препарата проверяют путем введения животным. Например, брюшнотифозный и дизентерийный бактериофаги вводят подкожно трем мышам по 1 мл, либо внутривенно одному кролику 5 мл. За животными наблюдают в течение 3–4 суток. Литическую активность бактериофага определяют титрованием в жидкой питательной среде методом Аппельмана, на плотной питательной среде — методом Отто. За титр бактериофага при определении методом Аппельмана принимают то его наибольшее разведение, которое вызывает полный лизис тестовой культуры микроорганизмов.
После проведения контрольных исследований препарат разливают во флаконы нейтрального стекла. Помимо жидких препаратов бактериофага могут изготавливать и сухие. Для их получения фаголизат осаждают сернокислым аммонием, осадок отделяют от жидкой части, добавляют к нему стабилизатор (9 % глюконат кальция), смесь тщательно растирают и лиофилизируют [31].
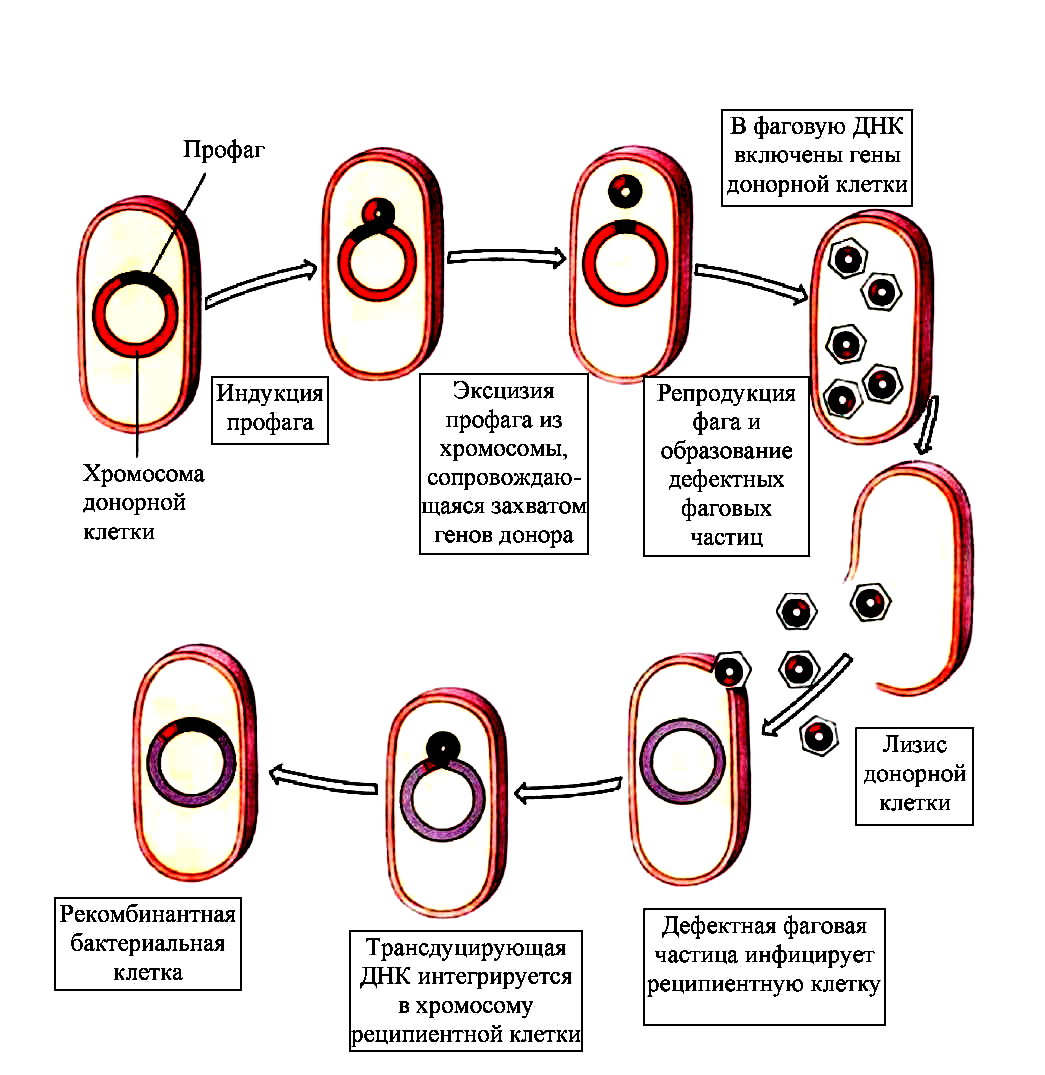
Биологическое значение бактериофагов
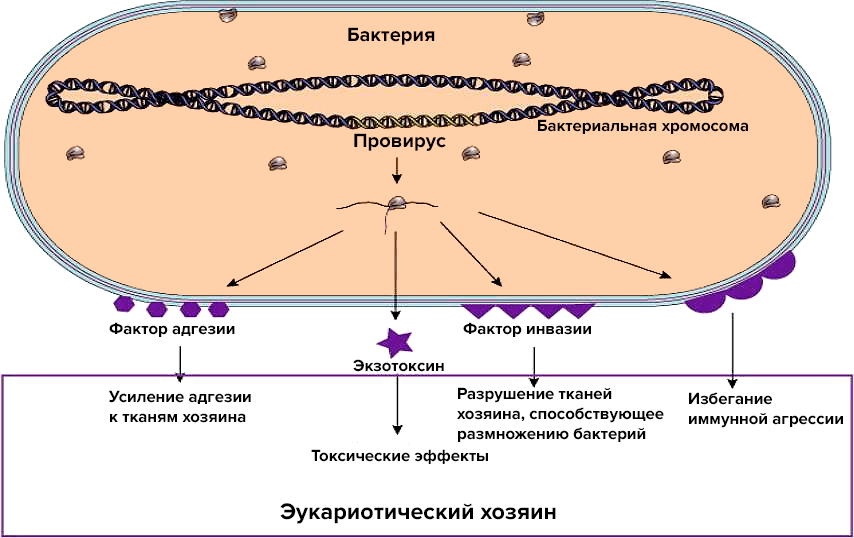
Бактериофаги играют важную роль в круговороте углерода и энергии, контроле численности микробных популяций и эволюции бактерий. Бактериофаги, будучи подвижными генетическими элементами, служат мощным фактором изменчивости бактерий. Например, они осуществляют процесс трансдукции — перенос бактериальных генов из одной клетки в другую: вырезаясь из генома одной бактерии, они могут прихватывать с собой в капсид ее гены и, инфицируя другую клетку, передавать их новому хозяину. Есть все основания предполагать, что большинство бактерий содержит профаги. Многие культуры несут 2–4 и даже более умеренных фагов, то есть являются полилизогенными. Например, многие актиномицеты и клубеньковые бактерии содержат в геноме четырех и более профагов.
Способность фагов менять фенотип бактерий путем привнесения чужеродных (и фаговых в том числе) генов может быть одновременно залогом процветания для бактерий и источником больших проблем для человечества: так бактерии могут приобретать факторы вирулентности и устойчивости — к другим фагам, антибиотикам и прочим воздействиям (если фаг, например, награждает бактерию способностью формировать биопленки) [32]. В 1951 году была описана фаговая конверсия Corinebacterium diphtheriae: оказалось, что ген tox, кодирующий дифтерийный токсин, в геном нетоксигенных бактериальных штаммов привносится умеренным фагом β. В результате коринебактерия производит сильнейший токсин, инактивирующий в человеческих клетках один из компонентов трансляционного аппарата — EF-2 (эукариотический фактор элонгации 2). Подавление синтеза белка проявляется своеобразной дифтерийной симптоматикой. Аналогичные механизмы приобретения патогенных свойств позже выявили у холерных вибрионов, сальмонелл, клостридий и др.
Лабораторное и промышленное применение бактериофагов
Способность фагов к внесению в клетку определенного количества генетического материала, упакованного в капсид, широко эксплуатируется в генной инженерии: их часто используют в качестве векторов различного назначения. Например, для создания библиотек генов нередко конструируют векторы на основе бактериофага λ, содержащего двухцепочечную ДНК. Левое и правое плечи ДНК фага содержат гены, необходимые для литического цикла, а среднюю — несущественную для размножения — часть молекулы можно заменять крупным (примерно до 24 т.п.н.) фрагментом чужеродной ДНК, включая эукариотическую. Такую рекомбинантную ДНК упаковывают в вирионы и заражают ими подходящую культуру бактерий, которая затем многократно воспроизводит фаговую ДНК с интересующими человека фрагментами.
Из-за высокой специфичности многие фаги служат диагностическими инструментами для идентификации бактериальных культур в медицинской, ветеринарной, технической микробиологии и фитопатологии. Метод фаготипирования, основанный на исключительной специфичности определенных фаговых штаммов, позволил распределить на фаготипы ряд штаммов бактерий, неотличимых друг от друга по другим признакам. Фаготипирование с успехом применяют для идентификации типов кишечной палочки, сальмонелл (включая возбудителя брюшного тифа), стафилококков и др. Этот метод дает эпидемиологам возможность отследить цепочку случаев заболевания и определить источник инфекции.
Бактериофаги прекрасно подходят для быстрого обнаружения небольших количеств патогенных бактерий во внешней среде: появляются и множатся хозяева — нарастает титр специфического бактериофага. Определение колифагов стало одним из ключевых мероприятий в санитарном контроле вод, поскольку позволяет выявить фекальное загрязнение даже при малом количестве кишечной палочки, не определяемом бактериологическими методами.
Фаги применяются и в борьбе с бактериальными вредителями различных технических брожений, и в производстве ферментов с помощью бактериальных культур. В то же время, заражая промышленные культуры, бактериофаг вредит «полезным» производственным штаммам (вакцинным, продуцентам антибиотиков, возбудителям молочнокислого, ацетонобутилового и некоторых других брожений), чем вызывает серьезные нарушения технологического процесса.
Применение бактериофагов в медицине
Первый отчет об успешной фаготерапии был опубликован в 1921 году фламандцами Р. Бранохе и Ж. Майсином, которые использовали бактериофаг для лечения кожной стафилококковой инфекции [33].
Как уже было упомянуто, западная медицина c середины ХХ века практически отказалась от использования бактериофагов в терапевтических целях [5], однако в СССР фаги довольно широко применялись. Одним из самых, пожалуй, масштабных примеров практического применения фагов является использование комплексного препарата бактериофагов в Сталинграде во время Великой Отечественной войны. З.В. Ермольева во время работы в Ташкентском институте вакцин и сывороток разработала препарат, содержащий 19 видов бактериофагов, в том числе холерный, брюшнотифозный и дифтерийный. Во время Сталинградской битвы в связи с угрозой эпидемии холеры было налажено производство холерного фага в самом Сталинграде, и препарат ежедневно принимали около 50 тысяч человек [34].
После войны в СССР приступили к промышленному производству фаговых препаратов, которое действует и в настоящее время. В России производством бактериофагов занимаются в основном филиалы НПО «Микроген»: «Иммунопрепарат» (г. Уфа), «ИмБио» (г. Нижний Новгород), «Биомед» (г. Пермь).
На данный момент в РФ зарегистрировано и производится 13 фаговых препаратов (табл. 2).
| Препарат | Применение* | Состав |
|---|---|---|
| Секстафаг®, пиобактериофаг поливалентный жидкий | Для лечения и профилактики заболеваний, вызванных стафилококками, стрептококками, протеями, клебсиеллами, синегнойной и кишечной палочками | Стерильный фильтрат фаголизатов бактерий Staphylococcus, Streptococcus, Proteus (P. vulgaris, P. mirabilis), Pseudomonas aeruginosa, Klebsiella pneumoniae, энтеропатогенных Escherichia coli |
| Интести-бактериофаг | Для лечения и профилактики заболеваний, вызванных стафилококками, стрептококками, протеями, клебсиеллами, синегнойной и кишечной палочками | Смесь стерильных фильтратов фаголизатов Shigella flexneri (сероваров 1, 2, 3, 4, 6), Shigella sonnei, Salmonella enterica (сероваров Paratyphi A, Paratyphi B, Typhimurium, Infantis, Choleraesuis, Oranienburg, Enteritidis), энтеропатогенных Escherichia coli (серогрупп, наиболее значимых в этиологии кишечных инфекций), Proteus vulgaris, Proteus mirabilis, Enterococcus, Staphylococcus, Pseudomonas aeruginosa |
| Пиобактериофаг поливалентный очищенный | Для лечения и профилактики различных форм гнойно-воспалительных заболеваний и инфекций ЖКТ | Стерильный фильтрат фаголизатов Staphylococcus, Streptococcus, Proteus mirabilis, Proteus vulgaris, Escherichia coli, Pseudomonas aeruginosa, Klebsiella pneumoniae |
| Пиобактериофаг комплексный жидкий | Для лечения гнойно-воспалительных заболеваний, обработки операционных и свежеинфицированных ран | Смесь стерильных фильтратов фаголизатов Staphylococcus, Streptococcus, Enterococcus, Proteus (P. vulgaris, P. mirabilis), Pseudomonas aeruginosa, энтеропатогенных Escherichia coli, Klebsiella pneumoniae, Klebsiella oxytoca |
| Бактериофаг стрептококковый | Для лечения и профилактики заболеваний, вызванных стрептококками | Стерильные фаголизаты Streptococcus spp. |
| Бактериофаг дизентерийный | Для лечения и профилактики дизентерии | Смесь стерильных фильтратов фаголизатов Shigella flexneri (сероваров 1, 2, 3, 4, 6) и Shigella sonnei |
| Бактериофаг стафилококковый | Для лечения и профилактики гнойно-воспалительных и кишечных заболеваний, вызванных стафилококками | Стерильные фаголизаты Staphylococcus spp. |
| Бактериофаг псевдомонас аеругиноза (синегнойный) | Для лечения и профилактики заболеваний, вызванных синегнойной палочкой | Стерильные фаголизаты Pseudomonas aeruginosa |
| Бактериофаг сальмонеллезный групп A,B,C,D,E | Для лечения заболеваний, вызванных сальмонеллами | Стерильный фильтрат фаголизатов наиболее распространенных сероваров Salmonella enterica (Paratyphi А и В, Typhimurium, Choleraesuis, Infantis, Oranienburg, Enteritidis) |
| Бактериофаг клебсиелл поливалентный очищенный | Для лечения и профилактики заболеваний, вызванных клебсиеллами | Стерильная смесь очищенных фильтратов фаголизатов Klebsiella (K. pneumoniae, K. ozaenae, K. rhinoscleromatis) |
| Бактериофаг коли | Для лечения и профилактики заболеваний, вызванных кишечной палочкой | Стерильный фильтрат фаголизатов патогенных штаммов Escherichia coli |
| Бактериофаг протейный жидкий | Для лечения и профилактики гнойно-воспалительных и кишечных заболеваний, вызванных протеями | Стерильный фильтрат фаголизатов Proteus vulgaris и Proteus mirabilis |
| Бактериофаг колипротейный | Для лечения и профилактики гнойно-воспалительных и кишечных заболеваний | Смесь стерильных фильтратов фаголизатов Proteus vulgaris, Proteus mirabilis и энтеропатогенных серогрупп Escherichia coli |
| * Производитель предупреждает, что препараты должны применяться после оценки чувствительности возбудителей болезни к фагам, что означает еще и необходимость идентификации бактерии-возбудителя. Кроме того, в случае тяжелых инфекций фаготерапия допустима только как часть комплексного лечения | ||
Отдельно стоит осветить вопрос применения фаготерапии в странах Запада. Как известно, после открытия антибиотиков работы, связанные с медицинским применением фагов, там были полностью свернуты. Однако в последние годы в связи с тревожной динамикой распространения внутрибольничных инфекций, резистентных к большинству известных антибиотиков, многие биотехнологические компании сделали резкий поворот к изучению возможности создания лекарств на основе бактериофагов. Однако, несмотря на существенные технологические преимущества, для создания эффективных препаратов необходима коллекция бактериофагов, действующих на клинически значимые штаммы возбудителей, и соответствующий опыт их клинического применения, чем эти компании пока не обладают.
С терапевтической целью бактериофаги применяют, например, в России, Грузии и Польше, причем самыми разными способами. Для коррекции кишечных дисбиозов жидкие препараты применяют внутрь или per rectum при помощи клизмы. Таблетированные формы принимают внутрь, возможно использование бактериофагов и в составе ректальных свечей. При кожных и раневых инфекциях их применяют в виде примочек на очаги поражения. При фарингитах, ларингитах и тонзиллитах препараты используют для орошения или полосканий, при отитах — закапывают в уши. Для лечения абсцессов в их полость вводят ватный шарик, пропитанный препаратом. Больным, страдающим хроническими остеомиелитами, препарат вводят непосредственно в пораженный участок кости. Также препараты можно вносить в брюшную, плевральную и суставные полости, а также применять в форме аэрозолей при поражениях легких. При инфекциях мочевыводящих путей бактериофаги вливают непосредственно в пораженный орган с помощью зонда. При гинекологических заболеваниях препарат вливают в матку либо применяют влагалищные тампоны, пропитанные фаговым раствором.
А еще их используют в методике под названием фаговый дисплей, которая, в частности, позволяет находить новые антитела для диагностики и терапии заболеваний: «Враг моего врага — мой друг. Как бактерии и вирусы помогают создавать антитела для лечения человека» [39]. — Ред.
Преимущества бактериофагов перед антибиотиками достаточно очевидны.
К сожалению, недостатков бактериофаги тоже не лишены.
Заключение
Прошло уже 100 лет с момента открытия бактериофагов. Неоправданно забытые на Западе и чудом сохранившиеся в России, они полвека пребывали в тени успеха антибиотиков. Но эпоха триумфа антибиотиков выявила и важнейшую проблему их активного применения — угрожающий рост резистентности к ним среди опасных патогенов, и многие ученые и врачи видят именно в фагах альтернативу антибиотикам. Если на сегодняшний день мы имеем штаммы бактерий, устойчивые даже к антимикробным препаратам «последней надежды», то фаги, благодаря описанным выше механизмам коэволюции с бактериями, никогда не утратят актуальности. За 100 лет они были детально изучены, признаны безопасными и стали незаменимым инструментом в генетике и биоинженерии, санитарной микробиологии и эпидемиологии, промышленности, медицине и даже в космической сфере (да-да, бактерии с профагом используют для оценки защиты обшивки космических кораблей от радиации). И как нельзя лучше характеризует значение фагов для человека древняя пословица: «Враг моего врага — мой друг».
Огромный и загадочный мир бактериофагов
Они живут везде, где только есть их хозяева — бактерии (читайте: повсюду!). Их присутствие незаметно, но оно влияет без преувеличения на каждого обитателя планеты. С начала прошлого столетия ученые не только с большим интересом исследуют мир фагов, но и находят способы применять их на благо человечества. Иллюстрация в полном размере.
Автор
Редактор
Рецензент
Бактериофаги, или фаги, — самые распространенные и вместе с тем самые загадочные обитатели нашей планеты. Их открыли в начале прошлого века, и в их лице многие ученые увидели спасительное средство от бактериальных инфекций, которого все так долго ждали. Но вскоре началась эра антибиотиков, и о фагах на время забыли. Очередная волна интереса к бактериофагам поднялась на пике развития молекулярной биологии — они стали модельными организмами, которые помогли заглянуть в самую суть жизни. Новое рождение биология фагов переживает прямо на наших глазах. С одной стороны, возросший интерес к ним обусловлен остро вставшей проблемой антибиотикорезистентности. В то же время, стало понятно, что вирусы бактерий — не просто паразиты, но и симбионты, регуляторы, которые образуют глобальную сеть передачи генетической информации в масштабах биосферы. Бактериофаги играют важную роль в биологии вездесущих прокариот, а те, в свою очередь, формируют условия, в которых обитают все эукариотические организмы, включая человека. Этой статьей «Биомолекула» начинает cпецпроект об увлекательном мире бактериофагов.
Бактериофаги
Партнер спецпроекта — НПЦ «Микромир» — производитель препаратов с бактериофагами для применения в медицине и ветеринарии.
Бактериофаги — это вирусы, заражающие бактериальные клетки. Они составляют наиболее многочисленную и эволюционно древнюю группу вирусов в биосфере Земли. Бактериофаги играют важную роль в контроле численности микробных популяций и в горизонтальном переносе бактериальных генов, выступая в качестве векторных систем.
В спецпроекте мы дадим общую информацию о бактериофагах, истории их изучения, использовании в лаборатории, попытках применения в медицине и ветеринарии и возможных будущих применениях.
Первые знакомства и начало науки о фагах
С миром микроорганизмов заочно были знакомы еще самые первые люди. Наши далекие предки наблюдали результаты жизнедеятельности этих невидимых для невооруженного глаза «соседей» повсюду: бактерии участвуют в формировании почвы и тем самым помогают выращивать урожай; делают несвежими продукты или, наоборот, помогают некоторые из них производить; вызывают болезни. Конечно же, поначалу никто не знал, что за это ответственны микроскопические существа. Коллективные усилия бактерий представали перед первобытными людьми то как благодать богов, то как проделки демонов.
Первым человечество познакомил с миром микроорганизмов нидерландский оптик-самоучка и исследователь-микроскопист Антони ван Левенгук в конце XVII века. Крохотные клетки, которые он увидел под микроскопом, произвели настоящий фурор [1]. На них интересно было смотреть, но пока еще никто не понимал, насколько важную роль они играют для человека и всей окружающей среды (рис. 1).
Рисунок 1. На пути к открытию бактериофагов: основные вехи. Конец XVII века. Антони ван Левенгук впервые увидел живые клетки под микроскопом [1]. 1892 г. Димитрий Иосифович Ивановский открыл первый вирус — вирус табачной мозаики. 1898 г. Британский химик и микробиолог Эрнст Ханбери Ганкин сообщил о литическом действии воды из рек Ганг и Джум, пропущенной через бактериальные фильтры, на возбудителей холеры. Считал, что это связано с летучим бактерицидным веществом. 1898 г. Российский и советский врач, микробиолог и эпидемиолог Николай Федорович Гамалея сообщил о «литическом ферменте», выделенном из лизата культур Baclillus anthracis. Вероятно, на самом деле это были бактериофаги. 1915 г. Фредерик Уильям Туорт впервые наблюдал лизис бактерий фагами. 1917 г. Повторное открытие вирусов бактерий и введение термина «бактериофаг» Феликсом д’Эреллем. 1940-е гг. Получены первые изображения бактериофагов под электронным микроскопом. Ученые убедились — фаги существуют!
Прошло еще почти два столетия, и стала зарождаться настоящая микробиология. Толчок дали работы двух великих ученых — Луи Пастера и Роберта Коха. К началу XX века многие микроорганизмы уже были изучены, открыты возбудители инфекций, против некоторых из них разработаны вакцины, лечебные токсиннейтрализующие сыворотки. Появилась полноценная бактериологическая диагностика.
В конце XIX века открыли и вирусы эукариот. Первым стал вирус табачной мозаики — его в 1892 году обнаружил русский физиолог и микробиолог Димитрий Иосифович Ивановский [2–4].
Казалось бы, мир паразитов изучен до самой последней границы, до самых простейших существ. Но ученых еще ожидал сюрприз, впоследствии положивший начало новому большому разделу биологии. Этим сюрпризом стали суперпаразиты — фаги, вирусы, способные поражать бактерий. Это оказалось настолько неожиданным, что в существование таких «молекулярных роботов» до того, как их удалось разглядеть в электронный микроскоп, отказывались верить некоторые маститые ученые и даже один Нобелевский лауреат.
Как и многие научные открытия, первое знакомство ученых с бактериофагами произошло благодаря случайности. Британский исследователь Фредерик Уильям Туорт (рис. 1, 2а) загорелся идеей вырастить на бесклеточной питательной среде вирус осповакцины (в то время не знали, что с вирусами так не получится). В 1913 году он решил культивировать вирус на бесклеточных средах, для чего использовал осповакцину, по случайности контаминированную стафилококками. Вирусы осповакцины в чашках Петри так и не появились, но Туорт заметил другой загадочный эффект: некоторые колонии стафилококков получились полупрозрачными. В них не было бактерий, но присутствовали какие-то мелкие частицы — видимо, остатки клеток. Когда Туорт переносил стекловидные колонии на свежие, те также превращались в «призраков». Британский ученый так и не понял, что же случилось, он лишь выдвинул три гипотезы. Возможно, стафилококков разрушил некий вирус; либо фермент, выделившийся из погибших клеток; либо какой-то другой «живой» фермент, способный воспроизводить сам себя. Как мы теперь знаем, одна из этих догадок попала точно в цель. Туорт первым предположил, что это вирусы, но, как и его современники, не понимал, что они собой представляют и как «работают» [8].
Второе открытие фагов совершил канадско-французский ученый Феликс д’Эрелль (рис. 2). В 1916 году в Париже он изучал вспышку дизентерии в драгунском эскадроне, стоявшем в Мезон Лавите. И снова, как у Туорта, первым шагом стало ошибочное предположение. Д’Эрелль считал, что диарею вызывает бактерия в сочетании с вирусом, и что они усиливают друг друга. Чтобы проверить эту догадку, ученый получил фильтраты фекалий больных и добавлял их в растущие культуры возбудителя. В результате фильтраты фекалий выздоравливающих пациентов разрушали (лизировали) культуры. А когда этот лизат высевали на агар вместе с новыми культурами, на бактериальных газонах появлялись прозрачные кружки, которые д’Эрелль назвал taches vierges — «чистые пятна» (сейчас их называют бляшками). В отличие от своего предшественника, д’Эрелль сразу понял, в чем дело, и объявил, что открыл вирусы бактерий. Он и назвал их бактериофагами (выбрать «имя» д’Эреллю помогла супруга) [2], [8], [9].
Рисунок 2а. Первооткрыватель бактериофагов Фредерик Уильям Туорт. Он первым увидел те самые бляшки на чашках Петри, но не смог однозначно объяснить, кто виновен в их возникновении.
Рисунок 2б. Феликс д’Эрелль — ученый, во второй раз открывший фагов, давший им название и заложивший основы фаготерапии.
Позже д’Эрелль пошел дальше и объявил фаги естественной защитной системой организма от бактериальных инфекций (в чем, к слову, отчасти оказался прав). В своих работах он критиковал ведущих иммунологов, чем очень уязвил бельгийского ученого Жюля Борде, получившего в 1919 году Нобелевскую премию за открытие системы комплемента. В ответ оскорбленный Борде заявил, что феномен, открытый самонадеянным французом, — всего лишь проявление аутолиза (когда бактериальные клетки разрушают сами себя своими же ферментами), и принялся доказывать свои идеи в экспериментах. Соперничество пошло только на пользу: оно помогло открыть некоторые важные свойства фагов. Все точки над i были расставлены в 1940 году, когда бактериофаги предстали перед учеными воочию, благодаря электронному микроскопу (рис. 1) [10].
Но это не конец истории, а только ее начало — благодаря фагам было сделано множество открытий в биологии и получена не одна Нобелевская премия. Подробнее об этом можно почитать в наших статьях «Пожиратели бактерий: убийцы в роли спасителей» [11] и «Модельные организмы: фаг лямбда» [12].
Знакомьтесь: фаги
Функционал бактериофага, как и любого вируса, незамысловат: найти подходящую клетку, проникнуть в нее, наплодить новые вирусные частицы, освободить их и отправить на поиски новой жертвы. В остальное время нужно лишь обеспечить надежную защиту для генетического материала. В этом плане все бактериофаги практически не различаются, поэтому и их структура организована по одному принципу, включая одни и те же основные компоненты:
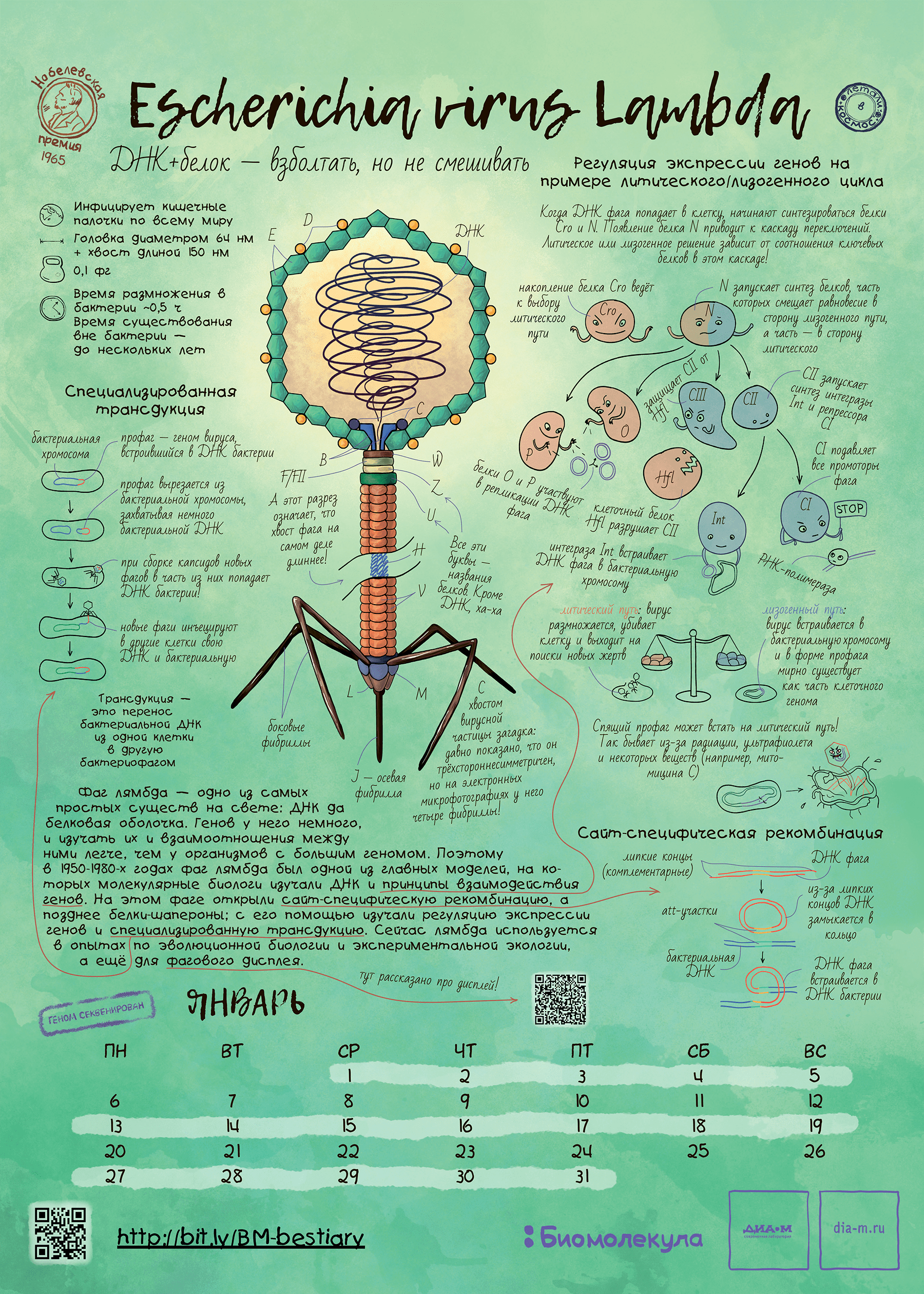
«Визитная карточка» большинства фагов — хвост. Такие фаги относятся к типу Uroviricota [3]. Это самые узнаваемые вирусы бактерий, внешне напоминающие инопланетный космический корабль. Например, так устроен фаг лямбда — модельный организм, который используют ученые по всему миру (рис. 3). В зависимости от типа хвоста, различают три морфологических варианта, (до недавнего времени они соответствовали таксономическим семействам) :
На самом деле таксономия фагов намного сложнее и продолжает пересматриваться — последние значительные изменения (на момент написания этой статьи) произошли в 2020 году. Классификация в зависимости от внешнего вида имеет исторический смысл и в настоящее время применяется для удобства. А полную актуальную классификацию всех вирусов, включая фагов, можно найти на сайте Международного комитета по таксономии вирусов (ICTV).
Рисунок 3. Тут изображен не НЛО, а пример структуры хвостатого фага. А именно — фага лямбда, модельного организма, о котором мы рассказывали в статье «Модельные организмы: фаг лямбда» [12].
Вообще, классификация фагов довольно сложна, и в ней учитываются разные характеристики, такие как морфология, физико-химические свойства вириона, структура нуклеиновых кислот, геномные данные.
Откуда взялись фаги?
Свято место, как известно, пусто не бывает. Бактерии, хотя и являются простейшими организмами, устроены всё же достаточно сложно, чтобы в них можно было паразитировать кому-то еще более мелкому и примитивному. Фаги заняли эту нишу очень давно, вероятно, сразу после возникновения первых прокариот. Точную дату никто не назовет, ведь вирусы — не динозавры и костей не оставляют. До сих пор нет ответа и на другой вопрос, волнующий ученых: откуда взялись бактериофаги? На этот счет существует несколько гипотез [15]:
О том, как джамбо-фаги могут образовывать псевдоядра в клетках бактерий, можно почитать в нашей статье «Я в домике!”: бактериофаги, у которых есть ядра» [24].
Если вам интересно узнать больше о мимивирусах и об их врагах в вирусном мире — читайте наши статьи «Гиганты вирусного мира» [25] и «Паразит паразиту враг» [7].
Филогенез бактериофагов до сих пор таит множество загадок. Между разными представителями обнаруживаются определенные сходства и различия, которые помогают выстраивать эволюционные линии. Однако неизвестно, составляют ли все вирусы, или хотя бы все фаги, единую монофилетическую группу. Иными словами, есть ли у них у всех один предок, или же отдельные разновидности возникли параллельно независимо друг от друга [26].
Из нашей статьи «Вирусные геномы в системе эволюции» можно подробнее узнать о происхождении вирусов и их месте в общей модели эволюции [27].
Поиски родственных связей затрудняет одна особенность фагов: мозаицизм их генома. Он напоминает лоскутное одеяло: сшит из многочисленных модулей, каждый из которых обладает собственной эволюционной историей. Эти модули могут включать [28], [29]:
Геном фагов «пестрый», потому что эволюционируют они не совсем так, как многоклеточные организмы. С одной стороны, у них, как и описано в учебниках школьной биологии, периодически возникают мутации: полезные закрепляются, вредные отбраковываются. Это так называемый вертикальный путь. Но у фагов есть еще и путь горизонтальный, и он очень активно работает. Это так называемый модульный механизм, связанный с латеральным переносом генов за счет различных видов рекомбинации. У бактерий этот механизм тоже работает, но не в такой степени [29–31].
Исследователи фагов традиционно делились на два лагеря. Одни утверждали, что эволюция бактериофагов в первую очередь происходит за счет модульного механизма. Противники были уверены, что, хотя модульный механизм и вносит существенный вклад, главным двигателем нужно признать мутации. Сегодня для всех очевидно, что оба механизма работают, вопрос только в том, насколько существенный вклад вносит каждый из них. Из-за этого и возникают сложности с изучением филогенеза фагов: ведь он пронизан густо переплетенными нитями.
Впрочем, со временем картина становится более четкой. Известно, что у бактериофагов-родственников (условно представителей одного рода и семейства) есть одинаковые гены, объединенные в консервативные кластеры. Тут изменения происходят в основном за счет точечных мутаций, а перестановки модулей наблюдаются редко. Эти участки называются кор-геномом. Они содержат консервативные гены, которые кодируют структурные белки вириона, ферменты, гены транскрипции и репликации. Существенные изменения тут чреваты: чтобы фаг остался жизнеспособным, их нужно компенсировать точечными мутациями. Время на возникновение этих мутаций есть только у умеренных фагов, пока профаг находится в безопасности внутри бактериальной клетки. Зато горизонтальный перенос часто происходит в периферическом геноме, где находятся вариабельные гены, преимущественно мороны [3], [32].
Изучение эволюции фагов важно не только само по себе. Ведь в большинстве случаев она протекает не изолированно, а в форме коэволюции с бактериями-хозяевами. Знание этих процессов важно для более эффективного применения фагов в медицине и других сферах, в изучении их влияния на экосистемы.
Бактерии и фаги: миллиарды лет вместе
Когда у ученых не было эффективных инструментов, чтобы подсчитывать число фагов в окружающей среде, считалось, что эти «инопланетяне» если и влияют на экосистемы, то весьма незначительно. Всё изменилось в 1980–1990-е годы, когда стали широко использовать методы прямого подсчета вирусных частиц в природных образцах, такие как электронная и эпифлуоресцентная микроскопии. Оказалось, что фаги буквально повсюду, и их примерно в 10 раз больше, чем бактерий. Фактически, это самые многочисленные обитатели нашей планеты.
Говоря о бактериофагах как о санитарах микромира, по аналогии с волками — санитарами леса, нужно отметить одно существенное отличие. Если вспомнить пищевые цепочки из школьного курса биологии, то в воображении сразу предстанет пирамида, где внизу травоядные, а у верхушки хищники. Последних меньше, и за счет этого они контролируют размеры популяции более многочисленных жертв, при этом и сами не оставаясь голодными. У фагов же с бактериями всё наоборот: «хищников» больше на порядок. Тем не менее система поддерживается в равновесии: прокариоты не подверглись тотальному геноциду, но и не стали поголовно устойчивыми к фагам.
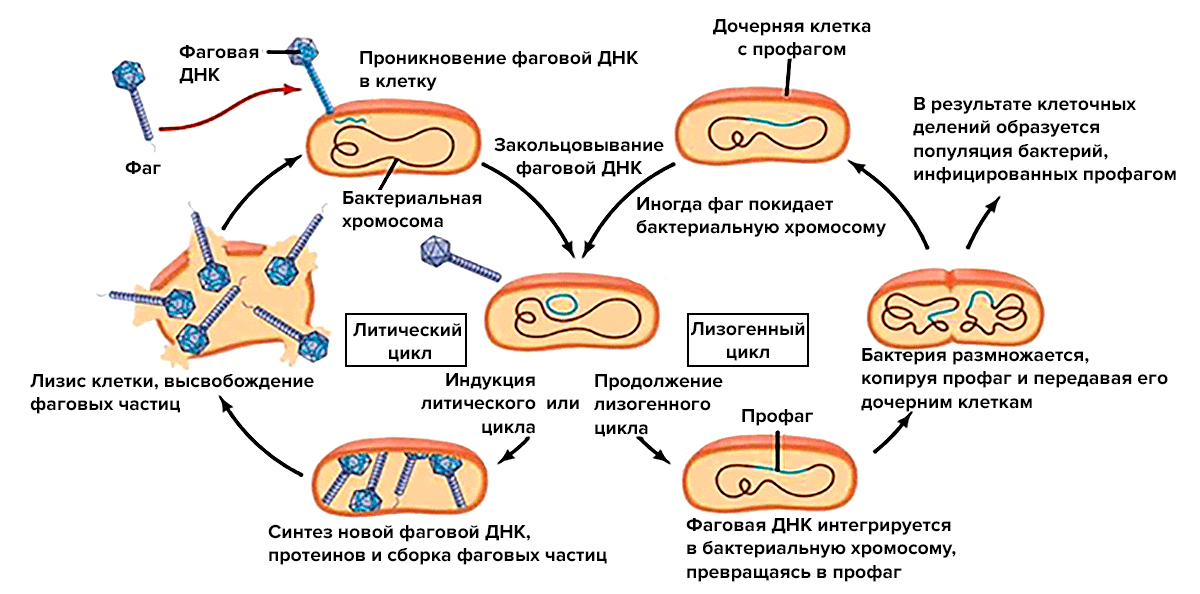
Чтобы понять, как фаги и чувствительные к ним бактерии стабильно сосуществуют, в первую очередь нужно поговорить о двух основных (но не единственных) жизненных циклах фагов (рис. 4):
Рисунок 4. Схематическое изображение литического и лизогенного циклов. В то время как одни клетки, инфицированные фагами, погибают, другие остаются живыми и даже получают некоторые новые полезные свойства. Но позже все-таки могут также погибнуть.
Если проанализировать виро́м (совокупность всех вирусов) разных сред, то окажется, что большая часть его населения представлена вирулентными фагами (по крайней мере, они обычно преобладают в воде). Теоретически эта орда должна массово атаковать бактерии и уничтожить их на корню. Но этого не происходит. Бактерии никогда не погибают полностью даже при большой концентрации фаговых частиц и процветают повсеместно. Дело в том, что они защищены с помощью целого ряда механизмов.
В течение миллиардов лет сосуществования бактерий и фагов происходило что-то вроде гонки вооружений. Прокариоты выработали целый арсенал методов защиты — своего рода иммунитет. Причем у бактерий в этой гонке есть преимущество: у них мутации, позволяющие защищаться от фагов, происходят чаще и проще. Бактериофаги в некоторой мере компенсируют это своей численностью [14].
На приобретение защитных мутаций бактериям требуется время, а для начала нужно как-то остаться в живых. Тут дела обстоят как с пандемией COVID-19: иммунитет человека может справиться с вирусом, но пока он «разгонится», вирус может справиться с организмом самого человека. Поэтому врачи рекомендуют меры профилактики: носить маски, избегать общественных мест, часто мыть руки, не подходить к больным людям и, конечно же, вакцинироваться. Бактерии успешно используют некоторые «убежища» (refuges), чтобы «прятаться» от фагов:
Санитары микромира
Если смешать вирулентные фаги с чувствительными к ним бактериями, последних тут же станет меньше. В самом деле, фаги — основные убийцы бактерий: на них приходится до 70% бактериальных смертей (в среднем — 15–30%). Кроме того, при хронической инфекции скорость размножения бактерий уменьшается, и это тоже влияет на их численность. Лучше всего все эти процессы изучены в морской воде.
Быстрее всего фаги размножаются в наиболее многочисленных и быстрорастущих популяциях бактерий. Это проявление принципа «убивай побеждающего» — kill the winner. Бактериофаги непрерывно работают как неутомимая и неподкупная антимонопольная служба. Как только популяция какого-нибудь микроорганизма начинает преобладать в экосистеме — среди ее членов немедленно разгорается эпидемия, приводящая к коллапсу. За счет этого никто не может окончательно победить в конкуренции, и поддерживается широкое биоразнообразие [37–39].
Влияние микроорганизмов на климат — далеко не новость для ученых. Мы рассказывали об этом в статье «О, этот благодатный дождь из бактерий!» [41].
Экологическое значение фагов пока изучено недостаточно, и имеющиеся сейчас данные в основном касаются морских экосистем. Ученым еще предстоит многое узнать о роли этих удивительных существ в жизни бактерий и всех остальных обитателей Земли.
Бактерии защищаются
Бактериальные клетки вовсе не беззащитны перед фагами. В ходе эволюции они сформировали многочисленные механизмы устойчивости и сопротивляются на каждом этапе развития инфекции.
Предотвращение адсорбции фагов
Чтобы запустить свой генетический материал внутрь клетки, для начала фаг должен прикрепиться к ней с помощью особых рецептор-связывающих белков, которые иногда также называют фаговыми адгезинами. В качестве рецепторов приходится использовать различные структуры на поверхности бактериальной клетки. Чтобы сопротивляться адсорбции, бактерии выработали по крайней мере три механизма: блокирование фаговых рецепторов, образование внеклеточного матрикса и продукция конкурентных ингибиторов.
Чтобы блокировать фаговые рецепторы, микроорганизмы могут изменить их химическую структуру или трехмерную конфигурацию. Например, интересный механизм наблюдается у золотистого стафилококка. Эти бактерии производят IgG-связывающий белок — фактор вирулентности А, заякоренный в клеточной стенке. Когда этого белка много, адсорбция фагов ухудшается. Это говорит о том, что белок А вместе со связанными им иммуноглобулинами маскирует фаговый рецептор.
Образование межклеточного матрикса — полимеров, в которые бактерии погружены, как в желе, — защищает микроорганизмы от негативных воздействий внешней среды, а также создает физический барьер между бактериофагами и их рецепторами. Пример с биопленками мы рассматривали выше. Но некоторые фаги научились распознавать полимеры межклеточного матрикса, и даже разрушать их.
Конкурентные ингибиторы — вещества, способные связываться с фаговыми рецепторами и конкурирующие за них с бактериофагами. Например, FhuA — соединение на поверхности кишечных палочек — одновременно отвечает за транспорт железа и служит рецептором для адсорбции фагов. Этот рецептор может быть заблокирован антимикробным пептидом микроцином J25. Бактерии начинают его производить в условиях нехватки ресурсов, чтобы подавить рост представителей родственных видов. Одновременно оно обеспечивает противофаговую защиту.
Предотвращение проникновения ДНК фага в клетку
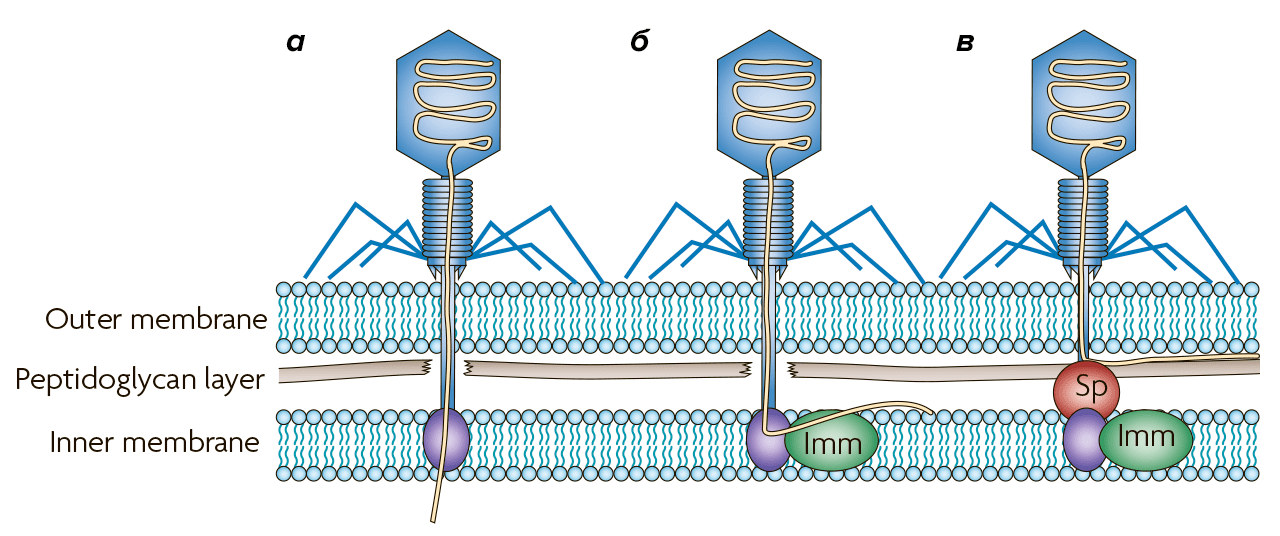
Этот механизм обеспечивается системами исключения суперинфекции (Sie). Они включают набор белков, которые, собственно, предотвращают проникновение в бактерию фаговых ДНК. Эти белки встроены в клеточную мембрану или связаны с ней. Интересно, что белки системы Sie зачастую «неродные» для бактерий: они кодируются не их собственными генами, а профагами. И это дает повод предположить, что Sie изначально предназначены не столько для защиты микроорганизмов, сколько, чтобы помогать фагам не пускать внутрь «кормушки» конкурентов.
Так, у фага T4 есть две системы Sie, предотвращающие проникновение в клетку других T-чётных фагов после инфицирования: эти системы представлены белками imm и sp. Они действуют отдельно друг от друга и работают по-разному (рис. 5):
Рисунок 5. Блокирование проникновения ДНК в бактериальную клетку. а — Обычное инфицирование E. coli фагом T4. Пептидогликановый слой разрушается, и белок внутренней мембраны участвует в проникновении ДНК в цитоплазму. б — Белок фага T4 imm блокирует проникновение ДНК в цитоплазму, тем самым предотвращая инфицирование другими T-четными фагами. в — Белок Sp, также кодируемый фагом Т4, предотвращает деградацию пептидогликана, останавливая фаговую ДНК между слоем пептидогликана и внешней мембраной.
Разрушение нуклеиновых кислот фага
Даже после того, как фаг сумел проникнуть внутрь бактериальной клетки, праздновать победу ему еще рано. Враждебная нуклеиновая кислота может быть разрушена еще до того, как успеет натворить бед. Для этого в клетках прокариот есть, на удивление, аналог иммунной системы животных и человека.
Например, бактерии многих, если не всех, родов обладают системами рестрикции-модификации. ДНК прокариот отличается от вирусной тем, что часто метилирована. Когда внутрь клетки попадает неметилированная ДНК фага, то она либо «разрезается» ферментами-рестриктазами (рестрикция), либо модифицируется — тоже метилируется (ферментами-метилазами — бактериальными или фаговыми), что запускает литический цикл (рис. 6). Судьба фагового генетического материала, а следовательно, и бактериальной клетки зависит от соотношения активности этих ферментов. Обычно «выигрывают» рестриктазы, в то время как метилирование обеспечивает защиту собственного генетического материала микроорганизма [42–44].
Рисунок 6. Схема работы системы рестрикции-модификации бактерий. Бактериальные рестриктазы «разрезают» ДНК фага, в то время как собственный генетический материал микроорганизма защищен метилированием.
Рисунок 7. Схема работы системы CRISPR/Cas. В хромосоме бактерии встроены участки, в которых содержатся фрагменты ДНК фагов. Они служат матрицами для синтеза CRISPR-РНК, которые затем связываются с ферментами Cas. Когда РНК распознает вирусную ДНК, фермент ее «разрезает».
На нашем сайте есть подробная статья о работе системы CRISPR/Cas — «Просто о сложном: CRISPR/Cas» [47]. Когда ученые узнали о замечательных свойствах этой системы, ее стали использовать в генной инженерии. На данный момент это один из самых быстрых и эффективных инструментов редактирования генома.
Системы абортивной инфекции
Эти системы предотвращают дальнейшее распространение фагов, уже заразивших клетку. Это единственный вид защиты, который предусматривает гибель инфицированной клетки, и он обеспечивается работой большого количества различных белков. Как правило, эти белки действуют на этапе репликации, транскрипции или трансляции фаговой ДНК. Используя подобные механизмы «самоубийства», бактериальное сообщество действует наподобие многоклеточных организмов, которые тоже обладают массой средств для уничтожения клеток, пораженных вирусами.
Арсенал противофаговых средств бактерий не изучен окончательно. Ученые постоянно открывают новые механизмы. Например, в 2018 году израильские исследователи обнаружили целых 10, ранее неизвестных. Мы рассказывали об этом в статье «Противофаговая линия Мажино в клетках прокариот: новые открытия» [48].
Кроме того, фаги и сами могут защищать своих жертв, и даже общаться между собой, посылая собратьям сообщение: «Эту клетку убивать не надо!». Об этом можно почитать в статье «Бактериофаг-1 Бактериофагу-2, приём!» [49].
То, что не убивает, — делает сильнее
Раньше ученые смотрели на бактериофаги исключительно как на хищников, безжалостно расправляющихся с бактериями. Современные взгляды сильно изменились. Хищник превратился в некое подобие программного кода. Он может оказаться не только вредителем, но и вполне полезным софтом.
Фаги могут способствовать адаптации бактерий четырьмя основными путями:
При лизогенной конверсии умеренный фаг вставляет в ДНК бактерии гены, которые кодируют те или иные полезные (для самой бактерии) белки (рис. 8). Этот признак наследуется вместе с профагом, но только до тех пор, пока захватчик не решит прекратить мирное сосуществование и не запустит литический цикл. Обычно гены, ответственные за лизогенную конверсию, находятся в моронах и не имеют большого значения для самого фага [53], [54].
Рисунок 8. Схема лизогенной конверсии. Профаг может нести гены, которые кодируют белки, усиливающие адгезию к тканям хозяина, обладающие эффектами токсинов, разрушающие ткани хозяина, помогающие уклоняться от агрессии иммунной системы.
Самый яркий и известный пример лизогенной конверсии — выработка токсина дифтерийными палочками. На самом деле ген, кодирующий этот токсин, принадлежит не бактериям, а инфицирующему их умеренному β-фагу [55]. Некоторые другие полезные свойства, которыми фаги могут поделиться с бактериями, представлены в таблице.
Иной механизм, с помощью которого фаги могут наделять бактерии полезными свойствами — трансдукция. В данном случае новый ген, позаимствованный у другого микроорганизма, не связан жестко с вирусной ДНК, а как бы приносится в дар бактерии и становится частью ее генома. Трансдукция бывает двух видов (рис. 9) [56], [57]:
Рисунок 9а. Схематическое изображение общей (неспецифической) фаговой трансдукции. В вирусные частицы случайным образом упаковываются фрагменты ДНК клетки-хозяина.
Рисунок 9б. Схематическое изображение специфической фаговой трансдукции. Профаг захватывает соседние участки ДНК.
В частности, в ходе трансдукции микроорганизмы могут обмениваться генами, отвечающими за устойчивость к антибиотикам. Но значение этого явления выходит далеко за рамки индивидуальной пользы для отдельно взятой бактерии. Фаговая трансдукция помогает в целом обеспечивать разнообразие микробного мира, важна для его выживания.
Безжалостный храповик
В прошлом столетии американский генетик Герман Джозеф Мёллер описал эффект, который по его имени был назван храповиком Мёллера. Храповик устроен так, что обеспечивает вращение механизма только в одну сторону. В одном направлении движется и небольшая популяция организмов, в которых нет полового процесса и других механизмов латерального переноса генов, но часто происходят мутации. Отсутствие «новой крови» приводит к тому, что «плохие» мутации накапливаются, особи становятся менее приспособленными и начинают вымирать. Бактерии не размножаются половым путем, и поэтому вынуждены вырабатывать другие способы обмена «здоровыми» генами. Одним из этих способов, реализованных совместно с фагами, и стала трансдукция [58].
Вирусный «микробиом» человека — виром
Организм человека населен микроорганизмами, составляющими его естественную микрофлору — об этом известно любому обывателю с тех пор, как реклама буквально из каждого утюга стала рассказывать о дисбактериозе и методах борьбы с ним. Но мало кому известно, что наше тело также является обиталищем огромного сообщества вирусов — вирома. Он включает примерно 10 13 вирусных частиц (примерно как бактерий), и среди них есть:
Считается, что большую часть от этого множества составляют хвостатые фаги.
По ряду причин изучать человеческий виром (еще иногда употребляют термин «фагом») сложнее, чем бактериальную микрофлору, но с появлением технологии секвенирования нового поколения дело пошло намного лучше [59], [60]. Один из наиболее известных современных проектов — «Микробиом человека». Когда ученые оценивают виром человека и животных, обычно они употребляют термин «вирусоподобные частицы». Это словосочетание означает, что генетический материал из тканей, биологических жидкостей и фекалий не всегда принадлежит жизнеспособным вирусам, способным заражать клетки [61–63].
Состав вирома различается в разных частях организма, а также зависит от возраста человека, питания, среды обитания, генетики, заболеваний, приема тех или иных лекарств и других факторов (рис. 10).
Рисунок 10. Вирусные сообщества в разных частях организма человека. Эта инфографика составлена на основе нескольких десятков научных обзоров. Будущие исследования наверняка приведут к тому, что списки этих виромов будут расширены.
Организм человека — не менее сложная «экосистема» для вирусов, чем, скажем, океан или почва. Тут на популяции микробов и вирусов влияют pH, иммунные механизмы, вещества, вырабатываемые в процессе жизнедеятельности человека (например, гидролипидная мантия на коже, желчь в кишечнике), доступность воды, питательных веществ и кислорода. В целом макроорганизм, бактерии и вирусы составляют сложную систему и постоянно взаимодействуют друг с другом [61], [63].
Научно-производственный центр «Микромир» основан в 2011 году. Сегодня компания «Микромир» — это одиннадцатилетний успешный опыт разработки комплексных антибактериальных препаратов на основе бактериофагов. Совместные усилия наших специалистов позволили компании стать одним из лидеров в области бактериофагии не только на территории России, но и на мировой арене.
Мы продвигаем бережное отношение к микробиому человека и создаем препараты, соответствующие нашему подходу и убеждениям. У человека должен быть выбор. На ранних, «мягких» стадиях инфекционных заболеваний бактериофаги — возможная разумная альтернатива антибиотикам, которые сегодня зачастую принимаются чрезмерно и не по назначению. Поэтому мы активно сотрудничаем с профессиональным медицинским сообществом, а также с ведущими научно-клиническими центрами России.
Наша цель — помогать не только людям, но и продвигать более экологичный подход к профилактике и лечению бактериальных инфекций в ветеринарии и сельском хозяйстве. В 2019 году в Венгрии зарегистрировали ветеринарный препарат для профилактики бактериальных заболеваний при выращивании птицы, а в 2020 году на территории РФ — первый лекарственный препарат с бактериофагами для ветеринарного применения «Фагоутерин», предназначенный для профилактики и лечения эндометритов бактериального этиопатогенеза у коров.
Мы активно развиваемся и всегда открыты для новых исследований, совместных разработок и будем рады видеть профессионалов в нашей команде. В научно-производственном центре «Микромир» можно пройти студенческую практику и в последствии стать частью большого и дружного коллектива.
По всем вопросам и предложениям можно написать на почту office@micromir.bio.
Подписывайтесь на нас в соцсетях, чтобы узнать еще больше о бактериофагах, жизни компании и наших разработках!
Материал предоставлен партнером — НПЦ «Микромир»
Пищеварительный тракт
Пищеварительный тракт — самая густонаселенная вирусами (в основном фагами) система человеческого организма, и ее виром изучен лучше всего. Тут обнаруживают в среднем 10 9 вирусоподобных частиц на каждый грамм кишечного содержимого. Наиболее распространены хвостатые фаги порядка Caudovirales.
Виром кишечника начинает формироваться с самого рождения. У детей на первом месяце жизни отмечается низкое разнообразие бактерий, но высокое — фагов. К двум годам картина меняется на противоположную: разновидностей бактерий становится много, а фагов — мало (вирусные сообщества в природе намного сложнее). Другое интересное свойство кишечной популяции фагов — ее большая вариабельность. Состав вирусоподобных частиц, которые получают от разных людей, зачастую сильно различается. Одно исследование показало, что ребенок «наследует» от матери 65% микрофлоры и только 15% вирома — остальная часть формируется в зависимости от условий окружающей среды и индивидуальных особенностей организма [61], [63], [64].
В норме в кишечнике преобладают умеренные фаги, а при многих заболеваниях увеличивается число вирулентных, чаще запускаются литические циклы. Триггерами могут стать не только патологические процессы, но и некоторые лекарства. Например, известно, что к индукции профагов приводят препараты из группы фторхинолонов — норфлоксацин и ципрофлоксацин. Лизис бактерий не проходит бесследно: он приводит к изменению состава микрофлоры. Вообще, при многих кишечных заболеваниях меняется структура не только микробиома, но и вирома [64].
| Заболевание | Исследованный материал | Изменения в вироме |
|---|---|---|
| Болезнь Крона и язвенный колит | кал* | Увеличение содержания Caudovirales |
| Ранняя стадия болезни Крона и язвенного колита | биоптант кишечника | Увеличение содержания Hepadnaviridae и Hepeviridae; уменьшение — Polydnaviridae, Tymoviridae и Virgaviridae |
| Колоректальный рак (злокачественные опухоли толстой и прямой кишки) | кал | Увеличение вирусного разнообразия |
| Сахарный диабет 1 типа | кал | Снижение вирусного разнообразия |
| Артериальная гипертония | кал | Обнаружены данные в пользу связи между увеличением числа фагов Erwinia ΦEaH2, Lactococcus 1706 и развитием артериальной гипертонии |
| Целиакия (непереносимость глютена) | кал | Увеличение содержания энтеровирусов |
| * — Важно понимать, что анализ кала не позволяет в полной мере оценить структуру микрофлоры и вирома пищеварительного тракта. В данном случае речь идет о микроорганизмах и вирусах, которые удается выделить в кале, — а в кишечнике они могут быть на самом деле представлены в меньшинстве. | ||
Микрофлора кожи отличается относительно низкой численностью. К тому же кожа — орган, который постоянно контактирует с окружающей средой и подвергается всевозможным воздействиям. Из-за этого ее виром исследовать сложно, а генетический материал трудно отличить от случайных загрязнений. Тем не менее некоторые исследования были проведены. Во время одного из них 95% обнаруженных генетических последовательностей не удалось отнести ни к одному известному вирусу. Среди идентифицированного материала значительная часть принадлежала хвостатым фагам [61], [65].
О криминалистических биотехнологиях во всех подробностях читайте в нашем спецпроекте «Криминалистика».
Ротовая полость
Как и в любой части организма, разнообразие бактериофагов в ротовой полости определяется разнообразием прокариот, а оно, в свою очередь, зависит от особенностей питания, вредных привычек, гигиены. Ротовая полость сама по себе неоднородна, и в ней есть разные «экологические ниши» (см. спецпроект «Биомолекулы» «Биология, медицина и косметология ротовой полости»). Если говорить о вироме, то тут, как и везде, преобладают хвостатые бактериофаги. В слюне содержится примерно 10 8 вирусоподобных частиц на мл, в зубном налете — 10 7 на мг.
Исследования показывают, что только небольшая часть вирусов в ротовой полости одинакова для разных людей. При этом у одного и того же человека со временем вирусное сообщество остается более-менее стабильным. Несомненно, фаги влияют на формирование микрофлоры рта, и их состав меняется при разных заболеваниях. В здоровой ротовой полости много умеренных бактериофагов, а при воспалительных процессах происходит сдвиг в сторону вирулентных. Изучение вирома ротовой полости играет важную роль в понимании развития различных патологий и может открыть новые подходы к лечению [61], [67], [68].
Дыхательные пути
Виром дыхательных путей, особенно нижних, исследован недостаточно хорошо. Этому вопросу посвящено мало научных работ, и в основном их проводили у детей с острыми респираторными заболеваниями. Раньше считалось, что микрофлора есть только в верхних дыхательных путях, а легкие стерильны. Более современные исследования показывают, что это не так. В легких здоровых некурящих людей есть небольшие бактериальные сообщества. Присутствуют в дыхательной системе и вирусы. Некоторые из них способны вызывать заболевания, некоторые безвредны. Есть тут и хвостатые фаги. Они попадают в легкие в основном из ротовой полости и верхних дыхательных путей [61], [69], [70].
Кровь
Даже святая святых организма человека — кровь, наша внутренняя среда, совсем не стерильна. В ней можно обнаружить как вирусы, так и фаги. В кровеносные и лимфатические сосуды бактериофаги проникают благодаря своей способности преодолевать слизистые оболочки из легких, печени, почек, головного мозга и главного резервуара — кишечника [61].
У фагов есть несколько возможностей проникнуть в кровоток. Самый простой способ — через повреждения на слизистой оболочке. Бактериофаги могут путешествовать внутри бактериальных клеток — в таком случае прокариоты играют роль «троянского коня». Но прячутся в таком «коне» вовсе не враги. Последствия проникновения фагов в кровь до конца не понятны, но считается, что они приносят пользу: помогают расправляться с опасными патогенами и стимулируют работу иммунной системы. Могут фаги путешествовать и путем эндоцитоза: когда клетка «прогибает» внутрь свою мембрану, и из нее получается пузырек с вирусной частицей внутри.
В 2017 году американские и австралийские ученые опубликовали результаты исследования, которое показало, что фаги путешествуют через плотно контактирующие клетки слизистых оболочек с помощью трансцитоза, и этот путь, видимо, имеет большое значение. Получается быстро и направленно: фаг перемещается по клетке в апикально-базальном направлении, то есть от верхушки к условно нижней части, прикрепленной к базальной мембране. При этом трансцитоз осуществляется через аппарат Гольджи. Исследователи наблюдали этот процесс на примере фага T4 в искусственно выращенных in vitro («в пробирке») клетках кишечника, легких, печени, почек и эндотелия головного мозга (рис. 11) [71].
Рисунок 11. Трансцитоз бактериофага T4 через клеточные слои в лабораторных условиях. а — Клетки, над которыми находится апикальная камера, а внизу — базальная камера («снизу» — там, где клетка прикрепляется к базальной мембране). Фаги T4 вносили в каждую из этих камер, чтобы проследить направление транспорта. б — Трансцитоз бактериофагов в базально-апикальном и апикально-базальном направлении. в — Трансцитоз фагов через клетки T84 (эпителий толстой кишки), CaCo2 (эпителий толстой кишки), A549 (эпителий легких), Huh7 (клетки печень — гепатоциты) и hBNec (эндотелиальные клетки головного мозга). Черные кружки отражают число фагов, загруженных в одну из камер, белые кружки — число фагов, обнаруженных в противоположной камере, которым удалось пройти через клетку. Видно, что транспорт носит апикально-базальный характер.
По подсчетам авторов этого исследования, ежедневно через слизистую оболочку кишечника в кровоток человека должно проникать около 31 миллиарда фаговых частиц.
Современные исследования показывают, что фаги есть не только в крови, но и в других средах организма, которые классически считались стерильными. Это заставило ученых выдвинуть новую концепцию «внутреннего фагома», и она находит всё больше сторонников. Взаимодействия в треугольнике «фаги — бактерии — клетки человека» сложны и не до конца изучены. Причем, бактериофаги не всегда враги бактериям и друзья нам. Например, они могут становиться резервуаром генов устойчивости микроорганизмов к антибиотикам.
Кроме того, фаги — резервуар генетической «темной материи». Есть мнение, что эти неисследованные гены могут экспрессироваться не только в бактериальных, но и в эукариотических клетках. Для этого потенциального механизма есть множество ограничений: сильные различия между сайтами транскрипции млекопитающих и вирусов, системы рестрикции и фосфорилирования, особенности кодонов, распределение транспортной РНК. Но даже с учетом этих ограничений нельзя исключить определенного прямого влияния фаговой ДНК на клетки человека, обмен веществ, иммунитет, состояние здоровья и развитие заболеваний. Это интересная область для будущих исследований [72].
Мочеполовая система
В моче человека содержится 10 7 вирусоподобных частиц на миллилитр. В большинстве случаев это фаги, но есть и вирусы эукариот — исследования показывают, что более чем у 90% испытуемых обнаруживаются вирусы папилломы человека. В мазках из влагалища у здоровых женщин обнаруживается в основном фаговая ДНК, и только 4% приходится на генетический материал вирусов эукариот. Семенная жидкость у мужчин тоже не стерильна [61].
Нервная система
Нервная система надежно защищена от микроорганизмов — она отгородилась от сосудистого русла баррикадой в лице гематоэнцефалического барьера [73]. Он пропускает даже не все лекарственные препараты. Тем не менее в спинномозговой жидкости фаги тоже есть — 10 4 вирусоподобных частиц на миллилитр. Что они тут делают — еще предстоит изучить [61].
Подводя итог, можно только повторить то, о чем мы упоминали в начале этого обзора: фаги — очень значимый фактор, оказывающий влияние на всё живое на нашей планете. И ученые смогли обратить этот фактор в ценный ресурс, возможности которого до сих пор далеко не исчерпаны. Фаги нашли применение в науке, пищевой промышленности, медицине, ветеринарии. Об этом пойдет речь в следующих статьях нашего спецпроекта.