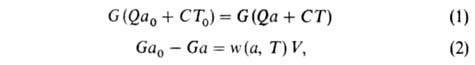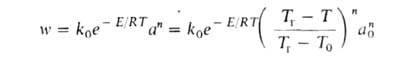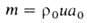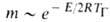Что такое горение
Что такое горение
Значение слова «горение»
Источник (печатная версия): Словарь русского языка: В 4-х т. / РАН, Ин-т лингвистич. исследований; Под ред. А. П. Евгеньевой. — 4-е изд., стер. — М.: Рус. яз.; Полиграфресурсы, 1999; (электронная версия): Фундаментальная электронная библиотека
Освоение огня сыграло ключевую роль в развитии человеческой цивилизации. Огонь открыл людям возможность приготовления пищи и обогрева жилищ, а впоследствии — развития металлургии, энергетики и создания новых, более совершенных инструментов и технологий. Управление процессами горения лежит в основе создания двигателей для автомобилей, судов и ракет.
Горение до сих пор остаётся основным источником энергии в мире и останется таковым в ближайшей обозримой перспективе. В 2010 году примерно 90 % всей энергии, производимой человечеством на Земле, добывалось сжиганием ископаемого топлива или биотоплив, и, по прогнозам Управления энергетических исследований и разработок (США), эта доля не упадёт ниже 80 % до 2040 года при одновременном росте энергопотребления на 56 % в период с 2010 по 2040 год. С этим связаны такие глобальные проблемы современной цивилизации, как истощение невозобновляемых энергоресурсов, загрязнение окружающей среды и глобальное потепление.
Химические реакции горения, как правило, идут по разветвлённо-цепному механизму с прогрессивным самоускорением за счёт выделяющегося в реакции тепла. Особенности горения, отличающие его от других физико-химических процессов с участием окислительно-восстановительных реакций, — это большой тепловой эффект реакции и большая энергия активации, приводящая к сильной зависимости скорости реакции от температуры. Вследствие этого горючая смесь, способная храниться при комнатной температуре неограниченно долго, может воспламениться или взорваться при достижении критической температуры воспламенения (самовоспламенение) или при инициировании внешним источником энергии (вынужденное воспламенение, или зажигание).
ГОРЕ’НИЕ, я, мн. нет, ср. (книжн.). Действие и состояние по глаг. гореть. Г. газа. Душевное г.
ГОРЕНИЕ
Полезное
Смотреть что такое «ГОРЕНИЕ» в других словарях:
Горение — спички … Википедия
ГОРЕНИЕ — физико химический процесс, при котором превращение вещества сопровождается интенсивным выделением энергии и тепло и массообменом с окружающей средой. Горение может начаться самопроизвольно в результате самовоспламенения либо быть инициированным… … Большой Энциклопедический словарь
ГОРЕНИЕ — ГОРЕНИЕ, горения, мн. нет, ср. (книжн.). Действие и состояние по гл. гореть. Горение газа. Душевное горение. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
горение — блеск, переливы, энтузиазм, сияние, игра, взлет, душевный подъем, подъем духа, сверкание, блистание, одержимость, огонь, страсть, огонек, воодушевление, поблескивание, вдохновение, увлеченность, живинка, увлечение, сгорание, подъем Словарь… … Словарь синонимов
Горение — ГОРЕНИЕ, химическое превращение, которое сопровождается интенсивным выделением тепла и тепло и массообменом с окружающей средой. Может начаться самопроизвольно (самовозгорание) или в результате зажигания. Характерное свойство горения способность… … Иллюстрированный энциклопедический словарь
Горение — физико химический процесс, при котором превращение вещества сопровождается интенсивным выделением энергии и тепло массообменом с окружающей средой. может начаться самопроизвольно в результате самовоспламенения либо может быть инициировано… … Словарь черезвычайных ситуаций
горение — Экзотермическая реакция окисления вещества, сопровождающаяся по крайней мере одним из трех факторов: пламенем, свечением, выделением дыма. [СТ СЭВ 383 87] горение Экзотермическая реакция, протекающая в условиях ее прогрессивного самоускорения.… … Справочник технического переводчика
горение — ГОРЕТЬ, рю, ришь; несов. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
Горение — (фр. и англ. combustion, нем. Verbrennung; хим.). Принятоназывать Г. такие случаи взаимодействия с кислородом воздуха каких бы тони было тел, которые сопровождаются значительным выделением тепла, аиногда и света. В более общем смысле можно… … Энциклопедия Брокгауза и Ефрона
ГОРЕНИЕ — букс. Жарг. угол. 1. Неизбежная опасность. ТСУЖ, 42. 2. Сигнал тревоги, опасности. ББИ, 58. Скачинский, 29; Балдаев 1, 92 … Большой словарь русских поговорок
Горение
Горе́ние — сложный физико-химический процесс превращения компонентов горючей смеси в продукты сгорания с выделением теплового излучения, света и лучистой энергии. Описать природу горения можно как бурно идущее окисление.
Дозвуковое горение (дефлаграция) в отличие от взрыва и детонации протекает с низкими скоростями и не связано с образованием ударной волны. К дозвуковому горению относят нормальное ламинарное и турбулентное распространения пламени, к сверхзвуковому — детонацию.
Горение подразделяется на тепловое и цепное. В основе теплового горения лежит химическая реакция, способная протекать с прогрессирующим самоускорением вследствие накопления выделяющегося тепла. Цепное горение встречается в случаях некоторых газофазных реакций при низких давлениях.
Условия термического самоускорения могут быть обеспечены для всех реакций с достаточно большими тепловыми эффектами и энергиями активации.
Горение может начаться самопроизвольно в результате самовоспламенения либо быть инициированным зажиганием. При фиксированных внешних условиях непрерывное горение может протекать в стационарном режиме, когда основные характеристики процесса — скорость реакции, мощность тепловыделения, температура и состав продуктов — не изменяются во времени, либо в периодическом режиме, когда эти характеристики колеблются около своих средних значений. Вследствие сильной нелинейной зависимости скорости реакции от температуры, горение отличается высокой чувствительностью к внешним условиям. Это же свойство горения обусловливает существование нескольких стационарных режимов при одних и тех же условиях (гистерезисный эффект).
Содержание
Теория горения
При адиабатическом сжигании горючей смеси могут быть рассчитаны количество выделившегося при горении тепла, температура ТГ, которая была бы достигнута при полном сгорании (адиабатическая температура горения) и состав продуктов, если известны состав исходной смеси и термодинамические функции исходной смеси и продуктов. Если состав продуктов заранее известен, ТГ может быть рассчитана из условия равенства внутренней энергии системы при постоянном объёме или её энтальпии при постоянном давлении в исходном и конечном состояниях с помощью соотношения: ТГ = Т0 + Qr/C, где Т0 — начальная температура смеси, С — средняя в интервале температур от Т0 до ТГ удельная теплоёмкость исходной смеси (с учетом её изменения при возможных фазовых переходах), Qr — удельная теплота сгорания смеси при температуре ТГ. При относительном содержании а0 в смеси компонентов, полностью расходуемых в реакции, QГ = Q*а0 где Q — тепловой эффект реакции горения. Значение ТГ при постоянном объёме больше, чем при постоянном давлении, поскольку в последнем случае часть внутренней энергии системы расходуется на работу расширения. На практике условия адиабатичекого горения обеспечиваются в тех случаях, когда реакция успевает завершиться прежде, чем станет существенным теплообмен между реакционным объёмом и окружающей средой, например в камерах сгорания крупных реактивных двигателей, в больших реакторах, при быстро распространяющихся волнах горения.
Термодинамический расчёт даёт лишь частичную информацию о процессе — равновесный состав и температуру продуктов. Полное описание горения, включающее также определение скорости процесса и критических условий при наличии тепло- и массообмена с окружающей средой, можно провести только в рамках макрокинетического подхода, рассматривающего химическую реакцию во взаимосвязи с процессами переноса энергии и вещества.
В случае заранее перемешанной смеси горючего и окислителя реакция горения может происходить во всём пространстве, занятом горючей смесью (объёмное горение), или в сравнительно узком слое, разделяющем исходную смесь и продукты и распространяющемся по горючей смеси в виде так называемой волны горения. В неперемешанных системах возможно диффузионное горение, при котором реакция локализуется в относительно тонкой зоне, отделяющей горючее от окислителя, и определяется скоростью диффузии реагентов в эту зону.
Описание процессов горения
Важность процесса горения в технических устройствах способствовала созданию различных моделей, позволяющих с необходимой точностью его описывать. Так называемое нулевое приближение включает описание химических реакций, изменение температуры, давления и состава реагентов во времени без изменения их массы. Оно соответствует процессам происходящим в закрытом объёме, в который была помещена горючая смесь и нагрета выше температуры воспламенения. Одно-, двух- и трёхмерные модели уже включает в себя перемещение реагентов в пространстве. Количество измерений соответствует количеству пространственных координат в модели. Режим горения бывает как и газодинамическое течение: ламинарным или турбулентным. Одномерное описанное ламинарного горения позволяет получить аналитически важные выводы о фронте горения, которые затем используются в более сложных турбулентных моделях.
Объёмное горение
Объемное горение происходит, например, в теплоизолированном реакторе идеального перемешивания, в который поступает при температуре Т0 исходная смесь с относительным содержанием горючего а0; при другой температуре горения реактор покидает смесь с иным относительным содержанием горючего а. При полном расходе G через реактор условия баланса энтальпии смеси и содержания горючего при стационарном режиме горения могут быть записаны уравнениями:
где w(а, Т) — скорость реакции горения, V — объём реактора. Используя выражение для термодинамической температуры ТГ, можно из (1) получить:
и записать (2) в виде:
где q—T = GC(T — Т0) — скорость отвода тепла из реактора с продуктами сгорания, q+T = Qw(a, Т)V — скорость выделения тепла при реакции. Для реакции n-ного порядка с энергией активации:
Диффузионное горение
Характеризуется раздельным подачей в зону горения горючего и окислителя. Перемешивание компонентов происходит в зоне горения. Пример: горение водорода и кислорода в ракетном двигателе, горение газа в бытовой газовой плите.
Горение предварительно смешанной среды
Как следует из названия, горение происходит в смеси, в которой одновременно присутствуют горючее и окислитель. Пример: горение в цилиндре двигателя внутреннего сгорания бензиново-воздушной смеси после инициализации процесса свечой зажигания.
Особенности горения в различных средах
Беспламенное горение
В отличие от обычного горения, когда наблюдаются зоны окислительного пламени и восстановительного пламени, возможно создание условий для беспламенного горения. Примером может служить каталитическое окисление органических веществ на поверхности подходящего катализатора, например, окисление этанола на платиновой черни.
Твердофазное горение
Это автоволновые экзотермические процессы в смесях неорганических и органических порошков, не сопровождающиеся заметным газовыделением, и приводящие к получению исключительно конденсированных продуктов. В качестве промежуточных веществ, обеспечивающих массо-перенос, образуются газовые и жидкие фазы, не покидающие, однако, горящую систему. Известны примеры реагирующих порошков, в которых образование таких фаз не доказано (тантал-углерод).
Как синонимы используются тривиальные термины «безгазовое горение» и «твердопламенное горение».
Примером таких процессов служит СВС (самораспространяющийся высокотемпературный синтез) в неорганических и органических смесях.
Тление
Вид горения, при котором пламя не образуется, а зона горения медленно распространяется по материалу. Тление обычно наблюдается у пористых или волокнистых материалов с высоким содержанием воздуха или пропитанных окислителями.
Автогенное горение
Самоподдерживающиеся горение. Термин используется в технологиях сжигания отходов. Возможность автогенного (самоподдерживающегося) горения отходов определяется предельным содержанием балластирующих компонентов: влаги и золы. На основе многолетних исследований шведский учёный Таннер предложил для определения границ автогенного горения использовать треугольник-схему с предельными значениями: горючих более 25 %, влаги менее 50 %, золы менее 60 %.
Горение
Что такое горение
Горение – это совокупность одновременно протекающих физических процессов (плавление, испарение, ионизация) и химических реакций окисления горючего вещества и материала, сопровождающееся, как правило, световым и тепловым излучением и выделением дыма. В основе горения лежит взаимодействие горючего вещества с окислителем, преимущественно с кислородом воздуха.
Однако горения может осуществляться без доступа воздуха (кислорода), если в состав горючей массы (среды) входит окислитель в виде примеси или составной части молекулы. В производственных условиях или ракетной технике горения может осуществляться в атмосфере таких окисляющих газов, как фтор, хлор, окислы азота и другие.
Некоторые вещества (порошкообразные титан и цирконий) способны гореть в атмосфере азота, двуокиси углерода, не относящимся к традиционным окислителям.
Виды горения
В зависимости от способа подвода окислителя различают:
При пожаре отмечается смешанный тип горения. В зависимости от скорости горение может быть медленным (тление), нормальным (дефлаграция) и взрывообразным (взрыв), переходящим в детонационное (детонация).
По внешнему проявлению горение может быть пламенным или беспламенным.
Беспламенное горение может возникнуть в результате дефицита окислителя (тление) или при низком давлении насыщенных паров горючего вещества (горение тугоплавких металлов и кокса).
По механизму развития горение может быть тепловым, при котором причиной самоускорения реакций окисления является повышение температуры, и автокаталитическим (цепным), когда ускорение процесса достигается накоплением промежуточных катализирующих продуктов (активных центров). Автокаталитическое горение осуществляется при сравнительно низких температурах. При достижении определенных концентраций промежуточных каталитических продуктов автокаталитическое горение может переходить в тепловое. При этом температура горения резко возрастает.
Горение может возникать и развиваться спонтанно, стихийно (пожар), но может быть специально организованным, целесообразным: энергетическое горение (в целях получения тепловой или электрической энергии) и технологическое горение (доменный процесс, металлотермия, синтез тугоплавких неорганических соединений и т.д.).
Характеристики горения
Горение характеризуется такими величинами, как: температура, скорость, полнота, состав продуктов. Располагая данными о механизме горения и его характерных особенностях, можно увеличивать скорость и температуру горения (промотирование горения) или снижать их вплоть до прекращения горения (ингибирование горения).
Источники: Основные характеристики горения. Мальцев В.М., Мальцев М.И., Кашпоров Л.Я. —М., 1977; Процессы горения в химической технологии и металлургии. Мержанов А.Г. —Черноголовка, 1975; Физика горения и взрыва. Хитрин Л.Н. —М., 1957.
ГОРЕНИЕ
физ.-хим. процесс, при к-ром превращение в-ва сопровождается интенсивным выделением энергии и тепло-и массообменом с окружающей средой. В отличие от взрыва и детонации протекает с более низкими скоростями и не связано с образованием ударной волны. В основе Г. лежит хим. р-ция, способная протекать с прогрессирующим самоускорением вследствие накопления выделяющегося тепла (тепловое Г.) или активных промежут. продуктов (цепное Г.). наиб. распространено тепловое Г.; цепное Г. в чистом виде встречается сравнительно редко, гл. обр. в случае нек-рых газофазных р-ций при низких давлениях.
Условия термич. самоускорения м. б. обеспечены для всех р-ций с достаточно большими тепловыми эффектами и энергиями активации. наиб. обширный класс р-ций Г.-окисление углеводородов, напр. при Г. прир. топлив, водорода, металлов и т. п.; окислители-кислород, галогены, нитросоединения, перхлораты. В режиме Г. могут происходить: разложение озона, ацетилена, гидразина, динитрогликоля, метилнитрата и др.; окислит.-восстановит. р-ции, в к-рых восстановители-элементы с высоким сродством к кислороду (Са, Al, Si, Mg и др.); синтез из элементов оксидов, галогенидов, халькогенидов, гидридов, интерметаллидов, тугоплавких нитридов и карбидов.
Объемное горение происходит, напр., в теплоизолиров. реакторе идеального перемешивания (см. Безградиентный реактор), в к-рый поступает при т-ре Т 0 исходная смесь с относит. содержанием горючего а 0; при другой т-ре Г реактор покидает смесь с иным относит. содержанием горючего а. При полном расходе G через реактор условия баланса энтальпии смеси и содержания горючего при стационарном режиме Г. могут быть записаны ур-ниями:
где Т 0 )-скорость отвода тепла из реактора с продуктами сгорания, скорость выделения тепла при р-ции. Для р-ции и-го порядка с энергией активации:
Критич. и гистерезисные явления, характерные для Г., возникают не только при изменении расхода, но и при изменении др. внеш. условий (Т 0, Vи т. д.).
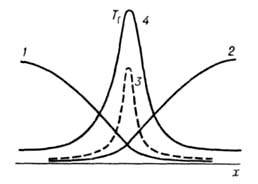
Волны горения обусловлены характерным св-вом Г.-способностью к распространению в пространстве, занятом горючей смесью. Начавшись в одном слое горючей смеси, заполняющей к.-л. объем, напр. трубу, р-ция Г. инициируется в соседних слоях вследствие их нагрева горячими продуктами или из-за диффузии активных центров из реагирующего слоя. В результате возникает распространяющийся вдоль трубы фронт Г., перед к-рым находится горючая смесь при начальной т-ре Т 0, за ним-продукты сгорания при т-ре Т П. При отсутствии потерь тепла через стенки трубы Т П = Т Г. В стационарном режиме Г. все точки плоского волнового фронта перемещаются с одинаковой скоростью м, постоянной во времени. Скорость р-ции w, т-ра Т и концентрация горючей компоненты араспределены во фронте Г. неравномерно, образуя вдоль координаты распространения фронта хтри зоны (рис. 2). В т. наз. зоне реакции 1 т-ра принимает значения в узком интервале 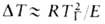
При сложных р-циях, протекающих по многостадийному механизму, структура фронта Г. может оказаться более сложной, чем в случае простой (одностадийной) р-ции. В зависимости от соотношения между кинетич. константами разл. стадий сложной р-ции эти стадии могут либо протекать в одной зоне (режим слияния), либо могут быть пространственно разделенными и взаимод. между собой посредством тепловых и диффузионных потоков (режим управления), либо не будут испытывать никакого взаимного влияния (режим отрыва). Скорость распространения фронта Г. с неск. зонами р-ции, как правило, определяется к.-л. одной из них (т. наз. ведущая зона).
Кол-во горючего, сгорающего на единице пов-сти фронта Г. в единицу времени, наз. массовой скоростью Г. т. Она определяется выражением: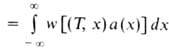
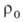
Расчет скоростей Г.-массовой m и линейной u-связан с отысканием распределения т-р и концентраций всех компонентов смеси во фронте Г. и требует совместного решения дифференц. ур-ний тепло- и массопереноса в реагирующей среде. Согласно Зельдовичу-Франк-Каменецкому, для простой (одностадийной) р-ции
где 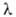
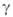
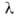
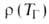
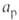

В реальных условиях распространение фронта Г. всегда сопровождается потерями тепла во внеш. среду (излучением, теплопроводностью), что приводит к уменьшению т-ры и скорости Г. по сравнению с их адиабатич. значениями. Если отношение интенсивности теплопотерь к мощности тепловыделения превышает нек-рое критич. значение, самораспространение р-ции по горючей смеси становится невозможным. Срыв Г. с ростом теплопотерь осуществляется скачком: непосредственно перед потуханием скорость Г. отлична от нуля и даже м. б. близка к скорости адиабатич. Г. Со срывом Г. вследствие теплопотерь связаны понятия разл. пределов Г. Так, если содержание воздуха в горючей смеси становится меньше стехиометрического, сильно уменьшаются скорости р-ции и тепловыделения. При неизменной теплоотдаче это приводит к росту отношения интенсивности теплопотерь к мощности тепловыделения. При нек-рой концентрации горючего это отношение достигает критич. значения, ниже к-рого смесь становится негорючей в данных условиях; соответствующая концентрация горючего наз. концентрационным пределом Г. Аналогично определяются пределы Г. по начальной т-ре, давлению, диаметру трубы и т. п.
Диффузионное горение имеет место в условиях, когда горючее и окислитель диффундируют в зону р-ции с противоположных сторон; таково, напр., Г. свечи, фитиля. Если при этом константа скорости kр-ции Г. много меньше константы скорости диффузии 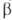
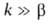
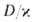
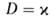
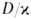
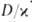
Особенности горения в различных средах.
При Г. газовых смесей на скорость распространения фронта Г. (пламени) и форму его пов-сти существенно влияет гидродинамич. течение среды. Скорость ираспространения пламени по неподвижной среде зависит от состава смеси, т-ры и давления и является физ.-хим. характеристикой смеси. Она наз. нормальной, или фундаментальной, скоростью Г. Для р-ции и-го порядка и
В ламинарно движущейся горючей смеси пламя распространяется со скоростью ив направлении, нормальном к его пов-сти. Пламя имеет стабилизированную в пространстве форму при условии, что иравна нормальной составляющей скорости потока В случае вытекания из горелки радиуса r заранее перемешанной смеси со скоростью потока v =const стабилизированная пов-сть пламени (т. н. факел) имеет форму конуса с высотой 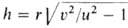
При турбулентном течении горючей смеси пульсации потока интенсифицируют тепло- и массоперенос в пламени, искривляют и дробят его пов-сть, расширяют зону р-ции, что приводит к резкому ускорению Г. Скорость распространения турбулентного пламени может превосходить ив десятки и сотни раз. В сильно шероховатых трубах турбулизация потока и ускорение пламени могут даже привести к переходу Г. в детонацию.
Рис. 5. Спиновое горение тантала в азоте: 1 сгоревшая часть образца (светятся горячие продукты горения); 2-очаг реакции, распространяющийся по спирали (стрелка указывает направление движения); 3-несгоревшая часть образца (исходное вещество).
При Г. газифицирующихся конденсированных систем (напр., твердых и жидких ВВ) происходит интенсивное газовыделение вследствие испарения горючего или его хим. разложения, обусловленных потоком тепла из зоны Г. Ведущая Г. экзотермич. р-ция может протекать в образующейся газовой фазе (т. наз. летучие системы) либо в конденсиров. фазе (нелетучие системы). Стационарное Г. летучих систем описывается той же теорией, что и Г. газовых смесей с заранее перемешанными компонентами. В нелетучих системах выделение большого кол-ва газообразных продуктов может приводить к мех. разрушению и диспергированию в-ва вблизи пов-сти. В результате зона р-ции сильно растягивается и тепловыделение происходит в осн. в мелкодисперсной смеси частиц горючего и продуктов его первичного хим. разложения. Линейные скорости иГ. порохов и других ВВ составляют от долей мм/с до десятков см/с; аномально высокие и(десятки м/с) наблюдаются при проникновении горячих газообразных продуктов в поры гранулированного твердого топлива (конвективное Г.). Как и при Г. газов, для ихарактерна степенная зависимость от ртипа и
Распространение пламени по взвеси частиц топлива в газе (аэровзвеси) протекает с большими скоростями (
10 м/с) вследствие того, что световое излучение от горящих частиц топлива нагревает исходную смесь на больших расстояниях перед фронтом Г. В больших объемах Г. аэровзвеси может переходить в детонацию вследствие самоускорения пламени, а также из-за автотурбулизации течения газа горящими частицами твердого топлива.
При Г. пористых в-в, напр. слоя частиц угля, распространение фронта Г. сопровождается фильтрац. течением газа, содержащего окислитель. Оно может возникать самопроизвольно вследствие поглощения либо выделения газа при р-ции или вынужденно, из-за задаваемого перепада давления. Т-ра и состав продуктов зависят от кинстич., теплофиз. и фильтрац. характеристик системы. Т-ра Г. при вынужденной фильтрации окислителя через продукты может в неск. раз превышать Тр, рассчитанную на полное сгорание горючего, содержащегося в пористой среде. Напр., при фильтрац. выжигании нефтяного песка т-ра в зоне р-ции может составлять 600-800
Характеристика процесса горения
Всем нам практически ежедневно приходится сталкиваться с тем или иным проявлением процессом горения. В нашей статье мы хотим более подробно рассказать какие особенности включает в себя данный процесс с научной точки зрения.
Горение является основной составляющим процессом на пожаре. Пожар начинается с возникновения горения, его интенсивность развития как правило путь пройденный огнем, то есть скорость горения, а тушение заканчивается прекращением горения.
Под горением обычно понимают экзотермическую реакцию между горючим и окислителем, сопровождающуюся, по крайней мере, одним из трех следующих факторов: пламенем, свечением, дымообразованием. Из-за сложности процесса горения указанное определение не является исчерпывающим. В нем не учтены такие важнейшие особенности горения, как быстрое протекание лежащей в его основе экзотермической реакции, ее самоподдерживающийся характер и способность к самораспространению процесса по горючей смеси.
Различие между медленной экзотермической окислительно-восстановительной реакцией (коррозия железа, гниение) и горением заключается в том, что последняя протекает настолько быстро, что теплота производится быстрее, чем рассеивается. Это приводит к повышению температуры в зоне реакции на сотни и даже тысячи градусов, к видимому свечению и образованию пламени. По сути так образуется пламенное горение.Если происходит выделение тепла но пламя при это отсутствует, то этот процесс называется тлением.И в том и в другом процессе происходит образование дыма – аэрозоля полного или неполного сгорания веществ. Стоит отметить, что при горении некоторых веществ пламени не видно, а также отсутствует и выделение дыма, к таким веществам относится водород. Слишком быстрые реакции (взрывчатое превращение) также не входят в понятие горения.
Необходимым условием для возникновения горения является наличие горючего вещества, окислителя (при пожаре его роль выполняет кислород воздуха) и источника зажигания. Для непосредственного возгорания необходимо наличие критических условий по составу горючей смеси, геометрии и температуре горючего материала, давлению и др. После возникновения горения в качестве источника зажигания выступает уже само пламя или зона реакции.
Типичная модель горения построена на реакции окисления органических веществ или углерода кислородом воздуха. Множество физических и химических процессов сопровождают горение. Физика это перенос тепла в систему. Окислительные и восстановительные реакции это составляющая природы горения со стороны химии. Отсюда из понятия горение вытекают самые разные химические превращения, включая разложение исходных соединений, диссоциации и ионизации продуктов.
Совокупность горючего вещества или материала с окислителем представляет собой горючую среду. В результате разложения горючих веществ под воздействием источника зажигания происходит образование газопаровоздушной реакционной смеси. Горючие смеси, которые по составу (соотношению компонентов горючего и окислителя) отвечают уравнению химической реакции, называются смесями стехиометрического состава. Они наиболее опасны в пожарном отношении: легче воспламеняются, интенсивнее горят, обеспечивая полное сгорание вещества, в результате чего выделяют максимальное количество теплоты.
Рис. 1. Формы диффузионных пламен
а – горение реактивной струи, б – горение разлитой жидкости, в – горение лесной подстилки
По соотношению количества горючего материала и объема окислителя различают бедные и богатые смеси: бедные содержат в изобилии окислитель, богатые — горючий материал. Минимальное количество окислителя, необходимое для полного сгорания единицы массы (объема) того или иного горючего вещества, определяется по уравнению химической реакции. При горении с участием кислорода требуемый (удельный) расход воздуха для большинства горючих веществ находится в пределах 4-15 м 3 /кг. Горение веществ и материалов возможно только при обусловленном содержании в воздухе их паров или газообразных продуктов, а также при концентрации кислорода не ниже заданного предела.
Так, для картона и хлопка самопотухание наступает уже при 14 об. % кислорода, а полиэфирной ваты — при 16 об. %. В процессе горения, как и в других химических процессах, обязательны два этапа: создание молекулярного контакта между реагентами и само взаимодействие молекул горючего с окислителем с образованием продуктов реакции. Если скорость превращения исходных реагентов определяется диффузионными процессами, т.е. скоростью переноса (пары горючих газов и кислорода переносятся в зону реакции за счет градиента концентраций в соответствии с законами диффузии Фика), то такой режим горения называется диффузионным. На рис. 1 приведены различные формы диффузионных пламен. При диффузионном режиме зона горения размыта, и в ней образуется значительное количество продуктов неполного сгорания. Если же скорость горения зависит только от скорости химической реакции, которая значительно выше скорости диффузии, то режим горения называется кинетическим. Ему свойственны более высокие скорости и полнота сгорания и как следствие высокие скорости тепловыделения и температура пламени. Этот режим имеет место в предварительно перемешанных смесях горючего и окислителя. Отсюда, если реагенты в зоне химической реакции находятся в одинаковой (обычно газовой) фазе, то такое горение называют гомогенным, при нахождении горючего и окислителя в зоне реакции в разных фазах — гетерогенным. Гомогенным является горение не только газов, но и жидкостей, а также большинства твердых веществ и материалов. Объясняется это тем, что в зоне реакции горят не сами материалы, а их пары и газообразные продукты разложения. Наличие пламени является отличительным признаком гомогенного горения.
Примерами гетерогенного горения служат горение углерода, углистых остатков древесины, нелетучих металлов, которые даже при высоких температурах остаются в твердом состоянии. Химическая реакция горения в этом случае будет происходить на поверхности раздела фаз (твердой и газообразной). Отметим, что конечными продуктами горения могут быть не только оксиды, но и фториды, хлориды, нитриды, сульфиды, карбиды и др.
Характеристики процесса горения разнообразны. Их можно подразделить на следующие группы: форма, размер и структура пламени; температура пламени, его излучательная способность; тепловыделение и теплота сгорания; скорость горения и концентрационные пределы устойчивого горения и др.
Всем известно, что при горении образуется свечение которое сопровождает пламя продукта горения.
Рассмотрим две системы:
В первом случае при возникновении горения весь процесс будет происходить в пламени, во втором же случае часть реакций будет происходить в самом материале, либо его поверхности. Как упоминалось выше существуют газы которые могут гореть без пламени, но если рассматривать твердые вещества существуют также группы металлов которые также способны гореть без проявления пламени.
Часть пламени с максимальным значением, где происходят интенсивные превращения, называется фронтом пламени.
Теплообменные процессы и диффузия активных частиц из зоны горения которые являются ключевыми механизмами движения фронта пламени по горючей смеси.
Скорость распространения пламени принято разделять на:
Рис. 2. Ламинарное диффузионное пламя
В зависимости от характера скорости движения газового потока, создающего пламя, различают ламинарные и турбулентные пламена. В ламинарном пламени движение газов происходит в разных слоях, все процессы тепло-, массообмена происходят путем молекулярной диффузии и конвекции. В турбулентных пламенах процессы тепло-, массообмена осуществляются в основном за счет макроскопического вихревого движения. Пламя свечи — пример ламинарного диффузионного пламени (рис. 2). Любое пламя высотой более 30 см будет уже обладать случайной газовой механической неустойчивостью, которая проявляется видимыми завихрениями дыма и пламени.
Рис. 3. Переход ламинарного потока в турбулентный
Очень наглядным примером перехода ламинарного потока в турбулентный является струйка сигаретного дыма (рис. 3), которая, поднявшись на высоту около 30 см, приобретает турбулентность.
При пожарах пламена имеют диффузионный турбулентный характер. Присутствие турбулентности в пламени усиливает перенос тепла, а смешивание влияет на химические процессы. В турбулентном пламени выше также скорости горения. Это явление делает затруднительным перенос поведения мелкомасштабных пламен на крупномасштабные, имеющих большую глубину и высоту.
Экспериментально доказано, что температура горения веществ в воздухе гораздо ниже температуры горения в атмосферной кислородной среде
В воздухе температура будет колебаться от 650 до 3100 °С, а в кислородной показатели температуры возрастут на 500-800 °С.
ГОРЕНИЕ
ГОРЕНИЕ — совокупность одновременно протекающих физических процессов (плавление, испарение, ионизация) и химических реакций окисления горючего вещества и материала, сопровождающееся, как правило, световым и тепловым излучением и выделением дыма (см. ДЫМ ) [1].
ГОРЕНИЕ — сложный физико-химический процесс взаимодействия горючего вещества и окислителя, характеризующийся самоускоряющимися превращениями исходных компонентов реакционноспособной смеси в продукты горения и сопровождающийся выделением большого количества тепла, дыма и света. Выделение тепла происходит непосредственно в зоне химической реакции превращения исходных компонентов горючей смеси в продукты горения [2].
Зона протекания химической реакции обычно локализована в сравнительно небольшой части пространства. Она может быть неподвижна, а может перемещаться в пространстве в зависимости от условий протекания процесса горения.
Горение происходит в два этапа:
1. Создание молекулярного контакта между молекулами горючего и окислителя (физический процесс).
2. Взаимодействие молекул с образованием продуктов реакции (химический процесс).
При этом второй этап наступает только при выполнении некоторых дополнительных условий. Молекулы должны находиться в особом энергетически или химически возбужденном состоянии и определенном количественном соотношении.
Горение является неравновесным процессом. При горении обязательно возникают неоднородности в составе молекул, их концентрации, неравномерности поля температур и скоростей потоков. В основе процесса горения лежат химические реакции окисления, то есть соединения исходных горючих веществ с кислородом.
При горении на пожарах (см. ПОЖАР) в качестве окислителя чаще всего выступает кислород воздуха, окружающий зону протекания химических реакций. В этом случае интенсивность горения определяется не скоростью протекания самих химических реакций, а скоростью поступления кислорода из окружающего пространства в зону горения, то есть непосредственно в зону протекания химических реакций.
Скорость протекания химических реакций горения значительно превосходит скорость таких физических процессов, как диффузия недостающих компонентов в зону реакции и передача тепла из зоны горения горючим веществам для подготовки их к химическому взаимодействию. Эти два процесса — диффузия и теплопередача — являются лимитирующими. Они определяют суммарную скорость горения, а, следовательно, и интенсивность процесса тепловыделения и образования продуктов горения. Поэтому считают, что процессы горения на пожаре развиваются в чисто диффузионной области и рассматривать их следует лишь с физической стороны.
ГЕТЕРОГЕННОЕ ГОРЕНИЕ — горение материалов в конденсированном (твердом или жидком) состоянии, когда реакции, определяющие развитие процесса горения, протекают в газовой фазе, а горючие компоненты поступают в эту фазу в результате испарения и разложения веществ и материалов.
ДИФФУЗИОННОЕ ГОРЕНИЕ — горение неперемешанных газо-, паровоздушных смесей с воздухом. Оно свойственно конденсированным горючим веществам — жидкостям и твердым материалам. Для диффузионного горения характерно наличие светящегося пламени. В зависимости от диаметра трубопровода, а также давления, при котором происходит истечение газов, диффузионное горение может быть ламинарным и турбулентным.
ЛАМИНАРНОЕ ГОРЕНИЕ — вид горения, характеризуемый газодинамически невозмущенным фронтом пламени, а также скоростью распространения пламени, не превышающей нескольких метров в секунду. Ламинарное горение зависит от теплообмена и других макрокинетических факторов. Процесс ламинарного горения заключается в передаче в свежую горючую смесь тепла и активных частиц, обеспечивающих распространение пламени. Скорость распространения пламени относительно свежей смеси, измеренная по нормали к фронту, называется нормальной скоростью распространения пламени [3].
ТУРБУЛЕНТНОЕ ГОРЕНИЕ — горение в турбулентных потоках смеси горючего с воздухом (кислородом), характеризующееся неупорядоченным, пульсирующим движением малых объемов таких смесей. Смешение компонентов при турбулентном горении происходит более интенсивно, чем при ламинарном горении, вследствие чего скорость турбулентного горения превышает скорость ламинарного горения.
Турбулентное горение, то есть горение смеси, течение которой является турбулентным, — это наиболее часто встречающийся в практических устройствах режим горения и одновременно наиболее сложный для изучения.
Турбулентное горение может быть вызвано автотурбулизацией пламени, заключающейся в том, что искривления фронта пламени самопроизвольно возрастают, плоская зона нормального горения перестает существовать, уступая место турбулентному пламени.
Различают турбулентнодиффузионное горение и турбулентное горение однородной горючей смеси. Первое — реализуется при сжигании предварительно не перемешанных газов в турбулентном потоке и широко используется в различных технически устройствах (промышленных печах, горелках, камерах сгорания газотурбинных двигателей и т. д.). Второе — реализуется при сжигании предварительно перемешанных газов или газовзвесей (смесей горючей пыли с газообразным окислителем) в турбулентном потоке и встречается в ряде технических устройств (двигателях внутреннего сгорания, форсажных камерах газотурбинных двигателей и т. д.) [4].
ВРЕМЯ ГОРЕНИЯ — длительность протекания процесса горения с момента зажигания горючего вещества (материала) до окончания пламенного горения или тления. Время горения регистрируется при испытаниях электрических изделий на пожарную опасность, служит в качестве показателя при определении предела огнестойкости строительных конструкций, а также критерием оценки допустимости изготовления различных изделий и их эксплуатации [5].
ВРЕМЯ ВЫГОРАНИЯ — время, в течение которого прекращается горение вещества (материала) в заданных условиях. Время выгорания зависит от:
— физико-химических свойств (теплоты сгорания, давления насыщенных паров, агрегатного состояния и пр.) вещества (материала) и его горючести;
— вида горения (гомогенного или гетерогенного) и скорости распространения пламени [5].
1. И.Н. Зверев, Н. Н. Смирнов. Газодинамика горения. — М.: Изд-во Моск. ун-та., 1987. — С. 165. — 307 с.
2. Теория горения и взрыва: конспект лекций / сост. П.П. Воднев. — Ульяновск: УВАУ ГА(И), 2010. — 180 с.
3. Теория горения и взрыва / Под ред. Ю.В. Фролова. М., 1981 г.
4. Баратов А.Н. Горение — Пожар — Взрыв — Безопасность. — М., 2003 г.
5. Кузнецов В.Р, Сабельников В.А. Турбулентность и горение. — М., 1986 г.
Горение
Смотреть что такое «Горение» в других словарях:
Горение — спички … Википедия
ГОРЕНИЕ — физико химический процесс, при котором превращение вещества сопровождается интенсивным выделением энергии и тепло и массообменом с окружающей средой. Горение может начаться самопроизвольно в результате самовоспламенения либо быть инициированным… … Большой Энциклопедический словарь
ГОРЕНИЕ — ГОРЕНИЕ, горения, мн. нет, ср. (книжн.). Действие и состояние по гл. гореть. Горение газа. Душевное горение. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
горение — блеск, переливы, энтузиазм, сияние, игра, взлет, душевный подъем, подъем духа, сверкание, блистание, одержимость, огонь, страсть, огонек, воодушевление, поблескивание, вдохновение, увлеченность, живинка, увлечение, сгорание, подъем Словарь… … Словарь синонимов
Горение — ГОРЕНИЕ, химическое превращение, которое сопровождается интенсивным выделением тепла и тепло и массообменом с окружающей средой. Может начаться самопроизвольно (самовозгорание) или в результате зажигания. Характерное свойство горения способность… … Иллюстрированный энциклопедический словарь
ГОРЕНИЕ — сложная хим. реакция, протекающая в условиях прогрессивного самоускорения, связанного с накоплением в системе теплоты или катализирующих продуктов реакции. При Г. могут достигаться высокие (до неск. тыс. К) темп ры, причём часто возникает… … Физическая энциклопедия
Горение — физико химический процесс, при котором превращение вещества сопровождается интенсивным выделением энергии и тепло массообменом с окружающей средой. может начаться самопроизвольно в результате самовоспламенения либо может быть инициировано… … Словарь черезвычайных ситуаций
горение — Экзотермическая реакция окисления вещества, сопровождающаяся по крайней мере одним из трех факторов: пламенем, свечением, выделением дыма. [СТ СЭВ 383 87] горение Экзотермическая реакция, протекающая в условиях ее прогрессивного самоускорения.… … Справочник технического переводчика
горение — ГОРЕТЬ, рю, ришь; несов. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
ГОРЕНИЕ — букс. Жарг. угол. 1. Неизбежная опасность. ТСУЖ, 42. 2. Сигнал тревоги, опасности. ББИ, 58. Скачинский, 29; Балдаев 1, 92 … Большой словарь русских поговорок
ГОРЕНИЕ
Смотреть что такое «ГОРЕНИЕ» в других словарях:
Горение — спички … Википедия
ГОРЕНИЕ — физико химический процесс, при котором превращение вещества сопровождается интенсивным выделением энергии и тепло и массообменом с окружающей средой. Горение может начаться самопроизвольно в результате самовоспламенения либо быть инициированным… … Большой Энциклопедический словарь
ГОРЕНИЕ — ГОРЕНИЕ, горения, мн. нет, ср. (книжн.). Действие и состояние по гл. гореть. Горение газа. Душевное горение. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
горение — блеск, переливы, энтузиазм, сияние, игра, взлет, душевный подъем, подъем духа, сверкание, блистание, одержимость, огонь, страсть, огонек, воодушевление, поблескивание, вдохновение, увлеченность, живинка, увлечение, сгорание, подъем Словарь… … Словарь синонимов
Горение — ГОРЕНИЕ, химическое превращение, которое сопровождается интенсивным выделением тепла и тепло и массообменом с окружающей средой. Может начаться самопроизвольно (самовозгорание) или в результате зажигания. Характерное свойство горения способность… … Иллюстрированный энциклопедический словарь
ГОРЕНИЕ — сложная хим. реакция, протекающая в условиях прогрессивного самоускорения, связанного с накоплением в системе теплоты или катализирующих продуктов реакции. При Г. могут достигаться высокие (до неск. тыс. К) темп ры, причём часто возникает… … Физическая энциклопедия
Горение — физико химический процесс, при котором превращение вещества сопровождается интенсивным выделением энергии и тепло массообменом с окружающей средой. может начаться самопроизвольно в результате самовоспламенения либо может быть инициировано… … Словарь черезвычайных ситуаций
горение — Экзотермическая реакция окисления вещества, сопровождающаяся по крайней мере одним из трех факторов: пламенем, свечением, выделением дыма. [СТ СЭВ 383 87] горение Экзотермическая реакция, протекающая в условиях ее прогрессивного самоускорения.… … Справочник технического переводчика
горение — ГОРЕТЬ, рю, ришь; несов. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
Горение — (фр. и англ. combustion, нем. Verbrennung; хим.). Принятоназывать Г. такие случаи взаимодействия с кислородом воздуха каких бы тони было тел, которые сопровождаются значительным выделением тепла, аиногда и света. В более общем смысле можно… … Энциклопедия Брокгауза и Ефрона
ГОРЕНИЕ — букс. Жарг. угол. 1. Неизбежная опасность. ТСУЖ, 42. 2. Сигнал тревоги, опасности. ББИ, 58. Скачинский, 29; Балдаев 1, 92 … Большой словарь русских поговорок
Что такое горение? Значение слова, суть химического процесса
Здесь читатель найдет ответ на вопрос о том, что такое горение. В этой статье мы рассмотрим этот процесс, ознакомимся с характеристиками и классификацией, изучим исторические сведения и определим место в природе и жизни человека. Также уделим внимание конкретным параметрам для определенных видов горения.
Введение
Когда человек слышит слово «горение», скорее всего, в его воображении возникает образ пламени, который охватывает что-либо. Этот процесс имеет исторически, даже эволюционно, огромное значение для человека.
Горение – химические процесс, в ходе которого исходный ряд веществ преобразуется в продукт сгорания. Это экзотермический тип реакции, при которой интенсивно выделяется тепло. Энергетические ресурсы, запасенные в веществах, участвующих в процессе горения, могут выделяться, принимать вид излучения света.
Общие сведения
Ответив на вопрос о том, что такое горение, человек смог сделать его главным ресурсом, из которого мы до сих пор черпаем энергию. Около 90 % всех энергетических ресурсов, производимых на Земле людьми, выпадают на процессы сжигания ископаемых видов топлива. Однако в обозримом будущем (приблизительно до 2040 года) этот показатель снизится на 10 %. Это связано с истощением ресурсов Земли, которые не подлежат восстановлению, а также загрязнением мира, явлением глобального потепления.
Горение – химический процесс, обычно идущий по пути разветвленно-цепного механизма. Здесь прогрессирует самостоятельное ускорение благодаря теплу, которое выделяется в ходе реакций. Особенностями, которые выделяют горение, можно считать наличие больших показателей выделения тепла и потребность в относительно огромных ресурсах, необходимых для активации реакции. Эти два фактора напрямую влияют на скорость, при которой она будет проходить.
Исторические факты
Буркеном и Шуманном в 1928 году была рассмотрена задача о явлении диффузионного пламени. Они показали, что при наличии скорости сгорания веществ, участвующих в реакции, выше скорости подвода реагентов, поставляемых диффузией, зона горения становится тонкой до бесконечности. Это значит, что в такой области процессов происходит автоматическое установление стехиометрического соотношения между веществами, отвечающими за окисление, и горючими материалами. Максимальные температурные показатели приближаются к адиабатическим.
Теория горения в своем современном виде началась с трудов Н.Н. Семенова, который изучал явление теплового взрыва. Это произошло в 1920 году. Через восемнадцать лет, в 1938 году, Д.А. Франком-Каменецким была развита теория тепловых взрывов.
Уже в 1940 году была развита общая теория детонации – ZND. Ее основателем считается Я.Б. Зельдович. Название происходит от имен З. Неймана, Деринга и, собственно, Зельдовича. Это связано с тем, что независимо друг от друга исследователи пришли к схожим итогам и выводам на основе своих экспериментов и вычислений.
Классификационные данные
Сущность процесса горения позволяет классифицировать его в соответствии с определенными параметрами. Например, в зависимости от скорости сгорания веществ, его делят на детонацию и дефлаграцию. Последнее бывает ламинарным и турбулентным. Детонация – только турбулентная.
Если газ – это исходный и основной компонент смеси, которая горит, то реакцию можно назвать гомогенной. Этот процесс характеризуется взаимодействием окислителя и горючего вещества в газофазном горении. Разделение горючих веществ и их постепенное слияние, вызывающее рассматриваемый процесс, называют диффузией. Гетерогенной можно назвать реакцию, в которой окислители и горючее имеют разное положение фазы. Кроме перечисленного выше, выделяют: процесс тления, беспламенное, холоднопламенное и (термо)ядерное горение.
Пламя
Отвечая на вопрос о том, что такое горение, человек смог выделить в нем явление пламени, которое представляет собой зону, излучающую свет и образующуюся в ходе реакций горения. Ее температурные показатели определяются составом смесей и условиями, при которых протекает процесс. Сгорание природных газов позволяет разгонять температуру до двух тысяч кельвинов и выше.
Теория горения
Суть процесса горения, несмотря на большой практический опыт и применение, исследовалась в течение многих лет и остается одной из самых сложных загадок человечества. Наука, изучающая явление горения, является междисциплинарной и располагается на стыке газодинамики, химической термодинамики, химкинетики, молекулярной и химической физики, а также материаловедения и моделирования с использованием компьютерных технологий.
Рассмотрим следующие положения теории горения: полноту сгорания и его термодинамический механизм. Положение полноты сгорания включает в себя информацию о том, что исходные компоненты горючих смесей характеризуются молярной и массовой долей элемента, а также начальными показателями давления и температуры. Подобрав вещество, способное в ходе сгорания и окисления полностью превратиться в продукт рассматриваемого явления, можно получить стехиометрическую реакцию. Смесь, обладающая избытком горючего вещества, что не может полностью разложиться из-за нехватки окислителей, именуется богатой. Вещество с нехваткой топливного ресурса называют бедным.
Термодинамические данные позволяют нам утверждать, что горение, протекающее адиабатическим путем при наличии постоянного показателя объема, сохранит полную энергию внутренней системы. Если имеется постоянное давление, то наблюдается энтальпия структурных компонентов. Условия, при которых протекает адиабатическое давление, практически применяются и реализуются в пламени, что распространяется свободными путями. При этом расчетом теплопотери пренебрегают.
Гетерогенность
Гетерогенные процессы наблюдаются в случае, когда взаимодействуют несколько фаз (от двух). Это могут быть газы и жидкости. Такое же явление можно отслеживать в «территории» границы разделения между фазами. В терминологии это слово используют для описания процессов горения, в которых окислительное и горючее вещество пребывают в разных состояниях фазы. Сюда относится даже испарение топлива, происходящее в газовой форме. Ярким примером может послужить взаимодействие угля и кислорода, содержащегося в воздухе. В ходе этого образуется угарный газ, который может подвергаться дальнейшему сгоранию в состоянии газа и превращаться в CO2.
Твердое топливо
Те вещества, что используются в качестве топлива для ракет, делятся на две формы: смесевую и баллиститную. В первом случае разделение горючего вещества и окислителя не наблюдается, а сгорание происходит послойным способом. Их именуют гомогенным порохом. Главный компонент – это нитроцеллюлоза, которую добывают путем желатинизации в толще нитроглицерина.
Общие данные о сгорании твердого топлива
Процесс разложения пороха включает в себя несколько этапов, которые отличаются типом экзотермической реакции, а именно проходят в двух фазах газа и конденсации. Проведение опытов с горением баллиститных порохов в пространстве вакуума и при показателе давления ниже двух мм.рт.ст. показало, что экзотермические реакции происходят лишь в приповерхностном уровне фазы конденсации. При диапазоне давления от пяти до двадцати мм.рт.ст. можно увидеть пламя, но заметное только в темноте, а реакции протекают в газовом этапе.
Медленный тип горения
Твердофазный тип горения
Существует явление, которое можно наблюдать в порошках неорганической и органической природы. Оно характеризуется автоволновой экзотермической реакцией, в ходе которой заметное выделение газа не наблюдается, но образуются продукты в конденсированной форме. Однако это конечный результат реакции, а в промежутках между фазами отслеживается создание газов или жидкостей.
Самостоятельно распространяющийся высокотемпературный синтез на практике основывается именно на безгазовом или твердопламенном горении. Ниже расскажем о том, как охарактеризовать слово «горение».
Сведения о слове
Разбор слова «горение» по составу показывает нам, что оно образуется с помощью:
Это три составных элемента, которые включены в общую структуру термина.
Чтобы ответить на вопрос о том, как пишется слово «горение», достаточно вслух сказать его. Произношение слова совпадает с правописанием. Гласными буквами, образующими эту языковую единицу, являются: «о», «и», «е». Ударение ставим на первую «е». Проверочное слово у «горения» отсутствует, однако можно определить правильность написания путем чередования гласных «а» и «о». Их варьирование подчиняется правилам правописания корней «гор» и «гар».
Подводя итоги
Анализируя полученную информацию, скажем, что слово «горение» означает химический процесс, взаимосвязанный с физическими явлениями. Он является главным источником энергии для всего населения планеты и основывается на сжигании различного вида топлив. Включает в себя множество разновидностей и имеет огромное значение для людей. Горение играло немаловажную роль в истории развития человечества, а детальное изучение его позволило стремительно расти технологическому процессу.
Горение
Полезное
Смотреть что такое «Горение» в других словарях:
Горение — спички … Википедия
ГОРЕНИЕ — физико химический процесс, при котором превращение вещества сопровождается интенсивным выделением энергии и тепло и массообменом с окружающей средой. Горение может начаться самопроизвольно в результате самовоспламенения либо быть инициированным… … Большой Энциклопедический словарь
ГОРЕНИЕ — ГОРЕНИЕ, горения, мн. нет, ср. (книжн.). Действие и состояние по гл. гореть. Горение газа. Душевное горение. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
горение — блеск, переливы, энтузиазм, сияние, игра, взлет, душевный подъем, подъем духа, сверкание, блистание, одержимость, огонь, страсть, огонек, воодушевление, поблескивание, вдохновение, увлеченность, живинка, увлечение, сгорание, подъем Словарь… … Словарь синонимов
Горение — ГОРЕНИЕ, химическое превращение, которое сопровождается интенсивным выделением тепла и тепло и массообменом с окружающей средой. Может начаться самопроизвольно (самовозгорание) или в результате зажигания. Характерное свойство горения способность… … Иллюстрированный энциклопедический словарь
ГОРЕНИЕ — сложная хим. реакция, протекающая в условиях прогрессивного самоускорения, связанного с накоплением в системе теплоты или катализирующих продуктов реакции. При Г. могут достигаться высокие (до неск. тыс. К) темп ры, причём часто возникает… … Физическая энциклопедия
Горение — физико химический процесс, при котором превращение вещества сопровождается интенсивным выделением энергии и тепло массообменом с окружающей средой. может начаться самопроизвольно в результате самовоспламенения либо может быть инициировано… … Словарь черезвычайных ситуаций
горение — Экзотермическая реакция окисления вещества, сопровождающаяся по крайней мере одним из трех факторов: пламенем, свечением, выделением дыма. [СТ СЭВ 383 87] горение Экзотермическая реакция, протекающая в условиях ее прогрессивного самоускорения.… … Справочник технического переводчика
горение — ГОРЕТЬ, рю, ришь; несов. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
Горение — (фр. и англ. combustion, нем. Verbrennung; хим.). Принятоназывать Г. такие случаи взаимодействия с кислородом воздуха каких бы тони было тел, которые сопровождаются значительным выделением тепла, аиногда и света. В более общем смысле можно… … Энциклопедия Брокгауза и Ефрона
ГОРЕНИЕ — букс. Жарг. угол. 1. Неизбежная опасность. ТСУЖ, 42. 2. Сигнал тревоги, опасности. ББИ, 58. Скачинский, 29; Балдаев 1, 92 … Большой словарь русских поговорок
Что такое горение?
Реакция горения проста 2H2 + O2 = 2H2O. Но это только с виду. В это время выделяется свет, тепло, излучение, звук и т.д.
Горение, это экзотермическая реакция (выделяющая тепло), т.е. процесс соединения газов с кислородом, в результате которого выделяются другие вещества: углекислый газ, вода, скипидар, а также тепло и свет. Процесс этот называется окисление.
Для запуска химической реакции горения нужно извлечь газ из топлива, а для этого его нужно разогреть. Например, бензин и бумагу нужно нагреть до 220 С°, дерево до 250-300 С°, а каменный уголь до 600 С°. Именно по этой причине некоторые вещества трудно зажечь – трудно их нагреть до нужной температуры.
Кстати, большинство металлов горючи (кроме золота и платины), только горят они в чистом кислороде и при большой температуре. Например, сталь горит при температуре 1350 С°.
Процесс горения
Древесина, как органическое вещество, содержит в себе преимущественно углерод (С) и водород (Н). Для их воспламенения требуется кислород (О).

Соединяя водород (Н2) и кислород (О) мы получаем воду – Н2O конденсат. Водородное топливо с точки зрения экологии самое чистое, т.к. отходом горения является вода.
Соединяя углерод (С) и кислород (О) мы получаем либо безвредную углекислоту СO2, которая содержится в газировке, либо угарный газ СO, который загрязняет атмосферу и в определенных дозировках смертелен для человека.
Кстати, именно на уменьшение выбросов угарного газа в атмосферу направлено Парижское соглашение 2015 года, от которого в 2018 году отказался президент США Дональд Трамп.
Более того, во многих странах Европе по протоколу DIN EN 303-5-2012 вам не позволят использовать печи, которые по выбросам превышают норм СО2, впрочем, как и автомобили без катализатора.
Не стоит думать, что в горении твердого топлива участвуют только водород и кислород. Во первых, этапы горения идут последовательно, во вторых, в топливе содержится множество химических веществ, и каждое горит в своё время и со своей спецификой.
Образования угарного газа
Формулы углекислоты CO2 и угарного газа СО похожи, но разница большая.
Для горения с образованием углекислоты СО2 требуется много кислорода (О), а если кислорода не хватает, то образуется угарный газ СО. Более того, при горении с недостатком кислорода (О), выделяется меньше энергии.
С + 2О = СО2 + 8137 калорий.
С + О = СО + 2428 калорий.
Аналогичные процессы происходят и в нашем организме при преобразовании углеводов (С6Н1206) в энергию. При недостатке кислорода (О), анаэробном дыхании, у спринтеров, выделяется в 2 раза меньше энергии, чем при аэробном дыхании у марафонцев.
Помимо того, что горение с недостатком кислорода снижает КПД топлива, так еще и остальные компоненты топлива не успевают сгорать. Они оседают на стенках дымохода в виде сажи и улетают в трубу. Темный дым из трубы в большинстве случаев как раз и говорит нам о том, что в топке не хватает воздуха и выделяется угарный газ (СО). Также при таком режиме горения печь или котел требуется чистить чаще, вдобавок сажа может воспламениться и привести к пожару.
Попытки растянуть время горения топлива путем ограничения подачи воздуха загрязняют атмосферу, котел и не позволяют извлечь из топлива большинство энергии. Поэтому лучше сжигать топливо сразу, а излишки тепла передавать, например, при водяном отоплении, в резервную емкость, которая потом тепло будет передавать теплоносителю. Либо сжигать маленькие порции топлива, например, в пеллетном котле с автозагрузкой.
Не забудьте и про то, что угарный газ может попасть в помещение и привести к отравлению или смерти его обитателей.
Существуют модели твердотопливных котлов, в которых подачу воздуха может регулировать автоматика. Это удобно, когда вы хотите ночью поддерживать тепло и при этом не просыпаться для закладки топлива, но это не должно приводить к тлению и образованию угарного газа (СО), по описанным выше причинам.
Есть тонкость с угарным газом: в основном на планете он появляется от сжигания угля, нефти (бензина) и газа. До момента сжигания угарный газ находился в твердом или жидком состоянии, и не загрязнял атмосферу, а после сжигания стал. Биотопливо, такое как пеллеты или брикеты, сделаны из дерева, дерево поглотили углерод (С) из атмосферы, при сжигании выделили обратно, т.е. в атмосфере его не стало больше. Поэтому биотопливо считается экологичным, при условии его правильно сжигания.
Пламя
Как видно из рисунка, температура на конце пламени может достичь 1400 С°. Этого достаточно для нагрева топлива и воспламенения выделившихся из него газов.
В пункте 1 температура самая низкая, т.к. в ней мало кислорода (О), но много газов. Цвет пламени голубой или бесцветный, т.к. в этот момент из-за нагрева идет пиролиз, т.е. выделение газа. По краям кислорода становится больше и окрас пламени усиливается.
В пункте 2, центре, кислорода все еще недостаточно, но газов много. Яркий цвет, это сгоревший углерод (С) и другие частицы.
В пункте 3 горючие вещества практически полностью смешались с кислородом и температура пламени наиболее высокая. Цвет не такой яркий, т.к. твердые частички уже сгорели.
Желтый и красный цвет пламени получается из-за наличия в нем твердых частиц. Когда их нет, пламя синее или голубое, как в газовой плите. А вот если пламя горит зеленым и другими странными цветами, это означает, что в топливе есть примеси, возможно, вредные.
Горение происходит не только в видимой области, но и в невидимом инфракрасном диапазоне. Мы думаем, что это жар от огня, а это инфракрасные волны. Их можно увидеть с помощью инфракрасного сканера (термографии).
Тление, копчение и пиролиз
Тление при недостатке кислорода, с точки зрения эффективности горения и выделения продуктов распада, наиболее неудачный процесс. Выделяется угарный газ, это раз. Выделяется бензпирен, вещество первого класса опасности, это два. А также сажа, скипидар, кислоты, канцерогенные смолы и токсичные вещества. Однозначно, это вредно. В больших городах именно этим и дышат, а воздух в провинции чистый из-за отсутствий этих примесей.
При копчении продуктов горение топлива не применяется, а идет его распад методом пиролиза, т.е. выделением энергии путем нагрева без участи кислорода. При таком методе обработки пищи большинство вредных элементов в неё и переходит.
Сажа (копоть, деготь) это частицы, состоящие преимущественно из углерода. При наличии температуры и кислорода они сгорают. Если этого нет, то они слипаются в крупные кусочки, и осаживаются на стенках печки и трубы, но могут и в трубу улететь.
Мало того, что это требует очистки печи, может воспламениться, так еще и снижает её КПД, т.к. образуется слой, который препятствует поглощению тепла стенками печи.
К вопросу о недостаточной изученности процесса горения: в 1996 году дали Нобелевскую премию Роберту Кёрлу за открытие в саже фуллеренов.
Образование конденсата
Как мы уже знаем, при реакции горении водорода (Н) с кислородом (О), помимо выделения энергии, образуется вода Н2О. Также вода, как правило, содержится и в самом топливе, т.к. твердого топлива с влажность 0% практически не существует. В случае с котлом или печью, полученная вода находится в газообразном состоянии. Когда этот пар поднимается по дымоходу, а дымоход холодный, происходит охлаждение пара и преобразование его в воду. Вследствие чего, на стенках трубы появляется пленка конденсата и стекает вниз.
Тоже происходит и в жилом помещении, когда в воздухе помещения много влаги, за окном холодно, и окна запотевают, или в ванной комнате.
Накопления конденсата в дымоходе можно избежать его нагревом, снизить принудительной вентиляцией.
Кстати, образование сажи на стенках дымохода отчасти идет по схожему принципу. Не сгоревший углерод охлаждается на стенках дымохода и накапливается на них.
Из чего состоит зола? Когда дерево растет, оно формируется за счет фотосинтеза, т.е. преобразования солнечной энергии и углекислого газа (СО) в углерод (С). Из которого и состоит на 50%. Также дерево потребляет влагу. А из почвы забирает азот (Т), фосфор (Р), калий (К) и другие микроэлементы – вот это и есть зола. Наибольшее содержание будущей золы в коре (7%) и листьях (3%), а в древесине её до 2%. Кстати, чем старше дерево, тем меньше в нем золы. Поэтому в премиальных пеллетах и брикетах после сгорания золы остается меньше 1%. Также часть этих элементов разрушается во время горения и улетает в трубу.
На образование золы в топке тратится энергия, соответственно чем больше золы, тем меньше тепла ушло по назначению.
Зола хорошее удобрение, т.к. элементы, которое забрало растение из почвы возвращаются обратно.
Зола может спекаться в шлак. Для каменного угля это нормальное явление. А вот для дров, премиальных пеллетов и брикетов нет, т.к. означает, что при их производстве были применены добавки. Для пеллетов из шелухи, соломы и других отходов наличие золы является нормальным показателем.
Лекция «Общие понятия о горении и пожаровзрывоопасных свойствах веществ и материалов, пожарной опасности зданий»
СОДЕРЖАНИЕ
ВНИМАНИЕ! При изучение данной темы следует учитывать, что деятельность по обеспечению пожарной безопасности детально регламентируется действующим законодательством, которое в рамках проводимых реформ активно изменяется, поэтому рекомендуется положения нормативных правовых актов и нормативных документов в области пожарной безопасности уточнять в актуальных редакциях.
1. ГОРЕНИЕ ВЕЩЕСТВ И МАТЕРИАЛОВ. ПОЖАР И ЕГО РАЗВИТИЕ
1.1. ОСНОВНЫЕ ТЕРМИНЫ И ОПРЕДЕЛЕНИЯ
ПОЖАР – неконтролируемое горение, приводящее к ущербу.
ГОРЮЧЕСТЬ – способность веществ и материалов к развитию горения.
Все вещества и материалы обладают определенной горючестью, т.е. способностью к развитию горения.
ГОРЕНИЕ – экзотермическая реакция окисления вещества, сопровождающаяся по крайней мере одним из трех факторов: пламенем, свечением, выделением дыма.
Из данного определения вытекает, что горение – это любая реакция окисления вещества, приводящая к выделению тепла. При этом реакция должна сопровождаться пламенем, свечением или дымом.
ПЛАМЕННОЕ ГОРЕНИЕ – горение веществ и материалов, сопровождающееся пламенем.
ТЛЕНИЕ – беспламенное горение материала.
ДЫМ – аэрозоль, образуемый жидкими и (или) твердыми продуктами неполного сгорания материалов.
ВОЗГОРАЕМОСТЬ – способность веществ и материалов к возгоранию.
ВОЗГОРАНИЕ – начало горения под воздействием источника зажигания.
То есть, начало выделения тепла в результате реакции окисления, сопровождающееся свечением, пламенем или дымом.
САМОВОЗГОРАНИЕ – возгорание в результате самоинициируемых экзотермических процессов.
Самовозгорание сопровождается пламенем, свечением или дымом.
ВОСПЛАМЕНЯЕМОСТЬ – способность веществ и материалов к воспламенению.
ВОСПЛАМЕНЕНИЕ – начало пламенного горения под воздействием источника зажигания.
В отличие от возгорания, воспламенение сопровождается только пламенным горением.
САМОВОСПЛАМЕНЕНИЕ – самовозгорание, сопровождающееся пламенем.
Самовоспламенение сопровождается только пламенем, в отличие от самовозгорания.
ОПАСНЫЙ ФАКТОР ПОЖАРА – фактор пожара, воздействие которого на людей и (или) материальные ценности может привести к ущербу.
Опасными факторами, воздействующими на людей и материальные ости, являются:
— повышенная температура окружающей среды;
— токсичные продукты горения и термического разложения;
— пониженная концентрация кислорода.
Предельные значения опасных факторов пожара:
Температура среды – 70 °С
Тепловое излучение – 500 Вт/м 2
Содержание оксида углерода – 0,1% (об.)
Содержание диоксида углерода – 6% (об.)
Снижение видимости менее 20 м
Содержание кислорода менее 17% (об.)
К вторичным проявлениям опасных факторов пожара, воздействуют на людей и материальные ценности, относятся:
— осколки, части разрушающихся аппаратов, агрегатов, установок, конструкций;
— радиоактивные и токсичные вещества и материалы, вышедшие из разрушенных: аппаратов и установок;
— электрический ток, возникший в результате выноса высокого напряжения токопроводящие части конструкций, аппаратов, агрегатов;
— опасные факторы взрыва по ГОСТ 12.1.010, происшедшего вследствие пожара.
1.2 ОБЩИЕ СВЕДЕНИЯ О ГОРЕНИИ
1.2.1 ДИФФУЗИОННОЕ И КИНЕТИЧЕСКОЕ ГОРЕНИЕ
Все горючие (сгораемые) вещества содержат углерод и водород, – основные компоненты газовоздушной смеси, участвующие в реакции горения. Температура воспламенения горючих веществ и материалов различна и не превышает для большинства 300°С.
Физико-химические основы горения заключаются в термическом разложении вещества или материала до углеводородных паров и газов, которые под воздействием высоких температур вступают в химическое воздействие с окислителем (кислородом воздуха), превращаясь в процессе сгорания в углекислый газ (двуокись углерода), угарный газ (окись углерода), сажу (углерод) и воду, и при этом выделяется тепло и световое излучение.
Воспламенение представляет собой процесс распространение пламени по газопаровоздушной смеси. При скорости истечения горючих паров и газов с поверхности вещества равной скорости распространения пламени по ним наблюдается устойчивое пламенное горение. Если же скорость пламени больше скорости истечения паров и газов, то происходит выгорание газопаровоздушной смеси и самозатухание пламени, т.е. вспышка.
B зависимости от скорости истечения газов и скорости распространения пламени по ним можно наблюдать:
— горение на поверхности материала, когда скорость выделения горючей смеси с поверхности материала равна скорости распространения огня по ней;
— горение с отрывом от поверхности материала, когда скорость выделения горючей смеси больше скорости распространения пламени по ней.
Горение газопаровоздушной смеси подразделяется на диффузионное или кинетическое. Основным отличием является содержание или отсутствие окислителя (кислорода воздуха) непосредственно в горючей паровоздушной смеси.
Кинетическое горение представляет собой горение предварительно перемешанных горючих газов и окислителя (кислорода воздуха). На пожарах этот вид горения встречается крайне редко. Однако он часто встречается в технологических процессах: в газовой сварке, резке и т.п.
При диффузионном горении окислитель поступает в зону горения извне. Поступает он, как правило, снизу пламени вследствие разрежения, которое создается у его основания. В верхней части пламени, выделяющее в процессе горения тепло, создает давление. Основная реакция горения окисления происходит на границе пламени, поскольку истекающие с поверхности вещества газовые смеси препятствуют проникновению окислителя вглубь пламени (вытесняют воздух). Большая часть горючей смеси в центре пламени, не вступившая в реакцию окисления с кислородом, предает собой продукты неполного горения (СО, СН4, углерод и пр.).
Диффузионное горение, в свою очередь, бывает ламинарным и турбулентным (неравномерным во времени и пространстве). Ламинарное горение характерно при равенстве скоростей истечения горючей смеси с поверхности материала и скорости распространения пламени по ней. Турбулентное горение наступает, когда скорость выхода горючей смеси значительно превышает скорость распространения пламени. В этом случае граница пламени становится неустойчивой вследствие большой диффузии воздуха в зону горения. Неустойчивость вначале возникает вершины пламени, а затем перемещается к основанию. Такое горение встречается на пожарах при объемном его развитии.
Горение веществ и материалов возможно только при определенном качестве кислорода в воздухе. Содержание кислорода, при котором исключается возможность горения различных веществ и материалов, устанавливается опытным путем. Так, для картона и хлопка самозатухание наступает при 14% (об.) кислорода, а полиэфирной ваты – при 16% (об.)
Исключение окислителя (кислорода воздуха) является одной из мер пожарной профилактики. Поэтому хранение легковоспламеняющихся и горючих жидкостей, карбида кальция, щелочных металлов, фосфора должно осуществляться в плотно закрытой таре.
1.2.2 ИСТОЧНИКИ ЗАЖИГАНИЯ
Необходимым условием воспламенения горючей смеси являются источники зажигания. Источники зажигания подразделяются на открытый огонь, тепло нагревательных элементов и приборов, электрическую энергию, энергию механических искр, разрядов статического электричества и молнии, энергию процессов саморазогревания веществ и материалов (самовозгорание) и т.п. Выявлению имеющихся на производстве источников зажигания должно быть уделено особое внимание.
Характерные параметры источников зажигания принимаются по:
Температура канала молнии – 30000°С при силе тока 200000 А и времени действия около 100 мкс. Энергия искрового разряда вторичного воздействия молнии превышает 250 мДж и достаточна для воспламенения горючих материалов с минимальной энергией зажигания до 0,25 Дж. Энергия искровых разрядов при заносе высокого потенциала в здание по металлическим коммуникациям достигает значений 100 Дж и более, что достаточно для воспламенения всех горючих материалов.
Поливинилхлоридная изоляция электрического кабеля (провода) воспламеняется при кратности тока короткого замыкания более 2,5.
Температура сварочных частиц и никелевых частиц ламп накаливания достигает 2100°С. Температура капель при резке металла 1500°С. Температура дуга при сварке и резке достигает 4000°С.
Зона разлета частиц при коротком замыкании при высоте расположения провода 10 м колеблется от 5 (вероятность попадания 92%) до 9 (вероятность попадания 6%) м; при расположении провода на высоте 3 м – от 4 (96%) до 8 м (1%); при расположении на высоте 1 м – от 3 (99%) до 6 м (6%).
Искры статического электричества, образующегося при работе людей с движущимися диэлектрическими материалами, достигают величин от 2,5 до 7,5 мДж.
Температура пламени (тления) и время горения (тления), «С (мин), некоторых малокалорийных источников тепла: тлеющая папироса – 320-410 (2-2,5); тлеющая сигарета – 420-460 (26-30); горящая спичка – 620-640 (0,33).
Для искр печных труб, котельных, труб паровозов и тепловозов, а также других машин, костров установлено, что искра диаметром 2 мм пожароопасна, если имеет температуру около 1000°С, диаметром 3 мм – 800°С, диаметром 5 мм – 600°С.
1.2.3 САМОВОЗГОРАНИЕ
Самовозгорание присуще многим горючим веществам и материалам. Это отличительная особенность данной группы материалов.
Самовозгорание бывает следующих видов: тепловое, химическое, микробиологическое.
Тепловое самовозгорание выражается в аккумуляции материалом тепла, в процессе которого происходит самонагревание материала. Температура самонагревания вещества или материала является показателем его пожарной опасности. Для большинства горючих материалов этот показатель лежит в пределах от 80 до 150°С: бумага – 100°С; войлок строительный – 80°С; дерматин – 40°С; древесина: сосновая – 80, дубовая – 100, еловая – 120°С; хлопок-сырец — 60°С.
Продолжительное тление до начала пламенного горения является отличительной характеристикой процессов теплового самовозгорания. Данные процессы обнаруживаются по длительному и устойчивому запаху тлеющего материала.
Микробиологическое самовозгорание связано с выделением тепловой энергии микроорганизмами в процессе жизнедеятельности в питательной для них среде (сено, торф, древесные опилки и т.п.).
На практике чаще всего проявляются комбинированные процессы самовозгорания: тепловые и химические.
2. ПОКАЗАТЕЛИ ПОЖАРОВЗРЫВООПАСНОСТИ
Изучение пожаровзрывоопасных свойств веществ и материалов, обращающихся в процессе производства, является одной из основных задач пожарной профилактики, направленной на исключение горючей среды из системы пожара.
В соответствии с ГОСТ 12.1.044 по агрегатному состоянию вещества и материалы подразделяются на:
ГАЗЫ – вещества, давление насыщенных паров которых при температуре 25°С и давлении 101,3 кПа (1 атм) превышает 101,3 кПа (1 атм).
ЖИДКОСТИ – то же, но давлении меньше 101,3 кПа (1 атм). К жидкостям относят также твердые плавящиеся вещества, температура плавления или ка-плепадения которых меньше 50°С.
ТВЕРДЫЕ – индивидуальные вещества и их смеси с температурой плавления или каплепадения выше 50°С (например, вазилин — 54°С), а также вещества, не имеющие температуру плавления (например, древесина, ткани и т.п.).
ПЫЛИ – диспергированные (измельченные) твердые вещества и материалы с размером частиц менее 850 мкм (0,85 мм).
Номенклатура показателей и их применяемость для характеристики пожаровзрывоопасности веществ и материалов приведены в табл.1.
Значения данных показателей должны включаться в стандарты и технические условия на вещества, а также указываться в паспортах изделий.
Химия пламени
Чем проклинать тьму,
лучше зажечь хотя бы
одну маленькую свечу.
Конфуций
В начале
Первые попытки понять механизм горения связаны с именами англичанина Роберта Бойля, француза Антуана Лорана Лавуазье и русского Михаила Васильевича Ломоносова. Оказалось, что при горении вещество никуда не «исчезает», как наивно полагали когда-то, а превращается в другие вещества, в основном газообразные и потому невидимые. Лавуазье в 1774 году впервые показал, что при горении из воздуха уходит примерно пятая его часть. В течение XIX века ученые подробно исследовали физические и химические процессы, сопровождающие горение. Необходимость таких работ была вызвана прежде всего пожарами и взрывами в шахтах.
Существуют два вида пламени. Топливо и окислитель (чаще всего кислород) могут принудительно или самопроизвольно подводиться к зоне горения порознь и смешиваться уже в пламени. А могут смешиваться заранее — такие смеси способны гореть или даже взрываться в отсутствие воздуха, как, например, пороха, пиротехнические смеси для фейерверков, ракетные топлива. Горение может происходить как с участием кислорода, поступающего в зону горения с воздухом, так и при помощи кислорода, заключенного в веществе-окислителе. Одно из таких веществ — бертолетова соль (хлорат калия KClO3); это вещество легко отдает кислород. Сильный окислитель — азотная кислота HNO3: в чистом виде она воспламеняет многие органические вещества. Нитраты, соли азотной кислоты (например, в виде удобрения — калийной или аммиачной селитры), легко воспламеняются, если смешаны с горючими веществами. Еще один мощный окислитель, тетраоксид азота N2O4 — компонент ракетных топлив. Кислород могут заменить и такие сильные окислители, как, например, хлор, в котором горят многие вещества, или фтор. Чистый фтор — один из самых сильных окислителей, в его струе горит вода.
Цепные реакции
Основы теории горения и распространения пламени были заложены в конце 20-х годов прошлого столетия. В результате этих исследований были открыты разветвленные цепные реакции. За это открытие отечественный физикохимик Николай Николаевич Семенов и английский исследователь Сирил Хиншельвуд были в 1956 году удостоены Нобелевской премии по химии. Более простые неразветвленные цепные реакции открыл еще в 1913 году немецкий химик Макс Боденштейн на примере реакции водорода с хлором. Суммарно реакция выражается простым уравнением H2 + Cl2 = 2HCl. На самом деле она идет с участием очень активных осколков молекул — так называемых свободных радикалов. Под действием света в ультрафиолетовой и синей областях спектра или при высокой температуре молекулы хлора распадаются на атомы, которые и начинают длинную (иногда до миллиона звеньев) цепочку превращений; каждое из этих превращений называется элементарной реакцией:
Cl + H2 → HCl + H,
H + Cl2 → HCl + Cl и т. д.
На каждой стадии (звене реакции) происходит исчезновение одного активного центра (атома водорода или хлора) и одновременно появляется новый активный центр, продолжающий цепь. Цепи обрываются, когда встречаются две активные частицы, например Cl + Cl → Cl2. Каждая цепь распространяется очень быстро, поэтому, если генерировать «первоначальные» активные частицы с высокой скоростью, реакция пойдет так быстро, что может привести к взрыву.
Таким образом, за ничтожный промежуток времени одна активная частица (атом H) превращается в три (атом водорода и два гидроксильных радикала OH), которые запускают уже три цепи вместо одной. В результате число цепей лавинообразно растет, что моментально приводит к взрыву смеси водорода и кислорода, поскольку в этой реакции выделяется много тепловой энергии. Атомы кислорода присутствуют в пламени и при горении других веществ. Их можно обнаружить, если направить струю сжатого воздуха поперек верхней части пламени горелки. При этом в воздухе обнаружится характерный запах озона — это атомы кислорода «прилипли» к молекулам кислорода с образованием молекул озона: О + О2 = О3, которые и были вынесены из пламени холодным воздухом.
Возможность взрыва смеси кислорода (или воздуха) со многими горючими газами — водородом, угарным газом, метаном, ацетиленом — зависит от условий, в основном от температуры, состава и давления смеси. Так, если в результате утечки бытового газа на кухне (он состоит в основном из метана) его содержание в воздухе превысит 5%, то смесь взорвется от пламени спички или зажигалки и даже от маленькой искры, проскочившей в выключателе при зажигании света. Взрыва не будет, если цепи обрываются быстрее, чем успевают разветвляться. Именно поэтому была безопасной лампа для шахтеров, которую английский химик Хэмфри Дэви разработал в 1816 году, ничего не зная о химии пламени. В этой лампе открытый огонь был отгорожен от внешней атмосферы (которая могла оказаться взрывоопасной) частой металлической сеткой. На поверхности металла активные частицы эффективно исчезают, превращаясь в стабильные молекулы, и потому не могут проникнуть во внешнюю среду.
Полный механизм разветвленно-цепных реакций очень сложен и может включать более сотни элементарных реакций. К разветвленно-цепным относятся многие реакции окисления и горения неорганических и органических соединений. Таковой же будет и реакция деления ядер тяжелых элементов, например плутония или урана, под воздействием нейтронов, которые выступают аналогами активных частиц в химических реакциях. Проникая в ядро тяжелого элемента, нейтроны вызывают его деление, что сопровождается выделением очень большой энергии; одновременно из ядра вылетают новые нейтроны, которые вызывают деление соседних ядер. Химические и ядерные разветвленно-цепные процессы описываются сходными математическими моделями.
Что надо для начала
Чтобы началось горение, нужно выполнить ряд условий. Прежде всего, температура горючего вещества должна превышать некое предельное значение, которое называется температурой воспламенения. Знаменитый роман Рэя Брэдбери «451 градус по Фаренгейту» назван так потому, что примерно при этой температуре (233°C) загорается бумага. Это «температура воспламенения», выше которой твердое топливо выделяет горючие пары или газообразные продукты разложения в количестве, достаточном для их устойчивого горения. Примерно такая же температура воспламенения и у сухой сосновой древесины.
Температура пламени зависит от природы горючего вещества и от условий горения. Так, температура в пламени метана на воздухе достигает 1900°C, а при горении в кислороде — 2700°C. Еще более горячее пламя дают при сгорании в чистом кислороде водород (2800°C) и ацетилен (3000°C). Недаром пламя ацетиленовой горелки легко режет почти любой металл. Самую же высокую температуру, около 5000°C (она зафиксирована в Книге рекордов Гиннесса), дает при сгорании в кислороде легкокипящая жидкость — субнитрид углерода С4N2 (это вещество имеет строение дицианоацетилена NC–C=C–CN). А по некоторым сведениям, при горении его в атмосфере озона температура может доходить до 5700°C. Если же эту жидкость поджечь на воздухе, она сгорит красным коптящим пламенем с зелено-фиолетовой каймой. С другой стороны, известны и холодные пламена. Так, например, горят при низких давлениях пары фосфора. Сравнительно холодное пламя получается и при окислении в определенных условиях сероуглерода и легких углеводородов; например, пропан дает холодное пламя при пониженном давлении и температуре от 260–320°C.
Только в последней четверти ХХ века стал проясняться механизм процессов, происходящих в пламени многих горючих веществ. Механизм этот очень сложен. Исходные молекулы обычно слишком велики, чтобы, реагируя с кислородом, непосредственно превратиться в продукты реакции. Так, например, горение октана, одного из компонентов бензина, выражается уравнением 2С8Н18 + 25О2 = 16СО2 + 18Н2О. Однако все 8 атомов углерода и 18 атомов водорода в молекуле октана никак не могут одновременно соединиться с 50 атомами кислорода: для этого должно разорваться множество химических связей и образоваться множество новых. Реакция горения происходит многостадийно — так, чтобы на каждой стадии разрывалось и образовывалось лишь небольшое число химических связей, и процесс состоит из множества последовательно протекающих элементарных реакций, совокупность которых и представляется наблюдателю как пламя. Изучать элементарные реакции сложно прежде всего потому, что концентрации реакционно-способных промежуточных частиц в пламени крайне малы.
Внутри пламени
Оптическое зондирование разных участков пламени с помощью лазеров позволило установить качественный и количественный состав присутствующих там активных частиц — осколков молекул горючего вещества. Оказалось, что даже в простой с виду реакции горения водорода в кислороде 2Н2 + О2 = 2Н2О происходит более 20 элементарных реакций с участием молекул О2, Н2, О3, Н2О2, Н2О, активных частиц Н, О, ОН, НО2. Вот, например, что написал об этой реакции английский химик Кеннет Бэйли в 1937 году: «Уравнение реакции соединения водорода с кислородом — первое уравнение, с которым знакомится большинство начинающих изучать химию. Реакция эта кажется им очень простой. Но даже профессиональные химики бывают несколько поражены, увидев книгу в сотню страниц под названием «Реакция кислорода с водородом», опубликованную Хиншельвудом и Уильямсоном в 1934 году». К этому можно добавить, что в 1948 году была опубликована значительно большая по объему монография А. Б. Налбандяна и В. В. Воеводского под названием «Механизм окисления и горения водорода».
Современные методы исследования позволили изучить отдельные стадии подобных процессов, измерить скорость, с которой различные активные частицы реагируют друг с другом и со стабильными молекулами при разных температурах. Зная механизм отдельных стадий процесса, можно «собрать» и весь процесс, то есть смоделировать пламя. Сложность такого моделирования заключается не только в изучении всего комплекса элементарных химических реакций, но и в необходимости учитывать процессы диффузии частиц, теплопереноса и конвекционных потоков в пламени (именно последние устраивают завораживающую игру языков горящего костра).
Откуда все берется
Основное топливо современной промышленности — углеводороды, начиная от простейшего, метана, и кончая тяжелыми углеводородами, которые содержатся в мазуте. Пламя даже простейшего углеводорода — метана может включать до ста элементарных реакций. При этом далеко не все из них изучены достаточно подробно. Когда горят тяжелые углеводороды, например те, что содержатся в парафине, их молекулы не могут достичь зоны горения, оставаясь целыми. Еще на подходе к пламени они из-за высокой температуры расщепляются на осколки. При этом от молекул обычно отщепляются группы, содержащие два атома углерода, например С8Н18 → С2Н5 + С6Н13. Активные частицы с нечетным числом атомов углерода могут отщеплять атомы водорода, образуя соединения с двойными С=С и тройными С≡С связями. Было обнаружено, что в пламени такие соединения могут вступать в реакции, которые не были ранее известны химикам, поскольку вне пламени они не идут, например С2Н2 + О → СН2 + СО, СН2 + О2 → СО2 + Н + Н.
Постепенная потеря водорода исходными молекулами приводит к увеличению в них доли углерода, пока не образуются частицы С2Н2, С2Н, С2. Зона сине-голубого пламени обусловлена свечением в этой зоне возбужденных частиц С2 и СН. Если доступ кислорода в зону горения ограничен, то эти частицы не окисляются, а собираются в агрегаты — полимеризуются по схеме С2Н + С2Н2 → С4Н2 + Н, С2Н + С4Н2 → С6Н2 + Н и т. д.