Что такое изотопы
Что такое изотопы
Изотопы
(от Изо. и греч. tópos — место)
разновидности одного химического элемента, занимающие одно место в периодической системе элементов Менделеева, но отличающиеся массами атомов. Химические свойства атомов, т. е. принадлежность атома к тому или иному химическому элементу, зависят от числа электронов и их расположения в электронной оболочке атома (см. Атом). Место химического элемента в периодической системе элементов определяется его порядковым номером Z, равным числу электронов в оболочке атома или, что то же самое, числу Протонов, содержащихся в атомном ядре. Кроме протонов, в ядро атома входят Нейтроны, масса каждого из которых приблизительно равна массе протона. Количество нейтронов N в ядре атома с данным Z может быть различным, но в определённых пределах. Например, в ядре атома гелия (Z = 2) может содержаться 1, 2, 4 или 6 нейтронов. Полное число протонов Z и нейтронов N в ядре (называется общим термином нуклоны) определяет массу ядра и по существу массу всего атома. Это число А = Z + N называется массовым числом атома. От соотношения чисел протонов и нейтронов в ядре зависят стабильность или нестабильность ядра, тип распада радиоактивного ядра, Спин, магнитный дипольный момент, электрический квадрупольный момент ядра (См. Квалрупольный момент ядра) и некоторые другие его свойства (см. Ядро атомное). Таким образом, атомы с одинаковым Z, но с различным числом нейтронов N обладают идентичными химическими свойствами, но имеют различные массы и различные ядерные свойства. Эти разновидности атомов также называются И. Для обозначения любых разновидностей атомов, независимо от их принадлежности к одному элементу, применяют термин нуклиды.
Первое доказательство того, что вещества, имеющие одинаковое химическое поведение, могут иметь различные физические свойства, было получено при исследовании радиоактивных превращений атомов тяжёлых элементов. В 1906—07 выяснилось, что продукт радиоактивного распада Урана — ионий и продукт радиоактивного распада тория (См. Торий) — радиоторий имеют те же химические свойства, что и торий, однако отличаются от последнего атомной массой и характеристиками радиоактивного распада. Более того, как было обнаружено позднее, все три элемента имеют одинаковые оптические и рентгеновские спектры. Такие вещества, идентичные по химическим свойствам, но различные по массе атомов и некоторым физическим свойствам, по предложению английского учёного Ф. Содди, стали называть И.
В 1934 И. Кюри и Ф. Жолио получили искусственным путём радиоактивные И. азота ( 13 N), кремния ( 28 Si) и фосфора ( 30 P), отсутствующие в природе. Этими экспериментами они продемонстрировали возможность синтеза новых радиоактивных нуклидов. В последующие годы с помощью ядерных реакций (См. Ядерные реакции) под действием нейтронов и ускоренных заряженных частиц было синтезировано большое число радиоактивных И. известных элементов, а также получено около 20 новых элементов. Известно 276 стабильных И., принадлежащих 81 природному элементу, и около 1500 радиоактивных И. 105 природных и синтезированных элементов.
Анализ соотношений между числами нейтронов и протонов для различных И. одного и того же элемента показывает, что ядра стабильных И. и радиоактивных И., устойчивых по отношению к бета-распаду, содержат на каждый протон не менее одного нейтрона. Исключение из этого правила составляют лишь два нуклида — 1 H и 3 He. По мере перехода ко всё более тяжёлым ядрам отношение числа нейтронов к числу протонов в ядре растет и достигает 1,6 для урана и трансурановых элементов (См. Трансурановые элементы).
Элементы с нечётным Z имеют не более двух стабильных И. Как правило, число нейтронов N в таких ядрах чётное, и, следовательно, массовое число А — нечётное. Большинство элементов с чётным Z имеет несколько стабильных И., из которых не более двух с нечётным А. Наибольшее число И. (10) имеет олово, 9 И. — у ксенона, 8 — у кадмия и теллура. Многие элементы имеют 7 И.
Все стабильные И. на Земле возникли в результате ядерных процессов, протекавших в отдалённые времена, и их распространённость зависит от свойств ядер и от первоначальных условий, в которых происходили эти процессы. Изотопный состав природных элементов на Земле, как правило, постоянен. Это объясняется тем, что он не подвергается значительным изменениям в химических и физических процессах, протекающих на Земле. Однако небольшие колебания в относительной распространённости И. всё же наблюдаются для лёгких элементов, у которых различие в массах атомов И. относительно велико. Эти колебания обусловлены изменением изотопного состава элементов (фракционированием И.), происходящим в результате диффузии, изменения агрегатного состояния вещества, при некоторых химических реакциях и других процессах, непрерывно протекающих в атмосфере и земной коре (см. Изотопов разделение, Изотопные методы в геологии, Изотопный обмен). Изменение изотопного состава элементов, интенсивно мигрирующих в биосфере (Н, С, N, О, S), связано и с деятельностью живых организмов.
Для нуклидов, образующихся в результате радиоактивного распада, например для И. свинца, различное содержание И. в разных образцах обусловлено разным первоначальным содержанием их родоначальников (U или Th) и разным геологическим возрастом образцов (см. Геохронология, Масс-спектроскопия, Радиоактивность).
Единство образования тел Солнечной системы позволяет думать, что изотопный состав элементов земных образцов характерен для всей Солнечной системы в целом (при наличии известных колебаний). Метеоры и глубокие слои земной коры показывают примерно одинаковое отношение 16 O/ 18 O. Астрофизические исследования обнаруживают отклонения изотопного состава элементов, составляющих звёздное вещество и межзвёздную среду, от земного. Например, для углеродных R-звёзд отношение 12 C/ 13 C изменяется от 4—5 до земного значения.
Возможность примешивать к природным химическим элементам их радиоактивные И. позволяет следить за различными химическими и физическими процессами, в которых участвует данный элемент, с помощью детекторов радиоактивных излучений. Этот метод получил широкое применение в биологии, химии, медицине, а также в технике. Иногда примешивают стабильные И., присутствие которых обнаруживают в дальнейшем масс-спектральными методами (см. Изотопные индикаторы).
Важной проблемой является выделение отдельных И. из их природной или искусственно полученной смеси или обогащение этой смеси каким-либо И.
Лит.: Астон Ф. В., Масс-спектры и изотопы, пер. с англ., М., 1948; Кравцов В. А., Массы атомов и энергии связи ядер, М., 1965; Lederer С. М., Hollander J. М., Periman I., Table of isotopes, 6 ed., N. Y. — [a. o.], 1967.
Изотопы
Изото́п (от др.-греч. ισος — «равный», «одинаковый», и τόπος — «место») — разновидность атома (и ядра) какого-либо химического элемента, отличающаяся от других изотопов только количеством нейтронов в ядре. Название связано с тем, что все изотопы одного атома помещаются в одно и то же место (в одну клетку) таблицы Менделеева. Химические свойства атома зависят от строения электронной оболочки, которая, в свою очередь, определяется в основном зарядом ядра Z (то есть количеством протонов в нём), и почти не зависят от его массового числа A (то есть суммарного числа протонов Z и нейтронов N ). Все изотопы одного элемента имеют одинаковый заряд ядра, отличаясь лишь числом нейтронов. Обычно изотоп обозначается символом химического элемента, к которому он относится, с добавлением верхнего левого индекса, означающего массовое число (например, 12 C, 222 Rn). Можно также написать название элемента с добавлением через дефис массового числа (например, углерод-12, радон-222). Некоторые изотопы имеют традиционные собственные названия (например, дейтерий, актинон).
Пример изотопов: 16 8 O, 17 8 O, 18 8 O — три стабильных изотопа кислорода.
Содержание
Терминология
Основная позиция ИЮПАК состоит в том, что правильным термином в единственном числе для обозначения атомов (или ядер) одного химического элемента с одинаковой атомной массой является нуклид, а термин изотопы допускается применять для обозначения совокупности нуклидов одного элемента. Термин изотопы был предложен и применялся изначально во множественном числе, поскольку для сравнения необходимо минимум две разновидности атомов. В дальнейшем в практику широко вошло также употребление термина в единственном числе — изотоп. Кроме того, термин во множественном числе часто применяется для обозначения любой совокупности нуклидов, а не только одного элемента, что также некорректно. В настоящее время позиции международных научных организаций не приведены к единообразию и термин изотоп продолжает широко применяться, в том числе и в официальных материалах различных подразделений ИЮПАК и ИЮПАП. Это один из примеров того, как смысл термина, изначально в него заложенный, перестаёт соответствовать понятию, для обозначения которого этот термин используется (другой хрестоматийный пример — атом, который, в противоречии с названием, не является неделимым).
История открытия изотопов
Первое доказательство того, что вещества, имеющие одинаковое химическое поведение, могут иметь различные физические свойства, было получено при исследовании радиоактивных превращений атомов тяжёлых элементов. В 1906—1907 годах выяснилось, что продукт радиоактивного распада урана — ионий и продукт радиоактивного распада тория — радиоторий имеют те же химические свойства, что и торий, но отличаются от него атомной массой и характеристиками радиоактивного распада. Было обнаружено позднее, что у всех трёх продуктов одинаковы оптические и рентгеновские спектры. Такие вещества, идентичные по химическим свойствам, но различные по массе атомов и некоторым физическим свойствам, по предложению английского учёного Содди стали называть изотопами.
Изотопы в природе
Считается, что изотопный состав элементов на Земле одинаков во всех материалах. Некоторые физические процессы в природе приводят к нарушению изотопного состава элементов (природное фракционирование изотопов, характерное для лёгких элементов, а также изотопные сдвиги при распаде природных долгоживущих изотопов). Постепенное накопление в минералах ядер — продуктов распада некоторых долгоживущих нуклидов используется в ядерной геохронологии.
Применение изотопов человеком
Изотопы 60 Co и 137 Cs используются в стерилизации Υ-лучами (лучевая стерилизация) как один из методов физической стерилизации инструментов, перевязочного материала и прочего. Доза проникающей радиации должна быть весьма значительной — до 20-25 мкГр, что требует особых мер безопасности. В связи с этим лучевая стерилизация проводится в специальных помещениях и является заводским методом стерилизации (непосредственно в стационарах она не производится). [1]
ИЗОТОПЫ
ИЗОТОПЫ – разновидности одного и того же химического элемента, близкие по своим физико-химическим свойствам, но имеющие разную атомную массу. Название «изотопы» было предложено в 1912 английским радиохимиком Фредериком Содди, который образовал его из двух греческих слов: isos – одинаковый и topos – место. Изотопы занимают одно и то же место в клетке периодической системы элементов Менделеева.
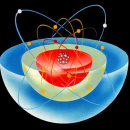
Атом любого химического элемента состоит из положительно заряженного ядра и окружающего его облака отрицательно заряженных электронов. Положение химического элемента в периодической системе Менделеева (его порядковый номер) определяется зарядом ядра его атомов. Изотопами называются поэтому разновидности одного и того же химического элемента, атомы которых имеют одинаковый заряд ядра (и, следовательно, практически одинаковые электронные оболочки), но отличаются значениями массы ядра. По образному выражению Ф.Содди, атомы изотопов одинаковы «снаружи», но различны «внутри».
В 1932 был открыт нейтрон – частица, не имеющая заряда, с массой, близкой к массе ядра атома водорода – протона, и создана протонно-нейтронная модель ядра. В результате в науке установилось окончательное современное определение понятия изотопов: изотопы – это вещества, ядра атомов которых состоят из одинакового числа протонов и отличаются лишь числом нейтронов в ядре. Каждый изотоп принято обозначать набором символов 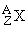
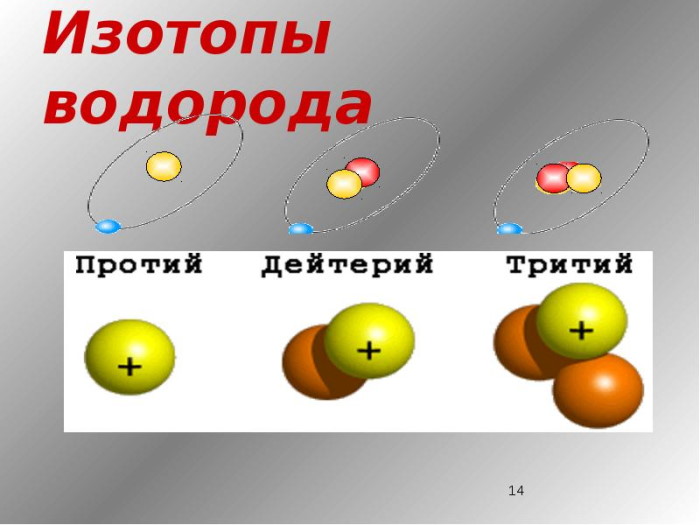
Из всех известных нам изотопов только изотопы водорода имеют собственные названия. Так, изотопы 2 H и 3 H носят названия дейтерия и трития и получили обозначения соответственно D и T (изотоп 1 H называют иногда протием).
В природе встречаются как стабильные изотопы, так и нестабильные – радиоактивные, ядра атомов которых подвержены самопроизвольному превращению в другие ядра с испусканием различных частиц (или процессам так называемого радиоактивного распада). Сейчас известно около 270 стабильных изотопов, причем стабильные изотопы встречаются только у элементов с атомным номером Z Ј 83. Число нестабильных изотопов превышает 2000, подавляющее большинство их получено искусственным путем в результате осуществления различных ядерных реакций. Число радиоактивных изотопов у многих элементов очень велико и может превышать два десятка. Число стабильных изотопов существенно меньше, Некоторые химические элементы состоят лишь из одного стабильного изотопа (бериллий, фтор, натрий, алюминий, фосфор, марганец, золото и ряд других элементов). Наибольшее число стабильных изотопов – 10 обнаружено у олова, у железа, например, их – 4, у ртути – 7.
Открытие изотопов, историческая справка.
В 1808 английский ученый натуралист Джон Дальтон впервые ввел определение химического элемента как вещества, состоящего из атомов одного вида. В 1869 химиком Д.И.Менделеевым была открыт периодический закон химических элементов. Одна из трудностей в обосновании понятия элемента как вещества, занимающего определенное место в клетке периодической системы, заключалась в наблюдаемой на опыте нецелочисленности атомных весов элементов. В 1866 английский физик и химик – сэр Вильям Крукс выдвинул гипотезу, что каждый природный химический элемент представляет собой некоторую смесь веществ, одинаковых по своим свойствам, но имеющих разные атомные масс, однако в то время такое предположение не имело еще экспериментального подтверждения и поэтому прошло мало замеченным.
Важным шагом на пути к открытию изотопов стало обнаружение явления радиоактивности и сформулированная Эрнстом Резерфордом и Фредериком Содди гипотеза радиоактивного распада: радиоактивность есть не что иное, как распад атома на заряженную частицу и атом другого элемента, по своим химическим свойствам отличающийся от исходного. В результате возникло представление о радиоактивных рядах или радиоактивных семействах, в начале которых есть первый материнский элемент, являющийся радиоактивным, и в конце – последний стабильный элемент. Анализ цепочек превращений показал, что в их ходе в одной клеточке периодической системы могут оказываться одни и те же радиоактивные элементы, отличающиеся лишь атомными массами. Фактически это и означало введение понятия изотопов.
Независимое подтверждение существования стабильных изотопов химических элементов было затем получено в экспериментах Дж. Дж. Томсона и Астона в 1912–1920 с пучками положительно заряженных частиц (или так называемых каналовых лучей), выходящих из разрядной трубки.
В 1919 Астон сконструировал прибор, названный масс-спектрографом (или масс-спектрометром). В качестве источника ионов по-прежнему использовалась разрядная трубка, однако Астон нашел способ, при котором последовательное отклонение пучка частиц в электрическом и магнитном полях приводило к фокусировке частиц с одинаковым значением отношения заряда к массе (независимо от их скорости) в одной и той же точке на экране. Наряду с Астоном масс-спектрометр несколько другой конструкции в те же годы был создан американцем Демпстером. В результате последующего использования и усовершенствования масс-спектрометров усилиями многих исследователей к 1935 году была составлена почти полная таблица изотопных составов всех известных к тому времени химических элементов.
Методы разделения изотопов.
Для изучения свойств изотопов и особенно для их применения в научных и прикладных целях требуется их получение в более или менее заметных количествах. В обычных масс-спектрометрах достигается практически полное разделение изотопов, однако количество их ничтожно мало. Поэтому усилия ученых и инженеров были направлены на поиски других возможных методов разделения изотопов. В первую очередь были освоены физико-химические методы разделения, основанные на различиях в таких свойствах изотопов одного итого же элемента, как скорости испарения, константы равновесия, скорости химических реакций и т.п. Наиболее эффективными среди них оказались методы ректификации и изотопного обмена, которые нашли широкое применение в промышленном производстве изотопов легких элементов: водорода, лития, бора, углерода, кислорода и азота.
Другую группу методов образуют так называемые молекулярно-кинетические методы: газовая диффузия, термодиффузия, масс-диффузия (диффузия в потоке пара), центрифугирование. Методы газовой диффузии, основанные на различной скорости диффузии изотопных компонентов в высокодисперсных пористых средах, были использованы в годы второй мировой войны при организации промышленного производства разделения изотопов урана в США в рамках так называемого Манхэттенского проекта по созданию атомной бомбы. Для получения необходимых количеств урана, обогащенного до 90% легким изотопом 235 U – главной «горючей» составляющей атомной бомбы, были построены заводы, занимавшие площади около четырех тысяч гектар. На создание атомного центра с заводами для получения обогащенного урана было ассигновано более 2-х млрд. долл. После войны в СССР были разработать и построены заводы по производству обогащенного урана для военных целей, также основанные на диффузионном методе разделения. В последние годы этот метод уступил место более эффективному и менее затратному методу центрифугирования. В этом методе эффект разделения изотопной смеси достигается за счет различного действия центробежных сил на компоненты изотопной смеси, заполняющей ротор центрифуги, который представляет собой тонкостенный и ограниченный сверху и снизу цилиндр, вращающийся с очень высокой скоростью в вакуумной камере. Сотни тысяч соединенных в каскады центрифуг, ротор каждой из которых совершает более тысячи оборотов в секунду, используются в настоящее время на современных разделительных производствах как в России, так и в других развитых странах мира. Центрифуги используются не только для получения обогащенного урана, необходимого для обеспечения работы ядерных реакторов атомных электростанций, но и для производства изотопов примерно тридцати химических элементов средней части периодической системы. Для разделения различных изотопов используются также установки электромагнитного разделения с мощными источниками ионов, в последние годы получили распространение также лазерные методы разделения.
Применение изотопов.
Разнообразные изотопы химических элементов находят широкое применение в научных исследованиях, в различных областях промышленности и сельского хозяйства, в ядерной энергетике, современной биологии и медицине, в исследованиях окружающей среды и других областях. В научных исследованиях (например, в химическом анализе) требуются, как правило, небольшие количества редких изотопов различных элементов, исчисляемые граммами и даже миллиграммами в год. Вместе с тем, для ряда изотопов, широко используемых в ядерной энергетике, медицине и других отраслях, потребность в их производстве может составлять многие килограммы и даже тонны. Так, в связи с использованием тяжелой воды D2O в ядерных реакторах ее общемировое производство к началу 1990-х прошлого века составляло около 5000 т в год. Входящий в состав тяжелой воды изотоп водорода дейтерий, концентрация которого в природной смеси водорода составляет всего 0,015%, наряду с тритием станет в будущем, по мнению ученых, основным компонентом топлива энергетических термоядерных реакторов, работающих на основе реакций ядерного синтеза. В этом случае потребность в производстве изотопов водорода окажется огромной.
В научных исследованиях стабильные и радиоактивные изотопы широко применяются в качестве изотопных индикаторов (меток) при изучении самых различных процессов, происходящих в природе.
В сельском хозяйстве изотопы («меченые» атомы) применяются, например, для изучения процессов фотосинтеза, усвояемости удобрений и для определения эффективности использования растениями азота, фосфора, калия, микроэлементов и др. веществ.
Урок 2. Изотопы элементов
В уроке 2 «Изотопы элементов» из курса «Химия для чайников» рассмотрим что такое изотопы элементов и как правильно их обозначают; кроме того мы научимся определять массовое число, дефект массы и энергию связи ядра. Данный урок полностью опирается на основы химии, изложенные в первом уроке, в котором мы рассмотрели строение атома и атомного ядра, поэтому настоятельно вам рекомендую его изучить от корки до корки.
Что такое изотоп?
Хотя все атомы одного элемента имеют одинаковое число протонов, эти атомы могут отличаться числом имеющихся у них нейтронов. Такие различные атомы одного и того же элемента называются изотопами. Количество протонов, а также количество электронов у изотопа и исходного элемента совпадает. По этой причине в природе существует гораздо больше химических элементов, чем указано в таблице Менделеева, которая систематизирует элементы по числу протонов (порядковый номер).
Например, все атомы Li имеют 3 протона, но в природе существуют изотопы, содержащие от 3 до 5 нейтронов. Для обозначения изотопа, слева от символа элемента подписывают нижним индексом его порядковый номер, а верхним — массовое число. Массовое число — это суммарное число нуклонов (протонов и нейтронов) в атомном ядре, численно близкое к атомной массе элемента. Нижний индекс, обозначающий порядковый номер элемента, указывать не обязательно, так как все атомы лития имеют в своем ядре по 3 протона. Также, обсуждая эти изотопы, можно пользоваться записью «литий-6» и «литий-8».
Пример 1. Сколько протонов, нейтронов и электронов содержится в атоме урана-238? Запишите символ этого изотопа.
Решение: Порядковый номер урана (см. таблицу Менделеева) равен 92, а массовое число изотопа равно 238 (по условию). Следовательно, он содержит 92 протона, 92 электрона и 238 — 92 = 146 нейтронов. Его символ 238 U.
Дефект массы и энергия связи ядра
Затронув тему изотопов, нельзя пройти мимо феномена дефект массы ядра. Когда из отдельных нуклонов образуется атомное ядро, часть их массы превращается в энергию. Другими словами, вот взяли вы щепотку протонов и нейтронов, хорошенько их смяли вместе, и получили ядро, но его масса будет меньше массы исходных компонентов. Это и есть дефект масс. Формула для расчета дефекта массы ядра:
где Mя – масса ядра, Z – число протонов в ядре, N – число нейтронов в ядре, mp – масса протона, mn – масса нейтрона.
Если к атому подвести энергию (которая эквивалентна дефекту масс), то можно разделить его ядро обратно на нуклоны. Эта энергия носит название энергия связи ядра. Формула для расчета энергии связи ядра:
где с — скорость света, ∆m — дефект массы ядра
Проверьте себя, как вы усвоили понятия дефект массы и энергия связи ядра, самостоятельно решив задачу пользуясь формулами выше.
Пример 2. Если образовать атом углерода-12 из субатомных частиц, какое значение будет иметь дефект масс?
Ответ: 0,0990 а.е.м.
Теперь нам известно, что каждый изотоп элемента характеризуется порядковым номером (суммарным числом протонов), массовым числом (суммарным числом протонов и нейтронов) и атомной массой (массой атома, выраженной в атомных единицах массы). Поскольку дефект массы при образовании атома очень мал, массовое число обычно совпадает с атомной массой изотопа, округленной до ближайшего целого числа. (Например, атомная масса хлора-37 равна 36,966, что после округления дает 37.) Если в природе встречается несколько изотопов одного элемента, то экспериментально наблюдаемая атомная масса (естественная атомная масса) равна средневзвешенному значению атомных масс отдельных изотопов. Это средневзвешенное значение определяется соответственно относительному содержанию изотопов в природе. Хлор существует в природе в виде смеси из 75,53% хлора-35 (атомная масса 34,97 а.е.м.) и 24,47% хлора-37 (36,97 а.е.м.), поэтому средневзвешенное значение масс этих изотопов равно
Атомные массы, указанные в таблице Менделеева представляют собой во всех случаях средневзвешенные значения атомных масс изотопов, встречающихся в природе, и именно этими значениями мы будем пользоваться в дальнейшем, за исключением тех случаев, когда будет обсуждаться какой-нибудь конкретный изотоп. Все изотопы одного элемента в химическом отношении ведут себя практически одинаково. На рисунке ниже изображены состав и свойства некоторые атомов, ионов и изотопов элементов.
Пример 3. Магний (Mg) в основном состоит из трех естественных изотопов: 78,70% всех атомов магния имеют атомную массу 23,985 а.е.м., 10,13% — 24,986 а.е.м. и 11,17% — 25,983 а.е.м. Сколько протонов и нейтронов содержится в каждом из этих трех изотопов? Чему равно средневзвешенное значение их атомных масс?
Решение: Все изотопы магния содержат по 12 протонов. Изотоп с атомной массой 23,985 а.е.м. имеет массовое число 24 (суммарное число протонов и нейтронов), следовательно, он имеет 24 — 12 = 12 нейтронов. Символ этого изотопа 24 Mg. Аналогично находим, что изотоп с атомным весом 24,986 а.е.м. имеет массовое число 25, содержит 13 нейтронов и имеет символ 25 Mg. Третий изотоп (25,983 а.е.м.) имеет массовое число 26, содержит 14 нейтронов и имеет символ 26 Mg. Средняя атомная масса магния находится следующим образом:
Надеюсь урок 2 «Изотопы элементов» помог вам понять что из себя представляют изотопы. Если у вас возникли вопросы, пишите их в комментарии.
Изотоп
Изото́пы (от греч. ισος — «равный», «одинаковый», и τόπος — «место») — разновидности атомов (и ядер) одного химического элемента с разным количеством нейтронов в ядре. Название связано с тем, что изотопы находятся в одном и том же месте (в одной клетке) таблицы Менделеева. Химические свойства атома зависят практически только от строения электронной оболочки, которая, в свою очередь, определяется в основном зарядом ядра Z (то есть количеством протонов в нём) и почти не зависит от его массового числа A (то есть суммарного числа протонов Z и нейтронов N). Все изотопы одного элемента имеют одинаковый заряд ядра, отличаясь лишь числом нейтронов. Обычно изотоп обозначается символом химического элемента, к которому он относится, с добавлением верхнего левого индекса, означающего массовое число (например, 12 C, 222 Rn). Можно также написать название элемента с добавлением через дефис массового числа (например, углерод-12, радон-222). Некоторые изотопы имеют традиционные собственные названия (например, дейтерий, актинон).
Содержание
Терминология
Основная позиция ИЮПАК состоит в том, что правильным термином в единственном числе для обозначения атомов (или ядер) одного химического элемента с одинаковой атомной массой является нуклид, а термин изотопы допускается применять для обозначения совокупности нуклидов одного элемента. Термин изотопы был предложен и применялся изначально во множественном числе, поскольку для сравнения необходимо минимум две разновидности атомов. В дальнейшем в практику широко вошло также употребление термина в единственном числе — изотоп. Кроме того, термин во множественном числе часто применяется для обозначения любой совокупности нуклидов, а не только одного элемента, что также некорректно. В настоящее время позиции международных научных организаций не приведены к единообразию и термин изотоп продолжает широко применяться, в том числе и в официальных материалах различных подразделений ИЮПАК и ИЮПАП. Это один из примеров того, как смысл термина, изначально в него заложенный, перестаёт соответствовать понятию, для обозначения которого этот термин используется (другой хрестоматийный пример — атом, который, в противоречии с названием, не является неделимым).
История открытия изотопов
Первое доказательство того, что вещества, имеющие одинаковое химическое поведение, могут иметь различные физические свойства, было получено при исследовании радиоактивных превращений атомов тяжёлых элементов. В 1906—07 выяснилось, что продукт радиоактивного распада урана — ионий и продукт радиоактивного распада тория — радиоторий, имеют те же химические свойства, что и торий, но отличаются от него атомной массой и характеристиками радиоактивного распада. Было обнаружено позднее, что у всех трёх продуктов одинаковы оптические и рентгеновские спектры. Такие вещества, идентичные по химическим свойствам, но различные по массе атомов и некоторым физическим свойствам, по предложению английского учёного Ф. Содди, стали называть изотопами.
Изотопы в природе
Считается, что изотопный состав элементов на Земле одинаков во всех материалах. Некоторые физические процессы в природе приводят к нарушению изотопного состава элементов (природное фракционирование изотопов, характерное для лёгких элементов, а также изотопные сдвиги при распаде природных долгоживущих изотопов). Постепенное накопление в минералах ядер — продуктов распада некоторых долгоживущих нуклидов используется в ядерной геохронологии.
Применение изотопов человеком
См. также
Нестабильные (менее суток): 4 H: Водород-4, 5 H: Водород-5, 6 H: Водород-6, 7 H: Водород-7
Описание изотопов: определение, состав, превращения
Что такое изотоп?
Изотопами называют видоизменные элементы периодической таблицы Менделеева, которые имеют один и тот же порядковый номер, но различную атомную массу. Название характеризует нахождение подобных структур в одной клеточке периодической таблицы с нормальными элементами (изо – равное, топ – положение, место – в переводе с английского). Состав изотопов представляет собой совокупность протонов, электронов и нейтронов (количество нейтронов обычно больше, чем в обычных элементах периодической таблицы).
Обозначения изотопов
Видоизмененные элементы периодической таблицы Менделеева обозначаются следующим образом: к символу химического элемента, к которому принадлежит изотоп, подписывается верхний левый индекс с обозначением массового числа. Так, например, изотоп кислорода, обладающий массовым числом равным восемнадцати атомных единиц, будет обозначаться следующим образом: 18 O. Имеется также другое обозначение подобных атомов (например, кислород – 18).
Изотопы водорода
Выделяют три видоизменённых атома водорода, обладающих разными массовыми числами:
протий (Н) – одна атомная единица массы;
дейтерий (D) – две атомные единицы массы;
тритий (Т) – три атомные единицы массы.
Отдельно необходимо выделить, видоизменённые атомы водорода, массовое число которого может колебаться в районе 4 – 7 а.е.м.
Изотопы урана
Изотопный ряд урана включает в себя изотопы, имеющие массу от 219 а.е.м. до 243 а.е.м. Элементы, обладающие наибольшей изотопной распространенностью – это уран – 235 и уран – 238.
Нуклиды
Нуклиды подразделяются на две больших категории:
Химический элемент периодической таблицы ртуть (гидраргирум) обладает наибольшей изотопной распространенностью стабильных нуклидов. Так, стабильные нуклиды ртути – это вещества изотопного ряда гидраргиума, обладающие атомной массой от 170 а.е.м. до 219 а.е.м.
Термин нуклид (в понятии радионуклид) был предложен в двадцатом веке американцем Трумэном Команом. Радионуклиды отличаются длительным периодом полураспада, который в большинстве случаев имеет значение порядка 5*10 8 лет. Таким образом, радионуклиды населяют Землю с момента ее зарождения как планеты. В зависимости от массового числа нуклиды могут подвергать различным видам превращения, обозначим некоторые из них:
альфа-распад (для большинства радионуклидов подобный вид распада не наблюдается и из-за большого периода полураспада);
нейтронный и двухнейтронный распады.
Изотопы галлия
электронный захват (наблюдается в 13% случаев);
позитронный распад (наблюдается в 87% случаев).
Превращения изотопов
Превращения изотопов могут протекать двумя способами:
при участии технологий, созданных человеком (используется в промышленности);
самопроизвольно (протекает в природе).
Выделяют следующие виды ядерных превращений, связанных со изменением атомной массы химических элементов: распад (альфа, бета, двойной бета, нейтронный, позитронный), электронный захват (происходит присоединение электрона, вследствие чего изменяется заряд и состав нуклида).
Применение радиоактивных изотопов
Изотопы химических элементов представляют собой элементы периодической таблицы Менделеева, обладающие нестабильными ядрами и свойством подвергаться различного ядерному распаду. В научной терминологии подобные атомы называют также радионуклидами. Радиоактивные изотопы применяются в различных сферах человеческой деятельности.
В сельском хозяйстве использования радиоизотопов необходимо для изучения особенностей роста, развития и функционирования корневых систем растений (такой способ изучения получил название – метод меченных атомов).
В авиастроительстве радионуклиды применяют для испытания авиационных конструкций на предмет износостойкости.
В сфере градостроительстве радиоактивные изотопы нашли свое применение как универсальные измерители плотности почвы.
В области коммунального хозяйства видоизмененные химические элементы, обладающие радиоактивной способностью, применяют в целях стерилизации постельного белья.
В текстильной промышленности радионуклиды используются для удаления электрических зарядов с поверхности одежды.
В машиностроительной отрасли радионуклиды используются для определения толщины металлического покрытия.
Особое место в этом списке занимает использование радиоактивных изотопов в химической промышленности и в сфере медицинских услуг. Так, получение различных полимерных соединений, которые составляют основу большинства современных предметов обихода, письменных принадлежностей, резиновых изделий того или иногда вида использования происходит при помощи взаимодействия y-излучения с различными химическими соединениями органической природы. В медицине радиоизотопы применяются в лечебных целях в рамках радиационной терапии (процедура, при которой под воздействием радионуклидов происходит разрушение любого типа живой ткани). Радиотерапия нашла свое применения в области лечения онкологических заболеваний (на данный момент, по эффективности радиотерапия уступает только химиотерапии, но зачастую данные способы лечения составляют две стадии одного процесса).
В заключении, стоит отметить, что научный прогресс в области получения новых видов изотопов тех или иных химических элементов не стоит на месте, поэтому возможно в будущем при помощи грамотного и целесообразного использования видоизмененных атомов можно будет лечить неизлечимые на данный момент заболеваний и строить космические корабли для покорения других планет и галактик.
ИЗОТОПЫ
Полезное
Смотреть что такое «ИЗОТОПЫ» в других словарях:
ИЗОТОПЫ — (от изо. и греческого topos место), разновидности химических элементов, у которых ядра атомов (нуклидов) отличаются числом нейтронов, но содержат одинаковое число протонов и поэтому занимают одно и то же место в периодической системе химических … Современная энциклопедия
Изотопы — (от изо. и греческого topos место), разновидности химических элементов, у которых ядра атомов (нуклидов) отличаются числом нейтронов, но содержат одинаковое число протонов и поэтому занимают одно и то же место в периодической системе химических … Иллюстрированный энциклопедический словарь
ИЗОТОПЫ — (от изо. и греч. topos место) разновидности химических элементов, у которых ядра атомов отличаются числом нейтронов, но содержат одинаковое число протонов и поэтому занимают одно и то же место в периодической системе элементов. Различают… … Большой Энциклопедический словарь
ИЗОТОПЫ — ИЗОТОПЫ, хим. элементы, расположенные в одной и той же клетке периодической системы и следовательно обладающие одинаковым атомным номером или порядко вым числом. При этом И. не должны, вообще говоря, обладать одинаковым атомным весом. Различные… … Большая медицинская энциклопедия
изотопы — атомы одного и того же хим. элемента, ядра которых содержат одинаковое число протонов, но различное число нейтронов; имеют разные атомные массы, обладают одними и теми же хим. свойствами, но различаются по своим физ. свойствам, в частности… … Словарь микробиологии
ИЗОТОПЫ — атомы хим. элемента, обладающие разными массовыми числами, но имеющие одинаковый заряд атомных ядер и поэтому занимающие одно место в периодической системе Менделеева. Атомы разных изотопов одного и того же хим. элемента отличаются по числу… … Геологическая энциклопедия
Изотопы — Isotopes нуклиды, имеющие одинаковый атомный номер, но различные атомные массы (например, уран 235 и уран 238). Термины атомной энергетики. Концерн Росэнергоатом, 2010 … Термины атомной энергетики
ИЗОТОПЫ — (от изо. и греч. topos место), элементы с одинаковым порядковым номером, но с разной атомной массой. Большинство радиоактивных изотопов, важных для экологии, обладают энергией от 0,1 до 5 Мэв (чем выше энергия радиоактивных изотопов, тем больше … Экологический словарь
изотопы — Нуклиды, имеющие одинаковый атомный номер, но различные атомные массы (например, уран 235 и уран 238). [http://pripyat.forumbb.ru/viewtopic.php?id=25] Тематики атомная энергетика в целом EN isotopes … Справочник технического переводчика
ИЗОТОПЫ — разновидности атомов данного хим. элемента, ядра которых содержат одинаковое число протонов, но различное число нейтронов. И. имеют разные атомные (см.) и одинаковое число электронов в атомной оболочке, что определяет их очень близкие физ. хим.… … Большая политехническая энциклопедия
Изотопы
Полезное
Смотреть что такое «Изотопы» в других словарях:
ИЗОТОПЫ — (от изо. и греческого topos место), разновидности химических элементов, у которых ядра атомов (нуклидов) отличаются числом нейтронов, но содержат одинаковое число протонов и поэтому занимают одно и то же место в периодической системе химических … Современная энциклопедия
Изотопы — (от изо. и греческого topos место), разновидности химических элементов, у которых ядра атомов (нуклидов) отличаются числом нейтронов, но содержат одинаковое число протонов и поэтому занимают одно и то же место в периодической системе химических … Иллюстрированный энциклопедический словарь
ИЗОТОПЫ — (от изо. и греч. topos место) разновидности химических элементов, у которых ядра атомов отличаются числом нейтронов, но содержат одинаковое число протонов и поэтому занимают одно и то же место в периодической системе элементов. Различают… … Большой Энциклопедический словарь
ИЗОТОПЫ — ИЗОТОПЫ, хим. элементы, расположенные в одной и той же клетке периодической системы и следовательно обладающие одинаковым атомным номером или порядко вым числом. При этом И. не должны, вообще говоря, обладать одинаковым атомным весом. Различные… … Большая медицинская энциклопедия
ИЗОТОПЫ — разновидности данного хим. элемента, различающиеся по массе ядер. Обладая одинаковыми зарядами ядер Z, но различаясь числом нейтронов, И. имеют одинаковое строение электронных оболочек, т. е. очень близкие хим. св ва, и занимают одно и то же… … Физическая энциклопедия
изотопы — атомы одного и того же хим. элемента, ядра которых содержат одинаковое число протонов, но различное число нейтронов; имеют разные атомные массы, обладают одними и теми же хим. свойствами, но различаются по своим физ. свойствам, в частности… … Словарь микробиологии
ИЗОТОПЫ — атомы хим. элемента, обладающие разными массовыми числами, но имеющие одинаковый заряд атомных ядер и поэтому занимающие одно место в периодической системе Менделеева. Атомы разных изотопов одного и того же хим. элемента отличаются по числу… … Геологическая энциклопедия
Изотопы — Isotopes нуклиды, имеющие одинаковый атомный номер, но различные атомные массы (например, уран 235 и уран 238). Термины атомной энергетики. Концерн Росэнергоатом, 2010 … Термины атомной энергетики
ИЗОТОПЫ — (от изо. и греч. topos место), элементы с одинаковым порядковым номером, но с разной атомной массой. Большинство радиоактивных изотопов, важных для экологии, обладают энергией от 0,1 до 5 Мэв (чем выше энергия радиоактивных изотопов, тем больше … Экологический словарь
изотопы — Нуклиды, имеющие одинаковый атомный номер, но различные атомные массы (например, уран 235 и уран 238). [http://pripyat.forumbb.ru/viewtopic.php?id=25] Тематики атомная энергетика в целом EN isotopes … Справочник технического переводчика
ИЗОТОПЫ — разновидности атомов данного хим. элемента, ядра которых содержат одинаковое число протонов, но различное число нейтронов. И. имеют разные атомные (см.) и одинаковое число электронов в атомной оболочке, что определяет их очень близкие физ. хим.… … Большая политехническая энциклопедия
ИЗОТОПЫ
Полезное
Смотреть что такое «ИЗОТОПЫ» в других словарях:
ИЗОТОПЫ — (от изо. и греческого topos место), разновидности химических элементов, у которых ядра атомов (нуклидов) отличаются числом нейтронов, но содержат одинаковое число протонов и поэтому занимают одно и то же место в периодической системе химических … Современная энциклопедия
Изотопы — (от изо. и греческого topos место), разновидности химических элементов, у которых ядра атомов (нуклидов) отличаются числом нейтронов, но содержат одинаковое число протонов и поэтому занимают одно и то же место в периодической системе химических … Иллюстрированный энциклопедический словарь
ИЗОТОПЫ — (от изо. и греч. topos место) разновидности химических элементов, у которых ядра атомов отличаются числом нейтронов, но содержат одинаковое число протонов и поэтому занимают одно и то же место в периодической системе элементов. Различают… … Большой Энциклопедический словарь
ИЗОТОПЫ — ИЗОТОПЫ, хим. элементы, расположенные в одной и той же клетке периодической системы и следовательно обладающие одинаковым атомным номером или порядко вым числом. При этом И. не должны, вообще говоря, обладать одинаковым атомным весом. Различные… … Большая медицинская энциклопедия
ИЗОТОПЫ — разновидности данного хим. элемента, различающиеся по массе ядер. Обладая одинаковыми зарядами ядер Z, но различаясь числом нейтронов, И. имеют одинаковое строение электронных оболочек, т. е. очень близкие хим. св ва, и занимают одно и то же… … Физическая энциклопедия
изотопы — атомы одного и того же хим. элемента, ядра которых содержат одинаковое число протонов, но различное число нейтронов; имеют разные атомные массы, обладают одними и теми же хим. свойствами, но различаются по своим физ. свойствам, в частности… … Словарь микробиологии
ИЗОТОПЫ — атомы хим. элемента, обладающие разными массовыми числами, но имеющие одинаковый заряд атомных ядер и поэтому занимающие одно место в периодической системе Менделеева. Атомы разных изотопов одного и того же хим. элемента отличаются по числу… … Геологическая энциклопедия
Изотопы — Isotopes нуклиды, имеющие одинаковый атомный номер, но различные атомные массы (например, уран 235 и уран 238). Термины атомной энергетики. Концерн Росэнергоатом, 2010 … Термины атомной энергетики
ИЗОТОПЫ — (от изо. и греч. topos место), элементы с одинаковым порядковым номером, но с разной атомной массой. Большинство радиоактивных изотопов, важных для экологии, обладают энергией от 0,1 до 5 Мэв (чем выше энергия радиоактивных изотопов, тем больше … Экологический словарь
изотопы — Нуклиды, имеющие одинаковый атомный номер, но различные атомные массы (например, уран 235 и уран 238). [http://pripyat.forumbb.ru/viewtopic.php?id=25] Тематики атомная энергетика в целом EN isotopes … Справочник технического переводчика
ИЗОТОПЫ — разновидности атомов данного хим. элемента, ядра которых содержат одинаковое число протонов, но различное число нейтронов. И. имеют разные атомные (см.) и одинаковое число электронов в атомной оболочке, что определяет их очень близкие физ. хим.… … Большая политехническая энциклопедия
изотопы
Полезное
Смотреть что такое «изотопы» в других словарях:
ИЗОТОПЫ — (от изо. и греческого topos место), разновидности химических элементов, у которых ядра атомов (нуклидов) отличаются числом нейтронов, но содержат одинаковое число протонов и поэтому занимают одно и то же место в периодической системе химических … Современная энциклопедия
Изотопы — (от изо. и греческого topos место), разновидности химических элементов, у которых ядра атомов (нуклидов) отличаются числом нейтронов, но содержат одинаковое число протонов и поэтому занимают одно и то же место в периодической системе химических … Иллюстрированный энциклопедический словарь
ИЗОТОПЫ — (от изо. и греч. topos место) разновидности химических элементов, у которых ядра атомов отличаются числом нейтронов, но содержат одинаковое число протонов и поэтому занимают одно и то же место в периодической системе элементов. Различают… … Большой Энциклопедический словарь
ИЗОТОПЫ — ИЗОТОПЫ, хим. элементы, расположенные в одной и той же клетке периодической системы и следовательно обладающие одинаковым атомным номером или порядко вым числом. При этом И. не должны, вообще говоря, обладать одинаковым атомным весом. Различные… … Большая медицинская энциклопедия
ИЗОТОПЫ — разновидности данного хим. элемента, различающиеся по массе ядер. Обладая одинаковыми зарядами ядер Z, но различаясь числом нейтронов, И. имеют одинаковое строение электронных оболочек, т. е. очень близкие хим. св ва, и занимают одно и то же… … Физическая энциклопедия
изотопы — атомы одного и того же хим. элемента, ядра которых содержат одинаковое число протонов, но различное число нейтронов; имеют разные атомные массы, обладают одними и теми же хим. свойствами, но различаются по своим физ. свойствам, в частности… … Словарь микробиологии
ИЗОТОПЫ — атомы хим. элемента, обладающие разными массовыми числами, но имеющие одинаковый заряд атомных ядер и поэтому занимающие одно место в периодической системе Менделеева. Атомы разных изотопов одного и того же хим. элемента отличаются по числу… … Геологическая энциклопедия
Изотопы — Isotopes нуклиды, имеющие одинаковый атомный номер, но различные атомные массы (например, уран 235 и уран 238). Термины атомной энергетики. Концерн Росэнергоатом, 2010 … Термины атомной энергетики
ИЗОТОПЫ — (от изо. и греч. topos место), элементы с одинаковым порядковым номером, но с разной атомной массой. Большинство радиоактивных изотопов, важных для экологии, обладают энергией от 0,1 до 5 Мэв (чем выше энергия радиоактивных изотопов, тем больше … Экологический словарь
изотопы — Нуклиды, имеющие одинаковый атомный номер, но различные атомные массы (например, уран 235 и уран 238). [http://pripyat.forumbb.ru/viewtopic.php?id=25] Тематики атомная энергетика в целом EN isotopes … Справочник технического переводчика
ИЗОТОПЫ — разновидности атомов данного хим. элемента, ядра которых содержат одинаковое число протонов, но различное число нейтронов. И. имеют разные атомные (см.) и одинаковое число электронов в атомной оболочке, что определяет их очень близкие физ. хим.… … Большая политехническая энциклопедия
Значение слова «изотоп»
изото́п
1. физ. разновидность одного и того же химического элемента, отличающаяся от других разновидностей атомной массой ◆ Углерод-12, углерод-13, углерод-14 — изотопы, они обладают практически одинаковыми химическими свойствами. ◆ Хлор-37 — тяжёлый изотоп хлора. ◆ Для этого в кровь вводили бета-излучающие изотопы, которые в мозг попадали с кровотоком и концентрировались в местах активности нервных клеток, требующих повышенного кровоснабжения. Игорь Лалаянц, «Детектор лжи на молекулярном уровне? Завтра, завтра… послезавтра!» // ««Знание — сила»» (цитата из НКРЯ)
Делаем Карту слов лучше вместе

Спасибо! Я обязательно научусь отличать широко распространённые слова от узкоспециальных.
Насколько понятно значение слова расплётший (прилагательное):
Значение слова «изотопы»
[От греч. ’ίσος — равный и τόπος — место]
Источник (печатная версия): Словарь русского языка: В 4-х т. / РАН, Ин-т лингвистич. исследований; Под ред. А. П. Евгеньевой. — 4-е изд., стер. — М.: Рус. яз.; Полиграфресурсы, 1999; (электронная версия): Фундаментальная электронная библиотека
Делаем Карту слов лучше вместе

Спасибо! Я обязательно научусь отличать широко распространённые слова от узкоспециальных.
Насколько понятно значение слова желудочник (существительное):
Ассоциации к слову «изотоп»
Синонимы к слову «изотопы»
Предложения со словом «изотоп»
Сочетаемость слова «изотоп»
Какими бывают «изотопы»
Понятия со словом «изотопы»
Отправить комментарий
Дополнительно
Предложения со словом «изотоп»
Изменения могут выражаться в движении маятника, вибрации кристалла кварца или даже соотношении радиоактивных изотопов углерода в окаменелостях.
Оба изотопа урана – уран-235 и уран-238 подвергаются α-распаду – при самопроизвольном разрушении их ядер выделяется α-частица, которая представляет ничто иное, как ядро атома гелия.
Следующие 17 минут свободные нейтроны лихорадочно соединялись со всеми протонами, попадавшимися им на пути, и формировали тяжёлый изотоп водорода, называемый дейтерием.
ИЗОТОПЫ
И. бывают устойчивые стабильные и неустойчивые радиоактивные. Ядра атомов радиоактивных И. самопроизвольно распадаются, испуская в окружающую среду альфа-, бета- и гамма-излучения (см. Радиоактивность, Ионизирующие излучения). Различают естественные радиоактивные И., встречающиеся в природе (например, уран, радий, торий, радон, полоний), и искусственные получаемые при различных ядерных реакциях (например, технеций, прометий, плутоний).
В организм животного в естественных условиях радиоактивные И. поступают с кормом, водой, вдыхаемым воздухом и частично через кожу, а в экспериментальных условиях могут быть введены внутривенно, подкожно, внутрибрюшинно. Некоторые И., в том числе и радиоактивные, равномерно распределяются по всем органам и тканям (углерод, сера, калии, цезий, натрий и др.), а другие обладают выраженной органотропностью (например, фосфор фиксируется преимущественно в костях, кобальт в печени, йод в щитовидной железе, железо в эритроцитах). Ествественные радиоактивные И. углерода, калия, водорода, урана, тория и др. в небольших количествах постоянно поступают в организм из внешней среды. В организм поступают также искусственные радиоактивные И., образующиеся при ядерных взрывах и как отходы атомной промышленности. Среди них особенно опасны долгоживущие 99 Sr и l37 Cs, так как они долго мигрируют во внешней среде. Попав в организм, радиоактивные И. создают непрерывное облучение органов и тканей (см. Радиационная токсикология). Кроме тождественных химических свойств И. одного и того же элемента, проявляется тождественность их свойств и поведения в различных биохимических и физиологических процессах, протекающих в живом организме, поэтому в биологических исследованиях их применяют как изотопные индикаторы для изучения механизма действия лекарственных веществ, выяснения тонких процессов обмена веществ, отдельных физиологических функций и т. п. Излучения радиоактивных И. применяют главным образом в медицине для радиодиагностики и радиотерапии, а также для лучевой стерилизации пищевых продуктов, кормов, фармацевтических препаратов, хирургических инструментов, перевязочного материала и т. д. В небольших дозах радиоактивные И. можно применять как средство, стимулирующее рост и развитие сельскохозяйственных животных. В энтомологии этими И. пользуются для мечения насекомых при изучении дальности и путей их миграции. В микробиологии радиоактивными И. метят микробов с последующим выяснением патогенеза инфекционных заболеваний, имунобиологических реакций организма.
Литература:
Радиоактивные изотопы в медицине и биологии, М., 1955;
Воккен Г. Г., Ветеринарная радиология, 2 изд., Л., 1973.
Полезное
Смотреть что такое «ИЗОТОПЫ» в других словарях:
ИЗОТОПЫ — (от изо. и греческого topos место), разновидности химических элементов, у которых ядра атомов (нуклидов) отличаются числом нейтронов, но содержат одинаковое число протонов и поэтому занимают одно и то же место в периодической системе химических … Современная энциклопедия
Изотопы — (от изо. и греческого topos место), разновидности химических элементов, у которых ядра атомов (нуклидов) отличаются числом нейтронов, но содержат одинаковое число протонов и поэтому занимают одно и то же место в периодической системе химических … Иллюстрированный энциклопедический словарь
ИЗОТОПЫ — (от изо. и греч. topos место) разновидности химических элементов, у которых ядра атомов отличаются числом нейтронов, но содержат одинаковое число протонов и поэтому занимают одно и то же место в периодической системе элементов. Различают… … Большой Энциклопедический словарь
ИЗОТОПЫ — ИЗОТОПЫ, хим. элементы, расположенные в одной и той же клетке периодической системы и следовательно обладающие одинаковым атомным номером или порядко вым числом. При этом И. не должны, вообще говоря, обладать одинаковым атомным весом. Различные… … Большая медицинская энциклопедия
ИЗОТОПЫ — разновидности данного хим. элемента, различающиеся по массе ядер. Обладая одинаковыми зарядами ядер Z, но различаясь числом нейтронов, И. имеют одинаковое строение электронных оболочек, т. е. очень близкие хим. св ва, и занимают одно и то же… … Физическая энциклопедия
изотопы — атомы одного и того же хим. элемента, ядра которых содержат одинаковое число протонов, но различное число нейтронов; имеют разные атомные массы, обладают одними и теми же хим. свойствами, но различаются по своим физ. свойствам, в частности… … Словарь микробиологии
ИЗОТОПЫ — атомы хим. элемента, обладающие разными массовыми числами, но имеющие одинаковый заряд атомных ядер и поэтому занимающие одно место в периодической системе Менделеева. Атомы разных изотопов одного и того же хим. элемента отличаются по числу… … Геологическая энциклопедия
Изотопы — Isotopes нуклиды, имеющие одинаковый атомный номер, но различные атомные массы (например, уран 235 и уран 238). Термины атомной энергетики. Концерн Росэнергоатом, 2010 … Термины атомной энергетики
ИЗОТОПЫ — (от изо. и греч. topos место), элементы с одинаковым порядковым номером, но с разной атомной массой. Большинство радиоактивных изотопов, важных для экологии, обладают энергией от 0,1 до 5 Мэв (чем выше энергия радиоактивных изотопов, тем больше … Экологический словарь
изотопы — Нуклиды, имеющие одинаковый атомный номер, но различные атомные массы (например, уран 235 и уран 238). [http://pripyat.forumbb.ru/viewtopic.php?id=25] Тематики атомная энергетика в целом EN isotopes … Справочник технического переводчика
ИЗОТОПЫ — разновидности атомов данного хим. элемента, ядра которых содержат одинаковое число протонов, но различное число нейтронов. И. имеют разные атомные (см.) и одинаковое число электронов в атомной оболочке, что определяет их очень близкие физ. хим.… … Большая политехническая энциклопедия
Разница между Изотопами, Изобарами и Изотонами
Ключевое различие между изотопами, изобарами и изотонами заключается в том, что Изотопы — это атомы с одинаковым числом протонов, но различным количеством нейтронов, Изобары — это атомы разных химических элементов, имеющие одинаковые значения атомной массы, а Изотоны — это атомы разных химических элементов, имеющих одинаковое количество нейтронов в атомном ядре.
Содержание
Что такое Изотопы?
Изотопы — это атомы с одинаковым количеством протонов, но с разным количеством нейтронов. Число протонов в атоме является атомным номером этого атома. Определенный химический элемент имеет фиксированное количество протонов. Следовательно, атомный номер атомов одного и того же химического элемента подобен друг другу.
Изотопы водорода
И зотопы являются атомами одного и того же химического элемента. Общее количество протонов и нейтронов известно как атомная масса. Изотопы имеют разные атомные массы.
Химическое поведение изотопов химического элемента идентично, но физические свойства отличаются друг от друга. Почти все химические элементы имеют изотопы. Известно 275 изотопов 81 стабильного химического элемента. Для конкретного химического элемента существуют стабильные изотопы, а также радиоактивные изотопы (нестабильные).
Что такое Изобары?
Изобары — это атомы разных химических элементов, имеющие одинаковые значения атомной массы. Атомная масса — это сумма протонов и нейтронов в ядре атома. Протон и нейтрон называются как нуклоном. Следовательно, изобары имеют одинаковое количество нуклонов.
Атомные номера этих изобар отличаются друг от друга, потому что разные химические элементы имеют разные атомные номера. Изобарное правило Йозефа Мэттауча гласит, что если два соседних элемента в периодической системе химических элементов имеют изотопы с одинаковым массовым числом, один из этих изотопов должен быть радиоактивным. Если существуют изобары трех последовательных элементов, то первый и последний изобары стабильны, а средний может подвергнуться радиоактивному распаду. Серия изобар представляет собой совокупность различных изотопов, имеющих одинаковую атомную массу.
Что такое Изотоны?
Изотоны — это атомы разных элементов, имеющие одинаковое количество нейтронов в атомном ядре. Изотоны имеют разные атомные номера (количество протонов в ядре отличается друг от друга), а также у них разные атомные массы.
В чем разница между Изотопами, Изобарами и Изотонами?
| Изотопы, изобары и изотоны | |
| Изотопы | Изотопы — это атомы с одинаковым количеством протонов, но с разным количеством нейтронов |
| Изобары | Изобары — это атомы разных химических элементов, имеющие одинаковые значения атомной массы |
| Изотоны | Изотоны — это атомы разных элементов, имеющие одинаковое количество нейтронов в атомном ядре |
| Атомный номер | |
| Изотопы | Изотопы имеют одинаковый атомный номер |
| Изобары | Изобары имеют разные атомные номера |
| Изотоны | Изотоны имеют разные атомные номера | Атомная масса |
| Изотопы | Изотопы имеют различную атомную массу |
| Изобары | Изобары имеют одинаковую атомную массу |
| Изотоны | Изотоны имеют разную атомную массу |
| Количество нейтронов | |
| Изотопы | Изотопы имеют разное количество нейтронов |
| Изобары | Изобары имеют разное количество нейтронов |
| Изотоны | Изотонизирует одинаковое количество нейтронов |
Заключение — Изотопы, Изобары и Изотоны
Изотопы, изобары и изотоны — это термины, используемые для описания взаимодействий между атомами различных химических элементов. Разница между изотопами, изобарами и изотонами заключается в том, что изотопы — это атомы с одинаковым числом протонов, но различным количеством нейтронов, изобары — это атомы разных химических элементов, имеющие одинаковые значения для атомной массы, а изотоны — это атомы разных элементов, имеющих одинаковое количество нейтронов в атомном ядре.
ИЗОТОПЫ
Изотопы (греч. isos равный, одинаковый + topos место) — разновидности одного химического элемента, занимающие одно и то же место в периодической системе элементов Менделеева, т. е. имеющие одинаковый заряд ядра, но различающиеся массами атомов. При упоминании об Изотопах обязательно указывают, изотопом какого химического элемента он является. Термин «изотоп» иногда употребляют и в более широком смысле — для описания атомов различных элементов. Однако для обозначения любого из атомов независимо от его принадлежности к тому или иному элементу принято использовать термин «нуклид».
Принадлежность Изотопа к определенному элементу и основные хим. свойства определяются его порядковым номером Z или числом протонов, содержащихся в ядре (соответственно и одинаковым числом электронов в оболочке атома), а его ядерно-физ. свойства определяются совокупностью и соотношением числа входящих в него протонов и нейтронов. Каждое ядро состоит из Z протонов и N нейтронов, а общее число этих частиц, или нуклонов, составляет массовое число А = Z + N, определяющее массу ядра. Оно равно округленному до целого числа значению массы данного нуклида. Любой нуклид, т. о., определяется значениями Z и N, хотя некоторые радиоактивные нуклиды с одинаковыми Z и N могут находиться в различных ядерно-энергетических состояниях и различаться своими ядерно-физ. свойствами; такие нуклиды называются изомерами. Нуклиды с одинаковым числом протонов называются изотопами.
Изотопы обозначаются символом соответствующего хим. элемента с расположенным вверху слева индексом А — массовым числом; иногда слева внизу приводится также число протонов (Z). Напр., радиоактивные И. фосфора с массовыми числами 32 и 33 обозначают: 32 P и 33 P или 32 P и 33 P соответственно. При обозначении И. без указания символа элемента массовое число приводится после обозначения элемента, напр. фосфор-32, фосфор-33.
У И. разных элементов может быть одно и то же массовое число. Атомы с различным числом протонов Z и нейтронов N, но с одинаковым массовым числом А называют изобарами (напр., 14 32 Si, 15 32 P, 16 32 S, 17 32 Cl— изобары).
Название «изотоп» предложено англ. ученым Содди (F. Soddy). Впервые существование И. было открыто в 1906 г. при изучении радиоактивного распада тяжелых естественно-радиоактивных элементов; в 1913 г. они были обнаружены и у нерадиоактивного элемента неона, а затем с помощью масс-спектрометрии был определен изотопный состав всех элементов периодической системы. В 1934 г. И. Жолио-Кюри и Ф. Жолио-Кюри впервые получили искусственно-радиоактивные И. азота, кремния и фосфора, а впоследствии с помощью различных ядерных реакций на нейтронах, заряженных частицах и фотонах высоких энергий были получены радиоактивные И. всех известных элементов и синтезированы радиоактивные И. 13 сверхтяжелых — трансурановых элементов (с Z≥ 93). Известно 280 стабильных, характеризующихся устойчивостью, и более 1500 радиоактивных, т. е. неустойчивых, И., которые с той или иной скоростью претерпевают радиоактивные превращения. Продолжительность существования радиоактивного И. характеризуется периодом полураспада (см.) — промежутком времени T1/2, в течение к-рого количество радиоактивных ядер уменьшается вдвое.
В природной смеси Изотопов химического элемента разные Изотопы содержатся в разных количествах. Процентное содержание И. в данном хим. элементе называется их относительной распространенностью. Так, напр., в природном кислороде содержится три стабильных И.: 16O (99,759%), 17O(0,037%) и 18O (0,204%). Многие хим. элементы имеют только по одному стабильному И. ( 9 Be, 19 F, 23 Na, 31 P, 89 Y, 127 I и др.), а некоторые (Тс, Pm, Lu и все элементы с Z больше 82) не имеют ни одного стабильного И.
Изотопный состав природных элементов на нашей планете (и в пределах Солнечной системы) в основном постоянен, однако наблюдаются небольшие колебания в распространенности атомов легких элементов. Это объясняется тем, что различия в массах их И. относительно велики, и поэтому изотопный состав этих элементов изменяется под воздействием различных природных процессов, в результате изотопных эффектов (т. е. различия свойств хим. веществ, в которых содержатся эти изотопы). Так, изотопный состав ряда биологически важных элементов (Н, С, N, О, S) связан, в частности, с наличием биосферы и жизнедеятельностью растительных и животных организмов.
Различие в составе и структуре атомных ядер И. одного и того же хим. элемента (разное число нейтронов) определяет и различие их ядерно-физ. свойств, в частности то, что одни его И. могут быть стабильными, а другие — радиоактивными.
Радиоактивные превращения. Известны следующие виды радиоактивных превращений.
Альфа-распад — самопроизвольное превращение ядер, сопровождающееся испусканием альфа-частиц, т. е. двух протонов и двух нейтронов, образующих ядро гелия 2 4 He. В результате заряд Z исходного ядра уменьшается на 2, а общее число нуклидов или массовое число — на 4 единицы, напр.:
При этом кинетическая энергия вылетающей альфа-частицы определяется массами исходного и конечного ядер (с учетом массы самой альфа-частицы) и их энергетическим состоянием. Если конечное ядро образуется в возбужденном состоянии, то кинетическая энергия альфа-частицы несколько уменьшается, а если распадается возбужденное ядро, то энергия альфа-частицы соответственно возрастает (при этом образуются так наз. длиннопробежные альфа-частицы). Энергетический спектр альфа-частиц дискретный и лежит в пределах 4—9 МэВ примерно для 200 И. тяжелых элементов и 2—4,5 МэВ для почти 20 альфа-радиоактивных И. редкоземельных элементов.
Захват электрона при этом происходит с одной из электронных оболочек атома, чаще всего с ближайшей к ядру К-оболочки (К-захват).
Бета-минус-распад характерен для нейтроноизбыточных ядер, у которых число нейтронов больше, чем в устойчивых ядрах, а бета-плюс-распад и, соответственно, электронный захват — для нейтронодефицитных ядер, у которых число нейтронов меньше, чем у устойчивых, или так наз. бета-стабильных, ядер. Энергия распада распределяется между бета-частицей и нейтрино, в связи с чем бета-спектр не дискретный, как у альфа-частиц, а сплошной и содержит бета-частицы с энергиями от близких к нулю до нек-рой Еmax, характерной для каждого радиоактивного И. Бета-радиоактивные И. встречаются у всех элементов периодической системы.
Спонтанное деление — самопроизвольный распад тяжелых ядер на два (иногда 3—4) осколка, представляющих собой ядра средних элементов периодической системы (явление открыто в 1940 г. советскими учеными Г. Н. Флеровым и К. А. Петржаком).
Гамма-излучение — фотонное излучение с дискретным энергетическим спектром, возникает при ядерных превращениях, изменении энергетического состояния атомных ядер или при аннигиляции частиц. Испускание гамма-квантов сопровождает радиоактивное превращение в тех случаях, когда новое ядро образуется в возбужденном энергетическом состоянии. Время жизни таких ядер определяется ядерно-физ. свойствами материнского и дочернего ядер, в частности возрастает с уменьшением энергии гамма-переходов и может достигать относительно больших величин для случаев метастабильного возбужденного состояния. Энергия гамма-излучения, испускаемого разными П., лежит в пределах от десятков кэВ до нескольких МэВ.
Устойчивость ядер. При бета-распаде происходят взаимные превращения протонов и нейтронов до достижения наиболее энергетически выгодного соотношения p и n, что соответствует устойчивому состоянию ядра. Все нуклиды разделяются по отношению к бета-распаду на бета-радиоактивные и бета-устойчивые ядра. Под бета-устойчивыми понимаются либо стабильные, либо альфа-радиоактивные нуклиды, для которых бета-распад энергетически невозможен. Все бета-устойчивые И. у хим. элементов с атомными номерами Z до 83 стабильны (за несколькими исключениями), а у тяжелых элементов стабильных И. нет, и все их бета-устойчивые И. альфа-pадиоактивны.
При радиоактивном превращении происходит выделение энергии, соответствующее соотношению масс исходного и конечного ядер, массе и энергии испускаемого излучения. Возможность p-распада, происходящего без изменения массового числа А, зависит от соотношения масс соответствующих изобар. Изобары с большей массой в результате бета-распада превращаются в изобары с меньшей массой; при этом чем масса изобара меньше, тем он ближе к P-устойчивому состоянию. Обратный же процесс в силу закона сохранения энергии идти не может. Так, напр., для упомянутых выше изобар превращения идут в следующих направлениях с образованием стабильного изотопа серы-32:
Ядра нуклидов, устойчивых к бета-распаду, содержат не менее одного нейтрона на каждый протон (исключением являются 1 1 H и 2 3 He), а по мере возрастания атомного номера соотношение N/Z увеличивается и достигает значения 1,6 для урана.
С увеличением числа N ядро данного элемента становится неустойчивым по отношению к электронному бета-минус-распаду (с превращением n->p), поэтому нейтронообогащенные ядра бета-активны. Соответственно нейтронодефицитные ядра неустойчивы к позитронному бета+-распаду или электронному захвату (с превращением p->n), а у тяжелых ядер наблюдается также альфа-распад и спонтанное деление.
Разделение стабильных и получение искусственно-радиоактивных изотопов. Разделение И.— это обогащение природной смеси И. данного хим. элемента отдельными входящими в его состав И. и выделение чистых И. из этой смеси. Все методы разделения основаны на изотопных эффектах, т. е. на различиях физ.-хим. свойств разных И. и содержащих их хим. соединений (прочность хим. связей, плотность, вязкость, теплоемкость, температура плавления, испарения, скорость диффузии и т. д.). Способы разделения и основаны на различиях в поведении И. и содержащих их соединений в физ.-хим. процессах. Практически используются электролиз, центрифугирование, газовая и термодиффузия, диффузия в потоке пара, ректификация, хим. и изотопный обмены, электромагнитное разделение, разделение с помощью лазера и др. Если единичный процесс дает низкий эффект, т. е. малый коэффициент разделения И., его многократно повторяют до получения достаточной степени обогащения. Наиболее эффективно идет разделение И. легких элементов в связи с большими относительными различиями масс их изотопов. Напр., «тяжелую воду», т. е. воду, обогащенную тяжелым И. водорода— дейтерием, масса к-рого вдвое больше, в промышленном масштабе получают на электролизных установках; высокоэффективно также выделение дейтерия низкотемпературной дистилляцией. Разделение И. урана (для получения ядерного топлива — 235 U) проводят на газодиффузионных заводах. Широкий спектр обогащенных стабильных И. получают на электромагнитных разделительных установках. В некоторых случаях применяют разделение и обогащение смеси радиоактивных И., напр. для получения радиоактивного И. железа-55 с высокой удельной активностью и радионуклидной чистотой.
Некоторые радионуклиды либо вообще не могут быть получены в ядер-ном реакторе, либо такое их производство нерационально в медицинских целях. По реакции (n, γ) в большинстве случаев нельзя получить изотопы без носителя; некоторые реакции имеют слишком малую величину сечения a, a облучаемые мишени — малое относительное содержание исходного изотопа в природной смеси, что приводит к низким выходам реакций, недостаточной удельной активности препаратов. Поэтому многие важные радионуклиды, применяемые в клинической радиодиагностике, получают с достаточной удельной активностью, используя изотопно-обогащенные мишени. Напр., для получения кальция-47 облучают мишень, обогащенную по кальцию-46 с 0,003 до 10—20%, для получения железа-59 — мишень с железом-58, обогащенным с 0,31 до 80%, для получения ртути-197 — мишень с ртутью-196, обогащенной с 0,15 до 40%, и т. д.
В реакторе гл. обр. получают радионуклиды с избытком нейтронов, распадающиеся с бета-минус излучением. Нейтронодефицитные радионуклиды, которые образуются в ядерных реакциях на заряженных частицах (p, d, альфа) и фотонах и распадаются с испусканием позитронов или посредством захвата электронов, в большинстве случаев получают на циклотронах, линейных ускорителях протонов и электронов (в последнем случае используется тормозное излучение) при энергиях ускоряемых частиц порядка десятков и сотен МэВ. Так получают для мед. целей радионуклиды по реакциям: 51 V (р, n) 51 Cr, 67 Zn (р, n) 67 Ga, 109 Ag (α, 2n) 111 In, 44 Ca (γ, p) 43 K, 68 Zn (γ, p) 67 Cu и др. Важным преимуществом такого способа получения радионуклидов является то, что они, имея, как правило, иную хим. природу, чем материал облучаемой мишени, могут быть выделены из последней без носителя. Это позволяет получать нужные радиофармацевтические препараты с высокой удельной активностью и радионуклидной чистотой.
Для получения многих короткоживущих радионуклидов непосредственно в клинических учреждениях используют так наз. изотопные генераторы, содержащие долгоживущий материнский радионуклид, при распаде к-рого образуется нужный короткоживущий дочерний радионуклид, напр. 99m Tc, 87m Sr, 113m In, 132 I. Последний может быть многократно выделен из генератора в течение времени жизни материнского нуклида (см. Генераторы радиоактивных изотопов).
Применение изотопов в биологии и медицине. Радиоактивные и стабильные И. широко применяются в научных исследованиях. В качестве метки их используют для приготовления изотопных индикаторов (см. Меченые соединения) — веществ и соединений, имеющих отличный от природного изотопный состав. Методом изотопных индикаторов исследуют распределение, пути и характер перемещения меченых веществ в различных средах и системах, проводят их количественный анализ, изучают строение хим. соединений и биологически активных веществ, механизмы различных динамических процессов, в т. ч. их метаболизм в организме растений, животных и человека (см. Радиоизотопное исследование). С помощью метода изотопных индикаторов проводят исследования в биохимии (изучение обмена веществ, строения и механизма биосинтеза белков, нуклеиновых к-т, жиров и углеводов в живом организме, скорости протекания биохим, реакций и т. д.); в физиологии (миграции ионов и различных веществ, процессов всасывания из жел.-киш. тракта жиров и углеводов, экскреции, кровообращения, поведения и роли микроэлементов и т. д.); в фармакологии и токсикологии (исследование поведения лекарственных препаратов и токсических веществ, их всасывания, путей и скорости накопления, распределения, выведения, механизма действия и т. д.); в микробиологии, иммунологии, вирусологии (изучение биохимии микроорганизмов, механизмов ферментативных и Иммунохимических реакций, взаимодействия вирусов и клетки, механизмов действия антибиотиков и т. д.); в гигиене и экологии (изучение загрязненности вредными веществами и дезактивации производств и окружающей среды, экологической цепочки различных веществ, их миграции и т. д.). И. применяют и в других медико-биол. исследованиях (для изучения патогенеза различных заболеваний, исследования ранних изменений обмена веществ и т. д.).
В медицинской практике радионуклиды применяют для диагностики и лечения различных заболеваний, а также для радиационной стерилизации мед. материалов, изделий и медикаментов. В клиниках используют более 130 радиодиагностических и 20 радиотерапевтических методик с применением открытых радиофарм. препаратов (РФП) и закрытых изотопных источников излучения. В этих целях используют св. 60 радионуклидов, ок. 30 из них — наиболее широко (табл.). Радиодиагностические препараты позволяют получать информацию о функц, и анатомическом состоянии органов и систем организма человека. В основе радиоизотопной диагностики (см.) лежит возможность проследить за биол, поведением меченных радионуклидами хим. веществ и соединений в живом организме без нарушения его целостности и изменения функций. Введение нужного радиоизотопа соответствующего элемента в структуру хим. соединения, практически не изменяя его свойства, позволяет следить за его поведением в живом организме путем наружного детектирования излучения И., в чем и состоит одно из очень важных преимуществ метода радиоизотопной диагностики.
Динамические показатели поведения меченого соединения дают возможность оценить функц, состояние исследуемого органа или системы. Так, по степени разбавления РФП с 24 Na, 42 K, 51 Cr, 52 Fe, 131 I и др. в жидких средах определяют объем циркулирующей крови, эритроцитов, обмен альбумина, железа, водный обмен электролитов и др. По показателям накопления, перемещения и выведения РФП в органах, системах организма или в очаге поражения можно оценить состояние центральной и периферической гемодинамики, определить функцию печени, почек, легких, изучить йодный обмен и т. п. РФП с радиоизотопами йода и технеция позволяют исследовать все функции щитовидной железы. С помощью 99м Tc, 113m In, 123 I, 131 I, 133 Xe можно провести всестороннее исследование легких — изучить распределение кровотока, состояние вентиляции легких и бронхов. РФП с 43 K, 86 Rb, 99м Тс, 67 Ga, 131 I, 113m In, 197 Hg и др. дают возможность определить кровоток и кровоснабжение головного мозга, сердца, печени, почек и других органов. Радиоактивные коллоидные р-ры и некоторые йодорганические препараты позволяют оценить состояние полигональных клеток и гепатоцитов (купферовских клеток) и антитоксической функции печени. С помощью радиоизотопного сканирования проводят анатомо-топографическое изучение и определение наличия, величины, формы и положения объемных поражений печени, почек, костного мозга, щитовидной, паращитовидной и слюнных желез, легких, лимф, узлов; радионуклиды 18 F, 67 Ga, 85 Sr, 87M Sr, 99M Tc позволяют исследовать заболевания скелета и т. д.
В СССР разработаны и введены в действие нормы радиационной безопасности для пациентов при использовании радиоактивных веществ с диагностической целью, которые строго регламентируют эти процедуры с точки зрения допустимых уровней облучения. Благодаря этому, а также рациональному выбору методов и аппаратуры для разных видов обследований и применению в РФП по возможности короткоживущих радионуклидов, обладающих благоприятными характеристиками излучения в отношении эффективности их регистрации при минимальном лучевом воздействии, лучевые нагрузки на организм пациента при радиоизотопных диагностических процедур ах гораздо ниже доз, получаемых при рентгенол, обследованиях, и в большинстве случаев не превышают сотых и десятых долей рада.
В 70-х гг. 20 в. радиоизотопные препараты стали шире применяться для исследований in vitro, в основном — для иммунохим. анализа. Радиоиммунохим. методы основаны на высокоспецифичной иммунохим. реакции антиген — антитело, в результате к-рой образуется устойчивый комплекс из антитела и антигена. После отделения образующегося комплекса от непрореагировавших антител или антигенов проводят количественное определение путем измерения их радиоактивности. Использование антигенов или антител, меченных радиоизотопами, напр. 125 I, повышает чувствительность иммунохимических тестов в десятки и сотни раз. С помощью этих тестов можно определить содержание в организме гормонов, антител, антигенов, энзимов, ферментов, витаминов и других биологически активных веществ в концентрациях до 0,1 мг/мл. Таким образом удается определять не только различные патол, состояния, но и весьма малые изменения, отражающие начальные стадии заболевания. Напр., эти методики успешно применяют для ранней диагностики in vitro сахарного диабета, инфекционного гепатита, нарушений углеводного обмена, некоторых аллергических и ряда других заболеваний. Такие радиоизотопные тесты не только чувствительнее, проще, но и позволяют проводить массовые исследования и совершенно безопасны для пациентов (см. Радиоизотопная диагностика).
С леч. целью РФП и радионуклидные источники излучения применяются гл. обр. в онкологии, а также при лечении воспалительных заболеваний, экзем и др. (см. Лучевая терапия). Для этих целей используются как открытые РФП, вводимые внутрь организма, в ткани, серозные полости, полости суставов, внутривенно, внутриартериально и в лимф, систему, так и закрытые источники излучения для наружной, внутриполостной и внутритканевой терапии. С помощью соответствующих РФП, гл. обр. коллоидов и суспензий, содержащих 32 P, 90 Y, 131 I, 198 Au и другие радионуклиды, лечат заболевания кроветворной системы и различные опухоли, воздействуя локально на патол, очаг. При контактном облучении (дерматол, и офтальмол. бета-аппликаторы) применяют 32 P, 90 Sr, 90 Y, 147 Pm, 204 Tl, в дистанционных гамма-терапевтических аппаратах — источники 60 Co или 137 Cs высокой активности (сотни и тысячи кюри). Для внутритканевого и внутриполостного облучения используют иглы, гранулы, проволоку и другие специальные типы закрытых источников с 60 Co, 137 Cs, 182 Ta, 192 Ir, 198 Au (см. Радиоактивные препараты).
Токсикология радиоактивных изотопов — раздел токсикологии, изучающий влияние инкорпорированных радиоактивных веществ на живые организмы. Основными задачами ее являются: установление допустимых уровней содержания и поступления радионуклидов в организм человека с воздухом, водой и продуктами питания, а также степени безвредности РВ, вводимых в организм при клин, радиодиагностических исследованиях; выяснение специфики поражения радионуклидами в зависимости от характера их распределения, энергии и вида излучения, периода полураспада, дозы, путей и ритма поступления и изыскание эффективных средств для профилактики поражения.
Наиболее глубоко исследуется влияние на организм человека радионуклидов, широко используемых в промышленности, научных и мед. исследованиях, а также образующихся в результате расщепления ядерного горючего.
Токсикология радиоактивных изотопов органически связана с радиобиологией (см.), радиационной гигиеной (см.) и медицинской радиологией (см.).
Радиоактивные вещества могут проникать в организм человека через дыхательные пути, жел.-киш. тракт, кожу, раневые поверхности, а при инъекциях — через кровеносные сосуды, мышечную ткань, суставные поверхности. Характер распределения радионуклидов в организме зависит от основных хим. свойств элемента, формы вводимого соединения, пути поступления и физиол, состояния организма.
Обнаружены довольно существенные различия в распределении и путях выведения отдельных радионуклидов. Растворимые соединения Ca, Sr, Ba, Ra, Y, Zr избирательно накапливаются в костной ткани; La, Ce, Pr, Pu, Am, Cm, Cf, Np — в печени и костной ткани; K, Cs, Rb — в мышечной ткани; Nb, Ru, Te, Po распределяются сравнительно равномерно, хотя и имеют тенденцию к накоплению в ретикулоэндотелиальной ткани селезенки, костного мозга, надпочечниках и лимф, узлах; I и At — в щитовидной железе.
Распределение в организме элементов, относящихся к определенной группе периодической системы Менделеева, имеет много общего. Элементы первой основной группы (Li, Na, К, Rb, Cs) полностью всасываются из кишечника, сравнительно равномерно распределяются по органам и выделяются преимущественно с мочой. Элементы второй основной группы (Ca, Sr, Ba, Rа) хорошо всасываются из кишечника, избирательно откладываются в скелете, выделяются в несколько больших количествах с калом. Элементы третьей основной и четвертой побочной групп, в т. ч. легкие лантаниды, актиниды и трансурановые элементы, практически не всасываются из кишечника, как правило, избирательно откладываются в печени и в меньшей мере в скелете, выделяются преимущественно с калом. Элементы пятой и шестой основной групп периодической системы, за исключением Ро, сравнительно хорошо всасываются из кишечника и выводятся почти исключительно с мочой в течение первых суток, благодаря чему в органах обнаруживаются в сравнительно небольших количествах.
Отложение радионуклидов в легочной ткани при ингаляции зависит от размера вдыхаемых частиц и их растворимости. Чем крупнее аэрозоли, тем большая доля их задерживается в носоглотке и меньшая проникает в легкие. Медленно покидают легкие плохо растворимые соединения. Высокая концентрация таких радионуклидов часто обнаруживается в лимф, узлах корней легких. Очень быстро всасываются в легких окись трития, растворимые соединения щелочных и щелочноземельных элементов. Медленно всасываются в легких Pu, Am, Се, Cm и другие тяжелые металлы.
Нормы радиационной безопасности (НРБ) регламентируют поступление и содержание радионуклидов в организме лиц, работа которых связана с профвредностями, и отдельных лиц из населения, а также населения в целом, допустимые концентрации радионуклидов в атмосферном воздухе и воде, продуктах питания. Эти нормы основаны на величинах предельно допустимых доз (ПДД) облучения, установленных для четырех групп критических органов и тканей (см. Критический орган, Предельно допустимые дозы).
Для лиц, работающих в условиях профвредностей, принятая величина ПДД облучения всего тела, гонад и красного костного мозга равна 5 бэр/год, мышечной и жировой тканей, печени, почек, селезенки, жел.-киш. тракта, легких, хрусталика глаз — 15 бэр/год, костной ткани, щитовидной железы и кожи —30 бэр/год, кистей рук, предплечий, лодыжек и стоп —75 бэр/год.
Нормы для отдельных лиц из населения рекомендованы в 10 раз ниже, чем для лиц, работающих в условиях профвредностей. Облучение всего населения регламентируется генетически значимой дозой, к-рая не должна превышать 5 бэр за 30 лет. В эту дозу не входят возможные дозы облучения, обусловленные мед. процедурами и естественным радиационным фоном.
Величина годового предельно допустимого поступления растворимых и нерастворимых соединений (мкКи/год) через органы дыхания для персонала, предел годового поступления радионуклидов через органы дыхания и пищеварения для отдельных лиц из населения, среднегодовые допустимые концентрации (СДК) радионуклидов в атмосферном воздухе и воде (кюри/л) для отдельных лиц из населения, а также содержание радионуклидов в критическом органе, соответствующее предельно допустимому уровню поступления (мкКи) для персонала, приведены в нормативах.
При расчете допустимых уровней поступления радионуклидов в организм учитывается также нередко встречающийся неравномерный характер распределения радионуклидов в отдельных органах и тканях. Неравномерное распределение радионуклидов, приводящее к созданию высоких локальных доз, лежит в основе высокой токсичности альфа-излучателей, чему в немалой степени способствуют отсутствие восстановительных процессов и практически полная суммация повреждений, вызываемых этим видом излучения.
Таблица. Радиоактивные изотопы, наиболее широко применяемые в клинической практике, основные реакции их получения и некоторые физические характеристики
Обозначения: β- — бета-излучение; β+ — позитронное излучение; n — нейтрон; p — протон; d — дейтрон; t — тритон; α — альфа-частица; Э.З. — распад путем захвата электрона; γ — гамма-излучение (как правило, приведены лишь основные линии γ-спектра); И. П. — изомерный переход; U (n, f) — реакция деления урана. Указанный изотоп выделяют из смеси продуктов деления; 90 Sr-> 90 Y — получение дочернего изотопа ( 90 Y) в результате распада материнского ( 90 Sr), в т. ч. с помощью изотопного генератора.
Библиография: Иванов И. И. и др. Радиоактивные изотопы в медицине и биологии, М., 1955; Камен М. Радиоактивные индикаторы в биологии, пер. с англ., М., 1948, библиогр.; Левин В. И. Получение радиоактивных изотопов, М., 1972; Нормы радиационной безопасности (НРБ-69), М., 1972; Получение в реакторе и применение короткоживущих изотопов, пер. с ин., под ред. В. В. Бочкарева и Б. В. Курчатова, М., 1965; Производство изотопов, под ред. В. В. Бочкарева, М., 1973; Селинов И. П. Атомные ядра и ядерные превращения, т. 1, М.—Л., 1951, библиогр.; Туманян М. А. и Каушанский Д. А. Радиационная стерилизация, М., 1974, библиогр.; Фатеева М. Н. Очерки радиоизотопной диагностики, М., 1960, библиогр.; Хевеши Г. Радиоактивные индикаторы, пер. с англ., М., 1950, библиогр.; Dynamic studies with radioisotopes in medicine 1974, Proc, symp., v. 1—2, Vienna, IAEA, 1975; Lederer Ch. М., Hollander J. M. a. Perlmаn I. Tables of isotopes, N. Y., 1967; Silver S. Radioactive isotopes in clinical medicine, New Engl. J. Med., v. 272, p. 569, 1965, bibliogr.
В. В. Бочкарев; Ю. И. Москалев (токс.), составитель табл. В. В. Бочкарев.
ИЗОТОП
Смотреть что такое «ИЗОТОП» в других словарях:
ИЗОТОП — ИЗОТОП, а, муж. Атом химического элемента, отличающийся от другого атома того же элемента своей массой. Изотопы урана. | прил. изотопный, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
изотоп — сущ., кол во синонимов: 7 • актинон (1) • дейтерий (2) • ионий (2) • … Словарь синонимов
изотоп — Любой из двух или больше атомов элемента, имеющих в ядре одинаковое число протонов, но отличающихся числом нейтронов; см. carbon 14. [http://www.oceanographers.ru/index.php?option=com glossary&Itemid=238] Тематики океанология EN isotope … Справочник технического переводчика
изотоп — Разные формы химического элемента, имеющие общие химические свойства, тот же атомный номер, но неодинаковый атомный вес, некоторые изотопы используются для датирования органического материала (14С) или для определения палеотемператур в кернах… … Словарь по географии
изотоп — isotope изотоп. Oдна из форм химического элемента, отличающаяся числом входящих в ядро нейтронов, число протонов и электронов у И. одинаковы. (Источник: «Англо русский толковый словарь генетических терминов». Арефьев В.А., Лисовенко Л.А., Москва … Молекулярная биология и генетика. Толковый словарь.
изотоп — izotopas statusas T sritis fizika atitikmenys: angl. isotope vok. Isotop, n rus. изотоп, m pranc. isotope, m … Fizikos terminų žodynas
изотоп — izotopas statusas T sritis apsauga nuo naikinimo priemonių apibrėžtis To paties cheminio elemento atomas, turintis vienodą protonų, bet skirtingą neutronų skaičių. Tas pats cheminis elementas gali turėti keletą izotopų, pvz., uranas turi 12… … Apsaugos nuo naikinimo priemonių enciklopedinis žodynas
Изотоп — 10 Изотоп Нуклид с числом протонов в ядре, свой Источник: ГОСТ 15484 81: Излучения ионизирующие и их измерения. Термины и определения оригинал документа … Словарь-справочник терминов нормативно-технической документации
изотоп с избытком нейтронов — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN neutron rich isotope … Справочник технического переводчика
Изотопы
Смотреть что такое «Изотопы» в других словарях:
ИЗОТОПЫ — (от изо. и греческого topos место), разновидности химических элементов, у которых ядра атомов (нуклидов) отличаются числом нейтронов, но содержат одинаковое число протонов и поэтому занимают одно и то же место в периодической системе химических … Современная энциклопедия
Изотопы — (от изо. и греческого topos место), разновидности химических элементов, у которых ядра атомов (нуклидов) отличаются числом нейтронов, но содержат одинаковое число протонов и поэтому занимают одно и то же место в периодической системе химических … Иллюстрированный энциклопедический словарь
ИЗОТОПЫ — (от изо. и греч. topos место) разновидности химических элементов, у которых ядра атомов отличаются числом нейтронов, но содержат одинаковое число протонов и поэтому занимают одно и то же место в периодической системе элементов. Различают… … Большой Энциклопедический словарь
ИЗОТОПЫ — ИЗОТОПЫ, хим. элементы, расположенные в одной и той же клетке периодической системы и следовательно обладающие одинаковым атомным номером или порядко вым числом. При этом И. не должны, вообще говоря, обладать одинаковым атомным весом. Различные… … Большая медицинская энциклопедия
ИЗОТОПЫ — разновидности данного хим. элемента, различающиеся по массе ядер. Обладая одинаковыми зарядами ядер Z, но различаясь числом нейтронов, И. имеют одинаковое строение электронных оболочек, т. е. очень близкие хим. св ва, и занимают одно и то же… … Физическая энциклопедия
изотопы — атомы одного и того же хим. элемента, ядра которых содержат одинаковое число протонов, но различное число нейтронов; имеют разные атомные массы, обладают одними и теми же хим. свойствами, но различаются по своим физ. свойствам, в частности… … Словарь микробиологии
ИЗОТОПЫ — атомы хим. элемента, обладающие разными массовыми числами, но имеющие одинаковый заряд атомных ядер и поэтому занимающие одно место в периодической системе Менделеева. Атомы разных изотопов одного и того же хим. элемента отличаются по числу… … Геологическая энциклопедия
ИЗОТОПЫ — (от изо. и греч. topos место), элементы с одинаковым порядковым номером, но с разной атомной массой. Большинство радиоактивных изотопов, важных для экологии, обладают энергией от 0,1 до 5 Мэв (чем выше энергия радиоактивных изотопов, тем больше … Экологический словарь
изотопы — Нуклиды, имеющие одинаковый атомный номер, но различные атомные массы (например, уран 235 и уран 238). [http://pripyat.forumbb.ru/viewtopic.php?id=25] Тематики атомная энергетика в целом EN isotopes … Справочник технического переводчика
ИЗОТОПЫ — разновидности атомов данного хим. элемента, ядра которых содержат одинаковое число протонов, но различное число нейтронов. И. имеют разные атомные (см.) и одинаковое число электронов в атомной оболочке, что определяет их очень близкие физ. хим.… … Большая политехническая энциклопедия