Что такое разрыв сердца
Что такое разрыв сердца
Аневризма сердца
Аневризма сердца – истончение и выбухание участка миокарда сердечной камеры. Аневризма сердца может проявляться одышкой, сердцебиением, ортопноэ, приступами сердечной астмы, тяжелыми нарушениями сердечного ритма, тромбоэмболическими осложнениями. Основными методами диагностики аневризмы сердца служат ЭКГ, ЭхоКГ, рентген грудной клетки, вентрикулография, КТ, МРТ. Лечение аневризмы сердца предусматривает иссечение аневризматического мешка с ушиванием дефекта сердечной мышцы.
МКБ-10
Общие сведения
Аневризма сердца – ограниченное выпячивание истонченной стенки миокарда, сопровождающееся резким снижением или полным исчезновением сократительной способности патологически измененного участка миокарда. В кардиологии аневризма сердца выявляется у 10-35% пациентов, перенесших инфаркт миокарда; 68% острых или хронических аневризм сердца диагностируется у мужчин в возрасте от 40 до 70 лет. Чаще всего аневризма сердца формируется в стенке левого желудочка, реже – в области межжелудочковой перегородки или правого желудочка. Величина аневризмы сердца колеблется от 1 до 18-20 см в диаметре. Нарушение сократительной способности миокарда в области аневризмы сердца включает акинезиею (отсутствие сократительной активности) и дискинезию (выбухание стенки аневризмы в систолу и ее западение — в диастолу).
Причины аневризмы сердца
Массивный инфаркт миокарда вызывает разрушение структур мышечной стенки сердца. Под действием силы внутрисердечного давления некротизированная стенка сердца растягивается и истончается. Существенная роль в формировании аневризмы принадлежит факторам, способствующим увеличению нагрузки на сердце и внутрижелудочкового давления – раннему вставанию, артериальной гипертензии, тахикардии, повторным инфарктам, прогрессирующей сердечной недостаточности. Развитие хронической аневризмы сердца этиологически и патогенетически связано с постинфарктым кардиосклерозом. В этом случае под действием давления крови происходит выпячивание стенки сердца в области соединительнотканного рубца.
Гораздо реже, чем постинфарктные аневризмы сердца, встречаются врожденные, травматические и инфекционные аневризмы. Травматические аневризмы возникают вследствие закрытых или открытых травм сердца. К этой же группе можно отнести послеоперационные аневризмы, часто возникающие после операций по коррекции врожденных пороков сердца (тетрады Фалло, стеноза легочного ствола и др.).
Аневризмы сердца, обусловленные инфекционными процессами (сифилисом, бактериальным эндокардитом, туберкулезом, ревматизмом), весьма редки.
Классификация аневризм сердца
По времени возникновения различают острую, подострую и хроническую аневризму сердца. Острая аневризма сердца формируется в период от 1 до 2-х недель от инфаркта миокарда, подострая – в течение 3-8 недель, хроническая – свыше 8 недель.
Острая аневризма
В остром периоде стенка аневризмы представлена некротизированным участком миокарда, который под действием внутрижелудочкового давления выбухает кнаружи или в полость желудочка (при локализации аневризмы в области межжелудочковой перегородки).
Подострая аневризма
Стенка подострой аневризмы сердца образована утолщенным эндокардом со скоплением фибробластов и гистиоцитов, вновь образованных ретикулярных, коллагеновых и эластических волокон; на месте разрушенных миокардиальных волокон обнаруживаются соединительные элементы различной степени зрелости.
Хроническая аневризма
Хроническая аневризма сердца представляет собой фиброзный мешок, микроскопически состоящий из трех слоев: эндокардиального, интрамурального и эпикардиального. В эндокарде стенки хронической аневризмы сердца имеются разрастания фиброзной и гиалинизированной ткани. Стенка хронической аневризмы сердца истончена, иногда ее толщина не превышает 2 мм. В полости хронической аневризмы сердца часто обнаруживается пристеночный тромб различного размера, который может выстилать только внутреннюю поверхность аневризматического мешка или занимать почти весь его объем. Рыхлые пристеночные тромбы легко подвергаются фрагментации и являются потенциальным источником риска тромбоэмболических осложнений.
Встречаются аневризмы сердца трех видов: мышечные, фиброзные и фиброзно-мышечные. Обычно аневризма сердца является одиночной, хотя может обнаруживаться 2-3 аневризмы одновременно. Аневризмы сердца могут быть истинными (представлены тремя слоями), ложными (формируются в результате разрыва стенки миокарда и ограничены перикардиальными сращениями) и функциональными (образованы участком жизнеспособного миокарда с низкой сократимостью, выбухающего в систолу желудочков).
Симптомы аневризмы сердца
Клинические проявления острой аневризмы сердца характеризуются слабостью, одышкой с эпизодами сердечной астмы и отека легких, длительной лихорадкой, повышенной потливостью, тахикардией, нарушениями сердечного ритма (брадикардией и тахикардией, экстрасистолией, фибрилляцией предсердий и желудочков, блокадами). При подострой аневризме сердца быстро прогрессируют симптомы недостаточности кровообращения.
Клинике хронической аневризмы сердца соответствуют ярко выраженные признаки сердечной недостаточности: одышка, синкопальные состояния, стенокардия покоя и напряжения, ощущение перебоев в работе сердца; в поздней стадии – набухание вен шеи, отеки, гидроторакс, гепатомегалия, асцит. При хронической аневризме сердца может развиваться фиброзный перикардит, обусловливающий развитие спаечного процесса в грудной полости.
Тромбоэмболический синдром при хронической аневризме сердца представлен острой окклюзией сосудов конечностей (чаще подвздошного и бедренно-подколенного сегментов), плечеголовного ствола, артерий мозга, почек, легких, кишечника. Потенциально опасными осложнениями хронической аневризмы сердца могут стать гангрена конечности, инсульт, инфаркт почки, ТЭЛА, окклюзия мезентериальных сосудов, повторный инфаркт миокарда.
Диагностика
Патогномоничным признаком аневризмы сердца является патологическая прекордиальная пульсация, обнаруживаемая на передней стенки грудной клетки и усиливающаяся при каждом сердечном сокращении.
На ЭКГ при аневризме сердца регистрируются признаки трансмурального инфаркта миокарда, которые, однако, не изменяются стадийно, а сохраняют «застывший» характер на протяжении длительного времени. ЭхоКГ позволяет визуализировать полость аневризмы, измерить ее размеры, оценить конфигурацию и диагностировать тромбоз полости желудочка. С помощью стресс-ЭхоКГ и ПЭТ сердца выявляется жизнеспособность миокарда в зоне хронической аневризмы сердца.
Рентгенография органов грудной клетки обнаруживает кардиомегалию, явления застоя в малом круге кровообращения. Рентгеноконтрастная вентрикулография, МРТ и МСКТ сердца являются высокоспецифичными методами топической диагностики аневризмы, определения ее размеров, выявления тромбоза ее полости.
По показаниям больным с аневризмой сердца выполняется зондирование полостей сердца, коронарография, ЭФИ. Аневризму сердца необходимо дифференцировать от целомической кисты перикарда, митрального порока сердца, опухолей средостения.
Лечение аневризмы сердца
В предоперационном периоде больным с аневризмой сердца назначаются сердечные гликозиды, антикоагулянты (гепарин подкожно), гипотензивные средства, кислородотерапия, оксигенобаротерапия. Хирургическое лечение острой и подострой аневризмы сердца показано в связи с быстрым прогрессированием сердечной недостаточности и угрозой разрыва аневризматического мешка. При хронической аневризме сердца операция производится для предотвращения риска тромбоэмболических осложнений и с целью реваскуляризации миокарда.
В качестве паллиативного вмешательства прибегают к укреплению стенки аневризмы с помощью полимерных материалов. К радикальным операциям относятся резекция аневризмы желудочка или предсердия (при необходимости – с последующей реконструкцией стенки миокарда заплатой), септопластика по Кули (при аневризме межжелудочковой перегородки).
При ложной или посттравматической аневризме сердца производится ушивание сердечной стенки. При необходимости дополнительного реваскуляризирующего вмешательства одномоментно выполняют резекцию аневризмы в сочетании с АКШ. После резекции и пластики аневризмы сердца возможно развитие синдрома малого выброса, повторного инфаркта миокарда, аритмий (пароксизмальной тахикардии, мерцательной аритмии), несостоятельности швов и кровотечения, дыхательной недостаточности, почечной недостаточности, тромбоэмболии сосудов головного мозга.
Прогноз и профилактика
Без хирургического лечения течение аневризмы сердца неблагоприятное: большинство пациентов с постинфарктными аневризмами погибают в течение 2-3 лет после развития заболевания. Относительно доброкачественно протекают неосложненные плоские хронические аневризмы сердца; худший прогноз имеют мешковидные и грибовидные аневризмы, часто осложняющиеся внутрисердечным тромбозом. Присоединение сердечной недостаточности является неблагоприятным прогностическим признаком.
Профилактика аневризмы сердца и ее осложнений заключается в своевременной диагностике инфаркта миокарда, адекватном лечении и реабилитации больных, постепенном расширении двигательного режима, контроле за нарушением ритма и тромбообразованием.
Аневризма левого желудочка сердца
Тел.: 8-800-25-03-03-2
(бесплатно для звонков из регионов России)
Санкт-Петербург, наб. реки Фонтанки, д. 154
Тел.: +7 (812) 676-25-25
Санкт-Петербург, В.О., Кадетская линия, д. 13-15
Тел.: +7 (812) 676-25-25
Санкт-Петербург, ул. Циолковского, д.3
Тел.: +7 (812) 676-25-10
В результате ткань истончается и растягивается, образуя выпячивание- аневризму. Чаще всего поражается левый желудочек в передней верхней части.
Аневризма левого желудочка сердца классифицируется по нескольким признакам:
1. По времени появления:
2. По форме проявления:
В практике более часто встречаются диффузные формы, реже диагностируют расслаивающуюся и грибовидную аневризмы.
Симптомы и причины появления
Основная причина появления аневризма — инфаркт миокарда. Так же появление истонченных, выпирающих участков ткани на сердце может быть спровоцировано такими причинами, как:
Симптоматически наличие аневризмы левого желудочка сердца определить невозможно, но поскольку она вызывает нарушения работы сердца то и, соответственно, вызывает общие признаки расстройства сердечной деятельности. Среди них:
Диагностировать аневризму желудочка сердца может врач-кардиолог. После осмотра пациента и получения результатов всех необходимых исследований, в том числе ЭКГ, УЗИ и МРТ. Своевременная диагностика поможет избежать тяжелейших осложнений, часто смертельных. Для определения плана лечения необходимо точно знать локализацию, структуру и размеры аневризмы.
Методы диагностики
Главные способы диагностирования аневризмы основаны на последовательном выявлении клинических и инструментальных признаков. Начинается обследование с опроса больного, сбора анамнеза, некоторых лабораторных исследований крови и мочи — эти данные позволяют обнаружить сопутствующие заболевания, наличие которые может повлиять на развитие аневризмы. Пациент также получает направление на ЭКГ, МРТ или УЗИ и другие исследования.
Традиционные методы диагностики и информация, которую они предоставляют:
Комплексное всестороннее обследование пациента позволяет получить полную картину деформации тканей желудочка, а значит, назначить точное и наиболее эффективное лечение. Помимо медикаментозной терапии, больным с выявленной аневризмой левого желудочка сердца может быть назначено хирургическое вмешательство. Обычно такое решение принимается лечащим врачом в случае, если размеры поврежденной ткани превышают 20% площади стенки.
Методы лечения
В связи с относительно благоприятным прогнозом при бессимптомных аневризмах левого желудочка (ЛЖ), показания к хирургическому лечению у таких пациентов относительны. Тем не менее, у пациентов, которым показана хирургическая реваскуляризация миокарда (АКШ), в некоторых случаях необходимо выполнять хирургическое восстановление правильной формы левого желудочка.
Хирургическое лечение абсолютно показано пациентам, у которых в результате инфаркта миокарда появилась дисфункция ЛЖ с участками акинезии и дискинезии его стенок и закономерным увеличением объема ЛЖ: > 80 мл / м 2 при сокращении и > 120 мл / м 2 в момент расслабления, а также при угрозе разрыва аневризмы и в случае тромбоэмболического синдрома при тромбированных аневризмах.
При правильном профессиональном подходе, внимательном изучении функции ЛЖ по данным ЭхоКГ, оценке формы и локализации аневризмы, фракции выброса сокращающейся (уцелевшей) части ЛЖ – операция по устранению левожелудочковой аневризмы является вполне оправданной, так как впоследствии снижается напряжение в стенке ЛЖ, мышечные волокна вновь направляются в правильную сторону, возрастает систолическая и улучшается диастолическая функция ЛЖ.
Относительные противопоказания: крайне высокий риск анестезии, отсутствие «живого» миокарда за пределами аневризмы, низкий сердечный индекс.
При хирургическом лечении аневризмы ЛЖ выполняется стандартный доступ путем срединной стернотомии. Аппарат искусственного кровообращения подключается как для АКШ, для удобства устанавливается дренаж ЛЖ через правые легочные вены. После кардиоплегии участок аневризмы выглядит как белесая, фиброзная площадка, впалая в полость левого желудочка. Выполняется разрез аневризмы вдоль передней нисходящей артерии, отступая от нее не менее 1,5 см. Имеющийся в полости тромб удаляется, исключая оставление даже очень мелких фрагментов. Часто такие операции сопровождаются вмешательством на митральном клапане, а также шунтированием передней нисходящей артерии и других артерий при наличии показаний. Оценив объем резецированного участка приступают к ремоделированию и восстановлению геометрии ЛЖ. Методик для этого предложено много, ниже мы приведем основные из них. После завершения хирургических манипуляций на сердце, выполняется важный процесс изгнания воздуха из полостей сердца, следом к сердцу пускают кровоток, снимая зажим с аорты, и через пару минут происходит восстановление сердечной деятельности. Окончание сеанса искусственного кровообращения для оперированного ЛЖ может стать настоящим испытанием и потребовать применение до трех инотропных и вазопрессорных препаратов, а также внутриаортальной баллонной контрапульсации.
Техники ремоделирования ЛЖ
Прогресс не стоит на месте, и методики постоянно совершенствуются, но основные хирургические принципы для лечения данной патологии представлены вашему вниманию и заключаются в стремлении к уменьшению полости ЛЖ за счет резекции нефункционального аневризматического мешка и восстановлению близкой к нормальной геометрической формы ЛЖ применяя разной формы заплаты и кисетные пластики.
Результаты хирургического лечения аневризмы левого желудочка сердца
Частым осложнением после операции по поводу аневризмы ЛЖ является синдром малого выброса, который развивается вследствие чрезмерного уменьшения размеров полости ЛЖ, а так же желудочковые нарушения ритма и легочная недостаточность.
30-ти дневная летальность в последние годы снизилась и составляет 3-7%. Факторы повышенного риска операции это: пожилой возраст, женский пол, операция в экстренном порядке, а так же операция дополненная протезированием митрального клапана, исходно низкая сократительная способность миокарда (ФВ менее 30%), умеренная и высокая легочная гипертензия, почечная недостаточность.
В нашей клинике успешно выполняются все виды операций на сердце включая хирургическое ремоделирование и пластику при аневризмах ЛЖ.
Синдром «разбитого сердца» (синдром такоцубо)
Отделения
Впервые этот синдром стал широко известен в 2006 году после обсуждения этой темы на Европейском конгрессе кардиологов в Барселоне. Однако до сих пор многие практические врачи и пациенты остаются плохо осведомленными о его существовании. В последние годы современная медицина все больше внимания уделяет изучению его причин, которые до сих пор неясны.
Как правило, типичные симптомы синдрома разбитого сердца – это боль в сердце и затрудненное дыхание, что совершенно идентично симптомам острого инфаркта миокарда и определяет драматизм ситуации и его актуальность.
В настоящее время считается, что синдром разбитого сердца, или стресс-индуцированная кардиомиопатия (она же — обратимая апикальная дискинезия) вызван сильными эмоциями и характеризуется преходящим нарушением работы левого желудочка сердца, что проявляет себя изменениями на электрокардиограмме и в крови, свойственными инфаркту миокарда.
Стресс-индуцированная кардиомиопатия впервые была описана в 1991 году в Японии и даже получила название такоцубо по названию ловушки для ловли осьминогов, которую используют японские рыбаки, так как при этом синдроме форма левого желудочка становится похожей на нее. При этом расстройстве, сердце больных, вернее его левый желудочек, принимает необычную –шарообразную форму. Оно как будто бы сдавлено невидимым обручем. Этот симптом помогает отличить это расстройство от инфаркта и правильно поставить диагноз.
Провоцирующим это заболевание фактором является сильный стресс и интенсивные эмоциональные переживания. Почти сразу же после этого у больных возникает сильная боль в сердце и серьезные проблемы с дыханием, что обычно диагностируется, как инфаркт миокарда, так как симптомы и данные электрокардиограммы не вызывают никаких сомнений. Загрудинные боли при этом синдроме более длительные, чем при инфаркте миокарда.
Механизмы возникновения этого заболевания до конца неясны. Явная связь его со стрессом и тяжелыми эмоциями заставляет медиков думать, что причина его кроется в эффекте катехоламинов – гормонов стресса. Исследовались и другие механизмы – спазм коронарных артерий, нарушение микроциркуляции крови в сердце и неврологические причины, но ни одна из них до сих пор не подтвердилась.
Проблема в диагностике этого расстройства в том, что как анализы крови, так и электрокардиограмма при синдроме разбитого сердца практически идентичны результатам диагностических проб при инфаркте миокарда. Отличить его возможно только посредством коронарографии, которая демонстрирует в этом случае совершенно здоровые артерии сердца.
Есть сообщения, что патоморфологические изменения при этом виде кардиомиопатии представлены фокальным миоцитолизом; ассоциированных микробиологических агентов не выявляется. В некоторых случаях обнаруживалась инфильтрация малыми мононуклеарами; эти патологические находки позволяют предположить, что стрессовая кардиомиопатия является вариантом воспалительного заболевания сердца, а не коронарной патологией. Также имеются сообщения о гистологическом повреждении миокарда без ишемической болезни сердца.
Более 90% случаев этого заболевания возникает у женщин в климактерическом периоде. Причина этого неясна, но существует несколько гипотез: большая чувствительность женщин к действию гормонов стресса и проблемы в сосудах и мышце сердца, спровоцированные низким уровнем женских половых гормонов.
При стресс-индуцированной кардиомиопатии необходима неотложная госпитализация больного в стационар. При этом синдроме часто возникает сердечная недостаточность, которая бесследно исчезает через нескольких дней.
Прогноз заболевания, обычно, очень хороший. Несмотря на изначально тяжелое состояние пациентов, почти все они полностью выздоравливают в течение нескольких дней или недель без всяких осложнений. Смертность составляет лишь 1, 1%. В очень редких случаях могут быть тяжелые осложнения: мерцательная аритмия в 4, 2% и кардиогенный шок в 1, 5% случаев.
Аневризма сердца
Скидки для друзей из социальных сетей!
Для жителей районов Савеловский, Беговой, Аэропорт, Хорошевский
В этом месяце жителям районов Савеловский, Беговой, Аэропорт, Хорошевский» предоставляется скидка 5% на ВСЕ мед.
Захаров Станислав Юрьевич
Врач-кардиолог, врач функциональной диагностики
Высшая квалификационная категория, доктор медицины, Член Европейского общества кардиологов и Российского кардиологического общества
Рудько Гали Николаевна
Врач-кардиолог, врач функциональной диагностики
Высшая квалификационная категория, Член Российского кардиологического общества
Мы в Telegram и «Одноклассниках»
«Passion.ru», интернет-портал (март 2021г.)
«MediaMetrics», радиостанция, программа «ЛОР-заболевания с доктором Рамазановой». (октябрь 2020г.)
В подавляющем числе случаев аневризма сердца является осложнением после перенесенного инфаркта миокарда (чаще трансмурального). До 25% пациентов с инфарктом могут быть подвержены этому заболеванию.
По времени возникновения аневризмы делят на острые (1-2 неделя от начала развития инфаркта миокарда), подострые (3-6 недель) и хронические. Чаще всего постинфарктные аневризмы локализуются на переднебоковой стенке и на верхушке левого желудочка, в 50-65% случаев распространяются на передне-перегородочную область.
Аневризма левого желудочка диагностируется столь часто по причине максимального давления крови именно в этом желудочке. До 50% поверхности левого желудочка может пострадать в результате патологического процесса.
Аневризма левого желудочка
Аневризма задней стенки левого желудочка наблюдается у 2-8% больных. Нередко в полости аневризмы обнаруживаются тромбы, однако частота тромбоэмболических осложнений не более 13%.
Симптомы аневризмы сердца
Клинические проявления зависят от размеров и локализации аневризмы.
Острой аневризме сердца соответствуют следующие симптомы:
Подострая аневризма сердца проявляется быстро прогрессирующими симптомами недостаточности кровообращения.
Хроническую аневризму сердца характеризуют:
Среди опасных осложнений хронической аневризмы сердца можно назвать гангрену конечности, инсульт, инфаркт почки, ТЭЛА, повторный инфаркт миокарда.
В ряде случаев возможен разрыв хронической аневризмы сердца. Он происходит на 2-9 день после инфаркта миокарда и приводит к мгновенному летальному исходу. Клинические проявления разрыва аневризмы сердца: внезапная резкая бледность (которая быстро сменяется цианотичностью кожных покровов), холодный пот, переполнение вен шеи кровью, потеря сознания, похолодание конечностей, шумное, хриплое, поверхностное дыхание.
Диагностика аневризмы сердца
У 50% больных выявляется патологическая прекордиальная пульсация.
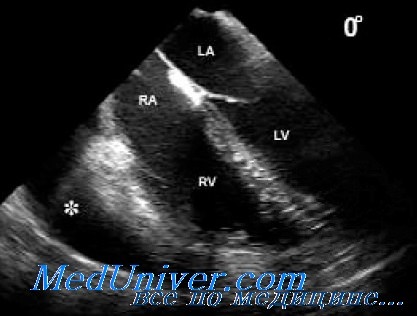
ЭХО-КГ позволяет визуализировать полость аневризмы, определить ее размеры и локализацию, выявить наличие пристеночного тромба.
Жизнеспособность миокарда в зоне хронической аневризмы сердца определяется посредством стресс-ЭхоКГ и ПЭТ.
С помощью рентгенографии органов грудной клетки представляется возможным выявить кардиомегалию, застойные процессы в кровообращении.
ЭКГ – метод диагностики аневризмы сердца
ЭХО-КГ – метод диагностики аневризмы сердца
Что такое тампонада сердца? Причины возникновения, диагностику и методы лечения разберем в статье доктора Кокориной Елены Ивановны, кардиолога со стажем в 10 лет.
Определение болезни. Причины заболевания
Тампонада сердца (Cardiac tamponade) — это скопление жидкости в полости перикарда, или околосердечной сумке. Камеры сердца при этом сдавливаются и оно не может полноценно сокращаться.
Типичные признаки тампонады сердца: дискомфорт и боль в груди, одышка и учащённое поверхностное дыхание. Острая тампонада может сопровождаться обмороком или внезапным коллапсом, т. е. резким снижением артериального давления, головокружением и потерей сознания.
Тампонада сердца может развиться как осложнение различных заболеваний.
К основным причинам тампонады сердца относятся:
Симптомы тампонады сердца
Симптомы тампонады вызваны снижением сердечного выброса и застоем крови в большом круге кровообращения.
Снижение сердечного выброса проявляется следующими симптомами:
Признаки застоя крови по большому кругу кровообращения:
Также могут возникать давящие боли и тяжесть в груди. Острое развитие тампонады может сопровождаться обмороками, состоянием шока и клинической смертью.
Патогенез тампонады сердца
Перикард — это фиброзно-серозный мешок, состоящий из двух листков, которые окружают сердце. Толщина перикарда составляет 1–2 мм, между его листками содержится 15–35 мл жидкости. Перикард играет роль механического барьера: он не даёт сердцу соприкасаться с окружающими тканями и оберегает его правые камеры от чрезмерного расширения.
Давление в полости перикарда варьирует от 6 мм рт. ст. в конце вдоха до 3 мм рт. ст. в конце выдоха. Снижение давления на вдохе способствует заполнению кровью правых камер сердца. Благодаря разнице давлений в полости перикарда, предсердий и желудочков сокращается сердце. Его клапаны позволяют регулировать давление в полостях и кровь, собранная от внутренних органов, поступает в правые отделы сердца. Затем она попадает в лёгочные сосуды, проходит по лёгким, насыщаясь кислородом, и поступает в левые отделы сердца, откуда разносится по внутренним органам, отдавая им кислород.
Из-за скопления крови, жидкости, гноя, газа или тромбов в полости перикарда нарушается движение крови и изменяется давление в предсердиях, желудочках и перикарде. В результате сердце перестаёт нормально сокращаться.
Классификация и стадии развития тампонады сердца
Тампонада сердца — это осложнение других заболеваний, её классификации не существует. Различаются только скорость, с которой накапливается жидкость в полости перикарда. Например, если пациент получил травму грудной клетки с проникающим ранением сердца, то большой объём крови стремительно, за минуты, поступает в полость перикарда и происходит сдавление сердца. Другой пример — перикардит, при котором жидкость накапливается медленно. В этом случае тампонада развивается постепенно в течение часов или дней.
Осложнения тампонады сердца
Долгосрочные осложнения появляются при медленном развитии тампонады. При быстром или массивном накоплении жидкости симптомы выражены ярко и без медицинской помощи пациент может погибнуть.
Постепенное накопление жидкости в полости перикарда приводит к застою в большом круге кровообращения. В результате нарушается венозный отток от внутренних органов, жидкость проникает через стенку сосудов в естественные полости и скапливается в брюшной полости. Такое состояние называют асцитом.
Кроме того, из-за застоя венозной крови и нарушения оттока в правые отделы сердца увеличивается печень, что проявляется болью в правом подреберье. При длительной тампонаде может развиться кардиальный цирроз печени.
При перикардите, помимо тампонады, может возникать миокардит и эндокардит. Эти заболевания в дальнейшем приводят к сердечной недостаточности, которая сохраняется после купирования тампонады и воспалительного процесса. Также часто листки перикарда слипаются и появляются спайки, что нарушает сократимость сердца. При выраженном воспалении в миокарде могут появляться рубцы, имитирующие перенесённый инфаркт миокарда.
Диагностика тампонады сердца
При резком появлении симптомов необходимо вызвать скорую медицинскую помощь. Если симптомы нарастают постепенно, нужно обратиться к кардиологу. Желательно посетить кардиолога приёмного покоя в стационаре: он может экстренно сделать ультразвуковое исследование сердца и при подтверждении тампонады — немедленную пункцию перикарда.
Сбор анамнеза
На приёме у врача нужно обязательно рассказать обо всех симптомах, хронических заболеваниях, перенесённых операциях, травмах, инфекциях и принимаемых препаратах.
Объективное обследование
С помощью объективного обследования можно выявить учащение сердцебиения, расширение яремных вен и увеличение печени. При большом объёме выпота приглушены тоны сердца, при простукивании слышно, что границы абсолютной тупости сердца расширены. Абсолютная тупость сердца — это область сердца, плотно прилегающая к грудной стенке и не прикрытая лёгочной тканью, поэтому при простукивании слышен абсолютно тупой звук.
Лабораторная диагностика
Результаты анализов крови важны при медленном течении заболевания. По общему и биохимическому анализу можно выявить маркеры воспаления: повышение скорости оседания эритроцитов (СОЭ), числа лейкоцитов, уровня С-реактивного белка и лактатдегидрогеназы (ЛДГ). Также очень важно определить маркеры повреждения миокарда: уровень тропонина и МВ-фракции креатинфосфокиназы.
Инструментальная диагностика
Эхокардиография (УЗИ сердца) — это наиболее информативный метод, позволяющий оценить объём жидкости в перикарде, уменьшение объёмов полости правого предсердия и правого желудочка при наполнении кровью и другие признаки, которые сможет интерпретировать только врач.
Дифференциальная диагностика
Тампонаду сердца важно отличать от плеврального выпота, лёгочной эмболии, пневмоторакса, констриктивного перикардита, различных видов шока — гиповолемического, кардиогенного, инфекционно-токсического и т. д. [4]
Лечение тампонады сердца
Лечением тампонады занимаются кардиохирурги, торакальные хирурги совместно с кардиологами.
Хирургическое лечение
Пункция перикарда занимает от 15 до 60 минут, после чего пациента обязательно оставляют под наблюдением в стационаре на 2–3 дня. При проведении декомпрессионной пункции перикарда в первую же минуту улучшаются показатели гемодинамики, уменьшается одышка и боль в груди.
Операция может приводить к осложнениям, например пневмотораксу или травме сердечной мышцы. Однако спасти пациента другим способом нельзя, поэтому польза от операции превышает возможные риски.
Медикаментозная терапия
При резком снижении артериального давления и периферических признаках шока (посинение рук, ног и лица) могут быть внутривенно введены средства, усиливающие силу сердечного выброса, например Добутамин.
Если тампонада развилась в результате декомпенсации хронической сердечной недостаточности, помимо неотложной терапии важно подобрать препараты для постоянного приёма: бета-блокаторы, диуретики, ингибиторы ангиотензинпревращающего фермента и т. д. [6]
Прогноз. Профилактика
При своевременно проведённой пункции прогноз благоприятный. В дальнейшем он зависит от течения основного заболевания. Без медицинской помощи при развёрнутой картине заболевания пациент погибает.
После лечения тампонады сердца необходимо наблюдаться у кардиолога: через неделю после выписки из стационара или проведения пункции перикарда, затем спустя 1, 3 и 6 месяцев. Перед посещением кардиолога нужно выполнить электрокардиографию и эхокардиографию. Эти исследования помогут исключить повторное скопление жидкости и нарушение ритма.
Для профилактики тампонады сердца нужно своевременно выявлять и лечить заболевания, приводящие к её развитию. После травм и операций важно контролировать состояние сердца с помощью УЗИ.
О самопроизвольных разрывах сердца в патолого-анатомическом и клиническом отношениях
М. Маркевич (Ленинград).
библиографическое описание:
О самопроизвольных разрывах сердца в патолого-анатомическом и клиническом отношениях / Маркевич М. // Судебно-медицинская экспертиза. — М.: Изд-во Наркомздрава, 1928. — №8. — С. 8-17.
код для вставки на форум:
По статистике Робина из 156 лиц, умерших от разрыва сердца, было
| — — 20 л. | 1 сл. |
| 30 — 40 „ | 6 „ |
| 40 —50 „ | 11 „ |
| 50 — 60 „ | 17 „ |
| 60 — 70 „ | 42 „ |
| 70 — 80 „ | 61 „ |
| 80 — 90 „ | 17 „ |
| 90 — 96 „ | 1 „ |
Что касается места разрыва, то по статистике Оливьера (47 сл.), Ellaume (55 сл.) и Робина (173 сл.), взятых вместе (275 случаев), было 216 (78,5%) разрывов левого желудочка.
| Абс. кол. | % % | |
| Разрыв правого желудочка | 35 | 13 |
| Разрыв правого предсердия | 14 | 5 |
| Разрыв левого предсердия | 6 | 2 |
| Разрыв обоих желудочков | 4 | 1,5 |
В виду всех этих директив в учении о патогенезе разрывов сердца, покойный проф. С. П. Шуенинов предложил мне заняться разработкой случаев разрыва сердца, накопившихся в патолого-анатомическом музее больницы.
Методика была обычная: из формалина кусочки, после уплотнения в спирте, заключались в целлюидин, срезы окрашивались по Ван-Деену, Вейгерту, гематоксилином и эозином и по Bielschowsky с некоторой модификацией. На жировое перерождение — Флемминг сафранин и замороженные Суданом (см. таблицу).
В описываемых мною случаях (см. таблицы) разрыв произошел в стенке левого желудочка. Во всех случаях главные изменения найдены в левой венечной артерии, только в случаях 4-м и 6-м были поражены обе арте рии. Обычно находим в начальной части нисходящей ветви или свежий красный тромб, или старые пристеночные тромбы, а ниже, в области раз рыва красные тромбы или облитерацию мелких ветвей.
В трех случаях (2, 4 и 7) разорвалась верхушечная аневризма, а в остальных (1, 3, 5 и 7) разрыв произошел в верхних частях левого желудочка, при чем в 1 и 5 найдено значительное аневризматическое расширение, в случае 3 истончение до 5 милл., а в 6 найдены 3 внутренние окаймляющие некроз трещины, из которых одна сделалась сквозною и дала разрыв с зазубренными краями. Из 4-х больничных случаев (1, 2, 4 и 6) три дали длительное течение болезни, а случай 6 закончился в 12 ч., судебномедицинские случаи 3 и 5 получены без всяких указаний, а 7 из психиатрической больницы с протоколом вскрытия, но без истории болезни.
При микроскопическом исследовании в общем найдены следующие изменения.
Фрагментация миокарда обнаружена во всех моих случаях и нигде я не мог найти каких-либо внедрений среди фрагментов или какой-либо реакции со стороны окружающих тканей, дававших бы указание на при жизненное ее происхождение. Здесь уместно будет сообщить об одном опыте, который мне пришлось проделать невольно. Желая изучить структуру миокарда на живой еще ткани, я быстро вырезал сердце у только что убитой для RW морской свинки, и теплое еще сердце для фиксации по ошибке опустил не в подогретый, а в холодный концентрированный раствор сулемы, при чем в этом сердце появились такие сильные сокращения, что, при исследовании потом на срезах, оказались разорванными все соедини тельные перегородки, но фрагментации миокарда нигде мне открыть не уда лось. Решетчатые волокна всюду хорошо окрашиваются и дифференцируются. В мышечной оболочке артерий они представляются в виде тонких фибрилл, идущих параллельно мышечным волокнам, отсюда они переходят на утолщения интимы. Но так как в этих утолщениях принимают участие эластические и коллогенные волокна, а дифференцируются пикриновым фуксином только коллогенные волокна, то быть может способ Белховского окрашивает и эластические волокна. В коагуляционных некрозах «Gittеr-fasеrn» хорошо окрашиваются, в геморрагических инфарктах, кровоизлияниях и миомалятических очагах — или вовсе не окрашиваются, или окрашиваются только по сторонам уцелевших мышечных глы- бок. На местах разрывов и фрагментации Gitter-fasern прерываются. Иногда в сильно дегенерированных участках окрашиваются только грубые волокна, без поперечных анастомозов или только в виде пунктирной линии. В мозолистых бляшках и грануляционных очагах открыть решетчатые волокна не удается.
При анализе микроскопической картины разрывов сердца можно сделать два предположения: 1) процесс разрыва совершился быстро, в одну или несколько систол, течение разрыва измеряется секундами, при чем предполагается какой-то внешний агент, напр., повышенное кровяное давление, физическое напряжение, психический аффект и проч., и 2) тот же процесс совершается медленно; постепенно волокно за волокном разъединяются друг от друга, образуется маленькая щель, которая расширяется далее уже при протоке крови через отверстие.
В первом случае мышечные волокна должны рваться или ломаться, а во втором они просто распознаются. Первый механизм возможен при коагуляционном некрозе Вейгерта и, быть может, при геморрагическом инфаркте (это можно проследить на микроскопических препаратах); второй — на истонченных местах, каким бы способом они ни образовались, и в миомалятических очагах. Но в таких случаях трудно показать это наглядно, гистологически же приходишь к заключению, что разрыв происходит медленно, так сказать, хронически, если можно применить такое выражение по отношению к разрывам; при этом волокна постепенно расползаются, подобно тому, как вскрывается хорошо созревший абсцесс: внезапно, без боли и предвестников, без внешних насилий, во время сна, при кашле, при чихании, при потягиваниях, при выпрямлении, т. е. при самых ничтожных напряжениях. Собственно говоря, все сквозные разрывы по длительности будут очень скоротечны, и течение их должно измеряться, если не секундами, то минутами. Но при каждом разрыве сердца надо различать самый разрыв и подготовительные к нему процессы, которые действительно могут протекать различно.
Вейгерт, установивший понятие о коагуляционном некрозе, полагает, что он может образоваться в 24 часа, но потеря окраски ядер, что, собственно, характерно для некроза, может продолжаться до 7 дней. Что касается геморрагического инфаркта и миомаляции, то здесь сроки еще менее определенны, поэтому клиническое наблюдение может дать руководящую нить и патологоанатому. Так как разрывы сердца и закупорка венечной артерии встречаются довольно редко, то в литературе часто смешивают симптомы закупорки с течением самого разрыва.
Клинически закупорка одной из главных ветвей венечных артерий всегда проявляется внезапным началом заболевания. Кардинальным симп томом ее служит status anginosus или в типичной форме (с ретростернальными болями, иррадиирующими в шею, голову и в левую руку), или в форме эквивалента этих болей — status asthmaticus, или, наконец,— status gastralgicus.
Все три формы могут сопровождаться диспептическими явлениями в форме тошноты и рвоты. Объективными симптомами служат: сердечная слабость — исчезание толчка верхушки, пресистологическое раздвоение 1-го тона при непосредственной аускультации, едва прощупываемый пульс лучевой артерии, цианоз и похолодание конечностей, набухание печени, одутловатое и напряженное тело. В анамнезе — припадки грудной жабы. От обыкновенного припадка грудной жабы закупорка венечной артерии отличается тем, что здесь припадки быстро следуют один за другим, и не прекращается сердечная слабость, обычно исчезающая при простой грудной жабе.
Если, вооружившись этими признаками, мы попытаемся дать себе отчет, что представляют наши случаи, то нам придется разбить их на группы: одну с клиническими данными — таковы наши больничные случаи (1, 2, 4 и 6), и вторую (3, 5 и 7), где мы имеем только патологоанатомическую картину.
В 1-ом нашем случае больная внезапно заболела 6/ХII 1895 г. после обеда и поступила в больницу с явлениями острого желудочно-кишечного заболевания, напоминающего азиатскую холеру: рвота, понос, судороги, боль в левой половине груди. При явлениях общей слабости умерла в ночь на 8 /ХII (3 дня).
Разрыв произошел на истонченном месте артерии с гиалинизированными стенками, в венах утолщение интимы, тромбоз вен и скопление лейкоцитов в мелких венах. Линия разрыва прошла через инфаркт и коагуляционный некроз. Здесь процесс подготовки к разрыву шел медленно, хронически; начало заболевания совпадает с прекращением подвоза крови, — что вызвало status anginosus с тромбозом вен и инфекцией их, это ускорило процесс размягчения. Следовательно, случай этот надо отнести в особую • группу и охарактеризовать, как острый инфекционный. По данным вскрытия и по клиническому течению азиатская холера исключается.
Случай 2-й. Заболела 23/II 1899 г. Внезапно появилась тошнота и рвота, одышка, боль в груди и общая слабость, повышенная Т°. 26/II с теми же явлениями поступает в больницу. 1/III Т° понизилась до нормы, жаловалась на онемение пальцев на руках. 2/III. Пульс 90, аритмичен, самочувствие хорошее. В 4 ч. вечера после чая внезапно почувствовала себя дурно и через 5 минут умерла. Status anginosus 23/II соответствует закупорке нисходящей ветви, проходимость скоро восстановилась, последовала новая закупорка красным тромбом, с образованием геморрагического инфаркта и миомаляции, которые и дали разрыв в истонченном месте. Разрыв здесь подготовлялся хронически и закончился в 5 минут. Случай хронический.
Случай 4-й. Больная поступила в больницу 11/IV 1906 г. с явле ниями гастроэнтерита: рвота, понос, слабость. До этого времени была совершенно здорова. Умерла 12/IV при явлениях возрастающей слабости. Красный тромб в начальной части нисходящей ветви левой венечной артерии соответствует началу заболевания — status anginosus и сердечная слабость; разрыв произошел на истонченном месте, но линия разрыва проходит через коагуляционный некроз и инфаркт — случай с хронической подготовкой, но с подострым течением разрыва.
Случай 3-й — судебно-медицинский. В нисходящей ветви венечной артерии старый пристеночный тромб и свежий, сплошь выполняющий просвет сосуда, свежие тромбы в разветвлениях; сквозной разрыв на неистонченном месте (5—6 мм.), линия разрыва проходит через коагуляционный некроз Вейгерта и геморрагический инфаркт. Величина разрыва говорит за быстроту, катастрофы. Жировое перерождение способствовало величине разрыва. Случай острого разрыва с острой подготовкой. С л у ч а й 5-й — судебно-медицинский. Место разрыва не очень истончено, красный тромб в области разрыва. Линия разрыва проходит через инфаркт и молодой грануляционный очаг. Случай острого разрыва под влиянием какого-то внешнего агента.
Случай 7-й (из психиатрической больницы). Облитерирующий эндар- териит нисходящей ветви, разрыв в истонченном месте проходит через инфаркт и, вероятно, миомаляцию; одновременно свежее кровоизлияние в мозгу. Случай хронической подготовки и скоротечного разрыва, быть может во время сна или в бессознательном состоянии после мозгового кровоизлияния.
На основании всего изложенного я прихожу к следующим выводам:
В заключение считаю своим приятным долгом принести мою сердечную признательность и глубокую благодарность высокоуважаемому проф. Федору Яковлевичу Чистовичу за просмотр моих микроскопических препаратов и за его всегда любезное отношение и интерес к моей работе.
похожие статьи
К вопросу о саморазрывах сердца / Кечек К.С. // Судебно-медицинская экспертиза. — М.: Изд-во Наркомздрава, 1928. — №8. — С. 109-111.
Публикации в СМИ
Травма сердца тупая
Тупая травма сердца (ушиб сердца) чаще всего возникает при работе с механизмами и при дорожно-транспортных происшествиях.
Частота • Повреждения сердца обнаруживают в 10–76% случаев смерти при травмах, повреждения сердца часто бывают истинной, но нераспознанной, непосредственной причиной смерти • Тупые травмы составляют 1/3 всех травм сердца • Отношение частоты у мужчин и женщинам — 2,7:1 • Повреждения сердца происходят в 70,9% автомобильных аварий, 9,5% травм пешеходов, 7,8% мотоциклетных аварий, 7,6% падений с высоты • В 16,3% случаев пациенты с тупыми травмами сердца не имеют других повреждений • 47,5% пациентов в дополнение к травме ССС имеют повреждения ещё двух систем — наиболее часто это бывают ЧМТ, травмы конечностей и тупые травмы живота, реже — травмы органов малого таза, мягких тканей и позвоночника • У 60,6% пациентов не бывает повреждений костного скелета грудной клетки • Чрезвычайно редко тупая травма сердца сочетается с травмой аорты • 0,3% пациентов с тупой травмой имеют надрыв или разрыв миокарда или перикарда, причём частота разрывов стенок всех камер сердца приблизительно одинакова.
• Объективное обследование •• Специфическая симптоматика отсутствует •• Регистрируют наружные повреждения и симптомы прочих сопутствующих травм, в 30% случаев обнаруживают гематому на передней поверхности грудной клетки, повторяющую контуры рулевого колеса — симптом татуированного руля.
Консервативная терапия • При стабильной гемодинамике и отсутствии по данным неинвазивных исследований разрывов и ушибов большого объёма специального лечения не требуется • В случае большого объёма ушиба, а также при высоком риске нарушений ритма необходимы интенсивное наблюдение, мониторинг гемодинамики и нормализация содержания калия и магния в плазме • Сердечно-лёгочную реанимацию, восстановление водно-электролитных и кислотно-основных нарушений, трансфузии, лечение нарушений ритма, острой сердечной недостаточности и другие интенсивные мероприятия при разрывах сердца проводят по стандартным протоколам • Назначение лидокаина для профилактики желудочковой тахикардии не влияет на выживаемость • При лечении нарушений ритма следует избегать применения препаратов с отрицательным инотропным эффектом.
• Показания •• Полные разрывы стенки сердца •• Неполные разрывы стенки сердца при нестабильной гемодинамике •• Тампонада сердца •• Необходимость ревизии и оперативного лечения сопутствующих повреждений органов грудной клетки.
• Методы оперативного лечения •• В большинстве случаев прибегают к доступу посредством срединной стернотомии •• При небольшом опыте и отсутствии инструментария для быстрого выполнения стернотомии, а также с диагностической целью допустимо использование субксифоидного доступа (высокой срединной лапаротомии) с частичной эвакуацией гемоперикарда и последующим расширением доступа для полной ревизии •• При гемотораксе выполняют торакотомию •• В некоторых случаях, особенно при необходимости доступа к высоким отделам задней поверхности сердца и манипуляциях при разрывах АВ-областей, может возникнуть необходимость в подключении аппарата искусственного кровообращения •• При наличии необходимой аппаратуры и квалификации хирургической бригады стремятся к полному восстановлению анатомии повреждённого сердца •• В противном случае допустимо двухэтапное оперативное лечение: сначала ликвидация разрывов свободной стенки сердца, а затем операция на открытом сердце по поводу повреждений сердечной перегородки, коронарных артерий и клапанов сердца.
Прогноз •• 90% случаев смерти при тупой травме приходится на разрывы стенок сердца, 82% из них составляют разрывы стенок желудочков •• Наиболее частая причина смерти при разрывах — тампонада сердца •• Госпитальная летальность после оперативного лечения (после предшествующей остановки кровообращения) — 40–88%.
Код вставки на сайт
Травма сердца тупая
Тупая травма сердца (ушиб сердца) чаще всего возникает при работе с механизмами и при дорожно-транспортных происшествиях.
Частота • Повреждения сердца обнаруживают в 10–76% случаев смерти при травмах, повреждения сердца часто бывают истинной, но нераспознанной, непосредственной причиной смерти • Тупые травмы составляют 1/3 всех травм сердца • Отношение частоты у мужчин и женщинам — 2,7:1 • Повреждения сердца происходят в 70,9% автомобильных аварий, 9,5% травм пешеходов, 7,8% мотоциклетных аварий, 7,6% падений с высоты • В 16,3% случаев пациенты с тупыми травмами сердца не имеют других повреждений • 47,5% пациентов в дополнение к травме ССС имеют повреждения ещё двух систем — наиболее часто это бывают ЧМТ, травмы конечностей и тупые травмы живота, реже — травмы органов малого таза, мягких тканей и позвоночника • У 60,6% пациентов не бывает повреждений костного скелета грудной клетки • Чрезвычайно редко тупая травма сердца сочетается с травмой аорты • 0,3% пациентов с тупой травмой имеют надрыв или разрыв миокарда или перикарда, причём частота разрывов стенок всех камер сердца приблизительно одинакова.
• Объективное обследование •• Специфическая симптоматика отсутствует •• Регистрируют наружные повреждения и симптомы прочих сопутствующих травм, в 30% случаев обнаруживают гематому на передней поверхности грудной клетки, повторяющую контуры рулевого колеса — симптом татуированного руля.
Консервативная терапия • При стабильной гемодинамике и отсутствии по данным неинвазивных исследований разрывов и ушибов большого объёма специального лечения не требуется • В случае большого объёма ушиба, а также при высоком риске нарушений ритма необходимы интенсивное наблюдение, мониторинг гемодинамики и нормализация содержания калия и магния в плазме • Сердечно-лёгочную реанимацию, восстановление водно-электролитных и кислотно-основных нарушений, трансфузии, лечение нарушений ритма, острой сердечной недостаточности и другие интенсивные мероприятия при разрывах сердца проводят по стандартным протоколам • Назначение лидокаина для профилактики желудочковой тахикардии не влияет на выживаемость • При лечении нарушений ритма следует избегать применения препаратов с отрицательным инотропным эффектом.
• Показания •• Полные разрывы стенки сердца •• Неполные разрывы стенки сердца при нестабильной гемодинамике •• Тампонада сердца •• Необходимость ревизии и оперативного лечения сопутствующих повреждений органов грудной клетки.
• Методы оперативного лечения •• В большинстве случаев прибегают к доступу посредством срединной стернотомии •• При небольшом опыте и отсутствии инструментария для быстрого выполнения стернотомии, а также с диагностической целью допустимо использование субксифоидного доступа (высокой срединной лапаротомии) с частичной эвакуацией гемоперикарда и последующим расширением доступа для полной ревизии •• При гемотораксе выполняют торакотомию •• В некоторых случаях, особенно при необходимости доступа к высоким отделам задней поверхности сердца и манипуляциях при разрывах АВ-областей, может возникнуть необходимость в подключении аппарата искусственного кровообращения •• При наличии необходимой аппаратуры и квалификации хирургической бригады стремятся к полному восстановлению анатомии повреждённого сердца •• В противном случае допустимо двухэтапное оперативное лечение: сначала ликвидация разрывов свободной стенки сердца, а затем операция на открытом сердце по поводу повреждений сердечной перегородки, коронарных артерий и клапанов сердца.
Прогноз •• 90% случаев смерти при тупой травме приходится на разрывы стенок сердца, 82% из них составляют разрывы стенок желудочков •• Наиболее частая причина смерти при разрывах — тампонада сердца •• Госпитальная летальность после оперативного лечения (после предшествующей остановки кровообращения) — 40–88%.
Что такое перикардит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Вишневой Елены Михайловны, кардиолога со стажем в 28 лет.
Определение болезни. Причины заболевания
Перикардит (Pericarditis) — это воспаление околосердечной сумки (перикарда). Заболевание зачастую проявляется острой болью в груди, которая ослабевает в положении сидя с наклоном вперёд. Также перикардит может сопровождаться одышкой и болью в груди в положении лёжа.
При перикардите в полости околосердечной сумки часто накапливается жидкость — выпот. Такую форму болезни называют экссудативным перикардитом.
Распространённость перикардита
Причины перикардита
Все причины поражения перикарда можно разделить на инфекционные и неинфекционные.
Острым инфекционным перикардитом чаще болеют в холодное время года. Заболеванию обычно предшествуют желудочно-кишечные или гриппоподобные симптомы: тошнота, нарушение глотания, икота, лихорадка до 38,0 °C, мышечная слабость и ломота в теле.
К другим неинфекционным причинам перикардита относятся аутоиммунные заболевания: системная красная волчанка, ревматоидный артрит, болезнь Стилла, развившаяся у взрослых, системная склеродермия, синдром Шегрена, дерматомиозит, полимиозит, системные васкулиты. Также к перикардиту может привести первичный аутоиммунный и послеоперационный гипотиреоз, терминальная хроническая болезнь почек, лучевая терапия при раке органов грудной клетки, первичные и вторичные новообразования перикарда.
Лекарственные перикардиты встречаются редко. К ним может привести длительный приём больших доз Прокаинамида, Гидралазина, Метилдопы, Изониазида, Фенитоина, пенициллинов и антинеопластических средств.
Классические представления о триаде основных причин перикардита: туберкулёзе, ревматизме и уремии — утратили своё значение. Сейчас разработаны эффективные меры профилактики, диагностики и лечения этих болезней, поэтому к перикардиту они приводят редко.
Симптомы перикардита
Перикардит может протекать без симптомов. В таких случаях болезнь выявляют на рентгено- или эхокардиограмме, выполненных по другому поводу, например при диспансеризации, профосмотре или плановом обследовании при других заболеваниях.
Характерным признаком перикардита при умеренных выпотах является одышка при нагрузке вплоть до ортопноэ — затруднённого дыхания в положении лёжа. Для прекращения ортопноэ пациенту приходится сесть и наклониться вперёд.
Другой частый симптом — это боль за грудиной и/или в области передней стенки грудной клетки, которая ощущается как распирание или наполнение.
В некоторых случаях симптомы перикардита проявляются только на этапе осложнений, например при развитии тампонады сердца. У пациента нарастает одышка, учащается сердцебиение, снижается артериальное давление, замедляется пульс, бледнеет кожа, выступает холодный липкий пот, кружится голова и возникает предобморочное состояние.
Патогенез перикардита
Выделяют три основных пути повреждения перикарда:
В начале заболевания перикард чаще всего воспаляется вдоль задней стенки левого желудочка. Воспаление может завершиться выздоровлением либо прогрессировать и приобрести экссудативный (выпотной) характер, распространившись на все отделы перикарда.
Классификация и стадии развития перикардита
Перикардит бывает первичным и вторичным. Первичный, или изолированный, перикардит встречается редко и имеет вирусное происхождение.
Согласно распространённой отечественной классификации, в зависимости от течения болезни перикардит может быть трёх видов:
Острый перикардит может быть сухим (фибринозным) и выпотным. Хронический перикардит подразделяют на адгезивный (со спайками), констриктивный (с отложением солей кальция) и выпотный (со скоплением жидкости из-за воспаления или сердечной недостаточности).
Стадии перикардита
В первой фазе заболевания воспаление начинается с висцерального листка в области основания сердца. Небольшой выпот всасывается обратно в кровоток, на листках перикарда откладывается белок фибрин. При сухом перикардите блестящая и гладкая поверхность серозной оболочки перикарда становится мутной и шероховатой. Постепенно объём фибринозных масс увеличивается, они срастаются с подлежащей тканью или образуются тяжи фибрина между листками перикарда и наружным листком перикарда с плеврой, диафрагмой, грудиной, капсулой печени и другими прилежащими органами.
Во второй фазе в воспалительный процесс интенсивно вовлекаются листки перикарда, из-за чего жидкость плохо всасывается обратно. Основными жалобами на этой стадии становятся тяжесть и ноющие боли в грудной клетке. При инфекционном процессе возникает лихорадка, озноб и интоксикация.
Из-за того, что жидкость плохо всасывается, в полости перикарда образуется выпот. Он может быть нескольких видов:
Осложнения перикардита
Перикардит может привести к миоперикардиту — воспалению и дегенеративным изменениям в прилегающих к выпоту слоях миокарда. За счёт развития рубцовой ткани миокард сращивается с близлежащими органами, грудной клеткой и позвоночником (медиастиноперикардит).
Перечисленные осложнения проявляются следующими симптомами: набухают вены на шее, возникает стойкая тахикардия и парадоксальный пульс, развивается гидроторакс и асцит (выпот в полость плевры и брюшную полость), отекают руки и ноги.
Диагностика перикардита
Согласно рекомендациям Европейского общества кардиологов, для диагностики острого перикардита необходимо выявить как минимум два из четырёх критериев:
Лабораторная диагностика
Изменение основных биохимических показателей крови: креатинина, мочевины, АСТ, АЛТ, общего билирубина, белка и их фракций, электролитов — может указывать на вторичный перикардит и возникшие осложнения. Изменения в коагулограмме отражают осложнения со стороны свёртывающей системы крови.
К дополнительным лабораторным исследованиям, позволяющим установить причины перикардита, относятся:
Инструментальная диагностика
Электрокардиография (ЭКГ) — доступный метод, позволяющий оценить работу сердечно-сосудистой системы. Он заключается в регистрации биопотенциалов, возникающих в сердце. Изменения на ЭКГ зависят от того, насколько в воспалительный процесс вовлечён висцеральный листок перикарда и прилегающие к нему участки миокарда.
Изменения на ЭКГ могут быть диффузными или локализованными. Характерные признаки наблюдаются приблизительно в 60 % случаев всех перикардитов.
Трансторакальная эхокардиография (ЭхоКГ) с допплерографией — обязательный и часто единственный метод визуализации заболеваний перикарда. Это неинвазивное и безопасное исследование, которое не требует специальной подготовки. При ЭхоКГ пациент ложится на спину или левый бок, и врач с помощью ультразвукового датчика осматривает сердце.
Перикардит следует дифференцировать с первичными опухолями перикарда, синдромом сдавления органов средостения, ожирением перикарда и водянкой сердца.
Лечение перикардита
Медикаментозная терапия
Противовоспалительная терапия — ведущий метод лечения острого перикардита. Применяется ацетилсалициловая кислота (АСК), Ибупрофен и Колхицин. Они признаны основными препаратами для лечения острого перикардита, не связанного со специфическими инфекциями, например туберкулёзом. Предпочтительным препаратом считается АСК. При её непереносимости принимают Ибупрофен.
Для лечения рецидивирующего перикардита также используются НПВП. Кроме Ибупрофена, применяют противовоспалительный препарат Индометацин. Дозировку лекарств и продолжительность приёма определяет лечащий врач.
НПВП увеличивают риск развития желудочно-кишечных кровотечений, поэтому, начиная с первых часов лечения острого перикардита, обязательно принимают лекарства, защищающие желудок от эрозий и язв.
Глюкокортикостероиды (ГКС) применяют для лечения острого перикардита, если АСК и НПВП противопоказаны, недостаточно эффективны или по специфическим показаниям (например, при перикардите, вызванном аутоиммунными заболеваниями). ГКС, в частности Преднизолон в низких дозах, уменьшают риск развития рецидива, осложнений после лечения и других побочных эффектов.
Терапия ГКС быстро устраняет симптомы перикардита. Чтобы уменьшить риск рецидивов и тем более при рецидивирующем перикардите дозу ГКС снижают медленно. При рецидиве нужно приложить все усилия, чтобы не увеличивать дозу препарата или не возобновлять кортикостероидную терапию.
Приём ГКС часто вызывает стероидную зависимость, которая проявляется воспалением даже при небольшом снижении доз. К побочным эффектам ГКС относятся задержка жидкости, отёки и нарушение баланса электролитов.
Внутривенное введение иммуноглобулина широко применяется при лечении аутоиммунных заболеваний. Препарат достаточно безопасен, но эффект от терапии непродолжителен, при перикардите он применяется редко.
Специфическое антимикробное лечение показано при гнойном перикардите. Это редкое заболевание опасно для жизни, но при адекватной терапии большинство пациентов выздоравливает. Внутривенная антимикробная терапия до получения результатов посевов назначается эмпирически, т. е. в зависимости от реакции организма на терапию. Чтобы предотвратить появление замкнутых «карманов» в полости перикарда (часто встречается при гнойном перикардите), необходимо своевременно дренировать полость перикарда.
На ранних стадиях перикардита проводится внутриперикардиальный тромболизис — это медикаментозная терапия, которая позволяет предотвратить развитие констриктивного перикардита.
Хирургическое лечение
Во многих случаях операция становится единственным подходящим методом лечения, но её проводят по строгим показаниям: если перикардит влияет на внутрисердечное кровообращение, при констриктивном перикардите и обызвествлении перикарда («панцирном» сердце).
Перикардэктомия (удаление перикарда) может быть рекомендована пациентам с хроническим рецидивирующим экссудативным перикардитом при одышке, боли в груди и невозможности бытовых нагрузок. Также её проводят при выраженной боли в груди, которая не ослабляется медикаментозной терапией.
Прогноз. Профилактика
Долгосрочный прогноз при остром перикардите в большинстве случаев благоприятный. Идиопатический и вирусный перикардит редко приводят к осложнениям, хуже поддаются лечению бактериальный и неопластический перикардиты.
Риск развития констриктивного перикардита (т. е. утолщения перикарда и сдавления сердца):
Профилактика перикардита
Чтобы уменьшить риск развития перикардита, нужно своевременно лечить инфекционные заболевания.
После перенесённого перикардита следует ежегодно посещать кардиолога, при ухудшении состояния к доктору необходимо обратиться немедленно. Также нужно избегать переохлаждения, заражения вирусными инфекциями и своевременно устранять очаги инфекции.
Разрыв сердца
Разрыв сердца — нарушение целостности стенок сердца. Наиболее часто происходит в виде серьёзного осложнения инфаркта миокарда, сопровождается высокой смертностью.
Этиология
Наиболее частой причиной разрыва сердца является инфаркт миокарда. Другие причины возникновения разрыва включают травму сердца, эндокардит, опухолевое поражение сердца, инфильтративные заболевания сердца, расслаивающую аневризму аорты. [1] [2] [3] [4]
Факторами риска разрыва после острого инфаркта миокарда являются: женский пол, пожилой возраст и низкий индекс массы тела. [5] [6]
Ссылки
Полезное
Смотреть что такое «Разрыв сердца» в других словарях:
разрыв сердца — инфаркт Словарь русских синонимов. разрыв сердца сущ., кол во синонимов: 1 • инфаркт (3) Словарь синонимов ASIS. В.Н. Тришин … Словарь синонимов
разрыв сердца — (ruptura cordis, cardiorrhexis; син.: кардиорексис, разрыв сердца внешний) образование сквозного дефекта в стенке сердца при трансмуральном инфаркте миокарда … Большой медицинский словарь
разрыв сердца внешний — (ruptura cordis externa) см. Разрыв сердца … Большой медицинский словарь
разрыв сердца внутренний — (ruptura cordis interna) нарушение целости внутриполостных элементов стенки сердца (межжелудочковой перегородки, сосочковых мышц) в связи с их некрозом и миомаляцией … Большой медицинский словарь
РАЗРЫВ СОСОЧКОВЫХ МЫШЦ — мед. Внутренний разрыв сердца нарушение целости внутрипо лостных элементов стенки сердца (межжелудочковой перегородки, сосочковых мышц) в связи с их некрозом и миомаляцией. Разрыв сосочковых мышц разновидность внутреннего разрыва сердца; полный… … Справочник по болезням
разрыв — сущ., м., употр. сравн. часто Морфология: (нет) чего? разрыва, чему? разрыву, (вижу) что? разрыв, чем? разрывом, о чём? о разрыве; мн. что? разрывы, (нет) чего? разрывов, чему? разрывам, (вижу) что? разрывы, чем? разрывами, о чём? о разрывах 1.… … Толковый словарь Дмитриева
разрыв — а; м. см. тж. разрывной 1) к разорвать разрывать 1), 3), 5) и разорваться разрываться 1), 2) Разры/в цепи … Словарь многих выражений
разрыв — а; м. 1. к Разорвать разрывать (1, 3, 5 зн.) и Разорваться разрываться (1 2 зн.). Р. цепи. Р. пряжи. Р. дипломатических отношений. Испытание материалов на р. (спец.; на прочность). Р. сердца (разг.; инфаркт миокарда, обычно со смертельным… … Энциклопедический словарь
АНЕВРИЗМА СЕРДЦА — АНЕВРИЗМА СЕРДЦА. А. с. или А. миокарда называют местные ограниченные выбухания стенки сердца, сопровождающиеся обычно истончением подлежащего участка миокарда. Прежде различали A. cordis to talis и partialis. Это деление, употребляющееся нек… … Большая медицинская энциклопедия
ТАМПОНАДА СЕРДЦА — мед. Тампонада сердца скопление жидкости в полости перикарда, вызывающее ограничение наполнения желудочков и предсердий, системный венозный застой и уменьшение сердечного выброса. Этиология • Уремия • Неопластические процессы в грудной полости,… … Справочник по болезням
Геморрагический инсульт
Почему рвутся сосуды?
Главная причина – артериальная гипертензия, особенно при отсутствии лечения или при перерывах в приеме гипотензивных лекарств. Сосуды физически не могут выдержать того давления, которое оказывается кровью на их стенки. Прорывается сосуд в месте истончения или повреждения, это бывает при наличии атеросклеротической бляшки, врожденных аневризмах, травмах головы, использовании некоторых лекарств, препятствующих свертыванию крови, при опухолях и энцефалитах. Другая важная причина разрыва – артериовенозные мальформации, когда мелкие артериальные и венозные сосуды не заканчиваются капиллярами, а сплетаются в один большой клубок. Такую врожденную патологию можно обнаружить при профилактическом обследовании. Если человек о ней знает, то ведет себя более осторожно, избегает ненужных рисков.
Природа максимально защитила головной мозг от повреждений, снабдив его массой протекторных и дублирующих систем. В молодом возрасте они срабатывают, а во второй половине жизни уже не всегда. Поэтому желательно, чтобы люди, находящиеся в группе риска, проходили ежегодное обследование у невролога.
Высок риск развития геморрагического инсульта у таких людей:
Как протекает геморрагический инсульт?
Разрыв сосудов может произойти в любое время суток. Этому, как правило, предшествует физическое или эмоциональное напряжение. Человек внезапно падает, иногда с громким криком, и теряет сознание.
Примерно у 30% пациентов бывают предвестники, развивающиеся в сроки от нескольких минут до нескольких дней. Накануне разрыва сосудов могут быть сильные головные боли – такие, которых человек никогда не испытывал. Бывает ощущение прилива и резкое покраснение лица. Иногда беспокоят ощущения онемения в конечностях, слабость мышц, появляется асимметрия лица.
Основные симптомы геморрагического инсульта такие:
С момента появления этих симптомов есть только 3 часа на то, чтобы максимально помочь человеку. Через 3 (иногда 6) часов произойдут необратимые изменения, тогда ничего поправить уже будет нельзя.
Что такое разрыв сердца
Сухожильные нити сердца. Поражения сердца при эндокардите
Важную роль в функции атриовентрикулярных клапанов играет удерживающий клапаны аппарат — сухожильные нити, крепящиеся, с одной стороны, к свободному краю створок клапана, с другой, — к вершинам сосочковых мышц. При эндокардитах и миокардитах эти образования вовлекаются в процесс, подвергаются патологическим изменениям, а потому в большей или меньшей степени нарушают функцию также в определенной степени пораженных клапанов.
Сухожильные нити наподобие клапанов состоят из фиброзной, бедной клетками ткани, покрытой весьма тонким слоем эндокарда. Переходя в ткань клапанных створок, фиброзная ткань нитей веерообразно распределяется в фиброзной пластинке створки. От каждой папиллярной мышцы отходит по одной или несколько сухожильных нитей, которые прикрепляются к свободным краям створок или реже — к их желудочковой поверхности.
Пучок нитей от каждой папиллярной мышцы разделяется в левом желудочке на две части, из которых одна идет к задней створке, другая — к передней. Распределение прикрепления нитей к створкам в правом желудочке не так четко выражено. Большое количество тонких сухожильных нитей начинается непосредственно от мускулатуры желудочков и идет к разным частям клапанов. Сухожильные нити левого желудочка толще и многочисленнее правого.
Если все нити одинаково напряжены, то створки клапанов равномерно растягиваются (А. М. Елисеева, 1948).
Естественно, что при эндокардитах воспалительный процесс может переходить и на сухожильные нити; клапанные створки подвергаются изменениям со своими сухожильными нитями. В результате организации тром-ботических масс и склероза происходит утолщение, укорочение, огрубение и уплотнение сухожильных нитей. Иногда соседние сухожильные нити спаиваются между собой или вследствие организации окутывающих их тромботических масс, или вследствие разрастания соединительной ткани со стороны клапанов.

В этих случаях могут образовываться соединяющие пластинки наподобие плавательных перепонок лапки лягушки. Процесс склероза может захватывать и верхушки сосочковых мышц. При язвенных эндокардитах процесс переходит на сухожильные нити, приводит к их разрушению, разрывам. Иногда все сухожильные нити одной створки оказываются разорванными.
Важная роль в обеспечении нормальной функции атриовентрикулярных клапанов принадлежит сосочковым (папиллярным) мышцам. Мышцы эти в левом желудочке сравнительно больших размеров, нем в правом. При напряжении папиллярных мышц соседние края створок сближаются.
При воспалении миокарда те же процессы наблюдаются и в сосочковых мышцах. В первую очередь и наиболее сильно поражаются основания папиллярных мышц. Склероз и гибель мышечной ткани также резче выражены в папиллярных мышцах, нежели в остальном миокарде. Сказанное подтверждают и данные М. А. Скворцова (1950).
Распространение язвенного эндокардита или гнойного миокардита может привести к разрушению сосочковых мышц, к их отрыву. Такую же патологию может вызвать инфаркт стенки желудочка с захватом сосочковой мышцы или с ограниченным ее некрозом. Чаще всего это бывает с задней сосочковой мышцей левого желудонка. На вскрытии находят обрывок мышцы, свободно свисающий на сухожильных нитях (Э. М. Гельштейн, 1951).
Разрыв или даже полный отрыв клапана, сухожильных нитей, а также сосочковых мышц может наблюдаться и без деструктивных процессов в эндокарде или миокарде — вследствие знанительных физических напряжений, резких ушибов и сдавлений груди, падения с высоты, прямых травм сердца. Эти же причины могут вызвать разрыв стенок сердца и крупных сосудов. Травматический разрыв сердца особенно легко наступает при патологических изменениях в миокарде на почве миокардита, кардиосклероза, аневризм (В. Н. Сиротинин, 1913; А. Фохт, 1920).
Патологические процессы, ведущие к склерозу клапанных аппаратов (створок, отверстий, сухожильных нитей и их мышц), лежат в основе той патологии, которую принято называть пороками сердца или, точнее, пороками клапанных аппаратов сердца. Поражение клапанов приводит к большему или меньшему нарушению работы сердца, вследствие чего развивается более или менее выраженная недостаточность кровообращения.
Разрыв аорты: что это такое, причины, описание симптомов, лечение, прогноз
Разрыв аорты – это полное или частичное повреждение стенок магистрального сосуда сердца.
Общие данные
Разрыв аорты – тяжелейшая сосудистая патология, входящая в число десяти наиболее опасных для жизни состояний. Смертность от разрыва аорты достигает 90%, и даже хирургическое вмешательство, проведенное вовремя, не всегда бывает успешным.
По статистике, за последние несколько десятилетий частота разрывов главного сосуда человеческого организма возросла в 7 раз. Спасти пациента с таким состоянием несоизмеримо сложнее, чем при многих других потенциально смертельных заболеваниях – инфаркте миокарда, кровоизлиянии в мозг и т. д. Если диагностировать изменения в аорте, чреватые разрывом, вполне возможно, то предотвратить их современная медицина пока бессильна.
Аорта – самый крупный и, без преувеличения, главный сосуд тела человека, который, доставляя кровь ко всем без исключения внутренним органам, испытывает огромную нагрузку, а объем крови, ежеминутно протекающий по аорте, довольно велик. Работая непрерывно и с большим напряжением, аорта подвержена разного рода патологическим изменениям, но настоящей проблемой последних десятилетий стал атеросклероз, выбирающий аорту в качестве основной мишени для поражения.
Причины и механизм развития
Основной причиной разрыва аорты является травма. В случае тупой травмы, обычным механизмом является тяжелая травма, такая, как при резком торможении транспортного средства; у пациентов часто присутствуют множественные переломы ребер, переломы 1-го и/или 2-го ребер, или другие проявления тяжелой травмы грудной клетки.
При проникающей травме, рана обычно пересекает средостение (например, входное отверстие раны располагается между сосками или лопатками).
Аорта имеет довольно мощную стенку, способную выдержать высокое давление и скорость движения крови, поэтому спонтанные разрывы сосуда не происходят. Для нарушения целостности стенки аорты нужны серьезные причины, в числе которых:
Травмы грудной клетки или брюшной полости могут привести к разрыву даже не поврежденной изначально аорты, но имеющийся атеросклероз, повышенное давление, врожденные аномалии многократно увеличивают такую возможность. Разрывы происходят в результате дорожно-транспортных происшествий, ножевых ранений, падений с высоты. Обычно такие разрывы сопровождаются повреждениями и других внутренних органов.
Атеросклероз и артериальная гипертензия – основные факторы риска нетравматических разрывов аорты. На фоне этих заболеваний обычно формируется аневризма, то есть локальное расширение просвета сосуда до двух и более раз с истончением стенки.
Атеросклероз поражает все отделы аорты, но наиболее активен он в брюшной части, где высока скорость кровотока, и ввиду отхождения крупных артериальных стволов образуются турбулентные токи крови, способствующие постоянному травмированию внутреннего слоя (интимы) сосуда. Липидные бляшки разрушают стенку аорты, деформируют и истончают ее, отложение солей кальция делает сосуд очень хрупким и уязвимым. При прогрессирующем атеросклерозе на фоне высокого давления крови просвет артерии увеличивается, и возникает аневризма.
На долю атеросклеротических аневризм брюшной части приходится до 95% случаев расширений сосуда. Особое место в числе причин занимает расслаивающая аневризма, причиной которой может стать артериальная гипертензия, и особенно плохим считается сочетание гипертонии с атеросклерозом. Повышенное артериальное давление вызывает микротравмы интимы аорты и ее разрывы, кровь устремляется под внутренний слой, постепенно его отслаивая на различном протяжении. При такой аневризме больной в буквальном смысле живет «на пороховой бочке», способной «рвануть» в любой момент, ведь и в зоне аневризмы продолжается постоянный кровоток.
Воспалительные процессы в виде сифилитического мезаортита, неспецифического артериита, грибкового поражения вызывают формирование так называемых воспалительных аневризм, которые тоже чреваты разрывом аорты.
Врожденные аневризмы возникают при несостоятельности соединительной ткани организма по причине генетических аномалий. Яркий пример тому – синдром Марфана, когда обнаруживаются аневризмы многих сосудов и другие пороки внутренних органов.
Риск разрыва аневризмы аорты зависит от ее строения, объема и причины. Так, выделяют мешковидные и веретеновидные аневризмы. Мешковидные образования представляют собой очаговое выпячивание одной из стенок сосуда, а веретенообразные – диффузный процесс, затрагивающий весь периметр аорты. Мешковидные расширения часто заполнены тромботическими наложениями, укрепляющими истонченную сосудистую стенку, поэтому шансов разорваться больше у веретенообразной аневризмы.
Стадии и виды патологии
Травма ассциирована со временем. А вот расслоение аорты может поразить любой ее отдел:
В зависимости от отдела, целостность которого нарушена, из-за разрыва аорты могут быть осложнения работы различных внутренних органов.
Расслоение этого важного сосуда происходит в несколько этапов:
В зависимости от того, как быстро развивается патология, выделяют 3 ее формы:
Наиболее благоприятный прогноз врачи дают при хронической форме, так как в этом случае можно вовремя оказать пациенту необходимую помощь. При острой быстротекущей форме разрыва аорты (сосуд может полностью разорваться даже за сутки) медики зачастую начинают действовать слишком поздно.
Симптомы
Пациенты обычно ощущают боль в груди. Признаки могут включать в себя дефицит пульса верхних конечностей, грубый систолический шум над прекордиальной областью или задним межлопаточным пространством, охриплость голоса, а также симптомы нарушения кровотока в нижних конечностях, в том числе снижение наполнения пульса или АД в нижних конечностях по сравнению с верхними конечностями.
Признаки разрыва аорты могут быть вариабельными и зависят от первопричин развития этой сосудистой катастрофы. Независимо от факторов, вызывающих массивное кровоизлияние, итогом разрыва самой крупной артерии становится острая кровопотеря и развивающийся шок.
В зависимости от места локализации разрыва симптомы разделяют на:
При разрывах восходящего отдела аорты у больного возникают следующие проявления:
При разрывах грудного отдела появляются следующие симптомы:
При разрывах аорты в брюшном отделе у пострадавшего возникают симптомы «острого живота»:
После начала излития крови в брюшную полость у больного нарастают признаки шока:
В зависимости от стадии заболевания и его локализации, оно может проявляться различными признаками:
Диагностика
Предупредить разрыв аорты могут своевременные исследования, которые проводятся в плановом порядке. Они показаны группам лиц, у которых существует высокий риск развития аневризмы аорты:
Предрасположенность к разрыву аорты может обнаруживаться при проведении следующих исследований:
Исследования визуализации аорты
Диагноз следует подозревать у пациентов с наличием соответствующих механизмов протекания заболевания или результатов исследований. Для уточнения диагноза выполняют рентгенографию грудной клетки.
Заболевание следует подозревать в случае получения следующих результатов рентгенографии грудной клетки:
Однако некоторые симптомы при рентгенографических исследованиях грудной клетки могут проявляться не сразу. Кроме этого, такие исследования или их комбинация не являются достаточно чувствительными или специфическими; таким образом, многие специалисты рекомендуют проведение исследований визуализации аорты для всех пациентов с тяжелой травмой в результате торможения, даже при отсутствии вызывающих подозрение результатов при обследовании или рентгенографии грудной клетки.
Выбор вида исследования визуализации аорты варьирует в зависимости от возможностей медицинского учреждения. Исследования, которые дают достаточно точные результаты, включают следующее:
Методы лечения пульсирующих гематом и ложных аневризм периферических артерий после рентгенэндоваскулярных вмешательств

В работе проведен анализ методов лечения 87 больных с ложной аневризмой и пульсирующей гематомой периферических артерий после рентгенэндоваскулярных вмешательств. Всем пациентам с пульсирующей гематомой лечение начиналось с локальной компрессии давящей по
87 cases of peripheral artery false aneurysm and pulsating hematoma after endovascular interventions were analyzed. For all patients with pulsating hematoma, the treatment began with local compression with a pressure bandage. The compression efficiency was 89.2%. Attempts of local compression in patients with false aneurysms were not successful and all the patients were operated. Surgical treatment was effective in 100% of false aneurysm cases. The effectiveness of treatment was influenced by: the patient’s intake of anticoagulant and disaggregant drugs, constitutional features of the patient, arterial hypertension, localization and diameter of the post-puncture artery defect. Definitions of pulsating hematoma and false aneurysm of peripheral arteries are formulated.
Эндоваскулярные вмешательства, несмотря на ряд преимуществ перед открытым хирургическим лечением, являются инвазивными методиками и предполагают такие осложнения, как пульсирующие гематомы и ложные аневризмы периферических сосудов, причем их количество увеличивается пропорционально распространению ангиографических методов диагностики и лечения [1, 3–7]. По данным литературы в структуре местных осложнений после пункции артерии ложные аневризмы занимают 60–80% [5]. Для снижения частоты осложнений в настоящее время чаще используют трансаксиллярный, трансбрахиальный и трансрадиальный доступы, ушивающие инструменты. Однако и при таких доступах и развитии эндоваскулярных технологий отмечены повреждения пунктируемой артерии [4–7]. На сегодняшний день актуальными видами лечения пульсирующих гематом и ложных аневризм являются хирургический и компрессионный методы с различными их модификациями [1, 3–5].
Цель работы: проанализировать результаты хирургического и компрессионного методов лечения ложных аневризм и пульсирующих гематом периферических артерий после эндоваскулярных вмешательств.
Материалы и методы исследования
Проанализированы результаты лечения 87 больных с пульсирующими гематомами и ложными аневризмами, находившихся в институте им. Н. В. Склифосовского с 2010 г. по январь 2018 г., в возрасте от 40 до 83 лет. У всех пациентов причиной патологии являлись эндоваскулярные вмешательства, 69 (79,3%) из которых выполнены в других лечебных учреждениях, с последующим поступлением по экстренным показаниям в сроки после манипуляций от 4 суток до 2 месяцев. Большая часть ложных аневризм (23 (88,5%) из 26 случаев) выявлена у пациентов с выполненными эндоваскулярными вмешательствами на коронарных артериях, причем у 14 (53,8%) больных с ложной аневризмой из 23 пациентов было выполнено стентирование коронарных артерий на фоне приема дезагрегантных препаратов (клопидогрел (Плавикс)).
Локализация повреждения: бедренная артерия в 75 случаях (86,2%), подмышечная артерия — 9 (10,3%), плечевая артерия — 2 (2,3%), в одном случае лучевая артерия. Из подтвержденной сопутствующей патологии артериальная гипертензия отмечена у 79 пациентов (90,8%); ожирение II–III степени у 21 (24,1%); сахарный диабет 2 типа средней тяжести у 25 (28,7%); атеросклеротический постинфарктный кардиосклероз у 44 пациентов (50,6%). Атеросклероз артерий нижних конечностей (гемодинамически значимые стенозы/окклюзия поверхностной бедренной артерии) выявлен у 38 больных (43,7%). Прием антикоагулянтных (варфарин, Ксарелто) и дезагрегантных препаратов (клопидогрел (Плавикс, Зилт)) до эндоваскулярных вмешательств отмечен у 61 (70,1%) пациента из 87.
Диагноз ложной аневризмы был установлен 26 (29,9%) больным, пульсирующей гематомы — 61 (70,1%).
При опросе пациентов при поступлении и первичном осмотре обращали внимание на наличие болезненности и припухлости в области выполненной пункции, пульсирующего образования и изменения кожных покровов над ним, систолического шума в области образования. При анализе анамнеза каждого пациента уделяли внимание таким моментам, как давность и объем эндоваскулярного вмешательства; сроки пребывания в стационаре. Ультразвуковое исследование было первым и основным этапом инструментального обследования пациентов. Исследование проведено на ультразвуковой системе Philips iU 22 мультичастотными линейными датчиками L9 — 3 МГц, L15 — 7 МГц.
При выполнении ультразвукового исследования оценивали размеры и количество полостей; длину и диаметр шейки ложной аневризмы (сообщение с сосудом), размер дефекта стенки сосуда, наличие атеросклеротических бляшек в просвете пунктированной артерии (рис. 1).
.png)
Под пульсирующей гематомой понимали пульсирующее опухолевидное образование (до 3,0 см в диаметре) в области пункции с экхимозом и болью в области пункции в сроки от 2–5 суток после вмешательства или ограниченное/диффузное выпячивание сосудистой стенки либо полость, образовавшуюся около стенки сосуда, сообщающуюся с ее просветом в сроки от 2 до 5 суток после манипуляции. Постпункционной ложной аневризмой считали патологическую полость в окружающих тканях, образовавшуюся путем организации околососудистой гематомы вследствие дефекта артериальной стенки и сообщающейся с просветом артерии, в сроки после 17 дней с момента манипуляции.
Результаты исследования
.png)
Открытое хирургическое лечение выполнено 31 (35,6%) больному, из них 26 пациентов с ложной аневризмой (рис. 5–6) и 5 с пульсирующей гематомой. Сроки выполнения реконструктивной сосудистой операции варьировались от 1 часа до 7 суток. Структура оперативных вмешательств: сосудистый шов артериального дефекта — 28 (90,3%); реконструкция артерии — 3 (9,7%). У всех пациентов удалось добиться восстановления целостности сосуда.
На исход лечения влияли: прием дезагрегантных и антикоагулянтных препаратов и их дозировка до и после эндоваскулярных вмешательств; конституциональные особенности больного, артериальная гипертензия, атеросклеротическое поражение артерии. Положительный исход компрессионного лечения зависел также от величины дефекта артерии, который оценивали по данным ультразвукового метода. При размере дефекта 1–2 мм положительный результат у 46 (92%), при размере 2,1–3 мм — у 4 больных (8%). Эффективность оперативного лечения составила 100%. В послеоперационном периоде был один летальный исход вследствие декомпенсации основного заболевания на фоне до- и интраоперацонной кровопотери; у одного пациента развилась ишемическая гангрена нижней конечности (декомпенсированное кровообращение при поступлении (сахарный диабет)); у трех пациентов отмечалась кожная гиперестезия с последующим регрессом симптоматики через один месяц. Несостоятельности кожных швов, нагноений, лимфорреи, кровотечения из послеоперационной раны не было.
Обсуждение
.png)
Выводы
Литература
Ю. А. Виноградова 1
Л. С. Коков, доктор медицинских наук, профессор, член-корреспондент РАН
И. П. Михайлов, доктор медицинских наук, профессор
В. П. Кирющенков
Е. В. Трошкина
ГБУЗ НИИ СП им. Н. В. Склифосовского ДЗМ, Москва
Методы лечения пульсирующих гематом и ложных аневризм периферических артерий после рентгенэндоваскулярных вмешательств/ Ю. А. Виноградова, Л. С. Коков, И. П. Михайлов, В. П. Кирющенков, Е. В. Трошкина
Для цитирования: Лечащий врач № 7/2018; Номера страниц в выпуске: 21-24
Теги: периферические артерии, осложнения, диагностика, стентирование
Что такое разрыв сердца
Тупая травма клапанов, сосочковых мышц сердца. Диагностика, лечение
Тупое повреждение сердца изредка вызывает клапанные повреждения. Клапаны могут быть разорваны вследствие прямой передачи энергии на грудину. Наиболее часто травмируется аортальный клапан, затем следует митральный. Классические признаки, связанные с клапанной дисфункцией, могут не быть немедленно распознаны из-за наличия более очевидных опасных для жизни повреждений.
Гиповолемия и уменьшение минутного сердечного выброса могут еще более скрыть степень клапанного повреждения, пока сердечный выброс не будет восстановлен. Важные клинические признаки включают наличие новых сердечных шумов, дрожания или громких музыкальных шумов. Столь же важными клиническими проявлениями являются острая левожелудочковая недостаточность с кардиогенным шоком и отеком легких.
Симптомы клапанной недостаточности являются основанием для немедленного начала дальнейших диагностических исследований в соответствии с клиническим статусом пациента.
Быстрое перемещение крови вследствие приложения к грудной клетке раздавливающих или сдавливающих усилий во время диастолы желудочков может разорвать створки клапанов сердца, сосочковые мышцы или сухожильные хорды, приводя к клапанной недостаточности. При этом механизме наиболее часто повреждается аортальный клапан. Чаще всего повреждается левая коронарная или некоронарная аортальная створка.
Повреждения митрального клапана могут также развиться через тот же самый механизм во время периода максимального диастолического заполнения. Сходным образом, любое внезапное увеличение внутриаортального давления может привести к разрыву или прорыву створки и может также вызвать растяжение и формирование гематомы в сосочковой мышце.
Внезапные нарушения анатомии сосочковой мышцы делают ее нефункциональной и могут вызвать клапанную недостаточность. Острая тяжелая левожелудочковая недостаточность с сопутствующим увеличением давления заклинивания в легочных капиллярах, наряду с уменьшением соотношения сердечный выброс/сердечный индекс, вместе с индексом систолической работы левого желудочка сигнализируют о наличии повреждения клапана, сухожильной хорды или дисфункции сосочковой мышцы.
Fulda в исследовании 59 пациентов с тупой травмой сердца, сообщил об отсутствии клапанных повреждений. Perchinsky в серии из 27 пациентов также не нашел ни одного случая клапанного повреждения. Parmley, в серии из 546 вскрытий сообщил о четырех пациентах с разрывами аортального клапана, в двух случаях двухстворчатые капаны были врожденными.
Кроме того, он сообщил о восьми пациентах, у каждого из которых был разрыв митрального и трехстворчатого клапана, об одном пациенте с разрывом легочного клапана и еще об одном, который имел комбинированное повреждение митрального и трехстворчатого клапана.
Разрывы перегородки также нечасты. В 1847 г. Hewett первым описал разрыв межжелудочковой перегородки, вызванный тупой травмой. В 1935 г. Bright и Beck описали 11 пациентов с разрывом перегородки в серии из 152 пациентов с фатальным повреждением сердца. В 1953 г. Guilfoil сообщил о первом пациенте, у которого дефект перегородки был диагностирован при катетеризации сердца.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021

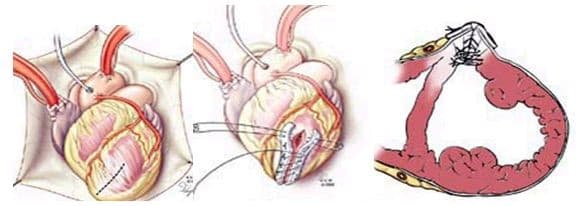
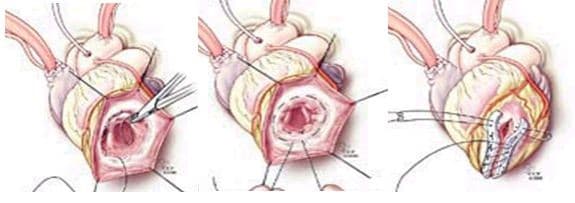
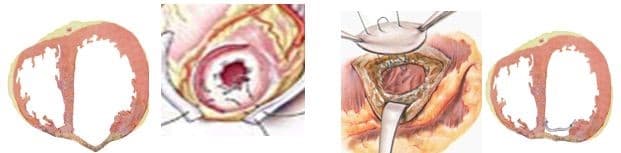




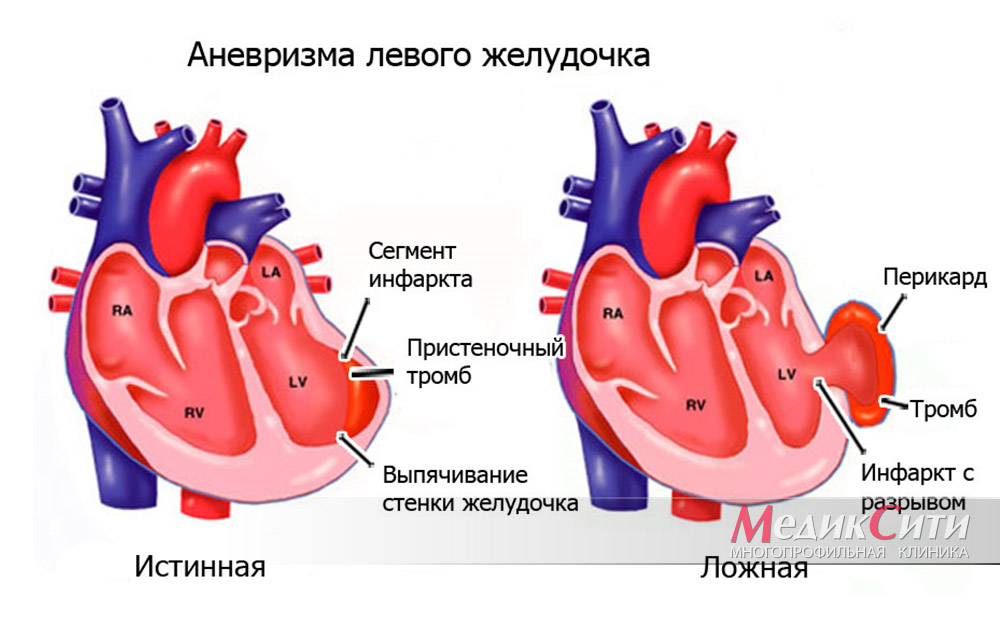


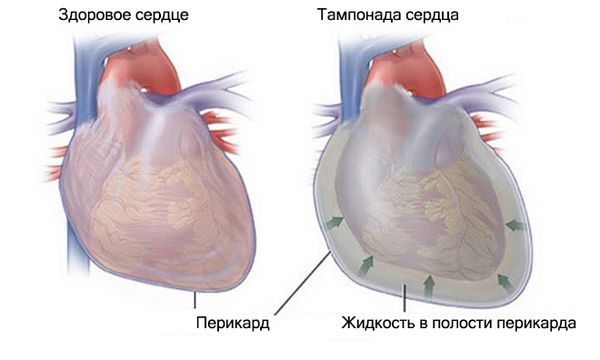
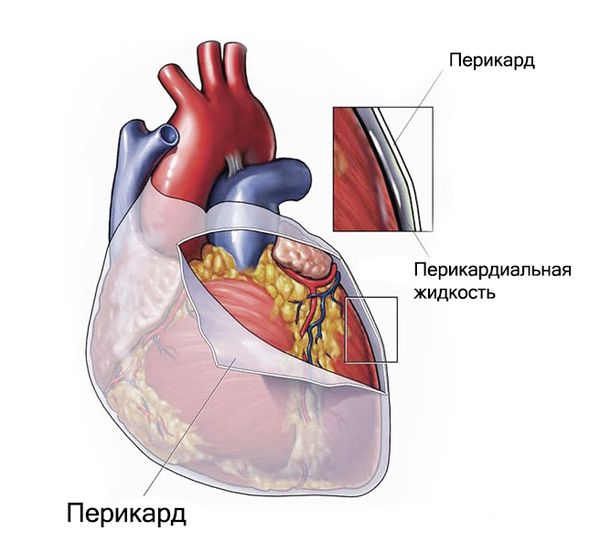
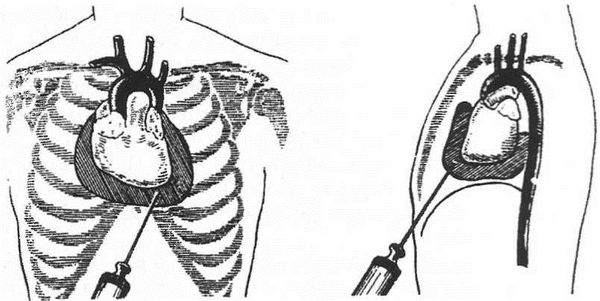

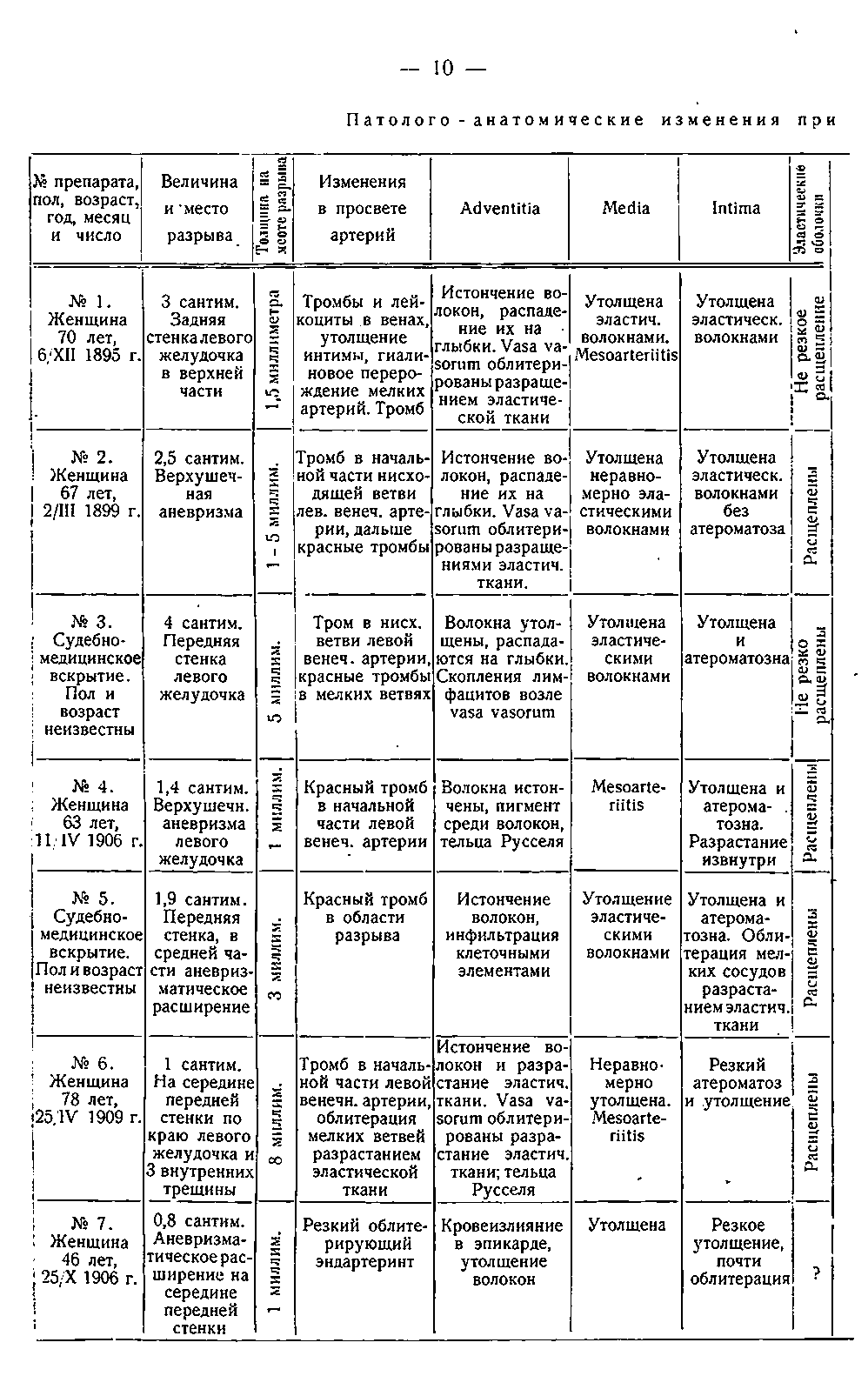
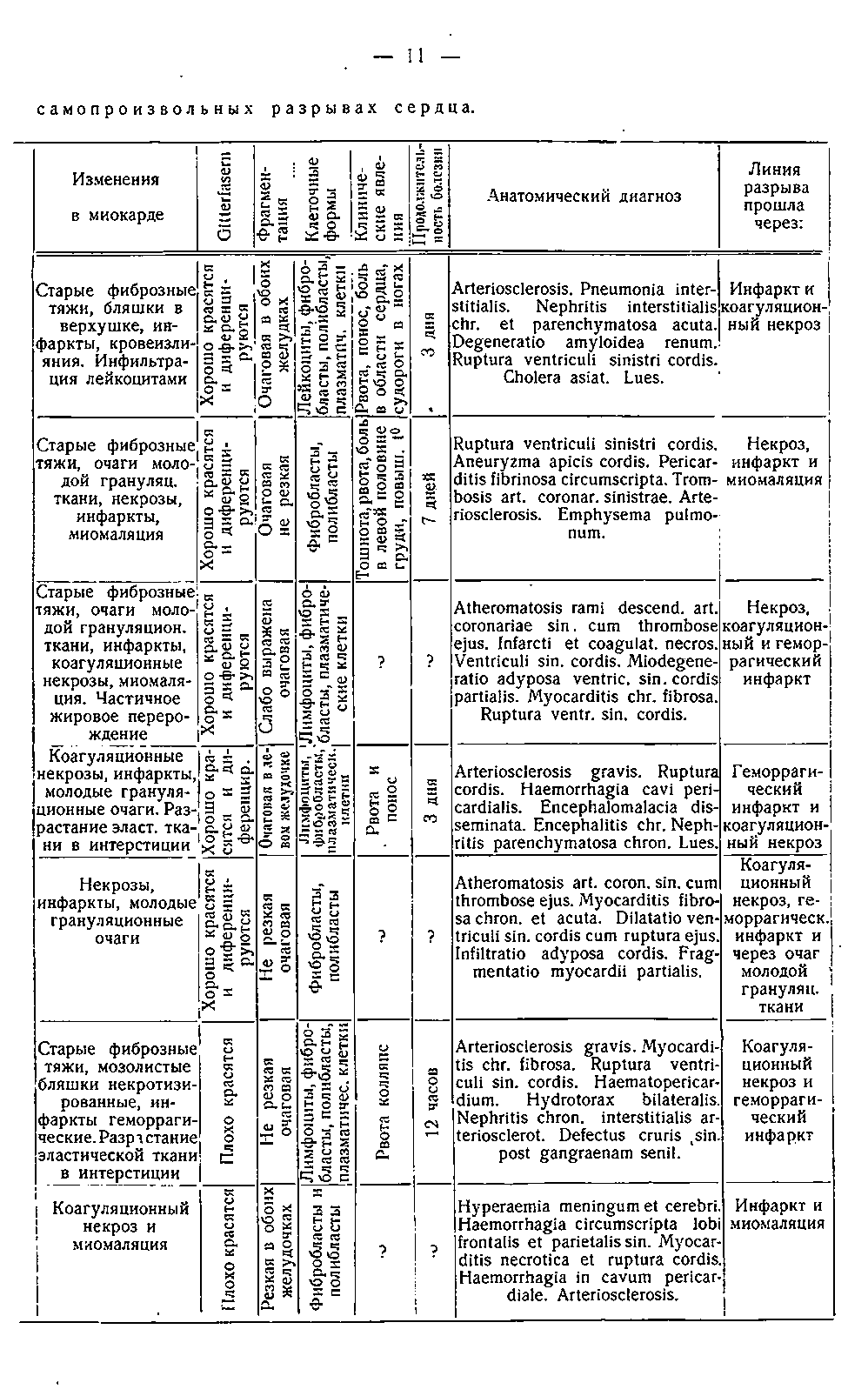

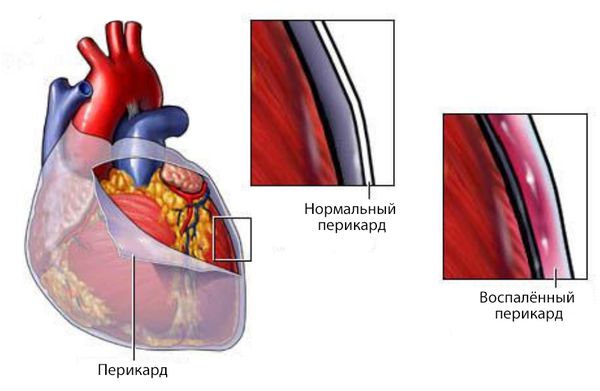
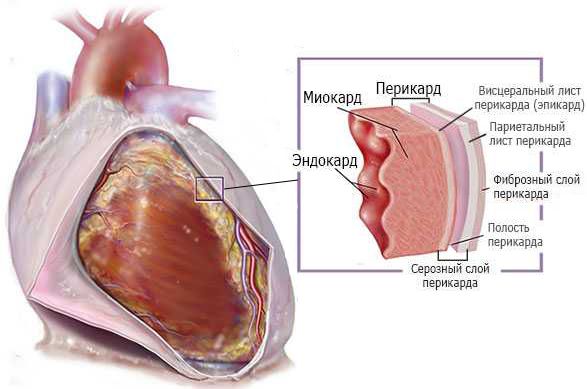
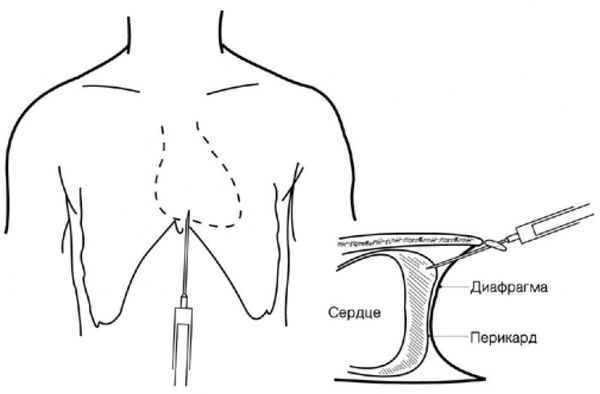






.png)
.gif)
.png)