Что значит интравагинально
Что значит интравагинально
УЗИ с интравагинальным датчиком, запись на прием в Москве
УЗИ с интравагинальным датчиком – распространенное исследование. Проводится оно в области малого таза. С его помощью можно определить наличие патологий в области внутренних половых органов, беременности первых недель.
УЗИ с интравагинальным датчиком: основные медицинские предпосылки

Сегодня существует множество показаний к осуществлению осмотра при помощи ультразвукового оборудования, оснащенного особыми датчиками. Сюда относятся:
• наличие беременности вне матки;
• определение патологий и эффективности лечения;
• выявление бесплодия и его причин;
• систематические болезненные ощущения в нижней части живота;
• избыточный вес.
УЗИ с интравагинальным датчиком особенности проведения обследования
УЗИ с интравагинальным датчиком преобладает над иными методиками исследований благодаря отсутствию противопоказаний. Молодых девушек, не имеющих опыта половой жизни, осматривают посредством введения датчиков в прямую кишку, а женщин – через влагалище.
На прием к доктору необходимо принести одноразовую пеленку, кусок ткани или полотенце. Беременным рекомендуется перед исследованием употребить около полулитра воды. УЗИ с интравагинальным датчиком желательно осуществлять при отсутствии вздутия. Предотвратить образование газов можно путем коррекции меню за два дня до обследования. В некоторых случаях уместен прием медицинских препаратов в виде сорбентов. Использование клизмы запрещено. Соблюдая все рекомендации, можно получить наиболее правдивые результаты.
УЗИ с интравагинальным датчиком назначается на период первой половины цикла. Если наблюдается эндометриоз, то диагностирование показана во второй фазе. Длительность процедуры варьируется от 15 до 20 минут.
УЗИ с интравагинальным датчиком: особенности расшифровки полученных данных
УЗИ с интравагинальным датчиком позволяет дать оценку таким показателям, как месторасположение матки и ее объемы, характер структуры тканей, размеры яичников. Оптимальным вариантом считается нахождение органа в положении anteflexio. Если наблюдается ретрофлексия, то вполне вероятно наличие бесплодия либо беременности вне матки.
УЗИ с интравагинальным датчиком, показывающее ровные и максимально четкие контуры репродуктивного органа, считается идеальным. Присутствие смытых линий свидетельствует о воспалительном процессе. Оптимальные параметры матки: длина 70 мм, ширина 10 мм меньше, а диаметр – 42 мм. Сниженные результаты определяют наличие инфантильности. Превышение параметров говорит о беременности, опухолевых процессах, миоме. Иные показатели расшифрует врач.
УЗИ с интравагинальным датчиком может носить профилактический характер. Обследование назначается дамам старше сорока лет. Периодичность проведения исследования составляет один раз в 6-12 месяцев.
Комплексная противовоспалительная, биокоррегирующая, топическая терапия острого бактериального вагинита
Статья посвящена результатам простого открытого сравнительного клинического исследования эффективности и безопасности лечения больных острым неспецифическим вагинитом, ассоциированным с условно-патогенными микроорганизмами. Проведена оценка эффективности
Совершенствование терапии бактериальных вагинитов остается важной медико-социальной проблемой, что связано с устойчиво высоким уровнем заболеваемости этими инфекциями в Российской Федерации, а также высокой долей вероятности и способности их к хронизации и частому рецидивированию [1, 2]. Назначение безопасной лекарственной терапии пациенткам с острыми вагинитами остается одной из актуальных задач современной дерматовенерологии [2, 3].
В большинстве случаев (90%) при бактериальных вагинитах, протекающих на фоне сниженной резистентности, среди возбудителей преобладают представители энтеробактерий: Escherichia coli, Enterococcus spp., Enterobacter spp., Klebsiella spp. и другие представители семейства. Вместе с ними обнаруживают Staphylococcus aureus, Streptococcus group B, Diphtheroides spp. и др. на фоне уменьшения количественного титра лактобактерий, которое ведет к сдвигу рН влагалищного содержимого в щелочную сторону, изменению химического состава вагинального секрета, его иммунологических свойств. Это, в свою очередь, способствует преобладающему росту условно-патогенной флоры [4–7].
Изменение местных защитных реакций происходит за счет антимикробных факторов — секретов слизистых оболочек, таких как секреторные антитела и лизоцим, способных разрушать пептидогликановый слой клеточной стенки многих бактерий. При контакте с антителами и комплементом лизоцим может инициировать лизис бактерий, уже обладающих устойчивостью к другим воздействиям [8, 9]. Данное утверждение предопределяет необходимость назначения одновременной комплексной коррекции микробиоценоза биотопа влагалища антибактериальными средствами в совокупности с заместительной терапией, обладающей способностью стимулировать механизмы местного иммунитета, то есть естественную неспецифическую реактивность, и оказывать противовоспалительное и муколитическое действие, за счет содержания антибактериальных ферментов [10, 11].
Для лечения воспалительных заболеваний данной группы в клинической практике врача применяются различные лекарственные препараты как специфического, так и неспецифического действия, обладающие антибактериальной активностью [1–3].
Целью настоящего исследования было разработать новый метод лечения острых вагинитов, ассоциированных с условно-патогенными микроорганизмами, основанный на топическом воздействии на этиологический агент, для минимизации побочных эффектов и нежелательных явлений, связанных с системной антибактериальной терапией.
Материалы и методы исследования
Для оценки эффективности применения местной комплексной терапии острых вагинитов и обоснования альтернатив существующей общей антибиотикотерапии проведено простое открытое сравнительное клиническое исследование эффективности и безопасности лечения больных острым неспецифическим вагинитом, ассоциированным с условно-патогенными микроорганизмами. Исследование включало три периода: период обследования (0–3 день) — клинико-лабораторная характеристика исходного заболевания; период активного лечения (7 ± 1 день), период диспансерного наблюдения (15 ± 2 дня) содержал клинико-лабораторный контроль излеченности и анализ переносимости комплексного лечения и наблюдаемых неблагоприятных явлений во время терапии.
Изначально было обследовано 110 пациенток от 18 до 45 лет, средний возраст больных составил 29,5 ± 5,5 лет. После исключения пациенток с урогенитальным кандидозом, бактериальным вагинозом и инфекциями, передаваемыми половым путем (ИППП), в исследовании осталось 83 обследованных с диагнозом «острый вагинит, обусловленный условно-патогенными микроорганизмами».
Диагноз «бактериальный вагинит, острое течение» выставлялся на основании длительности заболевания до двух недель и клинико-лабораторных критериев острого вагинита: наличия жалоб и характерных симптомов (патологические выделения из половых путей и их скопление в заднем своде влагалища, зуд, жжение, гиперемия, отечность слизистой оболочки половых органов); при микроскопическом исследовании увеличение количества полиморфноядерных лейкоцитов более 10 в поле зрения), при бактериологическом исследовании (посев на питательные среды) определяли качественный и количественный состав микроорганизмов вагинального биотопа и характер их ассоциаций. Результат видовой идентификации условно-патогенных микроорганизмов расценивается клинически значимым в патогенную составляющую при количественном титре более 10 4 КОЕ/мл.
Критерии включения пациенток в исследование: отсутствие ИППП; отсутствие признаков урогенитального кандидоза; отсутствие симптомов бактериального вагиноза; наличие установленного диагноза «острый бактериальный вагинит, обусловленный условно-патогенной флорой»; репродуктивный возраст от 18 до 45 лет; наличие подписанного и датированного информированного согласия пациента на участие в исследовании.
Критерии исключения пациенток из исследования: наличие ИППП или урогенитального кандидоза, бактериального вагиноза; гиперчувствительность к хлорамфениколу; гиперчувствительность к компонентам препарата Бифилиз; беременность и кормление грудью; прием антибактериальных препаратов менее чем за две недели до исследования; применение интравагинально лекарственных средств для восстановления микрофлоры влагалища менее чем за две недели до исследования; детский возраст; участие в другом исследовании за последние 30 дней.
Критерии эффективности проводимой терапии:
1. Выраженный эффект (выраженное улучшение после лечения):
а) отсутствие субъективной симптоматики;
б) объективно — отсутствие клинических признаков вагинита;
в) при микроскопии окрашенных мазков — лейкоциты единичные в поле зрения, отсутствие клеток условно-патогенной микрофлоры;
г) при посеве на питательные среды — стабильный рост лактопродуцирующей микрофлоры в титре более 10 7–9 КОЕ/мл и отсутствие роста условно-патогенной микрофлоры.
2. Удовлетворительный эффект (улучшение после лечения):
а) уменьшение субъективной симптоматики;
б) объективно — уменьшение клинических признаков вагинита;
в) при микроскопии окрашенных мазков — количество лейкоцитов до 10 в поле зрения, присутствие незначительного количества клеток условно-патогенных микроорганизмов;
г) при посеве на питательные среды — стабильный рост лактопродуцирующей микрофлоры в титре более 10 5–7 КОЕ/мл и умеренный рост условно-патогенной микрофлоры в титре не более 10 4 КОЕ/мл.
3. Неудовлетворительный эффект — отсутствие динамики, и/или ухудшение субъективной и объективной симптоматики, и/или отсутствие динамики результатов лабораторных тестов.
Все пациентки (n = 83) были рандомизированы методом случайных чисел на две группы (табл. 1). До назначения лечения группы были сопоставимы по клиническим и лабораторным признакам. Достоверности различий (р > 0,05) до назначения терапии у пациенток обеих групп получено не было, что подтверждает гипотезу об однородности исследуемых групп.
Статистический анализ данных проводился согласно общепринятым методам (J. H. Zar, 2010) c использованием лицензионной программы Stata 12 (StatCorp, USA). Для признаков приведены абсолютные значения и доля в процентах от числа всех наблюдений ± стандартная ошибка доли. Для всех статистических критериев ошибка первого рода устанавливалась равной 0,05. Нулевая гипотеза (отсутствие различий) отвергалась, если вероятность (р) не превышала ошибку первого рода.
Пациенткам первой группы, при бактериальном вагините, ассоциированном с E. coli, Enterococcus spp., Klebsiella spp., S. aureus, Streptococcus spp., Staphylococcus spp. в диагностически значимых титрах при снижении количества или отсутствия Lactobacillus spp., назначали местную терапию, включающую использование отечественного бактериостатического антибактериального препарата хлорамфеникол с широким спектром действия из группы левомицетина Синтомицин суппозитории вагинальные 250 мг № 10 (Россия). Регистрационный номер: ЛСР-004426 (МНН — хлорамфеникол). Хлорамфеникол (Синтомицин) активен в отношении грамположительных бактерий: Staphylococcus spp., Streptococcus spp.; грамотрицательных бактерий: Neisseria gonorrhoeae, Neisseria meningitidis, Escherichia coli, Haemophilus influenzae, Salmonella spp., Shigella spp., Klebsiella spp., Serratia spp., Yersinia spp., ряда штаммов Proteus spp., Rickettsia spp. Суппозитории Синтомицин получали 1 раз в сутки на ночь интравагинально.
В комплексе назначали препарат Бифилиз суппозитории вагинальные № 10 (Россия) Регистрационный номер: ЛС-001602 (МНН — бифидобактерии бифидум и лизоцим), который обладает антагонистической активностью в отношении условно-патогенных и ряда патогенных микроорганизмов в сочетании с антибактериальным и противовоспалительным действием лизоцима, стимулирующим метаболические, репаративные и иммунокорректирующие процессы во влагалище, нормализующие микрофлору влагалища. Терапевтический эффект препарата обусловлен наличием в его составе бифидобактерий, действие которых направлено на нормализацию лакто- и бифидомикрофлоры, и лизоцима в качестве естественного фактора защиты вагинальной среды. Назначался 2 раза в сутки утром и днем. Курс комплексного интравагинального лечения составлял 7 дней.
Результаты и их обсуждение
При оценке динамики жалоб, клинических симптомов, результатов лабораторного обследования (микроскопии вагинального мазка (табл. 2) и выделенному спектру микроорганизмов вагинального экссудата) в группах до и после лечения получены следующие данные.
После проведения семидневного курса интравагинальной терапии комплексом препаратов, обладающих совокупностью лекарственных свойств: антибактериальное, биовосстановительное и стимулирующее факторы неспецифического иммунитета в I группе и антибактериальным препаратом фторхинолонового ряда во II группе, дана сравнительная клинико-лабораторная характеристика эффективности применяемых видов лечения по предъявляемым жалобам пациенток, клиническим симптомам вагинита, результатам лабораторных исследований.
Достоверно установлено (р 0,05), что подтверждает однородность исследуемых групп.
Сопоставимые данные были получены при анализе бактериологической картины вагинального отделяемого. В I группе (интравагинальное лечение) достигнута качественная селекция молочнокислой микрофлоры (Lactobacillus spp. в количестве 10 7–9 КОЕ/мл) и подтверждена микробиологическая реконвалесценция в 100% случаев (р = 0,002). Результаты лечения во II группе были значительно хуже. Применение метода системной терапии антибактериальным препаратом фторхинолонового ряда микробиологического излечения по наличию пассажа продуктивных лактобактерий (Lactobacillus spp.) не удалось достичь у 24,4% пациенток (р = 0,01), а их наличие характеризовалось низким количественным титром и недостаточной способностью к пролиферативной активности.
В I группе пролеченных, по совокупности результатов местной терапии, выраженный эффект наблюдали у 95,2%, удовлетворительный эффект наблюдали у 4,8% (табл. 3). В группе лечения пероральным антибактериальным препаратом выраженный эффект от лечения удалось добиться только у 78,0% женщин (р = 0,047), у 2,4% достигнут удовлетворительный эффект (р = 0,963), у 19,5% лечение оказалось слабоэффективным (р = 0,006).
За время проведения исследования пациентки, получавшие интравагинальную терапию (табл. 4), перенесли ее отлично в 100,0% случаев (очень хорошо — 97,6% (р = 0,001) и хорошо — 2,4% (р = 0,004)). Во II группе, получавшей антибактериальную терапию, очень хорошая переносимость отмечена только у половины пациенток (48,9%), хорошая переносимость — у 26,8%, а 24,4% пролеченных пациенток не смогли оценить переносимость приема антибиотика как хорошую (р = 0,002).
Во время лечения пациентками фиксировались все нежелательные явления, которые могли бы наступить после начала приема лекарственной терапии (табл. 5).
Согласно данным табл. 9 среди наблюдаемых неблагоприятных явлений при местной терапии (группа I) женщины отмечали усиление выделений в 28,6% случаев (особенности применения интравагинальных форм препаратов). У большинства пролеченных в данной группе (71,4%) неблагоприятных явлений не наблюдалось (р = 0,001).
Получавшие системную антибактериальную терапию больные II группы отмечали неблагоприятные явления: диспепсию в 68,3% случаев (р = 0,001), диарею — в 14,6% (р = 0,032), тошноту — в 9,8% случаев (р = 0,116).
Выводы
Литература
УрНИИДВиИ МЗ РФ, Екатеринбург
Abstract. The article covers the results of simple open comparative clinical research of effectiveness and safety of treatment of acute nonspecific colpitis associated with opportunistic pathogenic bacterium. Effectiveness of topical complex therapy of acute colpitis is shown, alternatives of existing general therapy by antibiotics are justified.
Что значит интравагинально
Аэробный (неспецифический) вагинит является полимикробным заболеванием, при котором происходит замена анаэробных видов лактобацилл, превалирующих в норме, на аэробные бактерии, главным образом Streptococcus spp., Staphylococcus spp., Enterococcus spp., бактерии семейства Еnterobactеriасеае (E. coli, Klebsiella spp., Citrobacter spp., Enterobacter spp., Serratia spp., Proteus mirabilis, Morganella morganii), с развитием воспалительной реакции.
Распространенность АВ в женской популяции составляет 5–10%, среди беременных она дос-тигает 8,3–12,8%. У женщин с симптомами воспалительных заболеваний полового тракта АВ наблюдается в 23–30% случаев. Наиболее тяжелой формой АВ является десквамативный воспалительный вагинит.
АВ чаще всего выявляется у девочек до периода менархе и у женщин в менопаузальном периоде, когда в силу физиологических причин (низкого уровня эстрогенов, контролирующих обмен гликогена вагинального эпителия) количество лактобацилл снижается. В репродуктивном возрасте основными причинами развития АВ, как правило, являются инфекционные заболевания, эндокринная патология, снижение функциональной активности яичников, воздействие местных повреждающих факторов.
В пожилом и старческом возрасте развитие АВ во многом обусловлено сниженим активности факторов защиты слизистой оболочки влагалища, а именно снижением образования молочной кислоты из гликогена. Замещение условно-патогенными микроорганизмами с преимущественно аэробным катаболизмом других членов микробного сообщества приводит к развитию вагинита с выраженной лейкоцитарной реакцией и клиническими признаками воспаления.
Точные причины и механизм развития АВ до настоящего времени окончательно не определены. Однако установлено, что в этиопатогенезе заболевания микробный фактор играет такую же важную роль, как состояние макроорганизма и те обстоятельства, которые изменяют его иммунобиологические свойства.
К факторам риска развития АВ чаще всего относят: нарушение обмена веществ; общие инфекционные заболевания; алиментарный фактор; хронические стрессовые ситуации; токсическое воздействие некоторых лекарс-твенных препаратов (антибактериальных, цитостатических, глюкокортикостероидных средств, антацидов); различные экстрагенитальные заболевания, осложненное течение беременности и родов.
АВ относится к заболеваниям, которые не представляют прямой угрозы здоровью женщины. Однако при данном дисбиозе вагинального биотопа нижние отделы полового тракта массивно колонизируются условно-патогенными микроорганизмами, которые являются основными возбудителями гнойно-воспалительных заболеваний органов малого таза. Такие бактерии, как Staphylocоccus spp., Streptocоccus spp., колиформные бактерии (Escherichia coli), рассматриваются современными исследователями в качестве наиболее частых возбудителей хориоамнионита, интраамниальной инфекции, послеродового эндометрита, послеоперационных воспалительных осложнений.
По мнению многих исследователей, АВ является более частой причиной осложнений беременности, чем бактериальный вагиноз. С ним связывают также преждевременный разрыв оболочек плодного пузыря, преждевременные роды и низкий вес плода. Другим весьма значимым осложнением АВ, как указано ранее, является развитие воспалительных заболеваний органов малого таза у женщин.
КЛАССИФИКАЦИЯ
КЛИНИЧЕСКАЯ КАРТИНА
Особенностью течения АВ является наличие выраженной воспалительной реакции слизистой оболочки влагалища. При гинекологическом осмотре в острой стадии заболевания отмечаются болезненность при введении зеркал, отечность, гиперемия, петехиальные высыпания, поверхностные эрозии слизистой оболочки стенок и преддверия влагалища. При хронических формах АВ указанные признаки выражены меньше.
ДИАГНОСТИКА
Диагностика АВ основывается на данных анамнеза, результатах клинического обследования и лабораторных исследований.
Лабораторные исследования
1. Микроскопическое исследование вагинального отделяемого (400x увеличение, фазово-контрастный микроскоп).
Для микроскопической картины мазка, окрашенного по Граму, характерны следующие признаки, типичные для экссудативного воспалительного процесса:
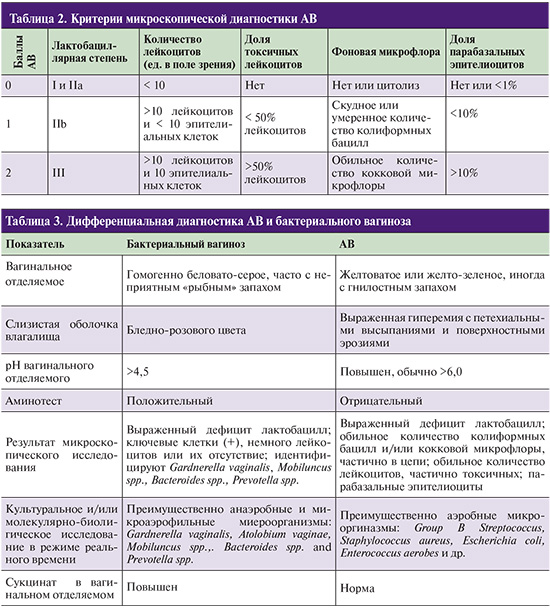
Для более точной диагностики АБ и оценки дефицита лактобацилл рекомендуется определение лактобациллярной степени (lactobacillary grading, LBG) показателя заселенности влагалища лактобациллами,
которая выявляется при микроскопии вагинального мазка, окрашенного по Граму (табл. 1).
Степени I и II A считаются показателем вагинального нормоценоза. Для определения наличия и степени тяжести АВ G.G. Donders (2002)предложены критерии, сходные с системой R. Nugent для диагностики бактериального вагиноза (табл. 2).
Баллы оцениваются отдельно по 5 критериям (лактобациллярная степень, количество лейкоцитов, доля токсичных лейкоцитов, фоновая микрофлора, доля парабазальных эпителиоцитов) и суммируются.
2. Культуральное исследование традиционно применяется в клинической практике для идентификации возбудителей, их количественной оценки и определения антибактериальной чувствительности выделенных изолятов. При АВ культуральное исследование позволяет выявить:
При АВ чаще всего выделяют и идентифицируют Streptococcus, Staphylococcus spp., Enterococcus spp., бактерии семейства Еnterobactеriасеае (E. coli, Klebsiella spp., Citrobacter spp., Enterobacter spp., Serratia spp., Proteus mirabilis, Morganella morganii).
Для оценки результатов микроскопического и культурального исследования используется комплексная система выявления нарушения микрофлоры влагалища («Интегральная оценка состояния микробиоты влагалища. Диагностика оппортунистических инфекций», Анкирская А.С., Муравьева В.В., 2011).
3. Полимеразная цепная реакция (ПЦР) в режиме реального времени относится к наиболее точным молекулярно-биологическим методам исследования микробиоты, позволяющим объективно исследовать количество условно-патогенной и нормальной вагинальной микрофлоры, степень и характер дисбаланса, а также провести контроль эффективности лечения.
Консультации других врачей-специалистов (эндокринолога, гастроэнтеролога) рекомендованы в случае частого рецидивирования АВ с целью исключения сопутствующих заболеваний (состояний), которые могут способствовать нарушению нормальной вагинальной микробиоты.
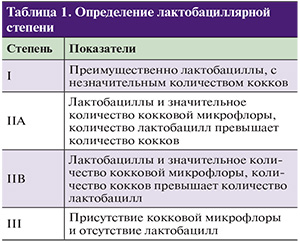
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Дифференциальную диагностику АВ необходимо проводить с другими урогенитальными заболеваниями, обусловленными патогенными (N. gonorrhoeae, T. vaginalis, C. trachomatis, M. genitalium) и условно-патогенными мик-роорганизмами (дрожжеподобными грибами рода Candida, генитальными микоплазмами, анаэробными микроорганизмами), аногенитальной герпесвирусной инфекцией. Алгоритм проведения дифференциальной диагностики АВ и бактериального вагиноза представлен в табл. 3.
ЛЕЧЕНИЕ
Показания к проведению лечения
Показанием к проведению лечения является установленный на основании клинического обследования и лабораторных исследований диагноз АВ. Лечение бессимптомного АВ, выявленного по результатам микроскопического исследования вагинального отделяемого, необходимо проводить перед введением внутриматочных средств; перед оперативными вмешательствами на органах малого таза, в том числе медицинскими абортами; беременным, имеющим в анамнезе преждевременные роды либо поздние выкидыши.
При наличии у половых партнеров клинических признаков баланопостита, уретрита и других заболеваний урогенитальной системы целесообразно проведение их обследования и при необходимости – лечения.
Цели лечения
Общие замечания по терапии
Основным направлением в лечении АВ должна являться элиминация повышенного количества аэробных микроорганизмов, что достигается с помощью применения этиотропных препаратов.
Местная терапия. Препаратами выбора для местного лечения являются неабсорбируемые антибактериальные препараты широкого спектра, действующие на кишечные грам+ и грам- аэробы: комбинированный препарат неомицина сульфат 35 000 МЕ, полимиксина В сульфат 35 000 МЕ, нистатин 100 000 МЕ (Полижинакс) и клиндамицин.
Комбинированный препарат: неомицина сульфат 35 000 МЕ, полимиксина В сульфат 35 000 МЕ, нистатин 100 000 МЕ обладает широким спектром противомикробного действия в отношении возбудителей АВ, оказывает выраженное противовоспалительное действие и способствует уменьшению симптомов заболевания с первых дней лечения. В отличие от лекарственных средств, содержащих глюкокортикостероиды, данный препарат не оказывает иммуносупрессивного действия на местный иммунитет и способствует быстрому восстановлению числа лактобацилл и функциональной активности вагинального эпителия. Интравагинальное применение препарата Полижинакс позволяет избегать системного воздействия на организм, а также делает возможным назначение препарата беременным (за исключением І триместра). Указанные особенности лекарственного средства способствуют достижению оптимального терапевтического эффекта, что особенно актуально при наличии смешанного бактериально-грибкового инфицирования.
Клиндамицин для местного применения удобен в использовании как в амбулаторной, так и в стационарной практике, обеспечивает удовлетворительный комплаенс и хорошую переносимость в сочетании с выраженной терапевтической эффективностью.
Повидон-йод (Бетадин) в виде раствора (для спринцеваний) или вагинальных суппозиториев способствует более быстрому облегчению симптомов, благодаря выраженному антисептическому эффекту, активности против антибиотикоустойчивых штаммов бактерий и собственному пребиотическому действию: повидон-йод повышает кислотность вагинальной среды, что приводит к быстрому созданию оптимальных условий для восстановления нормальной микрофлоры влагалища.
Кратковременное применение топических глюкокортикостероидных препаратов дополнительно к антибактериальной терапии показано только при десквамативном воспалительном вагините.
Лечение АВ может включать в себя местное применение эстриола или эстрадиола в тех случаях, когда в клинической картине доминируют атрофические изменения (увеличенное число парабазальных клеток).
Системная терапия. При тяжелом течении АВ рекомендуется терапия системными антибактериальными препаратами и местнодействующими лекарственными средствами.
Показания к назначению системных антибактериальных препаратов:
Показания к госпитализации
Рекомендованные схемы лечения
Местная терапия
комбинированный препарат: неомицина сульфат 35 000 МЕ, полимиксина В сульфат 35 000 МЕ, нистатин 100 000 М, вагинальные капсулы интравагинально 1 раз в сутки перед сном в течение 12 дней,
клиндамицин, крем 2%, 5,0 г интравагинально 1 раз в сутки, предпочтительно перед сном в тече-ние 3–7 дней, при десквамативном воспалительном вагините до 4–6 недель,
повидон-йод, вагинальные свечи интравагинально ежедневно перед сном, в течение 10–14 дней,
деквалиния хлорид 10 мг, таблетки вагинальные, интравагинально ежедневно перед сном, в течение 6 дней.
Системные антибактериальные препараты
офлоксацин 200–400 мг 2 раза в сутки в течение 7–10 дней,
ципрофлоксацин 125–500 мг 2 раза в сутки, в более тяжелых случаях – до 750 мг 2 раза в сутки в течение 7–14 дней,
левофлоксацин 500 мг 1–2 раза в сутки в течение 7–14 дней,
амоксициллин 500 мг 3 раза в сутки; при тяже-лом течении инфекции доза может быть повышена до 1,0 г 3 раза в сутки в течение 7–10 дней,
амоксициллин/клавуланат 500 мг+125 мг 3 ра-за в сутки в течение 7–10 дней.
Оценка эффективности лечения
Установление излеченности рекомендуется проводить через 14 дней после окончания лечения.
Тактика в отсутствие эффекта от лечения
Назначение иных препаратов или методик лечения.
Что значит интравагинально
Кафедра акушерства и гинекологии Оренбургской государственной медицинской академии, Оренбург, Россия
Институт клеточного и внутриклеточного симбиоза УрО РАН, Оренбург;
Кафедра акушерства и гинекологии Оренбургской государственной медицинской академии
Кафедра акушерства и гинекологии Оренбургской государственной медицинской академии
В последние десятилетия отмечается увеличение числа женщин с гинекологическими заболеваниями, в основном за счет роста распространенности инфекционно-воспалительных заболеваний женской половой системы [3]. Одной из причин сложившейся ситуации является недостаточное внимание к микроэкологическим факторам (состоянию местного иммунитета, колонизационной резистентности, микробиоценоза) нижних отделов репродуктивного тракта женщин, которые могут играть ключевую роль в возникновении, поддержании или купировании симптомов патологического процесса [7]. Развитие дисбиотических состояний приводит к повышению риска развития воспалительных заболеваний органов малого таза, способствует хронизации процесса, нарушению нормального течения беременности и родов и может явиться причиной утраты фертильности [8].
Материал и методы
Критериями исключения служили: наличие экстрагенитальной патологии, прием гормональных препаратов, противомикробных или витаминно-минеральных препаратов в течение 6 мес, предшествующих данному исследованию, а также наличие инфекций, передаваемых половым путем.
Для местной коррекции использовались следующие препараты:
— содержащий аскорбиновую кислоту в вагинальных таблетках по 250 мг, согласно рекомендациям производителя, вводился по 1 таблетке во влагалище в течение 6 сут;
— содержащий α-токоферола ацетат в масляном 50% растворе, в капсулах по 100 мг, вводился по 1 капсуле во влагалище 1 раз в сутки в течение 7 сут;
— содержащий ретинола ацетат в масле, капсулы 33 000 МЕ, вводился по 1 капсуле во влагалище 1 раз в сутки в течение 7 сут.
На 1-е и 7-е сутки после завершения терапии проводилось контрольное исследование состава микрофлоры влагалища. Статистическая обработка данных проводилась классическими методами параметрической и непараметрической статистики. Достоверными считались данные при p 
Средние концентрации витаминов у лиц с гиповитаминозами составили для ретинола ацетата 0,1±0,03 мг/мл (при норме 0,3-0,7 мг/мл), для α-токоферола 4,0±1,15 мкг/мл (норма 7-12 мкг/мл) и 0,19±0,03 мг/ч (0,7-1,0 мг/ч) для аскорбиновой кислоты.
Особенности функционирования репродуктивной системы женщин в зависимости от содержания витаминов представлены в таблице.
Наиболее выраженные нарушения функционального состояния репродуктивной системы, проявляющиеся в повышении частоты выявления дисбиотических состояний, дисменореи и нерегулярного менструального цикла, наблюдались у пациенток с изолированным дефицитом α-токоферола. Подобные изменения можно объяснить участием α-токоферола в биосинтезе эйкозаноидов (простагландиновая теория возникновения дисменореи). Кроме того, витамин Е способен подавлять образование метаболитов арахидоновой кислоты, препятствуя запуску воспалительного цитокинового каскада, которые, помимо всего, являются болевыми индукторами.
У пациенток с изолированным дефицитом ретинола ацетата или α-токоферола чаще других встречалась эктопия шейки матки (в 66 и 50% случаев соответственно). Несмотря на то что наличие эктопированного цилиндрического эпителия является вариантом нормы для этой возрастной группы, достоверное увеличение частоты эктопии в группе пациенток с гиповитаминозами по сравнению с таковым в контрольной группе заставляет задуматься о роли ретинола и токоферола в патогенезе заболеваний шейки матки. Это может быть связано с мембранным эффектом ретинола ацетата, который, напрямую взаимодействуя с мембранными липидами, изменяет их состав и метаболизм, влияя на межклеточные эпителиальные связи.
Следует отметить, что изменения микробиоценоза влагалища наблюдались у всех пациенток, страдающих гиповитаминозами. Степень выраженности дисбиотических состояний зависела от вида и тяжести витаминного дефицита. Самая высокая частота дисбиотических состояний репродуктивного тракта (75%) наблюдалась в группе пациенток с изолированным дефицитом аскорбиновой кислоты, несколько реже дисбиозы встречались в группах с изолированным дефицитом α-токоферола и сочетанного витаминного дефицита.
Оценку влияния интравагинального применения витаминов А, Е и С на состояние микрофлоры влагалища проводили в трех группах, сформированных в соответствии с выявленным дефицитом одного из витаминов.
Прирост бактериальной биомассы сопровождался возрастанием лейкоцитарно-эпителиального индекса со средних значений от 0,2 до 0,6 после коррекции. Это свидетельствует о провоспалительном влиянии витамина А на вагинальный биотоп, что может быть связано как с непосредственным действием препарата, так и с реакцией макроорганизма на увеличение обсемененности УПМ.
В группе пациенток, получавших интравагинально препарат, содержащий аскорбиновую кислоту, наблюдалось значимое увеличение обсемененности лактобактериями (рис. 3, а). 

Однако полученный положительный эффект не был продолжительным, и к 7-м суткам после завершения терапии обсемененность лактофлорой возвращалась к исходному уровню. Обсемененность УПМ и эпителиально-лейкоцитарный индекс значимо при применении аскорбиновой кислоты не изменялись.
Значение лейкоцитарно-эпителиального индекса в ходе терапии α-токоферолом значимо не изменялось. Таким образом, интравагинальное применение α-токоферола в условиях витаминдефицитных состояний оказывает положительное влияние на состояние микробиоценоза влагалища.
Достоверных различий значений КПИ в группах пациенток, которые получали препараты α-токоферола, ретинола ацетата, аскорбиновой кислоты, не наблюдалось, а изменения КПИ в течение менструального цикла были обусловлены циклическими колебаниями уровня половых стероидных гормонов.
Выводы
1. Гиповитаминозы α-токоферола, ретинола ацетата и аскорбиновой кислоты широко распространены. В половине случаев имеется сочетанный дефицит витаминов.
2. Дефицит витаминов антиоксидантного комплекса сопровождается нарушением менструальной функции и дисбиотическими состояниями нижних отделов репродуктивного тракта женщин. Увеличение частоты дисменореи и нерегулярного менструального цикла наблюдалось в группе пациенток с изолированным дефицитом α-токоферола. У пациенток с изолированным дефицитом ретинола ацетата или α-токоферола чаще других встречалась эктопия шейки матки. Самая высокая распространенность дисбиотических состояний влагалища наблюдалась в группе с дефицитом аскорбиновой кислоты.
3. Интравагинальное применение витаминов А, Е и С способно изменять состояние микробиоценоза влагалища. Аскорбиновая кислота оказывает интенсивное, но непродолжительное нормализующее влияние на вагинальный микробиоценоз. Воздействие α-токоферола, имея аналогичную направленность, отличалось инертностью: эффект развивался медленно, однако его интенсивность продолжала увеличиваться и после завершения терапии, достигая в итоге наилучших результатов. Влияние ретинола ацетата выражалось в увеличении обсемененности влагалища как лактофлорой, так и условно-патогенными микроорганизмами, сопровождающейся повышением лейкоцитарно-эпителиального индекса.
Рецидивирующие формы бактериального вагиноза: долгосрочное решение
Монотерапия клиндамицином – оптимальное решение проблемы бактериального вагиноза, направленное на основную причину заболевания – специфические механизмы, приводящие к образованию биопленки и обеспечивающие резистентность к классическим антибиотикам.
Одной из самых частых жалоб в практике врача-гинеколога были и остаются патологические выделения из влагалища. Симптом, нередко кажущийся самим пациенткам незначительным, требует тщательной диагностики, так как обычно связан с инфекционной патологией половых путей и высоким риском грозных осложнений.
Таким образом, сегодня необычайно высока необходимость в препаратах, учитывающих патогенез бактериального вагиноза и направленных против бактерий, ответственных за формирование устойчивости и определяющих тенденцию к рецидивированию. Большим плюсом для лекарственного средства будет также его эффективность при кратком курсе применения, который повысит приверженность к терапии. На данный момент этим критериям соответствует только Далацин® — оригинальный клиндамицин – от компании Pfizer.
Влагалищный микробиоценоз в норме и в патологии
Если доля лактобацилл снижается, их место в экосистеме занимают облигатно и факультативно анаэробные условно-патогенные микробы: Gardnerella vaginalis, Atopobium vaginae, Bacteroides spp., Peptostreptococcus spp., Mobiluncus spp., Mycoplasma hominis и многие другие.
Роль Atopobium vaginae и Gardnerella vaginalis в патогенезе рецидивирующего бактериального вагиноза
Появление методов амплификации нуклеиновых кислот в содержимом влагалища женщин с бактериальным вагинозом позволило выявить Atopobium vaginae, бактерию семейства Corinobacteriaceae spp., сегодня считающуюся высокоспецифичным маркером этого заболевания и имеющую ключевую роль в его патогенезе. Этот строго анаэробный микроорганизм часто существует в комбинации с Gardnerella vaginalis и существенно ослабляет иммунный ответ на локальном уровне.
Таким образом, бактерии, образующие биопленку, являются основной мишенью патогенетически-обусловленной терапии. Препараты, высоко активные в отношении Atopobium vaginae и Gardnerella vaginalis, решают принципиально важную проблему элиминации патологических очагов на слизистой, которые становятся причиной возврата заболевания. И таким образом позволяют женщине, наконец, перестать обращаться к врачу с одними и теми же жалобами.
Фокусная терапия рецидивирующих форм бактериального вагиноза
Для пациенток с рецидивирующей формой бактериального вагиноза оптимальным решением является Далацин® (оригинальный клиндамицин), один из немногих препаратов, эффективных одновременно против Atopobium vaginae и Gardnerella vaginalis.
Эффективность фокусной терапии рецидивирующих форм бактериального вагиноза, ассоциированных с Atopobium vaginae, была не раз доказана в клинических исследованиях.
Инструкция по медицинскому применению лекарственного препарата Далацин®
Регистрационные удостоверения: крем – П N011553/01, суппозитории – П N011553/02.
Служба Медицинской Информации: Medinfo.Russia@Pfizer.com. Доступ к информации о рецептурных препаратах Pfizer в России: www.pfizermedinfo.ru
Copyright 2020 Пфайзер Россия. Все права защищены. Информация предназначена только для специалистов здравоохранения Российской Федерации.
OOO «Пфайзер Инновации»
123112, Москва, Пресненская наб., д.10, БЦ «Башня на Набережной» (блок С)
Тел.: +7 495 287 50 00. Факс: +7 495 287 53 00
PP-CLO-RUS-0225 07.09.2020
Что значит интравагинально
Бактериальный вагиноз и вульвовагинальный кандидоз: оптимальные схемы лечения больных с сочетанной инфекцией
Журнал: Российский вестник акушера-гинеколога. 2013;13(3): 42‑46
Кузнецова И.В. Бактериальный вагиноз и вульвовагинальный кандидоз: оптимальные схемы лечения больных с сочетанной инфекцией. Российский вестник акушера-гинеколога. 2013;13(3):42‑46.
Kuznetsova IV. Bacterial vaginosis and vulvovaginal candidiasis: optimal treatment regimens for patients with mixed infection. Russian Bulletin of Obstetrician-Gynecologist. 2013;13(3):42‑46. (In Russ.).
Вагиниты являются широко распространенной проблемой и одним из самых частых поводов обращения к акушеру-гинекологу. Среди разнообразных вариантов вагинальной инфекции бесспорными лидерами считаются вульвовагинальный кандидоз (ВВК) и бактериальный вагиноз (БВ), выявляемые соответственно у 17-39% и 22-50% женщин с патологическими выделениями (белями) из влагалища [5]. Распространенность ВВК и БВ чрезвычайно высока. Приблизительно 75% женщин репродуктивного возраста сталкиваются с ВВК, по крайней мере, 1 раз в течение жизни, у 40-45% отмечаются 2 редицива заболевания и более. Большинство случаев ВВК классифицируются как неосложненный кандидоз [8], но примерно у 10% больных ВВК имеет осложненное течение.
Бактериальный вагиноз считается самой частой формой заболеваний влагалища и встречается приблизительно у 30% женщин [4]. При бесспорном инфекционном происхождении ВВК и БВ их заразность для полового партнера не доказана [4, 13], и они не относятся к инфекциям, передаваемым половым путем (ИППП). Тем не менее ряд факторов, связанных с сексуальным поведением, увеличивает риск возникновения этих заболеваний. К ним относятся: начало половой жизни, практика орогенитального секса, смена полового партнера, частое спринцевание влагалища [4].
Проблемы, связанные с ВВК и БВ, доставляют пациенткам множество неудобств, связанных не только с изменением количества и качества влагалищных выделений, но и жжением, раздражением кожи, ощущением сухости, диспареунией, дизурией [5]. Помимо сиюминутного дискомфорта, БВ и ВВК увеличивают риск спонтанного аборта, преждевременных родов, анте- и интранатального инфицирования плода [12, 19, 22], послеродового эндомиометрита, способствуют развитию цервицитов, воспалительных заболеваний органов таза с вовлечением мочевыделительной системы, распространению вирусной инфекции, в том числе ВИЧ и генитального герпеса, гонореи, хламидиоза, трихомониаза, повышают риск воспалительных послеоперационных осложнений [7, 33, 38].
Какие именно причины лежат в основе частых (4 раза в год и более) повторных эпизодов заболевания, до конца не ясно. Системная иммуносупрессия не может служить достаточным обоснованием рецидивирующего ВВК. Это наглядно демонстрируется наблюдениями за ВИЧ-инфицированными больными, у которых колонизация влагалища грибами Candida значительно повышается, но при этом частота рецидивирующего ВВК растет умеренно, намного отставая от роста частоты эпизодов орофарингеального кандидоза [28]. Более вероятно, что рецидивы ВВК обусловливает подавление либо снижение местных защитных иммунорегуляторных механизмов с изменением цитокинового профиля [18]. Существует версия, что причиной симптомных кандидозов является повышенная локальная чувствительность к грибам [15].
Для оценки видового разнообразия бактериальной флоры, обнаруживаемой при БВ, был разработан ДНК-биочип [1], использование которого позволило выявить у 80 женщин с БВ [2] 29 различных видов микроорганизмов, причем чаще всего идентифицировался A. vaginae. Важно, что с наибольшей частотой A. vaginae обнаруживался при длительном рецидивирующем течении заболевания, причем независимо от других БВ-ассоциированных микроорганизмов (G. vaginalis, Mobiluncus spp., Ureaplasma urealyticum, Mycoplasma hominis) [2]. Хотя A. vaginae обнаруживали в содержимом из влагалища не только при БВ, но и у здоровых женщин, соотношение распространенности A. vaginae среди пациенток с БВ явно выше, чем среди здоровых женщин [1].
Сочетание ВВК и БВ требует одновременного лечения обеих инфекций. Но даже в отсутствие клинических и лабораторных признаков ВВК лечение БВ антибиотиками может привести к развитию симптомов кандидоза в случаях предшествующей колонизации влагалища грибами [30].
Метронидазол назначается в дозе 500 мг 2 раза в день в течение 7 дней, или 0,75% гель метронидазола 5 г интравагинально 1 раз в день в течение 5 дней, или 2% крем клиндамицина по 5 г интравагинально в течение 7 дней. В качестве альтернативы эти рекомендации предлагают лечение клиндамицином внутрь по 300 мг 2 раза в день 7 дней или свечи клиндамицина по 100 мг интравагинально на ночь 3 суток подряд. Бесспорно, наиболее приемлемой для женщин является самая короткая схема лечения, предполагающая 3-дневный курс клиндамицина в свечах. Что касается назначения одномоментного лечения метронидазолом (внутрь в дозе 2 г), то удобство этой схемы нивелируется относительно низкой эффективностью, и поэтому она в настоящее время не рекомендуется CDC даже в качестве альтернативного варианта [12]. В Европейских рекомендациях [13] по ведению больных с выделениями из влагалища также указано на невысокую эффективность одномоментного применения метронидазола в дозе 2 г при БВ. Согласно Российским рекомендациям [3], предпочтительным методом является местное (интравагинальное) назначение метронидазола или клиндамицина: клиндамицин, крем 2% по 5,0 г интравагинально на ночь, 6 дней; метронидазол, гель 0,75% по 5,0 г интравагинально на ночь, 5 дней. Альтернативная схема подразумевает возможность использования свечей клиндамицина (100 мг) в течение 3 дней. Внутрь 5-нитроимидазолы или клиндамицин рекомендуют назначать только при неэффективности интравагинальной терапии: метронидазол 500 мг внутрь 2 раза в сутки в течение 7 дней; клиндамицин 300 мг 2 раза в сутки в течение 7 дней; орнидазол 500 мг внутрь в течение 5 дней.
Серьезную проблему представляют резистентные к терапии случаи БВ [40]. В случае неэффективности стандартной терапии метронидазолом возможно ее повторение с увеличением продолжительности, а при повторной неудаче рекомендуют еще одну попытку повторения с предварительным курсом лечения антибиотиками с целью элиминировать сопутствующую аэробную микрофлору, способную снижать эффективность воздействия нитрогруппы 5-нитроимидазолов на анаэробы [12, 13]. Однако целесообразность такого подхода представляется спорной по двум причинам. Во-первых, длительные курсы перорального применения метронидазола плохо переносятся. Во-вторых, причиной отсутствия эффекта от терапии могут быть не аэробные микроорганизмы, а ассоциированные с БВ анаэробы, нечувствительные к нитроимидазолам.
Устойчивостью к метронидазолу могут обладать некультивируемые или труднокультивируемые микроорганизмы, они же и обеспечивают упорное рецидивирующее течение БВ. Повторные эпизоды вагинита наблюдаются у 30% женщин в течение 3 мес после лечения [40]. Серия исследований, проведенных в Австралии, показала, что после перорального применения метронидазола рецидивы БВ в течение 1 года наблюдений отмечались у 58% пациенток [9]. Факторы риска рецидива ассоциировались с наличием БВ в предшествующем анамнезе, регулярной половой жизнью с постоянным партнером, лесбиянством. Использование презерватива не влияло на риск, а гормональная контрацепция имела протективный эффект. При молекулярном анализе некультивируемых организмов авторы исследования обнаружили, что неудачи долговременного эффекта терапии метронидазолом достоверно чаще были связаны с выявлением A. vaginae [10].
Невозможность идентификации некультивируемых микроорганизмов в рутинной практике до начала терапии становится залогом ее неэффективности [7, 11]. Устойчивость A. vaginae к метронидазолу была продемонстрирована неоднократно [14]. В ряде публикаций [7, 41] было показано, что A. vaginae в исследованиях in vitro обладает большей чувствительностью к клиндамицину, чем к метронидазолу. Клинические исследования подтверждают достоверно более высокую эффективность стандартной интравагинальной терапии БВ, ассоциированного с A. vaginae, клиндамицином (2% крем по 5 г интравагинально 6 дней) по сравнению с метронидазолом (0,75% гель по 5 г интравагинально 5 дней, на ночь). Аналогичные результаты были получены в исследованиях, сравнивавших топическую терапию метронидазолом и клиндамицином при БВ, предположительно ассоциированным с морфотипами Mobiluncus [26].
По-видимому, особенности чувствительности микроорганизмов, участвующих в развитии БВ, являются ведущим фактором неэффективности лечения или повышенной частоты рецидивов. Стратегии лечения половых партнеров и реколонизации влагалища лактобациллами не продемонстрировали значимого эффекта по снижению частоты рецидивов и нормализации микробиоты влагалища [6, 40], хотя отдельные исследования по использованию эубиотиков и пробиотиков дают обнадеживающие результаты [24]. В то же время нельзя сбрасывать со счетов участие аэробных микроорганизмов, в том числе грибов, в ухудшении прогноза лечения БВ. Сравнение геля метронидазола и влагалищных таблеток, содержащих метронидазол с нистатином, обнаружило снижение частоты рецидивов при использовании комплексного препарата [27] даже в отсутствие данных об исходной грибковой инфекции.
Таким образом, несмотря на сравнимую эффективность метронидазола и клиндамицина, последний имеет очевидные преимущества в лечении рецидивирующего БВ ввиду более широкого спектра воздействия на микроорганизмы, включая некультивируемые или трудно культивируемые формы. Применение 3-дневного курса вагинальных таблеток клиндамицина сравнимо по эффективности с другими курсами терапии, но кратковременность лечения обеспечивает большую приемлемость метода для пациенток. Однако применение клиндамицина чревато возникновением ВВК, что требует профилактических мер.
Для лечения ВВК предложено несколько групп лекарственных средств местного и системного действия. Эффективность их эквивалентна, как было продемонстрировано в систематическом обзоре 19 рандомизированных контролируемых исследований (РКИ), сравнивавших методы топической и пероральной терапии антимикотиками [25], хотя авторы обзора отметили тенденцию к лучшим отдаленным последствиям проведения пероральной терапии, связанным с меньшей частотой рецидивов [35]. Бесспорным лидером пероральной терапии с хорошим профилем безопасности и эффективности является флуконазол, который при неосложненном кандидозе используется в дозе 150 мг однократно [34].
Наличие рецидивирующего ВВК предполагает продолжительные режимы лечения. Из них наибольшей популярностью в мире пользуется применение флуконазола в дозе 150 мг 1 раз в неделю в течение 6 мес после первоначального купирования очередного острого эпизода трехкратным приемом 150 мг флуконазола с интервалом 72 ч. По результатам РКИ, 6-месячное использование флуконазола сопровождалось значимо меньшим числом рецидивов после его окончания (9%) по сравнению с плацебо (64%), причем ни одна из пациенток не прекратила лечение из-за побочных эффектов [37]. Несмотря на то что у части больных симптомы ВВК возвращаются через несколько месяцев после окончания лечения, схема супрессивной терапии флуконазолом является на сегодняшний день единственным методом, имеющим доказательную базу эффективности. Для контроля симптомов ВВК в отсутствие достаточного эффекта шестимесячного курса рассматривается возможность его пролонгации до года. Другие лечебные подходы, в том числе использование йогурта, лактобацилл, десенситизация к антигену Candida, низкоуглеводистая диета, пока не подтвердили свою эффективность в клинических исследованиях [31].
Вероятной причиной рецидивов ВВК и/или устойчивости к терапии являются особенности возбудителя инфекции. Известно, что чувствительностью к азоловым антимикотикам обладает C. albicans, самый частый возбудитель ВВК. Candida не-albicans отличается устойчивостью к большинству антимикотических средств, и лечение таких больных всегда представляет большую проблему. В США и Европе эта проблема разрешается с помощью 2-недельного курса желатиновых вагинальных капсул, содержащих 600 мг борной кислоты, к такому виду терапии чувствительна C. glabrata, самый распространенный не-albicans возбудитель [36]. Еще один способ терапии предлагает местное использование амфотерицина В (свечи 50 мг) изолированно или в комбинации с флуцитозином в течение 14 дней [29]. К сожалению, в России эти методы лечения недоступны, поэтому в отечественной клинической практике задача элиминации устойчивых возбудителей может решаться только с помощью повышения дозы азоловых антимикотиков.
Планирование лечения ВВК и БВ, а также микстинфекции, должно базироваться на доказательных данных эффективности схем лечения. Метронидазол и клиндамицин при БВ, пероральные и топические антимикотики при ВВК доказали свою сравнимую эффективность и могут назначаться как средства равного выбора первой линии терапии. Но при повторных эпизодах вагинитов или микстинфекции следует вспомнить об особенностях возбудителей БВ и ВВК, предрасполагающих к формированию хронических форм заболеваний. Учитывая сложности диагностики причины БВ и прогноза течения ВВК, в подобных ситуациях оптимальным режимом терапии может стать назначение клиндамицина, перекрывающего широкий спектр некультивируемых анаэробов, в виде местной терапии и флуконазола как средства профилактики и лечения ВВК. Трехдневный курс клиндамицина с однократным приемом флуконазола, безусловно, может считаться наиболее приемлемым вариантом терапии для пациенток.
Альтернатива антибактериальной терапии в акушерстве и гинекологии
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Инфекционная патология женских половых органов является наиболее актуальной проблемой акушерства, гинекологии и перинатологии, т. к. именно с ней связаны воспалительные заболевания гениталий, привычное невынашивание беременности, бесплодие, хронические тазовые боли, внутриутробная инфекция плода и новорожденного [1–4].
В последнее время стало понятно, что без использования современных достижений фундаментальной и клинической микробиологии решить проблему инфекционной патологии практически невозможно. Успехи в области молекулярной и биохимической вирусологии связаны с раскрытием стратегии вирусного генома, выявлением особенностей биосинтеза облигатных для бактерий паразитов — бактериофагов. Тем не менее, проблема профилактики и лечения различных острых и хронических, персистирующих бактериальных инфекций, до сих пор далека от окончательного разрешения [4, 5].
Важными вопросами являются выбор метода контроля за эффективностью лечения, определение критериев бактериологической излеченности, безопасность терапии [2, 4, 6, 9]. Неадекватная оценка тяжести течения инфекционного процесса и неправильно разработанная стратегия терапии приводят к развитию аутоиммунной патологии и хронизации воспалительных заболеваний [9–11].
В структуре патологии, связанной с персистирующими, рецидивирующими инфекциями, глобальной проблемой являются нарушения иммунитета. В настоящее время более 1/3 всей патологии человека протекает в сочетании с клиническими признаками иммунной недостаточности, что определяет тяжесть клинических проявлений заболевания, развитие осложнений и ухудшение прогноза. Именно снижение локальной и общей резистентности организма приводит к длительно существующим заболеваниям.
Изменение парадигмы иммунитета беременности создает длительно существующее повышение риска манифестации и рецидивирования персистирующих инфекций у беременных и новорожденных [1–3, 7].
В настоящее время основой правильной врачебной деятельности является использование принципов доказательной медицины, основывающейся на знании сочетания доказанной эффективности лечебных воздействий и подтверждения их безопасности. Именно оценка соотношения предполагаемой пользы и прогнозируемого (ожидаемого) риска является краеугольным камнем качественной клинической практики [2, 4]. Особенно высокие требования к безопасности назначаемого медикаментозного лечения предъявляются в акушерстве и педиатрии.
Широкое распространение антибиотикотерапии в середине XX в. имело свои преимущества за счет универсальности воздействия антибиотиков (широкого спектра их действия), возможности проведения эмпирической терапии и отсутствия устойчивых штаммов микроорганизмов.
В настоящее время проблема антибиотикорезистентности имеет критическое значение для всех областей клинической медицины. Полимикробная этиология инфекционных заболеваний в акушерстве и гинекологии, селекция резистентных штаммов возбудителей приводят к резкому снижению эффективности антибактериальных препаратов первого ряда выбора. Существующие рекомендации для лечения воспалительных заболеваний включают уже и применение нескольких антибактериальных препаратов [12].
Антибактериальная терапия может явиться причиной развития дисбактериоза. В случае применения антибиотиков на фоне дисбактериоза может усиливаться степень его выраженности. Кроме того, антибиотики снижают колонизационную резистентность влагалища и кишечника, увеличивают проницаемость слизистой оболочки, способствуя тем самым проникновению микроорганизмов в кровяное русло, внутренние органы и развитию вторичного очага инфекции и аллергизации организма [12, 13].
В США, Европе и России происходит ренессанс таргетной терапии инфекций с помощью бактериофагов [14–17]. Преимуществами фаготерапии является ее высокая специфичность, отсутствие подавления нормальной флоры, бактерицидное действие, в биопленках, саморепликация бактериофагов в очаге поражения, «автоматическое дозирование», отсутствие токсических и тератогенных эффектов, безопасность во время беременности, хорошая переносимость и очень низкий химиотерапевтический индекс.
Назначение бактериофагов можно без преувеличений назвать высокоспецифичной антибактериальной терапией. Исторически единственными лекарственными средствами, подавляющими рост бактерий, были антибактериальные вирусы — бактериофаги. Препараты бактериофагов имеют хорошие перспективы в качестве альтернативы химиотерапевтической антибактериальной терапии. В отличие от антибиотиков они обладают строгой селективностью действия, не подавляют нормальную микрофлору, стимулируют факторы специфического и неспецифического иммунитета, что особенно значимо при лечении хронических воспалительных заболеваний или бактерионосительства.
Характеристика и классификация
бактериофаги содержат поликлональные вирулентные бактериофаги широкого диапазона действия, активные и в отношении бактерий, устойчивых к антибиотикам [18]. Фаготерапия может успешно сочетаться с назначением антибиотиков [19].
Для приготовления препаратов бактериофагов используют вирулентные фаги, выделенные из окружающей среды и адаптированные к гомологичным возбудителям [20].
препараты бактериофагов выпускают на предприятиях ФГУП «НПО «Микроген» — Нижегородском филиале «ИмБио», в Пермском филиале «НПО «Биомед», Уфимском филиале «Иммунопрепарат». Все препараты являются либо поливалентными, содержащими фаги к различным видам и сероварам одного возбудителя (монокомпонентные), принадлежащего к одному роду, либо комбинированными, содержащими фаги к бактериальным возбудителям нескольких родов бактерий.
Достоинство поливалентных (монокомпонентных) препаратов заключается в строгой специфичности действия, поскольку они вызывают гибель только своего конкретного вида бактерий и в отличие от антибиотиков не влияют на нормальную микрофлору влагалища и кишечника больного. Использование бактериофагов показало хорошие результаты при лечении и профилактике кишечных инфекций, дисбактериозов, заболеваний при хирургической, педиатрической, гинекологической, ЛОР и офтальмологической патологии. Отечественными неонатологами показана высокая эффективность фаготерапии инфекций у детей раннего возраста.
После определения чувствительности бактерий к конкретному фагу можно использовать монокомпонентные поливалентные бактериофаги. Разнообразие механизмов резистентности к антибиотикам обусловливает возможность комбинированного применения химиопрепарата с антибактериальной активностью в сочетании с бактериофагом (). Особенно эффективна такая комбинация для разрушения микробных биопленок.
Препараты бактериофагов могут назначаться для профилактики и лечения инфекционных заболеваний, нарушений микроценоза, а также для предотвращения колонизации слизистых оболочек женских половых органов бактериями. В условиях роста антибиотикорезистентности можно рассматривать бактериофаги как успешную альтернативу антибиотикам [14, 15, 17, 22].
Комбинированные препараты фагов имеют более высокую активность литического действия на бактериальную клетку за счет синергизма действия отдельных фагов и обеспечивают получение лечебного эффекта при инфекциях, вызванных ассоциациями микробов.
Существуют разнообразные лекарственные формы бактериофагов: жидкие, таблетированные, гели. Хранятся бактериофаги при температуре от 2 до 10°С в сухом темном месте в течение лет. Важным условием, обеспечивающим результативность лечения фаговыми препаратами, является определение чувствительности к ним возбудителя [21].
Механизм действия бактериофагов
Вирулентные бактериофаги, адсорбируясь на поверхности гомологичной микробной клетки, инъецируют свой генетический материал в ее цитоплазму, где интенсивно размножаются, используя структурные компоненты клетки, и разрушают ее. Далее зрелые фаговые частицы готовы к новому заражению, и литический процесс повторяется с новыми и новыми бактериальными клетками. Скорость инфицирования бактериальных клеток может достигать 1023 за 1 секунду [21].
Методика определения чувствительности микроорганизмов к бактериофагам
Определение фагочувствительности проводят на 1,5% агаре или агаре Хоттингера (для стафилококков и стрептококков в питательный агар добавляют 0,4% глюкозы). Дно чашки Петри с обратной стороны предварительно расчерчивают соответственно используемым фаговым препаратам.
Бактериальную суспензию суточной агаровой культуры (5 ед. по ОСО П) выделенного бактериального штамма равномерно распределяют по поверхности чашки Петри с хорошо подсушенной питательной средой. Излишек жидкости удаляют пастеровской пипеткой и подсушивают в зоне пламени горелки в течение 20–30 с.
На поверхность агара с впитавшейся культурой пастеровской пипеткой с тонко оттянутым концом наносят по 1 капле (0,03 мл) образца препарата бактериофагов. После подсыхания капель фагов чашки инкубируют в термостате при температуре 37°С в течение 18–20 ч, для бактерий рода Proteus — в течение 4–6 ч.
Учет и регистрация результатов проводятся по схеме:
+++ — полусливной лизис (незначительный рост культуры в зоне лизиса);
++ — наличие в месте нанесения капли фага более 50 колоний фага (пятна лизиса);
+ — от 20 до 50 колоний фага;
± — менее 20 колоний фага;
— полное отсутствие лизиса. Наличие зон лизиса ++++ и +++ свидетельствует о высокой чувствительности изучаемого штамма к фагу, ++ — умеренной, + — слабой чувствительности. Предпочтение должно быть отдано бактериофагам, вызывающим лизис с интенсивностью ++++ и +++ [17].
Безопасность
Являясь безвредным биологическим методом лечения, фаготерапия может применяться во время беременности, в периоде новорожденности и у детей раннего возраста.
В настоящее время в клинической медицине используют только литические формы бактериофагов, которые обладают бактерицидным действием и четким механизмом саморегуляции собственной популяционной активности.
Для получения положительных результатов использования бактериофагов необходимо предварительное исследование чувствительности к ним микроорганизмов. При использовании бактериофагов в крупных клиниках, больницах целесообразно включать их в состав производственных штаммов, на которых готовятся коммерческие препараты, госпитальные штаммы возбудителей заболеваний, характерных для данного стационара.
Результаты собственных исследований
С целью повышения эффективности терапии вульвовагинальных инфекций и воспалительных заболеваний органов малого таза применяли поливалентный пиобактериофаг Секстафаг® (НПО «Микроген» Минздрава России).
Всего в исследование включили 136 женщин. С воспалительными заболеваниями органов малого таза (ВЗОМТ) были 73 пациентки, 32 из которых получали стандартную антибактериальную терапию в сочетании с пероральным приемом Секстафага®, 41 — только противомикробные препараты. Критериями исключения явились тяжелое и осложненное течение инфекции.
Больных с рецидивирующими нарушениями микроценоза влагалища (63) также разделили на две группы: 28 женщин получали только Секстафаг®, 35 — только метронидазол интравагинально. Критерием исключения служило обнаружение вульвовагинального кандидоза.
Внутри подгрупп не было достоверных отличий по возрасту и соматической патологии. Наблюдение за пациентами продолжали на протяжении 6 мес.
Пиобактериофаг поливалентный (Секстафаг®) обладает способностью специфически лизировать микроорганизмы (стафилококки, стрептококки, патогенные кишечные и синегнойные бактерии), Proteus mirabilis, Proteus vulgaris, Klebsiella pneumoniae. Перорально препарат поливалентного бактериофага пациенты получали по 20,0 мл 2 р./сут на протяжении 10 дней. Пероральный прием предваряли приемом щелочной минеральной воды или раствором пищевой соды.
Интравагинально Секстафаг® вводили по 10,0 мл 2 р./сут на тампоне с экспозицией 60 мин на протяжении 10 дней.
В результате проведения исследования отмечено, что у больных ВЗОМТ, получавших комбинированную фагоантибиотикотерапию, продолжительность лечения сократилась в среднем до 5,8 cут, в то время как у пациентов только с антибиотиками продолжительность эффективного курса составила 8,7 сут.
Среди пациенток с рецидивирующими нарушениями микроценоза влагалища эффективность монотерапии в виде интравагинального введения полифага составила 85,7% (24 из 28). При назначении метронидазола интравагинально микробиологическая эффективность достигала 71,4% (25 из 35). Частота рецидивов бактериального вагиноза и неспецифического кольпита на протяжении 6 мес. наблюдения снизилась в 4,2 раза после применения поливалентного бактериофага.
Во время назначения препарата бактериофага не было отмечено аллергических реакций, немотивированного отказа от лечения. На фоне антибиотикотерапии только у одной пациентки развились диспептические явления, не потребовавшие дополнительного лечения и отказа от основной терапии.
Изолированно от проведения настоящего исследования выполнена оценка эффективности профилактического использования препарата с бактериофагами для профилактики рецидивирования вагинальных инфекций.
Группу пациентов составили 32 женщины, имевшие жалобы на патологические вагинальные выделения, не коррелировавшие по результатам обследования с диагнозом «вульвовагинальный кандидоз», «сальпингоофорит».
Принимая во внимание, что целевую когорту пациентов составили 32 женщины, демонстрируем предварительные результаты наблюдений, длившихся на протяжении не более 7 мес.
Пациенты, принявшие участие в исследовании, предъявляли жалобы на «необычные» выделения из влагалища (чаще появляющиеся в течение 12–48 ч после полового контакта — 87,5%), зуд/жжение, неприятный запах вагинальных выделений (65,6%).
При проведении активного сбора анамнеза 12 (37,5%) пациенток с рецидивирующими жалобами на вагинальные выделения отмечали учащенное мочеиспускание/«позывы», «рези» при мочеиспускании, что клинически трактовалось как посткоитальный цистит.
В качестве профилактики вульвовагинальных инфекций и нарушения микробиоценоза влагалища назначали гель Фагогин (производитель ООО НПЦ «МикроМир»). Комплексное средство в гелевой форме Фагогин включает 40 видов бактериофагов, активных к патогенным штаммам: Staphylococcus aureus spp., Hafnia alvei, Gardnerella vaginalis, Campylobacter spp., Haemophilus spp., Actinomyces spp., Pseudomonas aeruginosa spp., Streptococcus spp., Klebsiella spp., Bacteroides spp., Proteus spp., Enterobacter spp., Escherichia coli spp., Neisseria gonorrhoeae.
Антибактериальное средство Фагогин предназначено для профилактики вульвовагинальных инфекций и инфекционных заболеваний половых органов, а также является средством интимной гигиены. Использование средства Фагогин как средства профилактики особенно актуально у беременных для снижения риска манифестации и рецидивирования персистирующих инфекций.
Гель Фагогин вводился интравагинально по 5 мл 2–3 р./сут на протяжении 3–4 недель. Обязательной рекомендацией являлось использование геля Фагогин в качестве гигиенической процедуры после полового контакта.
После 3 нед. терапии у 87,5% пациенток жалобы купировались. Явления посткоитального цистита регрессировали у 8 (66,7%) женщин. Принципы клинических решений применения бактериофагов в гинекологии представлены на рисунке 1.
На данном этапе накопленных знаний фундаментальной и клинической микробиологии и вирусологии, имеющегося клинического опыта необходимо выделить доказанные преимущества фаготерапии:
В настоящее время имеется ограниченное количество сообщений о применении фаготерапии в акушерстве и гинекологии. Распространение применения бактериофагов требует накопления базы качественных рандомизированных мультицентровых клинических исследований. Тем не менее, очевидными являются возможности и перспективы применения бактериофагов в акушерстве и гинекологии:
Таким образом, в условиях формирования антимикробной резистентности, формирования устойчивых бактериальных пленок необходимость в новых альтернативных лечебных технологиях и антимикробных препаратах приобретает все большую значимость. Перспективы применения бактериофагов касаются не только антимикробной терапии, но и высокоточной диагностики, а также онкологии. Проведенное исследование показало, что поливалентный пиобактериофаг в виде монотерапии и сочетанной с антибиотиками терапии повышает эффективность лечения, уменьшает частоту рецидивов и обладает высокой комплаентностью.
Эстровагин ® (Estrovagin)
Владелец регистрационного удостоверения:
Лекарственная форма
рег. №: ЛП-000720 от 20.09.11 — Бессрочно Дата перерегистрации: 26.02.20
Форма выпуска, упаковка и состав препарата Эстровагин ®
Суппозитории вагинальные в форме торпеды, от белого до светло-коричневого цвета.
| 1 супп. | |
| эстриол (микронизированный) | 500 мкг |
Фармакологическое действие
Эстроген, аналог естественного женского гормона. Восполняет дефицит эстрогенов у женщин в постменопаузном периоде и ослабляет симптомы постменопаузы. Наиболее эффективен при лечении мочеполовых расстройств. При атрофии слизистой оболочки нижних отделов мочеполовых путей эстриол способствует нормализации эпителия мочеполового тракта и способствует восстановлению нормальной микрофлоры и физиологического рН во влагалище. Повышает сопротивляемость эпителиальных клеток мочеполового тракта к инфекциям и воспалению, снижая такие жалобы, как болезненность при половом акте, сухость, зуд во влагалище, уменьшает вероятность возникновения вагинальных инфекций и инфекций мочевыводящих путей, способствует нормализации мочеиспускания, предотвращает недержание мочи.
В отличие от других эстрогенов, эстриол обладает коротким периодом действия, поскольку в ядрах клеток эндометрия он удерживается в течение короткого промежутка времени. Предполагается, что одноразовое введение суточной дозы не вызывает пролиферации эндометрия. Поэтому не требуется циклического введения прогестагена и не возникает кровотечений отмены. Кроме того, показано, что эстриол не увеличивает маммографической плотности.
Фармакокинетика
При применении препарата внутрь, а также местно эстриол быстро и почти полностью абсорбируется.
С max эстриола в плазме достигается через 1-2 ч после интравагинального применения.
В плазме почти весь (90%) эстриол связан с альбумином и в отличие от других эстрогенов практически не связан с глобулином, связывающим половые гормоны (ГСПГ).
Выведение эстриола (в связанной форме) осуществляется, главным образом, почками; около 2% выводится через кишечник в неизмененном виде. Выведение метаболитов с мочой начинается уже через несколько часов после применения и продолжается 18 ч.
Показания активных веществ препарата Эстровагин ®
ЗГТ для лечения атрофии слизистой оболочки нижних отделов мочевых и половых путей, связанной с эстрогенной недостаточностью; пред- и послеоперационное лечение женщин в постменопаузном периоде при операциях влагалищным доступом; с диагностической целью при неясных результатах цитологического исследования шейки матки (подозрение на опухолевый процесс) на фоне атрофических изменений.
Открыть список кодов МКБ-10
| Код МКБ-10 | Показание |
| N95.1 | Менопауза и климактерическое состояние у женщин |
| N95.2 | Постменопаузный атрофический вагинит |
| N95.3 | Состояния, связанные с искусственно вызванной менопаузой |
| Z03 | Медицинское наблюдение и оценка при подозрении на заболевание или патологическое состояние |
| Z51.4 | Подготовительные процедуры для последующего лечения или обследования, не классифицированные в других рубриках |
Режим дозирования
Вводят интравагинально. Доза составляет 500 мкг/сут. Схема применения устанавливается индивидуально, в зависимости от показаний и клинической ситуации.
Побочное действие
Возможно: может отмечаться чувствительность, напряженность, болезненность, увеличение размеров молочных желез, ациклические кровянистые выделения, прорывные кровотечения, метроррагия.
Противопоказания к применению
Установленный, имеющийся в анамнезе или подозреваемый рак молочных желез; диагностированные эстрогенозависимые опухоли или подозрение на них (например, рак эндометрия); кровотечение из влагалища неясной этиологии; нелеченная гиперплазия эндометрия; наличие венозных тромбозов в настоящее время и в анамнезе; активное или недавно перенесенное тромбоэмболическое заболевание артерий (например, стенокардия, инфаркт миокарда); заболевание печени в острой стадии или заболевание печени в анамнезе, после которого показатели функции печени не вернулись к норме; порфирия; установленная повышенная чувствительность к активному веществу.
Применение при беременности и кормлении грудью
Применение при беременности противопоказано. В случае возникновения беременности во время терапии эстриолом, лечение необходимо немедленно отменить.
Результаты большинства эпидемиологических исследований, проведенных к настоящему времени относительно непреднамеренного воздействия эстрогенов на плод, свидетельствуют об отсутствии тератогенных или фетотоксических эффектов.
Не рекомендуется применение в период лактации (грудного вскармливания). Эстриол выводится с грудным молоком и может уменьшать образование молока.
Особые указания
Во время лечения эстриолом возможен рецидив или ухудшение следующих заболеваний и состояний: лейомиома (фибромы матки) или эндометриоз; перенесенные тромбоэмболические нарушения или имеющиеся факторы риска таких нарушений; факторы риска эстрогенозависимых опухолей, например, 1-я степень наследственности для рака молочных желез; артериальная гипертензия; доброкачественные опухоли печени (например, аденома печени); сахарный диабет с наличием или отсутствием сосудистого компонента; желчнокаменная болезнь; желтуха (в т.ч. в анамнезе во время предшествующей беременности); печеночная недостаточность; мигрень или тяжелая головная боль; системная красная волчанка; гиперплазия эндометрия в анамнезе; эпилепсия; астма; отосклероз; семейная гиперлипопротеинемия; панкреатит.
Для лечения постменопаузных симптомов, ЗГТ необходимо начинать только в отношении симптомов, которые неблагоприятно влияют на качество жизни. Во всех случаях, необходимо не менее одного раза в год проводить тщательную оценку риска и пользы лечения. ЗГТ следует продолжать только в течение периода времени, когда польза превышает риск.
Терапию следует прекратить в случае выявления противопоказания и/или при возникновении следующих состояний: желтуха и/или ухудшение функции печени; значительное повышение АД; возобновление головной боли по типу мигрени; беременность.
При интравагинальном применении эстриола риск возникновения рака молочной железы не известен. Показано, что применение эстриола в отличие от других эстрогенов не связывалось с повышением риска развития рака молочной железы.
Если эстриол применяется по показанию «пред- и послеоперационное лечение женщин в постменопаузном периоде при операциях влагалищным доступом» необходимо предусмотреть профилактическое лечение для предупреждения тромбозов.
Если после начала применения эстриола развивается ВТЭ, то лечение необходимо прекратить.
Эстриол является слабым ингибитором гонадотропина и не оказывает других значимых влияний на эндокринную систему.
Лекарственное взаимодействие
Метаболизм эстрогенов может усиливаться при их применении в сочетании с соединениями, которые индуцируют ферменты, участвующие в метаболизме лекарственных средств, в особенности, изоферменты цитохрома Р450, например, такие как противосудорожные средства (фенобарбитал, фенитоин, карбамазепин) и противомикробные средства (рифампицин, рифабутин, невирапин, эфавиренз).
Ритонавир и нелфинавир проявляют индуцирующие свойства при применении в сочетании со стероидными гормонами.
Растительные препараты, содержащие зверобой, могут индуцировать метаболизм эстрогенов.
Повышенный метаболизм эстрогенов может привести к снижению их клинического эффекта.
Эстриол усиливает действие гиполипидемических средств.
Ослабляет эффекты мужских половых гормонов, антикоагулянтов, антидепрессантов, диуретических, гипотензивных, гипогликемических средств.
Средства для общей анестезии, опиоидные анальгетики, анксиолитики, некоторые гипотензивные средства, этанол снижают эффективность препарата.
Фолиевая кислота и препараты щитовидной железы усиливают действия эстриола.
Бактериальный вагиноз
Бактериальный вагиноз (БВ) — общий инфекционный невоспалительный синдром, связанный с дисбиозом влагалищного биотопа и сопровождающийся чрезмерно высокой концентрацией облигатно- и факультативно-анаэробных условно-патогенных микроорганизмов (УПМ) и
Бактериальный вагиноз (БВ) — общий инфекционный невоспалительный синдром, связанный с дисбиозом влагалищного биотопа и сопровождающийся чрезмерно высокой концентрацией облигатно- и факультативно-анаэробных условно-патогенных микроорганизмов (УПМ) и резким снижением или отсутствием молочнокислых бактерий в отделяемом влагалища [1].
На протяжении последних 40 лет несколько раз происходило изменение терминологической интерпретации этого заболевания, вследствие чего вокруг БВ по сей день происходит много споров. До недавнего времени такие термины, как неспецифический бактериальный, гемофильный, гарднереллезный вагиниты, неспецифический вагиноз, анаэробный вагиноз, использовались для описания патологических процессов, отличных от так называемых специфических вагинитов, при этом понятие «неспецифический вагинит» только обескураживало врачей [4].
Пытаясь установить терминологическую ясность, Speigel C. A. в 1983 году предложил новый термин — бактериальный вагиноз. Начиная с 1984 г., после доклада на Первом международном симпозиуме по вагиниту в Стокгольме, L. Westrom с соавт. (1984) обосновывают выделение вагиноза в отдельный синдром. Было принято характеризовать вагиноз как состояние, сопровождающееся появлением патологических выделений из влагалища, в которых обнаруживаются самые различные микроорганизмы. Вследствие этого термин «вагинит» был окончательно заменен на «вагиноз», а само заболевание стало называться бактериальным вагинозом [16].
В 1994 г. появилось еще два новых термина. Выступая на Третьем международном симпозиуме «Вагиниты/Вагинозы» (Португалия), профессор Р.-А. Mardh (1994) предложил название вагинальный бактериоз, отметив, что это заболевание тождественно ранее называемому Haemophilus vaginalis вагиниту. На этом же симпозиуме Horowitz B. et al. (1994) ввели термин «вагинальный лактобациллез», сделав вывод, что длинные лактобактерии ассоциируются с циклическим вагинозом.
Кроме рассмотренных нами терминов, в современной литературе встречаются и другие: аминокольпит, гарднереллез, влагалищные выделения с ключевыми клетками и др. [10, 26, 27], подразумевая по сути одно и то же патологическое состояние. Совершенно очевидно, что подобное положение далеко не лучшим образом сказывается на практической деятельности врачей, а следовательно, и на качестве оказания медицинской помощи. И сегодня в зарубежной специальной литературе нет единства в терминологии. Наиболее распространенным является термин бактериальный вагиноз.
По данным различных авторов, на долю БВ приходится от 1/3 до 1/2 всех вульвовагинальных инфекций нижнего отдела половых путей [3, 6, 9].
БВ можно рассматривать как синдром с полимикробной этиологией [2]. Е. Ф. Кира в 1995 г. была предложена оригинальная классификация [4], сочетающая в себе микробиологическую интерпретацию вагинального мазка, клиническую картину и конкретную нозологическую форму (табл.).
Таким образом, при БВ нарушается микробиоценоз влагалища и возрастает роль УПМ. При этом происходит замещение нормальной микрофлоры влагалища (лактобактерий) другими микроорганизмами, в частности бактероидами, фузобактериями, пептококками, вайлонеллами, а также гарднереллами и микоплазмами [2].
С проблемой БВ сталкиваются врачи различных специальностей, но чаще акушеры-гинекологи и дерматовенерологи. Так, в странах Европы и США выявление бактериального вагиноза в клинике венерических болезней составляет 33–64%, в общей гинекологической клинике — 15–23%, по данным службы планирования семьи — 23–29%, в акушерской клинике — 10–26% [1].
Отмечено, что примерно 20% женщин репродуктивного возраста страдают БВ. В 35–50% наблюдений заболевание ассоциируется с другими урогенитальными инфекциями: гонореей, хламидиозом, уреаплазмозом, трихомониазом и др. [14].
Следует констатировать тот факт, что в настоящее время место БВ среди других инфекционных заболеваний влагалища окончательно не установлено. Вероятно, поэтому БВ не вошел в МКБ-10, где под шифром ‡‚ 76 имеются лишь «Другие воспалительные болезни влагалища и вульвы» [4].
Предложено несколько гипотез развития БВ. Несомненно влияние гормональных факторов [11]. Функция яичников определяет синтез гликогена эпителиальными клетками влагалища и, следовательно, активность репродукции лактофлоры. Гормональный компонент в этиологии БВ предполагает тот факт, что заболевание редко наблюдается в ювенильном возрасте и периоде менопаузы, что предполагает гормональный компонент в его этиологии [27]. Однако использование гормональных контрацептивов не влияет на частоту БВ, хотя теоретически пероральные контрацептивы также, как и стероидная терапия, могут влиять на состав влагалищной микрофлоры [20]. Возможно, изменения в составе лактофлоры (уменьшение видового разнообразия и общего количества, потеря способности продуцировать перекись водорода и др.) могут быть связаны с нарушением синтеза специфических рецепторов клетками-эукариотами, что меняет силу адгезии бактерий. Однако этот вопрос малоизучен [1].
Другая гипотеза придает первостепенное значение микробному антагонизму, когда лактобактерии начинают снижать продукцию кислых метаболитов [12, 20]. Саморегуляция количества лактофлоры происходит с помощью бактерицидоподобных веществ — лактоцинов, которые вырабатывают сами лактобактерии и которые ограничивают в определенной степени их размножение. Кроме того, продукция перекиси водорода лактобактериями подавляет рост УПМ, не имеющих фермента каталазы. При БВ исчезают продуцирующие перекись водорода лактобактерии (или их количество резко снижается) [17]. Нельзя также не учитывать роль таких антимикробных факторов влагалищного отделяемого, как гликопротеин, лактоферрин, ионы некоторых металлов (цинк, марганец, железо), а также лизоцим, фибропектин, которые играют заметную роль в персистенции таких УПМ, как стафилококки, стрептококки, энтеробактерии [1, 5, 15, 25]. Установлено, что внутриматочная спираль (ВМС) нарушает противобактериальную защиту цервикального канала, при этом значительно возрастает риск возникновения БВ и других инфекций. По мнению многих отечественных и зарубежных авторов, БВ встречается у 50% женщин, использующих ВМС [4, 20]. Применение антибиотиков системного или местного действия часто предшествует развитию БВ [4, 11].
БВ сопровождается выраженными нарушениями в системе местного иммунитета, которые проявляются уменьшением концентрации IgA, IgG и увеличением концентрации IgM. Нарушения в системе общего иммунитета выражаются в умеренном напряжении гуморальных факторов (увеличение содержания IgA, IgM, трансферрина и реакции торможения миграции лейкоцитов) в отсутствие реакции клеточных факторов [1].
Поскольку у 71% женщин, страдающих БВ, выявляется дисбиоз желудочно-кишечного тракта, то можно предполагать единый дисбиотический процесс в организме с доминирующим проявлением либо в репродуктивной, либо в пищеварительной системе, что подтверждают многие авторы [4, 22].
Известно, что БВ является фактором риска, а иногда и одной из причин возникновения тяжелой патологии женских половых органов и осложнений беременности и родов. Исследования ряда авторов показали, что БВ может привести к развитию хориоамнионита, послеродового эндометрита, преждевременных родов и рождению детей с низкой массой тела, возникновению воспалительных процессов половых органов, гнойно-септических осложнений у матери и ребенка в послеродовом периоде и т. д., влияя на частоту акушерской и неонатальной патологии [2].
В настоящее время особое внимание уделяется изучению взаимосвязи между БВ и плоскоклеточными интраэпителиальными поражениями (ПИП) эпителия шейки матки. Выявляются противоречивые данные относительно корреляций между БВ и ПИП. Особого внимания заслуживает сообщение о том, что нитрозамины (продукт метаболизма облигатных анаэробов) являются коферментами канцерогенеза и, следовательно, могут быть причастны к развитию рака шейки матки [12]. Канцерогенные нитрозамины при БВ, действуя непосредственно или опосредованно через вирус папилломы человека (ВПЧ), способствуют развитию ПИП [33].
Но в ряде работ, выполненных в последние годы, достоверно показано, что у больных с БВ плоскоклеточные интраэпителиальные поражения встречались не чаще, чем у пациенток с нормальной влагалищной микрофлорой. Значительная разница количества нитрозаминов также не была выявлена у женщин с БВ и нормальной влагалищной флорой. В этих работах корреляции между БВ и ПИП выявлено не было [18, 27, 28].
Однако ряд исследований показывают, что БВ может увеличивать риск заражения и активации ВПЧ, что связано с тем, что влагалищная среда играет определенную роль в восприимчивости к ВПЧ. Папилломавирусной инфекции отводится ведущая роль в развитии ПИП. Но БВ не влияет на персистенцию ВПЧ, и эффекта БВ недостаточно для развития цервикальной интраэпителиальной неоплазии [28].
Выделяют 2 варианта клинического течения БВ: бессимптомное и с клиническими симптомами. У 50% женщин БВ может протекать бессимптомно. При бессимптомном течении отсутствуют клинические проявления заболевания наряду с положительными лабораторными признаками. Остальные пациентки с БВ, как правило, предъявляют жалобы на обильные выделения из половых путей белого или серого цвета, часто с неприятным запахом, описываемым как «рыбный», особенно после незащищенного полового акта или во время менструации. Поскольку семенная жидкость имеет рН 7,0, после эякуляции соответственно возрастает вагинальная рН, вследствие чего амины переходят в свободное состояние и, являясь летучими, обусловливают этот запах. Его усиление в связи с половым актом служит определенным дифференциально-диагностическим признаком БВ. Длительность существования этих симптомов может исчисляться годами. При прогрессирующем процессе выделения приобретают желтовато-зеленоватую окраску, становятся более густыми, обладают свойством пениться, слегка тягучие и липкие, равномерно распределяются по стенкам влагалища. Количество белей варьирует от умеренных до весьма обильных. У большинства пациенток наблюдаются диспареуния и дизурические явления. 25–30% женщин предъявляют жалобы на жжение и зуд в области вульвы и боли во влагалище. Эти симптомы могут иметь различную выраженность и продолжаться годами [23]. У 50% пациенток с БВ жалобы отсутствуют [5].
Ю. К. Скрипкин выделяет 3 фазы течения БВ: свежий, торпидный и хронический БВ с инкубационным периодом от 5 дней до 3 недель. В остром периоде возможна гиперемия слизистой шейки матки и влагалища.
Диагностика БВ основана на данных клинического обследования и специальных лабораторных методов исследования. Диагноз БВ можно выставить при наличии 3 из 4 критериев, предложенных R. Amsel и названных в литературе «золотым диагностическим стандартом»:
По мнению некоторых авторов, для диагностики бактериального вагиноза достаточно 2 наиболее достоверных критериев: «ключевых» клеток и положительного аминного теста.
Первый тест имеет низкую чувствительность (56,3%) и специфичность (48,9%) [25].
рН-метрия вагинального отделяемого обладает высокой чувствительностью (80–98%), но, к сожалению, этот тест малоспецифичен (50–70%) [25].
Одним из наиболее доступных и информативных методов диагностики БВ является положительный аминный тест — усиление или появление запаха «гнилой рыбы» при смешивании равных пропорций гидроокиси калия и влагалищных выделений. Этот признак достоверен у 94% пациенток с БВ. «Рыбный» запах, вызываемый алкилированием влагалищного содержимого, свидетельствует о наличии летучих аминов, таких как кадаверин, фенетиламин, тирамин, путресцин, гистамин, изобутиламин, — продуктов метаболизма строгих анаэробов. Этот тест чувствителен у 33,9–79% и специфичен у 86,9–97% пациенток с БВ [25].
Так называемые ключевые клетки (Glue cells) — эпителиальные клетки влагалища, плотно покрытые грамвариабельными палочками, обнаруживаются при бактериоскопии влагалищного содержимого у 70–90% женщин с БВ. Однако наибольшей чувствительности (76,7%) и специфичности (92,4–98%) этот метод достигает при окраске по Граму.
Методом выбора для диагностики БВ в настоящее время считают микроскопию вагинального мазка, окрашенного по Граму, когда легко можно исключить «ложноключевые» клетки, которые могут быть связаны с адгезией лактобацилл [1, 5, 25]. Чувствительность и специфичность метода близки к 100%. При бактериоскопии мазков дополнительными признаками БВ кроме «ключевых» клеток являются:
Существуют непрямые методы диагностики БВ, имеющие большое научное значение, такие как газожидкостная хроматография, которая позволяет сравнить содержание в вагинальном отделяемом основных продуктов метаболизма лактобацилл и облигатно-анаэробных микроорганизмов — гарднерелл: молочной (Lactic acid) и янтарной (Succinic acid) кислот. В норме соотношение янтарной и молочной кислот менее 0,4, а при БВ — более 0,4. Для диагностики БВ используют определение ферментов полиаминопептидазы и сиалидазы, а также классическое микробиологическое исследование с использованием аэробной и анаэробной техники культивирования микроорганизмов и количественной оценкой микроорганизмов-ассоциантов в составе микроценоза. Эти методы необходимы для изучения этиологической структуры и патогенетических механизмов развития дисбиотических процессов в вагинальном биотопе, а также служат критерием для оценки клинического значения ускоренных методов диагностики БВ и эффективности этиотропной терапии [1].
Успешное лечение БВ, как и любого заболевания, зависит от правильной и своевременной постановки диагноза и проведения патогенетически обоснованной терапии. Цель лечения бактериального вагиноза — восстановить нормальную микрофлору влагалища, задержать рост микроорганизмов, не свойственных этому микроценозу. Терапия бактериального вагиноза остается нелегкой задачей ввиду частого рецидивирования или низкой эффективности ряда предложенных препаратов.
Результаты лечения БВ значительно улучшаются при использовании двухэтапного метода комплексной этиотропной и патогенетической терапии, разработанного в 1995 г. Е. Ф. Кирой:
1) ликвидация возбудителей БВ (облигатно-анаэробный компонент микрофлоры влагалища);
2) восстановление биоценоза влагалища.
Препаратами первого этапа для этиотропной терапии БВ являются медикаментозные препараты против анаэробной микрофлоры. Наиболее эффективно лечение метронидазолом, клиндамицином, орнидазолом, поливидон-йодом, хлоргексидином [7]. Клиническая и бактериологическая эффективность указанных препаратов достигает 85–94%. Одновременно с применением антибактериальной терапии проводится системная профилактика вагинального кандидоза [19].
Многочисленные работы последних лет свидетельствуют о том, что препаратами выбора в настоящее время считаются метронидазол и клиндамицин, которые эффективны против анаэробной микрофлоры [1, 5, 8].
Среди местных форм лечения применение нашел клиндамицин — антибиотик группы линкозамидов. Известно, что он обладает выраженной антибактериальной активностью, подавляя синтез белка в микробной клетке, взаимодействуя с 50S-субъединицами рибосом. Клиндамицин применяют как перорально, так и местно внутривлагалищно в виде кремов и овулей. Среди неблагоприятных эффектов описаны аллергические реакции, рост дрожжеподобных грибов и т. д.
В настоящее время при лечении БВ возможно использование и других препаратов группы нитроимидазола (тинидазол, орнидазол).
Ввиду возможной активации кандидозной флоры некоторые авторы рекомендуют дополнительно к лечению антианаэробными средствами добавлять антимикотики. Поэтому очень удобной формой являются сочетанные препараты, в частности препараты «Клион-Д» и «Тержинан» [11, 12].
Особого внимания заслуживает применение для лечения БВ Метрогил ® Плюс. Это комбинированный препарат для интравагинального применения, эффективность которого обусловлена наличием в его составе двух компонентов: метронидазола и клотримазола. После интравагинального введения метронидазол подвергается системной абсорбции (около 56%). Относительная биодоступность вагинального геля в 2 раза выше биодоступности одноразовой дозы (500 мг) влагалищных таблеток метронидазола. При применении клотримазола интравагинально абсорбируется не более 3–10% от введенной дозы. Высокие концентрации в вагинальном секрете и низкие концентрации в крови сохраняются в течение 48–72 часов. Препарат вводится интравагинально. Разовая доза составляет 5 г (один полный аппликатор) 2 раза в день (утром и вечером). Курс лечения — 5 дней. При необходимости курс лечения можно повторить через 2 недели.
На втором этапе лечения применяются препараты, направленные на восстановление влагалищного микроценоза. Это осуществляется путем местного применения эубиотиков — Лактобактерина, Ацилакта, Бифидумбактерина, стимулирующих рост собственной лактофлоры влагалища и способствующих снижению числа рецидивов заболевания за счет повышения защитных свойств влагалища. Эубиотики назначают по 1 свече на ночь в течение 10 дней после обязательного контрольного микробиологического подтверждения отсутствия грибов. Эубиотики являются эффективным средством восстановления нормального биоценоза влагалища.
В Омской государственной медицинской академии проведено исследование влияния нормализации микробиоценоза влагалища на возможность элиминации ВПЧ. Нами обследовано 98 женщин с папилломовирусной инфекцией (ПВИ). Всем женщинам проведено микробиологическое исследование, полимеразная цепная реакция для выявления ВПЧ, цитологическое исследование по Папаниколау и по показаниям (наличие ПИП) — гистологическое исследование биоптатов, полученных прицельно после кольпоскопии. При этом только у 29,6% (29 человек) женщин с нормоценозом состояние микроэкологии полностью соответствовало критериям нормы репродуктивного возраста: у остальных имелись отклонения, связанные либо с лейкоцитарной реакцией, либо с недостаточным количеством лактобацилл, либо с нарастанием титра факультативных условно-патогенных микроорганизмов. Интерес представляла группа женщин в количестве 24 (24,5%) человек, у которых имелось сочетание ВПЧ с БВ. Наличие БВ было подтверждено микробиологически, наличие ПВИ — методом ПЦР, цито- и гистологически.
Для лечения БВ у 24 женщин с ПВИ и БВ применялся Метрогил ® Плюс по стандартной 5-дневной схеме. После указанной терапии для восстановления нормальной микрофлоры всем женщинам был назначен эубиотик Ацилакт внутривлагалищно по 1 свече в течение 10 дней. Было отмечено полное излечение БВ на основании указанных выше критериев у 19 (79,2%) из 24 женщин, только у 2 (8,3%) пациенток эффект отсутствовал, у остальных 3 женщин имелся частичный эффект. Генитальный кандидоз развился лишь в одном случае у женщины с часто рецидивирующим кандидозом, по поводу чего было назначено соответствующее лечение антимикотическим препаратом (Микосист по 150 мг per os в течение 2 дней).
После проведенного лечения БВ через 1 месяц проведено обследование на ПВИ. При этом у 7 (29,2%) женщин с положительным эффектом лечения БВ ВПЧ не выявлялся методом ПЦР. У этих же пациенток цитологически изначально выявлялся незначительный койлоцитоз, а после лечения — исчезновение койлоцитоза отмечено у 3 (21%) женщин из 7. Вероятно, полученный факт свидетельствует о том, что лечение БВ создает благоприятные условия для элиминации ВПЧ, находящегося в эписомной (свободной) форме.
Таким образом, БВ является достаточно распространенным заболеванием экосистемы влагалища женщин репродуктивного возраста, требующим своевременной диагностики, комплексной и адекватной терапии. БВ нередко сочетается с ПВИ гениталий у женщин и другими инфекциями, передаваемыми половым путем (ИППП). Полученные различными исследователями результаты свидетельствуют о целесообразности обследования пациенток с ПВИ влагалища и шейки матки с целью выявления нарушений микробиоценоза влагалища, предпочтительно с применением микробиологического обследования [2]. При обнаружении тех или иных нарушений следует проводить соответствующее лечение, направленное на восстановление микробиоценоза, и только после этого проводить терапию ПВИ гениталий, что не только повышает ее эффективность, но и позволяет избежать возможных осложнений. Адекватное лечение БВ может уменьшать риск инфицирования ВПЧ. Необходимость дальнейшего изучения проблемы БВ ввиду своей актуальности не вызывает сомнений. Последовательное ее решение будет способствовать улучшению репродуктивного здоровья и качества жизни женщин.
По вопросам литературы обращайтесь в редакцию.
Е. Б. Рудакова, доктор медицинских наук, профессор
С. И. Мозговой, кандидат медицинских наук, доцент
О. В. Лазарева
ОмГМА, Омск
_575.gif)
_575.gif)
_575.gif)