Фенол что это
Фенол что это
Фенол
Химическое название
Химические свойства
Что такое Фенол? Гидроксибензол, что это такое? Согласно Википедии – это один из простейших представителей своего класса ароматических соединений. Фенолы – это органические ароматические соединения, в молекулах которых к гидроксильной группе присоединены атомы углерода из ароматического кольца. Общая формула Фенолов: С6Н6n(ОН)n. Согласно стандартной номенклатуре, органические вещества этого ряда различают по числу ароматических ядер и ОН-групп. Различают одноатомные аренолы и гомологи, двухатомные арендиолы, терхатомные арентриолы и многоатомные формулы. Также Фенолам свойственно иметь ряд пространственных изомеров. Например, 1,2-дигидроксибензол (пирокатехин), 1,4-дигидроксибензол (гидрохинон) являются изомерами.
Спирты и Фенолы отличаются друг от друга наличием ароматического кольца. Этанол является гомологом метанола. В отличие от Фенола, метанол взаимодействует с альдегидами и вступает в реакции этерификации. Утверждение, что гомологами являются метанол и Фенол неверно.
Его подробно рассмотреть структурную формулу Фенола, то можно отметить, что молекула представляет собой диполь. При этом бензольное кольцо – отрицательный конец, а группа ОН – положительный. Наличие гидроксильной группы обуславливает повышение электронной плотности в кольце. Неподеленная пара электронов кислорода вступает в сопряжение с пи-системой кольца, а для атома кислорода характерна sp2 гибридизация. Атомы и атомные группы в молекуле обладают сильным взаимным влиянием друг на друга, и это отражается на физических и химических свойствах веществ.
Физические свойства. Химическое соединение имеет вид бесцветных игольчатых кристаллов, которые розовеют на воздухе, так как подвержены окислению. У вещества специфический химический запах, оно умеренно растворимо в воде, спиртах, щелочи, ацетоне и бензоле. Молярная масса = 94,1 грамм на моль. Плотность = 1,07 г на литр. Кристаллы плавятся при 40-41 градусах Цельсия.
С чем взаимодействует Фенол? Химические свойства Фенола. В связи с тем, что молекула соединения содержится, как ароматическое кольцо, так и гидроксильную группу, то оно проявляет некоторые свойства спиртов и ароматических углеводородов.
С чем реагирует группа ОН? Вещество не проявляет сильных кислотных свойств. Но является более активным окислителем, чем спирты, в отличие от этанола взаимодействует с щелочами образуя соли-феноляты. Реакция с гидроксидом натрия: С6Н5ОН + NaOH → C6H5ONa + H2O. Вещество вступает в реакцию с натрием (металлическим): 2C6H5OH + 2Na → 2C6H5ONa + H2.
Фенол не реагирует с карбоновыми кислотами. Эфиры получают при взаимодействии солей фенолятов с галогенангидридами или ангидридами кислот. Для химического соединения не характерны реакции образования простых эфиров. Эфиры образуют феноляты при действии на них галогеналканов или галогенпроизводных аренов. Гидроксибензол реагирует с цинковой пылью, при этом происходит замещение гидроксильной группы на Н, уравнение реакции выглядит следующим образом: C6H5OH + Zn → C6H6 + ZnO.
Химическое взаимодействие по ароматическому кольцу. Для вещества характерны реакции электрофильного замещения, алкилирования, галогенирования, ацилирования, нитрования и сульфирования. Особое значение имеет реакций синтеза салициловой кислоты: C6H5OH + CO2 → C6H4OH(COONa), протекает в присутствии катализатора гидроксида натрия. Затем при воздействии соляной кислоты образуется салициловая к-та.
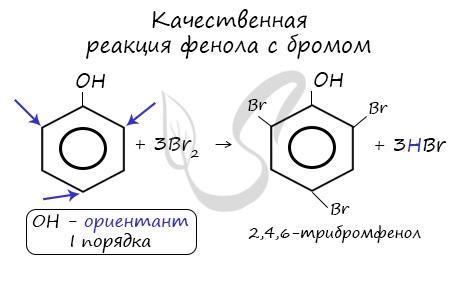
Реакция взаимодействия с бромной водой является качественной реакцией на Фенол. C6H5OH + 3Br2 → C6H2Br2OH + 3HBr. При бромировании образуется твердое белое вещество — 2,4,6-трибромфенол. Еще одна качественная реакция – с хлоридом железа 3. Уравнение реакции выглядит следующим образом: 6C6H5OH + FeCl3 → (Fe(C6H5OH)6)Cl3.
Реакция нитрования Фенола: C6H5OH + 3HNO3 → C6H2(NO2)3OH + 3 H2O. Для вещества также характерна реакция присоединения (гидрирования) в присутствии металлических катализаторов, платины, оксида алюминия, хрома и так далее. В результате образуются циклогексанол и циклогексанон.
Химическое соединение подвергается окислению. Устойчивость вещества значительно ниже, чем у бензола. В зависимости от условий реакции и природы окислителя образуются разные продукты реакции. Под действием перекиси водорода в присутствии железа образуется двухатомный Фенол; при действии диоксида марганца, хромовой смеси в подкисленной среде – пара-хинон.
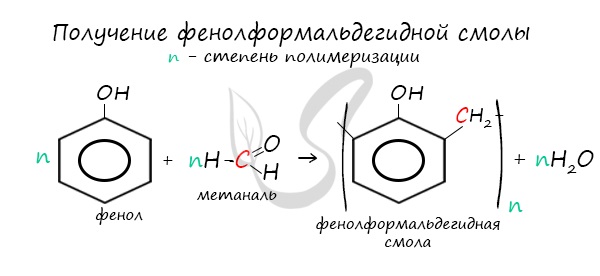
Фенол реагирует с кислородом, реакция горения: С6Н5ОН +7О2 → 6СО2 + 3Н2О. Также особое значение для промышленности имеет реакция поликонденсации с формальдегидом (например, метаналем). Вещество вступает в реакцию поликонденсации до тех пор, пока не израсходуется полностью один из реагентов и не образуются огромные макромолекулы. В результате образуются твердые полимеры, фенолформальдегидные или формальдегидные смолы. Фенол не взаимодействует с метаном.
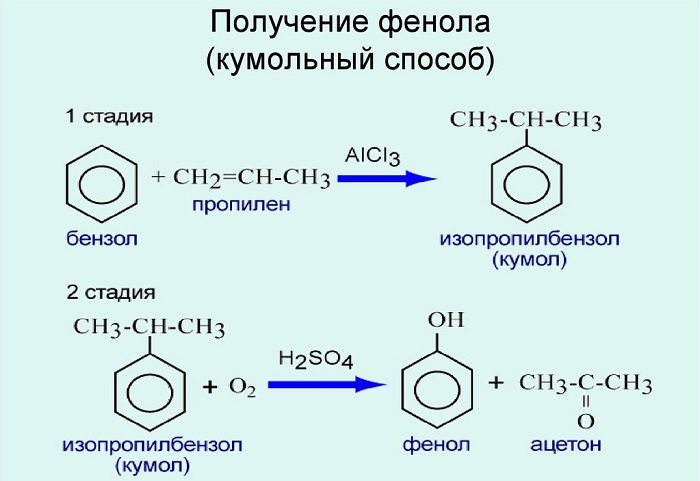
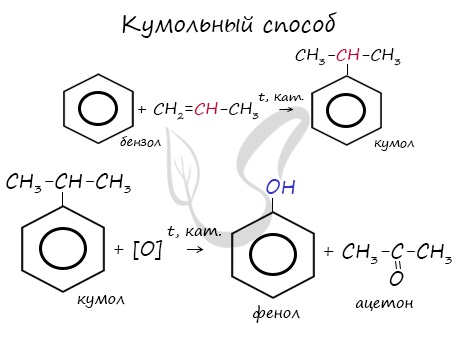
Получение. На данный момент существуют и активно применяются несколько методов синтеза гидроксибензола. Кумольный способ получения Фенола является наиболее распространенным из них. Таким способом синтезируют порядка 95% всего объема производства вещества. При этом некаталитическому окислению воздухом подвергается кумол и образуется гидропероксид кумола. Полученное соединение разлагается под действием серной кислоты на ацетон и Фенол. Дополнительным побочным продуктом реакции является альфа-метилстирол.
Также соединение можно получить при окислении толуола, промежуточным продуктом реакции будет являться бензойная кислота. Таким образом, синтезируют около 5% вещества. Все остальное сырье для различных нужд выделяют из каменноугольной смолы.
Как получить из бензола? Фенол можно получить с помощью реакции прямого окисления бензола NO2 (закись азота) с дальнейшим кислотным разложением гидропероксида втор-бутилбензола. Как из хлорбензола получить Фенол? Существует два варианта получения из хлорбензола данного химического соединения. Первый – реакция взаимодействия со щелочью, например, с гидроксидом натрия. В результате образуется Фенол и поваренная соль. Второй – реакция с водяным паром. Уравнение реакции выглядит следующим образом: C6H5-Cl + H2O → C6H5-OH + HCl.
Получение бензола из Фенола. Для этого сначала требуется обработать бензол хлором (в присутствии катализатора), а затем прибавить к полученному соединению щелочь (например, NaOH). В итоге образуется Фенол и хлорид натрия.
Превращение метан — ацетилен — бензол — хлорбензол можно осуществить следующим образом. Сначала проводится реакция разложения метана при высокой температуре 1500 градусов Цельсия до ацетилена (С2Н2) и водорода. Затем ацетилен при особых условиях и высокой температуре переводят в бензол. К бензолу прибавляют хлор в присутствии катализатора FeCl3, получают хлорбензол и соляную кислоту: C6H6 + Cl2 → C6H5Cl + HCl.
Одним из структурных производных Фенола является аминокислота тирозин, которая имеет важное биологическое значение. Данную аминокислоту можно рассмотреть в виде пара-замещенного Фенола или альфа-замещенного пара-крезола. Крезолы – достаточно распространены в природе на ряду с полифенолами. Также свободную форму вещества можно обнаружить в некоторых микроорганизмах в равновесном состоянии с тирозином.
Фармакологическое действие
Фармакодинамика и фармакокинетика
Средство проявляет бактерицидную активность по отношению в аэробным бактериям, их вегетативным формам и грибам. Практически не оказывает влияния на споры грибов. Вещество вступает во взаимодействие с белковыми молекулами микробов и приводит к их денатурации. Таким образом, нарушается коллоидное состояние клетки, значительно повышается ее проницаемость, нарушаются окислительно-восстановительные реакции.
В водном растворе является отличным дезинфицирующим средством. При использовании 1,25% раствора практически микроорганизмы погибают в течение 5-10 минут. Фенол, в определенной концентрации оказывает прижигающее и раздражающее действие на слизистую оболочку. Бактерицидный эффект от применения средства усиливается с ростом температуры и кислотности.
При попадании на поверхность кожи, даже если она не повреждена, лекарство быстро всасывается, проникает в системный кровоток. При системной абсорбции вещества наблюдается его токсическое действие, преимущественно на центральную нервную систему и дыхательный центр в головном мозге. Порядка 20% от принятой дозы подвергается окислению, вещество и продукты его метаболизма выводятся с помощью почек.
Показания к применению
Противопоказания
Вещество не используют:
Побочные действия
Иногда лекарственное средство может спровоцировать развитие аллергических реакций, зуд, раздражение в месте нанесения и чувство жжения.
Инструкция по применению (Способ и дозировка)
Консервацию лекарственных препаратов, сывороток и вакцин проводят с помощью 0,5% растворов Фенола.
Для наружного применения лекарство используют в виде мази. Препарат наносят тонким слоем на пораженные участки кожи несколько раз в сутки.
При лечении отита вещество используют в форме 5% раствора в глицерине. Препарат подогревают и закапывают по 10 капель в пораженное ухо на 10 минут. Затем необходимо удалить остатки лекарства с помощью ваты. Процедуру повторяют 2 раза в день в течение 4 суток.
Препараты Фенола для лечения ЛОР-заболеваний используют в соответствии с рекомендациями в инструкции. Продолжительность терапии – не более 5 дней.
Для ликвидации остроконечных кондилом их обрабатывают 60% раствором Фенола или 40% раствором трикрезола. Процедуру проводят один раз в 7 дней.
При дезинфекции белья применяют 1-2% растворы на основе мыла. С помощью мыльно-фенольного раствора обрабатывают помещение. При дезинсекции используются фенольно-скипидарные и керосиновые смеси.
Передозировка
При попадании вещества на кожу возникают жжение, покраснение кожи, анестезия пораженного участка. Поверхность обрабатывают растительным маслом или полиэтиленгликолем. Проводят симптоматическую терапию.
Симптомы отравления Фенолом при попадании внутрь. Наблюдаются сильные боли в животе, глотке, в ротовой полости, пострадавшего рвет бурой массой, бледность кожи, общая слабость и головокружение, миоз, коллапс, падение температуры тела, судороги, кома, острая печеночная недостаточность. В качестве терапии желудок промывают растительным маслом с добавлением белков, затем дают пострадавшему 10% раствор глицерола и активированный уголь. Показан прием оксида магния и глюконата кальция, форсированный диурез, тиосульфат натрия капельно внутривенно, витамины группы В. Проводят лечение токсического шока.
Взаимодействие
Лекарственное взаимодействие не происходит.
Особые указания
Фенол обладает способностью адсорбироваться пищевыми продуктами.
Средством нельзя обрабатывать обширные участки кожи.
Перед использованием вещества для дезинфекции предметов быта, их необходимо механически очистить, так как средство абсорбируется органическими соединениями. После обработки вещи могут еще длительное время сохранять специфический запах.
Химическое соединение нельзя использовать для обработки помещений для хранения и готовки пищевой продукции. Оно не влияет на окраску и структуру ткани. Повреждает поверхности, покрытые лаком.
Детям
Средство нельзя использовать в педиатрической практике.
При беременности и лактации
Фенол не назначают во время кормления грудью и при беременности.
Препараты, в которых содержится (Аналоги)
Фенол входит в состав следующих препаратов: Ферезол, Фукорцин, Фенола раствор в глицерине, Орасепт, Фармасептик. В качестве консерванта содержится в препаратах: Экстракт Белладонны, Набор для кожной диагностики медикаментозной аллергии, Постеризан и так далее.
Отзывы
Фенол – хорошее антисептическое средство, которое подходит, как для обработки инструментов и помещений, так и при лечении воспалительных ЛОР-заболеваний. При соблюдении рекомендаций врача и инструкции по применению, необходимых мер безопасности при работе с такого рода веществами, средство хорошо переносится и не вызывает негативного влияния на организм. Отзывы о применении препаратов Фенола, как правило, положительные. Особенно хорошие отзывы при лечении заболеваний горла.
Цена, где купить
Стоимость вещества для технического использования зависит от количества и производителя. Купить спрей для готовой полости Орасепт можно примерно за 400 рублей – флакон.
Образование: Окончила Ровенский государственный базовый медицинский колледж по специальности «Фармация». Окончила Винницкий государственный медицинский университет им. М.И.Пирогова и интернатуру на его базе.
Опыт работы: С 2003 по 2013 г. – работала на должностях провизора и заведующего аптечным киоском. Награждена грамотами и знаками отличия за многолетний и добросовестный труд. Статьи на медицинскую тематику публиковались в местных изданиях (газеты) и на различных Интернет-порталах.
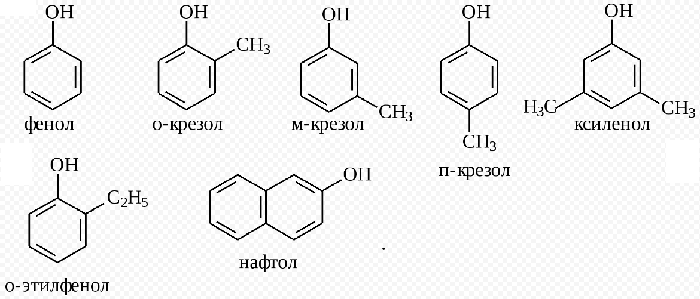
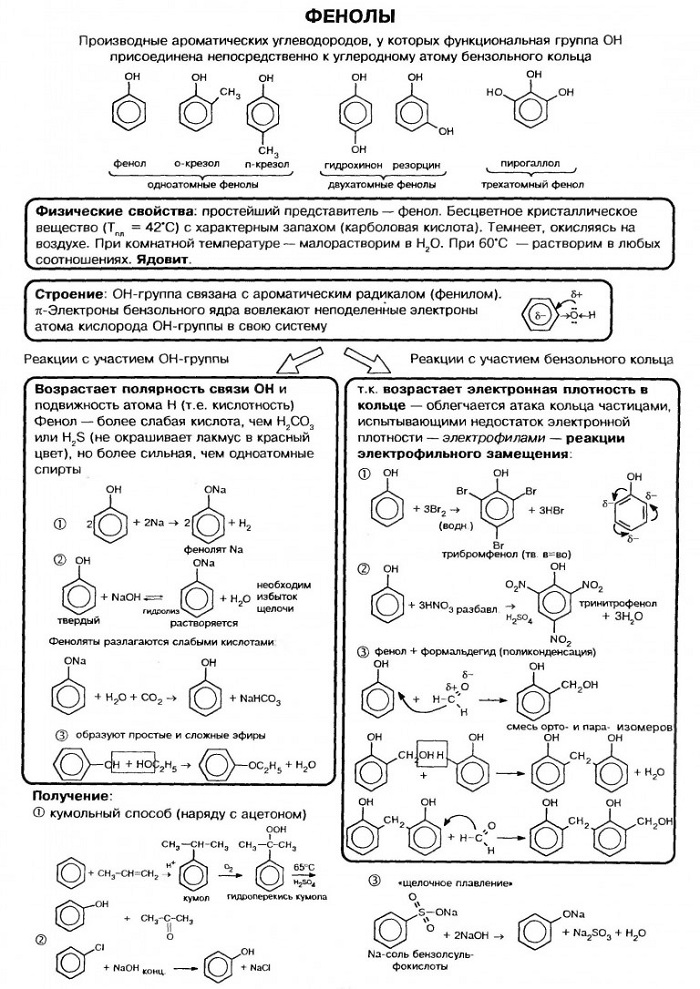
Фенолы
Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
| Спирты – это гидроксисоединения, в которых группа ОН соединена с алифатическим углеводородным радикалом R-OH. Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам. |
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
Классификация фенолов
По числу гидроксильных групп:
| Соединения, в которых группа ОН отделена от бензольного кольца углеродными атомами – это не фенолы, а ароматические спирты: |
Строение фенолов
В фенолах одна из неподеленных электронных пар кислорода участвует в сопряжении с π–системой бензольного кольца, это является главной причиной отличия свойств фенола от спиртов.
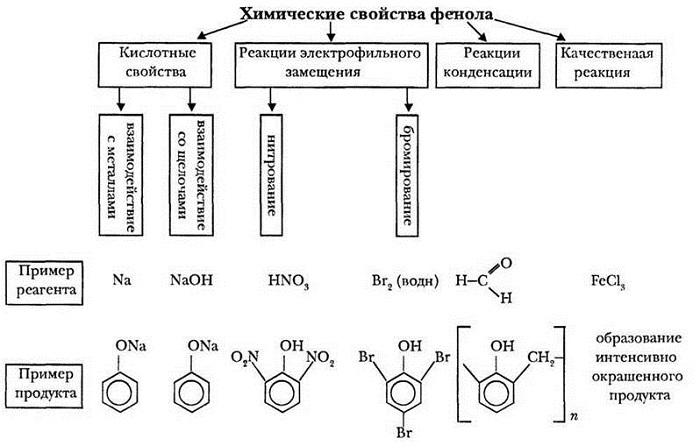
Химические свойства фенолов
Сходство: как фенол, так и спирты реагируют с щелочными металлами с выделением водорода.
Отличия:
1. Кислотные свойства фенолов
| Фенолы являются более сильными кислотами, чем спирты и вода, т. к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается. |
Раствор фенола в воде называют «карболовой кислотой», он является слабым электролитом.
1.1. Взаимодействие с раствором щелочей
В отличие от спиртов, фенолы реагируют с гидроксидами щелочных и щелочноземельных металлов, образуя соли – феноляты.
| Например, фенол реагирует с гидроксидом натрия с образованием фенолята натрия |
Так как фенол – более слабая кислота, чем соляная и даже угольная, его можно получить из фенолята, вытесняя соляной или угольной кислотой:
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Фенолы взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются феноляты. При взаимодействии с металлами фенолы ведут себя, как кислоты.
2. Реакции фенола по бензольному кольцу
| Наличие ОН-группы в бензольном кольце (ориентант первого рода) приводит к тому, что фенол гораздо легче бензола вступает в реакции замещения в ароматическом кольце. |
2.1. Галогенирование
| Фенол легко при комнатной температуре (без всякого катализатора) взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол). |
2.2. Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов.
| Например, при нитровании фенола избытком концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота): |
3. Поликонденсация фенола с формальдегидом
С формальдегидом фенол образует фенолоформальдегидные смолы.
4. Взаимодействие с хлоридом железа (III)
При взаимодействии фенола с хлоридом железа (III) образуются комплексные соединения железа, которые окрашивают раствор в сине-фиолетовый цвет. Это качественная реакция на фенол.
5. Гидрирование (восстановление) фенола
Присоединение водорода к ароматическому кольцу.
Продукт реакции – циклогексанол, вторичный циклический спирт.
Получение фенолов
1. Взаимодействие хлорбензола с щелочами
При взаимодействии обработке хлорбензола избытком щелочи при высокой температуре и давлении образуется водный раствор фенолята натрия.
При пропускании углекислого газа (или другой более сильной кислоты) через раствор фенолята образуется фенол.
2. Кумольный способ
Фенол в промышленности получают из каталитическим окислением кумола.
Первый этап процесса – получение кумола алкилированием бензола пропеном в присутствии фосфорной кислоты:
Второй этап – окисление кумола кислородом. Процесс протекает через образование гидропероксида изопропилбензола:
Суммарное уравнение реакции:
3. Замещение сульфогруппы в бензол-сульфокислоте
Бензол-сульфокислота реагирует с гидроксидом натрия с образованием фенолята натрия:
Получается фенолят натрия, из которого затем выделяют фенол:
Фенол
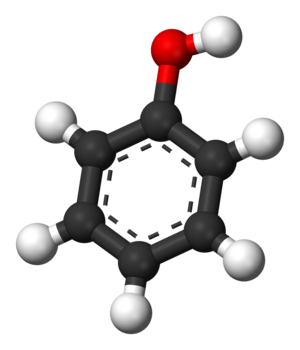
Фено́л (гидроксибензол, устар. карболовая кислота) C6H5OH — простейший представитель класса фенолов. Бесцветные игольчатые кристаллы, розовеющие на воздухе из-за окисления, приводящего к образованию окрашенных веществ. Обладают специфическим запахом гуаши. Растворим в воде (6 г на 100 г воды), в растворах щелоче́й, в спирте, в бензоле, в ацетоне. 5 % раствор в воде — антисептик, широко применяемый в медицине.
Мировое производство фенола на 2006 год составляет 8,3 млн тонн/год. По объёму производств фенол занимает 33-е место среди всех выпускаемых химической промышленностью веществ и 17-е место среди органических веществ.
Содержание
Получение
На 2006 год производство фенола в промышленном масштабе осуществляется тремя способами:
Ведутся пилотные испытания установок получения фенола прямым окислением бензола закисью азота и кислотным разложением гидропероксида втор-бутилбензола.
Фенол также можно получить восстановлением хинона.
Химические свойства
C6H5OH + 3Br2(aqua) → C6H2(Br)3OH + 3HBr образуется твердое вещество белого цвета 2,4,6 трибромфенол
6C6H5OH + FeCl3 → [Fe(C6H5OH)6]CI3 образуется трихлоридфенолят железа (III)(фиолетовое окрашивание)
Биологическая роль
Протеиногенная аминокислота тирозин является структурным производным фенола и может быть рассмотрена как пара-замещённый фенол или α-замещённый пара-крезол. В природе распространены и другие фенольные соединения, в том числе полифенолы. В свободном виде фенол встречается у некоторых микроорганизмов и находится в равновесии с тирозином. Равновесие поддерживает энзим тирозин-фенол-лиаза (КФ 4.1.99.2).
Биологическое значение фенола обычно рассматривается в рамках его воздействия на окружающую среду. Фенол — один из промышленных загрязнителей. Фенол довольно токсичен для животных и человека. Фенол губителен для многих микроорганизмов, поэтому промышленные сточные воды с высоким содержанием фенола плохо поддаются биологической очистке.
Применение
По данным на 2006 год мировое потребление фенола имеет следующую структуру:
Фенол и его производные обуславливают консервирующие свойства коптильного дыма. Также фенол используют в качестве консерванта в вакцинах. Пример использования, в качестве антисептика — препарат «Орасепт».
Токсические свойства
Фенол ядовит. Вызывает нарушение функций нервной системы. Пыль, пары и раствор фенола раздражают слизистые оболочки глаз, дыхательных путей, кожу.
Попадая в организм, фенол очень быстро всасывается даже через неповрежденные участки кожи и уже через несколько минут начинает воздействовать на ткани головного мозга. Сначала возникает кратковременное возбуждение, а потом и паралич дыхательного центра. Даже при воздействии минимальных доз фенола наблюдается чихание, кашель, головная боль, головокружение, бледность, тошнота, упадок сил. Тяжелые случаи отравления характеризуются бессознательным состоянием, синюшностью, затруднением дыхания, нечувствительностью роговицы, скорым, едва ощутимым пульсом, холодным потом, нередко судорогами. Зачастую фенол является причиной онкозаболеваний.
Примечания
Полезное
Смотреть что такое «Фенол» в других словарях:
ФЕНОЛ — в химии под этим общим названием известен ряд органических углеродистых соединений: карболовая кислота, сольвеол, лизол, резорцин, нафталин и др. Полный словарь иностранных слов, вошедших в употребление в русском языке. Попов М., 1907. ФЕНОЛОВАЯ… … Словарь иностранных слов русского языка
фенол — сущ. • карболовая кислота • карболка Словарь русских синонимов. Контекст 5.0 Информатик. 2012. фенол сущ., кол во синонимов: 15 • … Словарь синонимов
ФЕНОЛ — (карболовая кислота), C6H5OH, бесцветные, розовеющие на воздухе кристаллы, tпл 43шC. Выделяют из каменноугольной смолы или получают синтетически. Сырье в производстве синтетических смол (например, феноло формальдегидных), капролактама, красителей … Современная энциклопедия
ФЕНОЛ — ФЕНОЛ, фенола, муж. (от греч. phaino освещаю и лат. oleum масло) (хим.). Карболовая кислота. || чаще мн. Общее название группы веществ, представляющих собой производные бензола, как и карболовая кислота. Толковый словарь Ушакова. Д.Н. Ушаков.… … Толковый словарь Ушакова
ФЕНОЛ — ФЕНОЛ, а, муж. Карболовая кислота. | прил. феноловый, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
Фенол — – производные бензола с одной или несколькими гидроксильными группами. Применяется в производстве фенолформальдегидных пластмасс, синтетического волокна капрона, красителей, пестицидов, лекарственных препаратов (аспирин, салол) … Нефтегазовая микроэнциклопедия
ФЕНОЛ — (карболовая кислота C6H5OH) бесцветные (розовеют на воздухе) кристаллы с характерным запахом. Ф. ядовит. Получают из каменноугольной смолы. Применяют в производстве феноло формальдегидных смол, синтетического волокна, красителей, пестицидов,… … Российская энциклопедия по охране труда
феноліт — іменник чоловічого роду … Орфографічний словник української мови
Фенолы в сточной и питьевой воде: индекс, методы очистки, нейтрализация
Фенолы – широко распространенные антропогенные загрязнения. Чрезвычайно опасные органические соединения ароматического ряда губительны для многих микроорганизмов, поэтому промышленные сточные воды с высоким содержанием токсиканта плохо поддаются биологической очистке.
Фенолы в сточной воде
Технологии химической и нефтеперерабатывающей промышленности изначально создавались без учета очистки стоков. Небольшие производства не оказывали заметного влияния на окружающую среду. С техническим прогрессом возросло количество химических соединений, практически неразлагаемых в природе, и на проблему опасных стоков обратили внимание.
Летучие и нелетучие фенолы – разница
Фенолы разделяются на 2 группы по признаку летучести. К летучим фенолам (отгоняемым с водяным паром) причислены:
Летучие фенолы – основная часть фенольных стоков. До 50% общего количества фенолов составляет карболовая кислота, крезолы – от 30 до 60%; содержание же многоатомных фенолов достигает 15%.
Летучие фенолы, кроме п-крезола и других фенолов, замещенных в пара-положении, реагируют с 4-аминоантипирином в щелочной среде (рН 10,0 ±0,2). Это интенсивно пахнущие вещества. Летучие фенолы существенно ухудшают санитарное состояние водоемов. На водопроводных станциях, где вода обеззараживается хлорированием, содержание в питьевой воде летучих фенолов жестко лимитируется. Хлорпроизводные фенола (особенно крезолы) имеют неприятный запах даже в самых малых количествах.
Летучие и нелетучие фенолы различаются по температуре кипения
| Группа | Температура кипения фенолов при давлении 760 мм. рт. ст. |
| Летучие фенолы (одноатомные): | |
| фенол | 181,8 °С |
| крезол | 190,8 °С |
| ксиленол | 210-225 °С |
| Нелетучие (многоатомные) | |
| пирокатехин | 245,9 °С |
| резорцин | 280 °С |
| гидрохинон | 287 °С |
Фенол, крезол, ксиленол окисляются до CO2 и H2O, а пирокатехин, гидрохинон и другие многоатомные фенолы распадаются не до конца, образуя промежуточные продукты, устойчивые в отношении биохимического окисления.
Как появляются в природе?
Фенол и фенольные соединения свойственны природе, эти вещества появляются в экосистемах в результате обменных процессов водных организмов, высших растений, при биохимическом распаде органики в толще воды. К синтезу фенола способен ряд организмов в ответ на нападение насекомых, ранение или облучение ультрафиолетом. Чаще в природе встречаются производные фенола (биофлавоноид кверцитин, аминокислота тирозин, витамин токоферол), но и в свободной форме фенол тоже не редок.
К примеру, в хвое пихты сибирской содержится до 2,42% фенола в пересчете на абсолютно сухую хвою. В траве тимьяна обыкновенного обнаружен тимол, в листьях и семенах груши – гидрохинон.
Откуда берутся в воде?
В поверхностные водоемы фенол поступает в составе сточных вод, сбрасываемых:
Фенолы уходят в стоки при изготовлении красителей, в процессе переработки каменного угля и в производстве дубильных веществ. Даже изготовление ушных капель и средств для полоскания рта вносит свой негативный вклад в загрязнение сточных вод соединениями фенола.
Водные экосистемы постоянно подвергаются антропогенному воздействию, негативно влияющему на качество воды. Деятельность животноводческих хозяйств с постоянными навозными стоками, использование удобрений в сельском хозяйстве, неэффективная ирригация, стройки по берегам рек, загрязненные сточные воды крупных производств нарушают природный баланс водоемов. В природных водах все чаще регистрируют превышение по тяжелым металлам и ртути, наблюдают гибель гидробионтов, цветение вод и снижение их биоразнообразия.
Сточная, природная и питьевая вода
Вода квалифицируется и подразделяется на типы, исходя из самых разных признаков и факторов. Изначально вся влага на планете была природной, состоящей из воды океанов, морей, рек, озер, ледников, подземных источников, атмосферных осадков. С развитием хозяйственно-бытовой деятельности человека для используемой воды стали применять следующие понятия:
Термин «сточные воды» обозначает воды, использованные на промышленные и бытовые нужды и при этом загрязненные дополнительными примесями, меняющими её первоначальные физико-химические свойства. Под этот тип подходят также талые и дождевые потоки, уходящие с территорий населенных пунктов и промышленных предприятий.
Понятие «питьевая вода» характеризует воду, предназначенную для питья и бытовых потребностей населения и отвечающую всем гигиеническим нормативам, в том числе и по уровню фенолов.
Класс опасности фенола
Грязные массы воды, сброшенные с крупных производств, резко повышают уровень фенола в природной воде. Фенольные стоки серьезно изменяют концентрацию кислорода в речной воде. В жаркий сезон скорость распада фенолов в природных водоемах увеличивается, но в зимний период процессы замедляются.
Далее из природных источников при недостаточно эффективной очистке водного ресурса фенолы попадают в водопроводную сеть.
Согласно СанПиН 1.2.3685-21 содержание фенола в питьевой воде не должно превышать 0,001 мг/дм3, но при недостаточной водоподготовке токсичные примеси удаляются не полностью. В процессе дезинфицирующего хлорирования питьевой воды фенолы превращаются в хлорфенолы, особенно при кипячении. Появление в питьевой воде таких соединений обуславливает ее специфический лекарственный запах.
Фенольный индекс, ПДК
Для летучих алкифенолов (простой фенол, крезолы, гваякол, этилфенол) введен обобщенный показатель – «фенольный индекс».
Фенольный индекс отличается от реального содержания фенолов в их модельной смеси в 3-5 раз.
Влияние на природу
Угроза для человека
Фенол проникает в организм человека при непосредственном контакте с разлитым реагентом, вместе с питьем, через пищу и воздух, в момент применения медицинских и косметических товаров, во время курения. При точечном попадании фенола на кожу образуются язвы и сильные ожоги, а контакт больших площадей тела (более 25 %) с разбавленным раствором фенола приводит к гибели.
Фенол вступает в организме в химические реакции и накапливается там. Чем выше концентрация токсина в крови, тем серьезнее последствия фенольного отравления для человека. Безопасной (условно) считается доза 0,6 мг фенола на 1 кг живого веса, попавшая в организм человека в течение одних суток (по данным Управления по охране окружающей среды США). В расчетах не учтен канцерогенный эффект фенола, который потенциально проявится длительное время спустя.
Острое отравление фенолом при попадании его с водой в желудочно-кишечный тракт вызывает боль в глотке, раны во рту, ожоги слизистых, тошноту, рвоту, диарею. Артериальное давление снижается, развивается бледность кожных покровов, симптомы сердечной недостаточности, возможны судорожные спазмы, боль в животе. Моча бурого цвета быстро темнеет на воздухе. Вероятная летальная доза для человека при пероральном приеме 50-500 мг/кг, а проглатывание 1 грамма вещества смертельно.
При длительном отравлении фенолом развивается анорексия, наблюдается обильное слюноотделение. Люди теряют вес, ощущают слабость и боль в мышцах. Поражаются печень и почки, нервная система и легкие.
Методы определения фенолов
Для анализа воды на содержание в ней фенолов в лабораторной практике используются следующие методы:
Метод выбирают в зависимости от задач исследования химического состава контролируемого объекта.
Фотометрический
При определении фенола фотометрическим методом (ПНД Ф 14.1:2.105-97) летучие фенолы отгоняются с водяным паром из предварительно подкисленной пробы воды. Далее к отгону прибавляют 4-аминоантипирин и гексацианоферрат (III) калия и проводят экстракцию окрашенного соединения хлороформом. На спектрофотометре или фотоэлектроколориметре при длине волны λ = 460 нм и λ = 460-490 нм соответственно измеряют оптическую плотность экстракта.
Газо-жидкостная хроматография
Метод газо-жидкостной хроматографии основан на взаимодействии гидроксибензола (фенола) с бромирующим реактивом в присутствии слабого раствора серной кислоты. Избыток брома удаляют раствором сернистого натрия. Образовавшийся трибромфенол экстрагируют гексаном, гексановый экстракт хроматографируют на газовом хроматографе с электронозахватным детектором.
Броматометрическое титрование
Определение фенола броматометрическим методом основано на титровании анализируемой пробы воды избытком бромат-бромидной смеси, приготовленной из навесок KBrO3 и KBr.
Образующийся бром вступает в реакцию с фенолом:
При добавлении иодида калия, избыточный, не прореагировавший бром окисляет иодид до йода, который оттитровывают стандартным раствором Na2S2O3:
Флуориметрический
В ходе флуориметрического анализа фенол экстрагируется из воды растворителем бутилацетатом. Далее проводится реэкстракция фенолов в водный раствор NaOH, а затем определение их концентрации на анализаторе жидкости «Флюорат».
Летучие фенолы методом флуориметрии определяются после предварительной отгонки фенолов при помощи перегонного устройства.
Очистка вод от загрязнения фенолами
Методы обесфеноливания воды условно делятся на две группы:
Регенеративные методы нейтрализации
Регенеративный метод предполагает возвращение фенола в процесс производства или его переработку в альтернативные продукты. Так фенол иногда переводят в резольные смолы, используемые в дальнейшем для производства фанеры, или в фениловые эфиры полиэтиленгликоля.
Очистка испарением
Паровой метод предполагает выдувание фенолов большим объемом водяного пара из сточной воды, предварительно доведенной до кипения. Далее смесь пара и фенолов пропускается через горячий поглотительный раствор щелочи (100-103 ⁰С). При взаимодействии щелочи и фенолов образуются феноляты.
Но при очистке испарением сточная вода от фенолов освобождается не полностью, так как часть фенолятов остается в дистилляционной колонне перед обесфеноливанием воды.
Экстракция
Метод очистки экстракцией базируется на смешивании фенолсодержащей воды с растворителем, в котором гидроксибензол растворим легче, чем в воде. Важное условие – растворитель не должен сам растворяться в воде. Фенол переходит из загрязненных вод в растворитель, вода с растворителем смешиваться не способна, поэтому образуются два слоя, которые можно без труда разделить декантацией.
Метод экстракции дорог, так как требует специализированных растворителей (это трикрезилфосфат, фенолсольван) и последующей их отгонки. Бюджетные растворители – хинолин и анилин практически полностью извлекают фенол из воды, но сами смешиваются со стоками, создавая опасное загрязнение.
Мембранные технологии
Для очищения стоков применяют технологии, основанные на способности ультрапористых перегородок (полупроницаемых мембран) избирательно пропускать через себя компоненты очищаемых растворов.
| Виды мембранных процессов для извлечения фенолов из воды | Особенности процесса |
| обратный осмос | Вода (растворитель) под давлением проникает из более концентрированного раствора через синтетическую полупроницаемую мембрану в менее концентрированный раствор (обратный осмос). Мембранный барьер не препятствует растворителю, но мешает некоторым растворённым в нём веществам. Метод позволяет отделить органические молекулы массой 100 дальтон и даже менее. |
| нанофильтрация | Фильтрация происходит через ультрапористую мембрану при рабочем давлении 1-10 атм. В процессе очистки отделяются органические молекулы с массой более 300 дальтон. |
Для очистки фенолсодержащих вод часто применяются комбинированные методы, совмещающие мембранные и традиционные варианты очистки:
Мембраны чувствительны к жесткости воды, поэтому поступающую воду предварительно требуется очищать менее тонкими методами. Со временем проницаемость мембран снижается из-за эффекта «концентрационной поляризации», когда у поверхности полупроницаемого барьера скапливаются разделяемые вещества.
В то же время мембранный способ очистки вод энергосберегающий, не требует нагревания и почти полностью исключает взаимодействие между веществами в растворе. Фенолы выделяются из весьма разбавленной воды в достаточно высокой концентрации, которую можно повторно использовать. При реализации мембранного метода не требуются дополнительные реагенты, а, значит, не происходит вторичное загрязнение сточных вод.
Удаление адсорбцией
Несмотря на развитие электрохимических и мембранных методов водоочистки, абсорбционный метод очистки сточных вод от примесей остается наиболее востребованным.
Суть удаления примесей абсорбцией заключается в пропускании загрязненной воды через слой сорбента. Сорбент способен физически улавливать молекулы фенола за счет вандерваальсовых сил или образовывать с токсином химические связи.
К сорбентам предъявляются общие требования:
Для улавливания фенола в сточных водах применяют органические полимерные сорбенты («Полисорб», Poropak), ионообменные смолы, неорганические сорбенты (силикагели, цеолиты природного происхождения и синтезированные), активные угли, активированные углеродные волокна и ткани.
Биологические способы очистки
Биологический метод обесфеноливания воды основан на способности некоторых микроорганизмов окислять фенолы.
Для биологической очистки воды от фенола используют комбинацию активного ила, в состав которого входят коловратки, инфузории, жгутиковые, нитчатые бактерии, корненожки, зооглеи и группы специальных микроорганизмов-деструкторов токсинов. Эффективность разложения фенола при биологическом методе зависит от качества жизни организмов, осуществляющих очистку. Микроорганизмы-деструкторы чувствительны к факторам среды. Сточная вода, подвергаемая обесфеноливанию в биологическом бассейне, должна удовлетворять следующим условиям:
Биологический метод глубоко очищает воду от фенола, но при этом требует больших площадей для обустройства ирригационных бассейнов и четкого контроля за процессом.
Можно ли избавиться в быту?
Если вода из крана внезапно приобрела аптечный запах, самостоятельно очищать и затем пить эту воду нельзя. Фенол – опасное вещество, способное вызвать тяжелые поражения организма человека. Токсикант, легко растворяющийся в воде, бытовыми способами удалить не получится. Если вода из-под крана запахла «карболкой», необходимо сообщить об этом в аварийную службу ЖЭКа, ДЭЗа или ТСЖ, обратиться в городской Водоканал или санэпидемстанцию.
Но в быту можно позаботиться о доочистке поступающей из водопровода воды, установив в квартире или коттедже систему обратного осмоса с фильтрами, минерализатором и высокоселективной мембраной.
Современные бытовые фильтры справляются с очисткой воды от загрязнителей разного происхождения:
Осведомленность о фенолах, как наиболее часто встречаемых, токсичных и одновременно трудноудаляемых техногенных загрязнениях, необходима для грамотного решения задач по очистке воды и охране окружающей среды.
Фенолы – органические соединения. Они в небольших количествах есть в природе. Основную массу фенола и производных на его основе получают синтетическим путём.
Что такое фенол
К фенолам относят производные ароматических углеводородов, в молекулах которых гидроксильные группы связаны с фенил радикалом. Они могут иметь одну или несколько гидроксогрупп.
Самым простым представителем этой группы соединений считают фенол. Он и дал название классу веществ. Это же соединение называют гидроксибензолом.
Общая и структурная формулы
Простейший представитель класса имеет 1 гидроксогруппу. Его молекулярная формула С6Н5ОН. Структурная формула — ОН.
Если в молекуле фенола 1 атом водорода заместить на метильный радикал, получим метилфенол. Если к нему прибавить ещё одно бензольное ядро, получим нафтол.
Химические свойства фенола
Так как гидроксибензол содержит в своём составе 2 группы атомов, выделяют две группы химических свойств.
Свойства, идущие за счет фенил радикала:
Свойства, протекающие за счёт гидроксильной группы (кислотные свойства):
взаимодействие с активными металлами;
взаимодействие со щелочами.
Не следует понимать, что фенол, имея в своем составе черты строения бензола и спиртов, просто повторяет их свойства. На самом деле все сложнее. Чтобы понять особенность его химических взаимодействий, необходимо знать строение вещества. В молекуле фенола наблюдается взаимное влияние атомов.
На атоме кислорода гидроксильной группы есть 2 неподелённые электронные пары. Они взаимодействуют с π – электронной системой фенил радикала.
Результат взаимодействия следующий:
Нарушается равномерное распределение электронной плотности в фенил радикале. Она возрастает на атомах 2,4,6, то есть в орто– и параположениях. Именно в этих положениях водород будет легко замещаться на другие атомы.
Атом водорода гидроксогруппы, из-за влияния фенил радикала, приобретает положительный заряд и становится более подвижным.
Результатом влияния служат своеобразные свойства фенола. Он реагирует с активными металлами и щелочами. Спирты – только с металлами. В то же время и бензол, и гидроксибензол реагируют с бромной водой. Но у фенола, в отличие от бензола, идет замещение сразу по 3 атомам.
Физические свойства
С6Н5ОН – это белое кристаллическое вещество. В результате окисления кристаллы могут приобретать розовый цвет. Температура плавления 40,9 0 С. Молярная масса 94 г/моль.
В холодной воде фенол является малорастворимым веществом. При температуре выше +70 0 С растворяется хорошо. Карболовая кислота – так называют водный раствор фенола. Лучше растворяется в органических растворителях.
Отличается характерным резким запахом. Вещество ядовито. Проникая в организм человека, вызывает тяжёлое отравление.
С чем реагирует фенол
Гидроксибензол вступает в реакцию с активными металлами. С натрием даёт фенолят натрия. Уравнение выглядит следующим образом:
В реакциях со щелочами также образует феноляты. Реагируя с гидроксидом калия, образует фенолят калия:
Взаимодействуя со спиртами, образует эфиры. Например, в реакции с бутанолом, получают простой эфир:
Из свойств, протекающих за счёт фенил радикала, можно отметить реакцию нитрования. Взаимодействие с HNO3 даёт 2,4,6 тринитрофенол (пикриновую кислоту):
Реагируя с формальдегидом, фенол образует фенолформальдегидную смолу. Это реакция поликонденсации – получение высокомолекулярного вещества из низкомолекулярных веществ с отщеплением побочного продукта. В данном случае – это вода.
Качественные реакции на фенол
К качественным реакциям относят взаимодействие с бромной водой. В результате получают осадок белого цвета:
Ещё одной качественной реакцией является взаимодействие с хлоридом железа(III). Получается фиолетовое окрашивание. Качественные реакции позволяют разделить и определить органические вещества.
Реакция присоединения
К реакциям присоединения относят гидрирование ароматического ядра. Гидрирование – это реакции присоединения водорода. Превращение протекает легко, в присутствии катализатора. В результате разрушается π – электронная система, образуется циклогексанол и циклогексанон:
Окисление
Фенол не устойчив к окислению. Продукты реакции могут быть разными. Это зависит от самого окислителя и от условий, в которых протекает реакция. При окислении перекисью водорода получается двухатомный фенол:
К реакции окисления относят и реакцию горения. Образуется углекислый газ и вода.
Получение фенола
Фенол в небольшом количестве содержится в каменноугольной смоле. Но потребности в веществе настолько велики, что этого источника недостаточно.
Разработаны разные способы получения:
Используют для получения бензол и пропилен, в результате чего получают кумол. Затем кумол окисляют, в результате получают ценные продукты – фенол, ацетон.
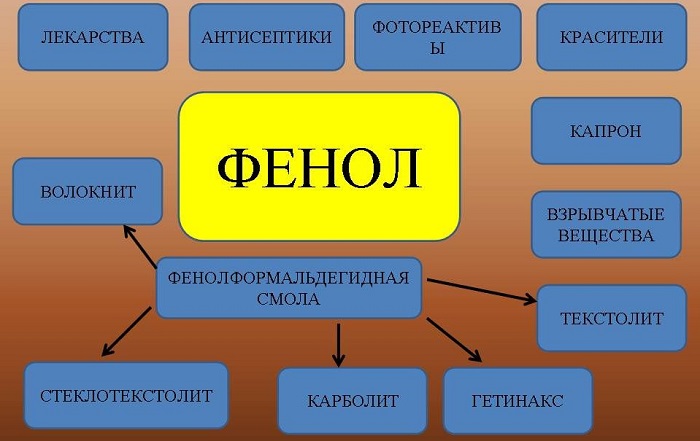
Применение
Вещество применяют для производства разнообразной продукции:
фенолформальдегидных смол и пластмасс;
раствор фенола в воде обладает антисептическими свойствами;
искусственных волокон и другой продукции.
Заключение
Фенол и фенольные соединения – очень важная группа веществ. Не следует забывать, что многие из них являются ядами. Все отходы промышленности, содержащие вещество, тщательно очищаются. Их подвергают каталитическому окислению, обработке озоном и другим способам очистки.
Свойства фенола и его влияние на организм человека
Фенол является простейшим представителем веществ, которые относятся к классу фенолов или так называемых ароматических углеводородов. Чаще всего это вещество используется для нужд строительства, производства органических материалов (пластмассы) и химической промышленности. Также он востребован и в других отраслях науки, в том числе в медицине и сельскохозяйственной химии.
Основные характеристики вещества
В 1834 году, в процессе перегонки каменноугольных смол было открыт фенол, причём его не синтезировали, как некоторые другие вещества, а выделили из угольных пластов. За более чем полтора века вещество успело поменять название (старое название — «карболовая кислота», химики до сих пор называют его «карболка»).
На сегодняшний день наименование химического соединения, к которому относится фенол — гидроксибензол. Со временем были уточнены некоторые физические свойства фенола, которые в XIX веке установить без погрешностей было проблематично. Молярная масса фенола равна 94,11 г/моль, его плотность составляет 1.07 грамм на кубический сантиметр.
Интересно, что при температуре в 40,9 градусов по Цельсию вещество — которое в своём обычном агрегатное состоянии является кристаллическим — начинает плавиться, приобретая характерный оттенок. При обычной (комнатной) температуре фенол представляет собой небольшие кристаллы, не имеющие цвета. Эти кристаллы сильно пахнут гуашью, запах фенола очень специфичен и способен надолго «прицепляться» к предметам и одежде.
Способность гидроксибензола к образованию однородных систем с другими веществами (проще говоря, растворимость) не очень высокая, это вещество не может полностью раствориться в воде. Фенол, формула которого C6H5OH, является токсическим и едким веществом, относящимся к ирритантам — раздражителям слизистой оболочки и кожных покровов человека.
Ещё одна особенность фенола — в его сильных кислотных свойствах. Также он может вступать в реакцию с щелочными растворами, образуя феноляты или соли. При реакции с гидроксидом натрия (Na OH) образуется фенолят натрия (C6H5ONa). Для класса фенолов характерно сочетание химических свойств ароматических углеводородов и спиртов.
Значение предельно допустимой концентрации (ПДК) фенола для человека в жилой зоне составляет 0,03мг/м в кубе, для рабочей зоны это значение равно 0.3 мг/м в кубе. Являясь летучим веществом, фенол опасен при попадании через дыхательную систему человека, а также через кожу, на которой он оставляет химические ожоги. В некоторых случаях симптомы отравления фенолом можно спутать с аллергией, так как имеются похожие симптомы (в виде тошноты, рвоты, опухания кожи).
Использование в промышленности
Для промышленного производства чаще всего используют фенольные соединения, которые можно разделить на 4 небольших группы:
Эти соединения получили обширное применение в различных сферах и отраслях. С помощь фенолов производят лакокрасочные изделия, которые имеют хорошую стойкость к воде и многим растворителям. Иногда для изготовления лаков используют алкилфенольные смолы, которые значительно увеличивают их срок службы.
Моющие средства, а также некоторые гели для уборки делают при помощи фенола. Однако в последнее время, в связи с новыми исследованиями, производители стараются отказываться от добавления в состав средства вредных для здоровья веществ. Фенол, наряду с хлором, кислотами и щелочами относится именно к таким веществам.
Широчайшее распространение получил фенола в производстве пластмассовых изделий, а также различных типов синтетических тканей (типа капрона и нейлона). Их делают при помощи синтетических фенолформальдегидных смол. Свойства, которыми обладает фенолформальдегид, позволяют этому материалу до сих пор оставаться востребованным и полезным:
Из этой синтетической смолы изготавливают много различных приспособлений, предметов и деталей по типу вилок, розеток, электроутюгов, электросчётчиков, выключателей, клеммных коробок и прочих электротехнических изделий.
Применение в медицинской сфере
В медицине довольно часто применяют средства, которые могут быть очень опасны для человека, если, к примеру, неправильно заклеить рану или превысить дозу препарата. Примером таких средств может служить цианистый акрилат (ЦА), а также фенол и похожие на него вещества.
Класс фенолов имеет высокие бактерицидные свойства, которые активно используют для обеззараживания медицинских инструментов и помещений. При растворении 5% фенола в воде получается антисептический раствор, хорошо себя зарекомендовавший для обработки ран.
В силу своей токсичности, фенол применяют для дезинфекции только в смесях с другими веществами и средствами. Часто для дезинфицирующих мероприятий используют фенольный раствор, в котором содержится калийное мыло, благодаря чему возможно замачивать бельё и обеззараживать помещения без особого вреда для здоровья человека.
Применение фенола также нашло себя и в лечении некоторых кожных заболеваний, таких, как кондиломы (папилломы), фолликулиты, фликтена, сикоз, импетиго, пиодермия и гнойные раны. Для таких процедур используют, как правило, глицериновый раствор фенола. Тем не менее при таком лечении могут быть побочные эффекты в случае попадания препарата в дыхательные пути.
Помимо прочего, фенол является необходимым компонентом для препаратов, которыми пользуются люди на протяжении длительного времени. К ним можно отнести следующие лекарства:
В последнее время набирает популярность фенолового пилинга лица и кожи. Это одна из процедур омоложения, которое достигается за счёт химического прижигания некоторых кожных участков с помощью фенола. Этот процесс способствует развитию регенерации и, как следствие, появлению новых молодых клеток.
Востребованность в сельском хозяйстве
Токсичные особенности фенольных веществ используют при борьбе с насекомыми-вредителями, а также против сорняков и паразитов. Инсектицидные средства на основе фенола обладают высокими обжигающими свойствами, благодаря которым также есть возможность лечить некоторые заболевания растений.
Учитывая современные разработки в области пестицидов, инсектицидов и прочих химических средств, фенол для сельскохозяйственных нужд используется значительно реже, чем прежде. Это объясняется не только потенциальным вредом для человека и животных, но и ввиду наличия более эффективных веществ.
К пестицидам на фенольной основе следует отнести все препараты, имеющие в своём составе 2,4-Дихлорфеноксиуксусную кислоту: Клопэфир, Дикопур, Антал, Альянс, Диамакс, Килео и другие.
Следует учитывать, что эти средства вредны для пчёл, поэтому вблизи пасеки их лучше не использовать.
Вред для здоровья человека
Отравление организма вследствие вдыхания паров фенола наступает очень быстро, за счёт чего можно без труда определить основные признаки интоксикации. При сильной концентрации вещества может наступить летальный исход либо же серьёзное поражение нервной системы, головного мозга и дыхательных путей.
Чаще всего подобные отравления происходят на химических фабриках и заводах. Нужно помнить, что если в воздухе рабочего присутствуют смеси различных химических веществ (не только фенол) — влияние на организм человека будет пагубным, даже при отсутствии признаков отравления. Нарушение техники безопасности никогда не приводит к хорошим последствиям.
Опасность, помимо заводов и фабрик, могут представлять лекарства, содержащие фенольные вещества либо же вдыхание паров бытовой химии (при уборке, к примеру). По этой же причине специалисты рекомендуют тщательно проветривать помещения после их покраски, особенно учитывая то, что в гидроксибензол довольно часто используется в лакокрасочной промышленности.
Плюс ко всему возможны несчастные случаи отравления фенолом, предугадать которые попросту невозможно. Именно поэтому следует знать, что надо делать в таких ситуациях.
Алгоритм действий при отравлении фенолом
Обработка поражённых участков кожи должна выполняться строго водой, недопустимы никакие спиртосодержащие жидкости, мази, масла и жирные вещества. Если с собой есть какой-либо вид сорбентов, следует дать человеку его выпить. Для этой цели подойдут такие препараты, как энтеросгель, полисорб, лактофильтрум, и, само собой, активированный уголь.
В качестве антидота к фенолу используют 10% раствор глюконата кальция (как правило, внутривенно). Однако следует заметить, что если человек никогда в жизни не делал никому инъекции, то лучше будет дождаться приезда врачей, где в токсикологическом отделении пострадавшему окажут необходимую помощь.
Фенолы
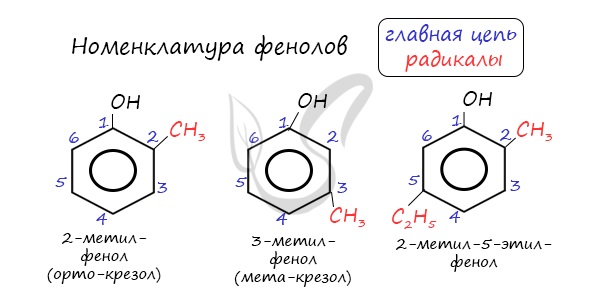
Номенклатура фенолов
Нумерацию атомов углерода в молекуле фенола начинают в такой последовательности, чтобы заместители получили наименьшие номера (идут кратчайшим путем). В основе названия принято сохранять тривиальное название «фенол».
Напомню, что гидроксильная группа является ориентантом I порядка (орто-, пара-ориентант). Поэтому реакции галогенирования, нитрования протекают в орто- и пара-положениях.
Получение фенолов
При гидролизе галогенбензолов происходит обмен: гидроксогруппа встает на место атома галогена.
Этим способом получают 95% всего производимого фенола. В ходе этой реакции кумол (изопропилбензол) подвергают окислению, в результате получается фенол и ацетон.
Химические свойства фенолов
При гидрировании разрываются двойные связи бензольного кольца, образуется циклогексанол.
В промышленности получила широкое распространение реакция поликонденсации фенола с формальдегидом, приводящая к образованию смолообразных полимеров (фенолформальдегидные смолы) и воды.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Фенол
Полезное
Смотреть что такое «Фенол» в других словарях:
Фенол — Фенол … Википедия
ФЕНОЛ — в химии под этим общим названием известен ряд органических углеродистых соединений: карболовая кислота, сольвеол, лизол, резорцин, нафталин и др. Полный словарь иностранных слов, вошедших в употребление в русском языке. Попов М., 1907. ФЕНОЛОВАЯ… … Словарь иностранных слов русского языка
фенол — сущ. • карболовая кислота • карболка Словарь русских синонимов. Контекст 5.0 Информатик. 2012. фенол сущ., кол во синонимов: 15 • … Словарь синонимов
ФЕНОЛ — (карболовая кислота), C6H5OH, бесцветные, розовеющие на воздухе кристаллы, tпл 43шC. Выделяют из каменноугольной смолы или получают синтетически. Сырье в производстве синтетических смол (например, феноло формальдегидных), капролактама, красителей … Современная энциклопедия
ФЕНОЛ — ФЕНОЛ, фенола, муж. (от греч. phaino освещаю и лат. oleum масло) (хим.). Карболовая кислота. || чаще мн. Общее название группы веществ, представляющих собой производные бензола, как и карболовая кислота. Толковый словарь Ушакова. Д.Н. Ушаков.… … Толковый словарь Ушакова
ФЕНОЛ — ФЕНОЛ, а, муж. Карболовая кислота. | прил. феноловый, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
Фенол — – производные бензола с одной или несколькими гидроксильными группами. Применяется в производстве фенолформальдегидных пластмасс, синтетического волокна капрона, красителей, пестицидов, лекарственных препаратов (аспирин, салол) … Нефтегазовая микроэнциклопедия
ФЕНОЛ — (карболовая кислота C6H5OH) бесцветные (розовеют на воздухе) кристаллы с характерным запахом. Ф. ядовит. Получают из каменноугольной смолы. Применяют в производстве феноло формальдегидных смол, синтетического волокна, красителей, пестицидов,… … Российская энциклопедия по охране труда
феноліт — іменник чоловічого роду … Орфографічний словник української мови
Фенол
наименование
токсичен, весьма едкий, является сильным ирритантом
Содержание
Получение
В настоящее время производство фенола в промышленном масштабе осуществляется тремя способами:
Фенол также можно получить восстановлением хинона.
Физические свойства
Представляет собой бесцветные игольчатые кристаллы, розовеющие на воздухе из-за окисления, приводящего к образованию окрашенных веществ (это связано с промежуточным образованием хинонов). Обладает специфическим запахом (таким, как запах гуаши, так как в состав гуаши входит фенол). Умеренно растворим в воде (6 г на 100 г воды), в растворах щелочей, в спирте, в бензоле, в ацетоне. 5 % раствор в воде — антисептик, широко применяемый в медицине.
Химические свойства
Из-за наличия ароматического кольца и гидроксильной группы фенол проявляет химические свойства, характерные как для спиртов, так и для ароматических углеводородов.
По гидроксильной группе:
Фенол — очень слабая кислота; даже угольная кислота вытесняет его из фенолятов:
C 6 H 5 O N a + H 2 O + C O 2 → C 6 H 5 O H + N a H C O 3 <\displaystyle <\mathsf
Более интенсивно феноляты разлагаются под действием сильных кислот, например, серной:
C 6 H 5 O N a + H 2 S O 4 → C 6 H 5 O H + N a H S O 4 <\displaystyle <\mathsf
Взаимодействие с металлическим натрием:
2 C 6 H 5 O H + 2 N a → 2 C 6 H 5 O N a + H 2 ↑ <\displaystyle <\mathsf <2C_<6>H_<5>OH+2Na\rightarrow 2C_<6>H_<5>ONa+H_<2>\uparrow >>>
Фенол непосредственно не этерифицируется карбоновыми кислотами, эфиры можно получить при взаимодействии фенолятов с ангидридами или галогенангидридами кислот:
C 6 H 5 O N a + C H 3 C O C l → C 6 H 5 O C O C H 3 + N a C l <\displaystyle <\mathsf 
Образование простых эфиров. Для получения простых эфиров фенола действуют галогеналканами или галогенпроизводными аренов на феноляты. В первом случае получают смешанные жирно-ароматические простые эфиры:
C 6 H 5 O N a + C H 3 I → C 6 H 5 O C H 3 + N a I <\displaystyle <\mathsf
Во втором случае получают чисто-ароматические простые эфиры:
C 6 H 5 O N a + C 6 H 5 C l → C u C 6 H 5 O C 6 H 5 + N a C l <\displaystyle <\mathsf
Реакция проводится в присутствии порошкообразной меди, которая служит катализатором.
При перегонке фенола с цинковой пылью происходит замещение гидроксильной группы водородом:
C 6 H 5 O H + Z n → C 6 H 6 + Z n O <\displaystyle <\mathsf
По ароматическому кольцу фенол вступает в реакции электрофильного замещения по ароматическому кольцу. Гидрокси-группа, являясь одной из самых сильных донорных групп (вследствие уменьшении электронной плотности на функциональной группе), увеличивает реакционную способность кольца к этим реакциям и направляет замещение в орто- и пара-положения. Фенол с лёгкостью алкилируется, ацилируется, галогенируется, нитруется и сульфируется.
C 6 H 5 O H + C O 2 → N a O H C 6 H 4 O H ( C O O N a ) <\displaystyle <\mathsf 
Взаимодействие с бромной водой (качественная реакция на фенол):
C 6 H 5 O H + 3 B r 2 → C 6 H 2 B r 3 O H + 3 H B r <\displaystyle <\mathsf
Образуется 2,4,6-трибромфенол — твёрдое вещество белого цвета.
Взаимодействие с концентрированной азотной кислотой:
C 6 H 5 O H + 3 H N O 3 → C 6 H 2 ( N O 2 ) 3 O H + 3 H 2 O <\displaystyle <\mathsf
6 C 6 H 5 O H + F e C l 3 → H 3 [ F e ( C 6 H 5 O ) 6 ] + 3 H C l <\displaystyle <\mathsf <6C_<6>H_<5>OH+FeCl_<3>\rightarrow H_<3>[Fe(C_<6>H_<5>O)_<6>]+3HCl>>>
Реакция присоединения: гидрированием фенола в присутствии металлических катализаторов получают циклогексанол и циклогексанон:
Окисление фенола: вследствие наличия гидроксильной группы в молекуле фенола устойчивость к окислению намного ниже, чем у бензола. В зависимости от природы окислителя и условия проведения реакции получаются различные продукты. Так, под действием пероксида водорода в присутствии железного катализатора образуется небольшое количество двухатомного фенола — пирокатехина:
C 6 H 5 O H + 2 H 2 O 2 → − H 2 O k a t : F e C 6 H 4 ( O H ) 2 <\displaystyle <\mathsf
При взаимодействии более сильных окислителей (хромовая смесь, диоксид марганца в кислой среде) образуется пара-хинон.
Биологическая роль
Протеиногенная аминокислота тирозин является структурным производным фенола и может быть рассмотрена как пара-замещённый фенол или α-замещённый пара-крезол. В природе распространены и другие фенольные соединения, в том числе полифенолы. В свободном виде фенол встречается у некоторых микроорганизмов и находится в равновесии с тирозином. Равновесие поддерживает фермент тирозин-фенол-лиаза (КФ 4.1.99.2).
Биологическое значение фенола обычно рассматривается в рамках его воздействия на окружающую среду. Фенол — один из промышленных загрязнителей. Фенол довольно токсичен для животных и человека. Фенол губителен для многих микроорганизмов, поэтому промышленные сточные воды с высоким содержанием фенола плохо поддаются биологической очистке.
Применение
По данным на 2006 год мировое потребление фенола имеет следующую структуру:
Фенол и его производные обусловливают консервирующие свойства коптильного дыма. Также фенол используют в качестве консерванта в вакцинах. Пример использования, в качестве антисептика — препарат «Орасепт» и «Фукорцин». В косметологии как химический пилинг (токсично).
Токсические свойства
Фенол ядовит. Относится к высокоопасным веществам (Класс опасности II). При вдыхании вызывает нарушение функций нервной системы. Пыль, пары и раствор фенола раздражают слизистые оболочки глаз, дыхательных путей, кожу, вызывая химические ожоги. Доказательства канцерогенности фенола для людей отсутствуют.
Фенольная катастрофа в Уфе
Наглядным примером воздействия фенола на окружающую среду стал случай весной 1990 года в Уфе. В результате техногенной аварии на предприятии ПО «Уфахимпром» произошла утечка большого количества фенола в речку Шугуровка, впадающую в более крупную реку Уфу, являющуюся источником хозяйственно-питьевого водоснабжения города Уфы. Загрязнение воды в районе Южного водозабора превышало ПДК более чем в 100 раз. Опасность загрязнения питьевой воды фенолом проявляется в том, что при очистке вод использовался хлор, который, взаимодействуя с фенолом, образовывал хлорпроизводные (смесь хлорфенолов) — более токсичные вещества (некоторые в 100—250 раз превышают токсичность самого фенола). Население Уфы было оповещено об опасности употребления водопроводной воды для питья. Общая численность населения, потреблявшего питьевую воду, загрязненную фенолом из Южного водозабора Уфы, составила 672 876 человек.
ФЕНОЛ (PHENOL) ОПИСАНИЕ
Фармакологическое действие
Фармакокинетика
Показания активного вещества ФЕНОЛ
Открыть список кодов МКБ-10
| Код МКБ-10 | Показание |
| A63.0 | Аногенитальные [венерические] бородавки (остроконечные кондиломы) |
| H66 | Гнойный и неуточненный средний отит |
| L01 | Импетиго |
| L08.0 | Пиодермия |
| L73.8 | Другие уточненные болезни фолликулов (сикоз бороды) |
| L73.9 | Болезнь волосяных фолликулов неуточненная |
| Z29.8 | Другие уточненные профилактические меры |
Режим дозирования
Наружно в виде 2% мази: при гнойных заболеваниях кожи после удаления гноя и некротических масс мазь тонким слоем наносят на ограниченные пораженные участки кожи 1-2 раза в день.
При остром неперфоративном гнойном среднем отите (в составе комплексной терапии): 5% раствор фенола в глицерине закапывают по 8-10 кап в теплом виде в слуховой проход на 10 мин (затем удаляют при помощи ваты) 2 раза в сутки в течение 3-4 дней (при отсутствии положительной динамики через 4 дня производят парацентез).
Генитальные остроконечные кондиломы: обрабатывают раствором, состоящим из 60% фенола и 40% трикрезола, с интервалом в 1 нед.
В фармацевтической практике для консервирования лекарственных средств, сывороток, свечей используют 0.5-0.1% растворы.
Для дезинфекции белья используют 1-2% мыльно-фенольные растворы (100-200 г жидкого фенола на 1 ведро воды); белье замачивают и выдерживают в течение 2 ч.
Для дезинсекции применяют фенольно-керосиновые, фенольно-скипидарные смеси.
Побочное действие
Зуд, жжение и/или раздражение кожи в месте аппликации, аллергические реакции.
Противопоказания к применению
Применение при беременности и кормлении грудью
Противопоказан при беременности, в период лактации.
Применение у детей
Особые указания
При при попадании большого количества вещества на кожу наблюдаются жжение, гиперемия, анестезия пораженного участка. Лечение: обработка кожи тампоном с растительным маслом или полиэтиленгликолем (нельзя использовать вазелиновое масло), симптоматическая терапия.
Нельзя обрабатывать обширные участки тела.
Рекомендуется предварительно механически очистить сильнозагрязненные обеззараживаемые предметы, поскольку фенол адсорбирует органические соединения и при этом снижается его бактерицидная активность. Обеззараживаемые предметы длительное время сохраняют запах фенола. Не применяют для дезинфекции помещений, используемых для приготовления и хранения пищевых продуктов и кухонной посуды. Не портит ткани, не меняет их окраску. При нанесении на поверхности, покрытые лаком, вызывает их изменение.
Фенолы
Содержание
Изомерия
Возможны 2 типа изомерии:
Электронное строение
Фенолы представляют собой полярные соединения (диполи). Бензольное кольцо является отрицательным концом диполя, группа — OH — положительным. Дипольный момент направлен в сторону бензольного кольца.
Во-первых, повышается способность к замещению атомов водорода в орто- и пара-положениях бензольного ядра, и в результате реакций замещения обычно образуются тризамещённые производные фенола.
Во-вторых, увеличение полярности связи O-H под действием бензольного ядра и появление достаточно большого положительного заряда на атоме водорода приводит к тому, что молекулы фенола диссоциируют в водных растворах по кислотному типу.
Фенол является слабой кислотой. В этом состоит главное отличие фенолов от спиртов, которые являются неэлектролитами.
Физические свойства
Большинство одноатомных фенолов при нормальных условиях представляют собой бесцветные кристаллические вещества с невысокой температурой плавления и характерным запахом. Фенолы малорастворимы в воде, хорошо растворяются в органических растворителях, токсичны, при хранении на воздухе постепенно темнеют в результате окисления. Фенол C6H5OH (карболовая кислота) — бесцветное кристаллическое вещество на воздухе окисляется и становится розовым, при обычной температуре ограниченно растворим в воде, выше 66 °C смешивается с водой в любых соотношениях. Фенол — токсичное вещество, вызывает ожоги кожи, является антисептиком.
В живых организмах
Химические свойства
1. Реакции с участием гидроксильной группы
При взаимодействии фенолятов с галогенпроизводными образуются простые и сложные эфиры (реакция Фриделя — Крафтса).
2. Реакции с участием бензольного кольца
Качественные реакции на фенолы
В водных растворах одноатомные фенолы взаимодействуют с хлоридом железа (III) с образованием комплексных фенолятов, которые имеют фиолетовую окраску; окраска исчезает после прибавления синильной кислоты
Способы получения
1. Из каменноугольной смолы. Каменноугольную смолу, содержащую в качестве одного из компонентов фенол, обрабатывают вначале раствором щелочи (образуются феноляты), а затем — кислотой. 2. Сплавление аренсульфокислот со щелочью: C6H5-SO3Na + NaOH → C6H5-OH + Na2SO3 3. Взаимодействие галогенпроизводных ароматических УВ со щелочами: C6H5-Cl + NaOH → C6H5-OH + NaCl или с водяным паром: C6H5-Cl + H2O → C6H5-OH + HCl
Применение фенолов
Примечания
Ссылки
Полезное
Смотреть что такое «Фенолы» в других словарях:
ФЕНОЛЫ — ФЕНОЛЫ, группа АРОМАТИЧЕСКИХ СОЕДИНЕНИЙ, в молекулах которых содержится одна или несколько гидроксильных групп ( ОН), присоединенных к бензольному кольцу (см. БЕНЗОЛ). Простейший представитель этого ряда веществ также называется фенолом или… … Научно-технический энциклопедический словарь
ФЕНОЛЫ — Третичные спирты, наиболее известна из них карболовая кислота. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ФЕНОЛЫ третичные спирты известной формулы; наиболее известен из них обыкновенный ф., называемый в… … Словарь иностранных слов русского языка
ФЕНОЛЫ — ФЕНОЛЫ, производные ароматических углеводородов, у к рых один или несколько атомов водорода заменены гидроксилами. По количеству гидроксильных групп различают одноатомные Ф. (С„Нгп 7. ОН), как напр. карболовая кислота (см.), крезолы (см.),… … Большая медицинская энциклопедия
ФЕНОЛЫ — органические соединения ароматического ряда, в молекулах которых гидроксильные группы связаны с атомами углерода ароматического кольца. По числу ОН групп различают фенолы одноатомные (напр., фенол), двухатомные (гидрохинон, пирокатехин, резорцин) … Большой Энциклопедический словарь
Фенолы — одно и двузамещенные гидроксильные производные ароматических углеводов, применяемые в практической медицине и ветеринарии как дезинфектанты и антисептики. Чаще используют карболовую к ту, крезолы, лизол, ксилол, судол, тимол, ментол, карвакрол,… … Словарь микробиологии
ФЕНОЛЫ — ароматические соединения, образованные путем замещения одного или нескольких атомов водорода бензольного кольца гидроксильной группой. Ф. твердые, кристаллические или жидкие вещества с характерным запахом и слабокислотными свойствами. Простейший… … Геологическая энциклопедия
ФЕНОЛЫ — ароматические соединения, имеющие гидроксильные группы, непосредственно связанные с атомами углерода ядра. Применяют в производстве феноло формальдегидных смол, клеев, лаков, фенолятов, термостойких лаков, красителей, пестицидов, ПАВ, лекарств,… … Российская энциклопедия по охране труда
фенолы — органические соединения ароматического ряда, в молекулах которых гидроксильные группы связаны с атомами углерода ароматического кольца. По числу ОН групп различают фенолы одноатомные (например, фенол), двухатомные (гидрохинон, пирокатехин,… … Энциклопедический словарь
ФЕНОЛЫ — ароматич. соед., содержащие в молекуле одну или неск. гидроксильных групп, связанных с атомами углерода ядра. По кол ву ароматич. ядер различают собственно Ф., наф толы (2 конденсированных ядра), антролы (3 ядра), фенант ролы (4), бензотетролы… … Химическая энциклопедия
Фенол*
Предпочтительнее, однако, (Lunge-K ö hler, l. с.), делать их более низкой формы, с высотою, составляющею примерно 3/4 их диаметра, чтобы пары по возможности быстрее удалялись из нагретого пространства в холодильник. На фиг. 2 представлен подобный котел, особенно пригодный для небольшого производства.
На некоторых заводах такого рода колонные аппараты употребляются и для первой перегонки Ф. Так, аппарат, применявшийся для этой цели Кёлером (l. с.), емкостью приблизительно на 2000 кгр. Ф., имел колонну высотою в 2 метра и в 30 стм диаметром, а внутри ее помещались на расстоянии 10 стм друг от друга горизонтальные дырчатые перегородки, стоявшие с помощью трех ножек одна на другой. Этот аппарат давал возможность получать главную фракцию сразу в значительно более узких пределах темп., именно 180—195°; следующая фракция собиралась только до 210°, и далее гонка уже не велась. Однако можно с успехом обойтись и без употребления колонных аппаратов, если вести перегонку в обыкновенном котле с достаточной медленностью, а особенно применяя прием, издавна практикуемый в Англии и состоящий в том, что погон, начиная от 180°, делят не на две крупные фракции, как указано выше, а на целый ряд мелких, собирая их по мере перегонки в отдельные небольшие приемники (Lu nge-Kö hler, l. с.). При этом в первых приемниках скопляется главным образом Ф., так что содержимое их при охлаждении застывает почти нацело, а в последних оказываются одни почти крезолы, остающиеся в жидком виде. Жидкая часть, отделенная от кристаллической, подвергается также новой фракционировке; при этом то, что отходит сначала, подвергается опять кристаллизации, а более высоко кипящий погон присоединяется к упомянутой выше фракции 205—220° от первой перегонки; эта фракция, в свою очередь, подвергается разгонке. Вообще, жидкие порции фракционируют, присоединяя их и их фракции к соответствующим погонам до тех пор, пока они не перестанут давать при охлаждении кристаллов Ф. Первая кристаллизация, а также кристаллизация нижекипящих фракций, получаемых при вторичной перегонке жидких продуктов, производится при температуре по возможности низкой, пользуясь для охлаждения водой или льдом; темп. ни в каком случае не должна быть выше +10° Ц. Сосуды для кристаллизации делаются из достаточно толстого листового цинка или оцинкованного железа, в форме довольно узких и глубоких ящиков емкостью от 50 до 150 литр., и обыкновенно снабжаются внизу отверстием с краном для спуска жидкой части; делают их также и воронкообразной формы. Если перегон дробится на мелкие фракции, то сосуды эти могут непосредственно служить и приемниками. По окончании кристаллизации спускают жидкую часть через кран, а остатки ее отжимают от кристаллов на центрифуге при 1500—2000 оборотах в минуту. Получаемый после этого продукт хотя и белого цвета, скоро на воздухе краснеет и плавится не выше 30—32°, а чаще ок. 25—28°. После вторичной перегонки и кристаллизации кристаллы Ф. могут сохраняться беcцветными уже довольно продолжительное время и показывают темп. пл. обыкновенно от 32° до 35° и ни в каком случае не выше 38°. Низкая темп. плавления продукта по сравнению c чистым Ф. (см выше) зависит, главным образом, от подмеси ортокрезола, который плавится при 30° (B é hal) и вследствие близости своей темп. кип. (188,5° — B é hal) к темп. кип. Ф. (178,5° — Choay) не может быть вполне отделен от него перегонкой, а также и паракрезола, плавящегося при 36,5° (B é hal, темп. кип. 199°, по тому же автору), след., близко к Ф., и потому отчасти кристаллизующегося вместе с последним. Дальнейшая очистка Ф. от этих примесей основывается на способности его (открытой в 1862 г. Лёве и впервые примененной для очищения Ф. на его заводе в Англии) образовать с водою кристаллический гидрат С 6 Н 5 —ОН + 1/2H 2 O с темп. пл. +16° (Calvert), тогда как крезолы подобных гидратов не образуют и при кристаллизации на холоду гидрата Ф. остаются жидкими в маточном растворе. По способу Кальверта и В. Алексеева, операция производится след. образом: Ф., очищенный, как указано выше, перегонками и кристаллизацией, расплавляют в эмалированных котлах на водяной бане и к нему при помешивании прибавляют 5% пo весу дистиллированной воды, затем выделившуюся при охлаждении до +8—10° кристаллическую массу гидрата отделяют от маточного раствора на центрифугах, повторяют, если нужно, кристаллизацию еще один или два раза и перегоняют из котла, нагреваемого в масляной бане; при перегонке вначале переходит вода с примесью Ф., а потом чистый Ф. с темп. пл. 41—42°; его прямо собирают в стеклянные или из белой жести сосуды, в которых он и поступает в продажу. Что касается причины, обусловливающей окрашивание Ф., даже наилучше очищенного, в красноватый цвет при более или менее долгом хранении, особенно на свету и при доступе воздуха, и ее устранения, то прежде приписывали ее какой-то особой примеси и думали удалить последнюю с помощью окисления, подвергая сырой Ф. перед ректификацией действию воздуха, или нагревая его с небольшим количеством хромовой смеси, или же, наконец, нагревая уже ректификованный Ф. с суриком и т. п. Однако Шнейдер (1890), а потом Кон и Фрайер (1893) показали, что и синтезом полученный Ф. способен краснеть при долгом хранении и что, следовательно, причина окрашивания Ф. лежит в нем самом и есть результат его окисления кислородом воздуха в присутствии влажности (Kohn and Fryer). Совершенно сухой воздух не действует на Ф. Свет и присутствие металлических окислов усиливают действие на него влажного воздуха, также и аммиачные соединения (Hankό, 1892); перекись водорода вызывает скорое покраснение Ф., особенно на свету (Kohn a. Fryer); напротив, хлористое олово, как восстановитель, задерживает покраснение (Hankό, Hoffmann); такое же действие оказывает и металлическое олово, поэтому хранение чистого Ф. в луженой металлической посуде (напр. жестяной) является целесообразным.
Выходы кристаллич. карболовой кислоты и крезолов из сырого Ф. чрезвычайно сильно варьируют в зависимости от происхождения последнего. Так, Кёлер (l. с.) получал обыкновенно от 25 до 30% карболовой кисл. (с темп. пл. 38°) и от 40 до 45% крезолов, всего около 70% фенолов. Штоман же указывает выходы значительно менее благоприятные, именно от 6 до 30% кристаллической карболовой кислоты и от 13 до 24,5% крезолов, причем общее количество фенолов составляло всего от 30.5 до 44% сырого продукта. Если выход этих продуктов отнести к каменноугольному дегтю, то, по данным Кёлера, он составит всего около 0,8% (0,3% крист. Ф. и 0,5% крезолов); по Рютгерсу (1879) — даже всего 0,5% (0,2% крист. Ф. и 0,3% крезолов); по Кремеру (1887) — от 0,35 до 0,5% крист. Ф. и от 0,6 до 1,2% крезолов.
Применения Ф. в практике весьма разнообразны. Главная масса его в чистом виде или в форме различных препаратов (карболовых растворов, порошков, мыла) служит как сильное антисептическое, дезинфекционное и дезодорирующее средство в медицине и санитарии, причем для дезинфекции под названием сырой карболовой кислоты идет также и остающаяся после выделения кристаллического Ф. жидкая смесь крезолов, дезинфицирующее действие которых нисколько не уступает Ф. Противогнилостные свойства карболовой кислоты широко утилизируются и в промышленности: ее употребляют для консервирования костей при дальних перевозках, сырых шкур и уже дубленого кожевенного товара, особенно подошвенного и лайки, а также и во время самого процесса дубления в кожевенном производстве; для консервирования соков на сахарных заводах; в винокуренном производстве Меркер рекомендует употреблять ее против размножения ферментов молочнокислого брожения; о применении ее для консервирования дерева — см. Дерево и Креозот. В кожевенном производстве карболовая кислота нашла применение также и в качестве дубильного материала. Значительное количество Ф. идет для производства азокрасок и некоторых других искусственных пигментов (см. Краски органические, искусственные), пикриновой кислоты (см.), из которой готовится взрывчатый состав, известный под именем мелинита, салициловой кислоты (см.), салола (см.) и фенолфталеина (см.). Наконец, в недавнее время с помощью сырой карболовой кислоты начали выделывать огнеупорные кирпичи для основной набойки конверторов, замешивая измельченный в порошок известняк, доломит, магнезит и пр. на крепком растворе фенолата и затем отформовывая получаемую при этом быстро твердеющую кашицеобразную массу. Лит.: Наrmsen, «Fabric. der Theerfarbstoffe und ihrer Rohmaterialien» (Б., 1889); K öhler, «Carbolsäure und Carbolsäureprä parate» (Б., 1891; имеется в русском перев. Витлока, СПб., 1891); Lunge-K öhler, «Industrie des Steinkohlentheers
und Ammoniaks» (Брауншвейг, 1900).
Анализ карболовой кислоты. Для качественного определения Ф. наиболее чувствительным реактивом служит раствор азотнокислой соли закиси ртути с азотистой кислотой (реактив Миллона). При анализе Альмэн прибавляет к 20 куб. с. исследуемого раствора 5—10 капель реактива Миллона, кипятит и слегка подкисляет азотной кисл. (для устранения основных солей); получается красивое красное окрашивание. В присутствии салициловой кисл. к жидкости прибавляют немного аммиака и хлорноватисто-натриевой соли. Количественное определение Ф. производится главн. образом в виде трибромфенола:
C 6 H 5 (HO) + 3Br 2 = C 6 H 2 Br 3 (HO) + 3НBr
(см. Фенолы), причем не вошедший в реакцию бром определяется йодометрическим способом (см. Йодометрия). Ввиду неудобства хранения бромной воды ее заменяют раствором бромистого и бромноватокислого калия (или натрия), которые выделят бром с кислотами:
5KBr + KBrО 3 + 6HCl = 3Br 2 + 3H 2 O + 6KСl.
Для производства определения по Бекуртс’у нужны следующие титрованные жидкости: 1) 1/10-норм. раствор КBr (5,939 гр. в литре); 2) 1/50-норм. раствор КBrО 3 (1,6666 гр. в литре); 3) раствор KJ (125 гр. на литр). Навеску Ф. [ок. 1 гр. С 6 Н 5 (НО)] растворяют в воде в литровой колбе; 25—30 куб. с. этого раствора вливают в колбу емкостью 250 куб. с. с пришлифованной пробкой, приливают по 50 куб. с. растворов КBr и КBrО 3 и 5 куб. с. крепкой серной кислоты и тщательно взбалтывают; через 10—15 мин. прибавляют 10 куб. с. раствора KI и титруют выделившийcя иод 1/10-норм. раствором гипосульфита. Из др. способов укажем на определение в виде трийодфенола (см. Фенолы) при действии йода на щелочной раствор Ф. при нагревании, при чем определяется избыток взятого йода гипосульфатом (Messinger, Vortmann). Вышеуказанные способы количественного определения Ф. применимы только тогда, когда исследуемый продукт не содержит других веществ, способных соединяться с бромом или йодом; они, след., совершенно непригодны для определения Ф., напр., в продажной сырой карболовой кисл. или в различных карболовых препаратах (мыле, порошке и проч.), где наряду с Ф. имеются крезолы и др. высшие гомологи его. Нет вообще хороших способов как для качественного, так и для количественного определения Ф. в присутствии его гомологов. При техническом анализе все эти вещества обыкновенно определяются вместе, напр. при анализе сырой карболовой кисл. берут 10 объемов ее и взбалтывают с 90 об. едкого натра уд. в. 1,079. Отстоявшийся щелочной раствор разлагают соляной кислотой и, насытив его поваренной солью, измеряют объем выделившейся смеси фенолов. Кроме указанной выше литературы, см. также: Lunge-B öckmann, «Chem.Techn. Untersuchungsmethoden» (1900).