инвазивные и неинвазивные лекарственные формы
Как работают неинвазивные методы приема лекарств: нанодоставка препаратов, гидрогели и нанопластыри
Тысячи людей по всему миру по разным причинам, в том числе финансовым, не получают жизненно необходимые лекарства с помощью таблеток, инъекций или капельниц. Главный барьер — доступ к медицинским услугам, которые предполагают инвазивное вмешательство в человеческий организм. Но ученые уже решают эту проблему. Нанодоставка препаратов в конкретный орган, гидрогели, способные выпускать порцию инсулина, когда организму это необходимо, и нанопластыри, которые могут победить проблемы с вакцинацией в странах третьего мира — все эти методы лечения уже показали себя эффективными и удобными. И можно с уверенностью сказать, что проколы кожи скоро уйдут в прошлое. «Хайтек» разобрался в том, какие новшества медицины помогут нам раз и навсегда забыть ощущение пугающего страха от шприцев на 20 кубиков и опасной гуляющей иглы капельниц.
Читайте «Хайтек» в
Все современные неинвазивные методы приема лекарств, как правило, представляют собой систему целевой доставки фармпрепаратов. Это означает избирательную транспортировку препаратов или веществ к необходимым тканям, органам и клеткам через различные средства-носители. Подобные механизмы улучшают фармакологические и терапевтические свойства обычных лекарств и преодолевают такие проблемы, как ограниченная растворимость, агрегация лекарств, недостаточное распределение лекарства в тканях и отсутствие возможности выбора точечной области лечения, контроль выведения лекарственного средства и снижение повреждений соседних клеток. Неинвазивные методы могут увеличить время воздействия лекарственного средства в месте поражения и ввести оптимальную концентрацию вещества.
Нанодоставка и гидрогели
Система наномедицины и нанодоставки — относительно новая, но быстро развивающаяся отрасль науки. Материалы в наноразмерном диапазоне используются в качестве средств диагностики или для доставки терапевтических агентов адресно, в необходимый орган, под неусыпным контролем врача. У нанотехнологий много преимуществ в лечении хронических заболеваний человека с помощью специфической и целенаправленной доставки лекарств.
Природные соединения уже показали свою высокую эффективность в лечении рака, диабета, сердечно-сосудистых, воспалительных и микробных заболеваний. Это происходит главным образом потому, что лекарства на основе натуральных компонентов обладают более низкой токсичностью и побочными эффектами, имеют относительно невысокую стоимость и демонстрируют хороший терапевтический потенциал.
Однако вопросы, связанные с биосовместимостью природных соединений, представляют большую проблему при использовании их в качестве лекарств. Следовательно, многие природные соединения не проходят фильтр клинических испытаний исключительно по этим причинам. Введение лекарств в организм посредством инъекций или с помощью обычных таблеток, покрытых пленочной оболочкой, создает серьезные проблемы, в том числе нестабильность in vivo, плохую биодоступность и растворимость, недостаточную абсорбцию в организме, а также возможные побочные эффекты лекарств.
In vivo (с лат. — «в (на) живом») — «внутри живого организма» или «внутри клетки».
В науке in vivo означает проведение экспериментов на (или внутри) живой ткани при живом организме. Такое применение термина исключает использование части живого организма (так, как это делается при тестах in vitro) или использование мертвого организма. Тестирование на животных и клинические испытания являются формами исследования in vivo.
Ни инъекции, ни таблетки не гарантируют попадания лекарства в необходимый орган или область. Следовательно, использование новых систем доставки лекарств для таргетного попадания в определенные части тела может быть вариантом, который способен решить эти критические проблемы. Нанотехнологии играют важную роль в передовых лекарственных препаратах, нацеленных на контролируемое высвобождение лекарств внутри организма.
Почему прием таблеток порой совершенно не улучшает состояние пациента?
Первая причина довольно банальна — некоторые лекарства работают лучше всего, когда их принимают в определенное время дня или вместе с приемами пищи. Люди могут просто забыть принять лекарства вовремя или не уделить должного внимания указаниям врача по поводу времени приема препаратов, что не является пустой прихотью терапевта. Кроме того, даже параллельный прием витаминов или биодобавок может повлиять на скорость всасывания и других принимаемых препаратов. Кроме того, пациенты порой халатно относятся к рекомендованной диете и не следуют ей, несмотря на то, что продукты могут влиять на то, как организм принимает лекарства или как они работают. Гормональные проблемы, плохой обмен веществ, плохой сон, высокое кровяное давление или нестабильная работа ЖКТ также способны изменить действие лекарств, поэтому перед назначением препаратов врач всегда задает пациенту вопросы относительно его общего состояния. Любая из вышеупомянутых проблем может считаться существенным поводом для изменения схемы лечения или дозировки назначенного препарата.
Недавние исследования показали, что материалы в форме гидрогеля могут использоваться для доставки различных лекарств и веществ через желудок в более щелочную среду. Гидрогели — это трехмерные, полимерные сети, которые считаются высоко проницаемыми для различных лекарственных соединений, могут противостоять кислой среде и набухать, тем самым высвобождая захваченные молекулы через их сетчатые поверхности.
В зависимости от химического состава геля различные внутренние и внешние раздражители (например, изменения pH, приложения магнитного или электрического поля, изменения температуры и ультразвукового облучения) могут использоваться для запуска этого эффекта. Однако после этого скорость захваченного высвобождения лекарственного средства определяется исключительно коэффициентом поперечной сшивки полимерной сети.
В течение последних двух десятилетий исследования систем доставки гидрогеля были сосредоточены главным образом на системах, содержащих основные цепи полиакриловой кислоты (ПАА). Гидрогели ПАА известны своей сверхпоглощающей способностью и возможностью образовывать длинные полимерные сети посредством водородных связей. Кроме того, они обладают качествами отличных природных адгезивов. Это означает, что они могут прилипать к слизистой оболочке желудочно-кишечного тракта на длительный период времени, медленно высвобождая инкапсулированные лекарства.
Адгезив — вещество, способное соединять материалы путем поверхностного сцепления. Адгезивы бывают природными и синтетическими. Скрепляющее действие адгезива основано на создании молекулярных связей между ним и поверхностями соединяемых материалов. Микронеровности, заполняемые адгезивом, увеличивают площадь контакта между прилегающими поверхностями. После застывания адгезива они склеиваются.
В 1997 году инженеры-химики из Университета Пердью в Уэст-Лафайетте, штат Индиана, под руководством Николаса А. Пеппаса, сообщили о синтезе чувствительного к глюкозе гидрогеля, который можно использовать для ввода инсулина пациентам-диабетикам с использованием внутреннего триггера рН. Эта система имеет инсулинсодержащий «резервуар», образованный гидрогелевой мембраной, в которую была помещена глюкозооксидаза.
В отличие от гидрогелевых систем, которые выделяют захваченные лекарственные вещества при набухании, эта система работает противоположным образом, сжимая мембранные «затворы». Точный триггер для этого механизма включает создание кислой среды вокруг геля. Это достигается, когда организм вырабатывает высокий уровень сахара; глюкоза взаимодействует с иммобилизованной глюкозооксидазой в воротах, образуя глюконовую кислоту, которая, в свою очередь, снижает pH организма и вызывает открытие ворот. Таким образом, собственные уровни глюкозы определяют и направляют доставку инсулина. В настоящее время исследователи изучают способы точного контроля скорости доставки лекарств, рассматривая эффекты варьирования размера ворот, концентрации захваченного инсулина и скорости, с которой ворота могут открываться и закрываться.
Таблетки на ниточке
Задача при разработке систем доставки лекарственных средств для лечения таких заболеваний, как туберкулез, заключается в том, чтобы сбалансировать простоту и безопасность введения и оптимизировать дозировку лекарств на нескольких уровнях. Во время интенсивной фазы лечения 60-килограммовый пациент с туберкулезом проглатывает почти 100 г антибиотиков за месяц. Прием лекарств через желудочно-кишечный тракт дает множество преимуществ, включая простоту введения, иммунотолерантность к широкому спектру материалов и возможность оптимизировать дозировку с точностью до грамма в соответствии с существующими схемами лечения туберкулеза.
Разработка системы, устойчивой к кислотной среде желудка (GRS, Gastric resistant system — «Хайтек»), ведется для того, чтобы обеспечить пациентам, которым необходим ежедневный прием препаратов, своевременное и полноценное лечение. Таблетки, буквально нанизанные на суперустойчивый материал — нитиноловую проволоку, вводятся через нос с помощью трубки, которую после расположения системы достают. GRS находится в желудочной полости все назначенное время приема препаратов, лекарственные вещества планомерно всасываются через стенки желудка. После завершения лечения пациенту снова помещают трубку, на конце которой есть поисковое устройство для прикрепления и удаления GRS из полости желудка. Устройство поиска состоит из датчика и магнита, который может обнаруживать и присоединяться к магнитам на любом конце GRS. Пунктирными кружками на картинке ниже обозначено сцепление поискового устройства с GRS. Также показаны компоненты обоих концов GRS — клей, фиксатор и заглушка из поликапролактона.
GRS из-за суперэластичности нитинола может скручиваться обратно в свою первоначальную форму спирали для компактного расположения в желудочной полости после прохождения через пищевод, что должно помочь избежать ощущения инородности и дискомфорта у пациентов. Система была испытана на свиньях весом от 30 до 75 кг. После длительного пребывания системы в желудке на слизистых оболочках желудка животных не было повреждений, эрозий или изъязвлений. Кроме того, у них не наблюдалось потери веса, признаков непроходимости желудочно-кишечного тракта или ограничений в прохождении пищи или жидкости. Таблетки для системы изготавливают, смешивая лекарственные средства с силиконами, кроме того, на них наносят полимерное покрытие. Диаметр каждой таблетки — 4 мм.
Ученые возлагают большие надежды на эту систему как на средство борьбы с туберкулезом, в первую очередь, в рамках программы DOTS. В 1994 году ВОЗ одобрила стратегию прямого наблюдения с коротким курсом лечения (DOTS), которая в настоящее время принята во всем мире. DOTS включает в себя прием пероральных комбинированных противотуберкулезных препаратов в определенной клинике в присутствии медицинского работника ежедневно или три раза в неделю. На данный момент для достижения желаемых результатов требуется существенная инфраструктура с надлежащим образом укомплектованным медицинским персоналом, но GRS не требует еженедельного наблюдения в стационаре.
«Хайтек» уже писал о том, как группа исследователей из Калифорнийского университета представила разработку реактивной таблетки, которая при помощи наночастиц диоксида титана и магния точечно доставит лекарства.
Инновационные методы диагностики и лечения рака
Нанопластыри
В январе 2019 года Дэвид Хой, генеральный директор компании Vaxxas, рассказал о работе над повышением эффективности вакцин с помощью новой технологии доставки вакцин под названием Nanopatch (нанопластырь — «Хайтек»). Принцип Nanopatch состоит в использовании тысяч микроигл на одном маленьком участке, которые безболезненно перфорируют наружные слои кожи. На концах микроигл Nanopatch мизерное вещество вакцины, которое вступает в реакцию с иммунными клетками непосредственно под поверхностью кожи. Это позволяет эффективно доставлять антигены в лимфатические узлы для быстрой иммунной реакции. В ходе тестов на животных было доказано, что всего лишь от 1/10 до 1/100 от нынешней дозы вакцины, поступившей в организм с помощью нанопластыря, может вызвать иммунный ответ, эквивалентный полной дозе, вколотой шприцом. В дополнение к этому вакцины, нанесенные на наноплату, могут быть сконструированы так, что не будут требовать особых условий хранения, а это огромная потенциальная победа для рынков развивающихся стран. Кроме того, чтобы получить вакцину из нанопластыря, не придется прибегать к помощи медицинских работников, способ его применения прост настолько, что его можно использовать и в домашних условиях.
Исследователи предложили с помощью микроигл доставлять в сетчатку пациентов, которые рискуют потерять зрение из-за ее отслоения, препарат, способный предотвратить этот процесс — луцентис. Иголки будут растворяться в течение всего 30 секунд, а пациент не будет испытывать боли.
Также технологии нанопластырей можно использовать в качестве контрацептивного средства. Микроиглы нанопластыря изготовлены из полимеров, а в качестве активного вещества содержат левоноргестрел. Компоненты микроигл постепенно растворяются в крови и в течение месяца защищают от нежелательной беременности.
Возможно, скоро наше будущее кардинально изменится. Мы будем лечиться совершенно иначе — нанотрубки доставят лекарства прямо в желудок или в форме препаратов на основе гидрогеля, а вакцинировать мы будем себя сами, в домашних условиях. Несмотря на это, будет все так же важно следить за состоянием своего здоровья, своевременно обращаться к врачу и не надеяться только на новые медицинские технологии.
Искусственная вентиляция легких (ИВЛ): инвазивная и неинвазивная респираторная поддержка
К искусственной вентиляции легких (ИВЛ) прибегают для оказания помощи пациентам с острой или хронической дыхательной недостаточностью, когда больной не может самостоятельно вдыхать необходимый для полноценного функционирования организма объем кислорода и выдыхать углекислый газ. Необходимость в ИВЛ возникает при отсутствии естественного дыхания или при его серьезных нарушениях, а также во время хирургических операций под общим наркозом.
Что такое ИВЛ?
Искусственная вентиляция в общем виде представляет собой вдувание газовой смеси в легкие пациента. Процедуру можно проводить вручную, обеспечивая пассивный вдох и выдох путем ритмичных сжиманий и разжиманий легких или с помощью реанимационного мешка типа Амбу. Более распространенной формой респираторной поддержки является аппаратная ИВЛ, при которой доставка кислорода в легкие осуществляется с помощью специального медицинского оборудования.
Показания к искусственной вентиляции легких
Искусственная вентиляция легких проводится при острой или хронической дыхательной недостаточности, вызванной следующими заболеваниями или состояниями:
Инвазивная вентиляция легких
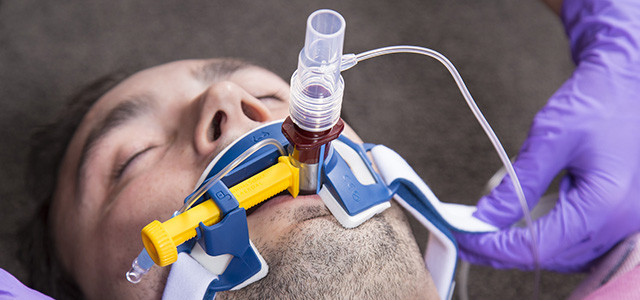
Эндотрахеальная трубка вводится в трахею через рот или через нос и подсоединяется к аппарату ИВЛ
При инвазивной респираторной поддержке аппарат ИВЛ обеспечивает принудительную прокачку легких кислородом и полностью берет на себя функцию дыхания. Газовая смесь подается через эндотрахеальную трубку, помещенную в трахею через рот или нос. В особо критических случаях проводится трахеостомия – хирургическая операция по рассечению передней стенки трахеи для введения трахеостомической трубки непосредственно в ее просвет.
Инвазивная вентиляция обладает высокой эффективностью, но применяется лишь случае невозможности помочь больному более щадящим способом, т.е. без инвазивного вмешательства.
Кому и когда необходима инвазивная ИВЛ?
Подключенный к аппарату ИВЛ человек не может ни говорить, ни принимать пищу. Интубация доставляет не только неудобства, но и болезненные ощущения. Ввиду этого пациента, как правило, вводят в медикаментозную кому. Процедура проводится только в условиях стационара под наблюдением специалистов.
Инвазивная вентиляция легких отличается высокой эффективностью, однако интубация предполагает введение пациента в медикаментозную кому. Кроме того, процедура сопряжена с рисками.
Традиционно инвазивную респираторную поддержку применяют в следующих случаях:
Как работает аппарат инвазивной ИВЛ?
Принцип работы приборов для инвазивной ИВЛ можно описать следующим образом.
Особенности оборудования для инвазивной вентиляции
Оборудование для инвазивной вентиляции легких имеет ряд характерных особенностей.
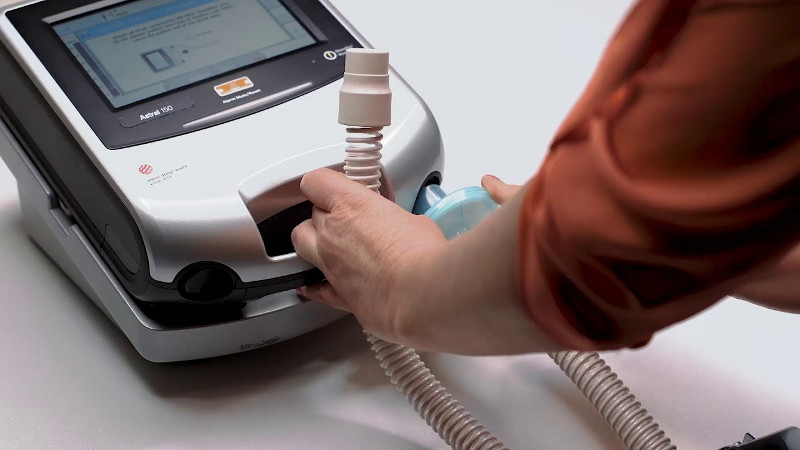
Неинвазивная вентиляция легких
За последние два десятилетия заметно возросло использование оборудования неинвазивной искусственной вентиляции легких. НИВЛ стала общепризнанным и широко распространенным инструментом терапии острой и хронической дыхательной недостаточности как в лечебном учреждении, так и в домашних условиях.
Одним из ведущих производителей медицинских респираторных устройств является австралийская компания ResMed
НИВЛ — что это?
Неинвазивная вентиляция легких относится к искусственной респираторной поддержке без инвазивного доступа (т.е. без эндотрахеальной или трахеостомической трубки) с использованием различных известных вспомогательных режимов вентиляции.
Оборудование подает воздух в интерфейс пациента через дыхательный контур. Для обеспечения НИВЛ используются различные интерфейсы – носовая или рото-носовая маска, шлем, мундштук. В отличие от инвазивного метода, человек продолжает дышать самостоятельно, но получает аппаратную поддержку на вдохе.
Когда применяется неинвазивная вентиляция легких?
Ключом к успешному использованию неинвазивной вентиляции легких является признание ее возможностей и ограничений, а также тщательный отбор пациентов (уточнение диагноза и оценка состояния больного). Показаниями для НИВЛ являются следующие критерии:
Инвазивные и неинвазивные лекарственные формы
К оплате принимаются наличные и карты.
Кандидозы: клиника и лабораторная диагностика
Доктор медицинских наук, профессор Селькова Е.П.
Сегодня человечество переживает эпидемию оппортунистических инфекций, среди которых микозам принадлежит одно из ведущих мест. По данным Всемирной Организации Здравоохранения в последнее десятилетние около 20% населения мира страдает микозами.
Возбудители кандидоза. Поражения у человека вызывают С. albicans (более 90% поражений), С. tropicalis, С. krusei, С. lusitaniae, С. parapsilosis, С. kefyr, С. guilliermondii и др. В начале XX в. кандидозы наблюдали сравнительно редко. С началом применения антибиотиков и по настоящее время заболеваемость кандидозами значительно возросла и продолжает расти. Немаловажное значение в развитии кандидозов имеет неблагоприятная экологическая обстановка, оказывающая отрицательное воздействие на иммунную систему организма человека. Кандидоз обычно возникает эндогенно в результате дисфункций иммунной системы и дисметаболических расстройств организме. В последние годы кандиды являются наиболее распространёнными возбудителями оппортунистических микозов. При поражении организма кандидами возможно развитие тяжёлых висцеральных форм, чаще с вовлечением лёгких и органов пищеварения и других систем организма.
Во многих исследованиях показано, что любые нарушения резистентности организма или изменения нормального микробного ценоза могут приводить к развитию заболеванияКандидоза..
Мочеполовой кандидоз передаётся половым путём.
Первичное инфицирование организма человека кандидами происходит при прохождении через родовые пути матери, о чем свидетельствует высокая частота выделения Candida у новорожденных (до 58%), и почти полное совпадение видового состава Candida у ребенка и матери. Инфицированию способствует увеличенная частота носительства и кандидоза влагалища в последней трети беременности. Имеются сведения о передаче грибов рода кандида при кормлении грудью.
Описан трансплацентарный путь заражения при кандидозе, прогноз которого зависит от степени доношенности: при рождении ребенка после 36 недель беременности заболевание, как правило, протекает в виде легко купируемых поверхностных поражений, а при рождении в более ранние сроки микоз принимает системный характер с высокой летальностью.
Поражение слизистых кандидами обусловлено тем, что C. albicans на слизистых обладает свойством активно прилипать к эпителию. Это свойство наиболее интенсивно выражено при 37 о и рН 7,3; довольно высокая степень адгезии отмечена и при слабокислых значениях среды (рН 6,0). Таким образом, условия организма способствуют активной колонизации слизистых C. albicans, где этот гриб на поверхности клеток размножается в виде дрожжевой фазы.
Патогенез. В патогенезе микозов наиболее важными факторами являются:
— нарушение целостности кожи и слизистых (ожоги, лучевая терапия, потертость и т.п.);
— длительное применение антибиотиков;
— нарушении гормонального баланса (сахарный диабет);
Резорбция в кишечнике продуктов метаболизма грибов рода Candida его плазмокоагулаза, протеазы, липофосфорилазы гемолизин и эндотоксины могут вызвать специфическую интоксикацию и вторичный иммунодефицит.
Наконец, за счет взаимодействия с представителями облигатной нормобиоты и условно-патогенными микроорганизмами Candida spp. могут индуцировать дисбиоз и микст-инфекцию слизистых оболочек.
Ключевым фактором начала инфекционного кандидозного процесса является нарушение неспецифической и специфической резистентности организма, как на местном, так и на общем уровне.
К факторам неспецифической резистентности традиционно относят адекватный баланс десквамации и регенерации эпителиоцитов, мукополисахариды слизи, нормальную микробиоту слизистых оболочек, (Bifidumbacterium spp., Lactobacillus spp., Escherihia coli, Peptostreptococus spp.,), перистальтическую активность и кислотно-ферментативный барьер пищеварительного тракта. Показано например, что лечение больных препаратами, содержащими бифидобактерии, значительно снижает содержание грибов рода Candida в кале больных.
К неспецифическим факторам относят так же секреторный IgA, лизоцим, трансферрин, компоненты комплемента. Однако наиболее важны число и функция полиморфно-ядерных мононуклеарных фагоцитов, в частности их способность к хемотаксису, аттракции, килингу и презентированию грибкового антигена. Именно в условиях нейтропении развиваются жизнеугрожающие формы кандидоза, включая висцеральные поражения (печени, желчного пузыря, поджелудочной железы).
Специфический иммунный ответ при кандидозе представлен наработкой специфических противокандидозных антител классов IgA, IgG, IgM, инактивирующих ферменты инвазии и эндотоксины гриба, а также вместе с компонентами комплемента участвующими в опсонизации.
Конфликт между факторами патогенности гриба и факторами антифунгальной резистентности приводит к развитию той или иной формы кандидоза. Механизмы патогенеза двух принципиально различных форм кандидоза (инвазивного и неинвазивного) легли в основу классификации кандидоза кишечника. Для практических целей необходимо выделять три формы поражения.
Клинические проявления микозов (кандидозов) могут быть различными в зависимости от их локализации.
Симптомокомплекс, развившийся на фоне применения антибиотикотерапии, может варьировать от незначительного преходящего интестинального дискомфорта до тяжелых форм диареи и колита. Клинически выделяют три основных варианта заболевания:
Колонизации кишечника Candida spp. способствует лечение широкоспектральными антибиотиками с анаэробной активностью, применение третьей генерации цефалоспоринов, а так же антибиотиков с интенсивной концентрацией в кишечнике. Колонизация кишечника микромицетами может привести к кандидемии при наличии следующих факторов риска: массивная колонизация кишечника Candida spp., первичное повреждение кишечника, гипохлоргидрия желудка, снижение кишечной перистальтики, цитотоксическая химиотерапия.
Клинически поражение грибами кишечника может представлять собой носительство, неинвазивный микотический процесс и инвазивный кандидоз.
Клинические проявления роста микромицетов