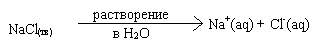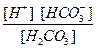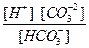использование теории гибридизации для прогнозирования геометрической формы молекул
9 Билет
Метод ВС. Основные типы геометрических форм молекул. Использование теории гибридизации для прогнозирования геометрической формы молекул.
Энергия Гиббса как критерий самопроизвольного протекания процесса.
Кобальт, никель. Строение атома, степени окисления, химическая активность. Оксиды, гидроксиды, соли, комплексные соединения. Биологическая роль кобальта.
С помощью метода валентных связей можно определить геометрическую форму молекулы, зная, какие из гибридных орбиталей заполняются электронами.
sp3 – идеальный тетраэдр,
sp2d – квадрат, согласно теории гибридизации
dsp3 – тригональная бипирамида,
d2sp3 – октаэдрическая форма
энтальпийного фактора: стремление частиц образовывать сложные связи для понижения П(потенциальной энергии)
энтропийного фактора: при повышении температуры частицы стремятся разорвать связи
Таким образом, энергия Гиббса наиболее четко показывает устойчивость системы :ΔG=ΔH-TΔS
ΔG 0 – процесс не протекает самопроизвольно
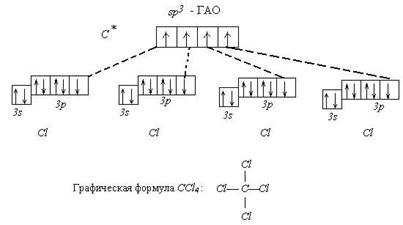
(3) Кобальт и никель устойчивы к воздействию воды, так как защищены оксидной пленкой. Кобальт и никель взаимодействуют с серой и галогенами только при нагревании. В очень мелкораздробленном состоянии кобальт и никель обладают пирофорными свойствами, то есть воспламеняются на воздухе при обычной температуре.Кобальт и никель вытесняют водород из разбавленных кислот: Э + НС1 = ЭС12 + н2, но не реагируют с растворами щелочей. В обычных условиях концентрированные серная и азотная кислоты пассивируют эти металлы, а при нагревании окисляют до солей кобальта(П), никеля(П): Со + 2H2S04 = C0SO4 + S02 + 2Н20 конц. В ряду Fe(OH)2, Со(ОН)2, Ni(ОН)2 увеличивается устойчивость гидроксидов и уменьшаются восстановительные свойства. Гидроксид железа(П) окисляется кислородом воздуха в момент получения, Со(ОН)2 — значительно медленнее, а №(ОН)2 на воздухе устойчив и окисляется под действием более сильных окислителей: 2Ni(OH)2 + NaCIO + Н20 = 2Ni(OH)3 + NaCl В ряду Fe(OH)3, Со(ОН)з, Ni(ОН)з устойчивость гидроксидов уменьшается, окислительные свойства возрастают. Гидроксиды кобальта(Ш) и никеля(Ш) окисляют концентрированные НС1 и H2S04: 2Ni(OH)3 + 6НС1 = 2№С12 + С12 + 6Н20 4Ni(OH)3 + 4H2S04 = 4NiS04 + 02 + 10Н20 Кобальт(П) и никель(П) чрезвычайно склонны к образованию комплексных соединений с координационными числами 4 и 6: Ni(CO)4, K2[Ni(CN)4], Н2[СоС14], [Со(Н20)6]С12, [Ni(NH3)6]Cl2, и другие. Кобальт(Ш) образует прочные связи с лигандами, содержащими донорный атом азота (аммиак, этилендиамин, тиоцианат-ион и другие). Так, ион гексааминкобальт(П) легко окисляется в растворе кислородом воздуха в более устойчивый ион гексааминкобальт(Ш): 4[Co(NH3)6]C12 + 2Н20 + 02 = 4[Co(NH3)6](OH)C12 Для качественного и количественного определения никеля(П) применяется реакция с реактивом Чугаева (этанольный раствор диметилглиоксима), в результате которой образуется диметилглиоксимат никеля — осадок малинового цвета.
(4) C =m/ M*V=0,033 моль/л pKa=-lgKa=4.7447 pH=(4.7447-lg0.033)/2=3.1131
1.Метод вс. Типы геом форм молекул. Исп теории гибридизации для прогнозирования геометрической формы молекул.
Основные положения метода валентных связей
1.Ковал хим связь обр двумя электронами с противоположно направленными спинами, принадлежащими двум атомам.
2.Ковал связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
3.Характеристики хим связи определяются типом перекрывания АО.
4.Ковал связь напр в сторону максимального перекрывания АО реагирующих атомов.
С помощью метода валентных связей можно опр геом форму молекулы, зная, какие из гибридных орбиталей заполняются электронами.
sp2 – идеальный тетраэдр,
sp2d – квадрат, согласно теории гибридизации
dsp3 – тригональная бипирамида,
d2sp3 – октаэдрическая форма
2.Соед As, Sb, Bi (оксиды, гидроксиды, галогениды, сульфиды). Получ и св-ва
В обыч усл металлич модиф As, Sb, Bi устойч по отн к кислороду и воде. При сгор обр оксиды Э2О3. В электрохимич ряду напр ме эти эл-ты расп после H, поэтому не взаим-ют с соляной, разб серной к-тами и с р-рами щелочей, но реаг с конц серной и азотной к-тами. Мышьяк проявл неме св-ва, обр соед анионного типа: 3As+5HNO3+2H2O=3H3AsO4+5NO
2As+3H2SO4=As2O3+3SO2+H2O, где As2O3 представляет собой мышьяковистый ангидрид.
Сурьма при взаим-ии с азотной кислотой также проявл неме св-ва, обр β-сурьмяную кислоту: 3Sb+5HNO3+2H2O=3H3SbO4+5NO, а с серной кислотой – соед катионного типа: 2Sb+6H2SO4=Sb2(SO4)3+3SO2+6H2O
Висмут при взаим-вии с к-тами проявл только ме св-ва, обр соли катионного типа: Bi+4HNO3=Bi(NO3)3+NO+2H2O
В ряду As Sb Bi усил осн и уменьш кисл св-ва гидроксидов. Гидроксид мышьяка (III) проявл амфотерные св-ва преобладание кислотных (мышьяковистая кислота). Гидроксид сурьмы(III) амфотерен с преобладанием осн св-в. Гидроксид висмута(III) в р-ре проявл только осн св-ва: BI(OH)3+3HCl=BiCl3+3H2O.
Получ гидроксида сурьмы и его амфотерные св-ва можно подтв след ур-ниями реакций:
Сульфиды as(III), sb(III), bi(III) получ непосредственным взаим-ем простых в-в или действием сульфида водорода в кислой среде на соответствующие соли:
Сульфиды as (V) и sb (V) осаждают, пропуская сульфид водорода через сильно подкисленные р-ры арсенатов или антимонатов: 2Na3ЭO4+5H2S+6HCl=Э2S5+6NaCl+8H2O
Сульфиды as и sb имеют кислотный характер и относятся к классу тиоангидридов, взаим-ют с осн сульфидами, обр тиосоли: Э2S3+3Na2S=2Na3ЭS3
При подкислении р-ров тиосолей свободные тиокислоты не выделяются, так как разлагаются в момент получения:
Сульфид висмута (III) Bi2S3, имеет основный характер, относится к классу сой и тиосолей не образует.
Сульфид мышьяка (III), As2S3 ковалентное соед, тиоангидрид, р-ряется в основных сульфидах и щелочах. Сульфид висмута (III) Bi2S3 ионное соед, соль, с р-рами основных сульфидов и щелочей не взаимодействует As2S3+3Na2S=2Na3AsS3
Bi2S3 не р-ряется ни в р-ре сульфида натрия, ни в щелочи.
AsCl5, AsCl3, SbCl5-кислотные соед, относящиеся к классу галогенангидридов, в водных р-рах гидролизованы нацело, но обратимо: AsCl3+4H2O↔As(OH)3+3HCl
В хлоридах сурьмы (III), висмута (III) связь более ионная и эти соед относятся к классу солей. В водных р-рах SbCl3 и BiCl3 сильно гидролизованы с обр основных солей Э(OH)2Cl, которые, отщепляя воду, выпадают в осадок в виде оксидохлоридов ЭOCl: ЭCl3+H2O
Гибридизация электронных орбиталей и геометрия молекул
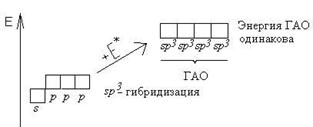
В 1930 г. Слейтером и Л. Полингом была развита теория образования ковалентной связи за счет перекрывания электронных орбиталей – метод валентных связей. В основе этого метода лежит метод гибридизации, который описывает образование молекул веществ за счет «смешивания» гибридных орбиталей («смешиваются» не электроны, а орбитали).
Определение типа гибридизации молекул с ковалентной связью
Определить тип гибридизации можно только для молекул с ковалентной связью типа АВn, где n больше или равно двум, А – центральный атом, В – лиганд. В гибридизацию вступают только валентные орбитали центрального атома.
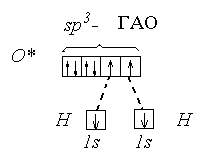
Определим тип гибридизации на примере молекулы BeH2.
Первоначально записываем электронные конфигурации центрального атома и лиганда, рисуем электронно-графические формулы.
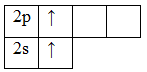
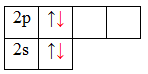
Атом бериллия (центральный атом) имеет вакантные 2p-орбитали, поэтому, чтобы принять по одному электрону от каждого атома водорода (лиганд) для образования молекулы BeH2 ему необходимо перейти в возбужденное состояние:
Образование молекулы BeH2 происходит за счет перекрывания валентных орбиталей атома Be
* красным цветом обозначены электроны водорода, черным – бериллия.
Тип гибридизации определяют по тому, какие орбитали перекрылись, т.о., молекула BeH2 находитс в sp – гибридизации.
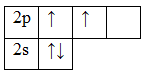
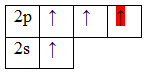
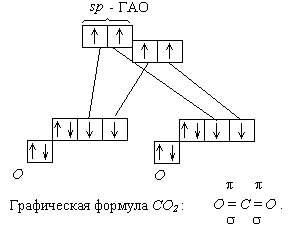
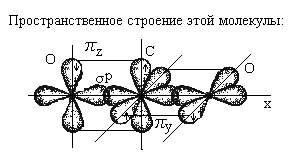
Помимо молекул состава ABn, методом валентных связей можно определить тип гибридизации молекул с кратными связями. Рассмотрим на примере молекулы этилена C2H4. В молекуле этилена кратная двойная связь, которая образована 
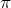
У атома углерода имеется еще одна вакантная p-орбиталь, следовательно, чтобы принять 4 атома водорода ему необходимо перейти в возбужденное состояние:
Определение геометрической структуры молекул
Геометрическую структуру молекул, а также катионов и анионов состава АВn можно с помощью метода Гиллеспи. В основе этого метода – валентные пары электронов. На геометрическую структуру оказывают влияние не только электроны, участвующие в образовании химической связи, но и неподеленные электронные пары. Каждую неподеленную пару электронов в методе Гиллеспи обозначают Е, центральный атом – А, лиганд – В.
Если неподеленных электронных пар нет, то состав молекул может быть АВ2 (линейная структура молекулы), АВ3 (структура плоского треугольника), АВ4 (тетраэдрическая структура), АВ5 (структура тригональной бипирамиды) и АВ6 (октаэдрическая структура). От базисных структур могут быть получены производные, если вместо лиганда появляется неподеленная электронная пара. Например: АВ3Е (пирамидальная структура), АВ2Е2 (угловая структура молекулы).
Чтобы определить геометрическую структуру (строение ) молекулы необходимо определить состав частицы, для чего вычисляют количество неподеленных лектронных пар (НЕП):
НЕП = (общее число валентных электронов – число электронов, пошедших на образование связи с лигандами) / 2
На связь с H, Cl, Br, I, F уходит по 1-му электрону от А, на связь с O – по 2 электрона, а на связь с N – по 3 электрона от центрального атома.
Рассмотрим на примере молекулы BCl3. Центральный атом – B.
НЕП = (3-3)/2 = 0, следовательно неподеленных электронных пар нет и молекула имеет структуру АВ3 – плоский треугольник.
Подробно геометрическое строение молекул разного состава представлено в табл. 1.
Таблица 1. Пространственное строение молекул
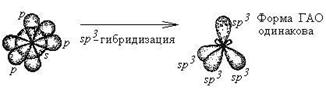
Теория гибридизации
Попытки применения МВС в простейшем варианте, изложенном выше для описания химического строения большинства молекул состоящих из 3 и более атомов оказались неудачными. Во многих случаях теория абсолютно не соответствовала экспериментальным данным. Для устранения этого противоречия была разработана теория гибридизации.
В настоящее время в различных веществах обнаружено около 20 различных типов гибридизации. Но чаще всего встречаются 6 типов гибридизации:
| Тип гибридизации | Взаимное расположение ГАО в пространстве | Структурные формы | Геометрическая фигура |
| sp |  |  | Линейная |
| sp 2 |  | 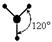 | Тригональная плоская |
| sp 3 |   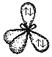 | 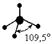 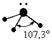 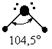 | Тетраэдрическая Тригональная пирамида Угловая |
| sp 3 d 1 |  | 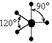 | Тригональная бипирамида |
| sp 3 d 2 |  | 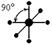 | Октаэдр |
| spd 2 |  |  | Плоский квадрат |
Наличие гибридизации и ее тип у того или иного атома в молекуле в общем случае предсказать нельзя. Для однозначного решения этой задачи в большинстве случаев нужно знать:
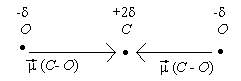
2. Чему равны валентные углы (углы между связями) или, по крайней мере, чему равен дипольный момент молекулы (сумма дипольных моментов связей).
Относительно возможной гибридизации атомов хлора ничего сказать нельзя, т.к. исходных данных недостаточно для этого.
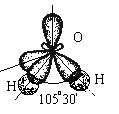
Несвязывающие атомные орбитали кислорода сильно отталкиваются друг от друга и это приводит к тому, что валентный угол в молекуле воды меньше на 5° относительно стандартного для sp 3 гибридизации.
ТЕМА 4. ХИМИЧЕСКАЯ КИНЕТИКА И УЧЕНИЕ О
1. Что такое скорость химической реакции? От каких факторов она зависит?
2. Зависимость скорости реакции от природы реагирующих веществ, концентрации и температуры.
3. Катализ. Катализаторы.
4. Обратимость химических реакций. Химическое равновесие.
5. Константа химического равновесия.
6. Смещение химического равновесия. Принципы Ле-Шателье.
v = 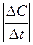
Для гетерогенных реакций в данном определении параметр D С следует заменить на D n
Величина скорости гомогенной реакции определяется 4 факторами:
1. Природой реагирующих веществ.
2. Концентрацией реагирующих веществ.
4. Наличием в системе того или иного катализатора.
Природа реагирующих веществ.
Концентрация реагирующих веществ.
Зависимость скорости реакции от концентрации выражается законом действия масс:
cкорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, равные стехиометрическим коэффициентам (т.е. тем коэффициентам, которые пишутся в уравнении реакции перед формулами веществ).
Следует учесть, что приведенное выше уравнение является верным, если данное взаимодействие протекает в одну стадию. Если реакция идет через ряд промежуточных стадий, общая скорость реакции равна скорости самой медленной стадии процесса (для этого необходимо знать реальный механизм данного взаимодействия). В дальнейшем, для простоты, будем считать все рассматриваемые процессы одностадийными.
Скорость химической реакции очень сильно зависит от температуры, при которой происходит взаимодействие веществ: чем выше температура, тем быстрее идет это взаимодействие. Математически эта зависимость может быть задана двумя способами: правилом Вант-Гоффа и уравнением Аррениуса.
Пример: температурный коэффициент некоторой реакции равен 2. Во сколько возрастет скорость этой реакции при увеличении температуры от 20 до 120°С?
Ответ: скорость данной реакции увеличится в 1024 раза.
Правило Вант-Гоффа найдено экспериментально и не является законом. Температурный коэффициент (¡) для большинства химических реакций имеет постоянное значение только в довольно узком интервале температур (как правило, D t не более 100 °С), за пределами которого заметно изменяется (увеличивается или уменьшается).
Точная зависимость скорости реакции от температуры задается уравнением Аррениуса:
k = A × 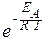
Уравнение Аррениуса является следствием теории активных соударений. По этой теории, не любое столкновение молекул взаимодействующих веществ приводит к образованию продуктов. Большинство частиц в момент соударения имеет суммарную кинетическую энергию меньше некоторого минимального значения, которое называется энергией активации (Е А). Столкновение частиц с энергией Е v0 и v2 > v0, то v3 > v0, другими словами произошло увеличение скорости химической реакции в присутствии катализатора. При этом катализатор называют положительным катализатором. Если наоборот, v1 и v2 меньше v0, то катализатор называют отрицательным катализатором или ингибитором.
Действие катализатора носит специфический характер. Так, например, оксид ванадия V2O5 ускоряет только процессы окисления с участием молекул кислорода (О2).
Положительные катализаторы и ингибиторы широко используются в промышленности и технике.
ОБРАТИМОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ.
ПОНЯТИЕ О ХИМИЧЕСКОМ РАВНОВЕСИИ
Рассмотрим взаимодействие между водородом и азотом, которое является типичным случаем обратимой реакции:
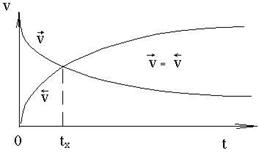
Допустим, в начальный момент времени были смешаны некоторые количества газообразных Н2 и N2. По закону действующих масс, скорость их взаимодействия (
 |
Причем, 
В начальный момент времени скорость обратной реакции (
Но по мере протекания реакции 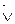
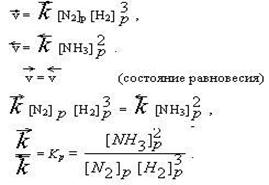 |
Отношение констант прямой и обратной реакции называется константой химического равновесия (Кр) .
Константа равновесия определяет соотношение концентрации исходных веществ и продуктов реакции в состоянии химического равновесия. Величина константы равновесия зависит только от природы реагирующих веществ и температуры. Константа равновесия не зависит от концентрации веществ, на нее не влияет катализатор (он изменяет энергию активации прямой и обратной реакции в одинаковой степени, поэтому отношение констант скоростей остается постоянным).
СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ
Химическое равновесие является случаем устойчивого равновесия. Если система находится в состоянии равновесия и на нее не оказываются внешние воздействия, она будет находиться в этом состоянии бесконечно долго.
Некоторые воздействия (изменение температуры, изменение концентрации одного из веществ, изменение давления) могут вывести систему из состояния равновесия. Но за счет того, что система находится в состоянии именно устойчивого равновесия, она самопроизвольно возвращается опять в состояние равновесия.
Принцип Ле-Шателье: если на систему, находящуюся в состоянии химического равновесия оказать какое-либо внешнее воздействие, выводящее ее из этого состояния, то в системе усилится тот процесс (прямая или обратная реакция), который возвратит систему в состояние равновесия.
Часто говорят о сдвиге (смещении) равновесия в системе: усиление прямой реакции приводит к смещению равновесия вправо (в сторону продуктов), а усиление обратной реакции смещает равновесие влево (в сторону исходных веществ).
Например, для обратимой реакции:
Внешнее воздействие влияет на равновесие следующим образом:
| Внешнее воздействие | Смещение равновесия |
| 1. Увеличение концентрации одного из исходных веществ (Н2 или N2) | 1. Вправо |
| 2. Уменьшение концентрации одного из исходных веществ (Н2 или N2) | 2. Влево |
| 3. Увеличение концентрации продукта | 3. Влево |
| 4. Уменьшение концентрации продукта (NH3) | 4. Вправо |
| 5. Увеличение температуры | 5. Влево (т.к. эндотермической является обратная реакция) |
| 6. Уменьшение температуры | 6. Вправо (т.к. эндотермической является прямая реакция) |
| 7. Увеличение давления | 7. Вправо (т.к. в уравнении данной реакции слева 4 моль газообразных веществ, а справа только 2 моль). |
| 8. Уменьшение давления | 8. Влево (см. пункт 7) |
Любое смещение равновесия для данной системы можно доказать двумя способами: по принципу Ле-Шателье или исходя из понятия о константе равновесия.
Например: произошло увеличение концентрации молекул Н2 (в реакционный сосуд ввели некоторое дополнительное количество газообразного водорода).
1. По принципу Ле-Шателье должна усиливаться та реакция, в ходе которой концентрация Н2 уменьшается, то есть водород расходуется. Это прямая реакция, а значит равновесие смещается вправо.
2. До внешнего воздействия система была равновесной, то есть выполнялось равенство:
Kp = 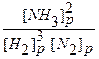
После введения в систему дополнительного количества водорода концентрации всех веществ стали неравновесными, т.к.:
Kp > 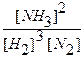
Чтобы система вернулась в состояние равновесия необходимо, чтобы увеличилась концентрация продукта (NH3) или уменьшились концентрации исходных веществ (H2 или N2). Если усилится прямая реакция, то произойдет и то и другое (концентрация NH3 увеличится, а концентрация H2 и N2 уменьшатся). Произойдет смещение равновесия вправо и концентрации веществ опять станут равновесными (но теперь уже будут иметь другие значения).
ТЕМА 5. ОБЩИЕ СВОЙСТВА РАСТВОРОВ
1. Основные понятия: раствор, растворитель, типы растворов (по агрегатному состоянию).
2. Способы выражения концентрации растворов.
3. Коллигативные свойства растворов (осмос, закон Рауля).
Если вещества в момент смешивания имели одинаковое агрегатное состояние, то растворителем считается тот компонент, которого больше по количеству вещества. Например, если смешать 180 г воды (10 моль) и 180 г этилового спирта (180 г / 40 г / моль = 3,9 моль), то растворителем является вода.
По агрегатному состоянию растворы можно разделить на газообразные, жидкие и твердые.
Способы выражения концентрации растворов
Таких способов существует множество, но чаще всего используется 6 перечисленных ниже. Символом X будет обозначаться формула того вещества, концентрация которого определяется данным выражением (Х =NaCl, H2SO4, KOH и т.д.)
w (X) = 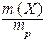
х(Х) = 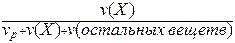
Т(Х) = 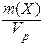
Обычно Т находят в единицах (г/дм 3 ), в системе СИ она имеет единицы измерения (кг/м 3 ). В аналитической химии эта величина находится в единицах (г/см 3 ) и называется титром вещества Х.
С(Х) = [X] = 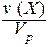
Обычно молярность выражают в (моль/дм 3 ) и обозначают буквой (М). В системе СИ молярность должна иметь единицы измерения (моль/м 3 ).
b(X) = 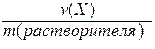
Моляльность может иметь только одну единицу измерения (моль/кг).
C(Э) = C(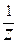
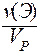
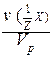
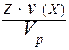
Ранее для обозначения этого понятия использовались синонимы: эквивалентная концентрация, нормальная концентрация, нормальность (все они считаются устаревшими).
Молярная концентрация эквивалентов обычно выражается в единицах (моль/дм 3 ). В СИ она имеет единицы измерения (моль/м 3 ).
Коллигативные свойства растворов
Некоторые физико-химические свойства разбавленных растворов не зависят от природы растворенного вещества, а определяются только количеством частиц этого вещества в растворе и природой растворителя. Такие свойства называются коллигативными.
Математические зависимости для коллигативных свойств выведены для сильно разбавленных растворов неэлектролитов. В случае электролитов в эти формулы вводится поправочный коэффициент, который называется изотоническим коэффициентом (i):
В ходе экспериментальных исследований жидких растворов широко используются полупроницаемые перегородки (осмотические мембраны).
Осмотическая мембрана изготавливается из материала, который пропускает через себя только молекулы растворителя. Молекулы растворенного вещества не могут проходить через нее. В современных приборах по измерению осмотического давления (осмометрах) осмотические мембраны изготавливаются из специальных сортов целлофана.
Для объяснения явления осмоса рассмотрим схему (рис. 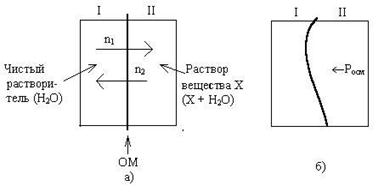
Некий сосуд разделен на две части осмотической мембраной (ОМ), выполненной из эластичного материала (типа очень тонкой резины). В начальный момент времени в левой части сосуда (I) находится чистый растворитель (например, вода), а в правой части сосуда (II) находится раствор вещества Х в данном растворителе (например, сахара в воде).
Концентрация молекул Н2О в чистом растворителе всегда больше, чем в растворе. Поэтому поток молекул воды через мембрану из левой части сосуда в правую (n1) будет больше, чем обратный поток (n2). Это приведет к тому, что объем I будет уменьшаться, а объем II увеличиваться. Эластичная осмотическая мембрана выгнется влево (рис. 1б).
Получается, что со стороны раствора на мембрану действует давление, которое деформирует эту перегородку. Такое давление называется осмотическим (Росм). Величина его определяется уравнением Вант-Гоффа:
Поэтому Вант-Гофф сформулировал закон осмотического давления следующим образом: осмотическое давление равно тому давлению, которое производило бы растворенное вещество, если бы оно в виде идеального газа занимало тот же объем при той же температуре.
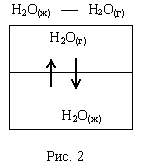
Если жидкий летучий растворитель (например, воду) поместить в замкнутый объем, то через некоторое время установится равновесие (рис. 2).
Закон Рауля: относительное понижение давления насыщенного пара растворителя над раствором нелетучего вещества равно мольной доле этого вещества в растворе.
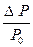
В экспериментальных исследованиях часто используются 2 следствия из закона Рауля.
Первое следствие из закона Рауля: раствор нелетучего вещества имеет температуру кипения выше, чем у чистого растворителя.
Значение Кэ определяется только природой растворителя: для воды Кэ = 0,52 кг×К/моль, для бензола Кэ = 2,57 кг×К/моль, для этилового спирта Кэ = 1,16 кг×К/моль, для диэтилового эфира Кэ = 2,02 кг×К/моль и т.д.
Измерив температуру кипения раствора неизвестного вещества в данном растворителе, можно рассчитать его молярную массу. Этот метод называется эбулиоскопией.
Второе следствие из закона Рауля: раствор нелетучего вещества имеет температуру замерзания ниже, чем у чистого растворителя:
Значение Кк для данного растворителя является константой:
Кк (диэтиловый эфир) = 1,73 кг×К/моль.
На этом следствии из закона Рауля основана криоскопия: метод нахождения молярных масс веществ, исходя из измерения температуры замерзания их растворов.
ТЕМА 6. РАСТВОРЫ ЭЛЕКТРОЛИТОВ
1. Теория электролитической диссоциации.
2. Степень электролитической диссоциации. Сильные и слабые электролиты. Уравнения диссоциации.
3. Теория сильных электролитов. Кажущаяся степень электролитической диссоциации. Активность иона.
4. Теория слабых электролитов. Константа диссоциации. Закон разбавления Оствальда.
5. Ионные уравнения химических реакций.
6. Собственная диссоциация воды. Водородный и гидроксильный показатели.
7. Произведение растворимости. Ненасыщенный, насыщенный и пересыщенный раствор.
Было установлено, что многие вещества, при растворении в полярных растворителях (например, в воде) распадаются на ионы. Такие вещества называются электролитами, а процесс распада на ионы называется электролитической диссоциацией (ЭД).
Индекс (aq) означает, что данный ион акватирован. Очень часто этот индекс опускается.
a = 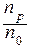
В соответствии со значениями a все вещества по отношению к данному растворителю можно разделить на 3 типа:
a = 0 неэлектролиты,
0 +3 + 3 SO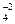
NaHCO3 = Na + + HCO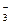
2. Некоторые основания (они называются сильными основаниями или щелочами):
3. Некоторые кислоты (они называются сильными кислотами):
HMnO4 = H + + MnO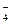
H2SO4 = H + + HSO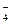
Слабые электролиты (уравнения диссоциации)
В отличие от сильных электролитов, слабые электролиты подвергаются ЭД обратимо. В растворе слабого электролита кроме ионов всегда присутствуют недиссоциированные молекулы. Причем, если раствор не слишком сильно разбавлен, целых молекул слабого электролита в нем, как правило, значительно больше, чем ионов.
К слабым электролитам относятся:
1. Многие кислоты (они называются слабыми) и все гидроанионы:
H2CO3 ¾ H + + HCO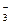
HCO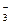
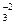
HSO 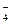
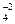
2. Многие основания (они называются слабыми) и все гидроксокатионы:
3. Все амфотерные гидроксиды, их гидроанионы и гидроксокатионы:
H2ZnO2 ¾ H + + HZnO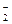
HZnO 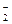
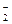
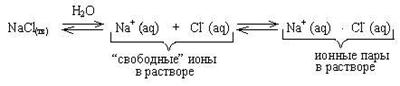
Теория сильных электролитов
По определению, для сильных электролитов истинная степень диссоциации a = 1. И, действительно, в их растворах не обнаружено целых (недиссоциированных) молекул.
Несмотря на это многие экспериментальные методы исследования степени диссоциации (самый простой основан на измерении электропроводности растворов) дают значения этой величины меньше 1.
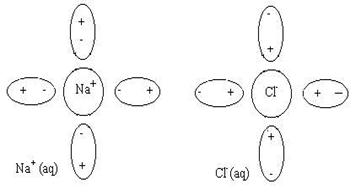
Во многих физических и химических процессах ионные пары ведут себя подобно “молекулам”, хотя, конечно, таковыми не являются. В ионной паре нет химической связи между центральными ионами, взаимодействуют только их гидратные оболочки.
Для учета отмеченных выше явлений вводится понятие об активности иона. Активность равна концентрации свободных ионов данного вида в растворе. Например, для ионов натрия:
Коэффициент активности (fa) показывает, какая часть ионов данного вида не входит в состав ионных пар, т.е. участвует в различных электрических и ионных процессах.
Для сильно разбавленных растворов коэффициент активности можно рассчитать. Сначала находится значение ионной силы раствора (J):
Коэффициент активности данного иона рассчитывается по уравнению:
где 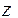
Теория слабых электролитов
Диссоциация любой частицы, являющейся слабым электролитом является обратимым процессом. Как и для любого другого обратимого процесса можно ввести понятие о константе равновесия, которая в данном случае получила название “константа диссоциации” (Кd). Например, угольная кислота является слабым электролитом и диссоциирует в две ступени (по второй ступени диссоциируют уже не молекулы Н2СО3, а гидрокарбонат-анионы НСО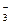
1 cтупень: Н2СО3 
К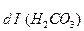
II ступень: HCO 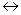
K 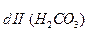
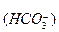
Общее уравнение: H2CO3 ¾ 2H + + CO
K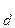
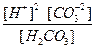
Нетрудно доказать, что:
Величина константы диссоциации зависит только от природы элктролита и растворителя, а также от температуры. Значения К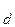
Константа диссоциации не зависит от концентрации электролита в растворе, а степень диссоциации (a) слабого электролита имеет явную зависимость от этого параметра: чем больше концентрация, тем меньше (a). Функционально эта зависимость описывается законом разбавления Оствальда:
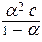
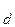
K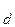
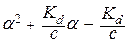
Положительным корнем этого уравнения является:

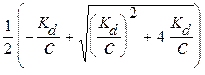
Ионные уравнения реакций
В качестве примера рассмотрим взаимодействие соляной кислоты и гидроксида натрия в водном растворе:
HCl + NaOH = NaCl + H2O.
Это уравнение написано в молекулярном виде. Молекулярное уравнение данного процесса не отражает реальных явлений, имеющих место при протекании такого взаимодействия, так как в приведенном примере все вещества, кроме воды, являются сильными электролитами и в растворе присутствуют не в виде молекул, а только в виде ионов:
Поэтому уравнение нейтрализации логичнее написать в ионном виде. При переходе от молекулярного к ионному (точнее: полному ионному) уравнению на ионы разбиваются только формулы сильных электролитов, хорошо растворимых в воде:
Полученное выражение можно сократить и получить сокращенное ионное уравнение:
Сокращенное ионное уравнение показывает, что данное взаимодействие сводится к реакции между ионами водорода и гидроксид-анионами с образованием молекул слабого электролита (воды).
Аналогичным образом следует рассматривать и другие процессы, протекающие в растворах с участием электролитов.
NH4OH + HNO2 = NH 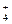
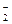
Пример 6. CuCl2 + Zn = Cu + ZnCl2
Cu +2 + Zn = Cu + Zn +2
ДИССОЦИАЦИЯ ВОДЫ. ВОДОРОДНЫЙ И ГИДРОКСИЛЬНЫЙ ПОКАЗАТЕЛИ
Вода является очень слабым электролитом. Она диссоциирует по уравнению:
Для данного обратимого процесса можно написать выражение:
[H2O] = 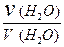
Полученное значение можно умножить на константу диссоциации и получить новую константу, которая называется константа воды (К):
В нейтральной среде рН = 7.
В кислой среде рН 7.
Точное определение рН (или рОН) растворов осуществляется специальными приборами (рН- метрами).
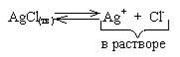
Произведение растворимости (ПР) является частным случаем константы равновесия для процесса перехода труднорастворимого сильного электролита в раствор.
После установления такого равновесия раствор будет называться насыщенным. Для данного обратимого процесса можно ввести константу равновесия:
Kp = 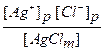
Концентрация [AgClm] является постоянной величиной. По сути дела это плотность твердого хлорида серебра, выраженная в единицах молярной концентрации (моль / дм 3 = М). Поэтому вводится новая константа равновесия, которая называется произведением растворимости (ПР):
Если же ПК > ПР, то раствор называется пересыщенным. Это тоже неравновесный раствор, так как избыточное количество растворенного вещества будет самопроизвольно выпадать в виде осадка до тех пор, пока ПК не станет равным ПР при этой температуре.
Решение: Взаимодействие должно протекать по уравнению:
AgNO3 = Ag + + NO
0,01 моль 0,01 моль 0,01 моль
Так как растворы очень разбавлены, то сумма их объемов равна объему смеси (1 дм 3 + 1 дм 3 = 2 дм 3 ).
Отсюда [Ag + ] = 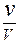
Аналогично можно найти концентрацию ионов SO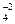
[SO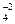
Ответ: осадок выпадать не будет.
Гидролизу могут подвергаться как органические, так и неорганические вещества. Наиболее практически важен гидролиз солей.
Любая соль является сильным электролитом, поэтому в водном растворе она суще
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет