Как найти количество нейтронов
Как найти количество нейтронов
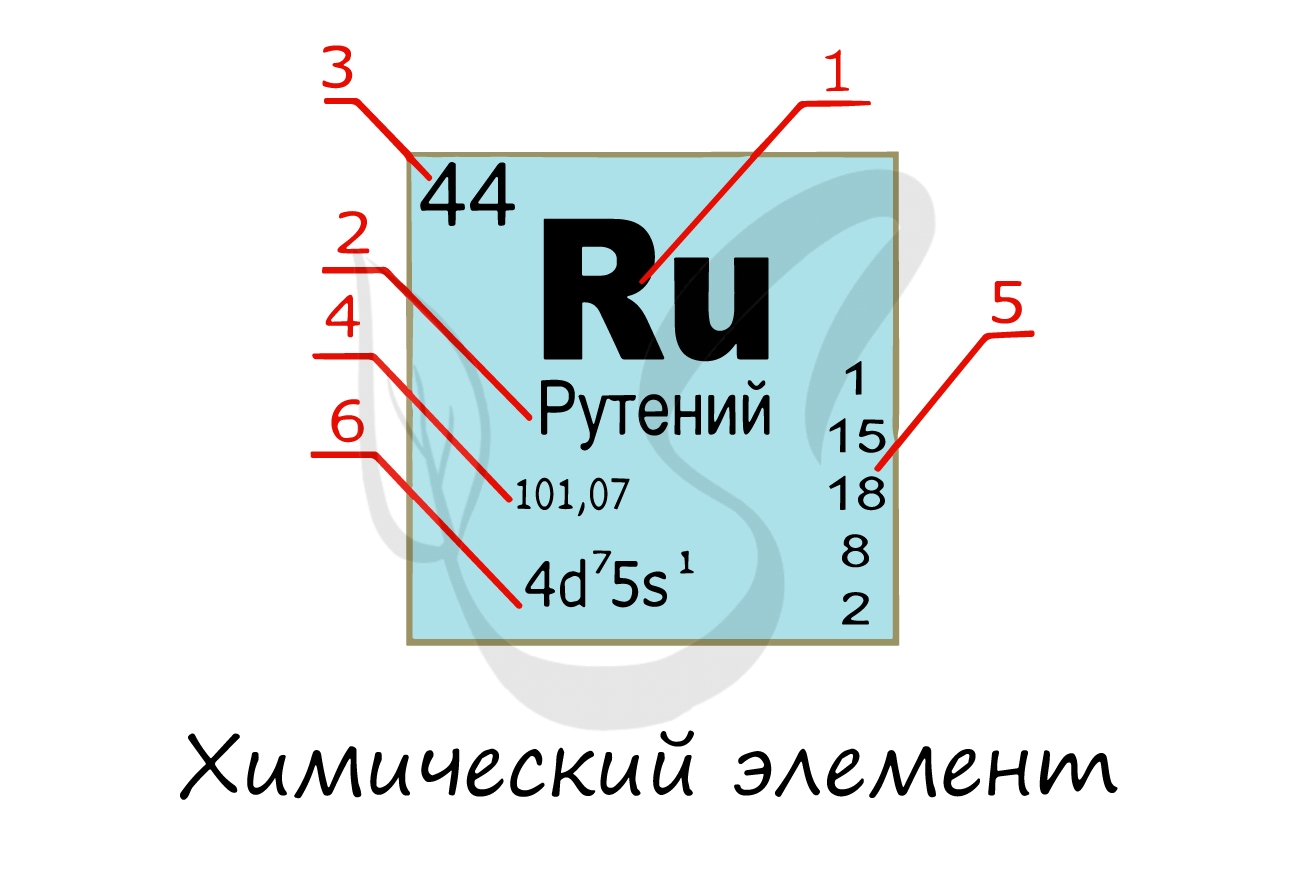
Химические элементы
Химический элемент
Надо заметить, что на экзамене часто из карточки элемента скрывают распределение электронов и конфигурацию внешнего уровня. Тем не менее, если вы успешно освоили предыдущую тему, то для вас не составит труда написать электронную конфигурацию атома зная его порядковый номер в таблице Д.И. Менделеева (номер уж точно не тронут!))
Протоны, нейтроны и электроны
Вы уже знаете, что порядковый номер элемента в периодической таблице Д.И. Менделеева равен числу протонов, а число протонов равно числу электронов.
Для того чтобы найти число нейтронов в атоме алюминия, необходимо вычесть из атомной массы число протонов:
Получается, что в атоме алюминия 14 нейтронов. Посчитайте число нейтронов, электронов и протонов самостоятельно для атомов бериллия, кислорода, меди. Решение вы найдете ниже.
Если вы поняли суть и научились считать протоны, нейтроны и электроны, самое время приступать к следующей теме.
Изотопы
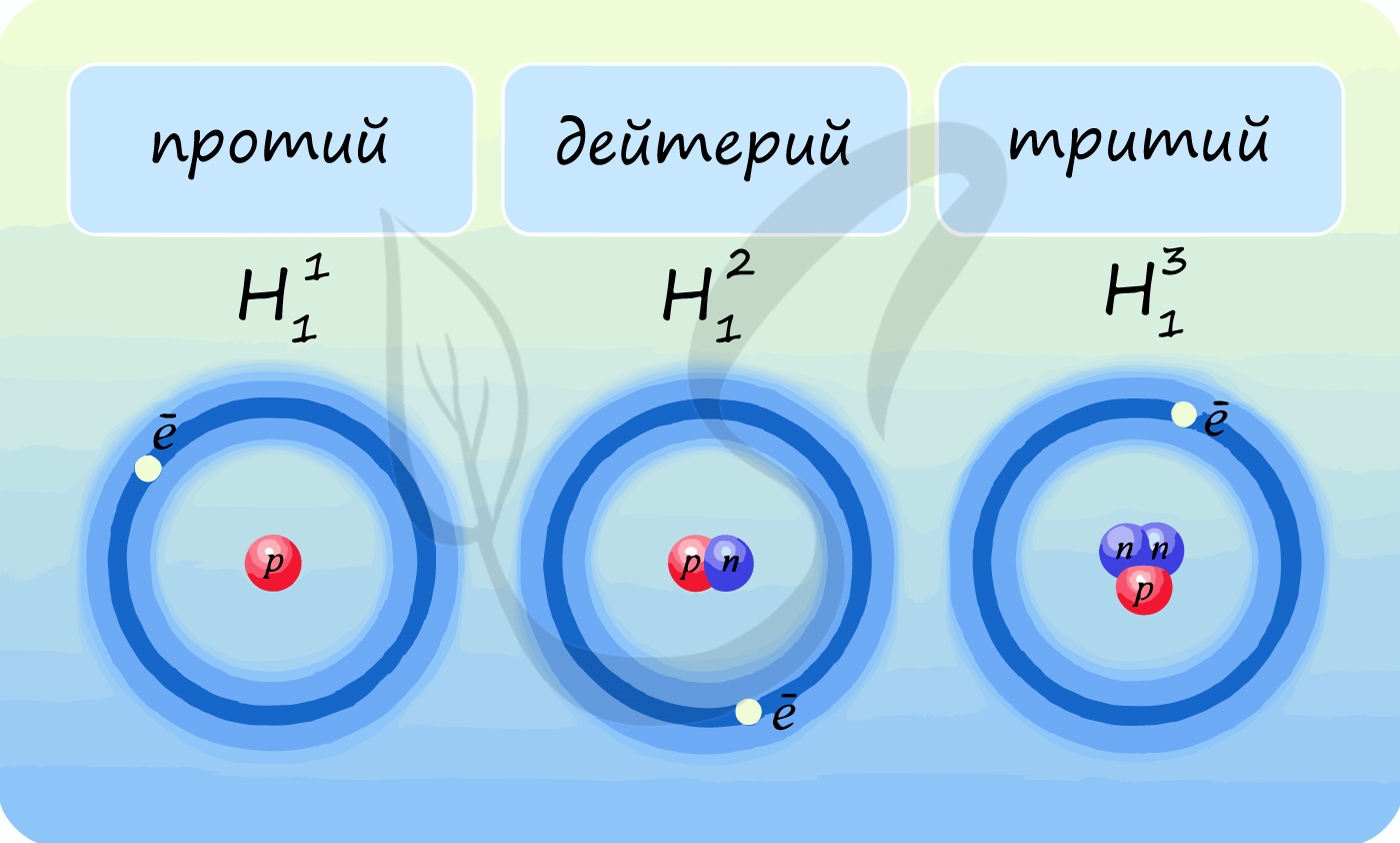
Лучше всего объяснить, что такое изотопы наглядным примером. Широко известны три изотопа водорода: протий, дейтерий и тритий.
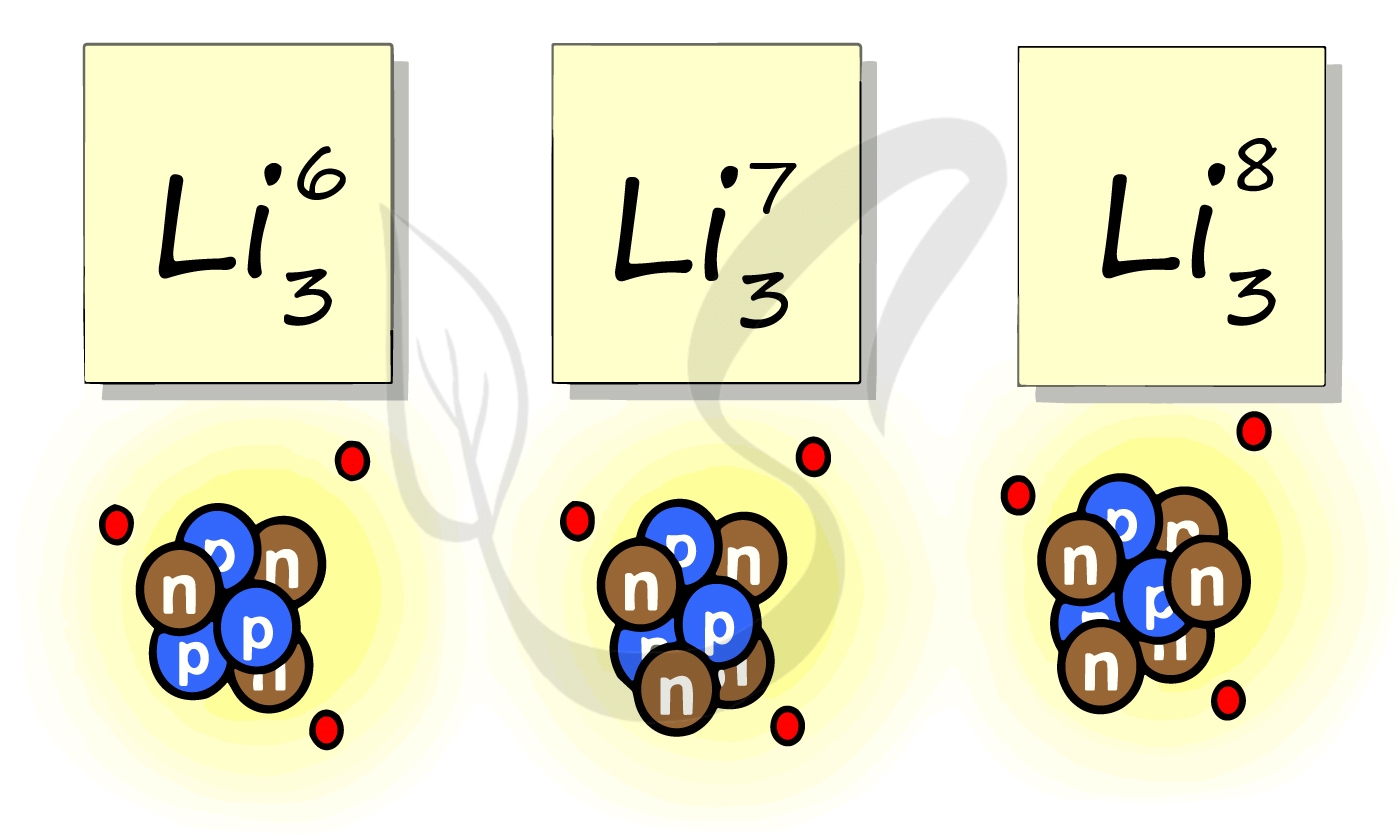
Рассмотрим пример с изотопами лития. Самостоятельно посчитайте количество нейтронов у каждого изотопа. Найдите тот, который включен в таблицу Д.И. Менделеева.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Как найти число нейтронов в атоме
Соавтор(ы): Bess Ruff, MA. Бесс Руфф — аспирантка Университета штата Флорида, работает над получением степени PhD по географии. Получила степень магистра экологии и менеджмента в Калифорнийском университете в Санта-Барбаре в 2016 году. Проводила исследования для проектов по морскому пространственному планированию в Карибском море и обеспечивала научную поддержку в качестве дипломированного участника Группы устойчивого рыболовства.
Количество просмотров этой статьи: 181 613.
В атомах одного и того же элемента число протонов неизменно, в то время как число нейтронов может меняться. Зная, сколько нейтронов содержится в конкретном атоме, вы сможете определить, является ли он обычным атомом или изотопом, который будет иметь меньшее или большее количество нейтронов. [1] X Источник информации Определить количество нейтронов в атоме — довольно просто. Все, что вам нужно сделать для расчета количества нейтронов в атоме или изотопе, — это следовать нашим инструкциям и держать под рукой периодическую таблицу.
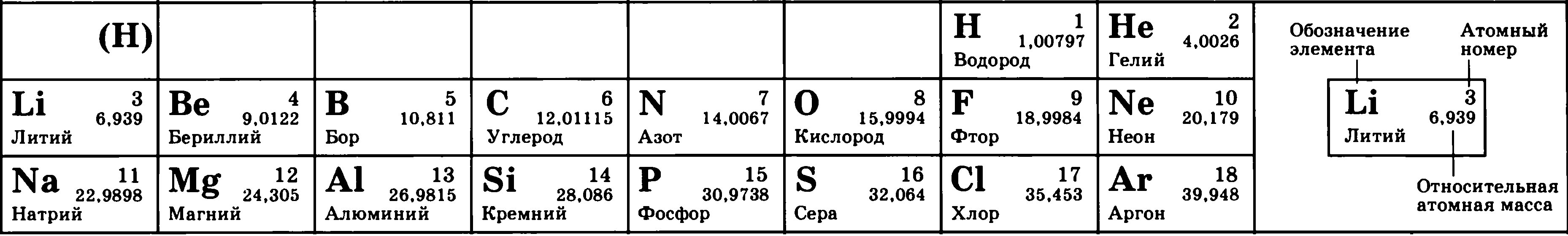
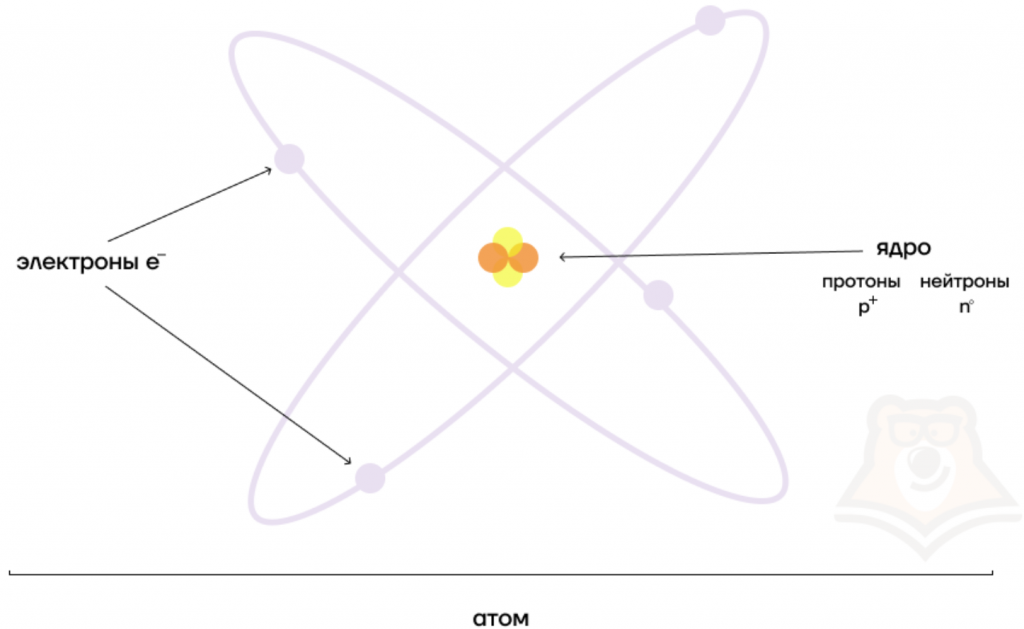
Атом состоит из ядра и вращающихся вокруг ядра электронов.
Ядро состоит из протонов и нейтронов
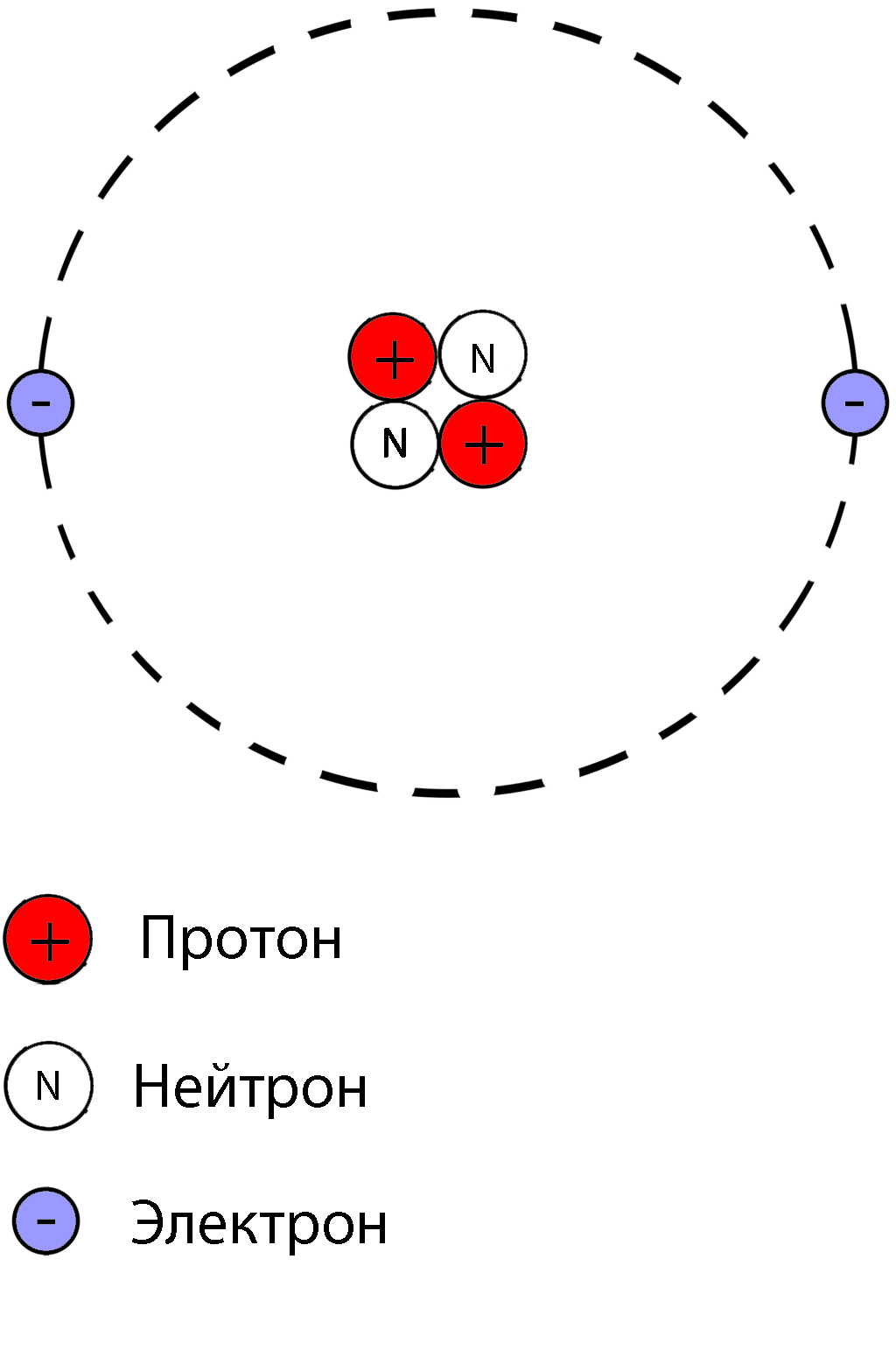
Протон- положительно заряженная частица
масса протона равна единице, заряд протона равен единице
Нейтрон-нейтральная частица
масса нейтрона равна единице, заряд нейтрона равен нулю
Масса атома складывается из числа протонов и числа нейтронов, масса электрона не учитывается
Рассмотрим фрагмент таблицы Менделеева и найдем количество протонов, нейтронов и электронов в атоме водорода
После чего начертим модель атома водорода
Порядковый номер атома водорода равен единице, значит атом имеет:
1 электрон
1 протон
Для нахождения количества нейтронов нужно из массы вычесть число протонов
Масса атома водорода равна единице
В атоме водорода нет нейтронов
Модель атома водорода:
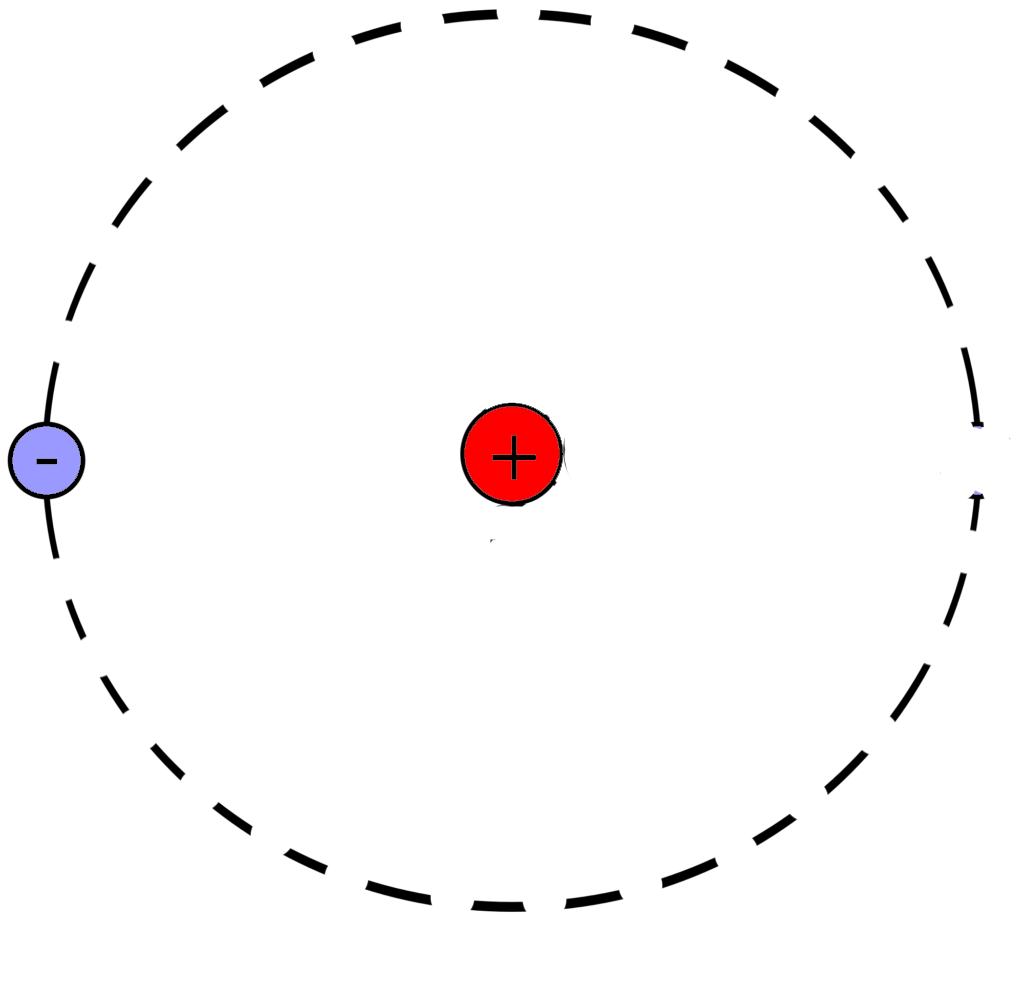
Рассмотрим фрагмент таблицы Менделеева и найдем количество протонов, нейтронов и электронов в атоме гелия
После чего начертим модель атома гелия
Порядковый номер атома гелия равен 2, значит атом имеет:
2 электрона
2 протона
Для нахождения количества нейтронов нужно из массы вычесть число протонов
Масса атома гелия равна 4
В атоме гелия 2 нейтрона
Модель атома гелия:
С помощью фрагмента таблицы Менделеева найти количество протонов, нейтронов и электронов в атоме лития
Массу атома округлить до 7.
Как найти количество нейтронов
Каждое атомное ядро, кроме водорода, содержит как протоны, так и нейтроны. Ядра слишком малы, чтобы их можно было увидеть даже под микроскопом, а нуклоны (это общий термин для протонов и нейтронов) еще меньше. Это позволяет подсчитать количество нейтронов, но ученые все еще знают, сколько в ядрах каждого изотопа каждого элемента. Откуда они знают? Они используют такие методы, как масс-спектрометрия, для измерения общей массы атомов конкретного элемента. Как только они узнают общую массу, остальное легко.
Используйте периодическую таблицу
Периодическая таблица перечисляет все элементы, увеличивая число протонов, поэтому место, которое элемент занимает в таблице, автоматически сообщает вам, сколько протонов находится в его ядре. Это атомный номер элемента, и он отображается прямо под символом для элемента. Рядом с ним другое число, которое является атомной массой. Это число всегда больше атомного номера и часто содержит дробь, потому что это среднее от атомных масс всех естественных изотопов этого элемента. Вы можете использовать его для определения среднего количества протонов в ядре этого элемента.
Процедура не может быть проще. Округлите атомную массу до ближайшего целого числа, затем вычтите из нее атомный номер элемента. Разница равна количеству нейтронов.
пример
1. Сколько в среднем нейтронов в ядре урана?
Уран является 92-м элементом в периодической таблице, поэтому его атомный номер 92, и в его ядре 92 протона. Периодическая таблица перечисляет атомную массу как 238.039 amu. Округлите атомную массу до 238, вычтите атомный номер, и у вас останется 146 нейтронов. Уран имеет большое количество нейтронов по отношению к числу протонов, поэтому все его изотопы радиоактивны.
Количество нейтронов в изотопе
Количество нейтронов в ядре конкретного элемента может варьироваться, и каждый вариант элемента с его характерным числом нейтронов известен как изотоп. Все элементы, кроме 20, имеют более одного изотопа, а некоторые имеют много. Олово (Sn) возглавляет список с десятью изотопами, сопровождаемыми ксеноном (Xe) с девятью.
В случае С-14 атомное число углерода равно 6, поэтому в ядре должно быть 8 нейтронов. Это на два больше, чем у более распространенного сбалансированного изотопа С-12. Дополнительная масса делает С-14 радиоактивным.
Как определить число протонов, нейтронов и электронов в изотопе?
Для того чтобы это сделать вам нужно знать 3 вещи:
Число протонов и электронов в атоме одинаково и равно порядковому номеру элемента в периодической таблице.
Число нейтронов вычисляется по формуле:
Где N — число нейтронов, A — атомная масса элемента (в целых числах), Z — заряд ядра атома (число протонов) или порядковый номер атома в периодической таблице Менделеева.
Что такое изотоп?
Изотопы это разновидности атомов химического элемента, которые имеют одинаковый заряд ядра (порядковый номер в таблице), но разные массовые числа.
Проще говоря, у изотопов в ядре атома одинаковое число протонов, но разное число нейтронов.
Таким образом, число протонов и электронов у изотопов такое же, как и у обычных атомов, разница лишь в количестве нейтронов.
Примеры
Сколько электронов, протонов и нейтронов содержит атом изотопа титана 50 Ti?
Титан имеет порядковый номер 22. Значит в ядре содержится 22 протона, а в атоме 22 электрона.
Число нейтронов: N = 50 – 22 = 28 нейтронов.
Сколько электронов содержит нейтральный атом изотопа полония?
В данном случае нам даже не нужно знать массовое число изотопа, т.к. речь идет только об электронах. Порядковый номер полония 84, значит в ядре атома 84 протона, а в атоме 84 электрона.
Определите число протнов, нейтронов и электронов для изотопа 55 Mn.
Порядковый номер марганца 25. Значит в ядре атома 25 протонов, а в атоме 25 электронов.
Найдем число нейтронов: N = 55 – 25 = 30 нейтронов.
Определите число протонов изотопа калия.
В этом случае массовое число изотопа не имеет значения, т.к. речь идет о протонах, число которых у изотопов одинаково. Калий имеет порядковый номер в таблице 19, значит у любого изотопа калия будет 19 протонов.
Число нуклонов (протонов и нейтронов) в атоме
Как определить число нуклонов в ядре атома?
Число нуклонов в ядре атома равно массовому числу атома (относительная атомная масса химического элемента) или сумме протонов и нейтронов.
Как определить число протонов в атоме?
Число протонов в атоме равно заряду его ядра (обозначается как Z) или порядковому номеру элемента в периодической таблице Менделеева.
Как определить число нейтронов в атоме?
Где N – число нейтронов, A – атомная масса элемента (в целых числах), Z – заряд ядра атома или порядковый номер атома в периодической таблице Менделеева.
Развернутый ответ
Масса атома складывается из двух величин: масса протонов + масса нейтронов. Дело в том, что масса электронов пренебрежимо мала.
Масса нейтрона = 1,674 927 498 04(95)⋅10⁻²⁷ кг= 1,008 664 915 60(57) а.е.м.
Масса протона = 1,672 621 923 69(51)⋅10⁻²⁷ кг = 1,007276466621(53) а.е.м.
Масса электрона = 9,109383 7015(28)⋅10⁻³¹ кг = 0,000548579909065 а.е.м.
То есть даже 100 электронов дадут в сумме всего 0,0548579909065 а.е.м.
Первоначально Д. И. Менделеев в построении своей периодической таблицы исходил из атомных весов элементов. Однако, дальнейшее развитие науки показало, что свойства химических элементов находятся в прямой зависимости не от атомной массы химического элемента, а от заряда ядра его атома. Таким образом, в периодической таблице химические элементы выстроены в порядке возрастания заряда ядра атома и номер элемента в таблице соответствует заряду его ядра. А заряд ядра равен сумме протонов. То есть № (элемента) = Z (заряд ядра или число протонов).
Остаток массы ядра приходится на нейтроны. Поэтому чтобы определить число нейтронов в атоме нужно всего лишь вычесть из атомной массы число протонов, которое равно заряду ядра или порядковому номеру элемента в таблице Менделеева.
Примеры
Сколько протонов и нейтронов в атоме натрия?
Ar (Na) = 23 а.е.м.
Z (Na) = 11 (протонов)
N = Ar (Na) – Z (Na) = 23 – 11 = 12 (нейтронов)
Ответ: число протонов в атоме натрия равно 11, а число нейтронов в атоме натрия равно 12.
Сколько протонов и нейтронов в атоме фосфора?
Ar (P) = 31 а.е.м.
Z (P) = 15 (протонов)
N = Ar (P) – Z (P) = 31 – 15 = 16 (нейтронов)
Ответ: число протонов в атоме фосфора равно 15, а число нейтронов в атоме фосфора равно 16.
Сколько протонов и нейтронов в атоме золота?
Ar (Au) = 197 а.е.м.
Z (Au) = 79 (протонов)
N = Ar (Au) – Z (Au) = 197 – 79 = 118 (нейтронов)
Ответ: число протонов в атоме золота равно 79, а число нейтронов в атоме золота равно 118.
Сколько протонов и нейтронов в атоме кремния?
Ar (Si) = 28 а.е.м.
Z (Si) = 14 (протонов)
N = Ar (Si) – Z (Si) = 28 – 14 = 14 (нейтронов)
Ответ: число протонов и нейтронов в атоме кремния равно 14.
Сколько протонов и нейтронов в атоме углерода?
Ar (C) = 12 а.е.м.
Z (C) = 6 (протонов)
N = Ar (C) – Z (C) = 12 – 6 = 6 (нейтронов)
Ответ: число протонов и нейтронов в атоме углерода равно 6.
Сколько протонов и нейтронов в атоме калия?
Ar (K) = 39 а.е.м.
Z (K) = 19 (протонов)
N = Ar (K) – Z (K) = 39 – 19 = 20 (нейтронов)
Ответ: число протонов в атоме калия равно 19, а число нейтронов в атоме калия равно 20.
Сколько протонов и нейтронов в атоме железа?
Ar (Fe) = 39 а.е.м.
Z (Fe) = 19 (протонов)
N = Ar (Fe) – Z (Fe) = 56 – 26 = 30 (нейтронов)
Ответ: число протонов в атоме железа равно 19, а число нейтронов в атоме железа равно 30.
Сколько протонов и нейтронов в атоме алюминия?
Сколько протонов и нейтронов в атоме фтора?
Ar (F) = 19 а.е.м.
Z (F) = 9 (протонов)
N = Ar (F) – Z (F) = 19 – 9 = 10 (нейтронов)
Ответ: число протонов в атоме фтора равно 9, а число нейтронов в атоме фтора равно 10.
Сколько протонов и нейтронов в атоме хлора?
Ar (Cl) = 35 а.е.м.
Z (Cl) = 17 (протонов)
N = Ar (Cl) – Z (Cl) = 35 – 17 = 18 (нейтронов)
Ответ: число протонов в атоме хлора равно 17, а число нейтронов равно 18.
Сколько протонов и нейтронов в атоме кислорода?
Ar (O) = 16 а.е.м.
Z (O) = 8 (протонов)
N = Ar (O) – Z (O) = 16 – 8 = 8 (нейтронов)
Ответ: число протонов и нейтронов в атоме кислорода равно 8.
Сколько протонов и нейтронов в атоме серы?
Ar (S) = 32 а.е.м.
Z (S) = 16 (протонов)
N = Ar (S) – Z (S) = 32 – 16 = 16 (нейтронов)
Ответ: число протонов и нейтронов в атоме серы равно 16.
Сколько протонов и нейтронов в атоме магния?
Ar (Mg) = 32 а.е.м.
Z (Mg) = 16 (протонов)
N = Ar (Mg) – Z (Mg) = 24 – 12 = 12 (нейтронов)
Ответ: число протонов в атоме магния равно 16, а число нейтронов равно 12.
Сколько протонов и нейтронов в атоме цинка?
Ar (Zn) = 65 а.е.м.
Z (Zn) = 30 (протонов)
N = Ar (Zn) – Z (Zn) = 65 – 30 = 35 (нейтронов)
Ответ: число протонов в атоме цинка равно 30, а число нейтронов в атоме цинка равно 35.
Протоны, нейтроны и электроны: строение атомов
В древние времена считалось, что все состоит из земли, воды и воздуха, другого — нет. И сравнительно недавно люди смогли показать всю составляющую нашего мира. Важным вопросом было: что из себя представляет вещество?
Вещество — это материя, которая есть во всех физических телах на нашей планете.
Оно может быть простым и сложным.
Различие этих двух групп состоит в том, что простые вещества состоят из одного вида атомов, а сложные — из нескольких, поэтому впервые в ходе реакций не могут раскладываться на другие атомы, как это делают вторые.
Образцом сложного вещества можно назвать воду (H2O). Если провести химическую реакцию, то оно образует 2 элемента — водород (Н) и кислород (О). То, что получилось, — простые вещества, без последующего разложения.
В 19 веке считалось, что сами элементы не поддаются изменениям и независимы от объединения. Но такие высказывания были опровергнуты русским химиком Дмитрием Ивановичем Менделеевым, который доказал обратное, при этом указав на то, что качественная характеристика каждого элемента влияет на его атомный вес, из-за чего происходит повтор их свойств. Это умозаключение он олицетворил в своей периодической системе, назвав в честь себя.
Атом — мелкая частица, которая не разлагается в реакции на другие компоненты.
Есть что-то меньше вещества — это атомы.
Атомы можно различать по нескольким параметрам (приведем самые распространенные):
Любой атом отличается от частицы другого элемента. Если сравнить атом водорода (Н) с атомом кислорода (О), то, очевидно, что у них будет несоответствие по многим характеристикам.
Размер атома
Если сравнить размеры атома и составляющих его частиц, то первый преобладает по своим масштабам. Ядро атома — ничто, по сравнению с ним самим. Взяв один кубический метр платины (Pt) и сплюснув его до такого состояния, где атомные расстояния просто бы исчезли, то он его кубический метр превратился бы в кубический миллиметр.
Из определения атома следует, что это маленькая частица. По форме они напоминают шар, а размер их поперечников составляет стомиллионную долю сантиметра. Чтобы это было нагляднее, рассмотрим поперечник атома водорода (Н), считающийся самым маленьким. Его размер составляет 10-8 доле сантиметра. Большим атомом является уран (U), чья величина составляет 3 х10-8 долей сантиметра.
Масштаб и вес атомов небольшие.
Вес атома
Чтобы посчитать вес какого-либо элемента, принято использовать 0,0625 долю кислорода (О), которая показывает насколько значение этого элемента больше. Если обратиться к таблице Менделеева, то можно увидеть под номерами всех элементов цифру, обозначающую атомный вес. Например, у водорода (Н) он составляет 1,008 (значение округляется, поэтому 1),а у радия — 226,025 (или же 226).Тут можно проследить разницу веса.
На заметку: при работе с периодической таблицей учтите, что если у вещества номер выше, тем вес атома будет больше.
Чаще всего у многих их вес будет дробный. Это объясняется тем, что они вмещают определенное количество частиц со своим весом, но признаки у всех абсолютно идентичны. Но такое не только у атомов. То же самое есть и самих элементов. Их называют изотопами.
Изотопы — химические элементы, занимающие один порядковый номер, но разную массу ядер.
Изотопы есть практически у каждого элемента (у кальция (Са) их целых четыре), при этом, чаще всего, их выводят искусственным путем.
Элементарные частицы
Протоны, нейтроны
Протоны — положительно заряженные части ядра. Заряд равен заряду электрона. Вес составляет 0,0625 грамм.
Нейтроны — нейтральная часть ядра. Чтобы узнать их значение, нужно из атомного веса элемента вычесть значение протонов (= электронов).
Поскольку электроны отделены от своих “напарников”, кружась вокруг них, стоит уделить им отдельное внимание.
Электроны
Электроны — частицы, у которых самый маленький отрицательный электрический заряд.
До настоящего времени считалось, что атомы, разложенные из элементов, являются конечным продуктом. На сегодняшний день эта мысль была развеяна учеными, которые доказали, что даже эти разложенные атомы содержат в себе крохотные молекулы.
Обратимся к одной из гипотез, объясняющую вещественную структуру. Там говорится, что элементный атом — некая совокупность, где есть центр, вокруг которого происходит вращение других крупинок.
Начнем с рассмотрения окраин центра, а именно с электронных уровней и электронов.
Как и говорилось ранее, значение электронов такое же, как и у протонов.
Масса электрона зависит от его скорости. Поговорив про массу “покоя”, которая есть у всех тел на Земле, нужно посмотреть и на массу “скорости”. Когда электрон занимается перемещением, то он образовывает электромагнитное поле. Оно играет большую роль, ибо именно из-за проявления ее инертных свойств набирается масса и энергия, передавая это все частицам. Сделаем вывод, что ускоренный динамизм этой частицы, приводит к набору его веса.
Но перемещение электронов не происходит ровно. Научно доказано, что эти частицы двигаются волнообразно из-за интерференции и дифракции.
Интерференция электронов — слияние нескольких волн электронов.
Дифракция электронов — волновое обтекание области места, через которое проходит ток.
Помимо того, что электроны двигаются волнами, так еще они крутят вокруг самих себя. Крутящееся и волновое движение говорит о нем (электроне) как о некоем магните.
Все три вида элементарных частиц фигурируют в постоянном обменивающемся контакте. Между электроном и протоном возникает связь, заставляющая их содействовать, поскольку их заряды противоположны, а вот две одинаковые частицы (например, два электрона) отталкиваются, т.к. заряды одинаковы (так же и у протона).
Нахождение частиц у элемента
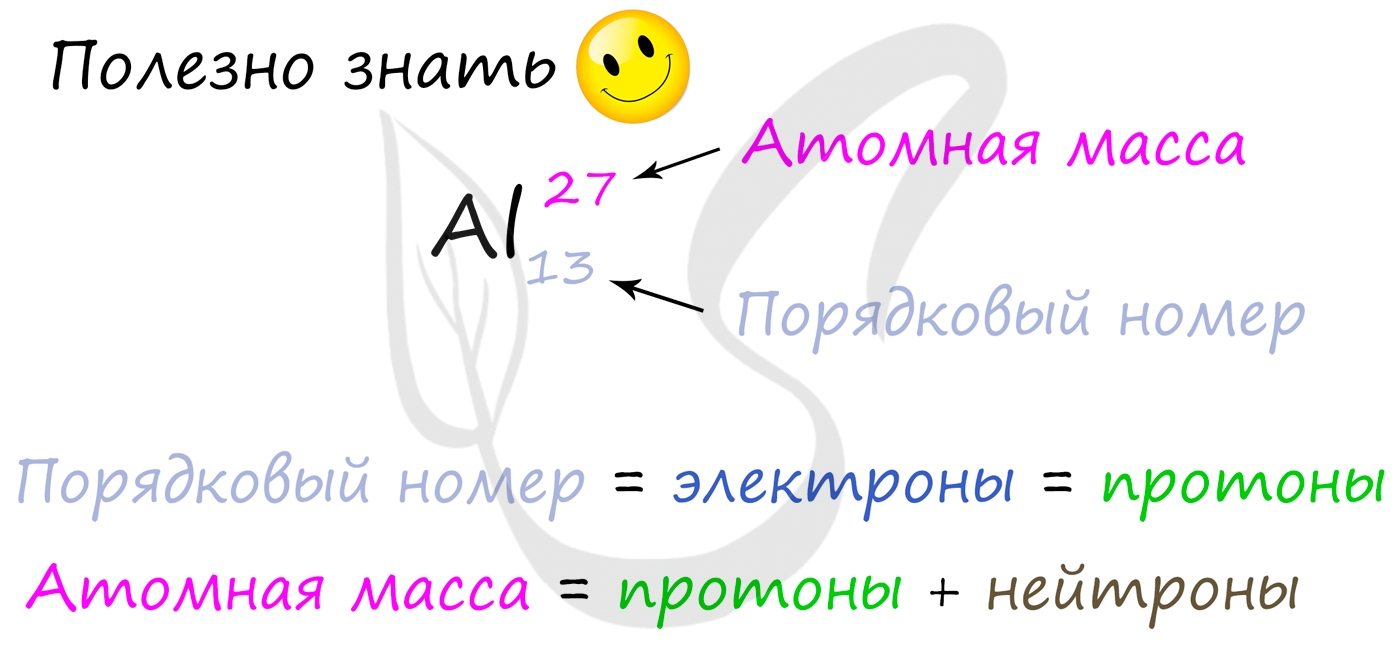
Найти у какого-либо элемента эти частицы несложно. Разберем это на примере алюминия (Al).
Его порядковый номер — 13, соответственно, это есть ядро. Атомная масса алюминия составляет 26,98154 (значение округляется, поэтому 27). Протоны равны массе заряда (р=13), так же и электроны (е=13). Чтобы узнать значение нейтронов, нужно из атомной массы вычесть значение заряда ядра (n=27-13=14).
Взаимосвязь частиц
Каждая частица имеет свое электрическое поле, через которое оно “соприкасается” с остальными. Такие поля можно обозначить определенной материей, в которой, помимо этих частиц, есть и другие, наполняющие эту материю — фотоны.
Фотон — частица, не имеющая массы. Является переносчиком электромагнитного “общения”.
Все они имеют конкретный запас энергии. Именно через фотоны происходит коммуникация частиц. В такой связи происходит “бартер” фотонами, что служит для хорошей энергетической силы, то есть взаимосвязи частиц.
И в самом ядре происходит “общение” протона и нейтрона, но здесь уже нет электрического поля, поскольку нейтрон его не образовывает. Здесь все проходит при помощи особого поля, исходящего от ядра.
Ядерное поле — вид материи, который состоит из протонов, нейтронов и мезонов.
Мезон — частица, которая способствует взаимодействию протонов и нейтронов, а также влияет на то, чтобы эти частицы оставались в ядре.
Благодаря мезонам, протоны и нейтроны способны внутри своего ядра передавать определенную информацию путем ядерной силы. Ее работа в ядре происходит на определенной дистанции (приблизительно сантиметров).
Ядерная сила — сила влияния протона и нейтрона друг на друга.
Ядерные силы, происходящие внутри ядра, способны делать из протонов нейтроны и наоборот при помощи мезонов.
Можно сказать, что ядерные силы намного мощнее электрических, но вместе они не дают протонам выйти за границы ядра. Несмотря на то, что частицы сопротивляются, объединение двойной силы подавляет их, при этом создавая крепкое ядро. Из-за них и зависит его прочность.
Все три частицы называются элементарными, потому что их невозможно разложить на другие упрощенные элементы, но они могут становиться и образовываться друг из друга.
Химическое строение атомов
Работа электрона
Структура водорода (Н) заслуживает внимания. Это единственный элемент, который содержит в себе две частицы — один протон, находящийся в ядре, и один электрон, вращающийся вокруг него. Но даже тут есть нюанс: у электрона нет определенного барьера, отгораживающего его от окружающей среды.
Путь электрона вокруг ядра достаточно пластичен и поддается изменениям (причиной может стать увеличение массы электрона). А поскольку в ядре и на оболочке противоположно заряженные частицы, то они имеют свойство присоединяться. Но есть один момент: когда отрицательно заряженная частица облетает ядро, то образовывается центробежная сила, которая пытается максимально отдалить частицу. Все эти моменты создают спорную ситуацию.
Получается, что электрон водорода (Н) находится неподалеку от протона, сохраняя минимум своей энергии. Но если какая-либо частица вторгнется в данную схему, и водород (Н) отдалится от ядра, то его энергия станет больше, но не надолго. Дело в том, что электрон все равно будет пытаться вернуться на место, приближенное к ядру. Электрон таким действием (переходом на другую орбиту) предоставил определенную часть своей энергии — лучистой энергии.
Если электрону дадут энергию, то он перейдет на другое место (чем больше энергии, тем дальше от протона). При этом, когда он будет возвращаться к ядру, то будет происходить активная выработка электромагнитной энергии с последующем излучением.
Когда ученые наблюдали за такими переходами этой частицы, они сделали вывод, что как и в любом элементе, так и в водороде (Н) электрон может совершать отойти только на конкретный круг, опираясь на полученное извне питание.Слои, на которых электрон способен перемещаться, называют дозволенными.
Работа протона и нейтрона в ядре
Как говорилось ранее, протон и электрон водорода (Н) — разноименные и аналогичные по значениям, поэтому их совместный заряд составляет — ноль. Из этого выходит, что водород (в обычном его состоянии) — нейтральная частица.
Такой вывод относится ко всем элементам из таблицы Менделеева. Все их атомы в нормальном состоянии нейтральны из-за равновесия разных зарядов.
Вернемся к ядру водорода (Н). Известно, что в нем находится только один протон. Обратимся к массе ядра.
Масса ядра — общее число протонов и нейтронов внутри ядра. Ее можно найти у всех элементов периодической таблицы.
Согласно этому, масса ядра водорода тоже будет составлять один (так как есть 1 протон и полностью отсутствуют нейтроны).
Что говорилось выше, относилось к природному водороду (Н), равному единице. Но существует еще и тяжелый водород (Н) — он же изотоп дейтерий (2H, имеет название тяжелого водорода). Масса равна двум. Если в ядре простого водорода (Н) всего лишь один протон, то у дейтерия — дейтоны.
Дейтон — объединение протона и нейтрона в ядре.
Водород и его изотопы
Несмотря на то, что вес водорода и его изотопов различается, их объединяют некоторые общие свойства. Например, если самый простой водород (Н) вступит в связь с кислородом (О), то получится вода (Н2О). То же самое происходит и в цепи дейтерия ( 2H) и кислорода (О). У этого изотопа тоже на выходе получается вода, но тяжелая, которая пользуется спросом в производстве атомной энергии.
Из примера можно сделать вывод, главную роль в химических свойствах играет электронная оболочка и ее устройство, а не массу ядра. Водород и его изотопы несут в себе разную массу, но общее у них — это электроны возле ядра, которые и сохраняют идентичные свойства.
Водород (Н) взял первое место в менделеевской таблице. Такое решение было неслучайным. Как мы знаем, порядковый номер напрямую зависит от числа заряда ядра. То же самое и у водорода (Н) (номер в таблице — один = заряд ядра — один). Если правильно сказать, то: всякое вещество, занимающее место в периодической таблице Менделеева, имеет свой порядковый номер, соотносящийся заряду ядра и числу электронов на его оболочках.
Из всего сказанного получается, что водород (Н), занимающий первое место, имеет заряд ядра — +1 и один электрон на орбите.
Гелий и его изотопы
На втором месте в таблице стоит гелий (Не). Как и говорилось ранее про все элементы, его номер и заряд ядра однозначны, поэтому второй будет равен +2 (внутри ядра два протона), а оболочка будет содержать два электрона.
Как и все составляющие таблицы, гелий (Не) имеет изотопы. Их целых девять, но самыми стабильными из них считаются легкий и тяжелый, поэтому ими пользуются чаще. Рассмотрим первый.
Легкий гелий (³Не, еще имеет название гелион). Масса его ядра составляет 3, состоит из двух протонов, одного нейтрона и трех электронов на оболочке. Считается, что содержание гелиона в природном гелии 1/1 000 000 тяжелого гелия. Выводится искусственным путем.
Тяжелый гелий (⁴Не). Считается самым востребованным из всех изотопов гелия (Не). Ядро содержит два протона и два нейтрона, а на орбитах расположены четыре электрона.Образовывает около 99% гелия на нашей планете. Есть забавный факт про это вещество: если охладить его (-271 ºС) и поместить в открытую емкость, то этот изотоп вытечет из нее.
Затруднение состава атома в элементе обусловлено возрастанием объема элементарных частиц: протонов и нейтронов в ядре и электронов на оболочке. При помощи таблицы Менделеева можно узнать все эти необходимые данные об элементе (а именно про частицы).
Радиоактивные элементы
У тяжелых элементов есть и подразделение радиоактивных. Они отличаются тем, что их ядра настолько непрочны, что они способны самостоятельно расщепляться на отдельные частицы. Радий (Ra) — самый известный радиоактивный химический элемент. Его порядковый номер — 88. Масса атома равна 226 (если быть точнее, то 226,025).
Состав протонов в ядре — 88, а нейтронов — 138. Все они занимаются распадом, где позже они трансформируются в атомы радона (Rn, радиоактивный газ, номер в периодической таблице — 86). Все происходит точно так же: атомы радона (Rn) занимаются распадом, после чего тоже преобразовываясь в другие элементы.
Электронные оболочки
Электронные оболочки — это тоже важная часть, без которой представление какого-то химического элемента просто не было бы. Как было рассмотрено ранее, электроны единственные, кто размещен за ядром, при этом крутится вокруг него, собираясь определенными группами по разным “отсекам”.
Познание с ядрами и их частицами подошло к концу, поэтому теперь стоит уделить внимание тому, что находится за пределами этой главной точки.
Нахождение электронных оболочек и его содержимого
Чтобы определить количество электронных слоев элемента, нужно обратиться к его номеру периода. Например, алюминий (Al) с порядковым номером 13, находится в третьем периоде, поэтому число его слоев равно 3.
Еще одной удивительной характеристикой оболочек является закрепленное число электронов, которые могут находиться на слое. На первой орбите могут расположиться два электрона, на втором — восемь, на третьем — 16 и т.д. (с каждым разом нужно умножать на четыре).
Завершенным считается тот слой, который достиг окончательного предела. Электроны, которые расположены дальше всего от ядра, более активны, поэтому предпочитают вступать в контакт с другими атомами (научно это можно назвать валентностью). Число электронов на внешней оболочке зависит от номера группы. Например, бор (В) имеет заряд — +5, он находится во втором периоде, поэтому количество электронных слоев равно двум. Первый слой равен двум, а второй — трем, поскольку бор (В) находится в 3 группе.
Когда электронный слой полностью заполнен, то он считается стабилизированным. Это говорит о том, что атому не требуется брать дополнительные силы (электроны) из окружающей среды или других веществ. Если взять гелий (Не), у которого два электрона, находящиеся на одной оболочке, а у неона (Ne) электронов десять, располагающиеся на двух электронных слоях(на первом — 2, на втором — 8). Из этого выходит, что и гелий, и неон полностью заполнены, поэтому они не нуждаются в посторонней помощи, так как их оболочки завершенные. Такие элементы являются инертными в химическом плане (не идут на контакт с другими элементами, чтобы “занять” или “обменяться” этими частицами).
Но таких самодостаточных элементов достаточно мало, больше всего тех, где на внешней оболочке будет не хватать электронов, поэтому такие элементы охотнее прибегают к воздействию с другими. Калий (К) имеет 19 электронов, находящихся на четырех слоях (первый — 2, второй — 8, третий — 8, четвертый — 1). Больше всего интересует последняя оболочка. Поскольку там всего лишь один электрон, который очень далеко от ядра, то последнее не в силах удержать электрон, поэтому он с легкостью может перейти к другому элементу.
Если же взять кислород (О), у которого восемь электронов и две электрические оболочки (на первом — 2, на втором — 6). Как видно, второй слой является незавершенным, до предела ему не хватает еще двух частиц. Кислород пытается сохранить недостающее число, а также найти два электрона, чтобы завершить свой последний круг. Это может произойти в реакции с другими элементами, у которых внешний слой тоже является незавершенным и достаточно отдаленным от ядра, чтобы тот, в свою очередь, не пытался что-либо удержать.
Элементы с проблемой недостатка электронов довольно энергичны в реакциях друг с другом, поскольку у них есть потребность в присоединении или отдаче нужного числа электронов.
Распределение электронов по слоям
Размещение электронов на оболочках происходит в установленном для них порядке. Если же получается, что частица изменяет свое местонахождение или число, то электронный слой просто меняется (а именно его физические и химические свойства).
Одинаковое число протонов и электронов в элементе является доказательством того, что общий заряд (электрический) равняется нулю.
Изменение количества двух этих частиц способно привести к тому, что атом преобразуется в электрически заряженный.
Если же у атома возникает проблема с большим объемом электронов, он меняется на отрицательный ион.
Ион — заряженная молекула. Ионы бывают катионами и анионами. Есть во всех веществах.
Катион — положительный ион.
Анион — отрицательный ион.
Хлор (Cl), который вобрал в себя всего лишь один электрон, превращается отрицательным ионом (или же анионом). Такой ион будет считаться однозарядным, так как вместил в себя одну частицу. Писаться он будет уже так: Cl⁻.
Кислороду (О), чтобы стать отрицательным ионом, нужно присоединить два электрона. Он будет считаться двухзарядным. Записываться будет вот так: О⁻.
Когда атом превращается в ион, то для окружающего мира он является системой, которая электрически заряжена, что подразумевает появление определенного электрического поля, объединяющее и сам атом, и все происходящее в его зоне контроля. Это электрическое поле позволяет атому контактировать с другими такими же частицами, имеющими заряженность (ионы, электроны и т.д.).
Как и в остальных случаях, ионы, обладающие разными зарядами, притягиваются химически, что приводит к появлению новых, сложных частиц. Ими считаются молекулы.
Окисление
Степень окисления — заряд элемента, находящегося в соединении, который вычислен путем того, что в соединении ковалентная полярная связь превратилась в ионную.
Частицы в реакциях
Когда происходит химическая реакция, электроны либо объединяются, либо переходят к более отрицательному атому, чтобы стать заряженными.
Если бы вещества состояли только из ионов, то их заряды имели целые числа, которые равнялись бы количеству электронов (отданных или не отданных). Рассмотрим хлорид натрия (NaCl). Хлор (Cl) отнимает у натрия (Na) один электрон, при этом два элемента становятся ионами, но с разными зарядами. Натрий (Na) становится положительным, то есть катионом (записывается Na⁺¹), а хлор (Cl) — отрицательным, то есть анионом (записывается Cl⁻¹). Перейдем к соляной кислоте (HCl).
В этой паре хлор (Cl) считается самым отрицательным в электрическом плане, поэтому все два электрона (от водорода (Н) и от него) больше направлены к хлору (Cl), а если электрон водорода (Н) перейдет к хлору, что заряды будут полными, а не частичными как в первом случае. Правильная запись выглядит вот так: H+1CI-1.
Эти надстрочные значки и являются степенью окисления.
Правила записи степени окисления
Чтобы правильно записать степень окисления, нужно знать несколько правил:
Пример степени окисления: H+2O-2
Пример заряда иона: AL3+ii.
Вычисление степени окисления
Вычисление степени окисления проводится по некоторым пунктам, которых стоит придерживаться:
1.Есть элементы, у которых степень окисления неизменна, к ним относятся:
Бывает такое, что соединение из трех составляющих. Ни в коем случае нельзя делать так, как в соединении двух элементов. Значение первого и последнего элементов известны, а значение третьего нужно считать по специальной формуле.
Пример
Возьмем Н3РО4 (фосфорная кислота).
Здесь будем использовать уравнение.
(+1) × 3 + Х + (-2) × 4 = 0
Мы знаем, что сумма всех элементов должна быть нулем, поэтому приравниваем весь пример ему. Перед водородом (Н) стоит цифра 3, поэтому его степень умножаем на это число, то же самое и с кислородом (О). Фосфор (Р) у нас неизвестен, поэтому обозначаем его иксом. Дальше решаем обычным уравнением и вписываем полученное значение над ним.
Если говорить про степень окисления и валентность, то это абсолютно разные вещи. Первое имеет отрицательное или нулевое значения, а второе только положительное.
Ключевые мометы
Эта тема переплела два ответвления — физику и химию, показывая всю многогранность нашей природы и взаимосвязь этих наук. Как мы поняли, некоторые моменты до сих пор непонятны нам, но ученые не останавливаются на достигнутом, продвигаясь дальше. Данный предмет обсуждения, находящийся в этой работе — базовые понятия, написанные доступным языком.
Этот материал разбирал такие маленькие, но важные для нас моменты — атомы, которых мы не видим, хотя они влияют на все вокруг, даже на нас самих.
Чтобы лучше усвоить материал, здесь собраны ключевые моменты из текста, требующие особого внимания:
Короткое, но познавательное видео про элементарные частицы:
Элементарные частицы: нейтроны, протоны, электроны. Действительно элементарные?
Когда речь заходит о том, из чего состоят различные окружающие нас объекты, мы сразу начинаем говорить о молекулах, затем об атомах. А из чего же состоят сами атомы? Так ли просто они устроены, как шарик, который мы видели на уроках химии и физике в школе? На самом деле, все не так уж и просто. Для простоты в самом начале скажем, что абсолютное большинство всех вещей в мире состоит из элементарных частиц. Почему не все? Дело в том, что далеко не вся Вселенная изучена человеком, поэтому мы не можем однозначно сказать, все ли состоит из частиц.
Например, свет — это волна, состоящая из элементарных частиц — фотонов, но раньше наука не могла такое сказать.
Теперь об этих самых частицах. Элементарные частицы — это такие частицы, которые человек сейчас расщепить на более маленькие не может, поэтому пока считается, что из них все и состоит. Таких частиц бывает огромное множество, но сегодня же мы будем больше говорить о наиболее популярных из них, а именно — нейтроны, протоны, электроны.
Где встречаются нейтроны, протоны, электроны?
Почему мы сказали выше, что эти три элементарные частицы считаются наиболее популярными? Все просто — из них состоит абсолютно любой атом. Если говорить об этом чуть более подробно, то атом состоит из двух частей:
В свою же очередь ядро атома включает в себя протоны и нейтроны. Таким образом, атом состоит из трех элементарных частиц, две из которых составляют ядро, а множество третьих вращается вокруг этого ядра.
Классификация элементарных частиц
Чтобы получше разобраться в том, какие бывают элементарные частицы и как они взаимодействуют друг с другом, нам нужно разделить их на группы по принципу схожести определенных свойств. Это и называется классификация. Сейчас все поймете.
Разделим по времени жизни
Делить какие-то там частицы по времени жизни звучит очень странно, ведь это неодушевленные предметы и о жизни здесь речь идти не должна. Вы будете абсолютно правы, имея такую точку зрения. Однако в данном случае имеется в виду не жизнь, как существование живого организма, а скорей пребывание в одном и том же состоянии. Если говорить проще, то не все из элементарных частиц могут сохранять свои свойства в течение большого отрезка времени, поэтому мы и решили их так разделить. Итак, разделить в данном случае можно на две группы:
Разделим по тому, как они взаимодействуют
Интересно, что при довольно схожем строении, разные частицы могут взаимодействовать друг с другом совсем по-разному. Давайте посмотрим, как можно разделить элементарные частицы по такому принципу:
Действительно, частицы тоже бывают составные и фундаментальные (по сути самые простые), и от этого многое зависит. Давайте подробно разберемся с каждым из этих видов.
Составные частицы, которые по-другому еще называются адронами (вы наверняка слышали про Адронный коллайдер в Швейцарии) взаимодействуют со всеми частицами. Такое взаимодействие еще называют фундаментальным. Они в свою очередь тоже подразделяются на мезоны и барионы.
Теперь давайте поговорим о фундаментальных частицах. Здесь все гораздо более интересно, ведь таких частиц в мире открыто великое множество. Давайте для начала узнаем, на какие виды разделяются фундаментальные или же бесструктурные частицы:
Теперь давайте остановимся на каждом виде отдельно и поговорим о нем более подробно. А начать предлагаем с кварков.
Кварки — это такие частицы, которые находятся в составе адронов. Отдельно их встретить ученым пока не удавалось, только в составе других частиц. Для того, чтобы их изучать, ученым приходится использовать различные хитрые методы. Они подразделяются еще на шесть подтипов, но о них сегодня мы говорить не будем. Интересной особенностью кварков является то, что они, являясь фундаментальными частицами, все же участвуют в сильных взаимодействиях.
Теперь давайте перейдем к лептонам (точечным частицам). Это тоже довольно важный вид бесструктурных частиц. Они в отличие от кварков уже не участвуют в сильных взаимодействиях. Однако именно заряженные лептоны все же могут принимать участие в взаимодействии электромагнитном. Здесь так же, как и в кварках, отмечается целых шесть подтипов.
Ну а теперь последний тип с довольно странным для многих названием — калибровочные бозоны. Это тоже немаловажный тип, ведь именно он служит своего рода посредником в различных взаимодействиях между частицами. Чтобы вам было легче запомнить, приведем несколько примеров таких частиц: фотон, гравитон и глюон.
Ядро протон нейтрон электрон
Отлично, когда мы уже знаем довольно много про то, как устроены остальные элементарные частицы, давайте вернемся обратно к протону, нейтрону и электрону. Теперь самое время поговорить об устройстве ядра атома.
Начнем с того, что в ядре атома собран весь его положительный заряд, который обеспечивается протонами. Несмотря на большой заряд, размеры ядра очень малы по сравнению с электронными орбитами (орбиты, по которым вращается электрон вокруг ядра). В среднем они колеблются от 10 в минус 15 степени до 10 в минус 14 степени. Как мы помним из школьного курса химии количество протонов атома — это номер Z атома и порядковый номер элемента в таблице Менделеева. Примечательно также то, что количество протонов и электронов в атоме всегда одинаково.
Наверняка вам очень интересно, почему ядро атома, которое тоже состоит из элементарных частиц, такое плотное. Дело в том, что связь между протонами и нейтронами не является ни гравитационной, и электромагнитной, но при этом она в несколько раз сильнее, чем связь между ядром и электроном.
Число протонов нейтронов и электронов
3 протона 3 нейтрона 3 электрона
Теперь для того, чтобы получше разобраться в этой теме, давайте попробуем все понять на примере другого атома. Это, как вы могли уже догадаться, атом Лития. У него 3 протона, 3 нейтрона и 3 электрона. По той формуле, которую мы уже узнали выше, тут сразу можно понять, что примерная масса атома Лития будет равна 6 (3 нейтрона + 3 протона). Также мы сходу можем сказать, что номер Лития в таблице Менделеева тоже 3 (количество протонов).
Теперь давайте посмотрим на таблицу Менделеева, представленную выше. Действительно, у Лития именно 3 номер и масса равна 6,941.
Видите, как все легко и просто. Однако особенно внимательный читатель уже давно заметил ошибку. Действительно, округлив массу Лития мы понимаем, что здесь количество нейтронов будет равно 4. Как же так получается, что у нас 3 нейтрона. Это подводит нас к следующей теме, о которой мы сейчас и поговорим.
Протон изотоп нейтрон электрон
Наверное, на одном из школьных уроков вы слышали такой термин, как изотоп. В школе это была та самая тема, после которой я полюбил естественные науки. Сейчас я не могу дать однозначный ответ, почему, просто было очень интересно. Итак, изотопы.
Что такое изотоп
Если говорить просто, то Изотопы представляют собой измененную модель обычного атома какого-то вещества. То есть возьмем любой атом какого-то вещества. У него есть фиксированное количество электронов, протонов и электронов. Однако, как мы уже заметили выше, это количество может быть и другим благодаря существованию изотопов. У изотопов такой же порядковый номер элемента в таблице Менделеева, а значит, как мы уже поняли, у них точно такое же количество протонов. Однако, есть отличия в массе элемента, а значит и в количестве нейтронов. Теперь давайте узнаем, как нам пригодится эта информация и как определить, что перед нами изотоп какого-то элемента.
Как определить, что перед нами изотоп
Наверняка самые догадливые и внимательные из вас уже догадались, что обычная формула с определением количества нейтронов с изотопами не работает от слова совсем, ведь это уже измененная модель обыкновенного элемента. Раз так, то мы можем просто попробовать подставить данные по атому в нашу формулу и понять, работает она или нет. Если нет, то перед нами изотоп. Но естественно, для удобства ученые придумали специальные обозначения для изотопов, чтобы нам, обычным людям, было удобнее с ними работать и изучать их. Как же эти обозначения работаю. А очень просто!
У изотопов после названия еще дописывается количество нуклонов в ядре (то есть количество элементарных частиц внутри ядра, сумма протонов и нейтронов). Давайте разберемся на примере очень популярного изотопа урана-235, радиоактивного урана. Обычный же уран по сути называется уран-238.
Зачем нам это знать?
Как вы уже могли понять, все многообразие элементарных частиц не ограничивается таблицей Менделеева и элементами, которые в ней представлены. У некоторых элементов бывает сразу несколько популярных изотопов, поэтому если вы хотите действительно хорошо разбираться в этой теме, то и запоминание всех популярных изотопов не будет лишним. А эта таблица вам в этом поможет:
Отлично, теперь мы уже неплохо разобрались с массой атома, таблицей Менделеева и разобрали основные типы элементарных частиц. Пришло время поговорить о более серьезных вещах. О чем же?
Радиоактивность
Для многих, кто в школе проходил эту тему лишь вскользь, это понятие выглядит очень страшным и непонятным. Кроме того, у многих на ум приходят различные катастрофы, косвенно связанные с этим понятием. Ну кто из вас сейчас не подумал о Хиросиме или о Чернобыле? Однако мы сейчас будем развеивать все эти мифы и стереотипы и хорошенько разберемся в этой далеко не легкой, но при этом очень интересной теме.
Как это работает?
Для того, чтобы разобраться в чем-либо, нужно сначала понять, с чего все начинается. В данном случае все идет от превращения атомов, а точнее от превращения их ядер. Интересно здесь то, что процесс этот самопроизвольный, то есть для того, чтобы он начался, нужно все-таки воздействовать извне, но как только превращения ядер начались, их уже не остановить! Да, далее произойдет именно то, о чем вы думаете. Ядро, с которого и начнется этот необыкновенно интересный с одной стороны и ужасно опасный с другой процесс называется материнским. Соответственно, если радиоактивный процесс затрагивает какое-то ядро помимо материнского, оно будет считаться дочерним, а 2 ядра, между которыми произошел обмен, называют генетически связанными — все как у людей.
Что такое радиоактивный распад?
Разумеется, радиоактивный распад встречается и в природе, однако происходит он крайне редко и не приносит никакого весомого вреда. А вот искусственный распад — штука очень опасная, если уметь ей управлять. Вся суть в том, что самопроизвольно меняется количество элементарных частиц. Существует несколько типов распадов и зависит этот тип от того, какие частицы будет испускать наш атом. Если это будут 2 протона и 2 нейтрона, то это положительно заряженная частица, называемая альфа-частицей. Соответственно, такой распад будет называться альфа-распадом. А вот с бета-частицами все немного посложнее.
Существует сразу 2 типа таких частиц: электроны и позитроны. Если эта частица электрон, то она обязательно образована нейтроном, распавшимся на протон и электрон. Если же эта бета-частица позитрон, то она всегда образована протоном, который распался на нейтрон и электрон. Распад, при котором из атома вылетает бета-частица — это уже бета-распад. Существует еще и менее популярный тип распада (изомерный переход или гамма-распад), при котором из атома вылетают гамма-кванты. Тут все еще сложнее, ведь такой изомерный переход никогда не бывает один. О чем я говорю? Дело в том, что гамма-распад очень часто сопровождают и другие типы распада. Это происходит в тот момент, когда частица распадается в первый раз. На этом этапе могут произойти другие виды распадов, а уж только потом процесс переходит непосредственно к гамма-распаду.
А в природе где это все можно встретить?
Как мы уже сказали выше, в природе тоже встречается радиоактивность. Если немного подумать, то оказывается, что радиоактивны по сути все вещества, у которых нет стабильных изотопов (кто еще не знает, что это, почитайте о них выше). Так вот, ученые пошли еще дальше и подошли к этому вопросу системно. В итоге они получили, что оказывается по таблице менделеева радиоактивны по своей природе вещества, у которых номер 83 или больше. Однако это если мы говорим о тех веществах, которые однозначно радиоактивны.
А ведь встречаются и немного другие. Например среди элементов с атомной массой поменьше встречаются такие, у изотопов которых очень большой период полураспада. Для примера возьмем теллур-128. У обычного теллура номер в таблице Менделеева 52, а значит он не подходит под первую группу, верно? И это неудивительно, ведь его изотоп теллур-128 так стабилен, что его период полураспада примерно в 2 раза больше, чем( 10 в степени 15 миллиардов лет). Неплохо, верно? Спешим вас успокоить, это элемент с самым большим периодом полураспада, но все-таки это очень много, ведь наша земля в миллиарды раз моложе. А для чего нужны все эти цифры? Это как-то практически применимо? Ну конечно, с помощью этих данных можно определять возраст многих минералов, горных пород и даже возраст планет в космосе! А ведь вы еще не знаете, что же такое период полураспада. Давайте разберемся с этим важнейшим понятием.
А что такое период полураспада?
Говоря о том, где можно встретить радиоактивность в природе, мы затронули такой термин, о котором еще не говорили. Что-ж, это неплохой повод, что это сделать сейчас. Так вот, период полураспада — это такое время, за которое частица распадается.
Но почему же именно ПОЛУраспад? Ну да, здесь все не так просто. Если говорить точнее, то это время, за которое она (частица) распадается с вероятностью 50 процентов. Теперь более понятно, верно?
Как вы уже могли догадаться у одной и той же частицы периоды полураспада могут отличаться в зависимости от изотопов. Однако для изотопа частицы это число постоянно.
Заключение
Как вы уже поняли, об элементарных частицах можно говорить очень много и говорить о них можно бесконечно много. Однако на этом наше небольшое вводное повествование о них предлагаем закончить. Если вам понравилась эта статья и вы хотите, чтобы мы публиковали больше материала на эту тему, то не забудьте проявить немного активности ниже. Напомним также, что на нашем сайте есть множество статей на смежные тематики, поэтому предлагаем вам с ними ознакомиться. До скорых встреч!
Как определить количество электронов, протонов и нейтронов в ядре атома?
Науке давно известно, что атомы любых химических элементов состоят из: положительно заряженных ядер и, соответственно, отрицательно заряженных электронов. А ядро атомов, в свою очередь же, включают положительно заряженные протоны и нулевой заряд нейтронов.
У многих возникает вопрос: как же исходя из таблицы Менделеева определить количество электронов, протонов и нейтронов в ядре атома?
Для этого, разумеется, необходимо взглянуть непосредственно в саму таблицу Менделеева.
Каждый элемент, расположенный в химической системе таблицы Менделеева, обладает своим порядковым номером, который равняется числу протонов (обозначается как «Z») также количеству электронов в атоме данного компонента.
Сейчас мы определяем численность нейтронов в атоме, для чего мы выведем следующую формулу: N=A-Z, в которой мы из атомной массы вычтем порядковый номер элемента их числа протонов. В качестве примера мы можем взять атом хлора, который в таблице Менделеева определяется — Cl. В данном случае Z=17, исходя из чего количество протонов и электронов равняется — 17. A=35,453.
Однако так как количество нейтронов никак не способен являться малым количеством! Равно Как являться? Во подобных вариантах ядерную изобилие округляют вплоть до близкого единого значимости, в таком случае имеется во этом случае вплоть до 35 (в самый-самом процессе, малые значимости ядерных тьмы объединены со присутствием изотопов — видов 1-го также этого ведь хим компонента, различающихся товарищ с товарища числом нейтронов во ядре).
Сейчас можем отыскать количество нейтронов:
N=A-Z=35-17=18 нейтронов. В конце мы получаем результат в 18 нейтронов.
Атомы различных хим компонентов различаются весом, объемами, структурой также качествами.
Как узнать число нейтронов в атоме – «Как определить число нейтронов?» – Яндекс.Знатоки
Как найти количество нейтронов в атоме — Наука и Техника — Каталог статей
Каждое атомное ядро, кроме водорода, содержит как протоны, так и нейтроны. Ядра слишком малы, чтобы их можно было увидеть даже под микроскопом, а нуклоны (это общий термин для протонов и нейтронов) еще меньше. Это позволяет подсчитать количество нейтронов, но ученые все еще знают, сколько в ядрах каждого изотопа каждого элемента. Откуда они знают? Они используют такие методы, как масс-спектрометрия, для измерения общей массы атомов конкретного элемента. Как только они узнают общую массу, остальное легко.
Общая масса атома — это сумма всех его протонов, нейтронов и электронов, но электроны настолько легки, что для всех практических целей они не имеют значения. Это означает, что масса элемента является суммой масс его нуклонов. Число протонов одинаково для каждого атома определенного элемента, а протоны и нейтроны имеют одинаковую массу, поэтому все, что вам нужно сделать, это вычесть количество протонов из атомной массы, измеренное в единицах атомной массы (amu), и вы остались с количеством нейтронов.
Используйте периодическую таблицу
Периодическая таблица перечисляет все элементы, увеличивая число протонов, поэтому место, которое элемент занимает в таблице, автоматически сообщает вам, сколько протонов находится в его ядре. Это атомный номер элемента, и он отображается прямо под символом для элемента. Рядом с ним другое число, которое является атомной массой. Это число всегда больше атомного номера и часто содержит дробь, потому что это среднее от атомных масс всех естественных изотопов этого элемента. Вы можете использовать его для определения среднего количества протонов в ядре этого элемента.
Процедура не может быть проще. Округлите атомную массу до ближайшего целого числа, затем вычтите из нее атомный номер элемента. Разница равна количеству нейтронов.
пример
1. Сколько в среднем нейтронов в ядре урана?
Уран является 92-м элементом в периодической таблице, поэтому его атомный номер 92, и в его ядре 92 протона. Периодическая таблица перечисляет атомную массу как 238.039 amu. Округлите атомную массу до 238, вычтите атомный номер, и у вас останется 146 нейтронов. Уран имеет большое количество нейтронов по отношению к числу протонов, поэтому все его изотопы радиоактивны.
Количество нейтронов в изотопе
Количество нейтронов в ядре конкретного элемента может варьироваться, и каждый вариант элемента с его характерным числом нейтронов известен как изотоп. Все элементы, кроме 20, имеют более одного изотопа, а некоторые имеют много. Олово (Sn) возглавляет список с десятью изотопами, сопровождаемыми ксеноном (Xe) с девятью.
Каждый изотоп элемента состоит из целого числа протонов и нейтронов, поэтому его атомная масса представляет собой простую сумму этих нуклонов. Атомная масса для изотопа никогда не бывает дробной. У ученых есть два способа обозначить изотоп. Взяв в качестве примера изотоп углерода, вы можете записать его как C-14 или 14C. Число — это атомная масса. Вычтите атомный номер элемента из атомной массы изотопа, и в результате получите число нейтронов в ядре этого изотопа.
В случае С-14 атомное число углерода равно 6, поэтому в ядре должно быть 8 нейтронов. Это на два больше, чем у более распространенного сбалансированного изотопа С-12. Дополнительная масса делает С-14 радиоактивным.
Как определить количество электронов 🚩 как найти число избыточных электронов 🚩 Естественные науки
Для описания свойств атома и его структуры используется модель, известная под названием «Модель атома по Бору». В соответствии с ней структура атома напоминает солнечную систему — тяжелый центр (ядро) находится в центре, а более легкие частицы движутся по орбите вокруг него. Нейтроны и протоны образуют положительно заряженное ядро, а отрицательно заряженные электроны движутся вокруг центра, притягиваясь к нему электростатическими силами.
Элементом называют вещество, состоящее из атомов одного типа, он определяется числом протонов в каждом из них. Элементу присваивают свое имя и символ, например, водород (H) или кислород (О). Химические свойства элемента зависят от числа электронов и, соответственно, числа протонов, содержащихся в атомах. Химические характеристики атома не зависят от числа нейтронов, так как нейтроны не имеют электрического заряда. Однако их число влияет на стабильность ядра, изменяя общую массу атома.
Изотопами называют атомы отдельных элементов с различным числом нейтронов. Данные атомы химически идентичным, однако обладают разной массой, также они отличаются своей способностью испускать излучение.
Атомный номер (Z) — это порядковый номер химического элемента в периодической системе Менделеева, он определяется числом протонов в ядре. Каждый атом характеризуется атомным номером и массовым числом (А), которое равно суммарному числу протонов и нейтронов в ядре.
Элемент может иметь атомы с различным числом нейтронов, но количество протонов остается неизменным и равно числу электронов нейтрального атома. Для того, чтобы определить, сколько протонов содержится в ядре изотопа, достаточно посмотреть на его атомный номер. Число протонов равно номеру соответствующего химического элемента в периодической таблице Менделеева.
В качестве примера можно рассмотреть изотопы водорода. В природе наиболее распространены атомы водорода с одним протоном и без нейтронов. В то же время существуют изотопы водорода с одним или двумя нейтронами, они имеют соответствующие названия. Однако у них у всех один протон, что соответствует порядковому номеру водорода в периодической таблице. Изотоп водорода с одним нейтроном и массовым числом 2 называют дейтерием или тяжелым водородом, он стабилен. Тритий, изотоп водорода с массовым числом 3 и двумя нейтронами, радиоактивен. Его иногда называют сверхтяжелым водородом, а ядро трития — тритоном.
Как найти число нейтронов в атоме Как? Так!
Определение количества нейтронов в атоме довольно простая задача, не требующая экспериментов. Все что вам нужно сделать для расчета количества нейтронов в атоме или изотопе — это следовать этим инструкциям.
Метод 1 Определение числа нейтронов в атомах (не изотопах)
Метод 2 Определение числа нейтронов в изотопах
Советы
Поговорим о том, как найти протоны, нейтроны и электроны
Поговорим о том, как найти протоны, нейтроны и электроны. В атоме существует три вида элементарных частиц, причем у каждой есть свой элементарный заряд, масса.
Строение ядра
Для того чтобы понять, как найти протоны, нейтроны и электроны, представим особенности строения ядра. Оно является основной частью атома. Внутри ядра располагаются протоны и нейтроны, именуемые нуклонами. Внутри ядра эти частицы могут переходить друг в друга.
Например, чтобы найти протоны, нейтроны и электроны в атоме водорода, необходимо знать его порядковый номер. Если учесть, что именно этот элемент возглавляет периодическую систему, то в его ядре содержится один протон.
Диаметр атомного ядра составляет десятитысячную долю всего размера атома. В нем сосредоточена основная масса всего атома. По массе ядро превышает в тысячи раз сумму всех электронов, имеющихся в атоме.
Характеристика частиц
Рассмотрим, как найти протоны, нейтроны и электроны в атоме, и узнаем об их особенностях. Протон — это элементарная частица, которая соответствует ядру атома водорода. Его масса превышает электрон в 1836 раз. Для определения единицы электричества, проходящего через проводник с заданным поперечным сечением, используют электрический заряд.
У каждого атома в ядре располагается определенное количество протонов. Оно является постоянной величиной, характеризует химические и физические свойства данного элемента.
Как найти протоны, нейтроны и электроны в атоме углерода? Порядковый номер данного химического элемента 6, следовательно, в ядре содержится шесть протонов. Согласно планетарной модели строения атома, вокруг ядра по орбитам движется шесть электронов. Для определения количество нейтронов из значения относительной атомной массы углерода (12) вычитаем количество протонов (6), получаем шесть нейтронов.
Для атома железа число протонов соответствует 26, то есть этот элемент имеет 26-й порядковый номер в таблице Менделеева.
Нейтрон является электрически нейтральной частицей, нестабильной в свободном состоянии. Нейтрон способен самопроизвольно превращаться в положительно заряженный протон, испуская при этом антинейтрино и электрон. Средний период его полураспада составляет 12 минут. Массовое число — это суммарное значение количества протонов и нейтронов внутри ядра атома. Попробуем выяснить, как найти протоны, нейтроны и электроны в ионе? Если атом во время химического взаимодействия с другим элементом приобретает положительную степень окисления, то число протонов и нейтронов в нем не изменяется, меньше становится только электронов.
Заключение
Существовало несколько теорий, касающихся строения атома, но ни одна из них не была жизнеспособной. До версии, созданной Резерфордом, не было детального пояснения о расположении внутри ядра протонов и нейтронов, а также о вращении по круговым орбитам электронов. После появления теории планетарного строения атома у исследователей появилась возможность не только определять количество элементарных частиц в атоме, но и предсказывать физические и химические свойства конкретного химического элемента.
Строение атома и электронные конфигурации 1.0
На этой странице вы узнаете
Атом можно представить как конструктор «Лего», который можно собрать из более простых “элементарных” частиц. У каждого атома число “деталек” может быть различным. Об этом и о других особенностях строения атома поговорим в статье.
Строение атома
Великие ученые и философы древности упорно бились над вопросом, из чего же состоят вещества, которые их окружают. Впервые идею о том, что все тела живой и неживой природы состоят из мельчайших частиц — атомов — высказал древнегреческий ученый Демокрит целых 2500 лет назад!
Что же из себя представляет атом?
Атом — это мельчайшая химически неделимая частица вещества.
Атомы могут соединяться друг с другом с помощью химических связей в различной последовательности, образуя более сложные частицы — молекулы. Можно провести аналогию:
Молекула — это мельчайшие частицы, которые состоят из атомов. Они являются химически делимыми.
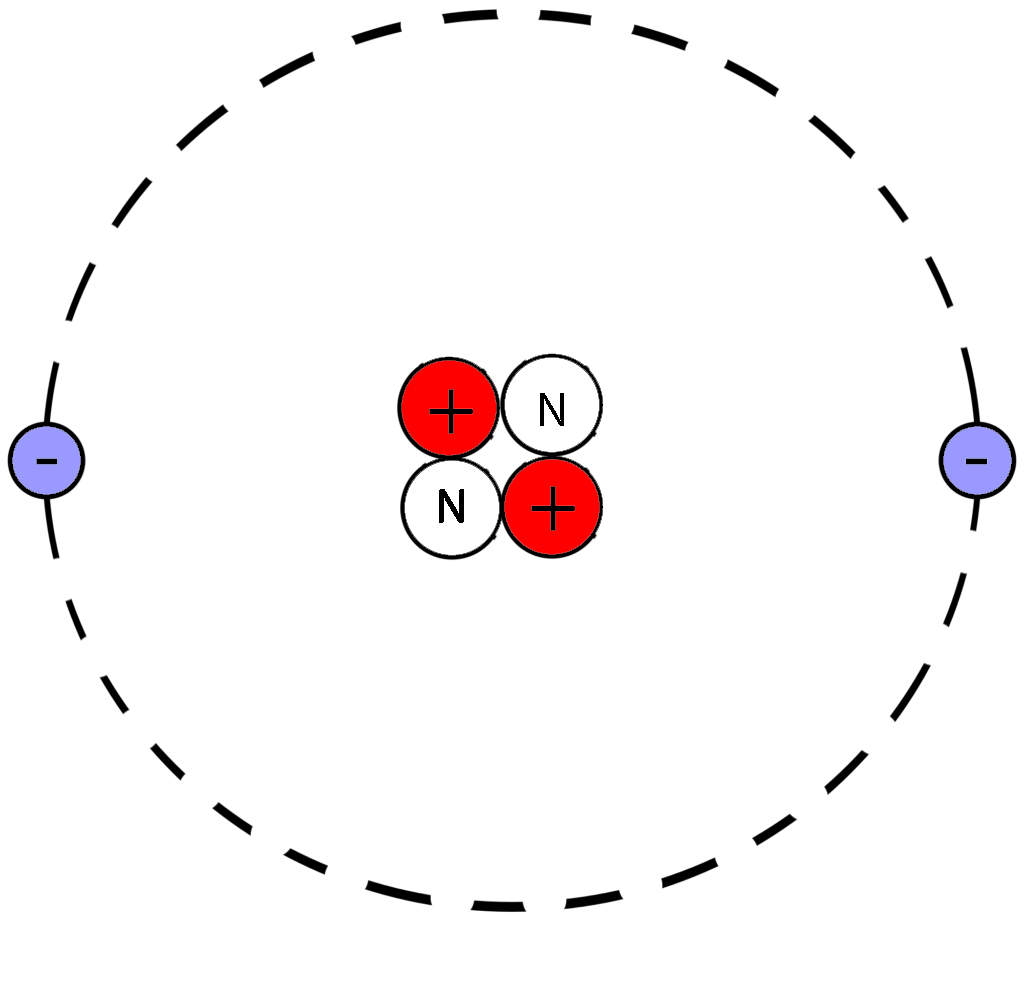
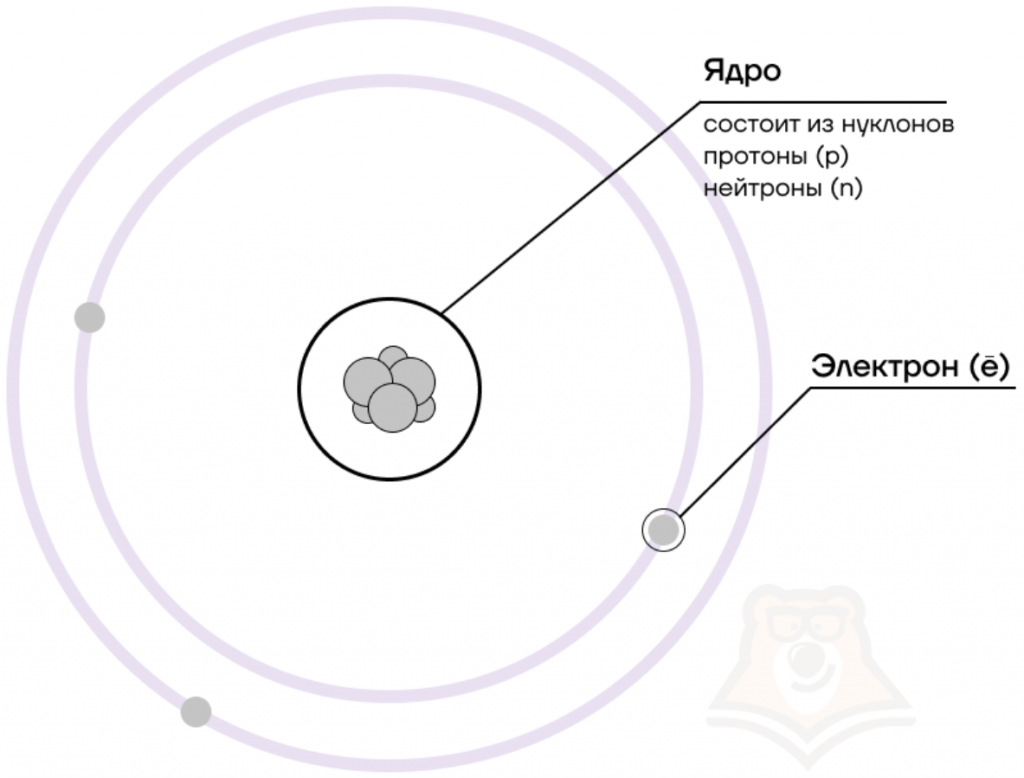
Долгое время считалось, что атом нельзя разделить далее на составляющие. Но с развитием науки учёные-физики выяснили, что атом состоит из более мелких, или элементарных частиц — протонов (p), нейтронов (n) и электронов (ē).
В центре атома располагается ядро, которое состоит из протонов и нейтронов (их общее название нуклоны), а вокруг ядра вращаются электроны.
| Чем атом похож на Солнечную систему? Можно представить атом как Солнечную систему, где вокруг ядра (Солнца) по орбитам вращаются электроны (планеты). Это так называемая планетарная модель атома. В реальности атом намного сложнее, но для запоминания нам удобнее пользоваться этими представлениями. |
Тогда более точно определение атома будет звучать так:
Атом — электронейтральная химически неделимая частица, которая состоит из положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных электронов.
Каждая из элементарных частиц в атоме имеет свой заряд и массу:
Характеристика элементарных частиц
Из таблички видно, что вся масса атома сосредоточена в протонах и нейтронах, то есть в ядре. При этом само ядро положительно заряжено, а вокруг ядра вращаются отрицательно заряженные электроны.
В разновидностях одного и того же химического элемента может быть различное число элементарных частиц. Давай рассмотрим это на примере атома водорода.
Первый случай: ядро атома водорода состоит из одного протона (масса ядра = 1 а.е.м.). Такой атом называется протием, именно он указан в периодической системе Д.И. Менделеева.
Добавим к этому ядру один нейтрон, тогда масса ядра будет равна 2 а.е.м.. Мы получили вторую разновидность атома водорода — дейтерий.
Если добавить второй нейтрон к такому ядру, то мы получим тритий. Так вот, разновидности одного и того же химического элемента, которые различаются числом нейтронов в ядре, называются изотопами.
| Один водород, но три лучше: что такое изотопы? Изотопы — атомы одного химического элемента с разным числом нейтронов: равные заряды ядра, равное число e и p, но разное число n! |
Как определить количество элементарных частиц
Сейчас мы научимся определять количество протонов, нейтронов и электронов в атоме любого химического элемента. В этом нам поможет периодическая система Д.И. Менделеева.
Давай рассмотрим ячейку в периодической системе с углеродом:
В верхней части ячейки располагается порядковый номер элемента (это целое число), под ним располагается относительная атомная масса. Она является нецелым числом, поэтому её легко определять. Относительная атомная масса, округленная до целого числа, называется массовым числом.
Эти характеристики связаны с количеством элементарных частиц в атоме следующим образом:
| Порядковый номер элемента = число протонов в ядре = заряд ядра атома = число электронов в атоме (№ элемента = p = Z = ē) Число нейтронов = массовое число – порядковый номер (n = Ar — № элемента) |
Давай рассмотрим основные определения и положения, связанные с характеристикой элемента и числовыми операциями:
На примере атома углерода определим количество элементарных частиц в его атоме.
Порядковый номер углерода равен 6, значит, заряд его атома + 6, число протонов и число электронов совпадает и тоже равно 6.
Относительная атомная масса равна 12,01, а число нейтронов равно 12 – 6 = 6.
Углерод находится во втором периоде, IV группе. Это показывает нам, что занято лишь 2 электронных слоя, при этом на внешнем электронном уровне располагаются 4 электрона.
“Грустный” и “веселый” атом
При заполнении электронами ячеек мы описываем так называемое основное состояние. Это такое состояние атома, при котором энергия системы минимальна. Его состояние можно определить как “веселое”: в атоме всё спокойно и в порядке.
Но может быть и другая ситуация, когда на электроны оказывается какое-то воздействие. Тогда происходит процесс, похожий на развод пары в человеческом мире. В результате воздействия те электроны, которые находились на орбитали вдвоем и были спаренными, могут друг с другом “поссориться” и “разъехаться” по разным орбиталям.
Тогда атом можно определить как “грустный”: электроны ссорятся, атома грустит. В химии это состояние и называется возбужденным. Такой “развод” возможен только в пределах одного энергетического уровня.
Атомные подуровни заполняются электронами в порядке увеличения их энергии. Этот порядок выглядит следующим образом:
| 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → … |
Проскок электрона
Это явление характерно для элементов IB и VIB групп, например, Cr, Cu, Ag.
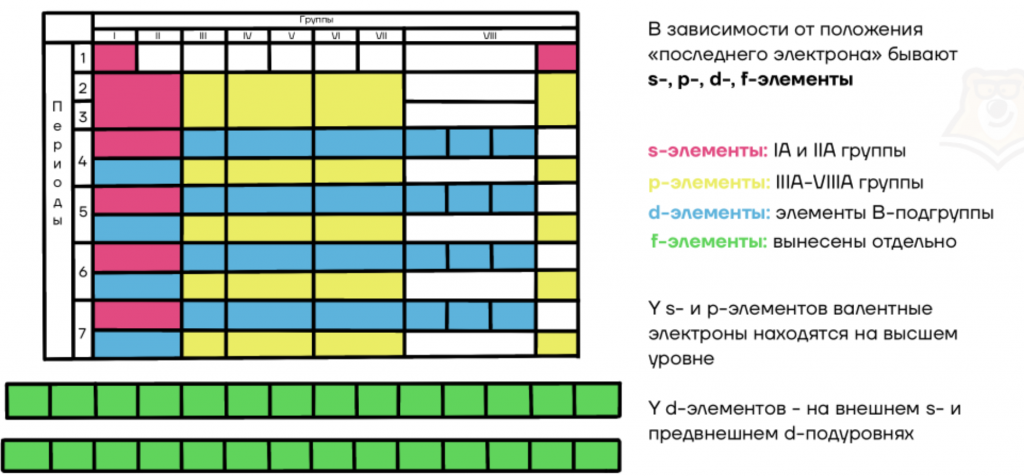
Классификация химических элементов: s-,p-,d-,f-элементы
В зависимости от положения “последнего электрона” бывают s-, p-, d-, f-элементы:
У s- и p-элементов валентные электроны находятся на внешнем уровне.
У d-элементов — на внешнем s- и на предвнешнем d-подуровнях.
Далее приведены электронные формулы атомов элементов первых четырех периодов. Благодаря этой шпаргалке всегда можно сверить свой вариант электронной конфигурации и проверить себя.
Продолжение темы читайте в статье «Строение атома и электронные конфигурации 2.0».
Фактчек
Проверь себя
Задание 1.
Ядро атома состоит из:
Задание 2.
У изотопов различается число:
Задание 3.
Проскок электрона характерен для элемента:
Задание 4.
На третьем электронном слое может находиться максимально:
Ответы: 1. — 1; 2. — 2; 3. — 4; 4. — 2.
Число протонов, нейтронов и определение заряда ядра: список примеров
Содержание:
Атом – частица, которая включает протоны, нейтроны и электроны. Совокупность протонов и нейтронов атома формирует ядро, вокруг которого движутся электроны. Все элементы, содержащиеся в атоме, имеют свои особенности.
Строение атомного ядра
У протонов и нейтронов масса примерно одинакова и равна 1. Они схожи по строению, но различны по заряду. Протоны обладают положительным зарядом, а нейтроны – нулевым. Сумма протонов и нейтронов в одном атоме называется массовым числом.
Порядковый номер атома кремния равен 14. Таким образом, заряд ядра атома кремния равен 14. Ядро составляют 14 протонов и 14 нейтронов. Массовое число кремния равно 28.
Электроны
Электроны, главное число которых равно одному (n=1), размещаются на первом энергетическом уровне. Изменение главного квантового числа связано со скачкообразным изменением энергии. При этом электроны могут переходить на следующий уровень. Максимальное число электронов на энергетическом уровне определяется по формуле:
Например, на первом энергетическом уровне согласно формуле может располагаться только два электрона, а на втором – восемь электронов.
Электроны, находящиеся на внешнем уровне, слабо связаны с атомным ядром, поэтому при химических взаимодействиях эти электроны легко отсоединяются. В электронейтральных атомах число электронов соответствует его порядковому номеру.
Сколько электронов в электронейтральном атоме кремния, можно узнать по порядковому номеру элемента. Таким образом, у кремния 14 электронов.
Число протонов нейтронов электронов в атоме элемента (Таблица)
Число протонов нейтронов и электронов в атоме химического элемента (изотопа) можно определить, зная порядковый номер элемента в периодической таблице Менделеева и его атомную массу:
— Число протонов = число электронов = порядковый номер элемента
— Число нейтронов = атомная масса – число протонов
Вычислим число нейтронов в атоме на примере кислорода 16 O:
Таблица число протонов нейтронов электронов в атоме химического элемента
Справочная таблица содержит список элементов (изотопов) и их число протонов, нейтронов и электронов, а также атомную массу изотопа.
| Элемент, изотоп | Число протонов (= электронов) | Число нейтронов | Атомная масса изотопа |
| 1 H | 1 | 0 | 1,0078 |
| 2 H | 1 | 1 | 2,0141 |
| 3 He | 2 | 1 | 3,0160 |
| 4 He | 2 | 2 | 4,0026 |
| 6 Li | 3 | 3 | 6,0151 |
| 7 Li | 3 | 4 | 7,0160 |
| 9 Be | 4 | 5 | 9,0122 |
| 10 B | 5 | 5 | 10,0129 |
| 11 B | 5 | 6 | 11,0093 |
| 12 C | 6 | 6 | 12,0000 |
| 13 C | 6 | 7 | 13,0034 |
| 14 N | 7 | 7 | 14,0031 |
| 15 N | 7 | 8 | 15,0001 |
| 16 O | 8 | 8 | 15,9949 |
| 17 O | 8 | 9 | 16,9991 |
| 18 O | 8 | 10 | 17,9992 |
| 19 F | 9 | 10 | 18,9984 |
| 20 Ne | 10 | 10 | 19,9924 |
| 21 Ne | 10 | 11 | 20,9938 |
| 22 Ne | 10 | 12 | 21,9914 |
| 23 Na | 11 | 12 | 22,9898 |
| 24 Mg | 12 | 12 | 23,9850 |
| 25 Mg | 12 | 13 | 24,9858 |
| 26 Mg | 12 | 14 | 25,9826 |
| 27 Al | 13 | 14 | 26,9815 |
| 28 Si | 14 | 14 | 27,9769 |
| 29 Si | 14 | 15 | 28,9765 |
| 30 Si | 14 | 16 | 29,9738 |
| 31 P | 15 | 16 | 30,9738 |
| 32 S | 16 | 16 | 31,9721 |
| 33 S | 16 | 17 | 32,9715 |
| 34 S | 16 | 18 | 33,9679 |
| 36 S | 16 | 20 | 35,9671 |
| 35 Cl | 17 | 18 | 34,9689 |
| 37 Cl | 17 | 20 | 36,9659 |
| 36 Ar | 18 | 18 | 35,9675 |
| 38 Ar | 18 | 20 | 37,9627 |
| 40 Ar | 18 | 22 | 39,9624 |
| 39 K | 19 | 20 | 38,9637 |
| 40 K* | 19 | 21 | 39,9640 |
| 41 K | 19 | 22 | 40,9618 |
| 40 Ca | 20 | 20 | 39,9626 |
| 42 Ca | 20 | 22 | 41,9586 |
| 43 Ca | 20 | 23 | 42,9588 |
| 44 Ca | 20 | 24 | 43,9555 |
| 46 Ca | 20 | 26 | 45,9537 |
| 48 Ca* | 20 | 28 | 47,9525 |
| 45 Sc | 21 | 24 | 44,9559 |
| 46 Ti | 22 | 24 | 45,9526 |
| 47 Ti | 22 | 25 | 46,9518 |
| 48 Ti | 22 | 26 | 47,9479 |
| 49 Ti | 22 | 27 | 48,9479 |
| 50 Ti | 22 | 28 | 49,9448 |
| 50 V* | 23 | 27 | 49,9472 |
| 51 V | 23 | 28 | 50,9440 |
| 50 Cr | 24 | 26 | 49,9460 |
| 52 Cr | 24 | 28 | 51,9405 |
| 53 Cr | 24 | 29 | 52,9406 |
| 54 Cr | 24 | 30 | 53,9389 |
| 55 Mn | 25 | 30 | 54,9380 |
| 54 Fe | 26 | 28 | 53,9396 |
| 56 Fe | 26 | 30 | 55,9349 |
| 57 Fe | 26 | 31 | 56,9354 |
| 58 Fe | 26 | 32 | 57,9333 |
| 59 Co | 27 | 32 | 58,9332 |
| 58 Ni | 28 | 30 | 57,9353 |
| 60 Ni | 28 | 32 | 59,9308 |
| 61 Ni | 28 | 33 | 60,9311 |
| 62 Ni | 28 | 34 | 61,9283 |
| 64 Ni | 28 | 36 | 63,9280 |
| 63 Cu | 29 | 34 | 62,9296 |
| 65 Cu | 29 | 36 | 64,9278 |
| 64 Zn | 30 | 34 | 63,9291 |
| 66 Zn | 30 | 36 | 65,9260 |
| 67 Zn | 30 | 37 | 66,9271 |
| 68 Zn | 30 | 38 | 67,9248 |
| 70 Zn | 30 | 40 | 69,9253 |
| 69 Ga | 31 | 38 | 68,9256 |
| 71 Ga | 31 | 40 | 70,9247 |
| 70 Ge | 32 | 38 | 69,9242 |
| 72 Ge | 32 | 40 | 71,9221 |
| 73 Ge | 32 | 41 | 72,9235 |
| 74 Ge | 32 | 42 | 73,9212 |
| 75 As | 33 | 42 | 74,9216 |
| 74 Se | 34 | 40 | 73,9225 |
| 76 Se | 34 | 42 | 75,9192 |
| 77 Se | 34 | 43 | 76,9199 |
| 78 Se | 34 | 44 | 77,9173 |
| 80 Se | 34 | 46 | 79,9165 |
| 82 Se * | 34 | 48 | 81,9167 |
| 79 Br | 35 | 44 | 78,9183 |
| 81 Br | 35 | 46 | 80,9163 |
| 78 Kr * | 36 | 42 | 77,9204 |
| 80 Kr | 36 | 44 | 79,9164 |
| 82 Kr | 36 | 46 | 81,9135 |
| 83 Kr | 36 | 47 | 82,9141 |
| 84 Kr | 36 | 48 | 83,9115 |
| 86 Kr | 36 | 50 | 85,9106 |
| 85 Rb | 37 | 48 | 84,9118 |
| 87 Rb* | 37 | 50 | 86,9092 |
| 84 Sr | 38 | 46 | 83,9134 |
| 86 Sr | 38 | 48 | 85,9093 |
| 87 Sr | 38 | 49 | 86,9089 |
| 88 Sr | 38 | 50 | 87,9056 |
| 89 Y | 39 | 50 | 88,9058 |
| 90 Zr | 40 | 50 | 89,9047 |
| 91 Zr | 40 | 51 | 90,9056 |
| 92 Zr | 40 | 52 | 91,9050 |
| 94 Zr | 40 | 54 | 93,9063 |
| 93 Nb | 41 | 52 | 92,9064 |
| 92 Mo | 42 | 50 | 91,9068 |
| 94 Mo | 42 | 52 | 93,9051 |
| 95 Mo | 42 | 53 | 94,9058 |
| 96 Mo | 42 | 54 | 95,9047 |
| 97 Mo | 42 | 55 | 96,9060 |
| 98 Mo | 42 | 56 | 97,9054 |
| 100 Mo* | 42 | 58 | 99,9075 |
| 96 Ru | 44 | 52 | 95,9076 |
| 98 Ru | 44 | 54 | 97,9053 |
| 99 Ru | 44 | 55 | 98,9059 |
| 100 Ru | 44 | 56 | 99,9042 |
| 101 Ru | 44 | 57 | 100,9056 |
| 102 Ru | 44 | 58 | 101,9043 |
| 104 Ru | 44 | 60 | 103,9054 |
| 103 Rh | 45 | 58 | 102,9055 |
| 102 Pd | 46 | 56 | 101,9056 |
| 104 Pd | 46 | 58 | 103,9040 |
| 105 Pd | 46 | 59 | 104,9051 |
| 106 Pd | 46 | 60 | 105,9035 |
| 108 Pd | 46 | 62 | 107,9039 |
| 110 Pd | 46 | 64 | 109,9052 |
| 107 Ag | 47 | 60 | 106,9051 |
| 109 Ag | 47 | 62 | 108,9048 |
| 106 Cd | 48 | 58 | 105,9065 |
| 108 Cd | 48 | 60 | 107,9042 |
| 110 Cd | 48 | 62 | 109,9030 |
| 111 Cd | 48 | 63 | 110,9042 |
| 112 Cd | 48 | 64 | 111,9028 |
| 113 Cd* | 48 | 65 | 112,9044 |
| 114 Cd | 48 | 66 | 113,9034 |
| 116 Cd* | 48 | 68 | 115,9048 |
| 113 In | 49 | 64 | 112,9041 |
| 115 In* | 49 | 66 | 114,9039 |
| 112 Sn | 50 | 62 | 111,9048 |
| 114 Sn | 50 | 64 | 113,9028 |
| 115 Sn | 50 | 65 | 114,9033 |
| 116 Sn | 50 | 66 | 115,9017 |
| 117 Sn | 50 | 67 | 116,9030 |
| 118 Sn | 50 | 68 | 117,9016 |
| 119 Sn | 50 | 69 | 118,9033 |
| 120 Sn | 50 | 70 | 119,9022 |
| 122 Sn | 50 | 72 | 121,9034 |
| 124 Sn | 50 | 74 | 123,9053 |
| 121 Sb | 51 | 70 | 120,9038 |
| 123 Sb | 51 | 72 | 122,9042 |
| 120 Te | 52 | 68 | 119,9040 |
| 122 Te | 52 | 70 | 121,9030 |
| 123 Te | 52 | 71 | 122,9043 |
| 124 Te | 52 | 72 | 123,9028 |
| 125 Te | 52 | 73 | 124,9044 |
| 126 Te | 52 | 74 | 125,9033 |
| 128 Te* | 52 | 76 | 127,9045 |
| 130 Te* | 52 | 78 | 129,9062 |
| 127 I | 53 | 74 | 126,9045 |
| 124 Xe* | 54 | 70 | 123,9059 |
| 126 Xe | 54 | 72 | 125,9043 |
| 128 Xe | 54 | 74 | 127,9035 |
| 129 Xe | 54 | 75 | 128,9048 |
| 130 Xe | 54 | 76 | 129,9035 |
| 131 Xe | 54 | 77 | 130,9051 |
| 132 Xe | 54 | 78 | 131,9042 |
| 134 Xe | 54 | 80 | 133,9054 |
| 136 Xe* | 54 | 82 | 135,9072 |
| 133 Cs | 55 | 78 | 132,9055 |
| 130 Ba* | 56 | 74 | 129,9063 |
| 132 Ba | 56 | 76 | 131,9051 |
| 134 Ba | 56 | 78 | 133,9045 |
| 135 Ba | 56 | 79 | 134,9057 |
| 136 Ba | 56 | 80 | 135,9046 |
| 137 Ba | 56 | 81 | 136,9058 |
| 138 Ba | 56 | 82 | 137,9052 |
| 138 La* | 57 | 81 | 137,9071 |
| 139 La | 57 | 82 | 138,9064 |
| 136 Ce | 58 | 78 | 135,9072 |
| 138 Ce | 58 | 80 | 137,9060 |
| 140 Ce | 58 | 82 | 139,9054 |
| 142 Ce | 58 | 84 | 141,9092 |
| 141 Pr | 59 | 82 | 140,9077 |
| 142 Nd | 60 | 82 | 141,9077 |
| 143 Nd | 60 | 83 | 142,9098 |
| 144 Nd* | 60 | 84 | 143,9101 |
| 145 Nd | 60 | 85 | 144,9126 |
| 146 Nd | 60 | 86 | 145,9131 |
| 148 Nd | 60 | 88 | 147,9169 |
| 150 Nd* | 60 | 90 | 149,9209 |
| 144 Sm | 62 | 82 | 143,9120 |
| 147 Sm* | 62 | 85 | 146,9149 |
| 148 Sm* | 62 | 86 | 147,9148 |
| 149 Sm | 62 | 87 | 148,9172 |
| 150 Sm | 62 | 88 | 149,9173 |
| 152 Sm | 62 | 90 | 151,9197 |
| 154 Sm | 62 | 92 | 153,9222 |
| 151 Eu* | 63 | 88 | 150,9199 |
| 153 Eu | 63 | 90 | 152,9212 |
| 152 Gd* | 64 | 88 | 151,9198 |
| 154 Gd | 64 | 90 | 153,9209 |
| 155 Gd | 64 | 91 | 154,9226 |
| 156 Gd | 64 | 92 | 155,9221 |
| 157 Gd | 64 | 93 | 156,9240 |
| 158 Gd | 64 | 94 | 157,9241 |
| 160 Gd | 64 | 96 | 159,9271 |
| 159 Tb | 65 | 94 | 158,9253 |
| 156 Dy | 66 | 90 | 155,9243 |
| 158 Dy | 66 | 92 | 157,9244 |
| 160 Dy | 66 | 94 | 159,9252 |
| 161 Dy | 66 | 95 | 160,9269 |
| 162 Dy | 66 | 96 | 161,9268 |
| 163 Dy | 66 | 97 | 162,9287 |
| 164 Dy | 66 | 98 | 163,9292 |
| 165 Ho | 67 | 98 | 164,9303 |
| 162 Er | 68 | 94 | 161,9288 |
| 164 Er | 68 | 96 | 163,9292 |
| 166 Er | 68 | 98 | 165,9303 |
| 167 Er | 68 | 99 | 166,9320 |
| 168 Er | 68 | 100 | 167,9324 |
| 170 Er | 68 | 102 | 169,9355 |
| 169 Tm | 69 | 100 | 168,9342 |
| 168 Yb | 70 | 98 | 167,9339 |
| 170 Yb | 70 | 100 | 169,9348 |
| 171 Yb | 70 | 101 | 170,9363 |
| 172 Yb | 70 | 102 | 171,9364 |
| 173 Yb | 70 | 103 | 172,9382 |
| 174 Yb | 70 | 104 | 173,9389 |
| 176 Yb | 70 | 106 | 175,9426 |
| 175 Lu | 71 | 104 | 174,9408 |
| 176 Lu* | 71 | 105 | 175,9427 |
| 174 Hf* | 72 | 102 | 173,9400 |
| 176 Hf | 72 | 104 | 175,9414 |
| 177 Hf | 72 | 105 | 176,9432 |
| 178 Hf | 72 | 106 | 177,9437 |
| 179 Hf | 72 | 107 | 178,9458 |
| 180 Hf | 72 | 108 | 179,9466 |
| 181 Ta | 73 | 108 | 180,9480 |
| 180 W* | 74 | 106 | 179,9467 |
| 182 W | 74 | 108 | 181,9482 |
| 183 W | 74 | 109 | 182,9502 |
| 184 W | 74 | 110 | 183,9509 |
| 186 W | 74 | 112 | 185,9544 |
| 185 Re | 75 | 110 | 184,9530 |
| 187 Re* | 75 | 112 | 186,9558 |
| 184 Os | 76 | 108 | 183,9525 |
| 186 Os* | 76 | 110 | 185,9538 |
| 187 Os | 76 | 111 | 186,9558 |
| 188 Os | 76 | 112 | 187,9558 |
| 189 Os | 76 | 113 | 188,9581 |
| 190 Os | 76 | 114 | 188,9581 |
| 192 Os | 76 | 116 | 191,9615 |
| 191 Ir | 77 | 114 | 190,9606 |
| 193 Ir | 77 | 116 | 191,9626 |
| 190 Pt* | 78 | 112 | 189,9599 |
| 192 Pt | 78 | 114 | 191,9610 |
| 194 Pt | 78 | 116 | 193,9627 |
| 195 Pt | 78 | 117 | 194,9648 |
| 196 Pt | 78 | 118 | 195,9650 |
| 198 Pt | 78 | 120 | 197,9679 |
| 197 Au | 79 | 118 | 196,9666 |
| 196 Hg | 80 | 116 | 195,9658 |
| 198 Hg | 80 | 118 | 197,9668 |
| 199 Hg | 80 | 119 | 198,9683 |
| 200 Hg | 80 | 120 | 199,9683 |
| 201 Hg | 80 | 121 | 200,9703 |
| 202 Hg | 80 | 122 | 201,9706 |
| 204 Hg | 80 | 124 | 203,9735 |
| 203 Tl | 81 | 122 | 202,9723 |
| 205 Tl | 81 | 124 | 204,9744 |
| 204 Pb | 82 | 122 | 203,9730 |
| 206 Pb | 82 | 124 | 205,9745 |
| 207 Pb | 82 | 125 | 206,9759 |
| 208 Pb | 82 | 126 | 207,9767 |
| 209 Bi* | 83 | 126 | 208,9804 |
| 232 Th* | 90 | 142 | 232,0381 |
| 235 U* | 92 | 143 | 235,0439 |
* это нестабильные изотопы и с большим периодом полураспада, который равняется возрасту Вселенной.
Как определить количество протонов и нейтронов
Вам понадобится
Инструкция
2. Увлекательно, что число протонов в ядре совпадает с числом электронов, движущихся вокруг ядра. То есть число электронов в атоме элемента определяется так же, как и число протонов – порядковым номером элемента. Пример 2. Если порядковый номер полония – 84, то в нем 84 протона (в ядре) и столько же – 84 электронов.
Совет 2: Как определить число нейтронов
Атом химического элемента состоит из ядерного ядра и электронов. В состав ядерного ядра входят два типа частиц – протоны и нейтроны. Примерно каждая масса атома сфокусирована в ядре, потому что протоны и нейтроны гораздо тяжелее электронов.
Вам понадобится
Инструкция
3. У различных изотопов одного химического элемента число A меняется, что отражено в записи этого изотопа. Определенные изотопы имеют свои подлинные наименования. Скажем, обыкновенное ядро водорода не имеет нейтронов и имеет один протон. Изотоп водорода дейтерий имеет один нейтрон (A = 2), а изотоп тритий – два нейтрона (A = 3).
4. Связанность числа нейтронов от числа протонов отражена на N-Z диаграмме ядерных ядер. Стабильность ядер зависит от отношения числа нейтронов и числа протонов. Ядра легких нуклидов особенно устойчивы при N/Z = 1, то есть при равенстве числа нейтронов и протонов. С ростом массового числа область стабильности сдвигается к величинам N/Z>1, достигая величины N/Z
1,5 для особенно тяжелых ядер.
Видео по теме
Совет 3: Как обнаружить число нейтронов
Атом химического элемента состоит из ядерного ядра и электронной оболочки. В состав ядерного ядра входят два типа частиц – протоны и нейтроны. Примерно каждая масса атома сконцентрирована в ядре, так как протоны и нейтроны гораздо тяжелее электронов.
Вам понадобится
Инструкция
2. Ядра атомов обозначают буквенным символом химического элемента из таблицы Менделеева. Справа от символа вверху и внизу стоят два числа. Верхнее число A – это массовое число атома. A = Z+N, где Z – заряд ядра (число протонов), а N – число нейтронов. Нижнее число – это Z – заряд ядра. Такая запись дает информацию о числе нейтронов в ядре. Видимо, что оно равно N = A-Z.
3. У различных изотопов одного химического элемента число A меняется, что дозволено увидеть в записи этого изотопа. Определенные изотопы имеют свои подлинные наименования. Скажем, обыкновенное ядро водорода не имеет нейтронов и имеет один протон. Изотоп водорода дейтерий имеет один нейтрон (A = 2, цифра 2 сверху, 1 снизу), а изотоп тритий – два нейтрона (A = 3, цифра 3 сверху, 1 снизу).
4. Связанность числа нейтронов от числа протонов отражена на так называемой N-Z диаграмме ядерных ядер. Стабильность ядер зависит от отношения числа нейтронов и числа протонов. Ядра легких нуклидов особенно устойчивы при N/Z = 1, то есть при равенстве числа нейтронов и протонов. С ростом массового числа область стабильности сдвигается к величинам N/Z>1, достигая величины N/Z
1,5 для особенно тяжелых ядер.
Видео по теме
Совет 4: Как обнаружить число протонов
Дабы обнаружить число протонов в атоме, определите его место в таблице Менделеева. Обнаружьте его порядковый номер в периодической таблице. Он будет равен числу протонов в ядерном ядре. Если изучается изотоп, посмотрите на пару чисел, описывающие его свойства, нижнее число будет равно числу протонов. В том случае, если знаменит заряд ядерного ядра, дозволено узнать число протонов, поделив его значение на заряд одного протона.
Вам понадобится
Инструкция
1. Определение числа протонов вестимого атома.В том случае, когда знаменито, какой атом изучается, обнаружьте его расположение в периодической таблице. Определите его номер в этой таблице, обнаружив ячейку соответствующего элемента. В данной ячейке обнаружьте порядковый номер элемента, тот, что соответствует постигаемому атому. Данный порядковый номер и будет соответствовать числу протонов в ядерном ядре.
2. Как обнаружить протоны в изотопе.Многие атомы имеют изотопы, отличающиеся массами ядер. Именно следственно только лишь массы ядра неудовлетворительно для однозначного определения ядерного ядра. При изложении изотопа перед записью его химического обозначения неизменно записывается пара чисел. Верхнее число показывает массу атома в ядерных единицах массы, а нижнее обозначает заряд ядра. Вся единица заряда ядра в такой записи соответствует одному протону. Таким образом, число протонов равно нижнему числу в записи данного изотопа.
3. Как обнаружить протоны, зная заряд ядра.Зачастую свойства атома характеризуется зарядом его ядра. Для того дабы определить число протонов в нем, нужно перевести его в кулоны (если он подан в кратных единицах). После этого поделите заряд ядра на модуль заряда электрона. Это связано с тем, что от того что атом электрически нейтрален, то число протонов в нем равно числу электронов. Причем заряды их равны по модулю и противоположны по знаку (протон имеет правильный заряд, электрон – негативный). Следственно заряд ядра атома поделите на число 1,6022•10^(-19) кулон. В итоге получится число протонов. От того что способы измерения заряда атома неудовлетворительно точны, в том случае, если при делении получилось дробное число, округлите его до целого.
Видео по теме
Совет 5: Как вычислить число протонов в ядре изотопа
Атомы состоят из субатомных частиц — протонов, нейтронов и электронов. Протоны представляют собой позитивно заряженные частицы, которые находятся в центре атома, в его ядре. Вычислить число протонов изотопа дозволено по ядерному номеру соответствующего химического элемента.
Модель атома
Для изложения свойств атома и его конструкции применяется модель, знаменитая под наименованием «Модель атома по Бору». В соответствии с ней конструкция атома напоминает ясную систему — весомый центр (ядро) находится в центре, а больше легкие частицы движутся по орбите вокруг него. Нейтроны и протоны образуют позитивно заряженное ядро, а негативно заряженные электроны движутся вокруг центра, притягиваясь к нему электростатическими силами.Элементом называют вещество, состоящее из атомов одного типа, он определяется числом протонов в всем из них. Элементу присваивают свое имя и символ, скажем, водород (H) либо кислород (О). Химические свойства элемента зависят от числа электронов и, соответственно, числа протонов, содержащихся в атомах. Химические колляции атома не зависят от числа нейтронов, потому что нейтроны не имеют электрического заряда. Впрочем их число влияет на устойчивость ядра, изменяя всеобщую массу атома.
Изотопы и число протонов
Примеры
В качестве примера дозволено разглядеть изотопы водорода. В природе особенно распространены атомы водорода с одним протоном и без нейтронов. В то же время существуют изотопы водорода с одним либо двумя нейтронами, они имеют соответствующие наименования. Впрочем у них у всех один протон, что соответствует порядковому номеру водорода в периодической таблице. Изотоп водорода с одним нейтроном и массовым числом 2 называют дейтерием либо тяжелым водородом, он стабилен. Тритий, изотоп водорода с массовым числом 3 и двумя нейтронами, радиоактивен. Его изредка называют сверхтяжелым водородом, а ядро трития — тритоном.
Совет 6: Полоний как химический элемент
Полоний — радиоактивный химический элемент VI группы периодической системы Менделеева, он относится к халькогенам. Полоний представляет собой мягкий серебристо-белый металл. Стабильных изотопов у данного элемента нет, но вестимо 27 радиоактивных.
Инструкция
1. Полоний был одним из первых открытых радиоактивных элементов, его нашли Пьер Кюри и Мария Склодовская-Кюри в 1898 году. Свое наименование он получил в честь Польши — родины Марии Склодовской-Кюри. Впервой полоний был выделен из урановой смоляной руды.
2. Полоний — редкий элемент, знамениты две его кристаллические модификации: низкотемпературная форма с кубическая решеткой, при температуре выше 36°С устойчива форма с ромбоэдрической решеткой.
3. Полоний присутствует в маленьких числах в морской воде, его могут накапливать разные морские организмы. Данный элемент попадает в тело человека совместно с пищей, позже чего равномерно распределяется по отдельным органам.
4. В высоких концентрациях полоний исключительно токсичен, для работы с ним применяют особые боксы. Токсичность полония была исследована в навыках на звериных, он вызывал метаморфозы состава периферической крови и уменьшал длительность жизни. У звериных прогрессировали опухоли разных органов. Биологическое влияние полония в мелких концентрациях неудовлетворительно изучено.
6. Нагревая металлы с парами полония при температуре 400-1000°С, получают полониды. Диоксид полония может существовать в 2-х кристаллических модификациях: при температуре ниже 54°С стабильна желтая форма с гранецентрированной кубической решеткой, при нагревании диоксид переходит в красную форму с тетрагональной решеткой. Монооксид полония представляет собой твердое вещество черного цвета, он образуется при беспричинном разложении селенита либо сульфита полония.
7. В граммовых числах полоний получают при помощи облучения металлического висмута нейтронами, процесс проходит в ядерных реакторах. В микроскопичных числах он может быть выделен из отходов переработки урановых руд. Его получают экстракцией, электроосаждением, возгонкой и ионным обменом. Полоний также образуется при облучении висмута протонами в циклотроне.
8. Полоний применяют в качестве источника энергии в ядерных батареях космических агрегатов, а также в переносных устройствах. Его используют для изготовления ампульных источников нейтронов.