Как расшифровать пцр
Как расшифровать пцр
Роспотребнадзор (стенд)
Роспотребнадзор (стенд)
ПЦР – диагностика. Просто о сложном
ПЦР – диагностика. Просто о сложном
С чего она начиналась. Конечно, с предшествующих открытий ДНК, принципа комплементарности, составляющих её аминокослот и использования фермента полимеразы для увеличения количества фрагментов лизированной ДНК.
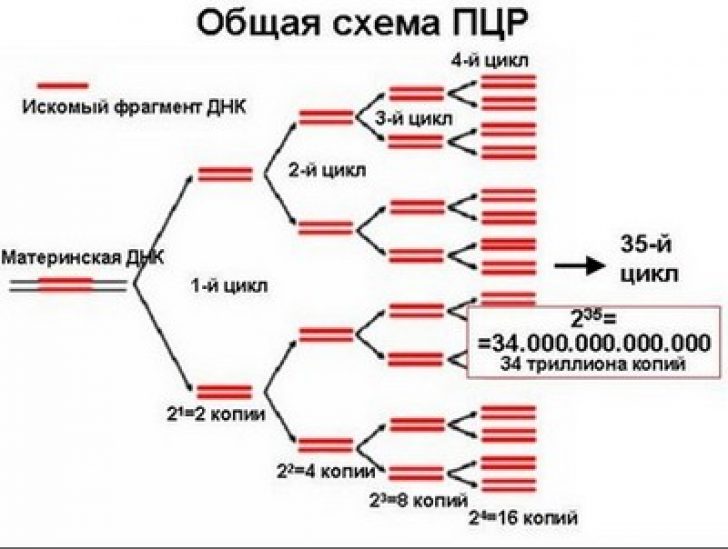
Что такое – ПЦР – диагностика? ПЦР – это полимеразная цепная реакция. Из названия становится ясно, что основной компонент реакции – фермент полимераза, причем необходима термоустойчивая разновидность. Цепная реакция – это потому, что протекает она по типу ядерной реакции. В короткое время обеспечивается увеличение количества определяемой нуклеиновой кислоты в 2-4-8-16 и т. д. раз в геометрической прогрессии…
Полимеразную цепную реакцию (ПЦР, PCR)изобрёл в 1983 году американский учёный Кэри Мюллис, работавший в области молекулярной биологии над созданием прибора под названием амплификатор.
Интересны обстоятельства, при которых у него появилась эта идея. Вот как это было… Открытию предшествовали размышления исследователя о проблеме разрушения обычной полимеразы в процессе воздействия высоких температур (до 95 град. С). В тёплую лунную майскую ночь биолог возвращался со своей дамой с дружеской вечеринки, девушка спала на заднем сидении кабриолета… Кэрри Мюллис вёл машину по пустынной дороге, освещенной лунным светом. И вот при таких романтических обстоятельствах у него появилась идея использовать полимеразу термоустойчивых бактерий, обитающих в термальных источниках!
В 1993 г. за воплощение в лабораторную практику молекулярной биологии этого изобретения он получил Нобелевскую премию.
В настоящее время ПЦР-диагностика является одним из самых точных и чувствительных методов диагностики инфекционных заболеваний, наследственных патологий, определения генетически модифицированных продуктов, идентичности биологического материала, в том числе в судебной практике.
ПЦР – диагностика стала необходимым элементом при постановке диагноза вирусных гепатитов В и С, назначении лечения интерферонами и его корректировке по дозам и срокам специфического лечения.
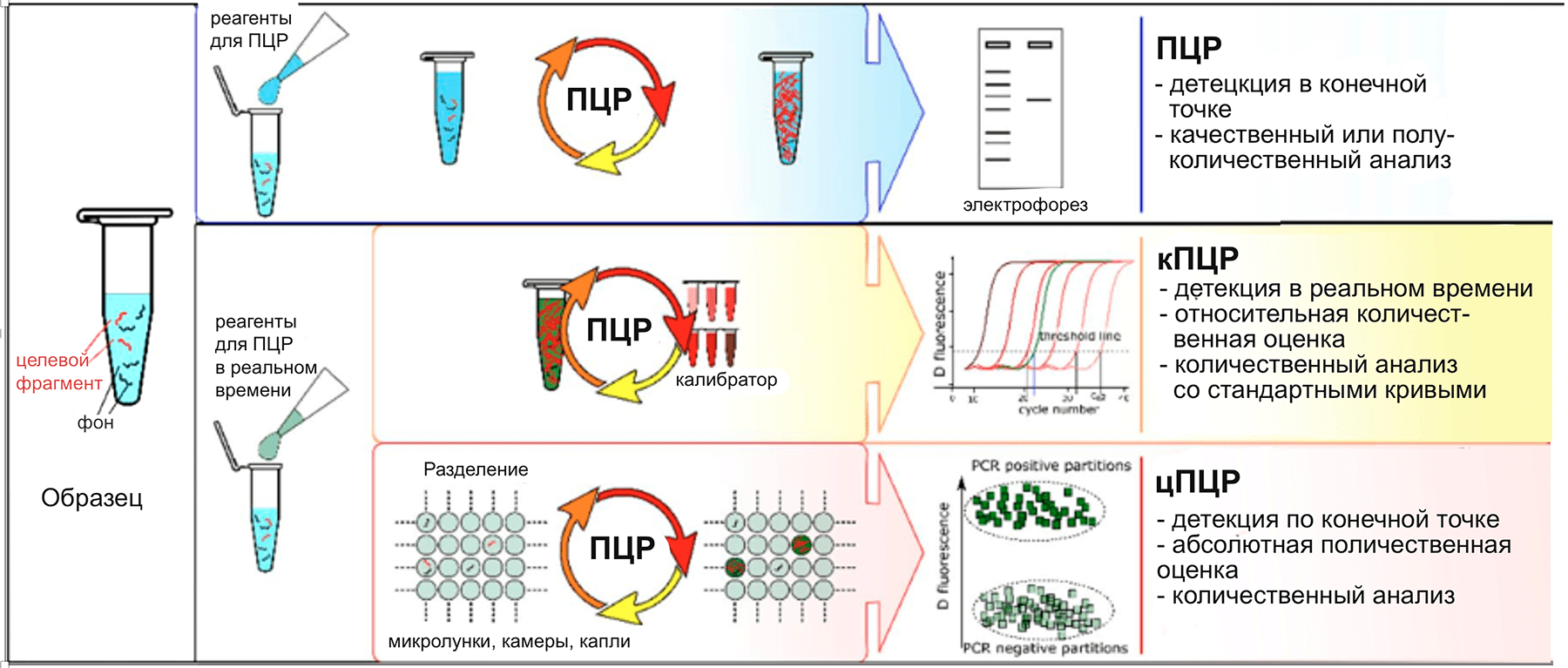
Различают методы ПЦР: с учётом по конечной точке методом электрофореза, флюоресцентной детекции на приборах «АЛА 1\4» (Латвия), «Джин» ( Россия), полуколичественный метод, и самый современный метод – в режиме реального времени с использованием надёжного специального оборудования.
Эпидемии гриппа А Н1N1 (Калифорния 09) 2009 г. и прошедшего эпидсезона 2015-2016 годов показали, что Роспотребнадзор по Республике Дагестан успешно справился с задачей диагностики гриппа и других острых респираторных вирусных инфекций у больных с тяжёлыми формами респираторной патологии.
ПЦР – диагностика с помощью мультиплексных тест-систем (на несколько инфекций) с успехом используется не только в диагностике ОРВИ, пневмоний, менингитов, а также для расшифровки вспышек пищевых токсикоинфекций, как на бактерии, так и на вирусы.
Диагностика инфекций методом ПЦР: что это такое?
Перечень анализов, проводимых при помощи ПЦР-диагностики расширяется с каждым днём. Что это за метод, как его проводят и в чём его достоинства? На эти и другие вопросы отвечает Владислав Александрович Чередниченко, врач-инфекционист, заместитель директора по развитию «Клиника Эксперт» Воронеж.
— Владислав Александрович, ПЦР – что это такое?
ПЦР или, иначе, полимеразная цепная реакция – это современный высокоинформативный метод молекулярно-генетической диагностики, активно применяемый для выявления у человека различных инфекционных и наследственных заболеваний.
За создание метода ПЦР американский биохимик Кэри Муллис был удостоен Нобелевской премии
— Как давно появилась ПЦР-диагностика и насколько она распространена сегодня?
Кэри Муллис
Сегодня без ПЦР-диагностики в клинической медицине практически невозможно обойтись. Высочайшая чувствительность метода позволяет опираться на него при выявлении различных инфекционных агентов в разных аспектах - как в качественном (возбудитель есть или нет), так и в количественном (какое количество микроорганизмов).
Помимо медицины метод нашёл применение в генетике, криминалистике, археологии.
— Для выявления каких заболеваний назначают проведение ПЦР?
Универсальность метода позволяет применять его для диагностики большинства патологий вирусной, бактериальной, грибковой природы, а также вызываемых гельминтами и простейшими. Например, метод ПЦР активно используется для выявления таких болезней инфекционной природы, как ВИЧ, гепатиты всех видов, уреаплазмоз, хламидиоз, микоплазмоз, кандидоз, мононуклеоз, трихомониаз, герпетические инфекции, сальмонеллёз, туберкулёз и многие другие.
Читайте материалы по теме:
— Какой биологический материал исследуют при ПЦР-диагностике?
Все биологические среды и жидкости человека: кровь, мочу, кал, мокроту, слюну, сок простаты, сперму, спинномозговую и суставную жидкость, и другие. Выбор биологического материала зависит от локализации возбудителя. К примеру, для проведения ПЦР на обнаружение хламидии, уреаплазмы или герпеса используют соскобы со слизистых оболочек, для выполнения ПЦР на гепатиты А, В, С и др. требуется кровь, а ПЦР-анализ на выявление туберкулёза лёгких будет максимально информативным при исследовании мокроты пациента. Использование метода полимеразной цепной реакции при изучении биоптатов из органов желудочно-кишечного тракта позволяет обнаружить хеликобактерную инфекцию.
— Как проводится процедура ПЦР? В чём её суть?
Суть ПЦР в том, что берётся малое количество ДНК или РНК-содержащего материала для исследования, а реакция способствует увеличению количества генетического материала, принадлежащего конкретному возбудителю, поэтому становится возможным его идентификация.
Пациента обычно отправляет на ПЦР-диагностику лечащий врач. В процедурном кабинете или в кабинете специалиста у пациента берут необходимый биоматериал, который упаковывается с соблюдением условий стерильности, температурного режима и маркировки. Затем биоматериал отправляют в ПЦР-лабораторию, где помещают в специальный аппарат, в котором происходит три этапа трансформации биоматериала.
Через 1-2 дня пациент получает результаты исследования.
— Требуется ли для проведения ПЦР-исследования специальная подготовка?
Нет, но рекомендуется придерживаться некоторых правил. Кровь для анализа сдают натощак. Слюну, мокроту, мочу и кал собирают в чистую посуду. Перед сдачей материала из половых путей для диагностики заболеваний мочеполовой системы следует на протяжении двух суток воздержаться от половой жизни. Также целесообразно перед исследованием уточнять особенности подготовки в лечебном учреждении либо в лаборатории.
А как готовиться к другим распространённым анализам? Об этом и не только читайте ниже:
— Владислав Александрович, расскажите о преимуществах и недостатках данного метода исследования.
Недостатков у ПЦР-диагностики при условии строгого соблюдения технологии проведения анализа и чистоты материала, на мой взгляд, нет.
Главным достоинством данного метода является его высокая чувствительность и возможность обнаружения самого возбудителя как в качественном, так и в количественном отношении. Определение количества микроорганизмов служит хорошим подспорьем для лечащего врача, так как позволяет оценить степень поражения, а также эффективность проводимого лечения.
Бесспорным преимуществом ПЦР-диагностики является также пригодность различных видов биологического материала пациента: крови, мочи, кала, спермы и т.д. В одном образце материала можно обнаружить нескольких возбудителей. К плюсам ПЦР-диагностики я бы отнёс и то, что это аппаратная методика, практически исключающая субъективизм в оценивании биологического материала.
Беседовала Севиля Ибраимова
Редакция также рекомендует:
Для справки:
Чередниченко Владислав Александрович
В 2000 году закончил Донецкий государственный медицинский университет им М. Горького по специальности «Лечебное дело».
В 2002 году закончил магистратуру в Украинской военно-медицинской академии (г. Киев) по специальности «врач-инфекционист».
Заместитель медицинского директора по развитию региона в «Клиника Эксперт» Воронеж. Принимает по адресу: ул. Пушкинская, д. 11.
Что такое ПЦР анализ
Аббревиатура ПЦР обозначает полимеразная цепная реакция.
Это современная методика лабораторного исследования, которая получила широкое распространение в клинической практике. В первую очередь она используется для диагностики различных инфекционных заболеваний.
В связи с широкой распространенностью данной диагностической методики, у пациентов часто возникает вопрос: ПЦР анализ – что это такое?
Цена анализа относительно не высокая, несмотря на то, что процедура позволяет получить достоверный результат.
Анализ крови ПЦР – что это такое?
Полимеразная цепная реакция представляет собой исследование, суть которого заключается в проведении амплификации (множественное копирование) генетического материала инфекционного агента. Данная методика дает возможность накопить ДНК или РНК выявляемых микроорганизмов в достаточном количестве. Оно необходимо для последующей идентификации генома и видовой принадлежности микроорганизмов. Благодаря ферментативной реакции множественного копирования молекул генетического материала ПЦР обладает высокой чувствительностью. Для выявления и идентификации достаточно нескольких фрагментов ДНК возбудителей в исследуемом биологическом материале.
Когда проводится анализ?
ПЦР получила широкое распространение в различных областях практической медицины. Исследование является одним из основных методов диагностики различных инфекционных заболеваний с половым путем передачи.
К ним относятся патологические процессы, вызванные:
Полимеразная цепная реакция также может использоваться для диагностики инфекций, вызванных условно-патогенными грибами (кандидоз).
Какой материал исследуется?
Материалом, который используется для лабораторного исследования методом ПЦР, являются различные биологические жидкости организма человека.
В зависимости от локализации и характера диагностируемого заболевания, это может быть:
Взятие материала проводится только в условиях манипуляционного кабинета медицинского учреждения соответствующим персоналом.
Обязательно соблюдаются правила асептики и антисептики. Они направлены на профилактику инфицирования пациента.
Подробную информацию про ПЦР анализ, что это такое и как правильно подготовиться к исследованию дает лечащий врач во время консультативного приема.
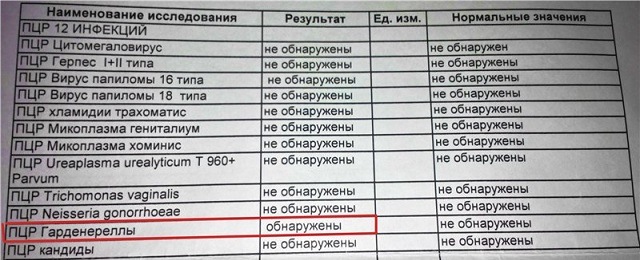
Расшифровка результата
В зависимости от методики проведения, а также диагностических целей ПЦР анализ может быть количественным и качественным. При проведении количественного исследования в результате указывает количество клеток возбудителя в единице объема материала.
При качественном исследовании – только факт наличия или отсутствия инфекции (в бланке анализа указывается положительный или отрицательный результат). Современные лаборатории могут проводить комплексное исследование на наличие сразу нескольких возбудителей инфекционной патологии. Хороший врач всегда ориентируется в информации про ПЦР анализ, что это такое, как делают и в какой лаборатории можно получить качественный результат проведенного исследования.
Обратитесь к нашим специалистам, и вам проведут качественную ПЦР диагностику.
Принцип ПЦР исследования
Что такое полимеразная цепная реакция (ПЦР)? Практически каждый человек в жизни сталкивается с этим методом, даже если не знает об этом. ПЦР исследует генетический материал – ДНК или РНК. Благодаря открытию ПЦР медицина и наука вышли на новый уровень и стала возможной точная диагностика различных инфекций, наследственных и онкологических заболеваний, установление отцовства и даже клонирование генов. ПЦР широко используется в криминалистике, раскопках и других областях, поскольку источником ДНК может быть капля крови, оставленная на месте преступления или человеческий волос, и даже останки мумии или мамонта, пролежавших тысячи, миллионы лет…
Но сегодня нас будет волновать ПЦР как точный метод диагностики инфекционных заболеваний, где он заслуженно удостоен звания «золотой стандарт». В основе метода – поиск ДНК микроорганизмов, то есть точное установление «личности» микроба, ставшего причиной заболевания.
Как работает ПЦР?
Всем известно из курса биологии, что генетический материал всего живого на Земле представлен двухцепочечной молекулой ДНК (кроме некоторых вирусов, содержащих РНК). Каждая цепочка ДНК состоит из комбинации четырех нуклеотидов. Да-да, нуклеотидов всего 4, но из них составлен генетический материал всех живых существ. Разница лишь в определенной последовательности нуклеотидов в цепочках ДНК. Зная уникальный порядок нуклеотидов в участке ДНК искомого микроорганизма, возможно его выявить в любом биологическом материале.
Принцип ПЦР заключается в многократном удвоении (амплификации) участка ДНК при помощи специальных ферментов.
Почему реакция называется полимеразная цепная?
В чём преимущества ПЦР?
Для грамотного применения метода следут запомнить следующие моменты:
ПЦР выявляет ДНК возбудителя независимо от того, живой он или мёртвый, поэтому:
Для выявления ДНК внутриклеточных инфекционных агентов ( например, вирусов) нужны клетки, поэтому:
Слизь, кровь и гной могут заблоктровать реакцию ПЦР, поэтому:
Проведение ПЦР требует строго соблюдения условий технологии, поэтому в лаборатории KDL:
Будьте здоровы и обследуйтесь в лаборатории, которой доверяете!
ПЦР-диагностика
Полимеразно-цепная реакция (ПЦР) – это одно из самых ярких достижений в сфере молекулярной биологии. Метод получил широчайшее распространение в разных областях науки. Благодаря очень высокой специфичности и чувствительности, метод ПЦР применяется в медицине, биологии, ветеринарии, криминалистике, санитарной службе и других отраслях деятельности человека.
Для анализа методом ПЦР можно использовать любые биологические материалы, которые содержат нуклеиновые кислоты (молекулу ДНК или РНК).
Принцип ПЦР- исследования
Кому мы обязаны появлением метода ПЦР?
Со слов американского биохимика Керри Мюллиса (Kary Mullis), идея идентифицировать живые организмы по короткому участку их генетического кода (ДНК) пришла ему в голову в 1983 году, по пути с работы домой. А в основе этой идеи, лежала работа другого американского биохимика, Артура Корнберга (Arthur Kornberg), которая в свое время не нашла отклика у научного сообщества.
Керри допустил возможность того, чтобы взять молекулу ДНК какого-либо организма, с помощью высокой температуры «распустить» ее спираль на две нити, специфическими маркерами-праймеры пометить уникальные для этого микроорганизма участки ДНК и затем, применив фермент ДНК-полимеразу, создать из двух нитей две новые молекулы ДНК. Но уже содержащие в себе меченные праймеры. И потом останется просто искать эти участки в диагностическом материале.
В итоге, корпорация CETUS, в которой работал Мюлис, выделила ему команду ученых. И в 1985 году, в издании Американского общества генетики человека, появилась публикация с теоретическим обоснованием ПЦР, как метода идентификации генетического материала живых организмов.
Как это все происходит в лаборатории
Выделение ДНК
Элонгация
Или синтез. После завершения процесса отжига, в реакционной смеси создают условия для активности полимеразы. Фермент, ориентируясь на молекулы праймеров (а не исходных нуклеиновых кислот), начинает синтез новых ниток ДНК/РНК. Которые становятся копиями исходных, искомых молекул нуклеиновых кислот.
Такой температурный цикл проводится 30 и более раз. В результате, даже при изначально небольшом количестве искомого генетического материала, в реакционной смеси накапливается значительное число «помеченных» праймерами нуклеиновых кислот (растет экспоненциально, с удвоением при каждом цикле).Обнаружить большие количества ДНК/РНК намного проще, за счет чего реализуется еще одно преимущество ПЦР – высочайшая чувствительность.
Детекция
Оценка результатов ПЦР проводится несколькими путями:
Преимущества методики ПЦР
Всего разработано более 10 разных методик амплификации, применяемых лабораториями в зависимости от исходных условий и поставленных целей.
Общим для них есть высокая чувствительность (для положительного результата достаточно 40 (!) или менее искомых копий ДНК в 1 мл образца, то есть вероятность ложноотрицательного ответа ничтожно мала. И очень высокая специфичность: вероятность ложноположительного ответа составляет менее 1%.
Но точность результатов сильно зависит от качества сбора диагностического материала, тщательного соблюдения всех технических требований к каждому этапу и качеству оборудования, расходных материалов (буфера, праймеров, раствора для отмывки и т.д.).
Области применения в медицине
В дерматовенерологии ПЦР используют для выявления венерических заболеваний: микоплазменной, хламидийной инфекций, сифилиса, генитального герпеса и др.
Инфекционисты активно используют ПЦР для диагностики туберкулеза, ВИЧ, вирусных гепатитов, герпеса, мононуклеоза, вируса Эпштейн-Барр и др.). А с помощью ПЦР в реальном времени, оценивая вирусную нагрузку, врачи могут составить мнение о динамике заболевания, отклике на лечение, что особенно актуально для пациентов с ВИЧ, принимающих терапию.
Также благодаря ПЦР врачи могут в течение нескольких дней с уверенностью идентифицировать коклюш и паракоклюш, выявить возбудителей эпидемии ОРВИ. Уточняются типы вируса гриппа, циркулирующие на определенной территории, на основании чего появляется возможность разработать эффективную вакцину для каждого сезона гриппа.
В течение суток или быстрее можно установить вид возбудителя кишечной инфекции, а значит – назначить адекватное лечение и обнаружить вероятный источник заражения.
Летом, ПЦР актуальна для диагностики заболеваний, передаваемых иксодовыми клещами: боррелиоза (болезни Лайма), клещевых энцефалитов.
Метод позволяет работать с любым биологическим материалом. Гемотрансмиссивные инфекции (сифилис, ВИЧ, гепатиты, боррелиоз) исследуются по пробе венозной крови или спинномозговой жидкости. Кожные болезни (герпес, грибки) – по соскобу с пораженного участка. Венерические и урологические – по образцу мочи, спермы, влагалищного отделяемого.
Так что в медицине, ПЦР применяется везде, где нужна высокая точность и быстрота получения результатов.
Лабораторные исследования, выполняющиеся методом ПЦР:
ПЦР: сверхчувствительная диагностика инфекций
ПЦР позволяет обнаруживать любые ДНК и РНК, даже когда бессильны другие методы. Безусловно, ПЦР — мощный и эффективный диагностический инструмент, позволяющий быстро и точно найти возбудителей очень многих инфекций.
Что такое ПЦР?
ПЦР — это метод лабораторной диагностики, направленный на выявление возбудителей инфекционных заболеваний. Трёхбуквенный вариант — это аббревиатура названия «полимеразная цепная реакция». Собственно, в этом названии и отражается суть метода, но для того, чтобы разобраться, придётся основательно вспомнить школьный курс биологии.
Но сначала – немного истории. Метод ПЦР был разработан в 1983 году Кэри Мюллисом, за что он был удостоен Нобелевской премии. Изначально метод использовался в основном для научных целей, но затем, разглядев его перспективность и эффективность, метод стали продвигать в практическую медицину.

В литературе очень часто встречается такое образное описание ПЦР: это метод, с помощью которого учёные могут находить иглу в стоге сена и затем строить стог из этих игл. В принципе, очень точное описание. Если продолжать сравнение, то игла – это небольшой участок генетического материала микроорганизма, а стог сена – это организм человека, в котором данный микроорганизм поселился.
Что показывает анализ ПЦР
Анализ позволяет обнаружить присутствие генетического материала инфекционных возбудителей. ПЦР в гинекологии и в урологии широко применяется для выявления скрытых и труднодиагностируемых инфекций. В том числе выполняется ПЦР и на ВИЧ.
Принцип работы
За генетическую информацию в живом организме любого размера отвечает ДНК — двухспиральная дезоксирибонуклеиновая кислота, состоящая из последовательности четырех нуклеотидов, которые принято обозначать буквами А (аденин), Г (гуанин), Т (тимидин) и Ц (цитозин). Одно из основных правил генетики – правило комплементарности, то есть нуклеотиды соседних спиралей ДНК соединяются только в определеном порядке: А с Т, Г с Ц, и никак иначе.
У каждого живого создания (бактерия, вирус, рыба, зверь) – своя ДНК, причём для выявления конкретного организма достаточно иметь лишь небольшой участок этого хранилища генетической информации. Некоторые виды микроорганизмов, например, вирус иммунодефицита человека, хранят генетическую информацию в другой нуклеиновой кислоте – РНК, но и её фрагменты можно находить с помощью ПЦР.
Именно на обнаружении этого небольшого, но уникального для каждого отдельного организма участка и построен принцип ПЦР. Для каждого возбудителя создан свой специфический генетический детектор, эталонный фрагмент ДНК, который по принципу комплементарности точно обнаруживает «свой» фрагмент ДНК и запускает реакцию создания огромного количества его копий.
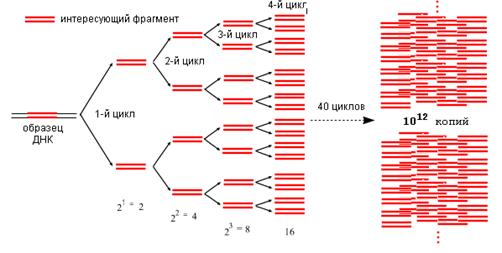
Один цикл ПЦР длится около трёх минут, количество копий растёт в геометрической прогрессии. Таким образом, за несколько часов количество фрагментов увеличивается в несколько миллиардов раз. Понятно, что теперь определить, какой возбудитель у данной конкретной инфекции, достаточно легко.
Достоинства
Теория – это, безусловно, замечательно, но что мы имеем на выходе? Какую практическую выгоду получает человек, когда отправляется на поиски вредоносных микроорганизмов, вооруженный ПЦР?
Недостатки
Безусловно, ПЦР не идеальный метод, имеются и свои недостатки. Но они напрямую связаны с его достоинствами и с так называемым «человеческим фактором». ПЦР – очень высокотехнологичный метод, требующий соблюдения строжайших правил оснащения лаборатории. Достаточно сказать, что в помещении должен быть установлен фильтр биологической очистки со степенью 99,9%. Это связано с тем, что в воздухе постоянно присутствует невероятный коктейль из фрагментов ДНК всевозможных живых организмов, и в процессе подготовки к проведению реакции образец может быть загрязнен — возможно «ложное срабатывание».
Оценивать результаты реакции должен практический врач, который лечит конкретного больного. Дело в том, что далеко не всегда положительный ответ теста означает наличие заболевания. Например, человек пролечился от какого-либо заболевания, но погибший и уже не опасный возбудитель будет еще некоторое время «разбираться на запчасти» защитной системой организма. Если в этот момент сделать ПЦР – результат окажется положительным.
Другой вариант – это отрицательный результат ПЦР при наличии даже явной клинической картины. Одна из наиболее возможных причин – материал для исследования был взят «не оттуда». Образец должен брать квалифицированный врач, строго следуя инструкции, которую ему дает лаборатория.

Когда нужно делать?
Когда следует бежать в лабораторию, чтобы проанализировать итоги вашего летнего отпуска? Специалисты советуют делать это в следующих случаях: выделения, зуд, чувство жжения в области половых органов, резко изменившийся запах от половых органов, дискомфорт при мочеиспускании, необычный характер выделений (цвет, количество, консистенция), случайный половой контакт без применения презерватива.
Подводим итоги
Безусловно, ПЦР — мощный и эффективный диагностический инструмент, позволяющий быстро и точно найти возбудителей очень многих инфекций. Чаще всего его используют для диагностики именно заболеваний, передающихся половым путем. Причём зачастую клиники и лаборатории уже предлагают своеобразные готовые «наборы» ПЦР на ИППП — 5 инфекций, 13 инфекций. В этих случая обычно материалом для исследования является мазок. Например, мазок на хламидии у женщин берут из влагалища, у мужчин — из уретры. Для анализа биоматериалом могут быть и слюна, и кровь, и моча, и выделения половых органов.
В любом случае нельзя ограничиваться только одним методом. Лучше всего комбинировать различные методы исследования – помимо определения самого возбудителя методом ПЦР необходимо оценивать и иммунный ответ организма, который определяется традиционными уже серологическими методами, например, ИФА.
И помните: положительный ответ любого, даже самого современного лабораторного исследования – это повод не для паники, а для визита к врачу.
Цифровая ПЦР: измеряя истину
Цифровая ПЦР позволяет детектировать даже единичные события
Авторы
Редакторы
Метод полимеразной цепной реакции (ПЦР) изменил биологию и медицину 80-х годов XX века, позволив быстро и точно диагностировать наследственные заболевания и инфекции, определять патогенов и свободно манипулировать генами. Интереснейшая его модификация — цифровая ПЦР — быстро завоевывает пространство лабораторной диагностики XXI века, когда требуется абсолютное количественное определение ДНК. В каком случае это нужно и каким образом может быть реализовано на современном оборудовании — читайте в нашей статье спецпроекта «Ультрасовременные методы».
Ультрасовременные методы
Партнер публикации — компания QIAGEN — один из мировых лидеров в технологиях анализа биологических образцов в области наук о жизни, молекулярной диагностики, геномики и онкологии, криминалистики и женского здоровья. Компания предлагает диагностическим и научным лабораториям наборы реагентов, оборудование и программное обеспечение, позволяющее проводить все этапы исследований «от образца к результату» — от гомогенизации, стабилизации и экстракции образцов до их молекулярно-генетического анализа, биоинформатической обработки и интерпретации данных. QIAGEN осуществляет не только поставку своей продукции в лаборатории, но и оказывает сервисное обслуживание, техническую поддержку и обучение пользователей, а также имеет собственный тренинговый центр.
Методы, которыми оперирует современная наука, постоянно совершенствуются. Некоторые области развиваются настолько стремительно, что порой даже специалистам сложно уследить за новейшими приборами и модификациями методик. Так происходит, например, в геномике. Другие же области (такие как гистология и связанные с ней световая и флуоресцентная микроскопия) развиваются куда медленнее, но всё равно расширяются и обзаводятся более высокопроизводительными методами. В статьях нового спецпроекта (он продолжает наш хит — «12 биологических методов в картинках») мы хотим рассказать, какие методы помогают ученым совершать новые открытия сегодня, и чего нам ждать в будущем.
До 2007 года количество публикаций о цПЦР оставалось небольшим (всего несколько штук в год), но пять лет назад всё изменилось, и сейчас наблюдается экспоненциальный рост числа статей об исследованиях с использованием метода цПЦР. Причем если сначала эти статьи публиковались преимущественно в изданиях по инженерным системам и микрофлюидике, то теперь они появляются в биологических и медицинских журналах.
Предельное разведение — это метод, основанный на использовании конечной точки по принципу «всё или ничего» и на предпосылке, что одна или несколько ДНК-мишеней в реакционной смеси приводят к положительной конечной точке.
ПЦР, количественная ПЦР, цифровая ПЦР: кто кого?
ПЦР, или полимеразная цепная реакция
Подробнейшим образом мы писали об этом в одноименной статье «Полимеразная цепная реакция» [6] классического спецпроекта «12 биологических методов в картинках», куда и отправляем первым делом читателей, которые хотят разобраться во всём досконально.
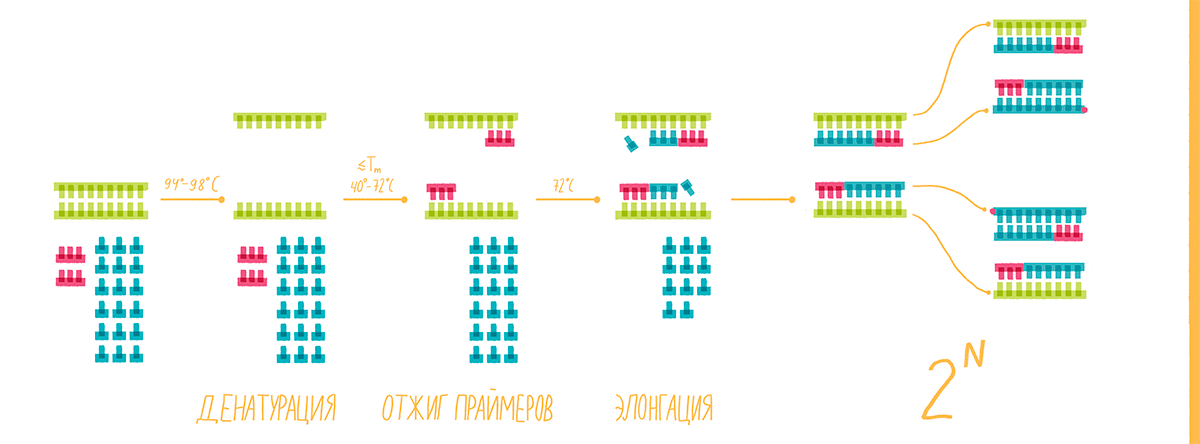
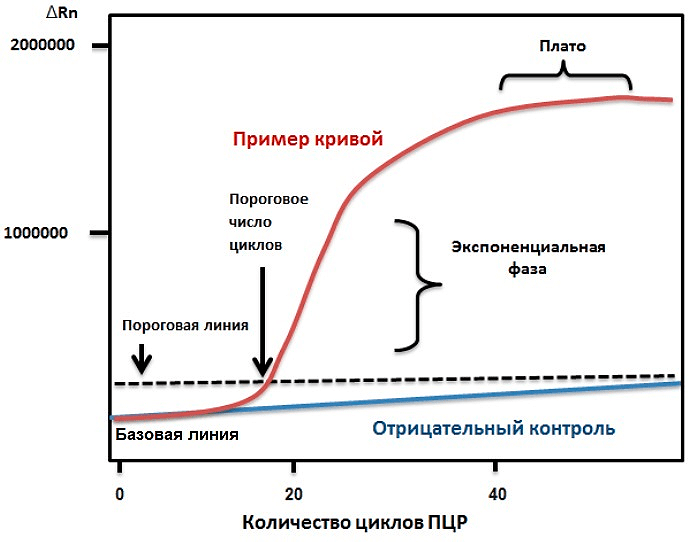
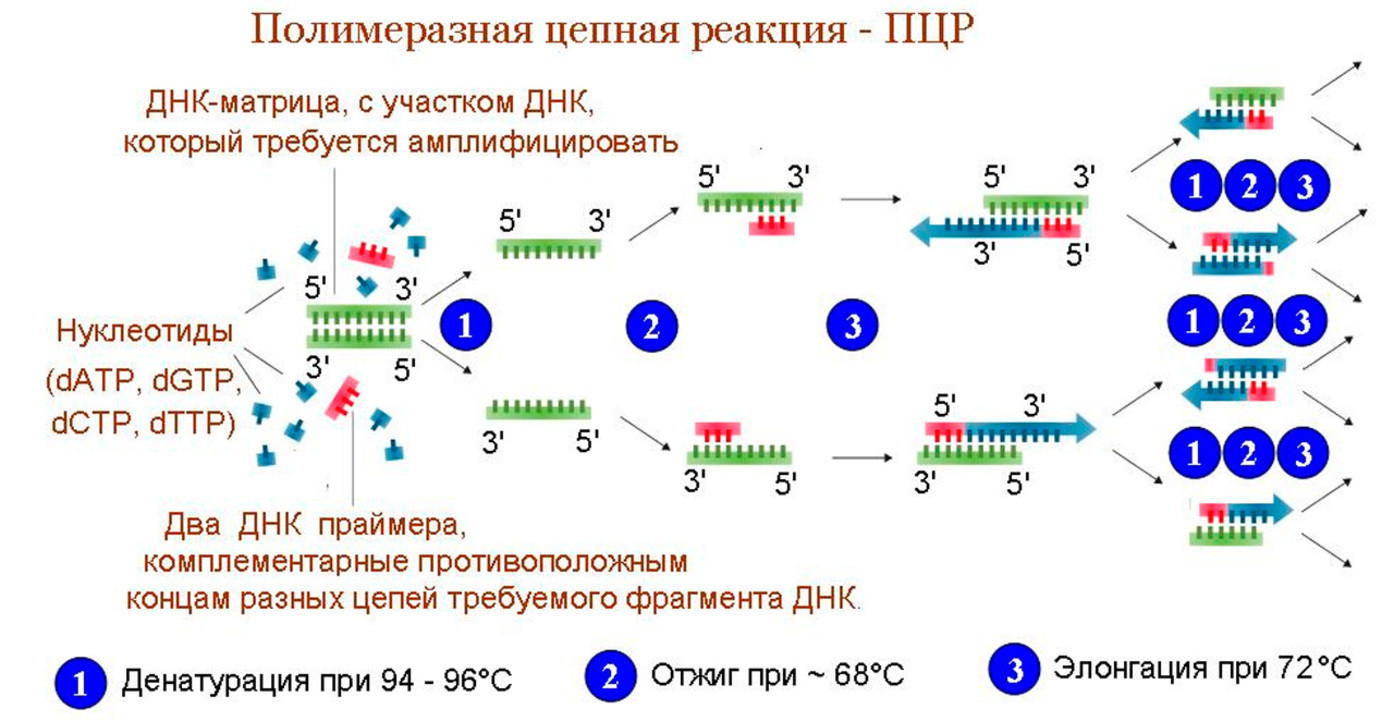
Специфичность ПЦР зависит от гибридизации с матрицей коротких последовательностей — праймеров, — которые комплементарны участкам, фланкирующим (ограничивающим) последовательность-мишень, а чувствительность — от природы фермента ДНК-полимеразы. ПЦР обычно состоит из серии температурных циклов, повторяющихся 20–40 раз. Каждый цикл — это последовательные денатурация двухцепочечной ДНК, гибридизация праймеров с ДНК-матрицей и элонгация (удлинение этих праймеров ДНК-полимеразой) (рис. 1а). Таким образом в каждом цикле количество молекул ДНК-мишени удваивается (так называемая экспоненциальная амплификация), и теоретически после n циклов может быть получено 2 n копий. На практике амплификация насыщается и выходит на плато по мере того, как реагенты ПЦР истощаются, а накопленные продукты ПЦР «отжигаются» сами на себя, предотвращая дальнейшую амплификацию. Наличие и примерное количество («много—мало») ПЦР-продукта можно оценить при помощи гель-электрофореза.
Эффективность ПЦР зависит от многих факторов. Это и производительность анализа, зависящая от последовательностей и структур праймеров и матриц; и чистота матрицы (например, отсутствие примесей, ингибирующих ПЦР); и концентрация используемых реактивов. В целом, любой из реагентов ПЦР может ограничивать скорость и производительность анализа [8].
Рисунок 1а. Принципы полимеразной цепной реакции (ПЦР). Каждый цикл ПЦР включает три этапа: (1) денатурация двухцепочечной ДНК нагреванием; (2) отжиг праймеров с комплементарными последовательностями ДНК-мишеней; (3) удлинение праймеров термостабильной ДНК-полимеразой. Типичная реакция ПЦР повторяется 20–40 раз.
Рисунок 1б. График амплификации ПЦР в реальном времени в линейной шкале. Типичный такой график — кривая сигмоидальной формы с четырьмя отдельными фазами:
Количественная ПЦР
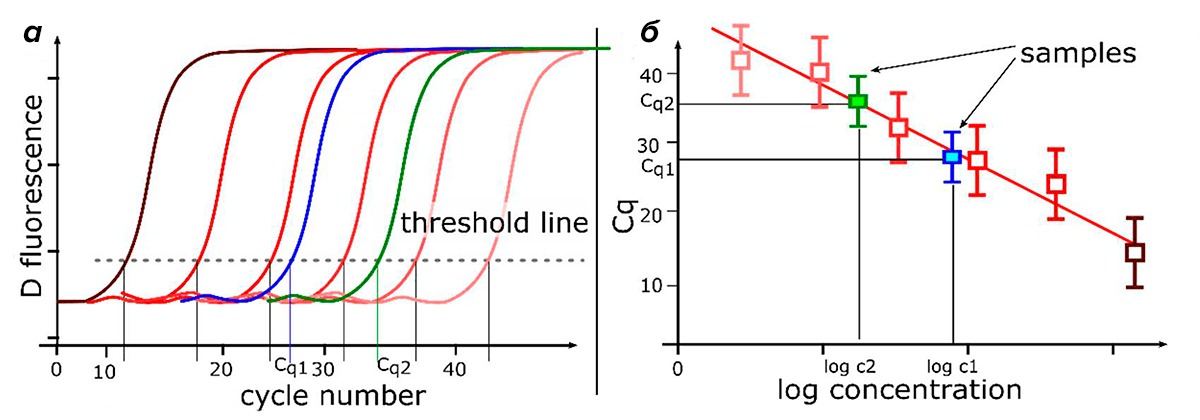
Количественная ПЦР (кПЦР, также называемая ПЦР в реальном времени) может использоваться для измерения количества продукта после каждого раунда амплификации с помощью считывания флуоресценции [9]. ПЦР в реальном времени позволяет проводить относительную количественную оценку мишени по отношению к калибратору (образец с точно известной концентрацией, относительно которого рассчитывается количество ДНК-мишени в опытном образце). Соответственно, при наличии стандартной калибровочной кривой (и, что важно, эквивалентной эффективности амплификации образца и стандарта!) метод является количественным (рис. 2) [10].
Рисунок 2. Анализ количественной ПЦР в реальном времени с использованием стандартной кривой. а — Кривые амплификации для шеститочечной серии десятикратных разведений матрицы с известными концентрациями (стандарт — образец с известной концентрацией, используемый для построения стандартной кривой) более пяти порядков (например, геномная ДНК, ампликон ПЦР, линеаризованная плазмида). Определяют значение Cq каждого серийно разбавленного стандарта. Кривые от коричневого до розового цветов — стандартные кривые различных разведений. Синяя и зеленые кривые — кривые амплификации образцов. б — Стандартная кривая создается путем нанесения значений Cq, полученных из кривых амплификации серии разведений, в зависимости от логарифма стандартного количества. По ней можно определить количество исследуемого образца, нанеся его значение Cq на график. Наклон стандартной кривой измеряет эффективность амплификации количественной ПЦР. Наклон −3,32 (для стандартной кривой, полученной из серии десятикратных разведений) указывает на 100%-эффективность амплификации (количество продукта ПЦР удваивается во время каждого цикла).
Главным недостатком кПЦР является относительность информации об исследуемом образце. Скажем, если образец, обработанный лекарственным веществом, содержит в два раза больше целевой мРНК, чем контрольный образец, то, чтобы определить абсолютное количество ее молекул, исследователи должны сравнить значения Ct (cycle threshold) образца со стандартной кривой [2], [4], [11].
Ct (cycle threshold) — это количество циклов создания дополнительных копий РНК, начиная с которого результат конкретного теста считается положительным. — Ред.
Цифровая ПЦР
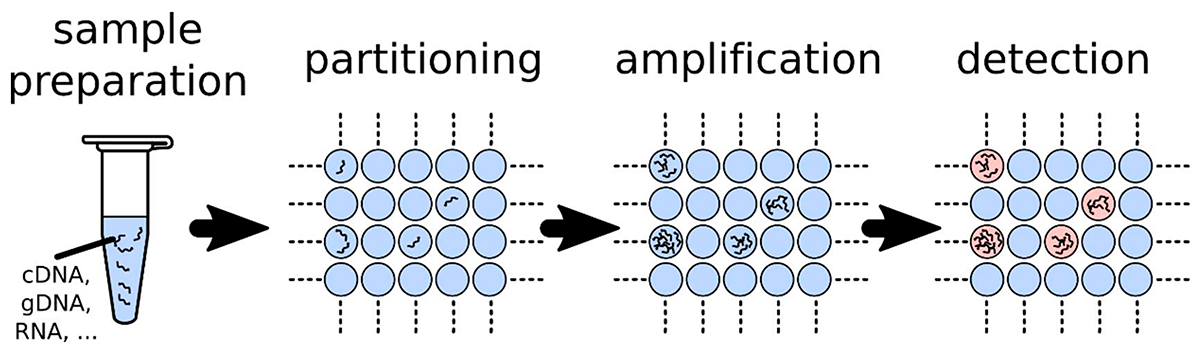
Цифровая ПЦР (цПЦР) позволяет проводить определение абсолютного количества целевых нуклеиновых кислот, присутствующих в образце. В цПЦР образец сначала разводят и разделяют на множество независимых реакций ПЦР, так что каждая ячейка реакционной смеси содержит либо одну ДНК-мишень (или всего несколько), либо не содержит их вовсе (рис. 3). Далее проводят ПЦР с флуоресцентным красителем или гидролизными зондами и считывают флуоресцентный сигнал. Доля положительных по амплификации ячеек используют для количественного определения концентрации целевой последовательности [12], [13]. Интересно, что разделение образцов эффективно концентрирует ДНК-мишени в ячейках. Этот эффект концентрации снижает конкуренцию матриц и, таким образом, позволяет обнаруживать редкие мутации на фоне последовательностей дикого типа. Кроме того, это также обеспечивает более высокую толерантность к ингибиторам, присутствующим в образце, так как их количество также многократно разводится.
Короткая одноцепочечная последовательность ДНК, имеющая флуорофор и «гаситель» на 3′- и 5′-концах, комплементарна внутреннему участку ДНК-мишени. При гибридизации с ДНК-мишенью зонд не флуоресцирует, при прохождении полимеразы во время элонгации зонд гидролизуется за счет 5′–3′ экзонуклеазной активности Taq-полимеразы, метки оказываются в растворе сильно разнесенными, и флуорофор начинает работать.
Рисунок 3. Принципы цифровой ПЦР. Образец разведен и наносится во множество независимых ячеек (или капель). Каждая ячейка действует как отдельный микрореактор ПЦР, и ячейки, содержащие амплифицированные ДНК-мишени, обнаруживаются по флуоресценции. Распределение ДНК-мишеней в ячейках можно аппроксимировать распределением Пуассона. Отношение положительных сигналов (наличие флуоресценции) к общему количеству позволяет определить концентрацию мишени в образце.
Ключевое различие между цПЦР и кПЦР заключается в их стратегии измерения количества ДНК-мишени (табл. 1). При кПЦР накопление продукта отслеживается на протяжении всего процесса амплификации, а количественная оценка основана на анализе флуоресцентного сигнала в экспоненциальной фазе ПЦР. Напротив, при цПЦР анализируются сигналы флуоресценции конечного продукта по окончании ПЦР и оценивается количество положительных ячеек из общего количества для обратного расчета исходной концентрации ДНК-мишени (рис. 4). цПЦР сводит количественную оценку к положительным или отрицательным результатам, таким образом, преобразуя аналоговый сигнал в серию двоичных (или цифровых) сигналов. В отличие от кПЦР, цПЦР не использует калибровочные кривые для количественного определения образца. Следовательно, она позволяет избежать искажения результатов, связанных с изменением эффективности реакции [10]. Количественная оценка с помощью цПЦР основана на биномиальной статистике, которая математически определяет присущую ей точность и показатели производительности.
Рисунок 4. Сравнение методов на основе ПЦР
| кПЦР | цПЦР |
|---|---|
| Различия | |
| Требуется стандартная кривая | Стандартная кривая не требуется |
| Нет разделения образца | Образец разделен на множество ячеек |
| Данные собираются в режиме реального времени | Сбор данных в конечной точке после окончания реакции |
| Относительная количественная оценка | Абсолютная количественная оценка |
| Сходства | |
| Совместимость методов пробоподготовки | |
| Компоненты реакции амплификации и их концентрации одинаковые — PCR Master Mix, флуоресцентные зонды, праймеры, ДНК-матрица | |
| Служат для определения количеств мишени, присутствующей в образце | |
| Одинаковые начальные объемы образца | |
| Оба работают либо с гидролизными зондами (TaqMan Probes, Molecular Beacons, Hybridization Probes, Scorpions Probes etc.), либо с ДНК-связывающим красителем (SYBR Green I, YO-PRO-1, SYBR® Gold, SYTO, BEBO, BOXTO и EvaGreen) | |
| Широкий динамический диапазон | |
| Возможность мультиплексирования | |
Требуется стандартная криваяСтандартная кривая не требуетсяНет разделения образцаОбразец разделен на множество ячеекДанные собираются в режиме реального времениСбор данных в конечной точке после окончания реакцииОтносительная количественная оценкаАбсолютная количественная оценка
Анализ результатов цПЦР: вспоминаем статистику
Огромное преимущество цПЦР — обсчет результатов с помощью статистических методов, которые позволяют сделать вывод как об исходной концентрации матрицы, так и о точности количественного определения.
Основы статистики для цПЦР. Биномиальная вероятность и приближение Пуассона
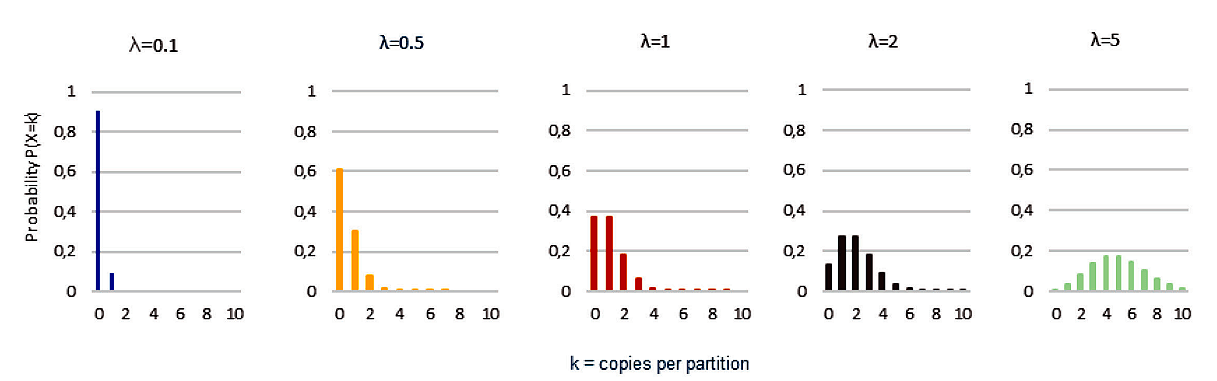
Распределение Пуассона описывает распределение вероятностей независимых событий, когда известно среднее число событий. Распределение Пуассона предсказывает долю ячеек, содержащих заданное количество ДНК-мишеней. И наоборот, знание распределения позволяет рассчитать среднее количество ДНК-мишеней в образце. Несмотря на то, что целевое разделение следует распределению Пуассона, цПЦР не обеспечивает подробного распределения, а только указывает, присутствуют ли целевые последовательности в ячейке или нет. Тем не менее отношение положительных разбиений k (содержащих некоторые целевые последовательности) к общему числу разбиений n достаточно для предсказания начальной концентрации ДНК-мишени в образце с λ = −ln(1 − k/n).
Рисунок 5. Распределение Пуассона для различных ожидаемых значений (λ)
QIAcuity User Manual Extension
Интуитивно понятно, что достоверность оценки исходной концентрации ДНК-мишени зависит от количества пустых ячеек. В крайних случаях, то есть когда большинство ячеек либо пусты, либо заполнены, достоверность расчетной концентрации очень низкая, поскольку паттерн «пустой/полный» не очень информативен.
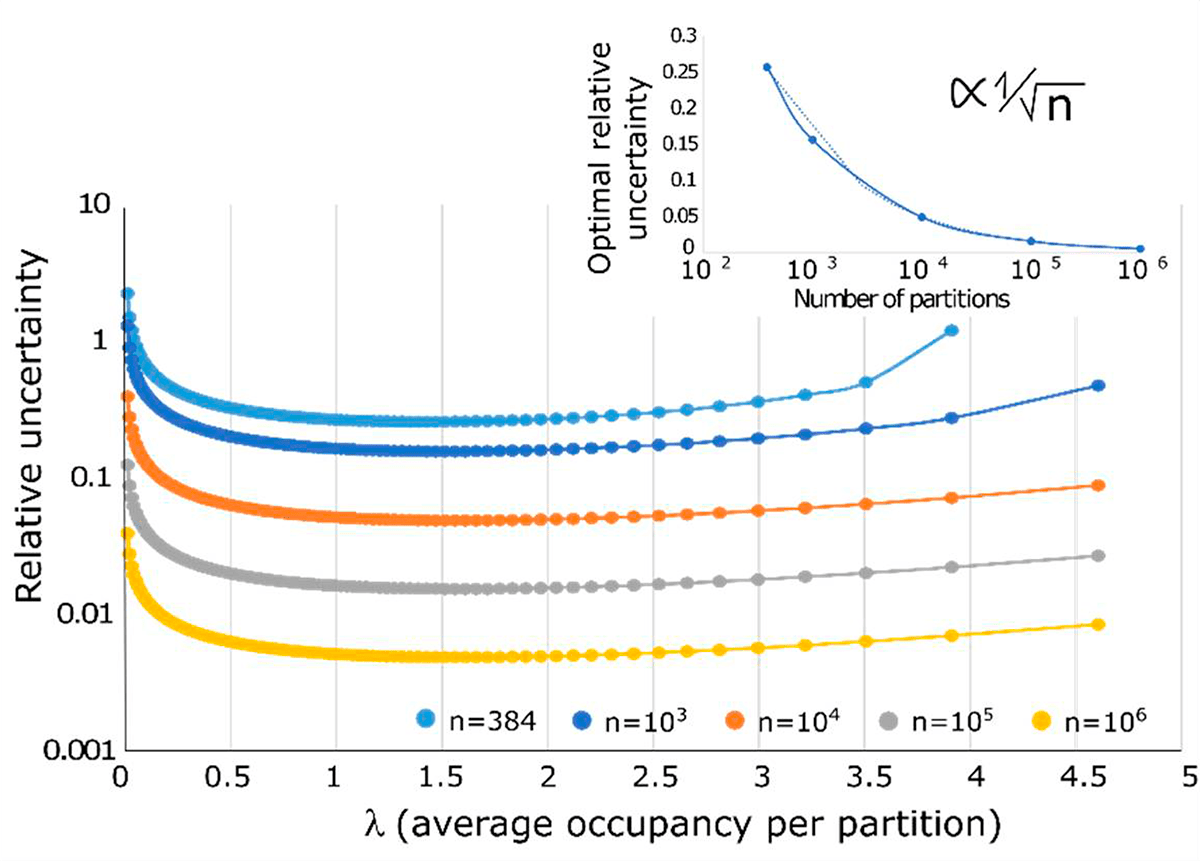
Можно предположить, что существует ожидаемое значение, для которого начальную концентрацию образца можно оценить с наибольшей достоверностью. В случаях 10 000 и более ячеек максимальная достоверность достигается при ожидаемом значении λ около 1,6, что соответствует 20% ячеек (рис. 6). Точность оценки λ увеличивается с количеством ячеек, а оптимальная точность (при λ = 1,6) масштабируется как обратный квадратный корень из числа ячеек.
Рисунок 6. Точность количественной оценки цПЦР. Точность цПЦР неравномерна и зависит от средней занятости ДНК-мишени на ячейку, а также от количества ячеек. На рисунке показано, что эволюция относительной неопределенности (взятая при λ ≈ 1,6) уменьшается как обратный квадратный корень из числа ячеек.
У цПЦР есть и присущие методу статистические ограничения. Так, точность цПЦР ограничена неопределенностью измерения из-за:
Собственная точность цПЦР не является постоянной во всем динамическом диапазоне и может быть довольно низкой в крайних точках (тот случай, когда большинство разбиений либо положительные, либо отрицательные). Еще одно техническое ограничение цПЦР связано с изменением объема ячейки, что может давать негативный эффект при высокой средней занятости λ и доминировать в неопределенности количественной оценки при очень большом количестве ячеек. Соответственно, очень важно использовать оптимальное количество ячеек одинакового объема для анализа [15].
Эффективность цПЦР
Чувствительность или нижний предел обнаружения ДНК-мишени для цПЦР — это обнаружение одной молекулы в одной ячейке. Следовательно, минимальная концентрация, которую можно детектировать, зависит от общего объема реакции (или от суммарного количества ячеек и их объема). Объем каждой ячейки в цПЦР лежит в диапазоне пл–нл (пиколитры–нанолитры). Количество ячеек обычно на практике ограничено, и именно это определяет предел чувствительности обнаружения цПЦР. Напротив, объем реакции кПЦР обычно намного больше, и его также можно легко отрегулировать для достижения более высокой чувствительности.
Наибольшая концентрация молекул напрямую зависит от объема ячейки, т.е. ячейки с меньшим объемом соответствуют более высоким концентрациям молекул при заданном λ. Интересно, что наибольшее количество обнаруженных последовательностей-мишеней может быть намного больше, чем количество ячеек. Это значение оценивается путем решения λ для заданной точности и количества ячеек в ситуации высокой занятости ячейки. Например, при точности 12,6% наибольшее количество обнаруженных последовательностей-мишеней может быть в 5 раз больше, чем 20 000 сгенерированных капель [14], или в 11 раз больше, чем 10 6 созданных ячеек [16].
Исходя из этих соображений, большой динамический диапазон обнаружения создает противоположные ограничения на объем ячеек; при этом большие объемы ячеек улучшают нижний предел обнаружения, а меньшие объемы ячеек улучшают верхний предел обнаружения.
Эту загадку можно решить, используя конструкции цПЦР с многообъемными ячейками, где ряд ячеек большого объема обеспечивает высокую чувствительность, в то время как ряд ячеек малого объема обеспечивает высокий предел обнаружения, а несколько рядов ячеек среднего объема обеспечивают высокую точность [17], [18]. С практической точки зрения этот подход уменьшает общее количество ячеек, необходимых для достижения заданного динамического диапазона, и, следовательно, общую площадь устройств.
Надежность цПЦР: ложноотрицательные и ложноположительные сигналы
Чувствительность метода сильно зависит от частоты ложноположительных и ложноотрицательных событий. Хотя цПЦР основана на цифровом анализе, обнаруженный сигнал изначально аналоговый, и при интерпретации результатов необходимо вводить порог, чтобы отделить истинный сигнал от фонового (о методе статистической пороговой обработки можно прочитать в [19]). Ложноположительные результаты могут возникать из-за плохого дизайна эксперимента или из-за обнаружения ложной амплификации при большом количестве циклов ПЦР, а также в результате контаминаций во время постановки эксперимента [14].
Ложноотрицательные результаты (или выбросы) менее вероятны, чем ложноположительные. Однако они появляются из-за того, что:
На результаты цПЦР, конечно, влияют и предыдущие стадии эксперимента (например, выделение ДНК и предварительная амплификация [24]). Скажем, у исследователя может возникнуть соблазн провести предварительную амплификацию образца с низкой исходной концентрацией, чтобы достичь оптимального значения λ, равного 1,6. Однако дисперсия, связанная с реакцией предварительного усиления, не является систематической и не может быть исправлена. Поэтому прямой количественный анализ даже мишени с низкой концентрацией всё же предпочтительнее [13], [25].
Приборы для цПЦР
За свою более чем 30-летнюю историю цПЦР давно ушла от использования традиционных 384-луночных планшетов, стала более высокотехнологичной и удобной в использовании. Сейчас на рынке представлено несколько платформ от разных производителей для проведения цПЦР, при этом общая концепция цПЦР остается неизменной: исходная ДНК разбавляется для создания нано- или пикомасштабных (количественных) реакций, содержащих 1 или 0 копий матрицы.
Standard BioTools Inc. (Fluidigm Corporation)
Одним из первых коммерчески доступных инструментов для цПЦР стала система BioMark™ HD dPCR (Standard BioTools Inc.), основанная на технологии микрофлюидных чипов. Чипы можно приобрести в различных форматах, включая 12-камерные или 48-камерные массивы. В массиве из 12 камер образцы разделены на 765 нанолитровых реакций, что дает 9180 реакций на чип (в 48-камерном массиве — 36 960 реакций на чип). Образцы загружаются во входное отверстие каждой камеры, и нанолитровые реакционные смеси распределяются по ней при помощи клапанов и насосов с регулируемым давлением. Разделение и смешивание образцов, а также реакции термоциклирования выполняются на чипе. После амплификации флуоресценция детектируется с помощью системы BioMark [26]. Встроенная обработка данных позволяет выполнять меньше ручных манипуляций, тем самым снижая вероятность внесения ошибок и сохраняя при этом более простую и удобную для пользователя систему.
Система цПЦР компании Standard BioTools позволяет мультиплексировать реакции и детектировать четыре разных ДНК-мишени на образец. Флуоресцентный сигнал чипа снимается до и после каждого цикла термоциклирования. Это позволяет вычесть любой фон до термоциклирования из окончательного флуоресцентного изображения, облегчая точный подсчет положительных компартментов. Еще одной особенностью системы является возможность количественного определения ДНК-мишени, которая разделена на каждую камеру, с использованием конкретных для каждой камеры графиков амплификации в реальном времени. Соответственно, BioMark™ HD можно использовать и как инструмент для проведения кПЦР [25], [27].
Thermo Fisher Scientific (Life Technologies™)
В основе работы систем OpenArray® и QuantStudio® 12K Flex dPCR (Thermo Fisher Scientific) лежит микрофлюидная технология. Приборы различаются по производительности: OpenArray вмещает до трех планшетов цПЦР, а QuantStudio 12K Flex dPCR — до четырех. Каждый 384-луночный планшет имеет 48 массивов с 64 «сквозными отверстиями». В результате получаются 3072 разделенные реакции на планшет. Нанолитровые реакции распределяются по «сквозным отверстиям» с помощью автоматизированной системы дозирования и стабилизируются там за счет гидрофобных и гидрофильных взаимодействий между каплей и покрытием планшета. Как и в BioMark™ HD, образцы можно мультиплексировать: правда, в данном случае одновременно детектируются лишь две ДНК-мишени. Данный прибор можно использовать и в формате количественной ПЦР [28].
Bio-Rad (RainDance Technologies)
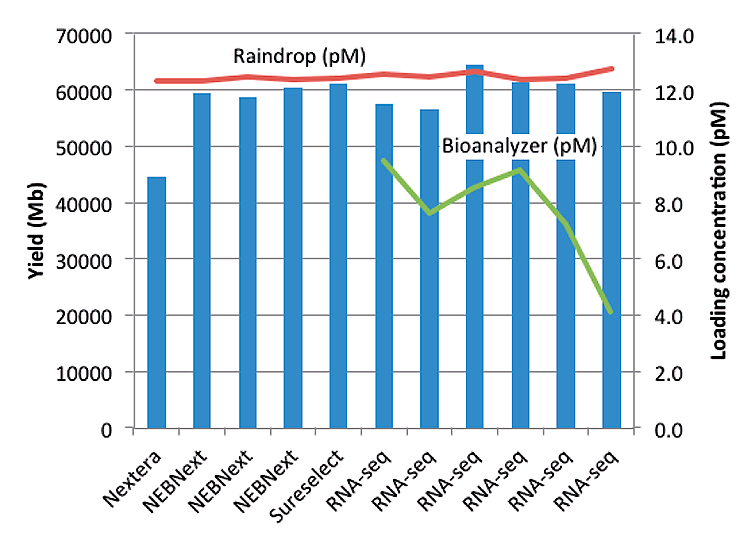
Прибор RainDrop™ (изначально созданный компанией RainDance Technologies) — еще одна высокочувствительная платформа для цПЦР. Увеличение чувствительности и количественной мощности в нем связано с более мелкими реакциями объемом в пиколитры и увеличенным количеством разделенных капель: около 10 миллионов на образец. RainDrop основан на микрофлюидной технологии эмульгирования капель. Чипы предназначены для нанесения восьми образцов, при этом каждый из них разделяется на 10 миллионов реакций. В результате на чип приходится 80 миллионов разделенных реакций. Благодаря увеличенному количеству реакционных ячеек на такой чип может быть нанесен образец с большим количеством ДНК, что делает эту платформу идеальной для выявления чрезвычайно редких мутаций. Результаты экспериментов показывают, что система RainDrop™ может использоваться для количественного определения 1 из 200 000 мутантов и имеет нижний предел обнаружения 1 из 1 000 000 [29].
В дополнение к повышенной чувствительности, на платформе RainDrop™ можно мультиплексировать пять ДНК-мишеней на образец, просто используя флуоресцентные зонды с красной и зеленой маркировкой. Изменение количества флуоресцентного зонда для каждой мишени создает уникальную интенсивность цвета, которая соответствует мутационно-специфичному зонду с двойной меткой, а интенсивность сигнала напрямую связана с концентрацией зонда, используемого в анализе. Метод разбавления флуоресцентных зондов для генерации оптического кода может не ограничиваться системой пятикратного мультиплексирования и может использоваться для создания системы десятикратного мультиплексирования, что делает эту систему одной из самых мощных доступных систем мультиплексирования цПЦР [30], [31].
Хотя RainDrop™ является одной из самых экономичных платформ с точки зрения цены анализа одного образца, но создана она так, что ее нельзя использовать для проведения количественной ПЦР. Кроме того, настройка этого прибора более трудоемка и, следовательно, сопровождается бóльшим количеством ошибок [31].
В 2017 году компания Bio-Rad Laboratories купила RainDance Technologies, сейчас прибор не выпускается.
Bio-Rad
Bio-Rad QX100™ Droplet Digital™ — единственная платформа, в которой не используются микрожидкостные чипы ни на одном этапе. В основе разделения образцов в данном случае лежит технология эмульгирования масла в стандартном формате 96-луночного планшета. В картридж можно одновременно загрузить восемь образцов. Каждый образец помещается рядом с лункой, содержащей масло, и вместе они подвергаются капельному эмульгированию с использованием генератора капель на основе вакуума. Таким образом, образец разбивается на 20 000 реакций и переносится в лунку стандартного 96-луночного планшета. Полностью загруженный образцами планшет содержит 1 920 000 капель. Далее образцы подвергают стандартной ПЦР, а конечные флуоресцентные сигналы считывают при помощи устройства для считывания капель на основе метода проточной цитометрии [25], [32].
Большое количество реакций, созданных с помощью этой платформы, повышает точность цПЦР, а также дает возможность загружать большее количество матричной ДНК. Прибор не совместим с приложениями количественной ПЦР и может использоваться для мультиплексирования только двух мишеней на образец.
QIAGEN
Система QIAcuity, в отличие от систем капельной цПЦР, использует технологию микрофлюидики в нанопланшетах. Такой подход позволяет избежать проблем, связанных с неравномерностью образования капель, их числом и размерами, сложностью рабочего процесса работы с эмульсией, а также медленным считыванием результатов при использовании капельных методов. Пять причин, почему разработчики выбрали именно формат планшетов и отказались от использования эмульсии:
QIAcuity разработан как портативный прибор, который интегрирует и автоматизирует все этапы обработки планшетов. Вручную необходимо провести только его подготовку перед запуском цикла (все манипуляции, как и в случае кПЦР — внести образцы, мастер-микс и заклеить планшет пленкой). После подготовки и настройки эксперимента в программном обеспечении планшет сразу загружается в прибор. Считывая штрих-код, прибор связывает планшет с протоколом, ранее определенным в программе. После запуска прибора и старта эксперимента все дальнейшие шаги выполняются полностью автоматически: распределение по микролункам, термоциклирование, визуализация и анализ данных. На этих этапах уже не требуется присутствия исследователя, а готовый результат будет готов примерно через два часа. При этом стандартный SBS-формат планшета дополнительно позволит автоматизировать процесс дозирования образцов с использованием робота.
Система QIAcuity One (QIAGEN) для цифровой ПЦР в нанопланшетах
Система QIAcuity One (QIAGEN) для цифровой ПЦР в нанопланшетах
Для проведения различных экспериментов используются разные типы нанопланшетов. Например, для тех задач, которые требуют более высокую пропускную способность, таких как анализ экспрессии генов, 96-луночные планшеты обеспечат распределение образца на 8500 микролунок. Для экспериментов, требующих высокого разрешения, таких как обнаружение редких мутаций или анализ свободно циркулирующих биомаркеров, QIAGEN предлагает планшеты, позволяющие анализировать до 24 образцов с распределением образца на 26 000 микролунок.
Прибор QIAcuity выпускается в различных конфигурациях с разной пропускной способностью — для загрузки 1, 4 или 8 планшетов. Системы содержат до 5 каналов детекции, что позволяет использовать максимальное мультиплексирование при анализе образцов, тем самым сопоставляя технологию цПЦР с возможностями традиционной ПЦР в реальном времени. Для удобства и увеличения скорости работы QIAcuity Eight оснащен двумя термоциклерами, которые работают параллельно.
Материал предоставлен партнёром — компанией QIAGEN
В таблице 2 приведена сравнительная характеристика упоминавшихся платформ для проведения цПЦР.