Как сделать искусственную клетку
Почему сложно создать искусственную клетку?
Если инженеры хотят создать что-то наноразмерное — размером с белок, антитела или вирус — имитировать поведение клетки было бы хорошим началом, поскольку они содержат огромное количество информации в крошечном пакете. Но сымитировать крошечную вещь — крайне сложная задача.
«Я привык считать клетки настоящими маленькими роботами. Биология запрограммировала природные клетки, но теперь инженеры начинают задумываться о том, как создать искусственные», — говорит Эрик Уинфри, профессор информатики, вычислений и нейтральных систем, а также биоинженер Калтеха.
«Мы хотим запрограммировать нечто размером с микрон, тоньше человеческого волоса, что сможет взаимодействовать с химической средой, а также выполнять спектр задач, подвластных биологическим вещам, но по нашим инструкциям».
Центральной проблемой биоинженеров на таких масштабах является то, что вещи просто не работают, как положено, хотя схемы вроде бы верные. Небольшие колонии молекул просто не ведут себя так же, как большие колонии таких же молекул.
Ритмичный пульс
Решением команды ученых стал генератор, состоящий из небольших синтетических молекул ДНК, которые активируются РНК-транскриптами и ферментами. Когда молекула ДНК активируется другими компонентами, создается биологическая цепь. Эта схема работает в ритмичном пульсе в течение примерно 15 часов, пока ее химические реакции не замедлятся и в конце концов не остановятся.
Затем исследователи решили «разбить» генератор из одной большой системы в экспериментальной пробирке на много небольших генераторов.
Используя подход, разработанный Максимилианом Вайцом и его коллегами из Технического университета Мюнхена и бывшим аспирантом Калтеха Элайзой Франко, ученые смешали водный раствор ДНК, РНК и ферментов, входящих в состав биохимического генератора, с маслом и встряхивали, пока небольшие порции раствора, каждая из которых содержала крошечный генератор, не были изолированы в каплях масла.
«После добавления масла и встряхивания смесь превратилась в крем, который можно назвать эмульсией, похожей на легкий майонез, — рассказал Уинфри ресурсу Futurity.org. — Затем мы взяли этот крем, вылили на стекло и размазали, чтобы посмотреть на пульсации каждой капли под микроскопом».
Если образец крайне мал
Когда активен большой образец раствора, он флуоресцирует в регулярном пульсе. Крупные капли ведут себя так, как и весь раствор: действуют отдельно, но все еще согласованно.
Но поведение мельчайших капель менее последовательно, а их импульсы быстро выходят из фазы крупных капель.
Исследователи ожидали, что различные капли, особенно мелкие, будут вести себя по-разному из-за эффекта, известного как динамика стохастической реакции. Отдельные реакции, составляющие биохимическую схему, могут происходить в разное время в разных частях раствора.
Если образец раствора достаточно велик, эффект усредняется, но если образец очень мал, различия во времени реакции увеличиваются. Чувствительность к размеру капель может быть еще более значительной в зависимости от характера реакций.
Как объяснил Уинфри, «если у вас есть две конкурирующих реакции, скажем, x преобразуется в y или x преобразуется в z, каждая протекает с одной и той же скоростью, в конечном итоге в пробирке образуется пополам y и z. Но если у вас в капле всего четыре молекулы, скорее всего, все они преобразуются в y».
Дело в шуме
В своих экспериментах на биохимическом генераторе Уинфри с коллегами обнаружили, что этот источник шума — динамика стохастической реакции — был относительно небольшим по сравнению с источником шума, который они не предвидели: эффекты разделения.
Другими словами, молекулы, которые были захвачены в каждой капле, не были одинаковыми. Некоторые капли изначально имели больше молекул, некоторые меньше, и соотношение между различными элементами также отличалось.
Таким образом, даже до того, как разное время реакция может создать стохастическую динамику, крошечные популяции молекул начинают с разнородными особенностями. Эти различия увеличиваются по мере того, как протекает биохимическая реакция.
«Чтобы заставить работать искусственные клетки, нужно знать источники шума. Основной мыслью у нас было то, что шум, с которым мы сталкивается, связан со случайностью химических реакций на таких масштабах. Но этот опыт научил нас тому, что стохастическая динамика — это задача следующего уровня. Чтобы на него выйти, нам нужно выяснить, что делать с шумом разделения».
Для Уинфри это весьма захватывающая задача: «Когда я программирую свой компьютер, я могу думать исключительно в терминах детерминированных процессов. Но когда я пытаюсь программировать на молекулярных масштабах, мне нужно думать в терминах вероятностей и случайных (стохастических процессов)».
Возможно, именно Уинфри станет первым создателем искусственных клеток. Но для начала ему нужно решить проблему случайностей.
Пять мастер-классов по созданию декоративных клеток
Для некоторых нужны деревянные шпажки от шашлычков, для некоторых — проволока или бумага. Внутрь можно поставить небольшой горшочек с цветами или сладостями.
Вторая тоже из проволоки, но делается иначе — паянием — и выглядит аккуратнее:
Остается только покрасить:
Из шпажек для шашлыков и красивой коробки для конфет:
Пимпочка сверху сделана так:
Для начала шпажки приклеиваем на основу сверху и снизу. Это может быть просто картон — его в клетке не будет видно.
Еще одна клетка из шпажек и пенопласта, которую видели уже все, от журнала «Невеста», тут.
Клетка может быть даже из бумаги или картона:
Два кружка картона склеиваем вместе полоской бумаги, чтобы сделать глубокое дно. Длинные полоски бумаги склеиваем посредине и вклеиваем изнутри в высокий бортик, чтобы получилась клетка. Внутрь можно вклеить на прозрачном пластике украшение — птичку, цветочек, сердечко.
Как своими руками сделать декоративную клетку (2 мастер-класса)
Декоративная клетка из шашлычных палочек (МК)
Для работы нужно подготовить следующие предметы:
После того как все необходимые материалы и инструменты собраны, можно начинать работу, разделив ее на следующие этапы:


4. На следующем этапе нужно аккуратно закапать клей в каждую отметку и вставить палочки.

5. На прутья сверху одеваем второй элемент пенопласта также по отметкам. Все нужно делать очень аккуратно и не спеша, чтобы не повредить пенопласт или не выломать палочку из приклеенного пенопласта.

7. Вырезанные детали приклеиваем один к одному и к пенопласту. На крышу для большей красоты и перекрытия стыка можно приклеить палочку длиной 11,5 см.


Таким образом мы получили красивое, а главное уникальное и неповторимое в своем роде изделие, созданное собственными руками. Данный аксессуар украсит дом своей изящностью и непременно будет притягивать восторженные взгляды.
На видео: декоративный домик своими руками
Металлический домик для птички (МК)
Составляющие для работы:
3. Мотив узора сгибается по окружности, таким образом у нас получается первая часть декорации. По аналогичной схеме делаем вторую окружность.
4. На этом этапе при помощи чертежей создаем верхние реберные части купола.
7. Украсить нашу клетку можно любым декором. Особенно эффектно смотрятся декоративные клетки с цветами, которые выглядят довольно романтично, создавая атмосферу тепла и домашнего комфорта.
Декоративная клетка в интерьере является модной и актуальной тенденцией в дизайне. Разнообразие форм и декора позволяет каждому подобрать для себя наиболее подходящий вариант, который выгодно подчеркнет стиль помещения и украсит любой дом.
Как сделать клетку из бумажных трубочек (видео)
Создан прототип клетки, способный синтезировать компоненты собственной мембраны

Рис. 1. Искусственная клетка — синтетическая биополимерная капсула, в которую заключены молекулы, выполняющие определенные функции. Минимальный набор компонентов искусственной клетки включает в себя клеточную мембрану, молекулы — носители информации (ДНК или РНК) и систему, позволяющую клетке производить белки. Хотя полноценные искусственные клетки еще не созданы, ученые активно работают в этом направлении. Рисунок с сайта cell-free.org
Для решения многих биотехнологических задач уже давно и успешно используются живые клетки. Но клетка — очень сложная система. Ее поведение зависит от внешних условий, поэтому она не всегда подчиняется инструкциям ученых, которые пытаются превратить клетку, например, в фабрику по производству лекарств. Поэтому биотехнологи стараются разработать искусственные аналоги клеток, содержащие минимально возможный набор генов, служащих конкретной цели. Ученые из Нидерландов сделали важный шаг к решению этой задачи: они создали прототип клетки, синтезирующий липиды, из которых состоит его мембрана.
Термин «биотехнология» возник только в XX веке, но можно считать, что развитие этой дисциплины началось еще в древности, когда люди впервые начали готовить хлеб, вино, сыр и другие продукты, в которых используются микроорганизмы. Настоящий прорыв в развитии биотехнологий произошел в 70-х годах XX века, когда ученые научились напрямую изменять ДНК живых организмов. С тех пор генетически модифицированные клетки бактерий, растений и животных нашли много полезных применений. В качестве удачных примеров можно привести организмы, синтезирующие лекарства и биотопливо. Так, бактерия Escherichia coli, «запрограммированная» на синтез инсулина, помогла наладить широкое промышленное производство этого гормона, обеспечив больных диабетом необходимым лекарством по доступной цене (D. V. Goeddel et al., 1979. Expression in Escherichia coli of chemically synthesized genes for human insulin). А ацетогенные бактерии (микроорганизмы, выделяющие ацетат в процессе анаэробного дыхания) были приспособлены для производства этанола, ацетона и бутанола, которые используются в качестве компонентов топлива (F. Liew et al., 2016. Gas Fermentation—A Flexible Platform for Commercial Scale Production of Low-Carbon-Fuels and Chemicals from Waste and Renewable Feedstocks).
Но не все попытки превратить клетки в живые фабрики или адаптировать их для других применений оказались такими успешными. Дело в том, что кроме выполнения генетической программы, которую ученые добавляют в клетку (например, инструкции «Синтезируй инсулин!»), клетка одновременно следует сотням других указаний от собственного генетического аппарата («Размножайся!», «Ищи еду!», «Защищайся от опасности!»). Эти параллельные процессы могут помешать ей делать то, что нужно ученым. Более того, в течение своей жизни клетка может мутировать или неожиданным образом изменять наши инструкции. А для применения таких клеточных машин, например, в медицине, требуется высокая надежность и гарантия от всяких неожиданностей.
Альтернатива использованию живых клеток — создание упрощенных их аналогов, которые вместо полного генома содержат только небольшую коллекцию необходимых генов. Одним из первых примеров такого подхода стали бесклеточные системы (см. Cell-free system). Они представляют собой экстракты, содержащие всё необходимое для синтеза белка: рибосомы, полимеразы и другие составляющие транскрипции и трансляции (Y. Lu, 2017. Cell-free synthetic biology: Engineering in an open world). Компоненты бесклеточных систем могут храниться в растворе либо в лиофилизированном (замороженном и высушенном) виде. Если смешать растворы в определенных пропорциях или добавить воду к высушенным компонентам, а потом добавить ДНК, то очищенные белки примутся за выполнение закодированных в генах инструкций.
Бесклеточные системы часто используются для изучения регуляции активности генов, для синтеза модифицированных белков и для создания биосенсоров — биологических систем, которые могут, например, обнаружить токсичные вещества в воде или измерить уровень определенных микроэлементов в образце крови (A. Tinafar et al., 2019. Synthetic Biology Goes Cell-Free). Но недостаток бесклеточных систем в том, что они не могут самостоятельно расти и размножаться и не имеют барьера, отделяющего и защищающего их от внешней среды. Это значит, что бесклеточные системы сложно использовать вне лаборатории: в отличие от живых клеток, они не могут регенерироваться и быстро выходят из строя в неблагоприятных условиях.
Чтобы сделать бесклеточную систему более похожей на клетку, можно окружить ее мембраной. Клеточная мембрана состоит из белков и липидов — молекул, которые не растворяются в воде, а группируются вместе, образуя двойной слой, защищающий содержимое клетки от внешней среды. Некоторым исследователям уже удалось создать мембранные капсулы, содержащие бесклеточные системы. В одной из первых работ по этой теме ученым из Принстонского университета удалось заключить в оболочку из липидов компоненты для производства зеленого флуоресцентного белка (V. Noireaux, A. Libchaber, 2004. A vesicle bioreactor as a step toward an artificial cell assembly). В другом исследовании были созданы липидные капсулы, содержащие гены для производства белков, способных уничтожать раковые клетки (N. Krinsky et al., 2018. Synthetic Cells Synthesize Therapeutic Proteins inside Tumors). Эти результаты могут иметь интересные применения — например, такие капсулы можно ввести в область опухоли, чтобы они локально производили лекарство. Но как сделать так, чтобы искусственные клетки могли регенерировать — увеличиваться в объеме, а впоследствии и делиться, создавая свои копии? На этот вопрос попытались ответить исследователи из Делфтского технического университета в Нидерландах.
Авторы статьи, опубликованной недавно в журнале Nature Communications, решили создать искусственную клетку, которая умеет синтезировать два вида липидов, часто встречающихся в мембранах бактерий: фосфатидилэтаноламин и фосфатидилглицерол. В качестве исходных компонентов для синтеза липидов они использовали молекулы глицераль-3-фосфат и ацетил-КоА.
Преобразование исходных компонентов синтеза в фосфолипиды происходит в несколько этапов. За каждый из них отвечает специальный фермент. Исследователи создали мини-геном с генами, необходимыми для производства этих ферментов (рис. 2).

Рис. 2. Синтез фосфолипидов с помощью ферментов, закодированных в мини-геноме искусственной клетки. Мини-геном содержит семь генов, необходимых для синтеза фосфатидилэтаноамина (PG) и фосфатидилглицерола (PE). Ферменты встраиваются в мембрану липосомы, где и происходит синтез новых липидов. Основные продукты реакций выделены жирным шрифтом, а названия ферментов выделены цветом. Ферменты, принимающие участие в реакции: глицерол-3-фосфат-ацилтрансфераза (PlsB), лизофосфатидная кислота-ацилтрансфераза (PlsC), интегральный мембранный белок CdsA, CDP-диацилглицерол-глицерол-3-фосфат-3-фосфатидил трансфераза (PgsA), фосфатидилглицерол фосфатазы A, B, C (PgpA, PgpB, PgpC). Рисунок из обсуждаемой статьи в Nature Communications
В смесь, содержащую копии генома, добавили компоненты бесклеточной системы и заранее подготовленные липиды. Они формируют липидные пузырьки (липосомы) — каркасы, к которым будут присоединяться новые липиды, созданные ферментами. В результате в смеси образовались липидные пузырьки, содержащие мини-геном и всё необходимое для экспрессии генов (рис. 3). Стоит отметить, что копии генома случайно распределяются в растворе. Часть из них оказывается внутри пузырьков, а часть — вне. Но так как пузырьки занимают значительную часть объема раствора, многие из них оказываются начиненными всеми нужными компонентами.

Рис. 3. Схема эксперимента по созданию искусственных клеток, синтезирующих липиды — компоненты мембран. В смесь добавляют копии генома, липиды, компоненты бесклеточной системы и исходные молекулы для синтеза липидов. В результате образуются липосомы, содержащие ферменты, которые производят новые липиды (синие). Из-за случайного распределения компонентов часть реакций может проходить вне липосом
Чтобы проверить, работает ли их идея, авторы заменили один из атомов углерода в исходных молекулах на более тяжелый изотоп этого элемента. Это помогло им отличить новые липиды от уже присутствующих в липосомных каркасах. Затем они применили метод масс-спектрометрии, который позволяет идентифицировать молекулы на основе информации об их весе и заряде. Результаты этого эксперимента показали, что в смеси действительно образовались новые липиды.
Но вопрос об эффективности искусственных клеток оставался открытым. В описанном выше эксперименте измерялся общий уровень новых липидов в смеси и не учитывалось, какая доля всех реакций происходила внутри липосом, а какая — вне. После того как липосомы сформировались, авторы добавили к смеси ферменты протеазу и ДНКазу, которые разрушают белки и ДНК, не защищенные липосомами. Это помогает избежать синтеза липидов вне липосом.
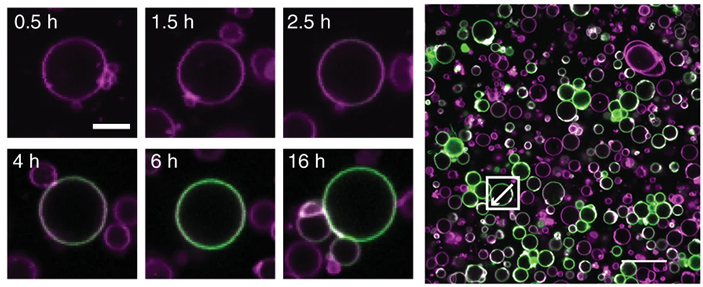
Для подтверждения того, что белки теперь находятся только внутри искусственных клеток, исследователи пометили их мембраны красным флуоресцентным белком и добавили ДНК желтого флуоресцентного белка (рис. 4). Как и копии мини-генома, эти ДНК случайно распределялись в смеси. Желтый сигнал указывал на области локализации белка, помогая удостовериться, что белки вне липосом были уничтожены. Измерения концентрации новых липидов, сделанные исключительно в липосомах, показали, что синтез имеет высокую эффективность: 40% исходных продуктов были успешно преобразованы в липиды.

Рис. 4. Изображение липосом, полученное с помощью флуоресцентной микроскопии. Мембраны липосом помечены красным флуоресцентным белком (они выглядят как фиолетовые колечки). К реакции была добавлена ДНК желтого флуоресцентного белка. Без добавления протеазы и ДНКазы экспрессия генов происходит как внутри, так и вне липосом (слева). При наличии протеазы (в центре) или ДНКазы (справа) экспрессия генов локализуется внутри липосом. Рисунок из обсуждаемой статьи в Nature Communications
На следующем этапе авторы попробовали ответить на несколько важных вопросов: какой процент липосом производит новые липиды? Как быстро происходит синтез? Насколько липосомы отличаются друг от друга? Чтобы проследить за синтезом новых липидов, исследователи использовали зеленый флуоресцентный белок. С его помощью они создали маркер, который прикреплялся к мембране липосом в том месте, где появлялся новый липид (рис. 5). По мере синтеза новых липидов мембраны липосом начинали флуоресцировать зеленым.
Рис. 5. Выявление липосом, синтезирующих новые липиды. Флуоресцентная проба прикрепляется к мембране в том месте, куда встроились новые липиды. По мере их синтеза яркость флуоресценции увеличивается, позволяя выявить «активные» липосомы. Рисунок из обсуждаемой статьи в Nature Communications
Авторы проследили, как флуоресценция отдельных липосом меняется со временем. Они заметили, что яркость постепенно увеличивается и достигает своего максимального значения после 16 часов (рис. 6, слева). Но оказалось, что только около половины липосом производили новые липиды (рис. 6, справа). Это происходит потому, что компоненты, нужные для синтеза, не попали в некоторые липосомы. Хотя 50% — хороший результат для первой попытки, в дальнейшем авторы надеются повысить эффективность своей технологии.
Рис. 6. Слева — динамика синтеза фосфолипидов и присоединения флуоресцентной пробы. Наблюдения с помощью флуоресцентной микроскопии позволяют проследить за синтезом липидов в реальном времени. Флуоресцентная проба прикрепляется к мембране в том месте, куда встроились новые липиды. Увеличение яркости зеленого флуоресцентного белка соответствует увеличению концентрации новых липидов в мембране. Справа — распределение липосом, производящих новые липиды. Анализ полного изображения позволяет определить процент липосом, которые синтезируют новые липиды. Изображения из обсуждаемой статьи в Nature Communications
На следующем этапе исследователям нужно будет найти способ создания искусственной клетки, которая умеет значительно увеличиваться в объеме и делиться. Для этого они предлагают улучшить бесклеточную систему и увеличить концентрацию ферментов, производящих липиды. А когда клетка достигнет нужного объема, деление произойдет автоматически (такой редкий механизм деления есть у некоторых бактерий, см. R. Mercier et al., 2013. Excess Membrane Synthesis Drives a Primitive Mode of Cell Proliferation). Этот процесс можно будет регулировать с помощью температурных колебаний, провоцирующих деформацию мембраны.
Результаты, описанные в обсуждаемой статье, — важный шаг в работе над созданием полноценной искусственной клетки. Они показывают, что всю цепочку реакций, нужных для синтеза мембранных липидов, можно поместить внутрь липосом. Кроме того, дизайн искусственной клетки, созданный авторами, можно использовать как платформу для производства разных типов липидов, полезных в фармацевтике и промышленности: компонентов мазей, эмульсий, покрытий и красок.
Можно надеяться, что успехи в создании искусственных клеток в будущем помогут построить надежные биореакторы для дешевого производства сложных химических соединений. Искусственные клетки могут послужить основой для биосенсоров, которые работают в условиях, не совместимых с выживанием обычных клеток, а также будут полезны для создания новых методов лечения и диагностики заболеваний — например, в качестве инструмента для местного синтеза и целевой доставки лекарств.
Источник: Duco Blanken, David Foschepoth, Adriana Calaça Serrão & Christophe Danelon. Genetically controlled membrane synthesis in liposomes // Nature Communications. 2020. DOI: 10.1038/s41467-020-17863-5.