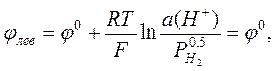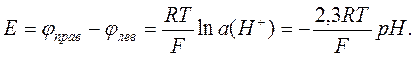Как сделать солевой мостик
Гальванический элемент в банке
Если погрузить металл в воду, его атомы будут стремиться перейти в раствор в виде положительно заряженных ионов (катионов). При этом поверхность металла заряжается отрицательно, и она начинает притягивать положительно заряженные ионы уже перешедшие в воду. Из-за отрицательного заряда поверхности металла, дальнейший переход ионов в раствор прекращается (наступает динамическое равновесие т.е. сколько перешло в раствор столько и вернулось), и на отрицательной поверхности образуется слой из положительно заряженных ионов металла, так называемый двойной электрический слой (ДЭС). Если погрузить два разных металла то они зарядятся оба, но в зависимости от активности металла, один сильнее, а другой слабее. Если соединить, эти, по-разному заряженные металлы проводником, из-за разности потенциалов потечет поток электронов от более «слабого» к более «сильному». В результате «слабый» металл (более активный) начнет растворяться (ионы переходят в раствор), а на «сильном» металле ионы восстанавливаются и оседают на поверхности.
Медно-цинковый гальванический элемент с электролитным мостом
После того, как поставлен электролитный мост, гальванический элемент начинает работать: по цепи течет электрический ток. На одном электроде, там, где цинк погружен в раствор сульфата цинка, происходит постоянное растворение металла и движение ионов цинка в растворе:
а на другом электроде постоянно выделяется медь:
Zn + Cu 2+ → Zn 2+ + Cu
вырабатывается электрическая энергия.
Ни медный стержень, ни ZnSO4 не являются обязательной частью этого элемента. Металлическая медь осаждается на катоде из любого другого проводника, например на платиновой проволоке, а раствор сульфата цинка в анодной камере можно заменить любой другой проводящей солью, которая не взаимодействует с цинковым анодом, например, хлоридом натрия. В качестве соляного мостика, можно использовать стеклянную U-образную трубку, содержащую какой-либо электролит типа KNO3, смешанный с агар-агаром либо желатиной, чтобы удержать электролит в трубке.
Что если оба металла погрузить в общий раствор, содержащий два вида ионов. Погрузить разумеется, можно, только обмен электронами будет на поверхности цинка, а не через внешнюю цепь. Цинк начнет растворятся постепенно покрываясь ямками, в тоже время покрываясь корочкой меди, которая сформирует губчатое коричневое покрытие. Но солевой мостик создает сопротивление диффузии ионов, создавая электрическое сопротивление, мешающее получению сильного тока от элемента, поэтому наилучшее устройство элемента, при условии его неподвижности, основывается на гравитационном разделении растворов без какой-либо перегородки между ними. В таком элементе разбавленный раствор ZnSO4 осторожно заливают поверх концентрированного, более плотного раствора CuSO4. При неподвижном состоянии и отсутствии вибраций элемент работает очень хорошо. Внутреннее сопротивление таком элементе почти полностью отсутствует, и это дает возможность получать большие токи. Такой элемент Даниэля раньше широко использовался в качестве стационарного источника тока на телеграфных станциях и в домах для дверных звонков. Подобный элемент можно сделать и другим способом. Стеклянная банка заливается концентрированным растворов поваренной соли (NaCl). У дна банки размещается медный электрод, а наверху цинковый. На дно банки аккуратно опускаются кристаллы CuSO4. Сульфат меди, растворяясь на дне, с концентрированным раствором NaCl смешивается медленно, из-за этого ионы Cu 2+ не достигают цинкового электрода.
Медно-цинковый гальванический элемент в одной банке без перегородок
Как мы видим, для того, чтобы электроны могли совершить полезную работу, нужно заставить их двигаться по внешней цепи.
Не знаю, обратили ли Вы достаточное внимание на то обстоятельство, что электродный потенциал (по уравнениям Нернста и Петерса) в немалой степени зависит от концентрации ионов в растворе. Не можем ли мы и из этого извлечь пользу? Раз электродный потенциал зависит от концентрации, то при погружении одного и того же металла в растворы его ионов различной концентрации можно получать различный электродный потенциал. Из таких электродов можно сделать и гальванический элемент. Называют его концентрационный гальванический элемент. Берем, например, две медные пластинки и погружаем их в растворы с концентрацией медных солей соответственно 2 моль/л и 0,2 моль/л (в расчете на ион меди). Ставим электролитный мост. Соединяем электроды проводником. Элемент начинает работать. На одном электроде, там, где концентрация ионов меди в растворе ниже, происходит непрерывное растворение меди:
Ионы меди восстанавливаются, их концентрация в растворе непрерывно уменьшается. Итак, концентрационный гальванический элемент работает за счет разности концентрации ионов меди у обоих электродов, пока концентрации ионов у двух электродов не станут равными. Тогда исчезнет и разность электродных потенциалов, следовательно, не будет и напряжения. Можно добавить к одному из двух растворов воду, чтобы изменилась концентрация соли. Опять возникнет разность электродных потенциалов, и гальванический элемент снова заработает. Можно даже поменять знаки у электродов. Концентрационные гальванические элементы редко используются на практике, поскольку при их изготовлении как из различных, так и одинаковых окислительно-восстановительных пар (при различной концентрации соответствующих ионов в растворе), трудно учесть влияние, зависящего от концентрации, слагаемого в уравнении Нернста.
Объединение электродов в измерительную ячейку
Измерительная ячейка, как и гальванический элемент, состоит из двух электродов, соединённых друг с другом. Поскольку состав электролита в левом и правом полуэлементах различен, разработаны специальные способы их соединения. Существуют элементы с жидкостными соединениями и элементы без жидкостных соединений.
Один из возможных способов жидкостного соединения электродов уже упоминался выше: это использование солевого мостика. Солевой мостик представляет собой стеклянную трубочку, заполненную очень вязким гелеобразным раствором хлорида калия, например, насыщенный раствор KCl в агар-агаре. Выбор хлорида калия в качестве электролита для заполнения солевого мостика определяется тем, что подвижность ионов и числа переноса K + и Cl – примерно одинаковы [10] ввиду близости их размеров и масс. Поэтому при протекании электрического тока через солевой мостик, заполненный раствором KCl, на его границах не возникает так называемый диффузионный потенциал.
Возникновение диффузионного потенциала при протекании электрического тока через электролит связано с тем, что перенос зарядов осуществляется катионами и анионами не в одинаковой степени. Поэтому при протекании тока через электролит, заполняющий солевой мостик, в котором анионы и катионы обладают разной подвижностью, на границах раздела с жидкими фазами, которые он соединяет, появляется дополнительная разность потенциалов. Если мостик заполнен раствором хлорида калия, этот эффект минимален, потому что подвижности обоих ионов примерно одинаковы и токи, определяемые диффузией анионов и катионов через жидкостное соединение, равны по величине. Такое соединение называют равнопроводящим. Кроме хлорида калия для заполнения солевого мостика можно использовать растворы KNO3, NH4NO3, RbCl.
Иногда можно использовать один и тот же электролит в каждом из электродов. Электрохимические ячейки, в которых оба электрода погружаются в один общий электролит, называются ячейками без переноса. Например, в элементе, составленном из водородного электрода и хлорсеребряного электрода, в качестве электролита можно взять раствор HCl, общий для обоих электродов. При этом никакого дополнительного соединения не требуется.
Измерение ЭДС элемента
Для измерения ЭДС гальванического элемента, т. е. разности электродных потенциалов, взятой со знаком плюс, в принципе достаточно использовать обычный вольтметр. Однако чтобы полученное значение соответствовало равновесным условиям, необходимо, чтобы значение тока в измерительной цепи было минимальным. Для этого можно применять компенсационные схемы или использовать вольтметр с большим входным сопротивлением (десятки или сотни Мом). Последнему условию удовлетворяют электрические схемы рН—метров и иономеров, и в этих приборах обычно предусмотрена функция измерения ЭДС.
Важнейшей задачей потенциометрии является измерение рН водных растворов. Ясно, что для этой цели в принципе подходит любой электрод, потенциал которого зависит от концентрации (активности) ионов водорода. Можно использовать, например, водородный электрод, описанный выше. В качестве электрода сравнения (левого электрода) можно использовать НВЭ. Если водород подаётся под давлением 1 атм, то потенциалы электрода сравнения и измерительного электрода равны, соответственно
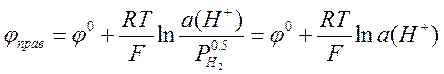
а разность электродных потенциалов гальванического элемента равна
Достоинством такого метода определения рН является отсутствие необходимости калибровки, так как измерение даёт абсолютный результат. Однако для рутинных измерений рН водородный электрод неудобен, поскольку требуется источник газообразного водорода (баллон или генератор).
В рН-метрах промышленного производства обычно используют так называемые стеклянные электроды. Стеклянный электрод не является гальваническим электродом, т. е. не относится к группе электродов, которые мы описывали до этого. Механизм возникновения электродного потенциала у стеклянного электрода связан не с окислительно-восстановительной реакцией, а с мембранными процессами, напоминающими, в известной степени, осмотические явления.[2]
Чтобы распечатать файл, скачайте его (в формате Word).
Элемент Даниеля
Соберите один из первых химических источников тока!
Проведите этот опыт с нашей подпиской!
Этот эксперимент, как и батарейка из лимона, входит в набор Химия и электричество. Подпишитесь и получите всё, что понадобится для проведения этого эксперимента дома.
Реагенты
Безопасность
Часто задаваемые вопросы
Затем проверьте качество соединения крокодилов с цинковой проволокой и медными пластинами. Стержни и пластины должны быть закреплены на стенке пробирки.
Проследите, чтобы бесцветный раствор сульфата цинка ZnSO4 содержался в пробирках с цинковой проволокой, а синий раствор сульфата меди CuSO4 – в пробирках с медными пластинами. При этом, стержни и пластины должны быть частично погружены в соответствующие растворы.
Впитывающая полоска ткани должна соединять синий раствор сульфата меди CuSO4 и бесцветный раствор сульфата цинка ZnSO4. Если потребуется, можете добавить еще несколько капель CuSO4.
Вместе с раствором гидросульфата натрия NaHSO4 мы добавляем и протоны. Протоны (положительно заряженные ионы водорода в данном случае) очень малы и подвижны. Они легко перемещаются по устройству. Добавление раствора увеличивает силу тока, следовательно, увеличивается и электропроводимость пищалки.
Другие эксперименты
Пошаговая инструкция
Подготовьте один стаканчик с раствором CuSO4 и второй с раствором ZnSO4.
Соедините стаканчики между собой с помощью тканевой полоски, пропитанной раствором CuSO4.
Подсоедините проволоку из цинка Zn к черному проводу, а проволоку из меди Cu к красному проводу.
Опустите металлы в стаканчики.
Ваш первый элемент Даниеля готов! Он сможет снабдить электричеством маленькую пищалку, но для светодиода нужно будет больше энергии.
Соберите второй элемент Даниеля.
Соедините два элемента Даниеля последовательно. Теперь энергии для светодиода будет достаточно.
Утилизация
Твердые отходы эксперимента утилизируйте вместе с бытовым мусором. Растворы слейте в раковину и затем тщательно промойте ее водой.
Что произошло
Почему загорается диод?
Перемещаясь по проводам от цинка к меди, электроны создают электрический ток. Когда ток проходит через светодиод или пищалку, они в прямом смысле включаются: лампочка загорается, а пищалка издает характерный звук.
Зачем нужен соляной мостик?
Соляной мостик соединяет два раствора: благодаря ему ионы свободно перемещаются из одного раствора в другой и наоборот. Без такого обмена электрическая цепь не была бы замкнута, а батарейка бы не работала.
В растворе сульфата цинка находится слишком много положительно заряженных ионов, а в растворе сульфата меди — отрицательно заряженных. Когда два раствора соединены соляным мостиком, отрицательно заряженные ионы могут перемещаться из раствора сульфата меди в раствор сульфата цинка, а положительно заряженные ионы идут в обратном направлении. Именно из-за этого электрическая цепь замыкается.
Почему для эксперимента нужно два элемента?
Две последовательно соединенные ячейки дают достаточное напряжение, чтобы диод светился. Одна ячейка дает примерно 1 В, две — в два раза больше. Если же соединить две ячейки параллельно, то напряжение будет 1 В, а вот сила тока увеличится вдвое.
Развитие эксперимента
Что нужно делать с баночкой раствора NaHSO4?
Как хорошо, что вы заметили лишнюю баночку! Именно так и работает исследователь! Капните несколько раз раствором NaHSO4 на тканевую полоску, а также добавьте немного раствора и в каждый из стаканчиков. Пищалка должна зазвучать еще громче! Поэкспериментируйте!
Это интересно
Каким был первый химический источник тока?
Итальянский исследователь Алесса́ндро Во́льта (полное имя − Алесса́ндро Джузеппе Анто́нио Анаста́сио Джерола́мо Умберто Во́льта) первым догадался соединить между собой медную и цинковую пластинки проводом, а затем опустить их в раствор электролита (вещества, дающего при растворении заряженные положительные и отрицательные ионы, т.е. и проводящего в растворённом виде электрический ток).
К слову, именно в его честь назвали очень важную для всех электрохимиков величину – единицу измерения разности потенциалов – вольт. В своих работах учёный доказал, что такая система из двух пластинок и электролита действительно создаёт электричество. По тем временам это было настоящим прорывом!
Вольта также показал, что ячейки с парой «цинк-медь» можно соединять между собой. Так появился вольтов столб – по сути, первый химический источник электричества, который позволял исследователям работать в широком диапазоне напряжений. Он состоял из чередующихся медных и цинковых пластин, причём между каждой первой и второй пластиной находился кусочек суконной ткани, смоченный раствором электролита.
В качестве электролита в обоих случаях может выступать как раствор сильных кислот (HCl, H2SO4) или щелочей (KOH, NaOH), так и раствор солей (NaCl, ZnSO4) – все они распадаются в растворе на заряженные части – ионы. Необходимо это для того, чтобы заряды могли «перетекать» с цинка на медь: если просто соединить медь и цинк, такой переход произойдёт только на их стыке, а в общем и целом такая система будет вести себя, как обычный кусочек металла.
Любопытно, что при достаточных размерах (больше 2100 пар пластин в одном устройстве!) вольтов столб оказывался настолько «сильным», что создавал электрическую дугу – явление, которое происходит из-за ионизации воздуха под действием мощного источника тока. Когда молекулы воздуха, обычно нейтральные (в основном это молекулы N2 и O2), сталкиваются с концами проводника, подключенного к такому большому вольтовому столбу, они ионизируются – отдают или принимают электроны. Этот процесс происходит лавинообразно, и в результате возникает целая область ионизированного воздуха – плазма, которая проводит электричество.
Что такое диод и как он устроен?
Диоды – это маленькие приборы, способные пропускать через себя электрический ток и выполнять при этом какую-то полезную работу. В данном случае речь идёт о светодиоде – при пропускании электрического тока он светится.
Все современные диоды содержат в своей основе полупроводник – особый материал, электропроводность которого не очень велика, но может вырастать, например, при нагревании. Что такое электропроводность? Это способность материала проводить через себя электрический ток.
В отличие от простого кусочка полупроводника, любой диод содержит два его «сорта». Само название «диод» (от греч. «δίς») означает, что в его составе есть два элемента – обычно их называют анод и катод.
Анод диода состоит из полупроводника, содержащего так называемые «дырки» − области, которые могут быть заполнены электронами (фактически пустые полочки специально для электронов). Эти «полочки» могут достаточно свободно перемещаться по всему аноду. Катод диода тоже состоит из полупроводника, но другого. Он содержит электроны, которые тоже могут относительно свободно двигаться по нему.
Оказывается, что такой состав диода позволяет электронам легко двигаться через диод в одну сторону, но практически не позволяет двигаться им в обратном направлении. Когда электроны движутся от катода к аноду, на границе между ними происходит встреча «свободных» электронов в катоде и электронных вакансий (полочек) в аноде. Электроны с удовольствием занимают эти вакансии, и ток двигается дальше.
Представим, что электроны двигаются в обратном направлении – им нужно слезть с уютных полочек в материал, где этих полочек нет! Очевидно, это им не выгодно и ток в этом направлении не пойдёт.
Таким образом, любой диод может выступать в роли своего рода клапана для электричества, которое проходит через него в одну сторону, но не проходит в другую. Именно это свойство диодов позволило использовать их в качестве основы для вычислительной техники – любой компьютер, смартфон, ноутбук или планшет содержит в своём составе процессор, в основе которого – миллионы микроскопических диодов.
У светодиодов, конечно же, другое применение – в освещении и индикации. Сам факт возникновения света связан с особым подбором полупроводниковых материалов, из которых состоит диод. В некоторых случаях тот самый переход электронов с катода в вакансии анода сопровождается выделением света. В случаях разных полупроводников происходит свечение разных цветов. Важными преимуществами диодов по сравнению с другими электрическими источниками света являются их безопасность и высокая эффективность – степень преобразования энергии электрического тока в свет.
Подпишитесь на наборы MEL Chemistry и проведите эти опыты у себя дома!